Характеристика клинико-функциональных и метаболических изменений при диабетической автономной кардиоваскулярной нейропатии у детей с сахарным диабетом 1 типа и коррекция выявленных нарушений
На правах рукописи
Расторгуева Татьяна Александровна
ХАРАКТЕРИСТИКА КЛИНИКО-ФУНКЦИОНАЛЬНЫХ И МЕТАБОЛИЧЕСКИХ ИЗМЕНЕНИЙ ПРИ ДИАБЕТИЧЕСКОЙ АВТОНОМНОЙ КАРДИОВАСКУЛЯРНОЙ НЕЙРОПАТИИ У ДЕТЕЙ С САХАРНЫМ ДИАБЕТОМ 1 ТИПА И КОРРЕКЦИЯ ВЫЯВЛЕННЫХ НАРУШЕНИЙ
14.01.05 – кардиология
14.01.08 – педиатрия
АВТОРЕФЕРАТ
диссертации на соискание учёной степени
кандидата медицинских наук
Тверь - 2010 г.
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Тверская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию» на кафедре педиатрии педиатрического факультета.
Научный руководитель:
доктор медицинских наук, профессор Гнусаев Сергей Фёдорович
Официальные оппоненты:
доктор медицинских наук, профессор Аникин Виктор Васильевич
доктор медицинских наук, профессор Леонтьева Ирина Викторовна
Ведущая организация: ФГУ «ФНКЦ детской гематологии, онкологии и иммунологии» Росздрава
Защита диссертации состоится «08» июня 2010 года в _______часов на заседании диссертационного совета Д 208.099.01 в ГОУ ВПО «Тверская государственная медицинская академия» Росздрава по адресу: 170100, г.Тверь, ул.Советская, д.4.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Тверская государственная медицинская академия» Росздрава и на сайте академии www.tvergma.ru
Автореферат разослан «____» ____________________2010 года.
Учёный секретарь диссертационного совета:
Кандидат медицинских наук, доцент В.В. Мурга
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. В последние годы отмечается значительный рост заболеваемости сахарным диабетом 1 типа у детей и подростков. Всемирная организация здравоохранения характеризует сахарный диабет 1 типа (СД) как эпидемию неинфекционного заболевания. При этом в настоящее время особенно актуально внимание к поздним осложнениям сахарного диабета (периферическая сенсорно-моторная полинейропатия, автономная кардиоваскулярная нейропатия, ретинопатия, нефропатия), которые приводят к ранней инвалидизации и высокой летальности больных. Так, при развитии сахарного диабета в детском возрасте продолжительность жизни больных ниже средне-популяционной (Алимова И.Л. и соавт., 2004, Атаманов В.М., 2000, Ахвердиева М.К., 2004, Мартынова М.И., 2003). Интерес к изучению сердечно-сосудистых осложнений сахарного диабета обусловлен увеличением частоты их возникновения, высоким риском развития внезапной сердечной смерти, безболевых форм острого инфаркта миокарда у взрослых больных, жизнеугрожающих нарушений ритма сердца и недостаточности кровообращения (Балаболкин М.И. и соавт., 2003, Гречкин В.И. и соавт., 2000, Дедов И.И. и соавт., 1996, Yotsukara M, 1996).
В генезе возникновения кардиоваскулярной патологии при сахарном диабете 1 типа, наряду с развитием в сердечной мышце диабетической микроангиопатии и метаболических нарушений, определенное значение принадлежит дисбалансу вегетативной регуляции работы сердца - автономной кардиоваскулярной нейропатии. Диабетическая автономная кардиоваскулярная нейропатия (ДАКН) характеризуется нарушениями функционального состояния сердечно-сосудистой системы и является одной из главных причин развития недостаточности кровообращения (Битакова Ф.И. и соавт., 1999).
С позиций энергетического метаболизма в патогенезе диабетической кардиопатии в целом и диабетической автономной кардиоваскулярной нейропатии в частности ведущая роль принадлежит дефициту инсулина, который приводит к нарушению утилизации тканями глюкозы, усиливает расщепление липидов и белков. При этом энергетическое обеспечение сердца осуществляется за счет эндогенных запасов глюкозы, которые постепенно истощаются. В результате развивается энергетический дефицит клеток миокарда и проводящей системы сердца, что сказывается на его функциональной способности.
Вместе с тем усилению энергетического дефицита и дисфункции миокардиоцитов способствует дефицит магния, участвующего в формировании ряда ферментов (глутаматсинтетаза, ацил-КоА-синтетаза и др.), регулирующих энергообеспечение клеток организма. Магний поддерживает разнообразные энергетические и пластические процессы, участвует в осуществлении различных антиоксидантных функций нейронов и глиальных элементов, в непосредственной защите рецепторов на постсинаптической мембране нейронов от повреждения свободными радикалами, токсическими веществами и медикаментами (Громова О.А., 2004, Ianello S., 2001, Kromhout D., 2001). Однако, несмотря на многочисленные исследования, посвящённые обмену магния в организме, на сегодняшний день очень мало публикаций о влиянии дефицита магния на формирование поздних осложнений со стороны сердечно-сосудистой системы у детей с сахарным диабетом.
Для выявления ранних признаков ДАКН наряду с кардиоинтервалографией и оценкой кардиоваскулярных тестов, используется Холтеровское мониторирование сердечного ритма с оценкой его вариабельности методами временного и спектрального анализов. Оценка вариабельности ритма сердца (ВРС) в большинстве случаев проводится при помощи временного анализа показателей rMSSD, pNN50, отражающих чувствительность синусового узла к парасимпатическим влияниям. Снижение этих показателей свидетельствует об уменьшении парасимпатических влияний на регуляцию ритма сердца и преобладании тонуса симпатической части вегетативной нервной системы (ВНС). Однако временной анализ ВРС не позволяет провести дифференцированную оценку состояния обоих отделов ВНС и определить, является ли повышение тонуса симпатического звена вегетативной нервной системы абсолютным в результате активации симпатических реакций в условиях стресса или же относительным вследствие снижения тонуса парасимпатикуса в результате формирования ДАКН у детей с сахарным диабетом 1 типа. Вместе с тем спектральный анализ ВРС позволяет разграничить симпатические и парасимпатические влияния на регуляцию ритма сердца, что представляет определённый интерес для определения критериев ранней диагностики ДАКН у детей с сахарным диабетом 1 типа.
Стремление к увеличению продолжительности и улучшению качества жизни больных сахарным диабетом выдвинуло на первый план проблему профилактики и лечения его поздних осложнений, число которых растет с увеличением длительности заболевания (Касаткина Э.П., 1996, Мартынова М.И. и соавт., 2003). Для профилактики развития поздних осложнений сахарного диабета главенствующее значение имеет регулярный контроль гликемических показателей. В настоящее время, помимо лечения основного заболевания, применяется метаболическая терапия, препараты калия, средства, улучшающие микроциркуляцию, антиоксиданты (Иванов Д.А. и соавт., 2005, Kaul N., 1996). Принимая во внимание влияние дефицита магния на формирование ДАКН у детей возникает необходимость в его коррекции. Однако данные о применении препаратов магния для профилактики и лечения кардиоваскулярных осложнений сахарного диабета в литературе малочисленны.
Всё вышеизложенное обусловило цель настоящего исследования и определило его задачи.
Цель исследования. Установить клинические, функциональные и метаболические изменения при диабетической автономной кардиоваскулярной нейропатии у детей с сахарным диабетом 1 типа и усовершенствовать коррекцию выявленных нарушений.
Задачи исследования:
- Определить критерии диагностики диабетической автономной кардиоваскулярной нейропатии у детей с сахарным диабетом 1 типа на основании электрокардиографии, кардиоинтервалографии, кардиоваскулярных тестов по Ewing и суточного мониторирования сердечного ритма.
- Выявить дефицит магния при исследовании концентрации магния в эритроцитах периферической крови и секрете слюнных желёз для обоснования метаболической терапии детей с сахарным диабетом 1 типа с признаками диабетической автономной кардиоваскулярной нейропатии.
- Оценить эффективность применения препарата магнерот® в комплексной терапии детей с сахарным диабетом 1 типа с признаками диабетической автономной кардиоваскулярной нейропатии.
Научная новизна. Установлены критерии диагностики диабетической автономной кардиоваскулярной нейропатии у детей с сахарным диабетом 1 типа на основании спектрального анализа вариабельности ритма сердца по данных суточного мониторирования ЭКГ.
Впервые установлена взаимосвязь дефицита содержания тканевого магния, определяемого в эритроцитах периферической крови и слюне, с развитием и степенью тяжести диабетической автономной кардиоваскулярной нейропатии.
Выявленное снижение концентрации магния в эритроцитах периферической крови и слюне позволило выделить вторичную гипомагнемию в патогенетическое звено формирования диабетической автономной кардиоваскулярной нейропатии и обосновать назначение препаратов магния в составе комплексной терапии кардиоваскулярных осложнений сахарного диабета 1 типа.
Практическая значимость. Разработанные критерии диагностики диабетической автономной кардиоваскулярной нейропатии позволяют обнаружить её признаки на ранних стадиях развития данного осложнения сахарного диабета 1 типа у детей, что необходимо для лечения и профилактики её прогрессирования.
Включение в схему лечения детей с признаками диабетической автономной кардиоваскулярной нейропатии препарата магнерот® представляет собой эффективный способ профилактики и снижения темпов ее развития.
Внедрение результатов работы в практику. Результаты исследования внедрены в практику работы:
- эндокринологического отделения детской городской больницы №2 г.Твери;
- Эндокринологического центра для детей Тверской области;
- отделения дневного пребывания детской городской клинической больницы №1 г.Твери;
- в учебный процесс со студентами и клиническими ординаторами кафедры педиатрии педиатрического факультета Тверской государственной медицинской академии.
Апробация работы. Основные положения диссертации были доложены и обсуждены на Российском конгрессе «Детская кардиология» (Москва, 2008 год), конгрессе «Современные технологии в педиатрии и детской хирургии» (Москва, 2008 год), заседании научно-практического общества педиатров Тверской области (Тверь, 2010 год) и на совместной конференции кафедр педиатрического, кардиологического и терапевтического профилей ГОУ ВПО Тверской ГМА (Тверь, апрель 2010 года).
По теме диссертации опубликовано 4 печатные работы, одна из них в рецензируемом ВАК журнале.
По материалам работы поданы 2 заявки на изобретение:
- № 2009101227 (001489) от 15.01.2009 г. «Способ ранней диагностики диабетической автономной кардиальной нейропатии у детей и подростков» (соавт. Гнусаев С.Ф., Иванов Д.А.) (получено положительное решение о выдаче патента на изобретение);
- № 2009140671 от 06.11.2009 г. «Способ профилактики и лечения диабетической автономной кардиальной нейропатии у детей и подростков с применением препарата магнерот» (соавт. Гнусаев С.Ф., Иванов Д.А.).
Объём и структура диссертации. Диссертация изложена на 156 страницах машинописного текста и состоит из введения, пяти глав, заключения, выводов, практических рекомендаций и списка литературы, содержащего 118 работ отечественных и 50 работ иностранных авторов. Работа иллюстрирована 20 таблицами, 19 рисунками и 2 выписками из историй болезни.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Исследовательская работа проводилась на базах кафедры педиатрии педиатрического факультета Тверской ГМА, эндокринологического отделения детской городской больницы №2 г.Твери и эндокринологического центра для детей Тверской области. В обследование были включены 120 детей, в том числе 90 детей с сахарным диабетом 1 типа. На период обследования ни у одного из детей не отмечалось кетоацидотических и гипогликемических состояний. В зависимости от длительности заболевания все дети были разделены на две группы. Первую составили 36 детей с длительностью СД менее 5 лет (40%), вторую группу – 54 ребёнка с продолжительностью заболевания более 5 лет (60%). Контрольную группу составили 30 здоровых детей, сопоставимых с больными детьми по полу и возрасту.
Помимо стандартного клинико-анамнестического метода исследования, кардиоинтервалографии (КИГ) и электрокардиографии использовались кардиоваскулярные тесты по Ewing, а также суточное мониторирование ритма сердца с оценкой циркадного индекса и параметров временного и частотного анализа вариабельности ритма сердца, допплерэхокардиография.
Степень компенсации заболевания оценивалась по уровню гликозилированного гемоглобина (HbA1с), определённого методом боратного аффинного анализа с помощью анализатора NycoCard Reader II. Признаки тканевой гипоксии с нарушением процессов аэробного окисления в митохондриях и компенсаторным усилением анаэробного гликолиза выявлялись при анализе уровня лактата периферической крови.
Уровень молочной кислоты в крови определялся по методу Баркера и Саммерсона в безбелковом фильтрате крови. В основе метода лежит фотометрическое определение 1,1-ди-(оксидифенил)-этана, являющегося продуктом химического превращения лактата.
Уровень внутриклеточного магния крови и магния слюны оценивался колориметрическим методом с использованием реагентов компании «RANDOX».
Статистическая обработка материала проводилась на персональном компьютере с использованием программ «Microsoft Excel» и, разработанной на кафедре педиатрии педиатрического факультета Тверской ГМА, программы «Cards», с помощью которых определялись основные статистические параметры (М – средняя величина переменной, m – ошибка средней, r – коэффициент корреляции). Достоверность результатов оценивалась с использованием параметрических и непараметрических критериев – Стьюдента и Фишера.
Результаты исследования
У обследованных детей были проанализированы предъявляемые ими жалобы. Жалобы носили неспецифический характер и были представлены болями в области сердца (17 детей, 18,9%), сердцебиением (20 детей, 22,2%), перебоями в работе сердца (12 детей, 13,3%) и головокружением (13 детей, 14,4%).
При анализе анамнестических данных выявлена значительная распространённость наследственной отягощённости по сахарному диабету у больных детей. Так, в 25 семьях (27,8%) при оценке генеалогического анамнеза был выявлен сахарный диабет, что существенно отличало их от детей контрольной группы (1 ребёнок, 3,3%; р<0,01).
Патологические сдвиги в обмене веществ не могли не сказаться на физическом развитии обследованных детей. При этом имелась определённая зависимость между уровнем физического развития и соматотипом и длительностью и тяжестью течения основного заболевания. Низкий уровень физического развития чаще выявлялся у детей с длительностью СД более 5 лет по сравнению с детьми, болеющими менее 5 лет и здоровыми детьми. У детей с тяжёлым течением СД также чаще выявлялся низкий уровень физического развития. Изменения соматотипа обследованных детей имели такую же направленность в зависимости от длительности и тяжести течения СД. Данный факт свидетельствует о более грубых метаболических сдвигах у детей с более длительных и тяжёлым течением основного заболевания.
У детей с сахарным диабетом 1 типа по мере прогрессирования основного заболевания отмечалось нарастание количества поздних осложнений и их тяжести.
Среди всех поздних осложнений наиболее часто выявлялись ретинопатия (57 детей, 63,3%), периферическая сенсорно-моторная полинейропатия (40 детей, 44,4%) и хайропатия (25 детей, 27,8%). Достаточно редко - нефропатия, она была выявлена у 8 детей (8,9%). Установлено, что только при длительном и тяжёлом течении заболевания были диагностированы нефропатия (8 детей, 8,9%), ретинопатия 3 стадии (1 ребёнок, 1,9%), синдромы Мориака (3 ребёнка, 5,6%) и Нобекура (2 ребёнка, 3,7%). Нарастание частоты встречаемости и тяжести осложнений на фоне увеличения продолжительности сахарного диабета свидетельствует об углублении обменно-дистрофических изменений и срыве адаптации в организме больного ребёнка.
Согласно полученным нами данным у детей с сахарным диабетом 1 типа имеет место вегетативный дисбаланс с преобладанием тонуса симпатической нервной системы. Так, у детей с длительным и тяжёлым течением заболевания отмечалась склонность к тахикардии и повышению систолического и диастолического артериального давления. Симпатическая направленность вегетативного гомеокинеза имела место и по данным КИГ. Симпатикотония была выявлена у 50 детей (55,6%), в то время как ваготония была отмечена лишь у 9 детей (10%), эйтония – у 29 детей с СД (32,2%). По данным КИГ установлено, что показатели исходного вегетативного тонуса у детей с СД зависели от длительности и тяжести течения заболевания. Так, у детей с длительностью СД более 5 лет, по сравнению с детьми, болеющими менее 5 лет и здоровыми детьми, симпатикотония выявлялась чаще (р<0,05 и р<0,01, соответственно). При тяжёлом течении заболевания у детей II группы также чаще определялась симпатикотония по сравнению с детьми I и контрольной групп (р<0,05 и р<0,01, соответственно).
Сдвиги в вегетативном обеспечении деятельности сердца подтверждались при оценке кардиоваскулярных тестов по Ewing. Так, нормальное вегетативное обеспечение деятельности сердца отмечено лишь у 35 детей с СД (40,7%), начальные изменения в вегетативном обеспечении - у 45 детей (52,3%) и отчётливое вовлечение вегетативного обеспечения в патологический процесс у 6 детей с СД (7,0%). Причём установлено, что только у детей с длительностью СД более 5 лет имело место отчётливое вовлечение вегетативного обеспечения деятельности сердца в патологический процесс.
Повышение активности симпатического отдела вегетативной нервной системы отражает не только процесс адаптации сердечно-сосудистой системы к метаболическим изменениям, но и является следствием ослабления парасимпатических влияний вследствие формирующейся у больных СД вагусной денервации сердца.
Преобладание симпатической направленности вегетативного гомеокинеза у детей с СД подтверждалось при анализе показателей электрокардиографического исследования. Так, по мере прогрессирования основного заболевания была выявлена большая частота тахиаритмий по сравнению с группой контроля. Помимо тахиаритмий у детей с СД было отмечено увеличение, по сравнению с контрольной группой, частоты встречаемости альтернации зубца R (р<0,05), нарушения процессов реполяризации (р<0,01), а также признаков перегрузки левого желудочка (р<0,001), что расценивается как признак обменно-дистрофических и электролитных изменений в миокардиоцитах.
С целью установления диагностической ценности холтеровского мониторирования в выявлении нарушений вегетативной регуляции у детей с СД, был проведён анализ суточной вариабельности ритма сердца (ВРС) у обследованных детей. Нами использовались временной и спектральный анализы ВРС. Анализ временных показателей вариабельности ритма сердца позволил установить, что у детей, по мере прогрессирования основного заболевания, снижается чувствительность синусового узла к парасимпатическим влияниям и формируется ригидность сердечного ритма. Так, установлено, что у детей с длительностью СД более 5 лет общий средний, средний дневной и средний ночной pNN50 и rMSSD были достоверно ниже, чем у детей больных менее 5 лет и здоровых детей (таблица 1).
Анализ спектральных показателей вариабельности ритма сердца показал, что у детей с признаками симпатикотонии (по результатам анализа временных показателей) показатели спектрального анализа достоверно ниже по сравнению с показателями детей с нормальными значениями pNN50 и rMSSD. Данные изменения свидетельствуют о значительном снижении у этих детей влияний не только парасимпатического, но и симпатического отделов вегетативной нервной системы на регуляцию сердечного ритма.
Анализ отношения показателей низкочастотного (LF) и высокочастотного (HF) волновых спектров показал, что у детей с признаками диабетической автономной кардиоваскулярной нейропатии это соотношение было достоверно больше (р<0,001) по сравнению с группой, имеющей нормальные значения pNN50 и rMSSD, где данный показатель находился в пределах нормы. Данные изменения, по нашему мнению, свидетельствуют о преимущественном и более выраженном вовлечении в патологический процесс парасимпатического отдела вегетативной нервной системы на начальных этапах формирования диабетической автономной кардиоваскулярной нейропатии и могут быть использованы в качестве критерия ее ранней диагностики.
Таблица 1.
Показатели вариабельности ритма сердца у детей с сахарным диабетом в зависимости от длительности заболевания, М±m
| Показатель | I группа (n=32) | II группа (n=37) | Контрольная группа (n=30) |
| pNN50 (общий средний), % | 26,0±3,03* | 14,0±2,1*** р1<0,01 | 37,2 ± 1,14 |
| pNN50 (средний днем), % | 18,6±2,69* | 7,4±1,33*** р1<0,001 | 22,5 ± 1,42 |
| pNN50 (средний ночью), % | 36,8±4,01* | 25,8±3,54*** р1<0,05 | 43,7 ± 1,95 |
| rMSSD (общий средний), мс | 54,2±5,04* | 31,8±3,61*** р1<0,001 | 80,4 ± 1,86 |
| rMSSD (средний днем), мс | 43,2±4,56* | 21,6±2,23*** р1<0,001 | 59,4 ± 2,41 |
| rMSSD (средний ночью), мс | 70,3±6,51* | 49,8±6,19*** р1<0,05 | 82,3 ± 2,10 |
Примечание. Достоверность различий: *** - р<0,001, ** - р<0,01, * - р<0,05 – по сравнению с контрольной группой; р1 – по сравнению с I группой.
В ходе работы была проведена оценка диастолической функции левого желудочка по данным эхокардиографического исследования. Для этого нами был использован один из основных эхокардиографических признаков нарушения диастолической функции миокарда - индекс податливости миокарда (ИПМ=АТЕ/DT1/2).
Анализ динамики ИПМ у детей показал, что у детей с признаками диабетической автономной кардиоваскулярной нейропатии (по результатам анализа временных показателей) данный показатель достоверно ниже по сравнению с детьми с нормальными значениями pNN50 и rMSSD. Данные изменения свидетельствуют о повышении ригидности миокарда в фазу диастолы и формирующейся диастолической дисфункции у детей с СД на фоне уже диагностированной ранее диабетической автономной кардиоваскулярной нейропатии.
Таким образом, диабетическую автономную кардиоваскулярную нейропатию можно рассматривать, на наш взгляд, как один из этапов формирования дистрофического поражения миокарда при сахарном диабете 1 типа у детей.
Помимо клинико-инструментального обследования у всех детей с СД проводился ряд лабораторных исследований для оценки степени компенсации углеводного обмена, наличия оксидантного стресса и клеточного энергодефицита в организме ребёнка.
Так, у большинства детей, больных СД, уровень гликозилированного гемоглобина (HbA1c) был выше допустимых для компенсации заболевания границ. Причем средний уровень HbA1c у детей с длительным и тяжёлым течением заболевания был достоверно выше, чем у остальных детей. Полученные данные свидетельствуют о недостаточной компенсации заболевания, неудовлетворительном самоконтроле гликемических показателей и лабильном течении заболевания, особенно при длительном и тяжёлом течении СД.
Уровень молочной кислоты периферической крови детей, больных СД, имел аналогичную направленность. Так, по мере прогрессирования и утяжеления основного заболевания отмечалось усугубление оксидантного стресса и клеточного энергодефицита в организме ребёнка, что проявлялось ростом уровня лактата периферической крови детей, больных сахарным диабетом 1 типа.
У большинства обследованных детей с СД был выявлен дефицит магния в слюне и эритроцитах периферической крови. Причём у детей с длительностью СД более 5 лет уровень магния в эритроцитах периферической крови и слюне был достоверно ниже, чем у детей, больных менее 5 лет и здоровых детей. Кроме того, у детей с тяжёлым течением заболевания также уровень магния в эритроцитах и слюне был достоверно ниже, чем у детей со средней степенью тяжести заболевания и детьми контрольной группы (р<0,01 и р<0,01 соответственно). Причём корреляционный анализ позволил выявить умеренную прямую корреляционную зависимость концентрации магния в секрете слюнных желёз от его концентрации в эритроцитах периферической крови.
Используя данные кардиоинтервалографии, оценки кардиоваскулярных тестов и суточного мониторирования сердечного ритма признаки ДАКН были выявлены у 18 детей с продолжительностью заболевания менее 5 лет и у 32 детей с длительностью СД более 5 лет.
У детей с признаками ДАКН также проводилось определение концентрации лактата периферической крови, магния в эритроцитах периферической крови и слюне.
Исследование показало, что уровень лактата периферической крови у детей с ДАКН был достоверно выше, чем у здоровых детей (р<0,001). Также установлено, что у детей с ДАКН с длительностью заболевания более 5 лет уровень молочной кислоты периферической крови был достоверно выше, чем у детей с продолжительностью СД менее 5 лет и здоровых детей (р<0,05 и р<0,001, соответственно).
У детей с ДАКН было выявлено достоверное снижение концентрации магния в секрете слюнных желёз и эритроцитах периферической крови по сравнению со здоровыми детьми (р<0,001 и р<0,001, соответственно). Установлена зависимость степени выраженность магниевого дефицита от длительности основного заболевания. У детей с продолжительностью СД более 5 лет уровень магния эритроцитов периферической крови был ниже, чем у детей с длительностью заболевания менее 5 лет и у детей контрольной группы (р<0,01 и р<0,001 соответственно). Концентрация магния в слюне детей с признаками диабетической автономной кардиоваскулярной нейропатии была также ниже у детей II группы по сравнению с I и контрольной группами (р<0,05 и р<0,001 соответственно).
Таблица 2.
Уровень лактата периферической крови, внутриклеточного магния и магния слюны у детей с диабетической автономной кардиоваскулярной нейропатией в зависимости от длительности заболевания, М±m
| Показатель | Всего (n=50) | I группа (n=18) | II группа (n=32) | Контроль (n=30) |
| Лактат | 2,7±0,14*** | 2,1±0,22* | 3,1±0,15*** р1<0,001 | 1,5±0,09 |
| Внутрикле- точный магний | 13,1±0,62*** | 15,3±0,69*** | 11,8±0,82*** р1<0,01 | 18,9±0,31 |
| Магний слюны | 0,35±0,06*** | 0,55±0,13 | 0,25±0,04*** р1<0,05 | 0,68±0,05 |
Примечание. Достоверность различий: *** - р<0,001, ** - р<0,01, * - р<0,05 – по сравнению с контрольной группой; р1 – по сравнению с I группой.
Для оптимизации обменных процессов детям с ДАКН, параллельно с инсулинотерапией, проводилась комплексная метаболическая терапия (липоевая кислота, панангин). Причём 25 детей для коррекции вторичной гипомагнезиемии и нормализации энергообразования в митохондриях клеток, нормализации выработки энергии ими в форме АТФ, недостаток которой имеет место при магниевом дефиците в организме вместо панангина получали препарат магнерот® (магниевая соль оротовой кислоты). Препарат назначался в дозе 50 мг/кг в сутки на 3 приёма в течение 1 недели, а затем 25 мг/кг в сутки на 3 приёма ещё на 3 недели.
Эффективность применения препарата магнерот® у детей с признаками ДАКН оценивалась путём сравнения показателей суточного мониторирования сердечного ритма группы детей, получившим магнерот® с этими же показателями у 25 детей, получавших кардиометаболическую терапию, включающую липоевую кислоту и панангин. Причём определение уровня магния эритроцитов периферической крови и слюны, а также оценка временных показателей вариабельности ритма сердца по данным суточного мониторирования ЭКГ проводились дважды: до и после проведения терапии.
По результатам исследования выявлено, что приём препарата магнерот® у детей с ДАКН приводит к достоверному повышению содержания магния в эритроцитах периферической крови и слюне. При динамическом наблюдении установлено, что магния оротата оказывает положительное влияние на функциональное состояние сердечно-сосудистой и вегетативной нервной систем у детей с сахарным диабетом. Так, общий средний, средний дневной и средний ночной pNN50 и RMSSD у детей с автономной кардиоваскулярной найропатией после лечения были выше, чем до лечения (рисунок 1).
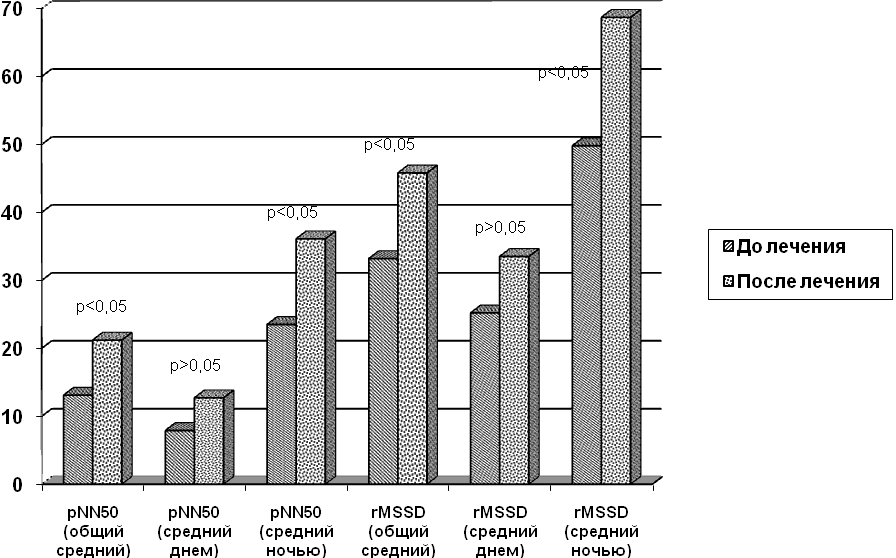
Рисунок 1. Влияние 4-х недельного курса лечения препаратом магнерот® на временные показатели вариабельности ритма сердца у детей с диабетической автономной кардиоваскулярной нейропатией.
В группе детей с признаками диабетической автономной кардиоваскулярной нейропатии, получавших метаболическую терапию, включающую липоевую кислоту и панангин, достоверного повышения концентрации магния эритроцитов периферической крови и секрета слюнных желёз достигнуто не было. Временные показатели суточного мониторирования сердечного ритма у этих детей также не имели значительной положительной динамики (рисунок 2).
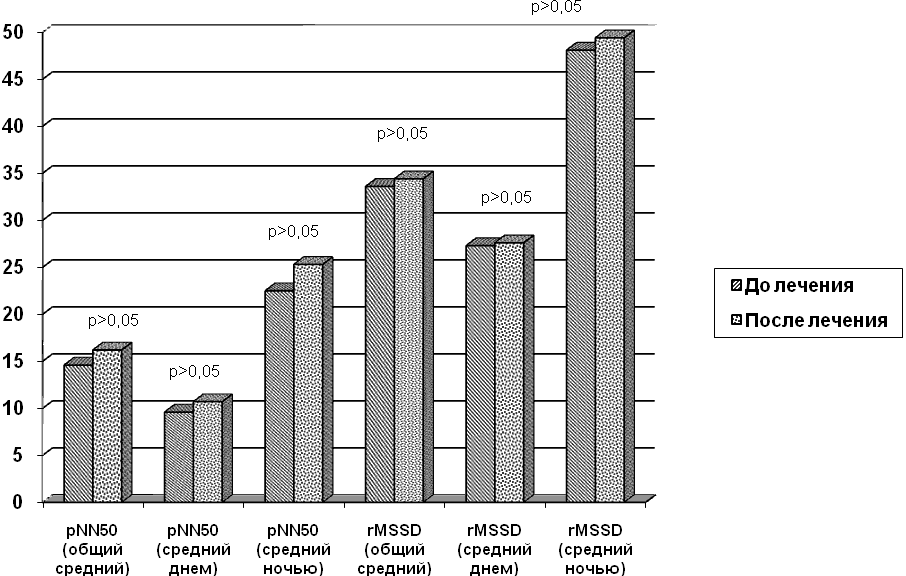
Рисунок 2. Динамика временных показателей вариабельности ритма сердца у детей с диабетической автономной кардиоваскулярной нейропатией, получавших метаболическую терапию, включающую липоевую кислоту и панангин.
Анализируя полученные данные можно сделать вывод, что дефицит магния действительно является одним из патогенетических механизмов развития кардиоваскулярных осложнений у детей с сахарным диабетом. Заместительная терапия с применением препарата магнерот® позволяет корректировать вторичную гипомагнемию и представляет собой эффективный способ профилактики и снижения темпов развития автономной кардиоваскулярной нейропатии у детей с СД.
ВЫВОДЫ
- Диабетическая автономная кардиоваскулярная нейропатия у детей с сахарным диабетом 1 типа характеризуется развитием тахиаритмических нарушений ритма, а также формированием ригидности сердечного ритма и снижением чувствительности синусового узла к парасимпатическим влияниям по данным временного анализа суточного мониторирования сердечного ритма.
- Ранними признаками диабетической автономной кардиоваскулярной нейропатии являются: уменьшение показателей спектрального анализа вариабельности ритма сердца (LF, HF), увеличение соотношения показателей низкочастотного и высокочастотного компонент более 1,6 по данным спектрального анализа суточного мониторирования сердечного ритма.
- Для детей с диабетической автономной кардиоваскулярной нейропатией характерно повышение уровня молочной кислоты периферической крови, а также снижение концентрации магния в эритроцитах периферической крови и секрете слюнных желёз, что является обоснованием для включения препаратов магния в комплексную метаболическую терапию детей с сахарным диабетом 1 типа.
- Включение препарата магнерот® в состав комплексной терапии детей с диабетической автономной кардиоваскулярной нейропатией позволило нормализовать концентрацию магния в эритроцитах периферической крови и слюне и способствовало улучшению временных показателей вариабельности ритма сердца по данным суточного мониторирования ЭКГ.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Врачам первичного звена, осуществляющим наблюдение за детьми с сахарным диабетом 1 типа (участковым педиатрам, врачам общей практики, семейным врачам, врачам сельских участковых больниц), целесообразно при наблюдении за этими детьми для раннего выявления изменений сердечно-сосудистой и вегетативной нервной систем применять трёхэтапную систему обследования, включающую:
I этап – на приёме врачу целесообразно уточнять факторы риска и кардиологические аспекты генеалогии, наличие клинических признаков, свидетельствующих о вовлечении сердечно-сосудистой и вегетативной нервной систем в патологический процесс;
II этап – детям, у которых на первом этапе выявлены изменения функции сердечно-сосудистой и вегетативной нервной систем, показано инструментальное обследование с использованием ЭКГ, КИГ, кардиоваскулярных тестов по Ewing в кабинетах функциональной диагностики ЦРБ или детской городской поликлиники;
III этап – детям, с выявленными нарушениями функции сердечно-сосудистой и вегетативной нервной систем, подтверждёнными клинико-функциональными методами исследования, показано квалифицированное кардиологическое обследование (Холтеровское мониторирование ЭКГ, допплерЭХО-КГ), наблюдение и терапия в условиях специализированных медицинских учреждений (консультативных центрах различного уровня, кардиологических диспансерах).
- Детям с сахарным диабетом 1 типа для контроля уровня магния и, соответственно, состояния энергообеспечения в организме ребёнка, показано регулярное, с момента манифестации заболевания, определение концентрации магния в секрете слюнных желёз.
- Детям с диабетической автономной кардиоваскулярной нейропатией для профилактики её прогрессирования необходимо проводить комплексную метаболическую и заместительную терапию с участием препарата магнерот® в дозе 50 мг/кг в сутки на 3 приёма в течение 1 недели, а затем 25 мг/кг в сутки на 3 приёма ещё на 3 недели не реже 1 раза в 6-12 месяцев.
Список опубликованных работ по теме диссертации
- Иванов, Д. А. Роль дефицита магния в формировании диабетической автономной кардиальной нейропатии у детей с сахарным диабетом 1 типа [Текст] / Д. А. Иванов, Т. А. Расторгуева, С. Ф. Гнусаев, М. А. Горшкова, Е. В. Декутович, В. В. Жмуркин // Российский вестник перинатологии и педиатрии. – 2009. - №5. – С. 70-75.
- Иванов, Д. А. Способ профилактики и лечения диабетической кардиопатии у детей [Текст] / Д. А. Иванов, С. Ф. Гнусаев, О. А. Дианов, Б. Н. Яковлев, Т. А. Белякова // «Современные технологии в педиатрии и детской хирургии». Материалы V Российского конгресса (24-26 октября 2006 г.). - Москва, 2006. - С. 95-96.
- Иванов, Д. А. Влияние дефицита магния на формирование диабетической кардиопатии у детей [Текст] / Д. А. Иванов, С. Ф. Гнусаев, Т. А. Белякова // «Детская кардиология 2008». Материалы V Всероссийского конгресса (6-7 июня 2008 г.). - Москва, 2008. - С. 160-161.
- Иванов, Д. А. Эффективность магнерота в комплексной профилактике и лечении диабетической кардиопатии у детей [Текст] / Д. А. Иванов, Т. А. Белякова, С. Ф. Гнусаев // «Современные технологии в педиатрии и детской хирургии». Материалы VIII Российского конгресса (20-22 октября 2009 г.). - Москва, 2009. - С. 236.
Патенты на изобретение
- Заявка на изобретение № 2009101227 (001489) от 15.01.2009 г. «Способ ранней диагностики диабетической автономной кардиальной нейропатии у детей и подростков» (РасторгуеваТ.А., Гнусаев С.Ф., Иванов Д.А.).
- Заявка на изобретение № 2009140671 от 06.11.2009 г. «Способ профилактики и лечения диабетической автономной кардиальной нейропатии у детей и подростков с применением препарата магнерот» (Расторгуева Т.А., Гнусаев С.Ф., Иванов Д.А.).
Список сокращений:
ВНС – вегетативная нервная система
ВР – вегетативная реактивность
ВРС – вариабельность ритма сердца
ДАКН – диабетическая автономная кардиоваскулярная нейропатия
ИВТ – исходный вегетативный тонус
ИПМ – индекс податливости миокарда
КИГ – кардиоинтервалография
СД – сахарный диабет
ХМ – Холтеровское мониторирование ритма сердца
ЭКГ – электрокардиография
HbA1c – гликозилированный гемоглобин
АТЕ – время достижения максимальной скорости потока в фазу раннего диастолического наполнения
DT1/2 – половина времени замедления скорости потока в фазу раннего диастолического наполнения
pNN50 – процентная представленность эпизодов различия последовательных интервалов RR более чем на 50 мс, характеризующая чувствительность пейсмекера к парасимпатическим влияниям
rMSSD – квадратный корень из суммы квадратов разности величин последовательных RR интервалов, определяющий функцию концентрации ритма

