Патогенетическая характеристика важнейших клинических форм нарушений психологического развития у детей и оптимизация их лечения
На правах рукописи
Крапивкин Алексей Игорьевич
ПАТОГЕНЕТИЧЕСКАЯ ХАРАКТЕРИСТИКА ВАЖНЕЙШИХ
КЛИНИЧЕСКИХ ФОРМ НАРУШЕНИЙ ПСИХОЛОГИЧЕСКОГО РАЗВИТИЯ У ДЕТЕЙ И ОПТИМИЗАЦИЯ ИХ ЛЕЧЕНИЯ
14.01.08 – педиатрия
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Москва 2012
Работа выполнена в Федеральном государственном бюджетном учреждении «Московский научно-исследовательский институт педиатрии и детской хирургии» Минздравсоцразвития Российской Федерации
Научные консультанты:
доктор медицинских наук, профессор Белоусова Елена Дмитриевна
доктор медицинских наук, профессор Сухоруков Владимир Сергеевич
Официальные оппоненты:
Новиков Петр Васильевич, доктор медицинских наук, профессор, ФГБУ «МНИИ педиатрии и детской хирургии» Минздравсоцразвития России, отделение психоневрологии и наследственных заболеваний с нарушением психики, заведующий
.
Маслова Ольга Ивановна, доктор медицинских наук, профессор, ФГБУ «Научный центр здоровья детей» РАМН, консультативно-диагностический центр НИИ профилактической педиатрии и восстановительного лечения, врач
Ивков Николай Николаевич, доктор медицинских наук, профессор, ГБОУ ВПО «Российский национальный исследовательский медицинский университет имени Н.И.Пирогова» Минздрава России, кафедра биологической химии, профессор
Ведущая организация:
ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России
Защита состоится «____ » ______________ 2013 года на заседании диссертационного совета Д-208.043.01 при ФГБУ «МНИИ педиатрии и детской хирургии» Минздравсоцразвития РФ
С диссертацией можно ознакомиться в библиотеке ФГБУ «МНИИ педиатрии и детской хирургии» Минздравсоцразвития России по адресу: 125412, г. Москва, Талдомская ул., д.2.
Автореферат разослан « ____ » ________________ 2012 года.
| Учёный секретарь диссертационного совета, кандидат мед. наук | Землянская Зинаида Константиновна |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
АКТУАЛЬНОСТЬ ПРОБЛЕМЫ.
Нарушения психологического развития и поведения широко распространены и часто входят в симптомокомплексы различных, в том числе наследственных, заболеваний детского возраста (Mash E.J., Wolf D.A. 2003, Гуровец Г. В., 2010). В то же время задачи дифференциальной диагностики и лечения детей с различными неврологическими заболеваниями с нарушениями познавательных функций разрешены далеко не полностью. В настоящее время не определены патогенетические механизмы большинства форм таких нарушений, имеет место недостаток применения соответствующих диагностических маркеров. Нарастающее число научных работ и эмпирически выявляемая эффективность энерготропной терапии в отношении оптимизации функционирования нервной системы свидетельствует о том, что большую роль в развитии вышеуказанных патогенетических механизмов играют нарушения энергообмена (Gardner, 2011).
В последнее десятилетие в медицине активно развивается так называемое «метаболическое направление», формирующее представление о роли митохондриальных нарушений (тканевой гипоксии) в развитии и течении самых разнообразных патологических процессов (Вельтищев Ю.Е. и соавт., 1992, 1998, 1999; Luft R. 1994; Scheffler I.E., 2001). В этом отношении наиболее актуальным представляется изучение нарушений центральной нервной системы, построенной из наиболее энергозависимых тканевых элементов.
Митохондрии - это структурные внутриклеточные единицы, обладающие собственным генетическим аппаратом и обеспечивающие энергетический обмен - образование молекул АТФ, играющие немаловажную роль в поддержании различных клеточных функций. Клинические проявления при поражении нейронов варьируют от умеренного повышения утомляемости до тяжелых энцефалопатий и полиневропатий (Сухоруков В.С., Николаева Е.А., 2004).
Нервные клетки являются наиболее энергозависимыми в организме человека, поэтому нарушения функции центральной нервной системы при митохондриальных болезнях и митохондриальной дисфункции имеют первостепенное значение (Сухоруков В.С., 2008). Изменения биохимических процессов, происходящих в митохондриях (окисление жирных кислот, цикл трикарбоновых кислот, дыхательные цепи, окислительное фосфорилирование, регуляция внутриклеточного распределения кальция, образование стероидов, регуляция апоптоза) способны вызвать сложную цепь нарушений метаболизма на уровне клеток головного мозга и всего организма в целом.
В настоящее время уже хорошо известны энцефалопатии, входящие в симптомокомплекс заболеваний, обусловленных мутациями митохондриальных или ядерных генов, кодирующих синтез митохондриальных белков. Данные мутации приводят к первичной митохондриальной недостаточности, лежащей в основе таких известных тяжелых синдромов, как синдром Кернса-Сейра, Пирсона, MELAS, MERRF и многих других. В последние годы описаны множество нозологических форм, связанных с дефектами митохондриального генома, что и послужило основанием для выделения самостоятельной группы митохондриальных болезней, появления термина "митохондриальная медицина" (Scheffler, 2001). Распространенность патологических состояний, связанных с митохондриальной недостаточностью, не ограничивается наследственными синдромами, вызываемыми мутациями генов митохондриальной ДНК. Широчайший круг других заболеваний включает в себя те или иные нарушения клеточной энергетики как вторичные звенья патогенеза. В целом, можно сказать, что изучение болезней, причиной которых являются наследственные нарушения митохондриальных функций, произвело своего рода революцию в современных представлениях о медицинских аспектах энергетического обмена человека. Помимо вклада в теоретическую патологию и медицинскую систематику, одним из главных достижений медицинской «митохондриологии» явилось создание эффективного диагностического инструментария (клинические, биохимические, морфологические и молекулярно-генетические критерии полисистемной митохондриальной недостаточности), позволившего оценивать полисистемные нарушения клеточного энергообмена. Возможность патогенетически обоснованной терапии митохондриальных заболеваний, как и возможность эффективного изменения традиционных подходов лечения многих болезней при снижении «энергетического фона», делает особо актуальными задачи совершенствования такой коррекции, а также разработки методов лабораторной диагностики указанных нарушений.
Современная литература изобилует доказательствами существенной роли митохондриальных нарушений в патогенезе неврологических и психических расстройств [Gardner А, 2011; Seaver L.H. еt al. 2011; Sofou K. et al., 2012).
Большое количество работ определяют актуальность усилий, которые должны быть направлены как на изучение дизэнергетических основ патоневрологических состояний и нарушений высшей нервной деятельности, так и на анализ психопатологических проявлений болезней, связанных с нарушениями клеточного энергообмена. Внимания требуют как новые клинические и лабораторные диагностические подходы, так и самое главное - новые способы лечения нарушений психологического развития и поведения.
В связи с этим актуальным является изучение патологических процессов, связанных с митохондриальной дисфункцией при различных формах заболеваний детского возраста с расстройствами психологического развития; формирования представлений о сути, степени и значении дизэнергетических процессов, происходящих при этом на тканевом уровне, исследование адаптационных реакций организма ребенка на происходящие изменения, а также поиск новых подходов к терапевтической коррекции данных патологических состояний.
ЦЕЛЬ ИССЛЕДОВАНИЯ:
Изучение клинических форм расстройств психологического развития и поведения у детей с точки зрения их патогенеза, характера нарушений тканевого энергетического метаболизма для обоснования целесообразности энерготропной терапии и оценки ее эффективности.
ЗАДАЧИ ИССЛЕДОВАНИЯ:
- Определить характер и выраженность изменений активности ферментов энергообмена (сукцинатдегидрогеназа, глутаматдегидрогеназа, альфа-глицерофосфатдегидрогеназа, лактатдегидрогеназа), биохимических показателей тканевого энергообмена (перекисного окисления липидов, молочной и пировиноградной кислот и др.) у детей с различными формами нарушений формирования устной речи (дислалии, дизартрии и др.), синдромом дефицита внимания / гиперактивности, у пациентов с задержкой психического развития.
- Оценить особенности интеллектуального развития (показателей памяти, внимания, нарушения речевого развития и др.) детей с различными нозологическими формами наследственных заболеваний, первично обусловленными полисистемными митохондриальными нарушениями.
- Выявить наличие и определить характер митохондриальных нарушений (биохимические изменения в сыворотке крови, морфофункциональные особенности митохондрий лимфоцитов периферической крови и скелетных мышц), а также признаки расстройств психологического развития и поведения у детей с различными нозологическими формами наследственных заболеваний с поражением нервной системы (туберозный склероз, различные эпилептические синдромы, дисгенезии коры головного мозга, невропатии и др.)
- Обосновать применение объективных лабораторных методов оценки расстройств тканевого энергообмена у детей с различными формами нарушений психологического развития и поведения (дефицит внимания/гиперактивности, нарушения речевого развития, задержка психического развития) для выбора метода лечения и оценки его эффективности.
- Оценить терапевтическую эффективность энерготропных препаратов (антигипоксантов, антиоксидантов, метаболических средств, витаминов) у детей с различными клиническими формами расстройств психологического развития и поведения.
НАУЧНАЯ НОВИЗНА РАБОТЫ.
Установлено, что расстройства психологического развития и поведения у детей, протекающие как в качестве самостоятельных клинических форм, так и в составе симптомокомплексов различных наследственных заболеваний, сопровождаются нарушениями тканевого энергетического метаболизма, проявляющимися в виде изменений биохимических и цитохимических показателей (изменение концентраций коэнзима Q10, восстановленного глутатиона, малонового диальдегида, 8-ОН-дезоксигуанозина, витаминов Е и С, бета-каротина, гидроперекисей, молочной и пировиноградной кислот, а также антиокислительной активности крови и активности сукцинатдегидрогеназы, альфа-глицерофосфатдегидрогеназы, глутаматдегидрогеназы и лактатдегидрогеназы). Характер и степень выраженности биохимических и цитохимических показателей зависят от нозологической формы заболевания.
Показано, что расстройства формирования устной речи (дислалии, дизартрии и др.) у детей сопровождаются полисистемными дисфункциями клеточной энергетики, умеренным дисбалансом митохондриальных процессов, компенсирующихся за счет повышения активности малоспецифичных сукцинатных механизмов.
Доказано, что дефицит внимания и гиперактивности у детей характеризуется снижением процессов запоминания, которые находятся в прямой корреляционной связи с активностью фермента сукцинатдегидрогеназы, а расстройства процессов поддержания и переключения внимания коррелируют с показателями активности фермента глутаматдегидрогеназы.
Установлено, что задержка психического развития у детей, в сравнении с другими расстройствами психологического развития и поведения, сопровождается более выраженными нарушениями энергообмена и характеризуются дисфункцией всех ключевых молекулярных путей тканевого энергообмена, включая нарушения активности сукцинатдегидрогеназы и глутаматдегидрогеназы, признаки гипоксического синдрома, повышение перекисных процессов и активности анаэробного гликолиза, дисфункцию фосфатно-кальциевого обмена, а также признаки интоксикации и активацию острофазных процессов.
Доказано, что степень выраженности нарушений тканевого энергетического метаболизма у детей с нарушениями психологического развития и поведения с аутизмом характеризуются различными вариантами нарушения активности фермента сукцинатдегидрогеназы: повышением у 50% и снижением у 30% обследованных относительно контрольных показателей у здоровых детей.
Установлено, что у всех детей с наследственными заболеваниями, первично обусловленными нарушениями митохондриальных функций, клинический симптомокомплекс заболевания включает в себя различные формы нарушения психологического развития и поведения.
Впервые показано, что в патогенезе аутизма значительную роль играют полисистемные нарушения клеточного энергообмена, характеризующиеся достоверным снижением активности альфа-глицерофосфатдегидрогеназы и глутаматдегидрогеназы на фоне повышения активности лактатдегидрогеназы более чем у половины обследованных детей.
Научно обоснованно использование энерготропных препаратов в комплексном лечении детей с расстройствами психологического развития и поведения, сопровождающимися нарушениями тканевого энергетического метаболизма и текущими как в качестве самостоятельных клинических форм, так и в составе симптомокомплексов различных наследственных заболеваний. Эффективность энерготропной терапии зависит от нозологической формы заболевания и степени расстройства тканевого энергетического метаболизма.
Определено, что цитохимические показатели активности митохондриальных ферментов (сукцинатдегидрогеназы, альфа-глицерофосфатдегидрогеназы, глутаматдегидрогеназы) и лактатдегидрогеназы позволяют определить целесообразность и оценивать клиническую эффективность энерготропной терапии при нарушениях психологического развития у детей.
ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ.
Определены клинические проявления расстройств психологического развития и поведения у детей при различных нозологических формах заболеваний нервной системы в зависимости от характера и степени выраженности полисистемных митохондриальных нарушений. На основании этого показано, что комплексное определение функциональных, цитохимических и ультраструктурных изменений митохондрий лимфоцитов периферической крови, а также биохимических показателей митохондриальных нарушений у детей с различными расстройствами психологического развития и поведения, в том числе при наследственных заболеваниях, может быть использовано для определения роли тканевого энергетического метаболизма, определения формы и тяжести заболевания, а также обоснования целесообразности включения в комплекс лечения энерготропных препаратов.
Предложено использование цитохимического определения активности митохондриальных ферментов (сукцинатдегидрогеназы, альфа-глицерофосфатдегидрогеназы, глутаматдегидрогеназы) и лактатдегидрогеназы в качестве лабораторных критериев для определения целесообразности и оценки последующей эффективности энерготропной терапии различных форм расстройств психологического развития и поведения у детей.
В практику лечения детей с различными формами расстройств психологического развития и поведения предложены энерготропные препараты (коэнзим Q10, карнитин и др.), способствующие повышению выработки энергии на клеточном уровне, снижающие перекисное окисление липидов, уменьшающие оксидативный стресс, и снижающие степень выраженности клинических проявлений заболевания.
ПОЛОЖЕНИЯ, ВЫНОСИМЫЕ НА ЗАЩИТУ.
- Нарушения психологического развития и поведения входят в симптомокомплекс многих заболеваний, связанных с дефектами митохондрий. Эти нарушения представляют собой различные формы речевых дисфункций (дислалии, дизартрии, сложные речевые расстройства), дефицит внимания и гиперактивности, задержку психического развития, симптомы аутизма.
- В патогенезе нарушений психологического развития и поведения часто выявляются свойственные для каждого из них характерные нарушения энергообмена, выражающиеся в специфичных паттернах изменений цитохимических и биохимических показателей тканевого энергообмена. Обладая специфическими, лабораторно выявляемыми характеристиками, особенности нарушений тканевого энергообмена имеют значение для дифференциальной диагностики нарушений психологического развития и поведения.
- Изолированные формы умеренных нарушений психологического развития и поведения, выражающихся в различных формах нарушений формирования устной речи (дислалии, дизартрии и др.), а также в дефиците внимания и гиперактивности, часто сопровождаются признаками компенсаторного напряжения аэробного окисления в митохондриях.
- Нарушения психологического развития и поведения, выражающиеся в значительной задержке темпа психического развития и в признаках аутизма, у большого числа пациентов связаны с декомпенсированными дизэнергетическими состояниями, проявляющимися признаками гипоксического синдрома, повышением перекисных процессов и активности анаэробного гликолиза, дисфункцией фосфатно-кальциевого обмена и биоэнергетики, а также признаками эндогенной интоксикации (средние молекулы, ураты) и активации острофазных процессов (фибриноген).
- Цитохимическое выявление активности ключевых ферментов энергообмена (сукцинатдегидрогеназы, альфа-глицерофосфатдегидрогеназы, глутаматдегидрогеназы, лактатдегидрогеназы) является чувствительным методом выявления полисистемных митохондриальных нарушений у детей с нарушениями психологического развития и поведения, а также - критерием оценки эффективности энерготропной терапии.
- Энерготропная терапия обладает высокой эффективностью в лечении детей с различными клиническими формами нарушений психологического развития и поведения, связанными с дисфункцией тканевого энергетического метаболизма.
ВНЕДРЕНИЕ РЕЗУЛЬТАТОВ РАБОТЫ.
Результаты исследования внедрены в практику клинических подразделений ФГБУ «МНИИ педиатрии и детской хирургии» Минздравсоцразвития России; в практику лечебно-диагностической работы Тушинской детской городской больницы Департамента здравоохранения города Москвы; Чукотской окружной больницы, в практику научной деятельности Российского национального исследовательского медицинского университета им Н.И. Пирогова, ФГБУ «Московский НИИ педиатрии и детской хирургии» Минздравсоцразвития России и ФГБУ «Московский НИИ психиатрии» Минздравсоцразвития России, Медицинского института ФГБУ ВПО «Мордовский государственный университет им. Н.П.Огарева», ГОУ ВПО «Тверская государственная медицинская академия» Минздравсоцразвития России, ГБОУ ВПО «Самарский государственный медицинский университет» Минздравсоцразвития России,
АПРОБАЦИЯ РАБОТЫ.
Основные положения диссертации доложены и обсуждены на II, V, XIX Российском национальном конгрессе "Человек и лекарство" (Москва, 1995, 1998, 2012 ), 2-м Европейском конгрессе по эпилепсии (Гаага, Нидерланды, 1996), 22-м, 23-м Международном конгрессе по эпилепсии (Дублин, Ирландия, 1997, Прага, Чехия, 1999), Российской научно-практической конференции «Современные методы диагностики и лечения эпилепсий» (Смоленск, 1997), VIII российском конгрессе педиатров (Москва, 1998), 3-м Европейском конгрессе по эпилепсии (Варшава, Польша, 1998), 4-м Международном конгрессе «Иммунореабилитация и реабилитация в медицине» (Сочи, 1998), 10-м Международном симпозиуме по туберозному склерозу (Гётеборг, Швеция, 1998), 8-м Международном конгрессе по детской неврологии (Любляна, Словения, 1998), VIII Дальневосточном медицинском конгрессе «Человек и лекарство» (Владивосток, 2011), Дальневосточной НПК «Актуальные проблемы педиатрии» (Хабаровск, 2011), I Всероссийском конгрессе «Медицина для спорта» (Москва, 2011), VII, VIII, IX, X, XI Российский конгресс «Инновационные технологии в педиатрии и детской хирургии» (Москва, 2008, 2009, 2010, 2011, 2012), III Российской конференции с международным участием «Проблемы нарушения клеточной энергетики» (Москва, 2012).
Публикации. По теме диссертации опубликовано 25 работ в отечественной и зарубежной печати, оформлено 2 патента на изобретения.
Объем и структура диссертации. Диссертация изложена на 317 страницах машинописного текста, состоит из введения, обзора литературы, описания материала и использованных методик, глав посвященных результатам собственных исследований, заключения, выводов, практических рекомендаций и указателя литературы, включающего 356 литературных источника. Текст иллюстрирован 42 таблицами и 38 рисунками.
СОДЕРЖАНИЕ РАБОТЫ
ГРУППЫ ОБСЛЕДОВАННЫХ БОЛЬНЫХ.
Общее количество обследованных детей- 293 пациента, в возрасте от 3-х до 18 лет. Обследуемые дети разделены на несколько групп:
Группа 1 - дети с различными формами нарушений формирования устной речи (дислалии, дизартрии и др.) (n=32).
Группа 2 - дети с синдромом дефицитом внимания и/или гиперактивности (n=30).
Группа 3 - дети с нарушениями темпов психического развития (n=31).
Группа 4 – дети с различными проявлениями аутизма (n=31).
Группа 5 - дети с нарушениями психологического развития и поведения, страдающие «первичными» митохондриальными заболеваниями (n=21).
Группа 6 - дети с нарушениями психологического развития и поведения, обусловленных синдромами с поражениями нервной системы (туберозный склероз, различные эпилептические синдромы, дисгенезии коры, невропатии и др.) (n=98).
Группа 7 (контрольная) – дети без признаков нарушений высшей нервной деятельности (n= 50).
МЕТОДЫ ИССЛЕДОВАНИЯ.
- Клинико-анамнестические и функциональные методы
- анкетный метод: анкетирование родителей, включающее получение анамнестических сведений о течении беременности и состоянии ребенка в периоде новорожденности, оценку раннего психомоторного развития, анализ становления психомоторных навыков, сроков формирования задержки и регресса психоречевого и моторного развития; характеристику течения основного заболевания (возраст дебюта, длительность, наличие эпилепсии и др.);
- неврологический осмотр с оценкой состояния центральной нервной системы на основе анализа степени задержки психомоторного и речевого развития, наличия микроцефалии и двигательных расстройств, состояние мышечного тонуса, рефлексов, координаторных нарушений;
-методы оценки интеллектуального развития (анализ когнитивных функций путем исследования памяти, внимания) с помощью методики «10 слов» (Лурия А.Р., 2000); корректурной пробы (по Векслеру, 1971); методики «10 слов» на зрительные стимулы.
- методы функциональной диагностики:
Электроэнцефалографическое исследование.
Нейрорадиологические методы исследования: магнитно-резонансная томография и компьютерная томография головного мозга.
II. Биохимические методы исследования:
- определение уровней молочной и пировиноградной кислот с помощью энзиматического метода Rollinghoff (1967) натощак;
- оценка состояния процессов перекисного окисления липидов (ПОЛ) в крови путем определения содержания гидроперекисей (по В.Б.Гаврилову и соавт., 1983), малонового диальдегида (МДА, по I. Minoru, 1978) и уровня антиоксидантной активности (по Г.И.Клебанову и соавт., 1985) плазмы крови;
- хроматомасс-спектрометрическое определение в сыворотке крови и в суточной моче концентраций следующих веществ: коэнзим Q10 (KoQ), восстановленный глутатион, малоновый диальдегид (МДА), 8-ОН-дезоксигуанозин (8-ОНДГ), витамин Е, витамин С, бета-каротин;
- биохимический анализ показателей суточной мочи: анализ мочевого осадка, рН, удельной плотности; выявление содержания белка, оксида азота, фосфолипазы А и С, фибриногена, перекисей, липидов, гликозамингликанов, хлоридов, фосфатов, кальция с помощью скрининг-метода, а также определение антиоксидантной способности мочи и анализ экскреции «средних молекул», электрофорез в агаровом геле микропротеинов мочи («Serba»).
II. Цитохимические методы исследования:
- цитохимическое выявление активности митохондриальных ферментов наборами реактивов фирмы ООО МНПК “Химтехмаш”, ГосНИИ “ИРЕА” (Россия): сукцинатдегидрогеназы, альфа-глицерофосфатдегидрогеназы, глутаматдегидрогеназы, лактатдегидрогеназы лейкоцитов периферической крови (метод Р.П.Нарциссова, (1986) с последующей визуальной и компьютерной морфометрией (пакет программ “Видеотест”, методика В.C.Сухорукова, Е.В.Тозлиян).
IV. Морфологические методы исследования:
- морфологический анализ исследования биоптатов мышечной ткани, полученных в результате биопсии четырехглавой мышцы бедра (по диагностическим показаниям у детей первой и второй групп) проводилась с помощью следующих методов:
- для выявления общих гистологических изменений – окраска нефиксированных замороженных и парафиновых срезов гематоксилином и эозином; окраски по методам Гомори-Энгела, Маллори, Ван Гизона; окраска фосфорно-вольфрамовой кислотой и гематоксилином.
- для выявления активности отдельных ферментов и субстратов на световом уровне – выявление активности сукцинатдегидрогеназы, активности цитохромоксидазы, гликогена, гликозаминогликанов, кальция, липидов. Визуально по интенсивности осадка реакции определялась активность сукцинатдегидрогеназы (СДГ) по методу Нахласа, цитохромоксидазы по методу Берстона; гликоген выявляли по методу Шабадаша, кальций – по методу Косса, липиды – окраской суданом черным В по методу Лизона.
- для ультраструктурного анализа образцы мышц фиксация в растворах глутарового альдегида и четырех окиси осмия, заливка в эпон-аралдитовую смесь смол, контрастирование уранилацетатом и цитратом свинца и изучение в электронном микроскопе ЭМ 125 (СССР), JEOL – 109 (Япония).
- электронная микроскопия лимфоцитов: для ультраструктурного анализа образцы, предварительно отцентрифугированной лейковзвеси венозной крови фиксировались в растворах глутарового альдегида и четырехокиси осмия, с последующей заливкой в эпон-аралдитовую смесь смол и контрастированием уранилацетатом и цитратом свинца. Полученные образцы изучались в электронном микроскопе ЭМ 125 (СССР), JEOL – 109 (Япония)..
- морфометрическая и статистическая обработка выполнена путем анализа распределения типов мышечных волокон, определения количества и размеров клеток и ультраструктурных элементов скелетно-мышечной и соединительной ткани на светооптическом и электронно-микроскопическом уровнях.
Статистическая обработка. Статистический анализ проведен методами параметрической и непараметрической статистики. Применялись методы вариационной статистики, корреляционный анализ и Т-тест для парных выборок. Проверка на нормальность осуществлялась с использованием критерия Шапиро-Уилка. Сравнение независимых групп, включающих количественные признаки, проводили с использованием критерия Манна-Уитни, для зависимых групп применялся критерий Вилкоксона. Достоверным считался уровень значимости р<0,05. Результаты исследования обрабатывали с использованием компьютерных программ «Excel» (Microsoft) и «Statistica6.0» (StatSoft).
Энерготропная терапия:
- Монотерапия препаратами левокарнитина в дозе в среднем 50-100 мг/сутки, ежедневно, в течение 2х месяцев
- Комбинация препаратов левокарнитина в дозе в среднем 50-100 мг/сутки, с коэнзимом Q10 в дозе 90 – 120 мг/сутки, раствором ацетиламиноянтарной кислоты 250 мг/сутки, препаратами витаминов группы В (нейромультивит или др.) в течение 2х месяцев
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
1. Особенности энергообмена у детей с нарушениями развития речи.
Группу детей с различными формами нарушений формирования устной речи (дислалии, дизартрии и др.) составили 32 ребенка с различными формами нарушений формирования устной речи, включающие сложные речевые расстройства, сопровождающиеся нарушениями становления всех компонентов речевой системы, относящихся к ее звуковой и смысловой стороне, при нормальном слухе.
1.1. Нарушения тканевого энергообмена у детей с задержкой речевого развития. В результате исследования было установлено, что показатели уровня молочной кислоты, соотношения молочной и пировиноградной кислот, параметров перекисного окисления липидов и другие лабораторные показатели полисистемной гипоксии у детей с задержкой речевого развития существенно не отличались от контрольных показателей.
Проведенное цитохимическое исследование клеток крови у детей с задержкой речевого развития выявило признаки митохондриальной дисфункции и тканевой гипоксии в данной группе (рисунок 1) в виде статистически достоверного повышения уровней активности СДГ (р=0,02), ГФДГ (р=0,009), а также ГДГ, ЛДГ, относительно контрольной группы.
При проведении психологического тестирования у детей с задержкой речевого развития отмечались более низкие, относительно среднестатических для данного возраста, показатели зрительной памяти, активности внимания, которые коррелировали с показателями цитохимической активности митохондриальных ферментов.
Рисунок 1.
Показатели уровней активности ферментов энергообмена
у детей с различными нарушениями формирования устной речи (n=32). 
Полученные результаты, демонстрируют улучшение когнитивных (познавательных) функций и свидетельствуют о патогенетической роли нарушений тканевого энергообмена в формировании нарушений речевого развития у детей.
1.2. Эффективность энерготропной терапии в коррекции нарушений речевого развития. Анализ результатов психологического тестирования после курса метаболической терапии у детей с различными формами нарушений формирования устной речи отметил улучшение кратковременной памяти, в сравнении с исходными данными. Количество запоминаемых слов после первого этапа тестирования увеличилось вдвое. Данная тенденция сохранялась на протяжении всего тестирования. При проведении исследования после второго этапа тестирования было установлено формирование у детей данной группы «кривой заучивания» в виде плато, как представлено на рисунке 2.1., что свидетельствует об их эмоциональной вялости, отсутствии заинтересованности, психологической истощаемости.
Незначительное улучшение показателей в данной группе отмечалось при исследовании зрительной памяти (на 6%), долгосрочной памяти (на 15%) в сравнении с исходными цифрами (рисунок 2.2).
Рисунок 2.
Изменение показателей психологического тестирования у детей с различными нарушениями формирования устной речи до и после энерготропной терапии (n=32).
 |  |
При динамическом обследовании концентрации внимания и способности к его переключению у детей выявлено улучшение показателей в среднем на 25% в сравнении с исходными цифрами.
При анализе цитохимических показателей у детей с нарушениями формирования речи после курса метаболической терапии, как представлено на рисунке 3, отмечалась нормализация активности ферментов тканевого энергообмена. Наибольшие изменения отмечены у детей с исходной активностью СДГ > 15 усл.ед. у которых после курса энерготропной терапии была отмечена нормализация активности альфа-глицерофосфатдегидрогеназы (6,63 ± 0,27 – до и 6,13 ± 0,19 – после лечения, р<0,1), глутаматдегидрогеназы (6,35 ± 0,29 – до и 5,99 ± 0,26 – после лечения, р<0,05) и лактатдегидрогеназы (10,81 ± 0,26 – до и 10,3 ± 0,19 – после лечения, р<0,05).
 |  |
| Рисунок 3. Изменение показателей уровней активности ферментов энергообмена у детей с различными нарушениями формирования устной речи до и после энерготропной терапии (n=32). | Таблица 1. Корреляция разниц показателей уровней активности ферментов энергообмена с разницами результатов психологических тестов у детей с различными нарушениями формирования устной речи до и после энерготропной терапии (n=32). |
В результате выявлено, что у детей с нарушениями формирования речи положительные сдвиги по результатам тестирования памяти коррелируют с повышением активности сукцинатдегидрогеназы и с понижением активности -глицерофосфатдегидрогеназы после лечения (таблица 1).
2. Особенности тканевого энергообмена у детей с синдромом дефицита внимания и/или гиперактивностью.
Группу детей с синдромом дефицита внимания и/или гиперактивности составили 30 детей, соответствующих клиническим критериям диагноза согласно DSM-IV. Синдром дефицита внимания и/или гиперактивности проявлялся несвойственными для нормальных возрастных показателей двигательной расторможенностью, дефектами концентрации внимания, отвлекаемостью, импульсивностью поведения, проблемами во взаимоотношениях с окружающими и трудностями в обучении. Дети также отличались двигательной неловкостью (неуклюжестью), что было обусловлено недостаточным развитием координации движений.
2.1. Нарушения энергообмена у детей с синдромом дефицита внимания и/или гиперактивности. В результате исследования было установлено, что показатели уровня молочной кислоты, соотношения молочной и пировиноградной кислот, параметров перекисного окисления липидов и другие лабораторные показатели полисистемной гипоксии у детей с синдромом гиперактивности и дефицитом концентрации внимания существенно не отличались от контрольных показателей. В то же время, проведенное цитохимическое исследование крови у этих детей выявило признаки митохондриальной дисфункции и тканевой гипоксии в виде повышения активности СДГ, как представлено на рисунке 4, статистически достоверном повышении активностей ГФДГ (р=0,006), а также ГДГ, ЛДГ относительно контрольной группы.
При проведении психологического тестирования у детей с расстройствами психологического развития и поведения отмечались более низкие, относительно среднестатических для данного возраста, показатели вербальной памяти, способности к переключению внимания, которые коррелировали с показателями цитохимической активности митохондриальных ферментов.
Рисунок 4.
Показатели уровней активности ферментов энергообмена у детей
с синдромом дефицита внимания и/или гиперактивности (n=30).

Полученные результаты, свидетельствуют о патогенетической роли нарушений тканевого энергообмена в формировании синдрома дефицита концентрации внимания и/или гиперактивности у детей.
2.2. Эффективность энерготропной терапии у детей с синдромом гиперактивности и дефицитом концентрации внимания. Анализ результатов психологического тестирования после получения курса метаболической терапии у детей с дефицитом внимания и/или гиперактивностью выявил улучшение показателей слуховой вербальной памяти. Количество запоминаемых слов после первого прочтения увеличилось вдвое (Рисунок 5.1). При проведении исследования у этих детей формировалась зигзагообразная «кривая запоминания», что свидетельствует о неустойчивости внимания.
При динамическом обследовании концентрации внимания и способности к его переключению у пациентов после энерготропного лечения отмечалось некоторое улучшение показателей (на 15%) в сравнении с исходными цифрами. При исследовании долгосрочной памяти наблюдалось улучшение показателей практически вдвое. При исследовании зрительной памяти отмечено небольшое улучшение показателей (на 5%) (Рисунок 5.2).
Рисунок 5.
Изменение показателей психологического тестирования у детей с синдромом
дефицита внимания и/или гиперактивности до и после энерготропной терапии (n=30).
 |  |
При анализе цитохимических показателей у детей у детей с дефицитом концентрации внимания и/или гиперактивностью после курса метаболической терапии отмечалась нормализация уровня митохондриальных ферментов (Рисунок 6). В результате выявлено, что у детей с дефицитом внимания и гиперактивностью после лечения достоверно уменьшилась активность альфа-глицерофосфатдегидрогеназы (6,52 ± 0,26 – до и 6,02 ± 0,19 – после лечения, р<0,05). В подгруппе с исходным уровнем СДГ < 15 усл.ед. достоверно увеличилась активность глутаматдегидрогеназы (5,8 ± 0,04 – до и 6,6 ± 0,2 – после лечения, р<0,05), а в подгруппе с исходным уровнем СДГ > 15 усл.ед. отмечалось снижение активности альфа-глицерофосфатдегидрогеназы (6,69 ± 0,56 – до и 5,7 ± 0,49 – после лечения, р<0,05) и глутаматдегидрогеназы (6,1 ± 0,29 – до и 5,27 ± 0,52 – после лечения).
 | 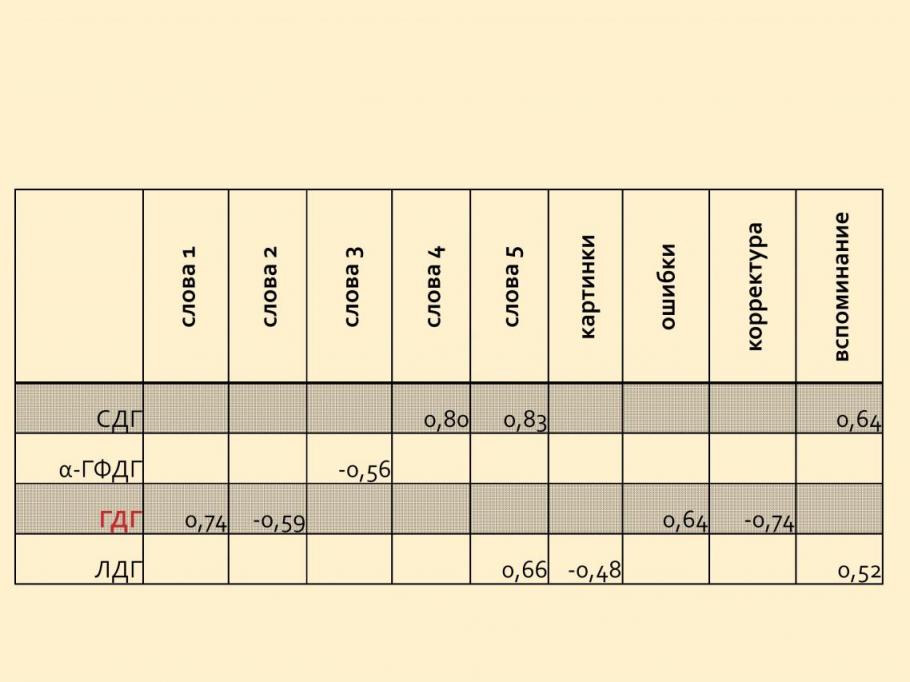 |
| Рисунок 6. Изменение уровней активности ферментов энергообмена у детей с дефицитом внимания и/или гиперактивности до и после энерготропной терапии (n=30). | Таблица 2. Корреляция разниц цитохимических параметров с разницами результатов психологических тестов у детей с дефицитом внимания и/или гиперактивности до и после энерготропной терапии (n=30). |
Таким образом, у детей с дефицитом внимания и/или гиперактивностью взаимосвязь с активностью сукцинатдегидрогеназы и -глицерофосфатдегидрогеназы принципиально не меняется по сравнению с показателями у детей предыдущей группы (с нарушениями речи), однако значительно большую роль играют изменения активности глутаматдегидрогеназы - фермента, изменения активности которого, по данным научной литературы, отражает развитие патологических процессов в центральной нервной системе (таблица 2).
3. Особенности тканевого энергообмена у детей с нарушениями темпов психического развития.
Группу детей с нарушениями темпов психического развития составил 31 ребенок с различными проявлениями задержки темпового психоречевого развития: замедленный темп психического развития, личностная незрелость, негрубые нарушения познавательной деятельности, по структуре и количественным показателям отличающиеся от умственной отсталости и имеющие тенденции к компенсации и обратному развитию. Состояния, относимые к данным нарушениям, являются составной частью более широкого понятия «пограничная интеллектуальная недостаточность».
3.1. Нарушения энергообмена у детей с нарушениями темпов психического развития. Вопрос о состоянии обменных процессов у детей с нарушениями темпов психического развития остается не до конца выясненным. Для определения наличия обменных нарушений была обследована группа детей с различными наследственными видами задержки психоречевого развития. Было показано, что умеренные изменения в крови отмечались у трети обследованных и касались снижения концентрации KoQ в среднем на 27%, повышения уровня МДА в среднем на 31%, у части детей было повышено содержание 8-ОНДГ в среднем на 36%. У трети детей отмечено снижение в крови витаминов С и А в среднем на 18%, но особенно часто отмечалось умеренное снижение содержания в крови витамина Е у 2/3 обследованных. Помимо этих данных в биохимическом анализе крови у 40% детей отмечалось повышение содержания уратов, средних молекул, наличие признаков гипоксии в виде снижения рО2 (< 70мм.рт.ст.), повышение продуктов анаэробного гликолиза – лактата и/или пирувата у 3/4 обследованных. У половины детей в сыворотке крови была повышена активность ЛДГ (480-618 ед. при норме до 450 ед.). Обращало внимание снижение гемоглобина крови у большинства больных (70%), а также у четверти было снижено содержание сывороточного железа (< 8 мкг/л). Практически у всех больных отмечалось повышение активности щелочной фосфатазы на 15-30%,и у половины детей была повышена концентрация кальция в сыворотке крови на 10-15% (Таблица 3).
Представленные результаты свидетельствуют о наличии риска нарушения окислительно-восстановительных процессов в данной группе, что подтверждается повышением конечного содержания продукта перекисных процессов (МДА) у ряда детей. Более выраженные изменения были выявлены при исследовании показателей в суточной моче.
Таблица 3.
Результаты обследования энергообмена у детей с нарушениями темпов
психического развития.
| Показатель | Значение | Норма |
| Кальций мочи (ед.) | 2 ± 0,29 | 0 |
| Фосфаты мочи (ед.) | 2,33 ± 0,24 | 0 |
| Хлориды мочи (ед.) | 1,44 ± 0,41 | 0 |
| Гликозамингликаны (ед.) | 388,89 ± 82,44 | 0 |
| Липиды мочи (ед.) | 363,33 ± 88,68 | 0 |
| Н2О2 (ед.) | 3,11 ± 0,45 | отриц. |
| Фосфолипаза А (моль/л сек.) | 4,22 ± 2,15 | 0 |
| Средние молекулы (ед.) | 2,33 ± 0,17 | 0 |
| Антиоксидантная активность (%) | 33,3 ± 3,72 | > 50 |
| Фибринолитическая способность мочи (у.ед.) | 0,589 ± 0,11 | 1 |
| рН мочи | 5,89 ± 0,26 | - |
| Удельная плотность мочи (мг/мл) | 1015,22 ± 2,15 | - |
| Оксид азота (ед.) | 0,33± 0,24 | 0 |
| Коэнзим Q (мг/л) | 0,61 ± 0,11 | 0,4 – 1,6 |
| Глутатион (восстановленный) (мкмоль/мл) | 519,6 ± 36,9 | 400 - 570 |
| Малоновый диальдегид (нмоль/мл) | 1,38 ± 0,23 | 0,45 – 1,7 |
| 8-ОН-дезоксигуанозин (нг/мл) | 0,26 ± 0,03 | 0,1 – 0,3 |
| Витамин Е (мкг/мл) | 4,27 ± 0,56 | 3,0 – 9,0 |
| Витамин С (мкг/мл) | 7,32 ± 1,56 | 4,0 – 20,0 |
| Бета-каротин (мкг/мл) | 0,16 ± 0,02 | 0.1 – 0,32 |
У всех детей отмечено значительное снижение антиоксидантной способности мочи (в 2-5 раз в сравнении с нормой), у 70% детей в моче отмечено значительное количество острофазного белка фибриногена, не выявляемого в норме (реакция с тромбином), а также у всех детей была повышена экскреция средних молекул, что свидетельствует о наличии эндогенной интоксикации у детей данной группы.
Кроме того, с помощью электрофореза микропротеинов мочи в агаровом геле («Serba») было показано наличие аномальных глобулинов у всех обследованных в количестве от 30 до 60%, при норме преимущественного выделения фракции альбумина. С помощью скрининг - тестов у всех детей выявлено значительное повышение экскреции кальция, фосфатов, перекисей, липидов, гликозамингликанов, что свидетельствует о повышении перекисных процессов в организме, нарушении фосфорно-кальциевого гомеостаза, в том числе в митохондриях со снижением биоэнергетических процессов.
Выявленные изменения нельзя было объяснить патологией органов мочевыводящей системы, так как изменения в мочевом осадке были выявлены лишь у 1 девочки 3х лет в виде микрогематурии. В остальных случаях не обнаружено изменений в осадке мочи, отмечены нормальные величины удельной плотности и рН мочи, не выявлено глюкозурии и протеинурии.
Таким образом, анализ показателей обменных процессов у детей с задержкой психоречевого развития позволил выявить признаки гипоксического синдрома, повышения перекисных процессов и активности анаэробного гликолиза, дисфункции фосфатно-кальциевого обмена и биоэнергетики, а также признаки эндогенной интоксикации (средние молекулы, ураты) и активации острофазных процессов (фибриноген).
Проведенное цитохимическое исследование крови выявило, как представлено на рисунке 7, признаки митохондриальной дисфункции и тканевой гипоксии у детей данной группы в виде повышения активности СДГ, статистически достоверном повышении уровней активности ГФДГ (р<0,05), а также ГДГ, ЛДГ, относительно контрольной группы.
При проведении психологического тестирования у детей с нарушениями темпов психического развития отмечались более низкие, относительно среднестатистических для данного возраста, показатели вербальной, зрительной, отсроченной памяти, способности к переключению внимания, которые коррелировали с показателями цитохимической активности митохондриальных ферментов.
Рисунок 7.
Показатели уровней активности ферментов энергообмена
у детей с задержкой темпов психического развития (n=31).
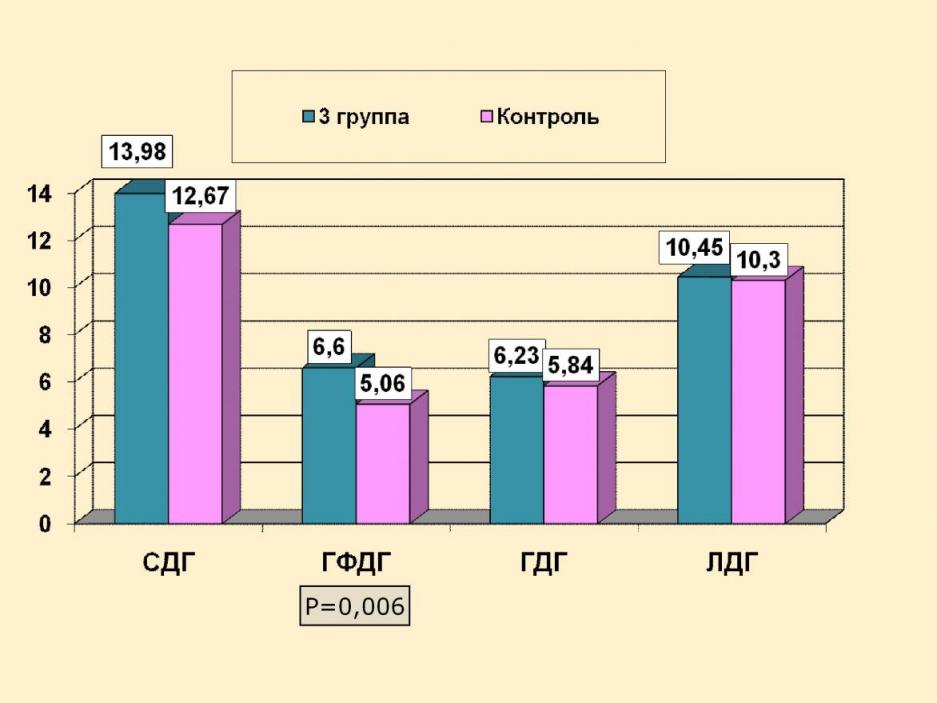
Полученные результаты свидетельствуют о патогенетической роли митохондриальной дисфункции в развитии нарушений темпов психического развития у детей.
3.2. Эффективность энерготропной терапии у детей с нарушениями темпов психического развития. Анализ результатов психологического тестирования детей с нарушениями темпов психического развития после курса метаболической терапии установил общую тенденцию улучшения показателей памяти и внимания, однако, менее выраженную, чем в двух предыдущих группах (с нарушениями развития речи и дефицитом внимания и/или гиперактивностью). Отмечалось улучшение кратковременной памяти в сравнении с исходным обследованием (Рисунок 8.1).
В дальнейшем «кривые запоминания» до и после энерготропной терапии практически сблизились, что свидетельствует о незначительном влиянии проведенной терапии на показатели кратковременной вербальной памяти (рисунок 8.2).
Рисунок 8.
Изменение показателей психологического тестирования у детей с нарушениями темпов психического развития до и после энерготропной терапии (n=31).
 |  |
При анализе средних цитохимических показателей по всей группе детей с нарушениями темпов психического развития после применения энерготропной терапии активность митохондриальных ферментов достоверно не изменилась (Рисунок 9.).
 |  |
| Рисунок 9. Изменение уровней активности ферментов энергообмена у детей с задержкой темпов психического развития до и после энерготропной терапии (n=31). | Таблица 4. Корреляция разниц цитохимических параметров с разницами результатов психологических тестов до и после лечения детей с задержкой развития (n=31). |
В то же время в подгруппе детей с исходно сниженной активностью СДГ (< 15 усл.ед.) достоверно повысилась активность ГДГ (5,9 ± 0,28 – до и 6,8 ±0,49 – после лечения, р<0,05), а у детей с исходно повышенной активностью СДГ (> 15 усл.ед.) активность ГДГ достоверно уменьшилась (6,5 ± 0,54 – до и 5,5 ± 0,2 – после лечения, р<0,05). При этом корреляция показателей психологического тестирования с изменениями сукцинатдегидрогеназы и -глицерофосфатдегидрогеназы усиливается по сравнению с предыдущими группами (с нарушениями речи и синдромом дефицита внимания/гиперактивностью) (таблица 4) и меняет свой знак на обратный, что может быть связано с относительно более декомпенсированными процессами энергообмена, при которых повышенные значения активности сукцинатдегидрогеназы меняются на пониженные при противоположной динамике активности -глицерофосфатдегидрогеназы.
Таким образом, у детей с нарушениями темпов психического развития диагностически актуально цитохимическое выявление активности ГДГ, СДГ и ГФДГ.
4. Особенности тканевого энергообмена у детей с различными проявлениями аутизма.
Группу детей с ранним детским аутизмом составило 32 ребенка, имевших клинические признаки специфического нарушения развития, проявляющиеся сложностью коммуникативных функций с окружающим миром, стереотипичностью поведения, задержкой и нарушениями речевого развития.
4.1. Нарушения энергообмена у детей с аутизмом. Проведенное биохимическое исследование крови выявило признаки митохондриальной дисфункции и тканевой гипоксии у детей с различными проявлениями аутизма, в виде снижения активности ГФДГ у 56% обследованных, ГДГ у 60% детей, повышения активности ЛДГ у 67%. В то же время уровень активности СДГ у 30% обследованных был ниже, а у половины превышал нормативные показатели. Полученные изменения позволяют предположить патогенетическую роль нарушений энергообмена в развитии проявлений аутизма у детей.
4.2. Эффективность энерготропной терапии у детей с аутизмом. При анализе клинических и цитохимических показателей у детей с различными появлениями аутизма после применения курса комплексной энерготропной терапии клинически отмечается улучшение поведения в виде уменьшения выраженности стереотипных движений, улучшения познавательных функций, увеличения объема активной речи. Особенно эффективна энерготропная терапия была у детей со сниженными показателями активности СДГ.
При анализе цитохимических показателей у детей с аутизмом после применения энерготропной терапии отмечалась нормализация активности ферментов СДГ и ЛДГ, и повышение ГФДГ и ГДГ (Рисунок 10).
Таким образом, у детей с аутизмом отмечаются гетерогенные признаки нарушений клеточного энергообмена. У большинства пациентов (с повышением активности сукцинатдегидрогеназы) они свидетельствуют о неспецифическом «напряжении» митохондриальных функций, что наиболее вероятно объясняется компенсаторными механизмами. Закономерно, что эффективность энерготропной терапии у таких детей не очень высока.
Рисунок 10.
Изменение уровней активности ферментов энергообмена у детей с ранним детским аутизмом до и после энерготропной терапии (n=31).

В то же время примерно у трети больных с аутизмом характер лабораторных показателей (снижение активности СДГ, выраженное снижение активностей ГФДГ и ГДГ, повышение концентрации продуктов ПОЛ, изменение коэффициента «лактат/пируват») свидетельствует о наличии более серьезной полисистемной митохондриальной дисфункции, возможно играющей значительную патогенетическую роль в развитии нарушений высшей нервной деятельности.
5. Расстройства психологического развития и поведения у детей с митохондриальными заболеваниями.
Группу детей с митохондриальными энцефаломиопатиями составили 21 ребенок, со следующими диагнозами: митохондриальная энцефаломиопатия (n=12), синдромом MERRF (n=1), синдромом Кернса-Сейра (n=4) и синдромом MELAS (n=4), проходившие стационарное обследование в подразделениях института. Анализ клинических проявлений нарушений тканевого обмена выявил высокую частоту поражения нервной и нервно-мышечной системы у обследованных детей. У всех отмечались низкая переносимость физической нагрузки, мышечная слабость, быстрая утомляемость.
Большинство детей имели выраженную неврологическую симптоматику, и только у 14% выявлены минимальные отклонения при неврологическом обследовании. Координаторные расстройства определялись у большинства больных и проявлялись в виде моторной неловкости, атактической походки, затруднений при выполнении координаторных проб. При электроэнцефалографическом исследовании у 2х пациентов отмечено «замедление» основной активности головного мозга, у остальных отмечены изменения дисфункционального характера. При нейрорадиологическом обследовании только у 4х детей были выявлены структурные изменения: у 2х детей - последствия инсультоподобных эпизодов, у 2х - проявления лейкомаляции.
Значительный интеллектуальный дефицит (IQ < 70) был установлен у 35% детей. Расстройства психологического развития и поведения были выявлены у всех детей. Нарушения речевого развития имели 95%, из них 37% умеренного характера. Нарушения психического развития установлены у 68,4% пациентов, из них у 38,5% умеренного, а у 15% - выраженного характера. При проведении психологического тестирования у детей отмечались выраженные нарушения кратковременной и отсроченной памяти, сложности с концентрацией и переключением внимания, значительные нарушения зрительной памяти. Гетерогенность нарушений психологического развития и поведения при этом очевидно была связана с нозологической гетерогенностью детей с «первичными» митохондриальными заболеваниями.
Таким образом, выраженные нарушения психологического развития и поведения фактически всегда сопровождают клиническую картину митохондриальных заболеваний. В тоже время следует отметить, что, как правило, при данных болезнях неврологические расстройства привлекают основное внимание и выходят на первый план при клинической оценке нарушений.
Исходный уровень молочной кислоты в крови был повышен у 80,9% детей и составил 2,26 ± 0,2 (при норме 1,0-1,7 ммоль/л), через 1 час - 2,8 ± 0,22 и через 3 часа - 2,65 ± 0,23. После нагрузки глюкозой уровень молочной кислоты был выше нормы у всех обследованных. Исходный уровень пирувата был повышен у 85,7% пациентов - 0,14 ± 0,02 (при норме 0,05 - 0,09 ммоль/л), а после нагрузки у 90,5% детей через 1 час 0,18 ± 0,02, и через 3 часа 0,13 ± 0,02.
В группе детей с «первичными» митохондриальными заболевании выявлено достоверно повышенное содержание гидроперекисей (2,37 ± 0,2 отн.ед./мл пл.) (контроль 1,02 ± 0,23) и малонового диальдегида (3,89±0,25 нмоль./мл пл.) (контроль 1,9 ± 0,22); была снижена антиокислительная активность плазмы крови, она составила 27,61 ± 1,66 %, (контроль 38,27 ± 0,8).
При цитохимическом исследовании сниженный уровень фермента сукцинатдегидрогеназы был выявлен у 68% детей. Среднее значение активности СДГ у детей данной группы (17,59 ± 1,04 у.е.) было ниже такого в контрольной группе (контроль 20,6 ± 0,83 у.е). Однако средний показатель не отражал реального изменения активности ферментов, так как у 25% детей данной группы отмечалось значительное повышение показателей до 23 и выше, а у 75% резкое снижение данной активности (от 10 до 13 у.е.) У детей с «первичными» митохондриальными заболеваниями активность ферментов ГФДГ, ГДГ и ЛДГ в среднем была достоверно снижена по сравнению с контрольными значениями. Снижение уровня альфа-глицерофосфатдегидрогеназы (7,45 ± 0,71) (контроль 12,5 ± 0,56 у.е.), выявлено у 84% пациентов, глутаматдегидрогеназы (8,54 ± 0,72) (контроль 12,2 ± 0,83 у.е.), у 68%; лактатдегидрогеназы у 37% (12,54 ± 0,8) (контроль 13,5 ± 1,14 у.е.). В тоже время отмечалась существенная гетерогенность индивидуальных изменений активности этих ферментов, что свидетельствует о значительной вариабельности митохондриальных изменений, которые не могут быть объективно охарактеризованы средними показателями.
Особенностью диагностического поиска в данной группе больных было проведение диагностической биопсии мышечной ткани (передняя группа мышц бедра) для подтверждения наличия митохондриальных нарушений. Морфологическое исследование, проведенное методами световой гистоферментохимии, показало наличие диагностически значимого критерия системных митохондриальных заболеваний – феномена RRF (ragged red fibres, «рваные» красные волокна) у 19 из 21 пациентов (таблица 5). Относительное количество и степень выраженности RRF существенно варьировали у различных больных. У 6 больных отмечалось относительное снижение цитохромоксидазы, что свидетельствует о высокой вероятности мутации митохондриальной ДНК. Электронно-микроскопический анализ мышечной ткани показал существенные ультраструктурные признаки повреждений митохондрий у всех больных данной группы. Отмечались разнообразные дефекты: изменения количества митохондрий, их размеров, вакуолизация матрикса, дефекты крист, образование мультиламеллярных телец, появление кристалловидных включений. При этом, как правило, в зонах скопления митохондрий определялись повышенные количества включений липидов и гликогена.
Таблица 5.
Результаты морфологического исследования биоптата мышечной ткани у больных с митохондриальными болезнями (n=21).
| Морфологические изменения | Пациенты | Норма |
| Количество больных с феноменом RRF | 19 | - |
| RRF,% | 33,42 ± 8,56 | < 5 |
| Выраженность RRF, баллы | 1,8 ± 0,18 | < 1, 0 |
| Митохондриальный индекс, баллы | 2,17 ± 0,34 | < 1,0 |
Корреляционный анализ подтвердил достоверность взаимосвязи исследованных цитохимических показателей лимфоцитов с биохимическими параметрами тканевого энергообмена и морфологическими показателями митохондриальных изменений мышечной ткани. При проведении данного анализа цитохимических показателей и выраженностью параметров нарушений психологического развития и поведения была выявлена наиболее выраженная связь с уровнем активности глутаматдегидрогеназы.
5.1 Влияние энерготропной терапии на выраженность нарушений психологического развития и поведения у детей с митохондриальными заболеваниями. Детям с «первичными» митохондриальными заболеваниями было проведено комплексное энерготропное лечение, включавшее препараты янтарной кислоты, цитохром С, коэнзим Q10, L-карнитин, витамины и антиоксиданты, направленное на повышение эффективности биологических процессов тканевого дыхания и окислительного фосфорилирования, высвобождения энергии органических соединений и продукции АТФ в организме. Предпочтение отдавалось комплексной терапии, т.к. известно, что сочетанное назначение препаратов, влияющих на разные уровни энергетического метаболизма, оказывает синергическое действие. Выбранное сочетание препаратов обеспечивало оптимальное воздействие на различные звенья митохондриального обмена.
Результаты оценки эффективности лечения позволили установить, что у 60% детей на фоне лечения отмечалась положительная динамика в виде улучшения психических функций (в сфере общения, структуры речевой деятельности, памяти, внимания, умственной работоспособности.). В тоже время у 24% улучшения были минимальны.
При анализе биохимических показателей у детей после курса метаболической терапии отмечалась тенденция к нормализации биохимических показателей: снижение уровня лактата (среднее значение 2,04 ± 0,11 ммоль/л, при исходном 2,26 ± 0,2 ммоль/л норма 1,0-1,7 ммоль/л). Отмечалось улучшение цитохимических параметров активности сукцинатдегидрогеназы (19,34 ± 0,26, при исходном 17,59 ± 1,04, норма 20,6 ± 0,83), улучшились показатели активности глицерофосфатдегидрогеназы, глутаматдегидрогеназы и лактатдегидрогеназы.
Таким образом, комплексная энерготропная терапия оказывала позитивное воздействие на проявления нарушений психологического развития и поведения. Выраженность позитивного эффекта варьировала от минимальной до значительной.
6. Нарушения тканевого энергообмена у детей с нарушениями психологического развития и поведения, обусловленных наследственными синдромами с поражениями нервной системы, не связанными этиологически с первичным поражением митохондрий.
Группу детей страдающих нарушениями психологического развития и поведения с наследственными заболеваниями нервной системы составили 98 детей, из них 52 наблюдались с туберозным склерозом; 46 пациентов с различными эпилептическими синдромами, дисгенезиями коры, невропатиями, синдромом альтернирующей гемиплегии и другими наследственными синдромами.
- Психическое развитие и особенности энергообмена у детей с туберозным склерозом. Туберозный склероз — генетически детерминированное заболевание, относится к группе нейроэктодермальных нарушений, характеризуется поражением нервной системы, кожи и наличием доброкачественных опухолей (гамартом) в различных органах. Более чем половина детей, страдающих туберозным склерозом, имеют средние (нормальные) интеллектуальные показатели, но практически у всех отмечаются нарушения когнитивных функций, проявляющиеся проблемами обучения в школе. Большинство из проблем обучения связаны со специфической задержкой формирования речевых навыков (сложности высказывания мыслей, «косноязычее» и др.) недостаточным развитием логических способностей; снижением способностей к концентрации и переключению внимания
При психологическом тестировании у всех детей с туберозным склерозом были выявлены более низкие, относительно среднестатистических для данного возраста, показатели активности внимания, вербальной и зрительной памяти; снижение двигательной и психической активности, общего фона настроения, вербально-мнестические нарушения. В группе детей дошкольного возраста коэффициент концентрации внимания, коэффициент устойчивости внимания, были статистически достоверно ниже, чем в контрольной группе. В группе детей школьного возраста показатели концентрации, скорости переключаемости внимания также были статистически достоверно ниже, чем у здоровых. Степень дефицита интеллектуальных показателей относительно среднестатистических нормативных данных в зависимости от возраста пациента имели тенденцию к уменьшению, но данная тенденция не была статистически значимой (р=0,07). У пациентов страдающих туберозным склерозом, как дошкольного, так и школьного возраста было установлено статистически достоверное снижение показателей (объем непосредственного воспроизведения слов, опосредованного запоминания, долговременной и зрительной памяти), в сравнении с группой здоровых детей данного возраста.
В результате исследования тканевого энергообмена у детей, с туберозным склерозом было установлено, что показатели уровня молочной кислоты и соотношения молочной и пировиноградной кислот имели значения несколько выше в группе с грубой задержкой психического развития, чем в группе с нормальным уровнем психического развития и легкой степенью задержки психического развития. У 12 из 15 детей, которым в диагностических целях была проведена биопсия мышечной ткани, был выявлен феномен RRF.
При исследовании перекисного окисления липидов, показатели уровня малонового диальдегида и гидроперекисей имели значения несколько выше у детей с туберозным склерозом в группе с грубой задержкой психического развития, чем в группе с нормальным уровнем психического развития и легкой степенью задержки психического развития. В тоже время показатели цитохимических параметров митохондриальных ферментов имели более низкие значения в группе детей с нормальным уровнем психического развития и легкой степенью задержки психического развития, чем в группе детей с туберозным склерозом с грубой задержкой психического развития, но различия показателей оказались статистически недостоверными. Электронномикроскопический анализ митохондрий в лимфоцитах периферической крови выявил признаки ультраструктурных дефектов этих органелл.
6.2. Эффективность энерготропной терапии у детей с туберозным склерозом. На основании данных клинических проявлений, обменных и морфологических нарушений, обнаруженных у детей с туберозным склерозом, предполагающих дизэнергетическую основу нарушений, детям с туберозным склерозом назначался курс энерготропной терапии. Принципы лечебной тактики включали назначение препаратов, способных активизировать как перенос электронов в дыхательной цепи (коэнзим Q10) в дозе 30-60 мг/кг, раствором ацетиламиноянтарной кислоты (когитум) в дозе 10 мг/кг, так и активацию обмена жирных кислот (карнитин) в дозе 20-30 мг/кг. Выбранное сочетание препаратов обеспечивало оптимальное воздействие на различные звенья митохондриального обмена. Общий курс лечения составил два месяца.
Для оценки клинической эффективности было проведено сравнение показателей когнитивных функций, включающего тестирование показателей памяти, внимания и др. до и после лечения.
В процессе динамического наблюдения за детьми школьного возраста, страдающими туберозным склерозом, после курса энерготропной терапии (таблица 6) отмечалось статистически достоверное (р<0,05), относительно исходных показателей, улучшение коэффициентов концентрации внимания, устойчивости внимания; объема и скорости переключаемости внимания.
У детей-дошкольников также была отмечена положительная тенденция заключавшаяся в улучшении показателей параметров внимания.
При динамическом изучении параметров памяти у детей с туберозным склерозом группы было установлено достоверное увеличение объема (р<0,05) непосредственного воспроизведения слов, опосредованного запоминания, долговременной и зрительной памяти в группе детей с туберозным склерозом после лечения (таблица 7).
Таблица 6.
Изменение показателей внимания у детей с туберозным склерозом
до и после энерготропной терапии в усл.ед. (n=52).
| Показатель | Исходный показатель | Показатель после терапии |
| Коэффициент концентрации внимания | 135,6 ± 6,9 | 162,4 ± 8,68 |
| Коэффициент устойчивости внимания | 186,4 ± 15,45 | 233,3 ± 15,74 |
| Уровень объема внимания | 37 ± 5,74 | 40,2 ± 4,16 |
| Скорость переключаемости внимания | 4,65 ± 0,30 | 6,3 ± 0,42 |
Таблица 7.
Изменение показателей памяти у детей с туберозным склерозом
до и после энерготропной терапии в усл.ед. (n=52).
| Показатель | Исходный показатель | Показатель после терапии |
| Объем непосредственного воспроизведения слов | 3,65 ± 0,16 | 4,4±0,19 |
| Опосредованное запоминание | 15,9 ± 0,7 | 18,71±0,4 |
| Долговременная память, отсроченное воспроизведение | 7,45 ± 0,32 | 9,3±0,24 |
| Зрительная память | 4,25 ± 0,1 | 4,8±0,1 |
У детей-дошкольников, страдающих туберозным склерозом, также отмечена положительная тенденция в улучшении показателей памяти.
При оценке эмоционально-волевой сферы отмечалось достоверное повышение уровня эмоциональной устойчивости в группах детей с туберозным склерозом до и после лечения. Кроме того, родителями отмечено преобладание позитивных эмоций, адекватных реакций, а также повышение толерантности к психическим нагрузкам, как в школе, так и дома. После проведения курса терапии в качестве основной тенденции отмечалось повышение двигательной и общей психической активности.
Отдельную группу среди больных туберозным склерозом составляли дети с глубокой степенью умственной отсталости и аутизмом (n=12), которые не понимали заданий и вербальных инструкций. Поэтому подробное психологическое тестирование памяти, внимания у таких детей было невозможным. При первичном осмотре психолога и со слов родителей отмечено расторможенное, инертное, аутичное поведение, большое количество стереотипий, иногда агрессия, резкие перепады настроения. После проведения курса энерготропной терапии при повторной консультации психолога, со слов родителей и воспитателей отмечалась тенденция к стабилизации эмоционального фона, (перепады настроения становились несколько реже), снижению проявлений агрессии и аутоагрессии. В поведении отмечалось улучшение устойчивости внимания – дети дольше задерживали взгляд на предметах, совершали манипулятивные действия с предметами, хотя количественно оценить эти сдвиги не представлялось возможным.
Вместе с динамическим изучением показателей когнитивных функций, до и после курса терапии проводилось исследование биохимических и цитохимических показателей крови. После курса терапии, у детей страдающих туберозным склерозом, было уставлено снижение уровня молочной и пировиноградной кислот и соотношения лактат/пируват; нормализация антиокислительной активности плазмы крови и показателей перекисного окисления липидов (уровня гидроперекисей и малонового диальдегида); нормализация активности ферментов энергообмена в лимфоцитах периферической крови (сукцинатдегидрогеназы, -глицерофосфатдегидрогеназы, глутаматдегидрогеназы, лактатдегидрогеназы).
Таким образом, после проведения курса энерготропной терапии у детей страдающих туберозным склерозом отмечалось улучшение параметров памяти, внимания; повышение уровня эмоциональной устойчивости, нормализация биохимических и цитохимических показателей. У всех детей, проходивших лечение, отмечалось повышение двигательной и общей психической активности. Полученные результаты могут свидетельствовать о патогенетической роли энергодефицитных нарушений в формировании нарушений умственного развития и поведения у детей, страдающих туберозным склерозом, а также демонстрируют необходимость включения энерготропных препаратов в комплексное лечение данного заболевания.
6.3. Особенности энергообмена у детей с нарушениями психологического развития и поведения, обусловленными другими наследственными синдромами с поражениями нервной системы. Группу из 46 детей с другими наследственными синдромами с поражениями нервной системы включала пациентов с различными эпилептическими синдромами, дисгенезиями коры больших полушарий, невропатиями и др. Из них у 15 отмечалась выраженная интеллектуальная недостаточность, у 19 - умеренная задержка психоречевого развития, а у 12 пациентов - легкие нарушения. У всех пациентов были выявлены отклонения в неврологическом статусе. При электроэнцефалографическом исследовании у 70% детей с «грубой» задержкой психоречевого развития отмечено «замедление» основной активности головного мозга. У детей с умеренным интеллектуальным дефицитом или легкими отклонениями превалировали изменения дисфункционального характера, а «замедление» основной активности головного мозга установлено у трети пациентов. В результате исследования тканевого энергообмена у детей данной группы было установлено, что показатели уровня молочной кислоты, пировиноградной кислоты исходно и после нагрузки имели значения выше нормативных показателей как в группе с грубой задержкой психического развития, так и в группе с легкой степенью задержки психического развития, а изменения активности цитохимических ферментов носили разнонаправленный характер в зависимости от степени нарушений психологического развития и поведения.
У детей этой группы с выраженными нарушениями психологического развития и поведения исходный уровень молочной кислоты был повышен у половины и составил 1,87 ± 0,13 (при норме 1,0-1,7 (ммоль/л), через 1 час - 2,33 ± 0,16 и через 3 часа - 2,03 ± 0,09. После нагрузки глюкозой уровень молочной кислоты был выше нормы у всех обследованных. Исходный уровень пировиноградной кислоты был повышен у 71,4% пациентов 0,15 ± 0,012 (при норме 0,05-0,09 (ммоль/л), а после нагрузки у 78% детей через 1 час 0,19 ± 0,04, и через 3 часа 0,12 ± 0,02. При цитохимическом исследовании активность СДГ была ниже таковой в контрольной группе (17,73 ± 1,13 у.е.; контроль 20,6 ± 0,83 у.е). Однако данный показатель не отражал реального изменения активности ферментов, так как у 25% детей данной группы отмечалось повышение показателей выше 20 у.е., а у 20% определялось снижение активности фермента (от 13 до 14 у.е.). Активность ГФДГ (8,28 ± 0,54; контроль 12,5±0,56 у.е.), ГДГ (9,43 ± 0,82; контроль 12 ± 0,83 у.е.), в данной группе при оценке в среднем была достоверно снижена (р<0,05) в сравнении с контрольными значениями. Средние показатели активности лактатдегидрогеназы у детей с выраженными нарушениями психологического развития и поведения не отличались от контроля и составили 13,15 ± 1,43 у.е. (контроль 13,5 ± 1,14 у.е.).
У детей этой группы с умеренными нарушениями психологического развития и поведения исходный уровень молочной кислоты также был повышен у половины и составил 1,92 ± 0,22 (при норме 1,0 - 1,7 (ммоль/л), через 1 час - 2,94 ± 0,66 и через 3 часа - 2,49 ± 0,42. После нагрузки глюкозой уровень молочной кислоты был выше нормы у всех обследованных. Уровень пировиноградной кислоты был повышен у 80% пациентов как исходно (0,19 ± 0,03 ммоль/л; при норме 0,05 - 0,09), так и после нагрузки через 1 час (0,18 ± 0,04), и через 3 часа (0,18 ± 0,04). При цитохимическом исследовании у половины детей данной группы отмечалось снижение показателей активности СДГ (14,36 ± 1,02 у.е.; контроль: 20,6 ± 0,83 у.е.). Активность ГФДГ (6,33 ± 0,79 у.е.; контроль 12,5 ± 0,56 у.е.) и ГДГ (6,42 ± 0,89 у.е.; контроль 12,1 ± 0,83 у.е.), в данной группе при оценке в среднем была достоверно снижена. Средний показатель активности ЛДГ у детей с умеренными нарушениями психологического развития и поведения, страдающих наследственными «немитохондриальными» заболеваниями нервной системы, не отличался от контроля и составил 13,92 ± 1,53 у.е. (контроль 13,5 ± 1,14 у.е.).
У детей этой группы с легкими нарушениями психологического развития и поведения исходный уровень молочной кислоты был повышен у 70% пациентов и составил 2,18 ± 0,17 ммоль/л (при норме 1,0 - 1,7 (ммоль/л)). После нагрузки глюкозой уровень молочной кислоты был выше нормы у 90% обследованных через 1 час - 2,48 ± 0,19 и через 3 часа - 2,11 ± 0,27. Уровень пирувата был повышен у 70% пациентов как исходно (0,16 ± 0,03 ммоль/л при норме 0,05-0,09), так и после нагрузки через 1 час (0,17 ± 0,03), и через 3 часа (0,12 ± 0,02). При цитохимическом исследовании среднее значение активности СДГ у детей данной группы не отличалось от контрольной группы (20,87±1,72 у.е.; контроль 20,6 ± 0,83 у.е), а у 57% детей данной группы отмечалось повышение показателей активности фермента. Активность ГФДГ в данной группе в среднем была достоверно ниже контрольных значений (8,36 ± 0,79 у.е.; контроль 12,5 ± 0,56 у.е.). Средние показатели активности ГДГ не отличались от контрольной группы (11,44 ± 0,89 у.е.; контроль 12 ± 0,83 у.е.). В тоже время уровень активности ЛДГ (16,23 ± 2,29 у.е.) у детей с легкими нарушениями психологического развития и поведения был выше, чем в контрольной группе (контроль 13,5 ± 1,14 у.е.).
Полученные результаты, свидетельствуют о том, что полисистемная митохондриальная дисфункция, вне зависимости от ее этиопатогенетических особенностей, может играть значительную роль в развитии многих форм наследственных нарушений нервной деятельности, а также об обоснованности включения в схемы терапии соответствующих заболеваний энерготропных препаратов.
ЗАКЛЮЧЕНИЕ.
Таким образом, на основании анализа вышеприведенных результатов, можно считать, что нарушения тканевого энергообмена вносят дифференцированный вклад в развитие нарушений психологического развития и поведения у детей.
Проведенные и сследования цитохимической активности ферментов и других лабораторных показателей энергообмена до и после лечения показывают, что клиническая эффективность энерготропного лечения, достоверно коррелирует со степенью нормализации отдельных цитохимических показателей. Полученные результаты свидетельствуют, что энергодефицит, по-видимому, является одной из причин развития дисфункций высшей нервной деятельности, или, как минимум, способствует их проявлению. Важно отметить что паттерн, как цитохимических нарушений, так и изменений цитохимических показателей на фоне лечения различен при разных вариантах нарушений функционирования центральной нервной системы, что, по нашему мнению, свидетельствует о специфичности патогенетического участия митохондриальных дисфункций при расстройствах психологического развития и поведения.
Выявленные полисистемные характеристики митохондриальных функций свидетельствуют об относительной интенсификации клеточного энергообмена у многих детей с различными формами нарушений психологического развития. Корреляция такой интенсификации с нормализацией параметров психологического тестирования свидетельствует о значении дизэнергетических процессов в нарушении психологического развития (или, как минимум, о значении стимуляции митохондриальных функций в усилении компенсаторных процессов в центральной нервной системе).
Результаты лабораторных исследований при этом подкрепляют мнение об обоснованности применения энерготропной терапии при нарушениях психологического развития. Важно отметить, что характер корреляционных взаимосвязей между изменениями энергообмена и оптимизацией параметров психологического тестирования у детей указывает на различные патогенетические механизмы при исследованных клинических вариантах нарушений психологического развития и поведения.
Полученные результаты позволяют рассчитать прогностическую ценность анализа цитохимических параметров для определения эффективности энерготропной терапии у детей с расстройствами развития и поведения. Результаты позволяют судить о возможной клинической эффективности применения энерготропного препарата при различных вариантах изменения активности ферментов энергообмена и, таким образом, выбирать подходы дифференцированного лечения.
ВЫВОДЫ.
- Расстройства психологического развития и поведения у детей характеризуются изменениями кратковременной и отсроченной вербальной и зрительной памяти, концентрации и переключении внимания, сопровождаются митохондриальными нарушениями, проявляющимися в виде изменений биохимических и цитохимических показателей (изменение концентраций коэнзима Q10, восстановленного глутатиона, малонового диальдегида, 8-ОН-дезоксигуанозина, витаминов Е и С, бета-каротина, гидроперекисей, молочной и пировиноградной кислот, а также антиокислительной активности крови и активностей сукцинатдегидрогеназы, альфа-глицерофосфатдегидрогеназы, глутаматдегидрогеназы и лактатдегидрогеназы). Характер и степень выраженности которых зависят от нозологической формы расстройства психологического развития и поведения.
- У детей с различными формами расстройств формирования устной речи (дислалии, дизартрии и др.) нарушения энергообмена выражаются в полисистемных дисфункциях клеточной энергетики, и умеренных проявлениях дисбаланса митохондриальных процессов, компенсирующихся за счет повышения активации сукцинатных механизмов (малоспецифичных).
- У 40% детей с дефицитом внимания и/или гиперактивности отмечаются умеренно выраженные нарушения энергообмена, и заключаются в дисфункции митохондриальных процессов, при которых снижение запоминания находится в прямой корреляционной связи с малоспецифичными механизмами активации сукцинатдегидрогеназного комплекса; а расстройство процессов поддержания и переключения внимания коррелирует с нарушениями активности глутаматдегидрогеназы.
- У детей с задержкой психического развития нарушения энергообмена носят более выраженный характер, спектры цитохимических показателей отражают дисфункцию всех ключевых молекулярных путей митохондриального энергообмена характеризуются дисфункцией, включая нарушения активности сукцинатдегидрогеназы и глутаматдегидрогеназы, признаки гипоксического синдрома, повышение перекисных процессов и активности анаэробного гликолиза, дисфункцию фосфатно-кальциевого обмена, а также признаки эндогенной интоксикации и активацию острофазных процессов.
- Нарушения энергообмена у детей с аутизмом характеризуется снижением уровня активности альфа-глицерофосфатдегидрогеназы (у 56%) и глутаматдегидрогеназы (у 60%) на фоне повышения активности лактатдегидрогеназы (у 67%) детей. Активность сукцинатдегидрогеназы отмечается разнонаправленностью: у 50 % больных аутизмом повышается, а у 30% снижается по сравнению с контрольными показателями группы здоровых детей.
- Характер специфических нарушений энергообмена проявляющихся изменением активности цитохимических ферментов (сукцинатдегидрогеназы, альфа-глицерофосфатдегидрогеназы, глутаматдегидрогеназы) и лактатдегидрогеназы зависят от формы расстройства психологического развития и поведения, а степень повышения от тяжести основного заболевания.
- Эффективность энерготропной терапии у детей с различными формами нарушений формирования устной речи (дислалии, дизартрии и др.), проявляется улучшением кратковременной памяти на 56%, способности к переключению внимания на 25%, долгосрочной памяти на 15%, улучшением показателей зрительной памяти на 6%, и нормализацией цитохимических показателей энергетического метаболизма.
- Энерготропная терапия у детей с дефицитом внимания и/или гиперактивностью способствует повышению концентрации внимания и способности к его переключению, улучшению показателей долгосрочной памяти вдвое, улучшению показателей зрительной памяти, с нормализацией всех показателей энергетического метаболизма.
- У детей с задержкой психического развития энерготропная терапия приводит к улучшению показателей кратковременной памяти, зрительной памяти, концентрации внимания, способности к его переключению, а также нормализации цитохимических и биохимических показателей энергетического метаболизма.
- Цитохимические показатели активности митохондриальных ферментов (сукцинатдегидрогеназы, альфа-глицерофосфатдегидрогеназы, глутаматдегидрогеназы) и лактатдегидрогеназы являются критериями наличия нарушений психологического развития и поведения, и позволяют определять целесообразность энерготропной терапии, и оценивать ее терапевтическую эффективность.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ:
- У детей с наследственными заболеваниями, сопровождающимися нарушениями тканевого энергообмена, следует проводить диагностическую оценку особенностей психологического развития и поведения, с исключением признаков нарушений речевого и психического развития, дефицита концентрации внимания, гиперактивности, аутизма.
- Эффективность энерготропной терапии у детей с наследственными заболеваниями, сопровождающимися полисистемным нарушением тканевого энергообмена, должна оцениваться с использованием тестов психологического развития и поведения (показателей памяти, внимания, нарушения речевого развития и др.) в динамике лечения.
- Комплексное определение функциональных, цитохимических и ультраструктурных изменений митохондрий различных тканей, морфологические изменения скелетных мышц, а также биохимические показатели нарушений аэробного и анаэробного окисления эффективно в отношении выявления полисистемных нарушений тканевого энергообмена у детей с расстройствами психологического развития и поведения при различных нозологических формах наследственных заболеваний. Индивидуальная оценка цитохимических показателей активности ферментов клеточного энергообмена (сукцинатдегидрогеназы, альфа-глицерофосфатдегидрогеназы, глутаматдегидрогеназы и лактатдегидрогеназы) в лимфоцитах периферической крови позволяет прогнозировать эффективность проводимого лечения.
- В практику лечения детей с различными формами расстройств психологического развития и поведения необходимо вводить энерготропные препараты (коэнзим Q, карнитин и др.), направленные на повышение эффективности выработки энергии на клеточном уровне, снижающие перекисное окисление липидов и уменьшающие оксидативный стресс. Рекомендуется использование препаратов левокарнитина в дозе в среднем 50-100 мг/сутки, как в качестве монотерапии, так и в комбинации с коэнзимом Q10 в дозе 90 – 120 мг/сутки, раствором ацетиламиноянтарной кислоты 250 мг/сутки, препаратами витаминов группы В (нейромультивит или др.).
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Крапивкин А.И., Лобов М.А., Темина П.А. Болезнь «Моя-Моя» // Вестник практической неврологии. – 1998. - № 4. – С. 6-10.
2. Крапивкин А.И., Темина П.А., Лобов М.А. Синдром альтеринирующей гемиплегии у детей. // Российский вестник перинатологии и педиатрии. – 1999. - № 2. – Т.44. – С.46 - 49.
3. Семенов А.В., Крапивкин А.И., Шилкина О.И. Изменение фагоцитарной
активности нейтрофилов у детей с различными формами эпилепсий. - Материалы II Российского Конгресса «Современные технологии в педиатрии и детской хирургии». - М., 2003. - С.170-171.
4. Крапивкин А.И.,Виноградова Т.В., Темин П.А. Изучение иммунологических особенностей у детей с различными формами эпилепсий. - Материалы II Российского Конгресса «Современные технологии в педиатрии и детской хирургии». - М., 2003. - С.506.
5. Царегородцев А.Д. Крапивкин А.И., Медико-экономическая эффективность современной фармакотерапии у детей // Вестник педиатрической фармакологии и нутрициологии. – 2006. - №3. - Т.3. – С.9-12.
6. Царегородцев А.Д., Кешишян Е.С., Крапивкин А.И. Эффективная программа обучения медицинских работников первичного звена по оказанию помощи детям раннего возраста - интегрированное ведение болезней детского возраста.// Российский вестник перинатологии и педиатрии. – 2006. - № 3. – Т.51. – С. 6- 1.
7. Крапивкин А.И., Крайнева Л.С. Синдром альтернирующей гемиплегии./ в книге Дифференциальный диагноз эпилепсии под ред. Белоусовой Е.Д., Ермакова А.Ю. – М., - 2007. - С. 244-260.
8. Семенов А.В., Крапивкин А.И. Исследование фагоцитарной активности нейтрофилов у больных с эпилепсией. // Клинико-лабораторный консилиум. – 2008. - № 20. - Т.1. - С.21-27.
9. Сухоруков В.С., Клейменова Н.В., Тозлиян Е.В., Белов В.А., Крапивкин А.И., Виноградова Т.В., Ружицкая Е.А., Семенов А.В. Энергодефицитный диатез у детей // М., - 2008. - С.24.
10. Сухоруков В.С., С.О.Ключников С.О., Гнетнева Е.С. Крапивкин А.И., Вторая диспансерная группа здоровья. Варианты адаптационных возможностей // Вестник РГМУ. - 2008. - № 4. - С 13-15.
11. Богданова-Гайдукова Е.В., Елизарова В.М., Крапивкин А.И, Севбитов А.В. Характеристика стоматологических нарушений у детей с эпилепсиями. // Российский вестник перинатологии и педиатрии. – 2008. - № 6. – Т.53. – С.53-56.
12. Крапивкин А.И., Сухоруков В.С. Возможности энерготропной терапии для коррекции нарушений познавательных функций у детей // Практика педиатра. - 2009. - №2. - С.49-52.
13. Крапивкин А.И., Сухоруков В.С., Ключников С.О. Митохондриальные нарушения у детей с расстройствами психологического развития и поведения // Российский вестник перинатологии и педиатрии. - 2009. - № 1. - Т.54. - С.45-52.
14. Крапивкин А.И. Рациональная фитотерапия невротических расстройств у детей // Практика педиатра. – 2009. - №3. – С.33-36.
15. Крапивкин А.И., Сухоруков В.С. Возможности энерготропной терапии для коррекции нарушений познавательных функций у детей // Практика педиатра. – 2009. - №2.- С.49-52.
16. Сухоруков В.С., Юрьева Э.А., Кобринский Б.А., Ружицкая Е.А., Виноградова Т.В., Клейменова Н.В., Погомий Н.Н., Шабельникова Е.И., Тозлиян Е.В., Невструева В.В., Мамедов И.С., Семенов А.В., Крапивкин А.И., Белов В.А. // Алгоритм формирования групп риска по развитию различных заболеваний у детей (усовершенствованная медицинская технология). МНИИ П иДх - 2009.
17. Крапивкин А.И., Сухоруков В.С., Дорофеева М.Ю. Современные терапевтические подходы к коррекции нарушений умственного развития и поведения у детей с туберозным склерозом // Российский вестник перинатологии и педиатрии. - 2011. - № 5. – Т.56. – С.42-45.
18. Крапивкин А.И., Ключников С.О. Нарушения психологического развития. Очерки митохондриальной патологии / под ред. Сухорукова В.С. - М., - 2011. - С.184-195.
19. Сухоруков В.С., Клейменова Н.В., Тозлиян Е.В., Шабельникова Е.И., Белов В.А., Крапивкин А.И. Энергодефицитный диатез // Клинико-лабораторный консилиум. - 2011. - №4. – С. 44-49.
20. Царегородцев А.Д., Кобринский Б.А., Крапивкин А.И. Континиуум переходных состояний здоровья. Функциональные состояния и заболевания у детей. Руководство для врачей / Под ред. А.Д.Царегородцева, В.В.Длина – М., - 2011. – С. 11 – 39.
21. Крапивкин А.И., Дорофеева М.Ю. Нарушения умственного развития и поведения у детей с туберозным склерозом. // Российский вестник перинатологии и педиатрии. – 2011. - № 4. – Т.56. – С.78-84.
22. Брызгалов А.С., Севбитов А.В., Крапивкин А.И. Повышение эффективности стоматологической помощи подросткам находящимся на стационарном лечении с общесоматической патологией. // Российский вестник перинатологии и педиатрии. – 2011. - № 5. – Т.56. – С.88-90.
23. Крапивкин А.И., Дорофеева М.Ю. Нарушения умственного развития и поведения. Туберозный склероз/ под ред. Дорофеевой М.Ю.. - М., - 2012. - С.108-126.
24 Харламов Д.А., Крапивкин А.И., Сухоруков В.С., Куфтина Л.А., Грознова О.С. Неврологические нарушения при митохондриальной энцефалопатии - лактат-ацидозе с инсультоподобными эпизодами (синдроме MELAS) // Российский вестник перинатологии и педиатрии. - 2012. - № 4. – Т. 57. - С. 43-53.
25. Крапивкин А.И., Киреева И.П., Сухоруков В.С., Харламов Д.А. Нарушения тканевого энергообмена у детей с клиническими проявлениями раннего детского аутизма и эффективность энерготропной терапии // Российский вестник перинатологии и педиатрии. – 2012. - № 4. – Т.57. – С.80-84.
ПАТЕНТ
1. Сухоруков В.С., Царегородцев А.Д., Клейменова Н.В., Невструева В.В., Шабельникова Е.И., Харламов Д.А., Влодавец Д.В., Крапивкин А.И., Вишневский Е.Л., Багирова Н.И. «Способ оценки степени тканевой адаптации к функциональной недостаточности органов и систем с помощью определения феномена компенсаторной пролиферации митохондрий в клетках соответствующих тканей». / Патент на изобретение № 2357247. Зарегистрировано в Государственном реестре изобретений РФ 27.05.2009 г.
2. Сухоруков В.С., Белов В.А., Шабельникова Е.И., Влодавец Д.В., Крапивкин А.И., Лисицына С.В. «Применение чрезкожного мониторирования газообмена для диагностики энергодефицитных состояний»./ Патент на изобретение № 2442535. Зарегистрировано в Государственном реестре изобретений РФ 20.02.2012 г.
УСЛОВНЫЕ СОКРАЩЕНИЯ
8-ОНДГ - 8-ОН-дезоксигуанозин
KoQ - коэнзим Q10 ()
АТФ – аденозинтрифосфорная кислота
ГДГ - глутаматдегидрогеназа
ГФДГ – альфа-глицерофосфатдегидрогеназа
ДНК – дезоксирибонуклеиновая кислота
ЛДГ - лактатдегидрогеназа
МДА - малоновый диальдегид
ПОЛ – перекисное окисление липидов
СДГ - сукцинатдегидрогеназа
DSM-IV (the Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition) – рабочая классификация диагностических критериев психических заболеваний.

