Механизмы иммунопатогенеза вич-инфекции и вирусного гепетита с на оригинальных моделях гуманизированных мышей
На правах рукописи
КОВАЛЕВ ГРИГОРИЙ ИГОРЕВИЧ
МЕХАНИЗМЫ ИММУНОПАТОГЕНЕЗА ВИЧ-ИНФЕКЦИИ И ВИРУСНОГО ГЕПЕТИТА С НА ОРИГИНАЛЬНЫХ МОДЕЛЯХ ГУМАНИЗИРОВАННЫХ МЫШЕЙ
14.03.09 – Клиническая иммунология, аллергология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Москва 2013 год
Работа выполнена в ФГБУ «ФНКЦ детской гематологии онкологии и иммунологии имени Дмитрия Рогачёва» Министерства здравоохранения и социального развития Российской Федерации и Онкологическом Центре Лайнебергер Университета Северной Каролины в Чапел Хилл, США.
Научные консультанты:
Академик РАМН, доктор
медицинских наук, профессор Румянцев Александр Григорьевич
Профессор Су Лишан
Официальные оппоненты:
Баранова-Намазова Лейла Сеймуровна член-корреспондент РАМН, доктор медицинских наук, профессор, заместитель директора по научной работе ФГБУ «Научный центр здоровья детей» РАМН
Ганковская Людмила Викторовна доктор медицинских наук, профессор, и.о. заведующего кафедрой иммунологии медико-биологического факультета ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И.Пирогова» Министерства здравоохранения и социального развития Российской Федерации
Тутельян Алексей Викторович доктор медицинских наук, профессор, заведующий лабораторией госпитальных инфекций и эпидемиологического анализа ФГУН «Центральный НИИ эпидемиологии» Роспотребнадзора
Ведущая организация: ФГБУ «ГНЦ Институт иммунологии» ФМБА России
Защита диссертации состоится «04»марта 2013 в 14.00 часов на заседании диссертационного совета Д 208.072.05 на базе ГБОУ ВПО РНИМУ им. Н.И.Пирогова Министерства здравоохранения Российской Федерации по адресу 117997, г. Москва, ул. Островитянова, д.1.
С диссертацией можно ознакомиться в библиотеке ГБОУ ВПО РНИМУ им. Н.И.Пирогова Министерства здравоохранения Российской Федерации.
Автореферат разослан «____»_________ 201 года
Ученый секретарь диссертационного совета,
доцент Т.Е. Кузнецова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность
В последние десятилетия медицинским работникам различных специальностей приходится иметь дело с особым видом инфекционных заболеваний. Данные инфекции, как правило вирусной этиологии, не вызывают в большинстве случаев яркой клинической симптоматики во время и непосредственно после инфицирования, но их возбудители, проникая в клетки и реплицируясь в них, приводят к длительной персистенции инфекции, что проявляется тяжелыми хроническими заболеваниями, приводящими к инвалидизации и смерти значительного числа пациентов (Dustin L.B., 2007; Kallings L.O., 2008). Прежде всего, речь идет о инфекциях, возбудителями которых являются вирус иммунодефицита человека (ВИЧ), вирус гепатита С (ВГС) и вирус гепатита В (ВГВ), вирус Эпштейна-Барр (ВЭБ) и другие герпесвирусы (например, вирус саркомы Капоши). Ряд нозологий, вызываемых указанными вирусами, включает СПИД, хронический гепатит с исходом в цирроз печени и гепатоцеллюлярную карциному, лимфомы, саркомы и т.д. (Хаитов Р.М., 1992; Bruno S., 2008).
Вовлечение иммунной системы играет основную роль в патогенезе указанных заболеваний. Иммунопатогенез данных заболеваний многогранен. Во-первых, для многих вирусов иммунные клетки являются мишенями и местом репликации, что приводит к прямой и опосредованной гибели клеток или их патологическому функционированию (Giorgi J.V., 1987; Siegal F.P., 2001; Oswald-Richter K., 2004; Joshi A., 2004). Во-вторых, указанные вирусы обладают уникальной способностью уклоняться от иммунного ответа путем многочисленных механизмов (Bowen D.G., 2005; Dustin L.B., 2007). В-третьих, инфицирование приводит к неконтролируемой активации иммунной системы, являющейся ключевым фактором в патогенезе тяжелейших иммунологических и онко-гематологических заболеваний (Giorgi J.V., 1993; Dustin L.B., 2007). Расшифровка всех уровней патогенеза позволит развивать иммунопатогенетическую терапию и профилактику данных заболеваний. Серьезным лимитирующим фактором в изучении иммунопатогенеза этих патологических процессов является тот факт, что данные инфекции строго специфичны для человека, в связи с чем использование классических моделей животных крайне ограничено. Например, экспериментальное изучение приматов, несмотря на их важную роль в подобных исследованиях, имеет ряд существенных недостатков (Bukh J., 2004), таких как значительные отличия патогенеза и манифестации данных инфекций от таковых у человека, дороговизна и наличие этических проблем. Использование же малых животных – мышей, как моделей системной инфекции практически невозможно в связи с тем, что указанные вирусы не в состоянии проникать в клетки грызунов, реплицироваться в них и вызвать адекватный инфекционный процесс и иммунный ответ.
Поскольку необходимость адекватных моделей животных для экспериментальной медицины очевидна, в последние три десятилетия ведутся работы над ксенотрансплантацией тканей человека лабораторным животным, в особенности мышам, как наиболее универсального представителя экспериментальных моделей (McCune J.M., 1988; Mosier D.E., 1998, Tary-Lehmann M., 1994). Наибольший прогресс в подобных исследованиях отмечается в последнее десятилетие, в связи с появлением эффективных иммунодефицитных мышей-реципиентов человеческих тканей (Lock R.B., 2002; Traggiai E., 2004; Gimeno R., 2004), что позволило создание гумманизированных мышей (“humanized mice (hu-mice)” (англ.)) – иммунодефицитныx животных, обладающих человеческими клетками, тканями, органами и системами, трансплантированными и развившимися впоследствии. “Гуманизация” мышей, особенно с использованием трансплантации клеток-предшественниц тканей человека позволяет экспериментально исследовать человеческие физиологические и патологические процессы in vivo, что без подобных моделей было бы невозможно (Shultz L.D., 2007).
Цель работы
Определить иммунопатогенетические механизмы развития ВИЧ- инфекции и вирусного гепатита С в разработанных оригинальных моделях гуманизированных мышей с трансплантированными клеточными линиями иммуногемопоэза и гепатопоэза человека.
Задачи исследования
- Разработать адекватную мышиную модель человеческого гемопоэза и системной инфекции, позволяющую изучать механизмы вирусной репликации и иммунного ответа при ВИЧ и других инфекциях.
- Доказать адекватность патогенеза экспериментальной ВИЧ-1 инфекции в данной модели патофизиологическим процессам в организме человека при ВИЧ-1 инфицировании.
- Изучить функциональные свойства Т-регуляторных клеток и их роль в ВИЧ-1 инфекции в данной гуманизированной мышиной модели.
- Определить функциональные свойства плазмоцитоидных дендритных клеток и их роль в иммунопатогенезе ВИЧ-1 инфекции в данной гуманизированной мышиной модели.
- Создать мульти-гуманизированную мышиную модель, позволяющую изучать патогенез гепатотропных инфекций человека, в первую очередь вирусных гепатитов С и В.
- Изучить некоторые аспекты иммунопатогенеза инфекции вирусом гепатита С с использованием созданной модели гепатотропной инфекции.
- Разработать подходы к созданию терапевтических вакцин для гемо-гепатотропных инфекций.
Научная новизна
- Впервые показано, что гуманизированная мышиная ДНО-hu модель может быть использована для изучения ВИЧ-1 инфекции in vivo.
- Впервые ДНО-hu модель была комплексно охарактеризована, с демонстрацией наличия и функциональной достаточности Т-регуляторных и плазмоцитоидных дендритных клеток человека; была изучена роль данных клеточных популяций в патогенезе ВИЧ-1 инфекции.
- Впервые создана и охарактеризована принципиально новая гуманизированная мышиная модель (AFC8-hu HSC/Hep), являющаяся на сегодняшний день первой оригинальной гуманизированной мышиной моделью с человеческой иммунной системой и клетками печени.
- Впервые показана возможность инфицирования AFC8-hu HSC/Hep мышиной модели вирусом гепатита С человека, с развитием персистирующей инфекции, индуцирующей ВГС-специфический иммунный ответ человека, а также поражение печени с лимфоцитарной инфильтрацией и развитием гепатита и фиброза.
- Впервые in vivo было показано, что эктопическая экспрессия молекулы LIGHT (клеточный рецептор, индуцирующийся на активированных Т-клетках и являющийся лигандом к рецептору -лимфотоксина (LTR) и HVEM (herpes virus entry mediator)) приводит к разрешению экспериментальной инфекции в печени за счет иммуномодуляции.
Практическое значение
Основное практическое значение работы заключается в разработке и создании современной in vivo мышиной модели специфичных для человека персистирующих вирусных инфекций.
Проведенная при усовершенствованнии существующей ДНО-hu модели более углубленная характеристика позволяет использовать ее как модель для изучения ВИЧ-инфекции, включая изучение вирусологических аспектов, механизмов иммунопатогенеза всех уровней, а также вопросов профилактики, терапии и вакцинации. В настоящее время модель широко используется для оценки эффективности и поиска новых противо-ВИЧ препаратов, а также для тестирования методов профилактики трансмиссии ВИЧ.
Продемонстрированная экпериментально-индуцированная популяционная деплеция Т регуляторных (Трег) лимфоцитов позволяет использовать данный метод для изучения роли этих клеток при ряде патологических процессов, а также расширить данный подход для изучения роли других лимфоцитарных популяций.
На основе ДНО-hu модели была создана принципиально новая модель (AFC8-hu HSC/Hep), воспроизводящая гемопоэз и гепатопоэз человека, показана возможность использования ее для изучения ВГС инфекции. В настоящее время данная модель используется для изучения ВГВ инфекции, разработки и тестирования препаратов для терапии данных гепатотропных инфекций, их профилактической и терапевтической вакцинации и изучения комбинированных инфекций: ВИЧ/ВГС/ВГВ. Наличие человеческой печеночной ткани в данной модели позволяет исследовать влияние алкоголя на течение инфекций ВГВ, ВГС и ВИЧ и поражений печени, а так же гепатотоксичность различных препаратов. Наличие фиброза печени в данной модели, являющегося результатом вирус-индуцированной патологии иммунной системы, позволяет изучать патогенез и терапевтические тактики при данной патологии.
Нами были получены данные, демонстрирующие терапевтический иммуномодуляционный эффект эктопической экспрессии молекулы LIGHT при экспериментальной персистирующей инфекции печени. Следовательно, данный подход может быть использован для создания терапевтических вакцин, обладающих противовирусным эффектом.
Положения, выносимые на защиту
- Гуманизированная ДНО(RAG2/C-/-)-hu мышиная модель, сконструированная путем трансплантации CD34+ гемопоэтических стволовых клеток (ГСК) человека новорожденным иммунодефицитным RAG2/C-/- мышам, является эффективной мышиной in vivo моделью иммуногемопоэза человека и может быть использована для изучения патогенеза и терапии ВИЧ-1 инфекции.
- Клетками-мишенями ВИЧ-1 инфекции являются Т регуляторные CD4+ клетки (Трег), что коррелирует с увеличением их апоптоза. Трег содействуют генерализации ВИЧ-1 в острой фазе заболевания.
- Инфицирование ВИЧ-1 плазмоцитоидных дендритных клеток вызывают деплецию CD4+ Т-лимфоцитов и нарушение иммуного ответа
- Гуманизированная мышиная (AFC8-hu HSC/Hep)-модель, созданная путем трансплантации гемопоэтических клеток и гепатоцитов человека является уникальной моделью для изучения патологии печени человека, в частности патогенеза и терапии инфекции ВГС и вирусиндуцированного фиброза печени.
- Поражение печени при ВГС инфекции у AFC8-hu HSC/Hep мышей обусловленно наличием сочетанного действия вируса и иммунного ответа хозяина. Использвание оригинальной модели ВГС-инфекции позволило установить иммунный генез фиброза печени.
- Генно-инженерная индукция экспресии молекулы LIGHT у негумманнизированных мышей, инфицированных гепатотропными вирусными векторами приводит к иммуно-опосредованному разрешению инфекции, что является основанием для дальнейшей разработки подобных терапевтических вакцин для терапии гепатотропных и, возможно, других персистирующих инфекций.
Внедрение в практику
Результаты исследования внедрены в работу ряда лабораторий Онкологического Центра Лайнебергер и Центра инфекционных болезней медицинской школы Университета Северной Каролины, Отдела инфекционных заболеваний Медицинского центра Юго-Восточного Техасского Университета, США, ФГБУ «ФНКЦ детской гематологии онкологии и иммунологии имени Дмитрия Рогачёва» и ФГБУ «Гематологический научный центр» Министерства здравоохранения и социального развития Российской Федерации. Основные положения диссертации используются в новой быстроразвивающейся международной области экспериментальной медицины – “Humanized Mice”.
Апробация диссертации
Основные результаты работы доложены на ежегодных конференциях Американского общества гематологов (Новый Орлеан, США, 1999) и Американской ассоциации иммунологов (Новый Орлеан, США, 2002; Денвер, США, 2003 ), заседаниях научной группы иммунологов/вирусологов научного треугольника Северной Каролины (Дурам, США, 2008, 2011), 3-м Международном воркшопе по гуманизированным мышам (Питсбург, США, 2011), симпозиуме HepDARTTM 2011 (Колоа, США, 2011), VI и XIX Российских национальных конгрессах «Человек и лекарство» (Москва, Россия, 2000 и 2012 гг.), научно-клинических конференциях ФГБУ «ФНКЦ детской гематологии, онкологии и иммунологии им. Дмитрия Рогачёва» Минздравсоцразвития России (2011), Национального общества детских гематологов онкологов (Москва, Россия, 2012).
Основные положения диссертации апробированы на совместной научно-практической конференции сотрудников клинических и лабораторных отделов ФГБУ «ФНКЦ детской гематологии, онкологии и иммунологии им. Дмитрия Рогачёва» Минздравсоцразвития России 27 апреля 2012 и на межлабораторной конференции Онкологического Центра Лайнебергер Университета Северной Каролины в Чапел Хилл, США 23 марта 2012 года.
Структура и объем диссертации
Материал изложен в одном томе на _____ страницах машинописного текста, содержит _____ таблиц и проиллюстрирован ____ рисунками. Указатель литературы включает ____ источника. Работа состоит из введения, обзора литературы, описания материалов и методов, результатов собственных исследований и их обсуждения, заключения выводов, практических рекомендаций и списка литературы.
СОДЕРЖАНИЕ РАБОТЫ
МАТЕРИАЛЫ И МЕТОДЫ
- Создание гуманизированных мышиных моделей
1.1 Конструирование мышиной модели с человеческим гемопоэзом – (Rag2-/-C-/-)-hu мышей (гуманизированных ДНО-hu мышей)
Для создания модели использовались мыши-реципиенты – иммунодефицитные мыши с генетическим фоном BALB/C и двойным нокаутом (ДНО) генов Rag2-/- и C-/-: BALB/CRag2-/-C-/-. После процесса «гуманизации», модель сокращенно называлась ДНО-hu. Процесс «гуманизации» заключался в следующем. Человеческие CD34+ гемопоэтические стволовые клетки (ГСК) были выделены либо из пуповинной крови (коммерческие), либо из эмбриональной печени (17-23 недель гестации). Для получения клеток из эмбриональной печени последняя была дезагрегирована, гепатоцитарная фракция была отцентрифугирована и мононуклеарная фракция затем была выделена с помощью Ficoll градиента (GE Healthcare Bioscience AB). CD34+ клетки выделялись с помощью позитивной селекции на автоматическом магнитно-активированным клеточном сепараторе autoMACS согласно инструкции производителя (Miltenyi Biotec, Германия). Суспензия обогащенных CD34+ клеток (~80-95%) в количестве 0,5-1х106 (клетки эмбриональной печени) или 1х105 (клетки пуповинной крови) вводилась в печень новорожденных иммунодефицитных мышей в возрасте 1-5 дней, предварительно подвергшихся -облучению в дозе 4 Гр (Traggiai E., 2004). Количество ГСК полученных от одного донора позволяло осуществить трансплантацию 10-30 новорожденным животным. Такая группа мышей с генетически идентичным кроветворением человека была условно названа когортой. Трансплантированные мыши были тестированы через 8-16 недель для определения эффективности трансплантации на основании анализа состава гематологических клеток человека (CD45+, CD3+, CD4+, CD8+ и CD19+) проведенного с помощью проточной цитометрии.
- Конструирование мышиной модели с человеческим гемопоэзом и печенью: AFC8-hu HSC/Hep мышей
Создание указанной модели происходило в два этапа:
Этап 1. Создание особой мыши-реципиента на основе BALB/CRag2-/-C-/- (ДНО): AFC8 трансгенной мыши экспрессирующей в печени ген индуцированного апоптоза.
Этап 2. Гуманизация AFC8 трансгенных мышей. Гуманизация производилась как указанно выше, за исключением того, что отсепарированные путем центрифугирования гепатоциты (30% EpCam+ гепатобластов/предшественников) эмбриональной печени (15-18 недель гестации) были введены внутрипеченочно в дозе 0,5-1x106 клеток/мышь вместе с аутогенными CD34+ ГСК (0,5-1x106) новорожденным (1-5 дней), облученным (4 Гр) AFC8-трансгенным мышам и нетрансгенным однопометникам для контроля. Трансплантированные таким образом мыши получили условное название AFC8-hu HSC/Hep мышей, демонстрирующее, что это специальные трансгенные мыши с клетками человеческой (hu, от англ., human) печени (Hep, от лат., hepar) и иммунной системы (HSC, от англ., hematopoietic stem cells).
После трансплантации вводился апоптозо-индуцирующий препарат AP20187 (Ariad Pharmecuticals), внутриперитонеально или внутривенно в дозе 5 мкг/г веса тела по определенным дням. Контрольным мышам вводили раствор без препарата (4% этанол, 10% ПЭГ-400, 2% Твин-20 в воде). Для контроля разрушения гепатоцитов измерялся уровень АЛТ в крови.
- Инфицирование гуманизированных мышей
- ВИЧ-1 инфицирование гуманизированных ДНО-hu мышей
ВИЧ-1 инфицирование осуществлялось внутривенным введением вируса. На 12-16-й неделе после трансплантации, мыши со стабильной реконституцией человеческих лейкоцитов (более 10% CD45+ клеток в периферической крови) были инфицированы разными изолятами ВИЧ-1: NL4-R3A (вирус двойного тропизма – X4/R5), JRCSF (R5 тропизм), или NL4-3 (X4 тропизм), в дозе 1-5 нг р24/мышь (или 4000 инфекционных единиц/мышь в экспериментах, посвященных роли ПДК). Для контроля эксперимента были использованы 3 группы мышей. 1) ДНО-hu, не инфицированные ВИЧ-1, которым была произведена инъекция супернатанта с культивированных незараженных ВИЧ-1 клеток периферической крови человека; 2) ДНО-hu, инфицированные ВИЧ-1, инактивированным термическим воздействием (+55С° в течение 1 ч). 3) не трансплантированные ДНО мыши без человеческого гемопоэза, инфицированные ВИЧ-1.
Виремию контролировали определением концентрации вируса в плазме крови у мышей, проведенным с использованием теста Roche Amplicor Monitor v.1.5. (Roche Diagnostics, Indianapolis, США) и определением белка p24 внутри клеток с помощью проточной цитометрии еженедельно, в течение первого месяца, затем – разово в 1-3 мес. Для оценки репликации и патогенеза вируса в тимусе, лимфатических узлах и селезенке указанные органы были выделены и анализированы в различное время после инфицирования (Su L., 1995; Meissner E.G., 2005).
- Инфицирование ВГС AFC8-hu HSC/Hep мышей
Инокуляция ВГС в AFC8-hu HSC/Hep мышей производилась внутривенно, путем введения 100 мкл клинических изолятатов ВГС генотипа 1a (концентрация ~1-5x107 геномных копий/мл). Контрольной группе вводилось 100 мкл сыворотки крови человека. В последующем кровь и печень мышей были выделены, из образцов была получена РНК для определения геномной РНК ВГС.
3. Обследование гуманизированных мышей
- Проточная цитометрия
Анализ человеческих лейкоцитов в периферической крови, лимфоидных органах и тканях проводился на многоканальном (9 каналов) проточном цитометре CyAn (Dako North America, Inc, Carpinteria, CA). В конечной стадии исследования мыши выводились из эксперимента; периферическая кровь и все лимфоидные органы, включая тимус, селезенку, периферические лимфатические узлы (ЛУ) (шейные, подмышечные, брюшные), мезентеральные лимфатические узлы и костный мозг собирались для последующего анализа. Клетки выделялись из указанных органов, очищались от эритроцитов, маркировались моноклональными антителами (МАТ) и затем фиксировались 1% растворе формальдегида для проточной цитометрии. Для сепарации мертвых клеток при проведении цитометрии использовался ультрафиолетовый флуоресцентный краситель ДНК (VLD, L34955, Invitrogen). Перед проведением проточной цитометрии число клеток определялось с помощью автоматического клеточного анализатора Guava Easycytes (Guava, Hayward, CA).
Определялась экспрессия следующих маркеров: CD45, CD3, CD4, CD8, CD45RO, CD25, CD45RA (HI100), HLA-DR, CD127, CCR5 (2D7), CXCR4 (12G5), CD123, CD86, CD80, CD303 (BDCA2). ВИЧ-1 инфицированные клетки определялись анти-ВИЧ-1 p24 (FH190-1-1) МАТ, конъюгированными с FITC (Beckman Coulter, Fullerton, CA). Для определения таких внутриклеточных белков как p24, каспазы-3, ИФН-,, ФНО-, ИЛ-2 и FoxP3 производили вначале маркировку поверхностных маркеров, а затем пермеабилизировали клетки с помощью коммерческого буфера (BD Bioscience) и окрашивали внутриклеточно МАТ. МАТ были получены от Biolegend (Сан-Диего, Калифорния), BD Biosciences (Сан-Диего, Калифорния), Invitrogen/Caltag (Invitrogen, Карлсбад, Калифорния), Miltenyi (Miltenyi Biotech, Германия).
- Функциональное исследование иммунной системы гуманизированных мышей
Оценка супресивной активности Т-регуляторных (Трег) клеток
Метод 1. Для изоляции Трег клеток использовалась смесь клеток селезенки и мезентериальных ЛУ, полученных от 3-5 мышей из одной когорты, трансплантированной от одного донора. Клетки окрашивались МАТ к мышиному CD45, и человеческим CD45, CD4, CD25, и затем Трег клетки (с фенотипом: мышиныеCD45негативныечеловеческиеCD45+CD4+CD25+) выделялись при помощи проточного цитометрического сортера (Dako North America, Carpintera, CA). Данная популяция в настоящем исследовании получила название «подавляющие клетки». Человеческие CD4+CD25- клетки (отвечающие клетки) были изолированы из периферической крови доноров с использованием МАТ и магнитных бус. Далее, отвечающие клетки были окрашены CFSE (англ., Carboxyfluorescein succinimidyl ester) путем инкубации с данным препаратом в течение 3 мин. в водяной бане при 37С с последующей 3-разовой отмывкой в натрий-фосфатном буфере. Затем эти клетки были смешаны с изолированными Трег клетками (подавляющие) в соотношении 2:1 (отвечающие/подавляющие), стимулированы CD3/CD28 МАТ и инкубированы в течение 4-х дней, после чего тестированы на проточном цитометрометре.
Метод 2. Для достоверности результатов также использовался модифицированный метод, отличающийся другой стимуляцией. Стимуляция осуществлялась суперантигеном – стафилококковым энтеротоксином В (СЭВ) в дозе 0,1 пг/мл – 10 нг/мл. Отвечающие и подавляющие клетки были приготовлены как описано выше, и смешаны в соотношении 1:1. Клетки культивировались в присутствии различных концентраций СЭВ и моноцито-производных дендритных клеток в течение 6 дней. Для получения последних были изолированы моноциты (CD14+) из периферической крови доноров, которые затем культивировались в присутствии ИЛ-4 (100 нг/мл) и гранулоцитарно-макрофагального колониестимулирующего фактора (50 нг/мл) в течение 4-6 дней.
Удаление Трег клеток in vivo у ДНО-hu мышей
Для удаления Трег клеток in vivo использовался препарат денилейкин дифтитокс, который еще известен как ОНТАК – противоопухолевый белковый препарат, содержащий фрагменты ИЛ-2, связанного с дифтерийным токсином. ОНТАК связывается с рецептором к ИЛ-2 и таким образом обеспечивает попадание дифтерийного токсина в клетку, экспрессирующую этот рецептор, вызывая в дальнейшем гибель этой клетки. ОНТАК применяется при лейкозах, лимфомах и злокачественной меланоме. ОНТАК вводился внутрибрюшинно 12-недельным ДНО-hu мышам в дозе 0,75 мкг/мышь (разведенной в 100 мкл натрий-фосфатного буфера). Для контроля мышам вводили натрий-фосфатный буфер. На 1, 3, 6 и 12 день после инъекции определялось количество Трег клеток в периферической крови. Для удаления Трег во время ВИЧ-1 инфекции ДНО-hu мышам вводили ОНТАК, а затем через 2 дня инфицировали ВИЧ-1. Репликацию и патогенность ВИЧ-1 оценивали через 7 и 10 дней после инфекции.
Выделение плазмоцитоидных дендритных клеток (ПДК) и их стимуляция in vitro
Клетки костного мозга маркировали смесью МАТ (CD3, CD19 человека; CD45 и Ter119 мыши; в дальнейшем они названы lin – от англ. lineage), конъюгированных с биотином. Lin-положительные клетки были удалены путем маркировки стрептавидин-меченных магнитных бус с последующей сепарацией на аппарате AutoMACS (Miltenyi Biotech, Германия). Оставшиеся человеческие клетки (СD3-CD19-) были маркированы МАТ к CD4 и CD123 и затем CD4+CD123+ клетки были выделены с помощью проточного сортера (очистка > 95%). Клетки костного мозга (2х105 в 100 мкл культуральной среды) или очищенные ПДК (1х104 в 100 мкл культуральной среды) стимулировали CpG2216 (2 мкг/мл, InvivoGen, Сан-Диего, Калифорния), вирусом гриппа A/PR8/34 (2 мкг/мл, Charles River Laboratories International, Массачусетс) или УФ-инактивированным вирусом простого герпеса (ВПГ) (1х107/мл). Через 16 ч инкубации активационный статус и продукция цитокинов оценивалась с помощью проточной цитометрии.
Анализ ВГС-специфического Т-клеточного ответа
Лейкоциты, полученные из различных тканей AFC8-hu мышей, были проанализированы при помощи проточной цитометрии для определения поверхностных маркеров человека. Смесь клеток, полученных из селезенки и ЛУ, содержащую 1х105 человеческих CD45+ клеток, стимулировали фитогемоаглютинином (ФГА) в течение 12-16 ч in vitro 10 мкг/мл. Клетки затем маркировали МАТ к человеческим Т-лимфоцитам (CD45, CD3, CD4, CD8) и внутриклеточным цитокинам человека ИЛ-2, ФНО- и ИФН-. Для анализа ВГС-специфического Т-клеточного ответа, человеческие Т-клетки селезенки/ЛУ подвергались in vitro экспансии путем стимуляции антигенной панелью состоящей из 19 пептидов core-белка ВГС (перекрывающихся друг с другом на протяжении 10 аминокислот) в концентрации 10 мкг/мл для каждого пептида в присутствии 1 мкг/мл анти-CD28 МАТ. Затем клетки культивировались в течение 8-10 дней в среде IMDM с 10% эмбриональной телячьей сывороткой, 10 U/мл человеческого ИЛ-2 и 125 нг/мл ИЛ-7. По окончанию культивирования/экспансии, клетки были вновь стимулированы той же панелью пептидов ВГС в течение 18 ч и маркированы МАТ для определения субпопуляций Т-клеток и экспрессии эффекторных цитокинов человека, как указано выше.
Анализ цитокинов человека (Luminex) в гуманизированных мышах
Цитокины в плазме мышей или супернатанте культуральной среды определялись с помощью коммерческого набора Human Cytokine 25-Plex kit (Invitrogen/Biosource, Carlsbad, CA). Образцы были собраны в различное время и до анализа хранились замороженными при –70°C. Для дезактивации ВИЧ, перед проведением анализа в образцы был добавлен Triton X-100 (до достижения конечной концентрации 1%). Анализ проводился в лаборатории клинической протеомики в Университете Северной Каролины в Чапел Хилл.
- Гистологическое исследование
Иммуногистохимия
Гистологические срезы парафиновых блоков мезентериальных ЛУ и селезенки ДНО-hu мышей окрашивали МАТ к FoxP3 человека и затем инкубировали с козьими антимышиными антителами, конъюгированными с биотином, а затем с авидин-биотиновым комплексом (ABC; Vector Laboratories, Burlingame, CA) и проявляли при помощи субстрата DAB (Pierce, Rockford, IL). Срезы были изучены с помощью микроскопа Nikon Microphot FXA (Nikon, Garden City, NY) в 20- и 10-кратном увеличении. Изображения были получены с помощью цифровой камеры QImaging Micropublisher 3,3 CCD и программного обеспечения QCapture версии 3,0 (QImaging, Surrey, BC).
Анализ крови и гистология ВГС инфицированных мышей
На 12-16 неделе после трансплантации производился забор крови у AFC8-hu HSC/Hep мышей для определения приживления гемопоэтических клеток человека. При достижении конечной стадии исследования и выводе мышей из эксперимента, часть печени замораживалась в РНК-сохраняющем растворе, а часть печени фиксировалась в 10% формалине для последующего гистологического анализа, заключающегося в окраске: 1) гематоксилином/эозином; 2) сириусом красным в сочетании с фаст зеленым; 3) антителами (мышиные античеловеческие МАТ к -актину гладких мышц, клон 1A4; мышиные анти-человеческие МАТ к CD45, клон 2В11+PD7/26; кроличьи поликлональные антитела к альбумину человека (все антитела получены от Dako)). Иммунореактивность выявляли инкубацией с субстратом DAB (Pierce) или Vulcan red (Dako), для определения локализации экспрессии производили окраску с гематоксилином.
- Молекулярно-биологическое исследование
Определение экспрессии специфичных генов человека для исследования гуманизированной печени
Праймеры для количественной ПЦР в реальном времени, специфичные для человека и мыши, были разработаны с использованием программы разработки праймеров NCBI и базы данных Blast. Для анализа экспрессии генов были использованы реагенты для Thermo Scientific SYBR Green количественной ПЦР в реальном времени. Результаты указаны в относительных значениях экспрессии генов к экспрессии клеточного фермента катализатора гликолиза – GAPDH.
ПЦР и Вестерн-блот
Праймеры ПЦР к усовершенствованному зелёному флуоресцентному белку (англ. enhanced green fluorescent protein, (eGFP)) и р18 были использованы для измерения относительного количества генома AAВ. Для детекции еGFP белки выделяли из печени для Вестерн-блоттинга.
4. Аденоассоциированный вирусные (AAВ) и аденовирусные векторы и инокуляция мышей
ААВ вектор серотипа 8 (McCarty D.M., 2001) использовался для создания ААВ векторов, экспрессирующих eGFP под контролем промотора U1A. Рекомбинантные Aд5 (E1/E3-) аденовирусные векторы, экспрессирующие -галактозу (Aд-Контр.) и Aд-LIGHT, были созданы согласно ранее опубликованному протоколу (Yu P., 2007). Введение ААВ вектора (1х1011 вирусных частиц) C57BL/6 мышам дикого типа и LTR-нокаутным мышам проводилась через портальную вену. Аденовирусные векторы вводили внутривенно в дозе 3х1010 вирусных частиц/мышь через 2-3 недели после инокуляции ААВ. Рекомбинантный гибридный белок LTR-Ig был получен согласно описанию, опубликованному ранее (Wu Q., 1999; Browning J.L., 1997). Человеческий IgG, используемый для контроля, был получен из Biogen Inc. LTR-Ig или человеческий IgG (200 мкг/кг) вводился интраперитониально еженедельно, 1 раз в неделю в течение трех недель: один раз непосредственно перед и дважды после инъекции аденовирусного вектора у мышей, инфицированных ААВ.
5. Статистический анализ
Статистическая обработка данных, проведенная методом вариационной статистики с использованием программы Microsoft Excel, включала вычисление средних величин исследуемых показателей, их стандартных отклонений, уровней достоверности различий значений параметров в разных группах по критерию Стьюдента и проведение корреляционного анализа. При сравнении полученных данных уровень достоверности был принят p<0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
- Создание адекватных гуманизированных мышиных моделей, позволяющих изучать патогенез ВИЧ инфекции и других видоспецифичных инфекций человека
Критериями СПИДа являются высокий уровень инфицированности ВИЧ-1, деплеция CD4+ Т-клеток и как следствие – развитие иммунодефицита. Механизм иммунопатогенеза ВИЧ-1 не достаточно ясен в связи с тем, что высокой уровень репликации ВИЧ-1 и развитие СПИДа возможно только у человека, что резко ограничивает использование моделей экспериментальных животных. В связи с этим тормозится разработка эффективных превентивных и терапевтических мер. Многочисленные попытки инфицирования приматов позволяли достичь только низкого уровня репликации ВИЧ-1 у шимпанзе или же, для достижения моделирования ВИЧ инфекции у обезьян, приходилось использовать другой вирус – вирус иммунодефицита обезьян или вирус иммунодефицита обезьян/человека (Desrosiers R.C, 1988; Li J, 1992; Levy J.A., 1996). ВИЧ-1 не способен инфицировать клетки мыши, в связи с несостоятельностью обеспечения последними различных этапов жизненного цикла ВИЧ. Мыши с реконституцией человеческой иммунной системы являются идеальной малой экспериментальной моделью для изучения патогенеза ВИЧ-1 инфекции. В последние 20 лет был создан ряд человеко-мышиных химерических моделей, но применение их было ограниченно в основном за счет того, что ни в одной из этих моделей не удавалось развить длительный гемопоэз человека, в связи неэффективным приживлением ГСК человека, обусловленным, как правило, недостаточной имуннодефицитностью мыши-хозяина. Наибольший успех в создании подобных моделей был достигнут в 2004 году при использовании мышей, нокаутных по двум генам: 1) рекомбиназактивирующему гену 2 (RAG2), кодирующему протеин 2, который индуцирует рекомбинацию V(D)J; и 2) гену общей С цепи рецепторов ИЛ-2, -4, -7, -9 и -15. Двойной нокаут указанных генов позволяет создать идеальную модель для ксенотрансплантации с глубоким стойким иммунодефицитом (полная потеря Т- и В-лимфоцитов, а также натуральных киллеров) и отсутствием сопутствующих проблем, таких как спонтанное лимфомообразование, повышенная чувствительность к -радиации, повышенная смертность при манипуляциях и сниженная фертильность (Mazurier F., 1999).
Инъекция человеческих CD34+ гемопоэтических предшественников непосредственно в печень новорожденных мышей с описанным двойным нокаутом (RAG2/C) позволяет добиться развития функционирующей человеческой иммунной системы с центральными и периферическими иммунокомпетентными органами, такими как селезенка, ЛУ и периферическая кровь, в которых в течение длительного времени определяются человеческие клетки лимфоидных (Т, В, НК) и миелоидных (моноциты и дендритные клетки) линий (Traggiai E., 2004; Gimeno R., 2004).
Задачей данного фрагмента работы является демонстрация возможности развития ВИЧ-1 инфекции в экспериментальной мышиной модели с адекватным человеческому иммунопатогенезом (гуманизированные мыши), основанной на трансплантации CD34+ ГСК двойным нокаутным (ДНО) RAG2/C-/- мышам (ДНО-hu мышам).
Этапы создания оригинальной модели схематично представлены на рис. 1.
Гемопоэтические CD34+ клетки-предшественники, полученные из человеческой пуповинной крови или эмбриональной печени, были трансплантированы в печень новорожденных иммунодефицитных мышей. Между 8 и 33 неделями после трансплантации определялось наличие человеческих лейкоцитов в периферической крови и лимфоидных органах этих мышей. Установлено, что более чем 90% мышей на 10-16 неделе после трансплантации имеют стойкое приживление человеческих CD34+ клеток, о чем свидетельствовало наличие CD45+ клеток человека в периферической крови (рис. 2а).

Рисунок 1. Схема создания мышиной модели с гемопоэзом человека (гуманизированных мышей)

Рисунок 2. Приживление CD34+ ГСК человека, трансплантированных в иммунодефицитных мышей.
Кроме того, было выявлено наличие Т- и В-популяций лимфоцитов человека в периферической крови трансплантированных мышей (рис. 2б), а также основных субпопуляций Т-клеток: Т-хелперов (CD4+) и цитотоксических (CD8+) Т-лимфоцитов (рис. 2в). Развитие указанных популяций человека также определялось в лимфатических узлах, селезенке и тимусе мышей. Для дальнейшего определения адекватности данной модели человеческому гемопоэзу тестировалось наличие различных лимфоцитарных субпопуляций, характерных для функциональной иммунной системы человека. Было определено, что у данных мышей развиваются такие субпопуляции, как Т-регуляторные клетки (CD4+CD25+) и Т-клетки памяти (CD3+СD45RO+) (рис. 3г). Продолжительное наблюдение в течение 33 недель после трансплантации подтвердило длительное поддержание лимфопоэза с присутствием нормальных Т-клеточных субпопуляций у этих моделей (рис. 2г).
Проникновение вируса в иммунную клетку обусловлено его одновременным взаимодействием с рецептором CD4+ и поверхностными корецепторами: белками CCR5 или CXCR4. Для определения возможности входа ВИЧ-1 в клетки в ДНО-hu модели мы исследовали экспрессию этих важных корецепторов и установили, что CCR5 и CXCR4 экспрессировались на человеческих CD4+ Т-клетках. Уровень экспрессии CCR5 на клетках моделей был сравним с таковым у клеток периферической крови и клеток лимфоидных органов человека. Уровень же экспрессии CXCR4 был снижен (Bleul C.C., 1997; Ostrowski M.A., 1998). Также как и на лимфоцитах человека, Т-клетки памяти (CD45RО+) преимущественно экспрессировали CCR5, в то время как наивные Т-клетки (CD45RО) эффективно экспрессировали CXCR4. Таким образом, была установлена принципиальная возможность моделирования в ДНО-hu мышах длительно существующего лимфопоэза, адекватного человеческому, с наличием необходимых элементов для развития ВИЧ-1 инфекции.
Для определения возможности развития ВИЧ-1 инфекции в этой мышиной модели сначала был использован рекомбинированный вирус NL4-R3A с двойным тропизмом (R5/X4) – R3A Env. Вирус R3A был выделен у потребителей инъекционных внутривенных наркотиков. Этот вирус характеризуется высоким прогрессированием инфекции и инфицирует макрофаги и Т-лимфоциты (Meissner E.G., 2004). Высокая агрессивность и двойной тропизм определили выбор данного вируса для получения первичных данных о возможности развития ВИЧ-1 инфекции в данной модели. По той же причине вначале была использована высокая доза вируса для инфицирования: 20 000 Ед инфицирования/мышь. Через неделю после инфицирования у мышей определялась высокая виремия (200 000–400 000 копий вирусной РНК/мл), с последующим снижением виремии (10 000 копий вирусной РНК/мл) к 2-4 неделе. Вирус присутствовал в крови на 12-й неделе после инфицирования (947 копий вирусной РНК/мл). Во всех 3 контрольных группах мышей ВИЧ-1 инфекции не обнаружено (рис. 3а). У экспериментальных мышей виремия сопровождалась значительной деплецией CD4+ Т-лимфоцитов в периферической крови на 2, 3, 4 и 12 неделе инфекции (рис. 3б).
Для определения возможности инфицирования мышей низкими дозами была введена редуцированная доза вируса NL4-R3A (4000 Ед инфицирования или 1x10-6 мг/мышь). Репликация ВИЧ-1 достигла пика на 2-3 неделе инфекции, коррелируя с деплецией CD4+ Т-лимфоцитов в периферической крови (рис. 3в). Характерно, что такая динамика нарастания виремии с истощением CD4+ лимфоцитов на 2-3 недели инфекции с последующим снижением виремии и нормализацией уровня CD4+ после 5 недели инфицирования характерна для течения острого периода ВИЧ-1 инфекции у человека. На 19 неделе ВИЧ-1 инфекция не определялась в периферической крови, но была определена при культивировании тимоцитов инфицированной мыши с активированными человеческими мононуклеарами. Высокий уровень продуктивной инфекции с деплецией лимфоцитов был обнаружен в тимусе, селезенке и лимфатических узлах на 1 неделе инфекции. Знаменательно, что были инфицированы как наивные CD45RО Т-лимфоциты, так и клетки памяти (CD45RO+) (рис. 3г), что наблюдается в лимфоидных органах ВИЧ-1-инфицированных людей (Eckstein D.A., 2001).

Рисунок 3. ВИЧ-1 инфицирование гуманизированнных мышей.
В тимусе и лимфатический узлах наблюдалось преимущественное истощение CD4-лимфоцитов (рис. 3д). Эффективная ВИЧ-1 инфекция также определялась при инфицировании R5-тропным вирусом – JRCSF и X4-тропным вирусом – NL4-3.
Таким образом, мышиная модель с гемопоэзом человека может служить адекватной моделью для изучения патогенеза ВИЧ-1 инфекции. Во-первых, в гуманизированной мыши развивается эффективный и стабильный человеческий лимфопоэз с Т-, В-лимфоцитами и миелоидными клетками в центральных и периферических органах. Во-вторых, ВИЧ-1 инфекция приводит к высокой и персистентной ВИЧ-1 виремии в периферической крови и лимфоидных органах (Baenziger S., 2006). В-третьих, человеческие CD4 Т-лимфоциты угнетены ВИЧ-1 инфекцией в дозо- и вирусозависимой манере. Однако Т-клеточный ответ и генерация человеческих антител в ответ на ВИЧ-1 инфекцию в этой мышиной модели, пока недостаточны. Тем не менее, создание и дальнейшее совершенствование длительно действующей (33 нед.) мышиной модели способствует углубленному изучению иммунопатогенеза ВИЧ-1 инфекции и открывает перспективы развития терапевтического контроля ВИЧ-1 заболеваний.
- Изучение патогенеза человеческих инфекций на моделях гуманизированных мышей
2.1 Роль FoxP3+CD4+ Т регуляторных клеток в острой фазе ВИЧ-1 инфекции в модели ДНО-hu мышей
В последние годы значительное внимание уделяется такой субпопуляции Т-лимфоцитов, как регуляторные Т-клетки (CD4+CD25+, Трег). Установлено, что данные клетки играют значительную роль в патогенезе ряда патологических процессов, таких как рак (Curiel T.J., 2004; Wang H.Y., 2004), инфекционные болезни (Beilharz M.W., 2004; Dittmer U., 2004; Oswald-Richter K., 2004; Weiss L., 2004) и аутоиммунные заболевания (Sakaguchi S., 2004; Morse S.S., 1999; Boyer O., 2004). Трег клетки индуцируются (или рекрутируются/экспансируются) во время иммунного ответа для контроля гиперреактивности иммунитета. Таким образом, Трег клетки играют ключевую роль в иммунном ответе и иммунопатогенезе острых и хронических инфекционных болезней. При хронической вирусной инфекции Трег клетки могут способствовать ослаблению противовирусного иммунного ответа, и, как следствие, персистенции вируса. Это замечено при вирусном гепатите С у человека и шимпанзе (Sugimoto K., 2003) и при инфекции вирусом лейкоза Френда у мышей (Dittmer U., 2004).
Для понимания происхождения Трег клеток интенсивно изучаются молекулярные механизмы их развития. Современные генетические исследования, проведенные у человека и мышей, позволили идентифицировать транскрипционный фактор Scurfin или FoxP3, детерминирующий развитие Трег и являющийся их молекулярным маркером (Bennett C.L., 2001; Hori S., 2003; Fontenot J.D., 2003).
Роль Трег клеток в патогенезе ВИЧ-1 инфекции изучена недостаточно, в основном за счет отсутствия адекватных экспериментальных моделей для изучения функции иммунной системы человека in vivo. Так как Трег клетки экспрессируют маркер CD4, они являются потенциальными клетками-мишенями для ВИЧ-1 инфекции. Однако данных об инфицированности Трег клеток у человека нет. Известно, что хроническая иммунная активация является отличительной особенностью и достоверным предсказателем прогрессии СПИДа (Giorgi J.V., 1993). Было высказано предположение, что ВИЧ-1 инфекция приводит к нарушению функции или элиминированию Трег клеток, что в свою очередь, приводит к иммунной гиперактивации и, как следствие, к прогрессированию заболевания. Однако, существуют противоречивые сведения, демонстрирующие как увеличение, так и снижение количества Трег клеток у ВИЧ-1 инфицированных пациентов в течение прогрессии СПИДа.
Соответственно задачей данного фрагмента работы являлось выяснение роли Foxp3+CD4+CD25+ Tрег клеток в патогенезе ВИЧ-1 инфекции в модели ДНО-hu мышей.
Развитие и функциональные возможности Трег в ДНО-hu модели. Посредством проточной цитофлоуметрии была проанализирована экспрессия маркера Трег клеток – FoxP3+ в CD4+ клетках человека и определено содержание этой клеточной популяции в крови и лимфоидных органах ДНО-hu модели. Трег клетки были обнаружены в периферической крови и лимфоидных органах в количестве, сопоставимом с таковым в крови и органах человека, а также нормальных мышей (имеется в виду мышиные Трег клетки). Такая же закономерность была выявлена при исследовании экспрессии CD25 на CD4+ клетках (менее точный маркер Трег клеток) (рис. 4). Помимо этого было установлено, что около 60% CD3+CD4+CD25+ клеток экспрессируют FoxP3 и около 40-50% FoxP3+CD4+CD3+ T-клеток экспрессируют CD25. Важно, что подобная экспрессионная закономерность наблюдается и у человека. Только незначительная часть FoxP3+CD4+ Трег клеток селезенки и ЛУ ДНО-hu мышей экспрессировали IL7R (<20%), CD45RA (10-25%) или HLA-DR (<5%), в то время как большинство FoxP3-CD4+CD3+ T-клеток экспрессировали IL7R и CD45RA. Функционально эти CD4+CD25+ клетки были анергичны in vitro, т.е. отвечали на активацию сниженными продукцией ИЛ-2 и пролиферацией. Также была исследована основная функция Трег клеток – супресивная активность, с помощью специального супресивного анализа. Было установлено, что CD4+CD25+/hi клетки, изолированные из селезенки и лимфатических узлов, способны эффективно подавлять пролиферацию CD4+CD25- Т-клеток при коактивации CD3/CD28 (рис. 5а-в), а также при культивировании Трег и CD4+CD25- Т-клеток с первичными дендритными клетками, стимулированными суперантигеном – стафилококковым энтеротоксином В (рис. 5г-е).
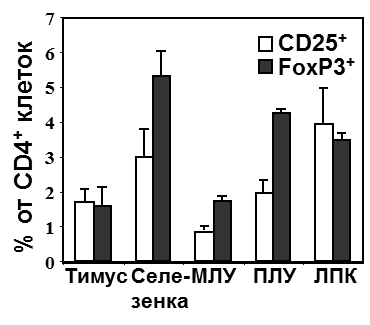
Рисунок 4. Содержание Трег клеток в различных органах ДНО-hu модели. МЛУ – мезентериальные ЛУ; ПЛУ – периферические ЛУ (чаще всего шейные); ЛПК – лимфоциты периферической крови.

Рисунок 5. CD3+CD4+CD25+ клетки ДНО-hu модели подавляют пролиферацию Т клеток in vitro, т.е. являются функциональными Трег клетками: а, г – неактивированные отвечающие клетки меченные CFSE; в, д – отвечающие клетки меченные CFSE, активированные в отсутствии Трег; в, е – отвечающие клетки меченные CFSE, активированные в присутствии Трег (см. раздел «Материалы и методы»).
Таким образом, в данной мышиной модели в крови и во всех лимфатических органах среди человеческих Т-клеток присутствуют Трег клетки с нормальным фенотипом и нормальной функциональной супресивной активностью.
Продуктивное ВИЧ-1 инфицирование FoxP3+ Трег клеток в ДНО-hu модели. Как отмечалось ранее, ДНО-hu мыши восприимчивы к CCR5- или CXCR4-тропным ВИЧ-1, с развитием инфекции в тимусе, селезенке и ЛУ. Было выявлено, что значительная часть Трег клеток в селезенке и ЛУ экспрессируют CCR5 (30 и 60% соответственно), по сравнению с FoxP3-CD4+ T-клетками, из которых только 4-8% экспрессируют CCR5. В то же время экспрессия CXCR4 была одинаковой в обоих типах клеток. Для ответа на вопрос, возможна ли продуктивная ВИЧ-1 инфекция в CD4+FoxP3+ Tрег клетках, человеческие лимфоциты, изолированные из ДНО-hu мышиной модели, зараженной патогенным ВИЧ-1 изолятом R3A, обладающим двойным тропизмом, были тестированы на наличие инфицированности, которая определялась внутриклеточной маркировкой белка ВИЧ-1 р24 с помощью МАТ и последующей проточной цитометрией. В связи с тем, что экспрессия CD4 подавляется в ВИЧ-1 инфицированных клетках, экспрессия р24 и FoxP3 была проанализирована в CD45+CD3+CD8- T-клетках. ВИЧ-1 инфицировал как FoxP3+ так и FoxP3- T-клетки (рис. 6а), но процент инфицированных FoxP3+ клеток значительно превышал таковой в FoxP3- Т-клетках селезенки и ЛУ (превышение в 2 и 5 раз, соответственно; р<0.05, рис. 6б). Таким образом, среди CD3+CD8-FoxP3+ Tрег клеток было инфицировано 13-15%, в то время как среди CD3+CD8-FoxP3- было инфицировано только 3-5%. Также, CCR5-тропный вирус – HIV-JRCSF инфицирует FoxP3+ T-клетки более эффективно, чем FoxP3-CD4 T-клетки (25 и 7%, соответственно). Таким образом можно сделать заключение, что ВИЧ-1 способен эффективно инфицировать и реплицироваться в FoxP3+ Tрег клетках in vivo.

Рисунок 6. ВИЧ-1 преимущественно инфицирует Трег клетки.
ВИЧ-1 инфекция преимущественно деплецирует FoxP3+ Tрег клетки в модели. Помимо возможности заражения Трег клеток была изучена динамика изменений их уровня в течение ВИЧ-1 инфекции (рис. 7а-б). Было выявлено, что высокопатогенный ВИЧ-R3A хорошо реплицировался, вызывая высокую виремию к 1 неделе постинфекции, но при этом наблюдалась только незначительная деплеция общего числа CD4+ клеток в лимфоидных органах (рис. 7а). В то же время, абсолютное и относительное количество CD3+CD8-CD25+ (рис. 7б) и CD3+CD8-FoxP3+ (рис. 7в,г) Tрег клеток было значительно снижено. Ко второй неделе постинфекции CD4+ и Трег клетки практически полностью отсутствовали.

Рисунок 7. ВИЧ-R3A преимущественно деплецирует Трег клетки на первой неделе постинфицирования.
Затем, определялся уровень каспаза-3 положительных клеток среди Трег клеток, для оценки ВИЧ-1 индуцированного апоптоза в них. Мы обнаружили, что количество каспаза-3+ клеток среди Трег (FoxP3+CD3+CD8-) значительно превышает таковое количество среди FoxP3-CD3+CD8- T-клеток в селезенке и лимфатических узлах. Однако в селезенке контрольных мышей низкий уровень каспаза-3+ клеток обнаруживается как у FoxP3+, так и FoxP3- CD3+CD8- T-клеток. Следовательно, ВИЧ-1 инфицирование индуцирует апоптоз преимущественно в FoxP3+ клетках. В ЛУ неинфицированных мышей уровень апоптотических клеток базово выше у FoxP3+ клеток, чем у FoxP3- клеток, но, как и в селезенке, ВИЧ-1 инфекция индуцирует увеличение апоптоза преимущественно в FoxP3+ клетках. Апоптоз также определялся в инфицированных и неинфицированных клетках, используя совместную с каспазой 3 внутриклеточную маркировку р24. Выявлено, что апоптотические клетки определяются как среди инфицированных (р24+), так и неинфицированных (р24-) Трег клеток, но при этом превалируют среди инфицированных. Подобная разница не наблюдалась при исследовании апоптоза у FoxP3- клеток. Таким образом, можно заключить, что высокопатогенный ВИЧ-R3A преимущественно инфицирует и деплицирует Трег клетки, что коррелирует с увеличением апоптоза в последних.
Экспериментальное удаление CD4+CD25hi Трег клеток редуцирует репликацию ВИЧ-1 in vivo. Для определения роли Трег клеток в патогенезе активной стадии ВИЧ-1 инфекции было решено удалить CD4+CD25+/hi Трег клетки из инфицированных животных, для чего был использован иммунотоксин ОНТАК, применяемый для лечения хронического лимфолейкоза. До этапа работы с инфицированными животными было установлено, что введение в ДНО-hu мышей препарата ОНТАК эффективно удаляет человеческие CD4+CD25hi Трег клетки, без значительного влияния на другие популяции лимфоцитов, включая CD4+CD25- или CD8+ T-клетки. Редуцированный уровень человеческих CD4+CD25hi Трег клеток в лимфоидных органах у ДНО-hu мышей наблюдался в течение 10-12 дней и коррелировал с повышенным уровнем экспрессии HLA-DR на CD4+ и CD8+ Т-лимфоцитах. После того как было установлено, что введение ОНТАК приводит к стойкому удалению Трег клеток в ДНО-hu модели, мыши, предварительно получившие ОНТАК и контрольные мыши, получившие натрий-фосфатный буфер, были инфицированы ВИЧ-1-R3A. К 1 неделе после инфицирования наблюдалась деплеция FoxP3+ Tрег клеток в периферической крови контрольных мышей, инфицированных ВИЧ, но не получавших ОНТАК, как и наблюдалось ранее. У ОНТАК мышей наблюдался низкий уровень Трег клеток как у неинфицированных мышей, так и у инфицированных. Для изучения кинетики ВИЧ-1 инфекции у мышей бралась кровь на 3, 7 и 10 день после инфекции. На 10 день мыши были выведены из эксперимента и лимфоидные органы выделены для анализа.

Рисунок 8. Снижение вирусной нагрузки ВИЧ-1 инфекции, при ОНТАК индуцированном удалении Трег клеток (Представлены данные одного репрезентативного эксперимента с 2 экспериментальными животными в каждой группе. Данные подтверждены 3 независимыми экспериментами.
Наиболее низкий уровень ВИЧ-1 инфекции был обнаружен у инфицированных мышей, получивших ОНТАК, что определялось внутриклеточным определением p24 в лимфоцитах лимфоидных органов (рис. 8а) и виремией в плазме крови (рис. 8б). Таким образом, редуцированный уровень Трег клеток приводит к сниженному уровню ВИЧ-1 инфекции в активной стадии.
Таким образом, обсуждая вовлечение Трег клеток в патогенез ВИЧ-1 инфекции необходимо отметить, что роль данной популяции остается неясной по ряду причин. Во-первых, основы иммунобиологии Трег клеток у человека недостаточно хорошо изучены, в связи с тем, что в основном доступны для изучения Трег клетки периферической крови, исследование которых может не полностью раскрывать биологию Трег клеток лимфоидных тканей. Во-вторых, функции Трег клеток в активной стадии ВИЧ-1 инфекции могут различаться с таковыми в хронической стадии и при развитии СПИДа. Также нельзя не учитывать, что индивидуальные различия в исследуемых группах могут приводить к противоречивым результатам. Для того, чтобы разрешить эти проблемы необходима адекватная экспериментальная модель для изучения роли Трег клеток при ВИЧ-1 инфекции in vivo. Мышиная модель ДНО-hu отвечает этим требованиям. Наличие человеческой иммунной системы, адекватной по морфологическим и функциональным параметрам, позволяет развиться ВИЧ-1 инфекции с характерными патогенетическими манифестациями, основной из которых является деплеция CD4+ клеток. В данном разделе работы установлено, что супрессивные CD4+ Трег клетки развиваются в нормальной пропорции во всех лимфоидных органах ДНО-hu мышей и обладают нормальной функциональной супрессивной активностью. Данные клетки заражаются ВИЧ-1 in vivo и деплицируются в течение инфекции высокопатогенными изолятами ВИЧ-1, что коррелирует с их увеличенным апоптозом. Более того, экспериментальное удаление Трег клеток значительно снижает уровень ВИЧ-1 инфекции и репликации вируса. Таким образом FoxP3+ Tрег клетки являются важными клетками мишенями для ВИЧ-1 инфекции и репликации, особенно в лимфоидных органах, в стадии острой инфекции, когда большинство CD4+ Т клеток крови находятся в «молчащей» фазе и маловосприимчивы к инфицированию вирусом. Как следствие, аккумуляция CD4+FoxP3+ Tрег клеток в лимфоидных органах в острой стадии ВИЧ-1 инфекции может приводить к увеличению числа клеток мишеней для ВИЧ-1, и в то же время подавлять иммунный ответ против ВИЧ-1 в лимфоидных органах.
Исследуемая модель является ценным инструментом в дальнейшем понимании того, как Трег клетки отвечают на ВИЧ-1 инфекцию и как ВИЧ-1 взаимодействует с популяцией Трег клеток в процессе инфекции.
2.2 Роль плазмоцитоидных дендритных клеток (ПДК) в патогенезе ВИЧ-1 инфекции
ПДК являются эффекторными клетками врожденного иммунитета, которые могут созревать в антигенпрезентирующие клетки (АПК), и играют ключевую роль во взаимодействии врожденного и приобретенного иммунитета и в координации антивирусного иммунного ответа (Swiecki M., 2010; Colonna M., 2004; Liu Y.J., 2005).
Несколько линий доказательств указывают на то, что ПДК играют важную роль в патогенезе ВИЧ инфекции (Colonna M., 2004; Fonteneau J.F., 2004). Во-первых, ПДК обладают высоким уровнем экспрессии CD4, CCR5 и CXC4, и ВИЧ может продуктивно инфицировать ПДК in vitro. Во-вторых, ПДК (но не миелоидные дендритные клетки) эффективно активируются ВИЧ в отсутствие продуктивной инфекции (Fonteneau J.F., 2004). В-третьих, у ВИЧ-положительных пациенто в, как правило, отмечается сниженный уровень активности ПДК. Фактически, открытие ПДК у человека в ранних исследованиях, было сделано на основании обнаружения снижения ИФН-продуцирующих клеток у больных СПИДом (Siegal F.P., 1999). Таким образом, ПДК, вероятно, являются критическими модуляторами иммунопатогенеза ВИЧ-инфекции.
Изучение ПДК у ВИЧ-1-инфицированных пациентов крайне затруднено в связи с тем, что, во-первых, уровень данной популяции в периферической крови крайне невысок (0,5-1%), что ограничивает количество исследуемого материала, а во-вторых, ПДК костного мозга и селезенки практически недоступны для исследования. Противоречивые данные, полученные при обследовании пациентов, подчеркивают важность изучения взаимодействия ВИЧ и ПДК в соответствующих экспериментальных моделях in vivo. Поскольку, как уже было показано, ДНО-hu модель обладает адекватной функциональной иммунной системой человека, включающей наличие дендритных клеток, и развивает ВИЧ-1 инфекцию при инфицировании штаммами вируса с разным тропизмом, было решено использовать ее для достижения следующей задачи.
Задачей данного раздела работы являлась характеристика пригодности ДНО-hu модели для исследования развития и функционирования ПДК, и изучение их роли в патогенезе ВИЧ инфекции in vivo.
Развитие функциональных ПДК человека в центральных и периферических лимфоидных органах у ДНО-hu мышей. Оценка развития человеческих ПДК в различных лимфоидных органах в ДНО-hu модели производилась при помощи проточной цитометрии, при использовании следующего фенотипа ПДК: CD45+CD3-CD19-CD11c-CD4+CD123+BDCA2+. Было обнаружено, что развитие ПДК наблюдалось в костном мозге и периферических лимфоидных органах (рис. 9а,б). Относительно низкий уровень ПДК человека был обнаружен в периферической крови, селезенке и ЛУ гуманизированных мышей, что соответствует уровню данной клеточной популяции среди мононуклеаров периферической крови человека. Относительно высокое содержание ПДК было обнаружено в костном мозге ДНО-hu мышей; крайне низкий уровень – в тимусе.

Рисунок 9. Содержание ПДК в различных органах ДНО-hu модели. КМ-костный мозг, МЛУ – мезентериальные ЛУ; ПЛУ – периферические ЛУ (чаще всего шейные); ЛПК – лимфоциты периферической крови.
Для исследования функциональной активности ПДК были выделены из костного мозга с помощью проточного цитометрического сортера клеток и стимулированы in vitro вирусом гриппа (приводит к стимуляции TLR7) и ВПГ (приводит к стимуляции TLR9). В ответ на стимуляцию, ПДК стремительно продуцировали ИФН-, ИЛ-6 и хемокины, такие как протеин индуцирующий ИФН- (англ.: interferon gamma-induced protein 10 kDa – IP-10) и макрофагальный воспалительный протеин (англ.: macrophage inflammatory protein – MIP1 (рис. 10а), и созревали до экспрессии CD80, 83, 86, HLA-DR, ICOS-L (лиганд индуцированного костимулятора

Рисунок 10. ПДК ДНО-hu мышиной модели обладают нормальной функциональной активностью.
Т-клеток; англ.: inducible T-cell costimulator ligand) и других рецепторов АПК (рис. 10б).
Таким образом, нормально функционирующие ПДК, обладающие нормальным ответом на стимуляцию лигандами TLR7 или TLR9, могут развиваться в мышиной модели ДНО-hu.
ПДК в ДНО-hu мышах экспрессируют CCR5 и CXCR и могут быть эффективно инфицированы ВИЧ in vivo. В начале было установлено, что ПДК человека (фенотип: Lin-CD4+CD123+) в мышах ДНО-hu экспрессируют корецепторы, необходимые для инфицирования ВИЧ – CCR5 и CXCR4 (рис. 11а). Затем была исследована возможность ВИЧ-1 инфицирования ПДК в различных лимфоидных органах ДНО-hu модели in vivo. Наличие инфицированных ПДК определялось путем внутриклеточной маркировки белка p24 на 1-2 неделе после инфицирования. Было выявлено, что ПДК были эффективно инфицированы как в селезенке, так и в костном мозге зараженных мышей (рис. 11б).
Таким образом, приведенные данные неопровержимо показывают, что ВИЧ-1 эффективно инфицирует ПДК костного мозга и селезенки в ранней стадии ВИЧ-1 инфекции in vivo.

Рисунок 11. ПДК в ДНО-hu мышах экспрессируют CCR5 и CXCR и могут быть эффективно инфицированны ВИЧ in vivo.
ВИЧ-1 инфекция приводит к быстрой активации ПДК in vivo. Предполагается, что активация ПДК вносит вклад в прогрессирование ВИЧ-1 инфекции. В связи с этим нами определялось содержание ИФН- в крови инфицированных и контрольных мышей ДНО-hu. Значительная индукция ИФН- была обнаружена в крови ВИЧ-инфицированных мышей (рис. 12а). Помимо этого, была проанализирована экспрессия маркеров активации на поверхности ПДК у ВИЧ-инфицированных и контрольных мышей. Выявлено, что ПДК инфицированных мышей экспрессировали высокий уровень HLA-DR (рис. 12б), CD38, CD80 и ICOS-L. Интересно, что активация ПДК положительно коррелировала с активацией CD4+ Т-клеток (рис. 12в), апоптозом и деплецией последних (рис. 12г).

Рисунок 12. ВИЧ-1 инфекция индуцирует активацию ПДК у ДНО-hu мышей.
Таким образом, человеческие ПДК были значительно активированы в лимфоидных органах ВИЧ-1-инфицированных мышей ДНО-hu, и активированные ПДК возможно способствовали активации и деплеции CD4+ T-клеток.
ВИЧ-1 инфекция преимущественно деплецирует человеческие CD4+ Т-клетки, но не ПДК in vivo. Для анализа истощения человеческих CD4+ Т-клеток и ПДК, опосредованного ВИЧ-1 инфекцией in vivo, определялось количество человеческих Т-клеток и ПДК в каждом лимфоидном органе. Человеческие CD4+ Т-клетки были значительно деплицированы в костном мозге и селезенке инфицированных мышей, как и ожидалось (рис. 13а,б). Уровень же ПДК человека не изменялся (рис. 13а,б) ни в костном мозге (рис. 13а), ни в селезенке (рис. 13б).
Таким образом, ВИЧ-инфекция преимущественно деплецирует CD4+ Т-клетки, но не CD4+ ПДК, даже в том случае если они были продуктивно инфицированы ВИЧ-1.

Рисунок 13. Дифференциальная деплеция CD4+ Т-клеток и ПДК у ВИЧ-1-инфицированных ДНО-hu мышей.
ВИЧ-1 инфекция вызывает нарушение функции ПДК костного мозга и селезенки in vivo. Хотя количество ПДК не уменьшается в течение острой стадии ВИЧ-1 инфекции, было установлено, что уровень ИФН- в крови был значительно снижен на 2 неделе инфекции по сравнению с содержанием на 1 неделе (рис. 14а). Было сделано предположение, что функция ПДК у ВИЧ-1-инфицированных мышей может быть нарушена, по аналогии с наблюдаемой у ВИЧ-1-инфицированных пациентов. Для анализа функции этих клеток, была проведена оценка активационного статуса ПДК костного мозга выделенных из инфицированных и контрольных мышей ДНО-hu, в ответ на стимуляцию лигандами к TLR7 или TLR9 in vitro. Было установлено, что ПДК от ВИЧ-инфицированных мышей обладали сниженным ответом при стимуляции TLR9 (ВПГ; рис. 14б) или TLR7 (вирус гриппа; рис. 14в). Таким образом, можно сделать заключение, что ПДК костного мозга ВИЧ-1-инфицированных ДНО-hu мышей обладают функциональными нарушениями, выражающимися в сниженной способности к выработке интерферона в ответ на стимуляцию TLR7 и TLR9.

Рисунок 14. ВИЧ-1 инфекция приводит к функциональной недостаточности ПДК.
Таким образом, в данной части работы установлено, что функционально активные человеческие ПДК развиваются во всех лимфоидных органах мышей ДНО-hu. Кроме того, ВИЧ-1 эффективно и продуктивно инфицирует ПДК периферической крови и лимфоидных органов в данной модели in vivo. Также установлено, что ВИЧ-1 инфекция преимущественно деплецирует CD4+ Т-клетки человека в костном мозге и селезенке, и приводит к функциональной недостаточности ПДК, количество которых не изменяется. ВИЧ-1 инфекция резко активирует ПДК костного мозга и селезенки, что коррелирует с активацией и деплецией CD4+ T-клеток. Полученные данные позволяют предположить, что активированные ПДК с функциональными нарушениями вносят вклад в истощение CD4+ Т-клеток у ВИЧ-1-инфицированных мышей ДНО-hu, которые могут служить важной моделью для изучения развития и функции ПДК человека in vivo.
- Создание гуманизированной мышиной модели для изучения патогенеза и терапевтических подходов гепатропных инфекций
Печень содержит уникальные субпопуляции АПК и лимфоцитов (Crispe I.N., 2003; Racanelli V., 2006). Предполагается, что инфекция ВГС приводит к нарушениям иммунного ответа в печени, что способствует развитию хронической инфекции у 80% зараженных пациентов. Хроническое воспаление и нарушение Т-клеточного ответа в печени предположительно приводит к поражению печени (Bowen D.G., 2005; Dustin L.B. 2007; Grakoui A., 2003; Rehermann B., 2005). В связи с трудностями изучения ВГС инфекции у человека и отсутствием надежной модели животных для изучения иммунопатогенеза этой инфекции, крайне мало известно о том, как происходит заражение ВГС у пациентов и механизмах, позволяющих вирусу избегать иммунного ответа, что приводит к хронизации инфекции в печени (Legrand N, 2009).
Хотя шимпанзе играют важную роль в изучении инфицирования вирусом гепатита (Bukh J., 2004), существует ряд недостатков лимитирующих использование этой модели: низкий уровень хронической инфекции, отсутствие фиброза печени, высокая стоимость и этические проблемы. Разработан ряд химерных моделей печени «человек-мышь», позволяющих изучать некоторые аспекты ВГС инфекции. Значительным недостатком данных моделей является отсутствие функциональной иммунной системы человека, необходимой для полноценного моделирования патологического процесса in vivo (Maeda N., 2004; Mercer D.F., 2001; Meuleman P., 2005; Azuma H., 2007; Bissig K.D., 2007; Bissig K.D., 2010). Мыши, трансплантированные аутогенными человеческими клетками печени и гемопоэтическими клетками, обеспечивающими развитие функциональной иммунной системы человека, являлись бы отличной моделью для изучения вируса гепатита С (Legrand N., 2009).
В связи с вышеизложенным, задачей данного фрагмента исследования являлось создание принципиально новой модели гуманизированных мышей, сочетающей наличие функциональной печеночной ткани и иммунной системы человека. Одной из главных задач исследования было доказать, что созданная модель восприимчива к развитию инфекции ВГС с адекватными признаками иммунопатогенеза этой патологии.
Эффективное приживление трансплантированных клеток печени и клеток иммунной системы человека у трансгенных AFC8 мышей. На первом этапе создания модели была поставлена задача создания специальных мышей-реципиентов человеческих тканей, обеспечивающих надежное приживление гепатоцитов человека. В качестве основы были использованы BALB/C Rag2-C-нокаутные мыши, которые обеспечивают развитие функциональной человеческой иммунной системы после трансплантации CD34+ человеческих ГСК (Traggiai E., 2004). Для возможности замещения мышиной печеночной ткани в этих животных на человеческую был сконструирован химерный ген, кодирующий комбинированный белок, состоящий из каспазы 8 (инициатор апоптоза) и FKBP (FK506-связывающий протеин) – FC (англ. FKBP-Caspase 8) белок (Pajvani U.B., 2005). Активация данного гена контролируется альбуминовым усиленным промотером (Conner E.A., 2000), так что экспрессия его происходит только в клетках печени. Соответственно, данный ген получил название AFC8. Сконструированный AFC8-ген был использован для создания AFC8-трансгенных BALB/C Rag2-C-нокаутных мышей (AFC8 мышей). Гепато-специфичность экспрессии AFC8 трансгена была подтверждена. Димеризация активной каспазы 8, происходящая под воздействием препарата AP20187, индуцирует апоптоз только тех клеток, в которых она экспрессирована, но не в окружающих клетках (рис. 15а).
Для индукции апотоза печеночных мышиных клеток AFC8 мышам вводился препарат AP20187. При введении препарата у AFC8 мышей наблюдалось повышение уровня АЛТ по сравнению с контрольными животными. Уровень АЛТ оставался повышенным после инъекции в течение 2-3 дней, и этот цикл повторялся при повторных инъекциях. Чтобы проверить способность AFC8 мышей приживлять человеческие гепатоциты, а также человеческие иммунные клетки, мы трансплантировали CD34+ ГСК и клетки-предшественники гепатоцитов (Hep), полученные из одной эмбриональной печени плода человека, в печень облученных новорожденных AFC8 мышей (AFC8-hu HSC/Нер мыши, объяснение термина дано в разделе «Материалы и методы»). После трансплантации наблюдался значительный рост гепатоцитов, экспрессирующих альбумин человека в AFC8-hu химерной печени (рис. 15б).
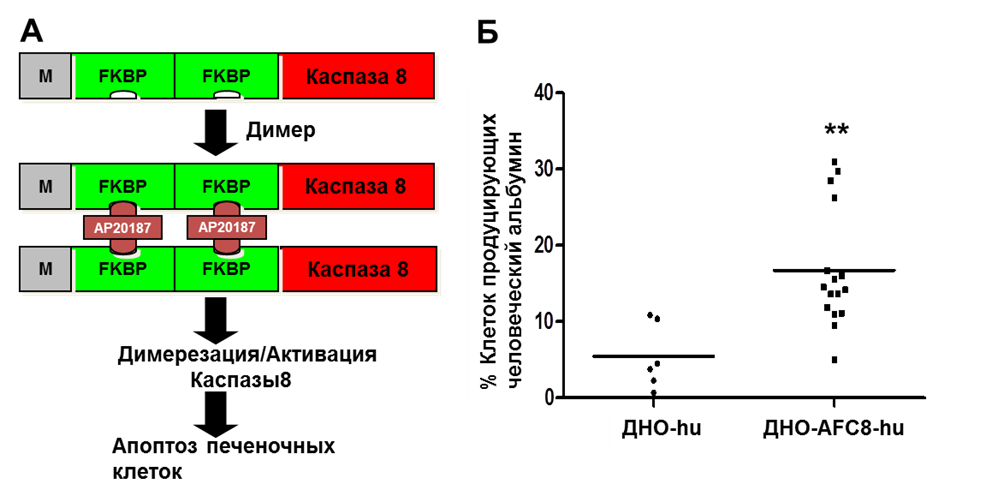
Рисунок 15. Приживление гепатоцитов человека в AFC8-hu мышах.
Через 5-16 недель после пересадки около 15% клеток от общего числа ядросодержащих клеток в химерной печени экспрессировали альбумин человека у AFC8-hu HSC/Нер мышей. Данные результаты получены при исследовании более 10 мышей из нескольких когорт. Когортой, определялась группа мышей, как правило, однопометников или мышей сходного возраста и идентичной линии, трансплантированных от одного донора. Используя ПЦР праймеры, специфические для человеческих генов, нами также была выявлена экспрессия генов альбумина человека и человеческих гепатоцитов – CYP2E1, CYP2C9 и UGT2B7 в печени AFC8-hu HSC/Нер мышей. Как и ожидалось, у AFC8-hu HSC/Нер мышей развивались клетки человеческой иммунной системы во всех лимфоидных органах и печени. Таким образом, была создана гуманизированная мышиная модель, как с человеческой иммунной системой, так и с печенью, содержащей гепатоциты человека.
ВГС-инфекция приводит к инфильтрации печени и гепатиту у AFC8-hu HSC/Нер мышей. AFC8-hu HSC/Нер мыши были инфицированы сывороткой крови больных гепатитом С (генотип 1a) и сывороткой крови здоровых доноров для контроля. При прекращении эксперимента (1-4 месяца после заражения) геномная РНК ВГС обнаруживалась в печени около 50% инфицированных AFC8-hu HSC/Нер мышей (рис. 16а), но обнаружить ВГС в крови инфицированных мышей не удавалось. В качестве контроля, была тестирована печень контрольно-инфицированных AFC8-hu HSC/Нер мышей и ВГС-инфицированных AFC8 мышей, не подвергшихся трансплантации гепатоцитов человека. Ни в одном контрольном образце РНК ВГС не была обнаружена (рис. 16а).

Рисунок 16. ВГС инфицирование в AFC8-hu HSC/Нер мышах.
При исследовании АЛТ в крови AFC8-hu HSC/Нер мышей в различное время после инфицирования ВГС, значительное повышение её уровня было обнаружено через 2-4 недели после заражения, что не отмечено ни у одной контрольной мыши (рис. 16б). В соответствии с повышенным уровнем АЛТ, наблюдалась значительная лимфоцитарная инфильтрация в печени ВГС-инфицированных AFC8-hu HSC/Нер мышей, включающая увеличение числа CD45+ лейкоцитов человека, в том числе CD68+ макрофагов и CD3+ Т-клеток. При анализе фенотипа моноцитарных клеток, выделенных из печени, обнаружено увеличение уровня нескольких субпопуляций лейкоцитов человека, в том числе CD3+CD4+ и CD3+CD8+ Т-клеток, CD3-CD56+ естественных киллеров и ПДК (CD123+CD4+CD3-). Аналогичная инфильтрация отмечена у ВГС-инфицированных пациентов (Ahlenstiel G., 2009; Ulsenheimer A., 2005; Yoshizawa K., 2010). Таким образом, AFC8-hu HSC/Hep мыши в состоянии развивать ВГС-инфекцию в печени, что ведет к её инфильтрации и функциональному нарушению.
ВГС-инфекция индуцирует ВГС-специфический человеческий Т-клеточный иммунный ответ. Для характеристики человеческого Т-клеточного ответа у ВГС-инфицированных AFC8-hu HSC/Нер мышей, клетки селезенки и ЛУ, полученных из контрольно- или ВГС-инфицированных мышей были стимулированы ФГА в течение 12-16 часов, с последующим определением экспрессии человеческих эффекторных цитокинов (ИЛ-2, ИФН- и ФНО-) в CD4+ и CD8+ Т-клетках. Наблюдалось значительное повышение уровня всех трех цитокинов как на CD4+ (рис. 17а) так и CD8+ (рис. 17б) Т-клетках от ВГС-инфицированных AFC8-hu HSC/Нер мышей. Таким образом, ВГС инфекция активирует человеческий Т-клеточный иммунный ответ у AFC8-hu HSC/Нер мышей.

Рисунок 17. ВГС-инфекция индуцирует ВГС-специфический человеческий Т-клеточный иммунный ответ.
Для выявления ВГС-специфического Т-клеточного ответа, клетки селезенки и ЛУ, полученные от контрольно- или ВГС-инфицированных мышей стимулировались панелью перекрывающихся пептидов core-белка ВГС в присутствии анти-CD28 МАТ. Через 8-10 дней культивирования наблюдалось увеличение CD3+ клеток человека в 4-5 раз в ВГС-инфицированных мышах по сравнению с контрольными мышами. При повторной стимуляции той же панелью пептидов core-белка ВГС, человеческие CD4+ (рис. 18а) и CD8+ (рис. 18б) Т-клетки от ВГС-инфицированных мышей отвечали продукцией ИЛ-2, ИФН-, и ФНО-. Таким образом ВГС инфекция в AFC8-hu HSC/Нер мышах индуцирует специфический человеческий Т-клеточный ответ на антигены ВГС.

Рисунок 18. ВГС-инфекция индуцирует ВГС-специфический человеческий Т-клеточный иммунный ответ (по оси Y показан % T-клеток продуцирующих указанные цитокины: CD4+ (справа) и CD8+ (слева)).
Развитие фиброза печени у AFC8-hu HSC/Нер мышей, инфицированных ВГС. Для ответа на вопрос, приводит ли экспериментальная ВСГ-инфекция в данной модели к характерным патологическим изменениям, было проведено гистологическое и иммуногистохимическое исследование печени инфицированных AFC8-hu HSC/Нер мышей. Около 50% ВГС-инфицированных AFC8-hu HSC/Нер мышей развивало тяжелый фиброз всей паренхимы печени, тогда как у контрольно-инфицированных AFC8-hu HSC/Нер мышей и ВГС-инфицированных AFC8 мышей без пересадки человеческих клеток фиброза не отмечалось. Инфильтрация печени человеческими CD45+ клетками была локализована в фиброзных регионах. В отсутствие функциональной иммунной системы, Alb-uPA/SCID и Fah-Rag2-C-нуль мыши с пересаженными гепатоцитами человека, обеспечивают поддержание ВГС инфекции, но не демонстрируют наличие существенных признаков фиброза печени (Shoukry N.H., 2003; Maeda N., 2004). Нами, также, была исследована патология печени у пяти ВГС инфицированных AFC8-hu мышей с пересаженными гепатоцитами взрослого человека (без гемопоэтических клеток), и не выявлено значительного фиброза печени. Только у двух из 5 мышей, неожиданно умерших и исследованных через 12-24 часов после смерти, были выявлены фибротические изменения низкой степени.
У человека, ВГС инфекция вызывает активацию звездчатых клеток печени, что вносит свой вклад в развитие фиброза печени (Bataller R., 2004). Нами проводилась иммуногистохимия срезов печени с мышиными анти-человеческими МАТ к -актину гладких мышц (SMA) для выявления активированных звездчатых клеток. В печени ВГС-инфицированных AFC8-hu HSC/Нер мышей были обнаружены активированные звездчатые клетки. Известно, что активированные звездчатые клетки также экспрессируют белки внеклеточного матрикса Col1A1 и TIMP1, которые ингибируют деградацию внеклеточного матрикса и разрешение фиброза (Yoshiji H., 2002). Нами, в свою очередь, была проанализирована экспрессия этих генов в печени с человеко-специфичными и мышино-специфичными праймерами ПЦР. В результате в печени некоторых ВГС-инфицированных AFC8-Hu HSC/Hep мышей была выявлена специфическая индукция человеческого TIMP1 и человеческого COL1A1, но не мышиных генов фиброза. Эти результаты позволяют предположить, что ВГС инфекция активирует звездчатые клетки человека и индуцирует экспрессию человеческих генов фиброза в химерной печени AFC8-hu HSC/Нер мышей.
Таким образом, в настоящей части работы приводятся данные о новой мышиной модели, которая обеспечивает эффективное приживление и функцию, как иммунных клеток, так и клеток печени человека. BALB/C RAG2-C-ноль мыши с трансгеном AFC8 позволяют индуцировано деплецировать мышиные гепатоциты. В дополнение к наличию клеток иммунной системы человека в лимфоидных органах и печени, печень AFC8-hu HSC/Hep мышей также эффективно заселяется гепатоцитами, экспресирующими альбумин человека. Инфицирование мышей AFC8-hu HSC/Hep вирусом гепатита С позволяет развить персистирующую ВГС инфекцию, которая индуцирует ВГC-специфический человеческий иммунный ответ, инфильтрацию печени, развитие гепатита и фиброза. Возможность инфицирования ВСГ и наличие специфического иммунного ответа определяет данную модель как уникальную, на сегодняшний день, iv vivo модель изучения гепатотропных инфекций человека.
- Разработка подходов к иммуномодулирующей таргетной вакцинотерапии тяжелых инфекционных заболеваний
Хроническое инфицирование ВГВ и ВГС приводит к таким заболеваниям печени, как цирроз и гепатоцеллюлярная карцинома (Dustin L.B., 2007). ААВ так же как и ВГВ и ВГС, может вызывать персистирующую инфекцию в печени (Li H., 2007). Механизмы, с помощью которых эти вирусы могут уклоняться от Т-клеточного ответа хозяина, и как следствие персистировать в печени, не ясны. Можно предположить наличие функциональных нарушений Т-клеток при инфицировании ААВ, что приводит к персистенции инфекции по аналогии с ВГВ и ВГС инфекцией (Dobrzynski E., 2004; Lin S.W., 2007).
Клеточный рецептор LIGHT входит в состав суперсемейства ФНО и взаимодействует с рецепторами LTR (Crowe P.D., 1994) и HVEM (Zhai Y., 1998). Введение аденовирусного вектора, экспрессирующего LIGHT (Aд-LIGHT), в опухолевые ткани приводит к генерации опухолево-специфических цитотоксических лимфоцитов (ЦТЛ) и отторжению первичных и метастазирующих опухолевых клеток в периферических тканях мышей (Yu P., 2007). Стимуляция рецептора HVEM молекулой LIGHT ко-стимулирует активацию Т-клеток (Tamada K., 2000). Блокировка взаимодействия LIGHT с рецепторами LTR или HVEM растворимыми гибридными белками HVEM-Fc или LTR-Fc, значительно снижает иммунный ответ аллогенных Т-клеток и реципиенто-специфических ЦТЛ в экспериментальной модели РТПХ (Yu P., 2004; Xu Y., 2007).
В печени LTR экспрессируется в клетках Купфера и может быть вовлечен в процесс индукции толерантности Т-клеток (Lee C.M., 2005). Кроме того, LTR также экспрессируется на гепатоцитах, что способствует регенерации печени и поддержанию её гомеостаза (Anders R.A., 2005). У трансгенных мышей, экспрессирующих LT- блокировка сигнала LTR редуцирует воспаление в печени (Haybaeck, J., 2009). Поскольку сигнальный путь LIGHT/LTR-HVEM участвует в модуляции иммунного ответа в печени, целью данного фрагмента исследований было исследование функций этих молекул в печени для изучения возможной индукции иммунной активации путем экспрессирования LIGHT, доставленного в печень с помощью аденовирусного вектора, для разрешения ААВ инфекции.
Aд-LIGHT вызывает очищение от генома аденоассоциированного вируса в печени. Для инфицирования был использован вектор, основанный на ААВ серотипа 8, являющийся гепатотропным in vivo (McCarty, D.M., 2001). Данный вектор включает зеленый флуоресцентный белок (англ. green fluorescent protein, GFP), который активируется промотером U1A, что позволяет регистрировать инфицирование гепатоцитов (Bartlett, J. S., 1996). Нами продемонстрировано, что ААВ инфекция с постоянной экспрессией GFP в печени может быть эффективно реализована, по крайней мере, на 3-месячный срок. Таким образом, AAВ-U1A-GFP создает постоянную экспрессию GFP в печени, без развития значительного воспалительного процесса в этом органе (рис. 19).

Рисунок 19. Экспрессия GFP в печени после AAВ-GFP инфицирования
Сигнальный путь LIGHT/LTR-HVEM вовлечен в процесс рекрутирования иммунных клеток в печени и также в процесс регуляции роста печени. Кроме того, LIGHT является мощным ко-стимулятором Т-клеток. Было предположено, что толерантность Т-клеток, индуцированная инфицированием печени ААВ-GFP, может быть отменена эктопической экспрессией LIGHT в печени. Для проверки этой гипотезы, была изучена возможность индукции активации иммунного ответа, достаточного для очищения печени от ААВ-GFP, путем экспрессии LIGHT в печени. Экспрессия LIGHT достигалась использованием вектора Ад-LIGHT (Yu P., 2007). На первом этапе эксперимента C57/BL6 мыши были инфицированы ААВ-GFP посредством введения последнего в портальную вену. На 18-21 день после инфицирования, различным группам инфицированных мышей вводился Ад-LIGHT, Aд-Контр.-вектор или натрий-фосфатный буфер. На 3-8 неделе после инъекции аденовируса определялась экспрессия GFP и уровень генома AAВ в печени. В группе мышей, получивших Ад-LIGHT, наблюдалось отсутствие экспрессии GFP в печени. В контрольной группе, получившей Aд-Контр.-вектор, экспрессия GFP была снижена по сравнению с мышами, получившими лишь натрий-фосфатный буфер, но не исчезла полностью (рис. 20а). Данная находка была также подтверждена ПЦР, показавшей, что печень мышей, получивших Ад-LIGHT, была полностью очищена от генома AAВ, в то время как он определялся в контрольных группах. Применение комбинаторного белка LTR-Ig во время терапии Ад-LIGHT, блокировало способность Ад-LIGHT очищать печень от инфекции ААВ (рис. 20б).

Рисунок 20. Экспрессия GFP в печени при терапии Ад-LIGHT.
Эти данные демонстрируют, что эктопическая экспрессия молекулы LIGHT в печени приводит к очищению от экспериментальной ААВ инфекции, возможно, путем взаимодействия данной молекулы с LTR.
LIGHT-опосредованное очищение коррелирует с увеличением числа CD8+ эффекторных Т-клеток в печени. Для характеристики иммунных эффекторных клеток, стимулированных молекулой LIGHT, были проанализированы лейкоциты, выделенные из печени и селезенки с помощью проточной цитометрии. Уровень активированных CD4+ Т клеток печени (CD4+CD44+) не был изменен. В то же время было отмечено значительное увеличение процента CD8+CD44+ Т-клеток в печени и селезенке мышей, получивших Aд-LIGHT, по сравнению с группой Aд-Контр мышей. Помимо этого, лейкоциты печени и селезенки были стимулированы анти-CD3 МАТ с последующим определением экспрессии ИФН в Т-клетках. В печени (рис. 21) и селезенке мышей, получивших Aд-LIGHT выявлено значительное увеличение уровня CD8+ИФН+ клеток. В тоже время LIGHT не вызвал повышения экспрессии ИФН в CD4+ клетках ни в печени, ни в селезенке. Этот результат согласуется с данными, демонстрирующими, что LIGHT является одним из костимуляторов CD8+ Т-клеток и вызывает увеличение продукции ИФН этими клетками (Tamada K., 2000; Tamada K., 2000), и что трансгенные CD8+ Т-клетки специфичные для имуногенного пептида овальбумина, трансплантируемые мышам с постоянной экспрессией того же пептида, опосредованной вектором AAВ, экспрессируют ИФН и вызывают поражение печени путем активации купферовских клеток (Giannandrea M., 2009). Чтобы определить, является ли LTR необходимым для LIGHT-опосредованного очищения AAВ, было изучено влияние Aд-LIGHT в LTR-нокаутных мышах. Отмечено, что Aд-LIGHT вызывает очищение AAВ, как у мутантных мышей, так и у мышей дикого типа, что дает основания предположить, что LTR не является критически необходимым для LIGHT-опосредованного очищения AAВ. Соответственно было сделано заключение, что сигнал, отличный от опосредованного взаимодействием LTR-LIGHT, необходим для LIGHT-опосредованной противо-AAВ активности. Вероятно, что взаимодействие LIGHT с HVEM, вносит свой вклад в очищение от ААВ в печени.

Рисунок 21. Ад-LIGHT индуцирует продукцию ИФН в печени.
Таким образом, применение иммуномодулирующей молекулы LIGHT, доставленной аденовирусным вектором у мышей со стойкой аденоассоциированной инфекцией, приводит к очищению аденоассоциированного вируса из печени, что коррелирует с повышенным уровнем CD8+ эффекторных Т-клеток. Применение белка LTR–Ig блокирует данную деятельность LIGHT. Эти данные позволили разработать новый подход иммуномммуномодулирующей таргетной терапии, основанной на аденовирусно-векторной ко-экспрессии LIGHT и специфического антигена инфекций, вызываемых ВИЧ, ВГС, ВГБ и ВЭБ-ассоциированных лимфом.
ЗАКЛЮЧЕНИЕ
Данная работа посвящена разработке современных in vivo моделей заболеваний человека. Предпосылкой данных исследований является отсутствие на сегодняшний день в арсенале экспериментальной медицины доступных и адекватных моделей заболеваний в основном вирусной природы, в связи с видоспецифичностью этиологического агента. Недавнее развитие в создании улучшенных линий иммунодефицитных мышей-реципиентов позволяет осуществлять ныне успешную ксенотрансплантацию клеток-предшественниц тканей человека. Используя данный подход, нами были разработаны две модели гуманизированных мышей и изучены некоторые аспекты иммунопатогенеза таких заболеваний как инфекции ВИЧ и ВГС. Настоящее исследование является одним из первых, которое, совместно с работами других исследователей, стремительно развивается, в последнее время, в отдельную перспективную область экспериментально-практической медицины – использование гуманизированных лабораторных животных. Спектр использования данных моделей крайне широк, от инфекционных до соматических заболеваний, и позволяет изучение, как всех уровней патогенеза, так и тестирование терапевтических тактик. Естественно гуманизированные модели не являются точным отображением процессов, происходящих в человеческом организме в норме и патологии, но работы над усовершенствованием их адекватности постоянно проводятся в коллективах, вовлеченных в данную область.
В целом, данное исследование демонстрирует необходимость дальнейшего развития гуманизированных мышиных моделей для изучения патогенеза различных патологических процессов, терапевтических подходов и возможностей экстраполяции результатов фундаментальных исследований данной экспериментальной области в клиническую практику.
ВЫВОДЫ
- В центральных и периферических органах иммунной системы гуманизированной (RAG2/C-/-)-hu (ДНО-hu) мышиной модели развивается эффективный и стабильный гемопоэз человека с наличием функциональных Т- и В-лимфоцитов, а также Т-регуляторных (FoxP3+), миелоидных и дендритных клеток, включающих плазмоцитоидные дендритные клетки.
- Инфицирование ДНО-hu мышей ВИЧ-1 приводит к персистирующей, длительной (до 1 года) ВИЧ инфекции с высокой стабильной виремией в периферической крови и лимфоидных органах и снижением числа (деплецией) человеческих CD4+ Т-лимфоцитов в дозо- и вирусозависимой манере, что соответствует критериям ВИЧ-инфекции человека и, следовательно, позволяет считать ДНО-hu мышей адекватной, эффективной и уникальной экспериментальной in vivo моделью человеческого гемопоэза, позволяющей изучать патогенез и методы терапии ВИЧ-1 инфекции.
- Т-регуляторные клетки преимущественно инфицируются и деплецируются патогенными ВИЧ-1 изолятами в ДНО-hu модели. Экспериментальное удаление Трег клеток из лимфоцитарного пула зараженных мышей, приводит к редукции вирусной нагрузки, что подчеркивает важность Трег клеток в патогенезе ВИЧ-1 инфекции.
- ВИЧ-1 эффективно инфицирует плазмоцитоидные дендритные клетки костного мозга и селезенки в ранней стадии ВИЧ-1 инфекции in vivo и вызывает активацию этих клеток, что способствует активации и деплеции CD4+ Т-клеток.
- Заражение плазмоцитоидных дендритных клеток в ранней стадии ВИЧ-1 инфекции не приводит к снижению уровня этой популяции в периферической крови и лимфоидных органах, но быстро вызывает их функциональные нарушения, выражающиеся в сниженной способности к выработке интерферона в ответ на стимуляцию TLR7 и TLR9.
- Сконструирована принципиально новая гуманизированная мышиная модель (AFC8-hu HSC/Hep), которая обеспечивает эффективное приживление и функцию как иммунных клеток, так и клеток печени человека, являясь, на сегодняшний день, первой оригинальной гуманизированной мышиной моделью с человеческой иммунной системой и клетками печени.
- Инфицирование AFC8-hu HSC/Hep мышиной модели вирусом гепатита С (ВГС) позволяет развить персистирующую инфекцию, которая индуцирует ВГС-специфический человеческий иммунный ответ (включающий ответ Т-клеток, макрофагов, дендритных клеток и натуральных киллеров), инфильтрацию печени, развитие гепатита и фиброза, то есть моделирует течение инфекции ВГС человека. Развитие ВГС-индуцированного фиброза, коррелирует с активацией звездчатых клеток и экспрессией генов фибриногена человека, что позволяет предложить данную модель как модель для изучения патогенеза фиброза печени.
- Эктопическая экспрессия молекулы LIGHT вызывает специфическую иммуномодуляцию, заключающуюся в стимуляции уровня CD8+ эффекторных Т-клеток в печени и приводящую к разрешению экспериментальной инфекции печени, что является основанием для дальнейшей разработки подобных терапевтических вакцин для терапии гепатотропных и, возможно, других персистирующих инфекций.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- ДНО-hu модель является наиболее адекватной in vivo моделью человеческого гемопоэза и может быть рекомендована для изучения роли Т-клеток, Т-регуляторных клеток и плазмоцитоидных дендритных клеток в функционировании иммунной системы человека в норме и патологии.
- ДНО-hu модель может быть рекомендована для in vivo изучения ВИЧ инфекции, включая тестирование противовирусных препаратов и инновационных терапевтических методик (терапевтических вакцин).
- Новейшая AFC8-hu HSC/Hep модель может быть рекомендована к использованию для in vivo изучения гепатотропных инфекций (ВГС и ВГВ), коинфекций с ВИЧ, вирус-индуцированных и других фиброзов печени, превентивной и терапевтической вакцинации против данных инфекций.
- Дальнейшее улучшение гуманизированных моделей мышей с использованием трансплантации различных тканевых стволовых клеток позволит расширить «гуманизацию» данной модели за счет развития большего числа человеческих тканей, органов и систем, что в свою очередь значительно расширит спектр их применения в клинических исследованиях.
Список работ, опубликованных по теме диссертации:
- Franklin D.S., Godfrey V.L., Lee H., Kovalev G.I., Schoonhoven R., et al. CDK inhibitors p18(INK4c) and p27(Kip1) mediate two separate pathways to collaboratively suppress pituitary tumorigenesis. Genes and Development 1998,12: 2899-2911.
- Kovalev G., Duus K., Wang L., Lee R., Bonyhadi M., et al. Induction of MHC> Journal of Immunology 1999, 162: 7555-7562.
- Kovalev G.I., Franklin D.S., Xiong Y., Su L. Coordination of T cell responses by CDK inhibitors p18(INK4c) and p27(Kip1). Blood 1999, 94: 2.
- Simon T.D., Kovalev G.I., Coffield V.M., Su L. Regulation of the hematopoietic stem/progenitor cell subsets in mouse bone marrow by the CDK inhibitor p18(INK4c). Experimental Hematology 2000, 28: 910.
- Duus K.M., Miller E.D., Smith J.A., Kovalev G.I., Su L. Separation of human immunodeficiency virus type 1 replication from nef-mediated pathogenesis in the human thymus. Journal of Virology 2001, 75: 3916-3924.
- Kovalev G.I., Franklin D.S., Coffield V.M., Xiong Y., Su L. An important role of CDK inhibitor p18(INK4c) in modulating antigen receptor-mediated T cell proliferation. Journal of Immunology 2001, 167: 3285-3292.
- Gebuhr T.C., Kovalev G.I., Bultman S., Godfrey V., Su L., et al. The role of Brg1, a catalytic subunit of mammalian chromatin-remodeling complexes, in T cell development. Journal of Experimental Medicine 2003, 198: 1937-1949.
- Kovalev G., Simon T., Franklin D., Su L. Collaborative role of CDK inhibitors p18Ink4c and p27Kip1 in regulation of thymocytes homeostasis. Faseb Journal 2003, 17: C6-C6.
- Krishnamurthy J., Torrice C., Ramsey M.R., Kovalev G.I., Al-Regaiey K, et al. Ink4a/Arf expression is a biomarker of aging. Journal of Clinical Investigation 2004, 114: 1299-1307.
- Rowell E., Wang L.Q., Kovalev G., Su L.S., Hancock W., et al. The cyclin-dependent kinase inhibitor p18ink4c inhibits T cell apoptosis and opposes transplantation tolerance induced by costimulatory blockade. American Journal of Transplantation 2004, 4: 522.
- Rowell E., Wang L., Kovalev G., Su L., Hancock W., et al. The cyclin-dependent kinase inhibitors p18INK4C and p27KIPI play distinct and opposing roles in allograft tolerance induced by costimulatory blockade. American Journal of Transplantation 2005, 5: 894.
- Rowell E., Wang L.Q., Kovalev G., Su L., Hancock W., et al. Opposing roles for the cyclin-dependent kinase inhibitors p18ink4c and p27kip1 in allograft tolerance induced by costimulatory blockade. Faseb Journal 2005, 19: A907-A907.
- Kovalev G.I., Simon T.D., McNeil Coffield V., Xiong Y., Franklin D.S., Su L. Control of thymocyte proliferation and thymus organ size by CDK inhibitors P18INK4c and P27KIP1. Journal of Stem Cells 2006, 1(2): 97-108.
- Zhang L., Kovalev G.I., Su L. HIV-1 infection and pathogenesis in a novel humanized mouse model. Blood 2007, 109: 2978-2981.
- Jiang Q., Zhang L., Wang R., Jeffrey J., Washburn M.L., Brouwer D., Barbour S., Kovalev G.I. et al. FoxP3+CD4+ regulatory T cells play an important role in acute HIV-1 infection in humanized Rag2-/-gammaC-/- mice in vivo. Blood 2008, 112: 2858-2868.
- Lu X., Kovalev G.I., Chang H., Kallin E., Knudsen G., et al. Inactivation of NuRD component Mta2 causes abnormal T cell activation and lupus-like autoimmune disease in mice. Journal of Biological Chemestry 2008, 283: 13825-13833.
- Ковалев Г.И. Экспериментальная мышиная модель человеческого гемопоэза для изучения лимфотропных инфекций. ГЕМАТОЛОГИЯ И ТРАНСФУЗИОЛОГИЯ 2008, 6: 27-30.
- Washburn M.L., Kovalev G.I., Koroleva E., Fu Y.X., Su L. LIGHT induces distinct signals to clear an AAV-expressed persistent antigen in the mouse liver and to induce liver inflammation. PLoS One 2010, 14;5(5): e10585.
- Washburn M.L., Bility M.T., Zhang L., Kovalev G.I., Buntzman A., et al. A Humanized Mouse Model to Study Hepatitis C Virus Infection, Immune Response, and Liver Disease. Gastroenterology 2011, 140(4):1334-44.
- Zhang L., Jiang Q., Li G., Jeffrey J., Kovalev G.I., et al. Efficient infection and impairment of pDC in the bone marrow and peripheral lymphoid organs during early HIV-1 infection in humanized rag2-/-gammaC-/- mice in vivo. Blood 2011, 117(23):6184-92.
- Nunoya J., Washburn M., Kovalev G., Su L.. Depletion of regulatory T cells (Tregs) during HIV infection leads to enhanced liver pathogenesis. 3rd International Workshop on Humanized Mice, Pittsburg, PA. 2011: 130
- Zhang L., Jiang Q., Guangming L., Jeffrey J., Kovalev G.I., Su L. Efficient infection, activation, and impairment of pDCs in the BM and peripheral lymphoid organs during early HIV-1 infection in humanized rag2-/- C-/- mice in vivo. 3rd International Workshop on Humanized Mice, Pittsburg, PA. 2011: 126
- Bility M.T., Luan Y., Zhang L.. Li F., Chi L., Curtis A., Kovalev G., Su L. HBV infection and immunopathogenesis in humanized mouse model. HepDART 2011 symposium, Koloa, Hawaii, 2011: 50
- Bility M.T., Zhang L., Washburn M.L., Curtis T.A., Kovalev G.I., Su L. Generation of a humanized mouse model with both human immune system and liver cells to model hepatitis C virus infection and liver immunopathogenesis. Nature Protocols 2012, Sep;7(9):1608-17.
Список сокращений
AAВ - аденоассоциированный вирус (вектор)
Aд - аденовирус
АПК - антигенпрезентирующие клетки
ВГВ - вирус гепатита В
ВГС - вирус гепатита С
ВПГ – вирус простого герпеса
ВЭБ - вирус Эпштэйна-Барр
ГСК - гемопоэтические стволовые клетки
ДНО-hu модель – двойная нокаутированная гуманизированная мышиная модель
ИЛ-2,4,7 - интерлейкин
ИФН-, - интерферон
ЛУ - лимфатические узлы
МАТ – моноклональные антитела
ПДК - плазмоцитоидные дендритные клетки
СЭВ - Стафилококковый энтеротоксин В
Трег - Т-регуляторные клетки
ФНО - - фактор некроза опухоли
AFC8 – комбинированный ген контролируемый альбуминовым промотором
AFC8-hu HSC/Hep - гуманизированная мышиная модель с человеческой печенью и гемопоэзом
BDCA2 – (англ., - blood dendritic cell antigen 2) – маркер плазмоцитоидных дендритных клеток
CCR5 – хемокиновый рецептор
CFSE (англ., Carboxyfluorescein succinimidyl ester) – клеточный поверхностный краситель позволяющий определять деление клетки.
CXCR4 - хемокиновый рецептор
GFP - (англ., green fluorescence protein) – зеленый флуоресцентный белок
HVEM - костимуляционная иммуномодулирующая молекула экспрессированная на поверхности клеток
IL7R – рецептор к интерлейкину 7
LIGHT – костимуляционная иммуномодулирующая молекула экспрессированная на поверхности клеток
Rag2-/-C-/- – двойной нокаут генов Rag2 и общей С цепи рецепторов цитокинов
TLR (англ., Toll-like receptor) - Толл-подобный рецептор

