Использование высокоинтенсивного лазерного излучения в лапароскопической хирургии
На правах рукописи
Пряхин
Александр Николаевич
ИСПОЛЬЗОВАНИЕ ВЫСОКОИНТЕНСИВНОГО ЛАЗЕРНОГО
ИЗЛУЧЕНИЯ В ЛАПАРОСКОПИЧЕСКОЙ ХИРУРГИИ
14.00.27 – хирургия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Челябинск – 2008
Работа выполнена в Государственном образовательном учреждении дополнительного профессионального образования «Уральская государственная медицинская академия дополнительного образования Федерального агентства по здравоохранению и социальному развитию» на кафедре хирурги и эндоскопии и в Областном государственном учреждении здравоохранения Центре организации специализированной медицинской помощи «Челябинский государственный институт лазерной хирургии».
Научный консультант:
доктор медицинских наук, профессор Совцов Сергей Александрович
Официальные оппоненты:
доктор медицинских наук, профессор Лисиенко Валентина Михайловна
доктор медицинских наук, профессор Привалов Валерий Алексеевич
доктор медицинских наук, профессор Пышкин Сергей Александрович
Ведущая организация: Государственное образовательное учреждение высшего профессионального образования «Башкирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Защита состоится 20 июня 2008 г. в 10 часов на заседании диссертационного совета Д 208.117.01 при Государственном образовательном учреждении высшего профессионального образования «Челябинская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию» по адресу: 454092, г. Челябинск, ул. Воровского, 64.
С диссертацией можно ознакомиться в библиотеке Государственного образовательного учреждения высшего профессионального образования «Челябинская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию»
Автореферат разослан «_____»_________________2008 г.
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор Долгушина В.Ф.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Одним из наиболее значимых событий последних десятилетий в медицине стало бурное развитие и внедрение в широкую клиническую практику лапароскопических технологий, коренным образом изменивших облик современной хирургии. В настоящее время малоинвазивные вмешательства используются практически во всех областях абдоминальной хирургии (Франтзайдес К., 2000). Наиболее широко лапароскопический доступ применяется при выполнении холецистэктомий, биопсий, фенестраций кист печени, фундопликаций, ваготомий, аппендэктомий, герниопластик паховых грыж (Борисов А.Е., 2002).
На сегодняшний день в эндоскопической хирургии для диссекции тканей и остановки кровотечения наиболее часто используется высокочастотная электроэнергия. В тоже время мировой опыт, накопленный в последние десятилетия, показал, что электрохирургия может быть источником серьезных осложнений, частота которых варьирует от 0,5 до 12% с летальностью до 11% (Антюхин К.Э. и соавт., 2007; Крапивин Б.В. и соавт., 2001; Nduka C.C. et al., 1994). К нежелательным эффектам электрохирургии относят ожоги тканей, поражение электрическим током, при которых могут пострадать как больной, так и медицинский персонал. Половина повреждений происходят в руках опытных хирургов, которые уже выполнили более 100 лапароскопических операций (Федоров И.В., Попов В.Я., 2003; Tucker, R.D. et al., 1995).
Высокоинтенсивное лазерное излучение успешно используется в отрытой абдоминальной хирургии уже более 40 лет (Скобелкин О.К., 1989). С появлением в 90-х годах прошлого века портативных и простых в эксплуатации диодных лазеров существенно расширился диапазон длин волн лазерного излучения, повысилась надежность лазерных приборов, снизилась их стоимость (Минаев В.П., 2005; Неворотин А.И., 2000).
В лапароскопической хирургии применение высокомощных лазеров пока ограничено (Гейниц А.В., 2005). До настоящего времени не разработана техника лапароскопических вмешательств с использованием лазерного луча, не определены оптимальные режимы лазерного воздействия, далеки от совершенства инструменты для выполнения эндоскопических операций с использованием высокоинтенсивного лазерного излучения.
Сегодня идеальная лапароскопическая операция представляется вмешательством с прецизионным выделением, пересечением и анастомозированием всех анатомических структур, с минимальной кровопотерей и невысокой частотой инфекционных осложнений (Седов В.М., Стрижелецкий В.В., 2002). С целью повышения качества выполняемых эндоскопических операций, снижения количества осложнений необходимо совершенствование имеющихся и поиск новых методов диссекции тканей и остановки кровотечения (Брехов Е.И. и соавт., 2001).
Цель исследования: улучшение результатов лапароскопических операций путем разработки и внедрения в клиническую практику новых способов оперирования с использованием высокоинтенсивного лазерного излучения ближнего инфракрасного диапазона.
Задачи исследования.
- Изучить непосредственные результаты лапароскопических операций (холецистэктомий, биопсий печени, фенестраций кист печени, ваготомий, фундопликаций, герниопластик паховых грыж, аппендэктомий, удалений сальниковых отростков сигмовидной кишки) с использованием высокочастотной электроэнергии в клинике.
- Определить в эксперименте на животных оптимальные режимы воздействия высокоинтенсивного лазерного излучения ближнего инфракрасного диапазона на ткани печени, стенки желудка, толстого кишечника, брюшной стенки для выполнения с их помощью лапароскопических операций в клинике.
- Провести сравнительный анализ морфологических изменений в тканях печени, стенки желудка и толстой кишки экспериментальных животных (собак) после воздействия высокочастотной электроэнергии и высокоинтенсивного лазерного излучения на сроках от 1 до 30 суток.
- Разработать новые инструменты для выполнения малоинвазивных вмешательств с использованием высокоинтенсивного лазерного излучения.
- На основе результатов экспериментального исследования разработать и внедрить в клиническую практику методики лапароскопических операций с использованием высокоинтенсивного лазерного излучения.
- Провести сравнительный анализ непосредственных результатов лапароскопических вмешательств с использованием высокомощных лазерных приборов и электрохирургических аппаратов в клинике.
- На основе полученных результатов проведенного исследования предложить оптимальные способы диссекции тканей и остановки кровотечения при выполнении лапароскопических операций.
Научная новизна работы. Опытным путем на основе сравнительных морфологических исследований определены оптимальные параметры воздействия высокоинтенсивного лазерного излучения для диссекции тканей и осуществления гемостаза при выполнении лапароскопических вмешательств на органах брюшной полости: холецистэктомии, биопсии печени, фенестрации кист печени, фундопликации, селективной ваготомии, аппендэктомии, герниопластики паховых грыж, удалении сальниковых отростков сигмовидной кишки.
Для повышения надежности гемостаза и желчестаза при проведении лапароскопической холецистэктомии разработан и внедрен в клиническую практику оригинальный способ обработки ложа желчного пузыря с использованием высокоинтенсивного лазерного излучения (патент РФ на изобретение № 2221607).
Доказана высокая эффективность нового способа обработки культи червеобразного отростка с использованием высокоинтенсивного лазерного излучения (патент РФ на изобретение № 2264192) за счет снижения количества интраоперационных и послеоперационных осложнений при выполнении лапароскопической аппендэктомии.
Разработанные и внедренные в клиническую практику новые хирургические инструменты для выполнения лазерной диссекции тканей и остановки кровотечения (патенты РФ на полезную модель № 46915, 51336, 58332, 58336) позволили повысить скорость рассечения и коагуляции тканей, надежность гемостаза, безопасность эндоскопических операций с применением высокоинтенсивного лазерного излучения.
На полученном экспериментальном и клиническом материале доказано, что использование высокоинтенсивного лазерного излучения вместо высокочастотной электроэнергии позволило уменьшить нежелательное термическое повреждение тканей и органов брюшной полости, ускорить репаративные процессы в ранах, снизить риск возникновения интраоперационных и послеоперационных осложнений при выполнении лапароскопических холецистэктомий, биопсий печени, фенестраций кист печени, фундопликаций, селективных ваготомий, аппендэктомий, герниопластик паховых грыж, удалений сальниковых отростков сигмовидной кишки.
Практическая ценность работы. В результате применения лазерных технологий удалось улучшить непосредственные результаты малоинвазивных вмешательств у больных с желчнокаменной болезнью, истинными непаразитарными кистами печени, грыжами пищеводного отверстия диафрагмы, язвенной болезнью двенадцатиперстной кишки, острым аппендицитом, паховыми грыжами, заворотом сальниковых отростков сигмовидной кишки.
Предложенные режимы воздействия высокоинтенсивного лазерного излучения для диссекции тканей и осуществления гемостаза позволяют существенно уменьшить термическую травму тканей при выполнении лапароскопических вмешательств.
Использование новых способов обработки ложа желчного пузыря и культи червеобразного отростка оптимизирует и упрощает технику лапароскопических холецистэктомий и аппендэктомий, повышая их безопасность.
Применение новых инструментов в ходе эндоскопических вмешательств позволяет сократить время выполнения диссекции тканей и гемостаза, упростить технику операций, снизить риск интраоперационных осложнений.
Основные положения, выносимые на защиту.
- Использование высокоинтенсивного лазерного излучения ближнего инфракрасного диапазона вместо высокочастотной электроэнергии при выполнении лапароскопических холецистэктомий, биопсий печени, фенестраций кист печени, фундопликаций, селективных ваготомий, аппендэктомий, герниопластик паховых грыж, удалений сальниковых отростков сигмовидной кишки приводит к существенному улучшению непосредственных результатов операции и позволяет снизить количество интраоперационных и послеоперационных осложнений за счет уменьшения термической травмы тканей в ходе их диссекции и осуществления гемостаза, и более благоприятного течения репаративных процессов в ранах.
- Предложенные режимы воздействия высокоинтенсивного лазерного излучения позволяют выполнять эффективную диссекцию и адекватный гемостаз с минимальным термическим повреждением окружающих тканей в ходе лапароскопических операций.
- Применение оригинальных инструментов и методик операций расширяет возможности лазерных технологий в лапароскопической хирургии, упрощает технику операции, уменьшает риск возникновения осложнений при выполнении малоинвазивных вмешательств.
Внедрение результатов исследования. Результаты исследования используются в повседневной работе ОГУЗ «Челябинский государственный институт лазерной хирургии», в хирургических отделениях МУЗ ГКБ № 3 и 6 г. Челябинска, АНО МСЧ АГ и ОАО «ММК» г. Магнитогорска, ЗАО МСЧ «НЕФТЯНИК» г. Тюмень, Областной клинической больницы г. Оренбурга, МУЗ ЦГБ г. Верхнего Уфалея, в учебном процессе на кафедре хирургии и эндоскопии ГОУ ДПО «Уральская государственная медицинская академия дополнительного образования Росздрава».
Апробация работы. Основные положения по теме диссертации доложены и обсуждены на: Межрегиональной научно-практической конференции “Хирургия деструктивного холецистита” (Екатеринбург, 2002); Международном хирургическом конгрессе “Актуальные проблемы современной хирургии” (Москва, 2003); Научно-практической конференции молодых ученых “Актуальные вопросы клинической и экспериментальной медицины” (Санкт-Петербург, 2003); Первой научно-практической конференции Северо-Западного региона РФ с международным участием “Высокие хирургические, лазерные и информационные технологии” (Санкт-Петербург, 2003); V научно-практической конференции “Современные технологии в медицине” (Нягань, 2003); Международном хирургическом конгрессе “Новые технологии в хирургии” (Ростов-на-Дону, 2005); Уральской межрегиональной научно-практической конференции “Хирургия минидоступа” (Екатеринбург, 2005); Научно-практической конференции “Актуальные проблемы медицинской науки, технологий и профессионального образования” (Челябинск, 2005); VI Московском международном салоне инноваций и инвестиций – лауреат (Москва, 2006); V конференции общества герниологов “Актуальные вопросы герниологии” (Москва, 2006); 7-ом Международном конгрессе Интернациональной Гепато-панкреато-билиарной Ассоциации (Эдинбург, 2006); XIII Международном конгрессе хирургов-гепатологов России и стран СНГ (Алматы, 2006); Научно-практической конференции “Инженерия и инновационные технологии в медицине” (Екатеринбург, 2006); XI Московском международном конгрессе по эндоскопической хирургии (Москва, 2007); Научно-практической конференции “Новые технологии в здравоохранении” (Челябинск, 2007); Российской научно-практической конференции “Актуальные вопросы неотложной хирургии” (Курск, 2007); трех заседаниях хирургического общества г. Челябинска в 2006, 2007 г.г.
Публикации, изобретения и рационализаторские работы. По теме диссертации опубликовано 40 научных работ, издано 3 учебных пособия для врачей, получено 2 патента на изобретения и 4 патента на полезные модели.
Объем и структура работы. Диссертационная работа включает в себя введение, пять глав, заключение, выводы, практические рекомендации, библиографический список из 417 источников (258 отечественных, 159 иностранных). Работа содержит 43 таблицы, 82 рисунка, 4 клинических случая. Диссертация оформлена в программе Microsoft Word 2002, отпечатана на 295 страницах машинописного текста.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Экспериментальное исследование выполнено в ОГУЗ Центре организации специализированной медицинской помощи «Челябинский государственный институт лазерной хирургии». Эксперимент проведен на 95 половозрелых беспородных собаках с массой тела 1215 кг с соблюдением правил гуманного обращения с животными (приложение к приказу МЗ СССР № 775 от 12.09.77).
На 5 животных были определены оптимальные режимы воздействия высокоинтенсивного лазерного излучения на ткани печени, стенки желудка, толстой кишки, брюшной стенки.
Моделирование операций с последующим морфологическим и морфометрическим исследованиям препаратов выполнено на 90 собаках, распределенных в две группы. В основной группе (45 особей) вмешательства производили с помощью высокомощных лазерных приборов. В группе сравнения (45 особей) операции выполняли с применением высокочастотной электроэнергии – наиболее часто используемый метод диссекции тканей и остановки кровотечения в клинической практике. Животным каждой группы выполнили 15 холецистэктомий, 15 серомиотомий передней стенки желудка (моделирование ваготомии по методике Тейлора) и 15 резекций купола слепой кишки (таким способом моделировали аппендэктомию, поскольку у собак нет червеобразного отростка). Животные были выведены из эксперимента на 1-е, 3-е, 7-е, 14-е, 30-е сутки после операций (табл. 1).
Таблица 1
Распределение животных в группах и
сроки выведения их из эксперимента
| Экспериментальные операции | Сроки выведения из эксперимента | |||||
| 1 сутки | 3 сутки | 7 сутки | 14 сутки | 30 сутки | ||
| Холецистэктомия | Основная группа | 3 | 3 | 3 | 3 | 3 |
| Группа сравнения | 3 | 3 | 3 | 3 | 3 | |
| Серомиотомия передней стенки желудка | Основная группа | 3 | 3 | 3 | 3 | 3 |
| Группа сравнения | 3 | 3 | 3 | 3 | 3 | |
| Резекция слепой кишки | Основная группа | 3 | 3 | 3 | 3 | 3 |
| Группа сравнения | 3 | 3 | 3 | 3 | 3 | |
| Итого | 90 | |||||
Для микроскопического исследования забирались фрагменты ткани печени в области ложа желчного пузыря после холецистэктомий, фрагменты передней стенки желудка после серомиотомий и фрагменты стенки слепой кишки после резекции последней. Материал фиксировали в 10%-ном растворе нейтрального формалина, обезвоживали в спиртах возрастающей концентрации и заливали в парафин. Гистологические срезы выполняли строго поперек и перпендикулярно по отношению к поверхности ложа желчного пузыря, стенке желудка и слепой кишки. Данное требование соблюдалось как на этапе вырезки фрагментов тканей, предназначенных для изготовления парафиновых блоков, так и на этапе заливки материала в парафин для последующего получения микротомных срезов. Препараты для световой микроскопии окрашивали гематоксилином и эозином, пикрофуксином по методу Ван-Гизон для выявления коллагеновых волокон и фукселином по Вейгерту для выявления эластических волокон. Для объективизации морфологических изменений на каждом сроке исследования измерялась толщина структурно измененных тканей печени, стенки желудка и слепой кишки после воздействия на них лазерного излучения и высокочастотной электроэнергии. Микроскопические исследования проводились на микроскопе «DMRXA» фирмы «LEIСA» (Германия). Документирование результатов исследования и морфометрия выполнялись с помощью компьютерной программы анализа изображения «ДиаМорф Cito-W» (Россия), совмещенной с микроскопом.
Выбор лазерного прибора осуществлялся, прежде всего, с учетом длины волны излучения квантовых генераторов. Излучение с длиной волны 970 нм хорошо поглощается биотканью, поскольку в диапазоне 970980 нм находится локальный пик поглощения лазерного излучения водой и оксигемоглобином. Зона нагрева не превышает 1 мм, благодаря чему оптимально сочетаются режущие и гемостатические свойства (Берлиен Х.П., 1997; Минаев В.П., 2005; Тучин В.В., 1995). В связи с этим полупроводниковые лазерные приборы «ЛС-0,97-ИРЭ-ПОЛЮС» и «MILON LAHTA» (Россия) с длиной волны излучения 970 нм использовались нами для диссекции тканей.
Излучение с длинами волн 805 и 1064 нм проникает в ткани на глубину до 10 мм с максимальным рассеянием и минимальным поглощением водой и оксигемоглобином, что обеспечивает надежную коагуляцию сосудов с диаметром до 2 мм. При этом спектр поглощения лазерного излучения тканями на этих длинах волн, а, следовательно, и глубина проникновения лазерного луча в ткани существенно не различаются (Берлиен Х.П., 1997; Тучин В.В., 1995). Поэтому для выполнения гемостаза в ранах печени и в ложе желчного пузыря нами были выбраны полупроводниковый лазер «ALTO-3000» (Россия) с длиной волны излучения 805 нм и Nd:YAG лазер «Радуга-1» (Россия) с длиной волны излучения 1064 нм. Предпочтение отдавали диодному лазеру, как наиболее функциональному, компактному и простому в эксплуатации прибору.
Доставка энергии к объектам воздействия производилась с помощью кварц-кварцевых моноволоконных световодов с тефзелевым покрытием с диаметром сердцевины 600 мкм, позволяющих подвести высокоинтенсивное лазерное излучение с длинами волн 805, 970 и 1064 нм через лапароскопический доступ.
Оптимальные режимы воздействия лазерного излучения на ткани были определены путем моделирования отдельных этапов эндоскопических операций, требующих применения квантовых генераторов (табл. 2).
Таблица 2
Оптимальные режимы воздействия лазерного излучения на ткани
| Этапы операций | нм | Режим | Т1/Т2 мс | Р Вт |
| Коагуляция ложа желчного пузыря после холецистэктомии | 1064 805 | Непрерывный Бесконтактный | 712 | |
| Коагуляция раны печени после биопсии | 1064 805 | Непрерывный Бесконтактный | 812 | |
| Коагуляция капсулы печени (моделирование деэпителизации капсулы кист печени) | 970 | Импульсный Бесконтактный | 20/20 | 5 |
| Серомиотомия передней стенки желудка (моделирование этапа ваготомии по Тейлору) | 970 | Импульсный Контактный | 50/50 | 7 |
| Мобилизация дна и кардиального отдела желудка, ножек диафрагмы (моделирование антирефлюксных операций) | 970 | Импульсный Контактный | 50/50 | 7 |
| Диссекция тканей брюшной стенки (моделирование грыжесечений) | 970 | Импульсный Контактный | 50/50 | 7 |
| Коагуляция слизистой оболочки культи слепой кишки (моделирование аппендэктомии) | 970 | Импульсный Бесконтактный | 50/50 | 4 |
| Отсечение сальникового отростка сигмовидной кишки | 970 | Импульсный Контактный | 50/50 | 6 |
Примечание: длина волны излучения; Т1 продолжительность импульса; Т2 продолжительность паузы; Р – средняя мощность излучения: при выполнении гемостаза может изменяться в пределах, указанных в таблице и зависит от вида кровотечения (артериальное, венозное, капиллярное) и диаметра кровоточащего сосуда.
С учетом литературных данных (Игнатьева Е.Н., 2001, Тучин В.В., 1995, 1998), для диссекции тканей изначально был выбран импульсный режим работы лазерных приборов с контактным способом воздействия, поскольку при этом достигается максимальный режущий эффект с минимальным термическим воздействием на окружающие ткани. Для коагуляции тканей и остановки кровотечения использовали непрерывный режим работы квантовых генераторов и бесконтактный способ воздействия, что обеспечивало более глубокий и равномерный прогрев тканей с надежным гемостазом.
Подбор мощности высокоинтенсивного лазерного излучения осуществляли путем постепенного ее увеличения с шагом 1 Вт, начиная с 1 Вт до величины, при которой желаемый клинический эффект от воздействия (диссекция, коагуляция) сопровождался минимальным термическим повреждением окружающих тканей.
Подобранные режимы воздействия высокоинтенсивного лазерного излучения использовались нами в дальнейшем в ходе экспериментальных вмешательств на животных, а затем и при выполнении лапароскопических операций в клинике.
Клиническое исследование выполнено на кафедре хирурги и эндоскопии ГОУ ДПО «Уральская государственная медицинская академия дополнительного образования Росздрава», в хирургических отделениях МУЗ ГКБ № 3 (г. Челябинск) и в клиническом отделении ОГУЗ Центра организации специализированной медицинской помощи «Челябинский государственный институт лазерной хирургии» в период с 2001 по 2007 год. Проведен анализ непосредственных результатов 927 лапароскопических вмешательств. Операции в основной и в сравниваемой группах выполнены одним хирургом (Пряхиным А.Н.), имевшим к моменту начала исследования опыт более 300 лапароскопических вмешательств.
Исследование проспективное, рандомизированное. Рандомизация проводилась с использованием пронумерованных непрозрачных запечатанных конвертов. Конверты вскрывались непосредственно перед операцией.
Критерии включения в исследование: в исследование были включены больные с желчнокаменной болезнью, истинными непаразитарными кистами печени, грыжами пищеводного отверстия диафрагмы, язвенной болезнью двенадцатиперстной кишки, острым аппендицитом, паховыми грыжами, заворотом сальниковых отростков сигмовидной кишки, при хирургическом лечении которых лапароскопические технологии являются методом выбора.
Критерии не включения в исследование: наличие у больных общих или местных противопоказаний к лапароскопической операции либо к использованию высокоинтенсивного лазерного излучения.
Критерии исключения из исследования:
- отказ больного от исследования;
- отказ пациента от рандомизации;
- невозможность больным понять информацию об исследовании (иностранцы, психические расстройства).
Ход исследования: 927 больных были разделены на две группы: основную и сравниваемую. В основную группу (466 человек) вошли больные, которым выполнялись лапароскопические вмешательства с использованием высокоинтенсивного лазерного излучения. Группу сравнения (461 человек) составили пациенты, которым были выполнены лапароскопические операции с использованием высокочастотной электроэнергии. Статистически достоверных различий между группами по основным параметрам (пол, возраст, нозология, давность заболевания) обнаружено не было. В зависимости от нозологии и вида выполненного оперативного вмешательства пациенты разделены на 8 групп (табл. 3).
Лапароскопические операции выполняли с помощью эндовидеохирургических комплексов фирм «REMA» (Германия), «Olympus» (Япония) и «Аксиома» (Россия). В качестве источника высокочастотной электроэнергии использовали электрохирургический генератор Force-300 фирмы «Valleylab» (США) с рабочей частотой в монополярном режиме – 394 кГц, в биполярном режиме – 470 кГц. Применяли минимальные уровни мощности высокочастотного аппарата, при которых достигались адекватная скорость диссекции тканей и надежный гемостаз. Все операции производились под эндотрахеальным наркозом с использованием миорелаксантов.
Таблица 3
Распределение пациентов в зависимости от нозологии и выполненных лапароскопических вмешательств
| Нозология | Вид лапароскопической операции | Количество пациентов | |
| Основная группа n=466 | Группа сравнения n=461 | ||
| Желчнокаменная болезнь | Холецистэктомия всего Холецистэктомия из мини-доступа | 177 29 | 188 26 |
| Непаразитарные кисты печени | Фенестрация кист печени | 21 | 18 |
| Хронический гепатит и цирроз печени | Биопсия печени | 32 | 36 |
| Язвенная болезнь 12-п. кишки | Ваготомия по методике Тейлора | 32 | 29 |
| Грыжи пищеводного отверстия диафрагмы | Фундопликация по методике Тоупе | 18 | 22 |
| Паховые грыжи | Герниопластика паховых грыж | 75 | 52 |
| Острый аппендицит | Аппендэктомия | 107 | 111 |
| Заворот сальниковых отростков сигмовидной кишки | Удаление сальниковых отростков сигмовидной кишки | 4 | 5 |
Высокоинтенсивное лазерное излучение применяли для осуществления гемостаза в ранах печени после биопсий и деэпителизации интрапаренхиматозной части капсулы кист печени в ходе их фенестраций.
Обработку ложа желчного пузыря в ходе лапароскопических холецистэктомий выполняли по оригинальной методике (патент РФ на изобретение № 2221607). Технической особенностью способа является выделение желчного пузыря из ложа лазерным излучением контактным способом или эндоскопическими ножницами с последующей бесконтактной коагуляцией ложа желчного пузыря лазерным лучом.
При выполнении холецистэктомии у пациентов с рубцово-сморщенным желчным пузырем в процессе отделения последнего от печени фиксированные фрагменты его задней стенки оставляли в печеночном ложе с последующей лазерной коагуляцией оставленных фрагментов задней стенки до полного удаления слизистой оболочки желчного пузыря.
В ходе ваготомии по методике Тейлора с использованием квантовых генераторов выполняли переднюю серомиотомию с последующим ушиванием раны желудка непрерывным швом.
При выполнении фундопликации лазерное излучение применяли на этапах мобилизации эзофагокардиального перехода и ножек диафрагмы.
Лазерным лучом производили диссекцию грыжевого мешка при лапароскопической трансбрюшинной преперитонеальной герниопластике паховых грыж с последующей имплантацией полипропиленового сетчатого протеза «Surgipro Mesh» SPМM (фирма Auto Suture) размерами 12х8 см.
В ходе исследования был разработан и внедрен новый способ лапароскопической аппендэктомии (патент РФ на изобретение № 2264192). После мобилизации и лигирования основания червеобразного отростка, последний пересекали эндоскопическими ножницами на 4/5 окружности. Используя непересеченный участок серозно-мышечной оболочки в качестве держалки, выполняли бесконтактную коагуляцию слизистой оболочки культи высокоинтенсивным лазерным излучением. Затем аппендикс полностью отсекали эндоскопическими ножницами и удаляли из брюшной полости.
При удалении сальниковых отростков сигмовидной кишки лазерные приборы применяли для пересечения их сосудистой ножки.
Лапароскопические операции в группе сравнения выполняли по аналогичным методикам, используя вместо лазерного излучения высокочастотную электроэнергию.
В послеоперационном периоде оценивали величину болевого синдрома, количество и характер отделяемого по дренажам. Дважды в сутки в 7 и 18 часов измеряли температуру тела пациента в подмышечной области.
Через сутки после операции всем больным проводили лабораторные исследования, включавшие в себя определение гемоглобина, количества эритроцитов, лейкоцитов в периферической крови, уровня билирубина, аланинаминотрансферазы, аспартатаминотрансферазы, тимоловой пробы.
Материал для бактериологического исследования, взятый из желчного пузыря, его ложа и с культи червеобразного отростка во время холецистэктомий и аппендэктомий, высевали на 5%-кровяной агар и сахарный бульон. На 2-е сутки учитывали результаты посевов на кровяном агаре. В случае бактериального роста подсчитывали количество колоний каждого вида, пересчитывали на 1 мл исследуемого материала и после бактериоскопии окрашенных по Грамму мазков, проводили дальнейшую биохимическую идентификацию культур. Результат посевов считали отрицательным, если в течение пяти суток не обнаруживали роста микрофлоры на сахарном бульоне.
Ультразвуковое исследование выполнялось после холецистэктомий, фенестраций кист печени, биопсий печени на 2-е сутки после операции аппаратом ALOKA ProSound 4000 (Япония) с использованием конвексного датчика с частотой 3,5 МГц. В процессе исследования проводилось документирование результатов с помощью сонопринтера ALOKA 305 E. Во время исследования оценивали состояние печени (размеры, структуру, эхогенность), размеры структурно измененных тканей в области ложа желчного пузыря, удаленных кист и ран печени, состояние желчных протоков; контролировали наличие жидкости в отлогих областях брюшной полости.
Обязательными условиями для перевода пациента на амбулаторное лечение считали:
- нормализацию температуры тела больного;
- восстановление моторной функции желудка и кишечника;
- нормализацию лабораторных показателей крови;
- отсутствие дренажей в брюшной полости;
- отсутствие признаков воспаления со стороны послеоперационных ран;
- отсутствие признаков послеоперационных осложнений по данным ультразвукового исследования.
Пациентам с язвенной болезнью двенадцатиперстной кишки через месяц после операции проводили эзофагогастродуоденоскопию эндоскопами GIF Q40 и EVIS 130 фирмы “Olympus” (Япония) и исследование кислотообразующей функции желудка с помощью прибора DIGITRAPPER MK-III фирмы “Synectics Medical” (Голландия).
Больным с паховыми грыжами на 7-е, 14-е, 30-е, 60-е сутки после гернипластики выполняли ультразвуковое исследование области операции с определением общей площади капиллярного сосудистого русла в зоне имплантированного сетчатого полипропиленового эндопротеза аппаратом Philips HD 11 XE (Германия) линейным датчиком L 12–3 (рабочая частота 3,8 МГц) с использованием режима энергетического допплера.
Полученные данные были обработаны методами вариационной статистики. Производили расчет показателей среднего и стандартного отклонения, относительных величин. Проверку гипотезы о наличии или отсутствии статистически значимых различий данных проводили с применением методов непараметрической статистики, так как распределение признака во всех выборках отличалось от нормального. При сравнении двух средних показателей использовали U-критерий Манна-Уитни. Для оценки различий долевых показателей использовали хи-квадрат Пирсона, а при частоте показателя менее 5 – хи-квадрат с поправкой по Йейтсу. С этой целью применяли универсальную систему обработки данных Microsoft Exсel 2002 и статистический программный пакет анализа данных Statistica 6,0. Различия считались достоверными при p<0,05.
Результаты исследования и их обсуждение
Анализ результатов морфометрического исследования препаратов животных показал, что после воздействия луча лазера, не зависимо от морфологического строения ткани, характера генерации лазерного излучения, ширина зоны термического повреждения тканей была достоверно меньше, чем при электрохирургическом воздействии (табл. 4).
Таблица 4
Ширина зоны термического повреждения тканей в 1-е сутки после операции у животных основной группы и группы сравнения
| Операция | Ширина зоны некроза в мкм | p | |
| Основная группа n=45 | Группа сравнения n=45 | ||
| Холецистэктомия | 1232,37±47,8 | 2841,3±129,6 | 0,0002 |
| Передняя серомиотомия | 944,8±52,9 | 1723,5±118,4 | 0,0004 |
| Резекция купола слепой кишки | 1002,4±73,7 | 1635,5±157,3 | 0,0002 |
Во всех органах границы с неповрежденными тканями после воздействия лазерного излучения были ровными и четкими. Отличительной особенностью ран в группе сравнения была значительная разница ширины зоны электрохирургического повреждения на разных участках тканей. Так в ранах печени встречались многочисленные некротические «языки», проникающие вглубь паренхимы на расстояние до 6,5 мм от коагулированной поверхности. В препаратах желудка и кишечника наблюдали участки термического повреждения всех слоев стенки органа с образованием глубоких язвенных дефектов слизистой оболочки. Причем глубину электрохирургического воздействия во время операции было практически невозможно контролировать, так как электрическая и тепловая проводимость тканей значительно изменялась в зависимости от их влагосодержания и других физических свойств. Данная особенность высокочастотной электроэнергии, по нашему мнению, весьма опасна, так как в ходе электрохирургического воздействия могут быть повреждены крупные сосуды, желчные протоки, стенки полых органов.
В ходе исследования было установлено, что процессы регенерации ран после воздействия лазерного излучения, в сравнении с электрокоагуляцией, характеризовались менее продолжительной фазой воспаления с меньшей экссудативной и лейкоцитарной реакцией, более активной и ранней (с 3-х суток после операции) пролиферацией фибробластов и макрофагов с образованием полноценной грануляционной и соединительной тканей.
Через 30 суток после операций во всех органах, независимо от характеристик лазерного излучения и морфологического строения ткани, соединительнотканный рубец был достоверно уже, содержал менее грубые, параллельно расположенные (не перекрученные) коллагеновые волокна и меньше деформировал ложе желчного пузыря, стенку желудка и толстой кишки, в сравнении с электрохирургическим воздействием (табл. 5).
Таблица 5
Ширина соединительнотканного рубца на 30-е сутки после операции у животных основной группы и группы сравнения
| Операция | Ширина рубца в мкм | p | |
| Основная группа n=45 | Группа сравнения n=45 | ||
| Холецистэктомия | 102,87±17,8 | 233,31±30,7 | 0,009 |
| Передняя серомиотомия | 295,05±56,5 | 1202,9±133,8 | 0,0001 |
| Резекция купола слепой кишки | 552,45±59,5 | 1487,7±133,9 | 0,0001 |
Благоприятные результаты экспериментального исследования позволили нам применить высокоинтенсивное лазерное излучение в клинической практике при выполнении лапароскопических операций.
Максимально эффективное и безопасное применение высокоинтенсивного лазерного излучения в лапароскопической хирургии возможно только при наличии специальных инструментов. С учетом особенностей лапароскопической и лазерной хирургии нами были созданы и внедрены в клиническую практику различные устройства для диссекции тканей и выполнения гемостаза.
Для диссекции тканей разработан эндоскопический инструмент (патент РФ на полезную модель № 58336), представляющий собой полый стержень, на рабочем конце которого расположен L-образный шпатель (рис. 1). Устройство обеспечивает надежный захват, позиционирование и умеренную компрессию рассекаемых структур с эффектом «биологической сварки», а также точное направление лазерного луча на зону разреза с защитой окружающих тканей.


а б
Рис. 1. Эндоскопический инструмент для выполнения диссекции тканей с использованием лазерного излучения (а), рабочая часть инструмента (б).
С целью коагуляции тканей и сосудов в ходе лапароскопических операций нами разработано устройство для подведения лазерного световода к месту воздействия при выполнении лапароскопических операций (патент РФ на полезную модель № 46915), позволяющее плавно изменять угол направления световода относительно оси инструмента от 0 до 45 (рис. 2).


а б
Рис. 2. Устройство для подведения лазерного световода к месту воздействия при выполнении эндоскопических операций (а), рабочая часть инструмента в положении 45 (б).
Эта конструктивная особенность инструмента дала возможность подводить лазерное излучение к объекту воздействия строго под прямым углом вне зависимости от места расположения зоны операционного действия и троакаров.
С целью оптимизации техники открытой безгазовой лапароскопической холецистэктомии с использованием высокоинтенсивного лазерного излучения нами разработаны ранорасширитель оригинальной конструкции и набор инструментов для подвода кварцевого световода к оперируемому органу при выполнении операций из малых доступов (патенты РФ на полезные модели № 51336 и № 58332) (рис. 3).
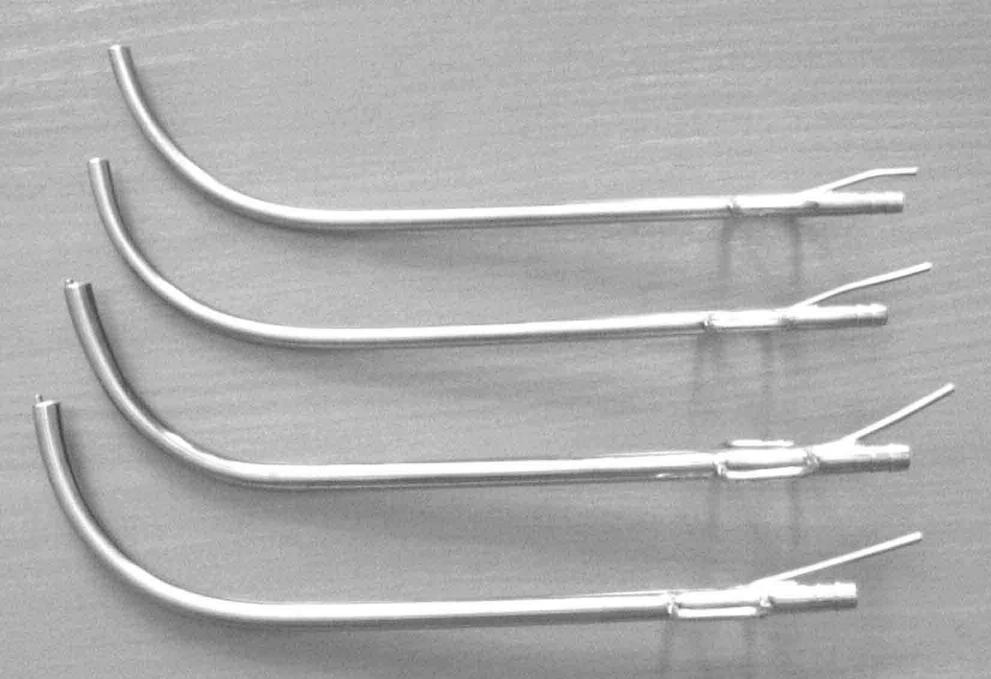
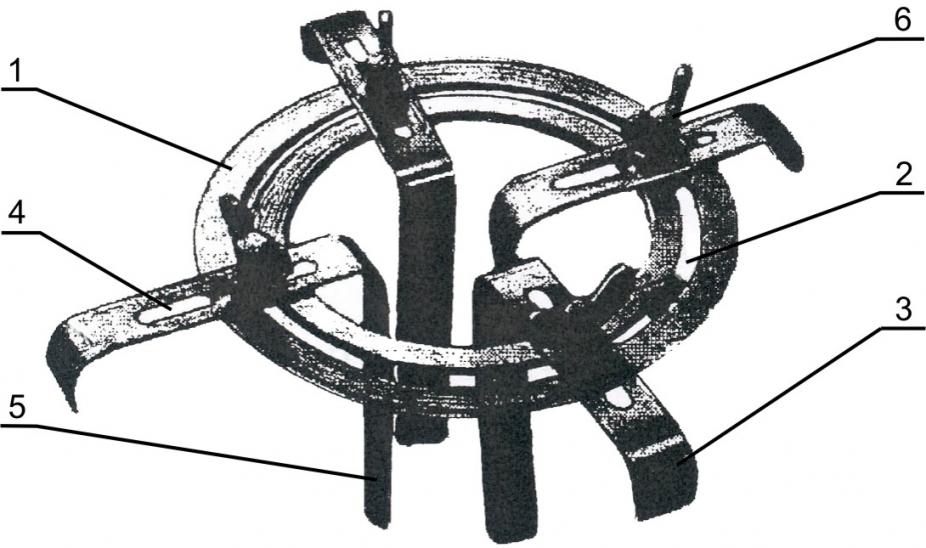
а б
Рис. 3. Набор инструментов для подведения кварцевого световода к оперируемому органу при выполнении операций из малых доступов (а) и ранорасширитель (б): 1 – кольцевая обойма; 2 – паз кольцевой обоймы; 3 – крючок; 4 – паз крючка; 5 – ретрактор крючка; 6 – болт с гайкой.
Анализ выполненных нами 466 малоинвазивных операций показал, что применение выше указанных инструментов позволило оптимизировать и упростить технику вмешательств с использованием высокоинтенсивного лазерного излучения, снизить риск интраоперационных осложнений.
При анализе интраоперационного периода в группе сравнения нами было показано, что применение электрокоагуляции, особенно в условиях выраженного воспаления тканей или инфильтративно-спаечного процесса, может сопровождаться рядом нежелательных электрохирургических эффектов. Так в ходе мобилизации эзофагокардиального перехода и грыжевого мешка при выполнении эндоскопических фундопликаций и герниопластик паховых грыж наблюдали туннелирование тока при пересечении спаек и коагуляции сосудов c повреждением нижней эпигастральной артерии у 1 пациента (1,9%). Демодуляции тока с нейромышечными сокращениями диафрагмы часто происходили в ходе мобилизации ножек диафрагмы при выполнении фундопликаций. Аномальные пути движения тока возникали в ходе аппендэктомий на этапе коагуляции слизистой оболочки культи червеобразного отростка, что послужило причиной ожога купола слепой кишки в 14 случаях (12,6%) и потребовало погружения культи с участком ожога в кисетный шов. Использование квантовой энергии для диссекции тканей и остановки кровотечения в основной группе позволило избежать нежелательных эффектов электрохирургии и тем самым значительно повысить безопасность лапароскопических вмешательств.
Необходимо отметить, что при использовании высокочастотной электроэнергии было очень сложно контролировать глубину электрохирургического воздействия, что привело к перфорации стенки желчного пузыря в 18 случаях (9,6%), повреждению подкапсульных вен печени с массивных кровотечением в 6 наблюдениях (3,2%), ожогам ложа желчного пузыря при выполнении холецистэктомий, а также к ожогам стенки желудка при выполнении серомиотомий с повреждением сосудов подслизистого слоя, сопровождавшимся массивными кровотечениями в 3 случаях (10,4%).
В отличие от электрического тока лазерный луч обладает высокой направленностью, позволяющей произвести прицельное воздействие на площади 1 мм и меньше, контролируемой глубиной воздействия с минимальной боковой передачей тепла. Это предотвращало возникновение ожогов окружающих тканей и позволяло безопасно оперировать в непосредственной близости от стенок полых органов и сосудов.
Во время электрохирургического воздействия, в отличие от лазерного излучения, образуется большое количество дыма, значительно ухудшающего визуальный контроль области операции.
Рабочая поверхность электрохирургического инструмента часто «прилипала» к коагулируемой поверхности с последующим отрывом коагуляционного струпа и возобновлением кровотечения. В ходе операции на поверхность электрода-крючка налипало большое количество коагулируемых тканей, что приводило к резкому снижению эффективности воздействия и требовало извлечения инструмента из брюшной полости и его очистки. Использование в основной группе бесконтактного режима лазерной коагуляции позволило эффективно решить и эту проблему электрохирургии.
При выполнении электрокоагуляции ран печени в ходе 5 биопсий (13,9%) и ножек жировых подвесков сигмовидной кишки у 3 больных (60%) гемостаз вообще оказался неэффективным. Это потребовало использования других методов гемостаза: аппликации пластины «Тахокомб» на рану печени в 4 наблюдениях, наложения швов на рану печени в 1 случае и клипирования артерии сальниковых отростков у 3 пациентов.
Всего в группе сравнения было зарегистрировано 45 (9,76%) интраоперационных осложнений, связанных с использованием высокочастотной электроэнергии (табл. 6).
Таблица 6
Характер и количество интраоперационных осложнений у пациентов основной группы и группы сравнения
| Вид осложнения | Количество осложнений | p | |
| Основная группа | Группа сравнения | ||
| Перфорация стенки желчного пузыря при выполнении холецистэктомий | n=177 | n=188 | 0,034 |
| 7 (3,95%) | 18 (9,6%) | ||
| Массивное кровотечение из ложа желчного пузыря при выполнении холецистэктомий | n=177 | n=188 | 0,017 |
| 0 | 6 (3,2%) | ||
| Массивное кровотечение из сосудов подслизистого слоя желудка при выполнении серомиотомий | n=32 | n=29 | 0,062 |
| 0 | 3 (10,4%) | ||
| Кровотечение из нижней эпигастральной артерии при выполнении герниопластик | n=75 | n=52 | 0,228 |
| 0 | 1 (1,9%) | ||
| Ожог слепой кишки при выполнении аппендэктомий | n=107 | n=111 | 0,0001 |
| 0 | 14 (12,6%) | ||
| Ожог пациента в области пассивного электрода | n=466 | n=461 | |
| 3 (0,65%) | |||
| Всего по основной группе и группе сравнения | n=466 | n=461 | <0,0001 |
| 7 (1,5%) | 45 (9,76%) | ||
Все осложнения и их последствия удалось ликвидировать через лапароскопический доступ без конверсий. Однако эти вынужденные манипуляции привели к значительному увеличению технической сложности операций, их продолжительности и травматичности. Для устранения осложнений потребовались дополнительные инструменты, расходные материалы: иглодержатели, пластины «Тахокомб», клипсы, атравматический шовный материал. Использование в основной группе лазерного излучения для диссекции тканей и осуществления гемостаза позволило снизить количество интраоперационных осложнений до 7 (1,5%).
Длительность лапароскопических вмешательств в основной группе оказалась достоверно меньше только при выполнении биопсий печени и удалении сальниковых отростков сигмовидной кишки (табл. 7). В ходе других вмешательств достоверных различий во времени выполнения этапов с применением луча лазера и высокочастотной электроэнергии обнаружено не было.
Таблица 7
Продолжительность операций у пациентов основной группы
и группы сравнения
| Операция | Время операции, мин | p | |
| Основная группа | Группа сравнения | ||
| Биопсия печени | n=32 | n=36 | 0,037 |
| 13,4±2,7 | 14,9±3,2 | ||
| Удаление сальниковых отростков сигмовидной кишки | n=4 | n=5 | 0,014 |
| 8,75±1,26 | 17±2,24 | ||
Проведенными экспериментальными исследованиями нами было показано, что использование высокоинтенсивного лазерного излучения, в сравнении с высокочастотной электроэнергией, сопровождается меньшей термической травматизацией тканей и менее выраженной их воспалительной реакцией. Эти данные нашли свое подтверждение и при анализе раннего послеоперационного периода в клинике.
Статистически достоверное уменьшение потребности в наркотических анальгетиках, а, следовательно, и уменьшение интенсивности болевого синдрома было обнаружено после лапароскопических холецистэктомий, фенестраций кист печени и герниопластик паховых грыж (табл. 8).
Таблица 8
Потребность пациентов основной группы и группы сравнения в наркотических анальгетиках в 1-е сутки после операций
| Операция | Количество пациентов, получавших наркотические анальгетики | p | |
| Основная группа | Группа сравнения | ||
| Холецистэктомия | n=177 | n=188 | <0,0001 |
| 14 (7,9%) | 43 (22,9%) | ||
| Фенестрация кист печени | n=21 | n=18 | 0,023 |
| 3 (14,3%) | 9 (47,4%) | ||
| Герниопластика паховых грыж | n=75 | n=52 | <0,0001 |
| 0 | 23 (44,2%) | ||
Необходимо отметить, что различия в величине болевого синдрома обнаружены только при эндоскопических вмешательствах, в ходе которых коагулировались большие раневые поверхности: ложе желчного пузыря, ложе кисты печени, ложе для имплантации полипропиленового сетчатого протеза. Это связано, по данным нашего исследования, с меньшей глубиной ожога коагулируемых тканей, а, следовательно, и меньшей местной воспалительной реакцией после воздействия лазерного излучения, в сравнении с электрокоагуляцией.
После операций с использованием лазерных приборов в большинстве нозологических групп отмечено достоверное уменьшение величины гипертермии тела пациентов и ее продолжительности (табл. 9). Это связано, по нашим данным, с меньшей термической травмой и воспалительной реакцией тканей после воздействия на них высокоинтенсивного лазерного излучения, в сравнении с высокочастотной электроэнергией.
Таблица 9
Величина и продолжительность гипертермии тела у пациентов основной группы и группы сравнения после операций
| Операция | Основная группа | Группа сравнения | p | |||
| t C | T сут. | t C | T сут. | |||
| Холецистэктомия | n=177 | n=188 | <0,0001 <0,0001 | |||
| 37,08±0,37 | 1,06±0,78 | 37,5±0,41 | 2,49±1,01 | |||
| Биопсия печени | n=32 | n=36 | <0,0001 <0,0001 | |||
| 37,07±0,39 | 1,06±0,8 | 37,52±0,25 | 2,3±0,58 | |||
| Фенестрация кист печени | n=21 | n=18 | 0,199 0,00027 | |||
| 37,2±0,52 | 0,81±0,67 | 37,41±0,46 | 2,26±1,15 | |||
| Ваготомия по методике Тейлора | n=32 | n=29 | <0,0001 <0,0001 | |||
| 37,31±0,29 | 1,5±0,8 | 37,74±0,51 | 2,45±0,78 | |||
| Фундопликация по методике Тоупе | n=18 | n=22 | 0,0087 0,00053 | |||
| 37,13±0,29 | 1,17±0,79 | 37,49±0,44 | 2,55±1,26 | |||
| Герниопластика паховых грыж | n=75 | n=52 | 0,0032 <0,0001 | |||
| 37,21±0,49 | 0,85±0,67 | 37,45±0,45 | 2,12±1,13 | |||
| Аппендэктомия | n=107 | n=111 | <0,0001 <0,0001 | |||
| 37,37±0,31 | 1,37±0,62 | 37,62±0,38 | 2,61±1,02 | |||
| Удаление сальниковых отростков сигмы | n=4 | n=5 | 0,066 0,14 | |||
| 37,08±0,34 | 1,5±0,57 | 37,5±0,32 | 2,4±0,89 | |||
Примечание: t – величина гипертермии тела пациентов в первые сутки после операции; T – продолжительность гипертермии.
Достоверных различий в количестве отделяемого по дренажам из брюшной полости после операций с применением высокоинтенсивного лазерного излучения и высокочастотной электроэнергии мы не обнаружили. На наш взгляд, это обусловлено влиянием на данный показатель других факторов: адекватности дренирования и санации брюшной полости во время вмешательства, анатомических особенностей области операции.
Сроки дренирования брюшной полости достоверно различались только после лапароскопических холецистэктомий, составив в среднем в группе сравнения 2,9±2,2 суток, в основной группе – 1,6±0,54 суток (p<0,0001). Увеличение сроков дренирования было обусловлено использованием марлевых тампонов в 6 (3,2%) наблюдениях при неустойчивом гемостазе в ложе желчного пузыря, желчеистечением из ложа желчного пузыря в послеоперационном периоде у 3 больных (1,6%) и необходимостью более длительного контроля за отделяемым из брюшной полости при наличии гипертермии тела пациентов и повышении уровня лейкоцитов в периферической крови.
Ультразвуковое исследование области воздействия луча лазера и электрокоагуляции выполнялось только после операций на печени (холецистэктомий, биопсий, фенестраций кист печени), поскольку исследование оказалось неинформативным при других нозологиях. При проведении ультразвукового обследования пациентов мы обнаружили, что на 2-е сутки после операций во всех выше указанных нозологических группах ширина структурно измененных тканей печени в области воздействия оказалась достоверно меньше у больных, оперированных с использованием лазерного излучения (табл. 10).
Таблица 10
Размеры зоны структурно измененных тканей печени в области воздействия лазерного излучения и высокочастотной электроэнергии по данным ультразвукового исследования
| Область воздействия | Ширина зоны, мм | p | |
| Основная группа | Группа сравнения | ||
| Ложе желчного пузыря | n=177 | n=188 | <0,0001 |
| 1,76±0,89 | 5,53±1,39 | ||
| Рана печени после биопсии | n=32 | n=36 | <0,0001 |
| 2,16±0,85 | 5,67±1,33 | ||
| Ложе кисты печени | n=21 | n=18 | <0,0001 |
| 2,19±0,93 | 5,16±0,38 | ||
При сравнительном анализе уровня гемоглобина, билирубина, тимоловой пробы статистически достоверных различий в группах, оперированных с использованием высокоинтенсивного лазерного излучения и высокочастотной электроэнергии, нами не обнаружено.
Повышение активности аминотрасфераз и статистически достоверные различия в уровнях их активности у пациентов основной и сравниваемой групп были зарегистрированы только после операций на печени: холецистэктомий, биопсий, фенестраций кист печени. Проведенными исследованиями было показано, что на 2-е сутки после лапароскопических операций на печени уровни активности АЛТ и АСТ превышали норму (до 40 ед.) и были достоверно выше в группе сравнения, уровень АЛТ во всех наблюдениях был достоверно больше АСТ (табл. 11). Эти данные убедительно свидетельствуют о прямой связи повышения уровня активности аминотрасфераз (особенно АЛТ) с гибелью гепатоцитов в ходе операции. Причем использование лазерного излучения вместо высокочастотной электроэнергии сопровождается достоверно меньшим повреждением ткани печени.
Таблица 11
Показатель активности аминотрасфераз у пациентов основной и сравниваемой групп на 2-е сутки после операций на печени
| Операция | Основная группа | Группа сравнения | p | ||
| АЛТ | АСТ | АЛТ | АСТ | ||
| Холецистэктомия | n=177 | n=188 | <0,0001 <0,0001 | ||
| 46,4±11,9 | 40,5±10,5 | 108,6±37,3 | 93,7±23,7 | ||
| Биопсия печени | n=32 | n=36 | <0,0001 <0,0001 | ||
| 47,2±12,1 | 38,8±11,9 | 96,5±25,4 | 79,3±17,1 | ||
| Фенестрация кист печени | n=21 | n=18 | <0,0001 <0,0001 | ||
| 58,2±11,1 | 51,2±13,5 | 99,4±32,6 | 77,3±17,4 | ||
У пациентов, оперированных по поводу острого воспаления желчного пузыря и червеобразного отростка, на 2-е сутки послеоперационного периода зарегистрированы различия в количестве лейкоцитов в периферической крови (табл. 12).
Таблица 12
Количество лейкоцитов в крови у пациентов основной и сравниваемой групп до операций и на 2-е сутки после операций
| Нозология | Количество лейкоцитов в крови, 109/л | p | |||
| Основная группа | Группа сравнения | ||||
| До операции | После операции | До операции | После операции | ||
| Острый холецистит | n=86 | n=95 | 0,211 <0,0001 | ||
| 9,81±1,73 | 7,22±0,72 | 9,63±1,76 | 10,5±2,15 | ||
| Острый аппендицит | n=107 | n=111 | 0,407 <0,0001 | ||
| 9,73±1,03 | 7,43±0,56 | 9,76±1,59 | 10,15±1,61 | ||
Достоверное увеличение количества лейкоцитов в группе сравнения убедительно свидетельствует о том, что электрохирургическое воздействие, в отличие от высокоинтенсивного лазерного излучения, усиливает воспалительный процесс в тканях после операций.
В этих же нозологических группах были показаны более высокие бактерицидные свойства высокоинтенсивного лазерного излучения, в сравнении с электрохирургией.
Так анализ результатов бактериологических посевов из ложа желчного пузыря у пациентов с одинаковой частотой бактериохолии в желчном пузыре показал, что после воздействия высокочастотной электроэнергии бактерии высеяны в 7,5 % наблюдений, а в основной группе микрофлора не высевалась (табл. 13).
При проведении бактериологических исследований с культи червеобразных отростков до воздействия высокоинтенсивного лазерного излучения и высокочастотной электроэнергии было установлено, что исходный уровень микробной обсемененности достоверно не различался (табл. 14).
Таблица 13
Видовой состав аэробной микрофлоры желчи у пациентов основной группы и группы сравнения
| Микроорганизмы | Количество пациентов | p | |
| Основная группа n=177 | Группа сравнения n=188 | ||
| Escherichia coli | 36 (45,6%) | 41 (50,6%) | 0,523 |
| Klebsiella | 11 (13,9%) | 10 (12,3%) | 0,768 |
| Proteus | 8 (10,1%) | 6 (7,4%) | 0,543 |
| Enterococcus | 4 (5,1%) | 6 (7,4%) | 0,54 |
| Streptococcus | 12 (15,2%) | 9 (11,1%) | 0,445 |
| Staphylococcus | 6 (7,6%) | 8 (9,9%) | 0,607 |
| Pseudomonas aerugenosa | 2 (2.5%) | 1(1,2%) | 0,545 |
| Всего | 79 (100%) | 81 (100%) | 0,766 |
Таблица 14
Видовой состав микрофлоры культи червеобразных отростков, высеянной до воздействия лазерного излучения и высокочастотной электроэнергии
| Микроорганизмы | Количество пациентов | p | |
| Основная группа n=107 | Группа сравнения n=111 | ||
| Escherichia coli | 83 (77,6%) | 89 (80,2%) | 0,637 |
| Pseudomonas aerugenosa | 12 (11,2%) | 9 (8,1%) | 0,437 |
| Proteus vulgaris | 5 (4,7%) | 6 (5,4%) | 0,805 |
| Enterococcus fecalis | 0 | 2 (1,8%) | 0,163 |
| Streptococcus viridans | 1 (0,94%) | 0 | 0,307 |
| Микробные ассоциации | 8 (7,5%) | 6 (5,4%) | 0,533 |
| Микрофлора не высеяна | 14 (13,1%) | 12 (10,8%) | 0,605 |
После коагуляции слизистой оболочки культи червеобразных отростков в группе больных, оперированных с использованием высокоинтенсивного лазерного излучения, микрофлора высевалась в 25,3 раза реже (p<0,0001), чем в группе больных, оперированных с использованием высокочастотной электроэнергии (табл. 15).
Таблица 15
Видовой состав микрофлоры культи червеобразных отростков, высеянной после воздействия лазерного излучения и высокочастотной электроэнергии
| Микроорганизмы | Количество пациентов | p | |
| Основная группа n=107 | Группа сравнения n=111 | ||
| Escherichia coli | 3 (2,8%) | 71 (64%) | <0,0001 |
| Pseudomonas aerugenosa | 0 | 6 (5,4%) | 0,015 |
| Proteus vulgaris | 0 | 1 (0,9%) | 0,325 |
| Enterococcus fecalis | 0 | 0 | |
| Streptococcus viridans | 0 | 0 | |
| Микробные ассоциации | 0 | 2 (1,8%) | 0,163 |
| Микрофлора не высеяна | 104 (97,2%) | 35 (31,5%) | <0,0001 |
Известно, что высокоинтенсивное лазерное излучение индуцирует процессы неоангиогенеза в тканях (Головнева Е.С., 2003). Эта уникальная особенность лазерной энергии широко используется для реваскуляризации миокарда, тканей нижних конечностей (Алехин Д.И. 2005; Евдокимов С.В, 2005). Нами впервые изучена динамика роста капиллярной сосудистой сети в зоне имплантации сетчатого полипропиленового протеза у пациентов, перенесших предбрюшинные лапароскопические гернипластики паховых грыж. На 7-е, 14-е, 30-е и 60-е сутки после операций мы измеряли площадь капиллярного сосудистого русла в области имплантированного сетчатого протеза ультразвуковым аппаратом в режиме энергетического допплера. Исследование показало, что у пациентов основной группы на всех сроках общая площадь капиллярных сосудов была достоверно больше (p<0,05), чем у больных группы сравнения (табл. 16). Эти данные свидетельствуют о том, что высокоинтенсивное лазерное излучение более активно, в сравнении с высокочастотной электроэнергией, индуцирует рост капилляров, а, следовательно, и тканевой кровоток в зоне имплантации сетчатого протеза, тем самым, стимулируя репаративные процессы и способствуя более быстрой и надежной фиксации имплантанта в области грыжевого дефекта.
Таблица 16
Общая площадь капиллярных сосудов в области имплантированного сетчатого протеза у пациентов основной и сравниваемой групп
| Сроки исследования после операции | Площадь капиллярных сосудов в мм | p | |
| Основная группа n=75 | Группа сравнения n=52 | ||
| 7 сутки | 415,6±130,5 | 317,4±121,2 | 0,024 |
| 14 сутки | 507,5±182,1 | 297,9±116,3 | <0,0001 |
| 30 сутки | 617±187,5 | 243,6±177,5 | <0,0001 |
| 60 сутки | 88,9±30,2 | 61,8±26,9 3 | <0,0001 |
Осложнения в раннем послеоперационном периоде у пациентов группы сравнения возникли в 10 (2,2%) случаях (табл. 17). Анализ осложнений позволил выявить прямую связь их возникновения с использованием высокочастотной электроэнергии. Все осложнения и их последствия были устранены с помощью консервативных методов лечения, повторных оперативных вмешательств не потребовалось ни в одном случае. Однако это привело к увеличению длительности стационарного лечения больных.
Таблица 17
Характер и количество послеоперационных осложнений
у пациентов группы сравнения
| Осложнения | Число | % |
| Желчеистечение из ложа желчного пузыря после холецистэктомий (n=188) | 3 | 1,6% |
| Атония желудка после ваготомий по Тейлору (n=29) | 3 | 10,4% |
| Дисфагия после фундопликаций по Тоупе (n=22) | 2 | 9,1% |
| Гематома паховой области после герниопластики (n=52) | 1 | 1,9% |
| Инфильтрат в области купола слепой кишки после аппендэктомий (n=111) | 1 | 0,9% |
| Всего по группе сравнения (n=461) | 10 | 2,2% |
У пациентов, оперированных с применением высокоинтенсивного лазерного излучения, осложнений в послеоперационном периоде не наблюдали.
Более благоприятное течение раннего послеоперационного периода в основной группе привело к значительному сокращению сроков стационарного лечения после операций с использованием лазерного излучения (табл. 18). Различия в продолжительности стационарного лечения после операции оказались недостоверными только после удалений сальниковых отростков сигмовидной кишки в виду малого количества наблюдений в группах.
Таблица 18
Сроки стационарного лечения после лапароскопических операций у пациентов основной группы и группы сравнения
| Операция | Сроки лечения в сутках | p | |
| Основная группа | Группа сравнения | ||
| Холецистэктомия | n=177 | n=188 | <0,000001 |
| 2,94±0,72 | 5,46±2,74 | ||
| Биопсия печени | n=32 | n=36 | 0,000012 |
| 2,28±0,52 | 2,97±0,51 | ||
| Фенестрация кист печени | n=21 | n=18 | 0,000008 |
| 3,4±1,2 | 5,6±1,1 | ||
| Ваготомия по Тейлору | n=32 | n=29 | <0,000001 |
| 3,03±0,69 | 4,52±1,12 | ||
| Фундопликация по Тоупе | n=18 | n=22 | 0,00065 |
| 2,72±0,75 | 3,82±0,96 | ||
| Герниопластика | n=75 | n=52 | 0,0015 |
| 1,96±0,45 | 2,52±1,02 | ||
| Аппендэктомия | n=107 | n=111 | <0,000001 |
| 3,33±0,72 | 5,9±3,09 | ||
| Удаление жирового подвеска сигмовидной кишки | n=4 | n=5 | 0,086 |
| 2±0,82 | 3,4±1,14 | ||
Таким образом, в ходе проведенного исследования нами было доказано, что энергия высокоинтенсивного лазерного излучения, используемая для диссекции тканей и выполнения гемостаза, имеет ряд преимуществ перед высокочастотной электроэнергией при выполнении малоинвазивных холецистэктомий, биопсий печени, фенестраций кист печени, фундопликаций, селективных ваготомий, аппендэктомий, герниопластик паховых грыж, удалений сальниковых отростков сигмовидной кишки.
Выводы
- Использование высокочастотной электроэнергии в лапароскопической хирургии сопряжено с высоким риском появления аномальных путей распространения, туннелирования и демодуляции тока, а глубина электрохирургического воздействия значительно варьирует и плохо контролируется, что приводит к возникновению интраоперационных осложнений в 9,76% случаев и послеоперационных осложнений в 2,2% случаев.
- Проведенными экспериментальными исследованиями доказано, что после воздействия лазерного излучения ширина зоны термического повреждения тканей была в среднем в 1,9 раз меньше; репаративные процессы характеризовались более короткой фазой воспаления с минимальной экссудацией и лейкоцитарной реакцией, более ранним (с 3-х суток после операции) образованием полноценной грануляционной ткани и соединительного рубца, ширина которого была в среднем в 3,1 раза меньше, в сравнении с электрохирургическим воздействием.
- Применение разработанных в ходе исследования устройства для подведения лазерного световода к месту воздействия при выполнении эндоскопических операций, инструмента для диссекции тканей, а так же ранорасширителя и набора инструментов для подвода кварцевого световода к оперируемому органу при выполнении операций из малых доступов позволило значительно расширить возможности лазерных технологий в лапароскопической хирургии, оптимизировать и упростить технику операции, снизить риск осложнений при выполнении малоинвазивных вмешательств.
- Высокоинтенсивное лазерное излучение в ходе лапароскопических операций показало ряд преимуществ перед высокочастотной электроэнергией в виде: высокой направленности с минимальной боковой температурной передачей и хорошо контролируемой глубиной воздействия, бесконтактности (отсутствует эффект «прилипания» инструмента к коагулируемой поверхности), более выраженного бактерицидного эффекта, меньшей задымленности в зоне операции; – что позволило снизить количество интраоперационных осложнений до 1,5% и избежать послеоперационных осложнений.
- Использование высокоинтенсивного лазерного излучения вместо высокочастотной электроэнергии способствует более благоприятному течению послеоперационного периода: уменьшается интенсивность болевого синдрома после холецистэктомий, фенестраций кист печени и герниопластик паховых грыж, температурная реакция тела во всех нозологических группах, лейкоцитарная реакция в периферической крови у пациентов с острым холециститом и аппендицитом, активность трансаминаз после операций на печени, воспалительная реакция тканей в ранах печени по данным ультразвукового исследования. Это приводит к более быстрой послеоперационной реабилитации этих больных и сокращению сроков стационарного лечения в среднем в 1,6 раз.
- Высокоинтенсивное лазерное излучение более активно, в сравнении с высокочастотной электроэнергией, индуцирует рост капиллярного сосудистого русла в зоне имплантации полипропиленового сетчатого протеза у пациентов с паховыми грыжами после лапароскопических герниопластик, а, следовательно, стимулирует тканевой кровоток и репаративные процессы, что способствует более быстрой и надежной фиксации протеза в области грыжевого дефекта.
Практические рекомендации
- Для профилактики электрохирургических осложнений при выполнении лапароскопических операций следует по возможности ограниченно и осторожно применять высокочастотную электроэнергию, особенно в зонах расположения жизненно важных структур и крупных сосудов.
- Отделение желчного пузыря от печеночного ложа при лапароскопической холецистэктомии и биопсию печени рекомендуем выполнять с помощью лазерного луча контактным способом или эндоскопических ножниц с последующей коагуляцией ложа желчного пузыря и раны печени высокоинтенсивным лазерным излучением с длиной волны 805 или 1064 нм в непрерывном режиме, бесконтактным способом, на мощности от 7 до 12 Вт в зависимости от интенсивности кровотечения, с использованием инструмента для подведения лазерного световода к месту воздействия при выполнении эндоскопических операций.
- При наличии у пациентов с желчнокаменной болезнью противопоказаний к пневмоперитонеуму (больные 3 класса по классификации ASA) холецистэктомию с использованием лазерного излучения следует выполнять по методике открытой безгазовой лапароскопии с применением кольцевого ранорасширителя и набора инструментов для подвода кварцевого световода к оперируемому органу при выполнении операций из малых доступов. При этом разработанный нами набор инструментов для выполнения открытой безгазовой лапароскопической холецистэктомии может использоваться как самостоятельно, так и совместно с комплектом «Мини-Ассистент» М.И. Прудкова.
- При выполнении малоинвазивных холецистэктомий у пациентов с рубцово-сморщенным желчным пузырем в процессе отделения последнего от печени фиксированные фрагменты задней стенки желчного пузыря необходимо оставлять в печеночном ложе с последующей коагуляцией слизистой оболочки оставленных фрагментов высокоинтенсивным лазерным излучением в непрерывном режиме, бесконтактным способом на мощности 10 Вт.
- Иссечение капсулы кисты печени, выступающей над поверхностью органа, при ее фенестрации следует выполнять с помощью эндоскопических ножниц с последующей деэпителизацией интрапаренхиматозной части кисты высокоинтенсивным лазерным излучением с длиной волны 970 нм, в импульсном режиме, бесконтактным способом, на мощности 5 Вт, с использованием инструмента для подведения лазерного световода к месту воздействия при выполнении эндоскопических операций.
- В ходе лапароскопической ваготомии по методике Тейлора высокоинтенсивное лазерное излучение с длиной волны 970 нм, в импульсном режиме, на мощности 7 Вт, контактным способом, с эндоскопическим инструментом для диссекции тканей наиболее оптимально использовать для выполнения передней серомиотомии с последующим обязательным ушиванием раны желудка непрерывным швом.
- Мобилизацию грыжевого мешка и эзофагокардиального перехода с ножками диафрагмы в ходе лапароскопических герниопластик и антирефлюксных операций целесообразно выполнять лазерным излучением с длиной волны 970 нм, в импульсном режиме, на мощности 7 Вт, контактным способом, с использованием эндоскопического инструмента для диссекции тканей, а при работе позади семенного канатика и пищевода – с применением инструмента для подведения лазерного световода к месту воздействия при выполнении эндоскопических операций.
- Обработку культи червеобразого отростка при лапароскопической аппендэктомии рекомендуем выполнять лигатурным способом с обязательной коагуляцией слизистой оболочки культи высокоинтенсивным лазерным излучением с длиной волны 970 нм, в импульсном режиме, на мощности 4 Вт, бесконтактным способом. Погружной способ аппендэктомии следует применять при возникновении в ходе операции осложнений, связанных с использованием лигатурного способа (электрохирургический ожог культи или купола слепой кишки).
- Отсечение некротизированного сальникового отростка сигмовидной кишки необходимо выполнять высокоинтенсивным лазерным излучением с длиной волны 970 нм, в импульсном режиме, на мощности 4 Вт, контактным способом, с применением эндоскопического инструмента для диссекции тканей.
Список работ, опубликованных по теме диссертации
- Пряхин, А.Н. Обработка ложа желчного пузыря с помощью диодного лазера после лапароскопической холецистэктомии [Текст] / А.Н. Пряхин, Ж.А. Ревель-Муроз, В.В. Сазанов, В.Ю. Подшивалов, С.А. Совцов, А.И. Козель // Хирургия деструктивного холецистита: материалы межрегион. науч.-практ. конф. Екатеринбург, 18–20 сентября, 2002 г. – Екатеринбург, 2002. – С.41.
- Пряхин, А.Н. Использование высокоинтенсивного лазерного излучения ближнего инфракрасного диапазона при лапароскопической холецистэктомии [Текст] / А.Н. Пряхин, Ж.А. Ревель-Муроз, В.В. Сазанов, В.Ю. Подшивалов, С.А. Совцов, А.И. Козель // Новые технологии в здравоохранении: сб. науч. ст. посвященных 75-летию Управления здравоохранения г. Челябинска / Отв. ред. Ю.А. Тюков. – Челябинск, 2002. – Вып. III. – С.151.
- Пряхин, А.Н. Первый опыт использования диодного лазера при лапароскопической холецистэктомии [Текст] / А.Н. Пряхин, Ж.А. Ревель-Муроз, В.В. Сазанов, В.Ю. Подшивалов, С.А. Совцов, А.И. Козель // Актуальные проблемы современной хирургии: сб. науч. тр. междунар. хирургич. конгр. М., 22–25 февраля, 2003 г. – М., 2003. – С.96.
- Пряхин, А.Н. Использование высокоинтенсивного лазерного излучения при операциях на печени [Текст] / А.Н. Пряхин, Ж.А. Ревель-Муроз, В.В. Сазанов, Л.В. Астахова, С.А. Совцов, А.И. Козель // Актуальные вопросы клинической и экспериментальной медицины: тез. докл. науч.-практ. конф. молодых ученых. – СПб., 2003. – С.154-155.
- Козель, А.И. Использование диодного лазера в хирургии печени и желчных протоков [Текст] / А.И. Козель, А.Н. Пряхин, Ж.А. Ревель-Муроз, Л.В. Астахова, Е.Н. Игнатьева // Высокие хирургические, лазерные и информационные технологии в медицине Санкт-Петербурга и Северо-Западного региона Российской Федерации: перспективы дальнейшего развития: материалы первой науч.-практ. конф. Северо-Западного региона Российской Федерации с междунар. участием СПб., 20–21 ноября, 2003 г. – СПб., 2003. – С.93.
- Козель, А.И. Использование диодного лазера в эндоскопической абдоминальной хирургии [Текст] / А.И. Козель, С.А. Совцов, Ж.А. Ревель-Муроз, А.Н. Пряхин, Л.В. Астахова, Е.Н. Игнатьева // Эндоскопич. хирургия. – 2003. – № 3. – С.22-25.
- Пат. 2221607 Российская федерация, МПК А 61 N 5/067. Способ обработки ложа желчного пузыря при проведении холецистэктомии [Текст] / А.Н. Пряхин, Ж.А. Ревель-Муроз, В.В. Сазанов, В.Ю. Подшивалов, Е.Н. Игнатьева, С.А. Совцов, А.И. Козель.; заявитель и патентообладатель Челяб. гос. ин-т лазерной хирургии, Уральская гос. мед. академия дополнительного образования. – № 2002106904/14; заявл. 18.03.2002; опубл. 20.01.2004, Бюл. № 2 (III ч.). – 626 с.
- Пат. 2264192 Российская федерация, МПК А 61 В 18/00, 17/32. Способ лапароскопической аппендэктомии [Текст] / А.Н. Пряхин, Р.З. Газизуллин, С.А. Совцов, А.И. Козель.; заявитель и патентообладатель Уральская гос. мед. академия дополнительного образования. – № 2004114392/14; заявл. 11.05.2004; опубл. 20.11.2005, Бюл. № 32 (II ч.). – 363 с.
- Пат. 46915 Российская федерация, МПК А 61 В 17/062, 17/28. Устройство для подвода световода к месту воздействия при выполнении эндоскопических операций [Текст] / А.Н. Пряхин.; заявитель и патентообладатель Челяб. гос. ин-т лазерной хирургии, Уральская гос. мед. академия дополнительного образования. – № 2005106304/22; заявл. 05.03.2005; опубл. 10.08.2005, Бюл. № 22 (IV ч.). – 1015 с.: ил.
- Пат. 51336 Российская федерация, МПК А 61 В 17/02 (2006.01). Ранорасширитель [Текст] / А.В. Панов, В.А. Панюшев, В.В. Сазанов, А.Н. Пряхин, Р.З. Газизуллин, С.А. Совцов.; заявитель и патентообладатель Панов Александр Васильевич. – № 2005120985/22; заявл. 04.07.2005; опубл. 10.02.2006, Бюл. № 4 (IV ч.). – 904 с.: ил.
- Пат. 58332 Российская федерация, МПК А 61 В 17/32 (2006.01). Хирургический инструмент для подвода гибкого элемента к оперируемому органу при выполнении операций из малых доступов [Текст] /А.Н. Пряхин, В.В. Сазанов.; заявитель и патентообладатель Челяб. гос. ин-т лазерной хирургии, Уральская гос. мед. академия дополнительного образования. – № 2006118294/22; заявл. 26.05.2006; опубл. 27.11.2006, Бюл. № 33 (II ч.). – 403 с.: ил.
- Пат. 58336 Российская федерация, МПК А 61 В 18/29 (2006.01). Эндоскопический инструмент для рассечения тканей высокоинтенсивным лазерным излучением [Текст] / А.Н. Пряхин, А.И. Козель, С.А. Совцов.; заявитель и патентообладатель Челяб. гос. ин-т лазерной хирургии, Уральская гос. мед. академия дополнительного образования. – № 2006118293/22; заявл. 26.05.2006; опубл. 27.11.2006, Бюл. № 33 (II ч.). – 404 с.: ил.
- Совцов, С.А. Способы обработки ложа желчного пузыря после лапароскопической холецистэктомии [Текст] / С.А. Совцов, А.Н. Пряхин // Эндоскопич. хирургия. – 2003. – № 5. – С.48-54.
- Пряхин, А.Н. Проблемы гемостаза в гепатобилиарной хирургии: сравнение диодного лазера и электрокоагуляции [Текст] / А.Н. Пряхин // Новые технологии в медицине: сб. науч. тр. V науч.-практ. конф. – Нягань, 2003. – С.22-23.
- Пряхин, А.Н. Наш опыт использования лазерных технологий в малоинвазивной абдоминальной хирургии [Текст] / А.Н. Пряхин, Р.З. Газизуллин, С.А. Совцов // Хирургия минидоступа: материалы Уральской межрегион. науч.-практ. конф. Екатеринбург 14–15 апреля, 2005 г. – Екатеринбург, 2005. – С.132.
- Пряхин, А.Н. Методы обработки ложа желчного пузыря после малоинвазивных холецистэктомий [Текст]: учеб.-метод. пособие / А.Н. Пряхин, Ж.А. Ревель-Муроз, В.В. Сазанов. – Челябинск, 2002. – 32 с.
- Пряхин, А.Н. Лапароскопическая аппендэктомия [Текст]: учеб. пособие для врачей / А.Н. Пряхин, Р.З. Газизуллин. – Челябинск: Иероглиф, 2005. – 72 с.
- Совцов, С.А. Протезирующая герниопластика паховых и бедренных грыж [Текст]: учеб. пособие для врачей / С.А. Совцов, А.Н. Пряхин, О.Б. Миляева. – Челябинск: Полиграф-Центр, 2007. – 68 с.
- Пряхин, А.Н. Способ обработки культи червеобразного отростка с использованием высокоинтенсивного лазерного излучения при лапароскопической аппендэктомии [Текст] / А.Н. Пряхин, Р.З. Газизуллин, С.А. Совцов // Новые технологии в хирургии: сб. науч. тр. междунар. хирургич. конгр. Ростов-на-Дону 5–7октября 2005 г. – Ростов-на-Дону, 2005. – С.231-232.
- Пряхин, А.Н. Выбор способа обработки культи червеобразного отростка при выполнении лапароскопической аппендэктомии [Текст] / А.Н. Пряхин, Р.З. Газизуллин // Актуальные проблемы медицинской науки, технологий и профессионального образования: сб. науч. работ. – Челябинск, 2005. – С.193-195.
- Козель, А.И. Сравнительная характеристика высокоинтенсивного лазерного излучения и высокочастотной электроэнергии в лапароскопической хирургии [Текст] / А.И. Козель, С.А. Совцов, А.Н. Пряхин // Лазерная медицина. – 2006. – Т. 10, № 1. – С.39-43.
- Пряхин, А.Н. Новые возможности и технические аспекты лапароскопии в лечении острого аппендицита [Текст] / А.Н. Пряхин, Р.З. Газизуллин // Иероглиф. – 2006. – Т. 9, № 31. – С.1264-1266.
- Совцов, С.А. Профилактика осложнений и рецидивов при эндоскопической герниопластике сложных форм паховых грыж [Текст] / С.А. Совцов, А.Н. Пряхин // Вестник герниологии: сб. науч. ст. / Под ред. А.Д. Тимошина, А.Л. Шестакова. – М., 2006. – Вып. 2 – С.174-177.
- Голощапова, Ж.А. Экспериментально-морфологическое обоснование применения высокоинтенсивного лазерного излучения при лапароскопической ваготомии желудка по Тейлору [Текст] / Ж.А. Голощапова, А.Н. Пряхин, Р.З. Газизуллин // Лазерные технологии в медицине: сб. науч. работ / Под ред. А.И. Козеля. – Челябинск, 2006. – Вып. 5 – С.116-121.
- Голощапова, Ж.А. Морфологическое обоснование применения ВИЛИ при лапароскопической аппендэктомии [Текст] / Ж.А. Голощапова, А.Н. Пряхин, Р.З. Газизуллин // Лазерные технологии в медицине: сб. науч. работ / Под ред. А.И. Козеля. – Челябинск, 2006. – Вып. 5 – С.121-127.
- Пряхин, А.Н. Первый опыт использования высокоинтенсивного лазерного излучения при лапароскопической фундопликации [Текст] / А.Н. Пряхин, А.И. Козель, С.А. Совцов // Инженерия и инновационные технологии в медицине: сб. ст. / Под ред. В.М. Лисиенко, С.И. Блохиной. – Екатеринбург, 2006. – С.103-106.
- Пряхин, А.Н. Сравнительный анализ результатов применения высокоинтенсивного лазерного излучения и электрокоагуляции при лапароскопической ваготомии по Тейлору [Текст] / А.Н. Пряхин // Анналы хирургии. – 2006. – № 6. – С.37-40.
- Пряхин, А.Н. Новые возможности диодных лазеров в эндоскопической гепатобилиарной хирургии [Текст] / А.Н. Пряхин // Анналы хирургич. гепатологии. – 2006. – Т. 11, № 3. – С.56.
- Пряхин, А.Н. Высокоинтенсивное лазерное излучения в лапароскопической гепатобилиарной хирургии [Текст] / А.Н. Пряхин // Анналы хирургич. гепатологии. – 2006. – Т. 11, № 4. – С.38-43.
- Sovtsov, S.A. Hemostasis problem in hepatobiliary surgery: comparison laser and electrocautery [Text] / S.A. Sovtsov, A.I. Kozel, A.N. Pryahin // Offic. J. Int. Hepato Pancreato Biliary Association. – 2006. – Vol. 8, № 2. – P.104.
- Пряхин, А.Н. Эндохирургическое лечение непаразитарных кист печени и селезенки с использованием полупроводниковых лазерных приборов [Текст] / А.Н. Пряхин // 11-й Московский международный конгресс по эндоскопической хирургии: тез. докл. / Под ред. Ю.И. Галлингера. – М., 2007. – С.284-286.
- Совцов, С.А. Наш опыт использования высокоинтенсивного лазерного излучения при лапароскопической герниопластике паховых и бедренных грыж [Текст] / С.А. Совцов, А.Н. Пряхин, О.Б. Миляева // Актуальные вопросы неотложной хирургии: материалы пленума Проблемной комиссии Межведом. науч. совета по хирургии РАМН и Рос. науч.-практ. конф. Курск, 1718 октября, 2007 г. М.; Курск, 2007. С.239-241.
- Пряхин, А.Н. Эффективность высокоинтенсивного лазерного излучения в обеспечении безопасности выполнения лапароскопических операций [Текст] / А.Н. Пряхин // Иероглиф. – 2007. – Т. 10, № 32. – С.1297-1299.
- Пряхин, А.Н. Морфологическое и клиническое обоснование использования высокоинтенсивного лазерного излучения при лапароскопической холецистэктомии [Текст] / А.Н. Пряхин // Последипломное медицинское образование и наука. – 2007. – Т. 5, № 1. – С.18-25.
- Пряхин, А.Н. Оптимизация методики лапароскопической аппендэктомии [Текст] / А.Н. Пряхин, Р.З. Газизуллин // Пермский мед. журн. – 2007. –Т.24, № 1-2. – С.18-23.
- Пряхин, А.Н. Лапароскопическая аппендэктомия: технические аспекты операции и профилактика осложнений [Текст] / А.Н. Пряхин, Р.З. Газизуллин // Эндоскопич. хирургия. – 2007. – № 3. – С.27-31.
- Пряхин, А.Н. Способы обработки культи червеобразного отростка при лапароскопической аппендэктомии [Текст] / А.Н. Пряхин // Хирургия. – 2007. – № 8. – С.56-59.
- Пряхин, А.Н. Выбор способа и технические аспекты протезирующих герниопластик при лечении сложных форм паховых грыж [Текст] / А.Н. Пряхин // Вестн. хирургии им. И.И. Грекова. – 2007. – Т. 166, № 2. – С.96-99.
- Пряхин, А.Н. Инструменты для выполнения лапароскопических операций с использованием высокоинтенсивного лазерного излучения [Текст] / А.Н. Пряхин // Эндоскопич. хирургия. – 2007. – № 4. – С.23-25.
- Совцов С.А. Сравнительный анализ результатов использования высокоинтенсивного лазерного излучения и высокочастотной электроэнергии при лапароскопической герниопластике паховых грыж [Текст] / С.А. Совцов, А.Н. Пряхин, О.Б. Миляева // Уральский мед. журн. – 2007. – № 10. – С.51-55.

