Реактивные изменения клеточно-гуморальной системы организма как типовой патологический процесс и его регуляция реактантами острой фазы
На правах рукописи
Осиков Михаил Владимирович
РЕАКТИВНЫЕ ИЗМЕНЕНИЯ КЛЕТОЧНО-ГУМОРАЛЬНОЙ СИСТЕМЫ ОРГАНИЗМА КАК ТИПОВОЙ ПАТОЛОГИЧЕСКИЙ ПРОЦЕСС И ЕГО РЕГУЛЯЦИЯ РЕАКТАНТАМИ ОСТРОЙ ФАЗЫ
14.00.16 – патологическая физиология
14.00.36 – аллергология и иммунология
А в т о р е ф е р а т
диссертации на соискание ученой степени
доктора медицинских наук
Челябинск - 2008
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования “Челябинская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию РФ” на кафедре патофизиологиии
Научные консультанты:
доктор медицинских наук,
профессор КРИВОХИЖИНА Людмила Владимировна
член-корреспондент РАМН,
доктор медицинских наук,
профессор ДОЛГУШИН Илья Ильич
Официальные оппоненты:
член-корреспондент РАМН,
доктор медицинских наук,
профессор ЛИТВИЦКИЙ Петр Францевич
доктор медицинских наук,
профессор ДОЛГИХ Владимир Терентьевич
доктор медицинских наук,
профессор АКЛЕЕВ Александр Васильевич
Ведущая организация:
ГОУ ВПО «Российский государственный медицинский университет Росздрава» (г. Москва)
Защита диссертации состоится « »______________ 2008 года в 10 часов на заседании диссертационного совета Д.208.117.02 при ГОУ ВПО «Челябинская государственная медицинская академия Росздрава» (454092, г. Челябинск, ул. Воровского, 64).
С диссертацией можно ознакомиться в научной библиотеке ГОУ ВПО «Челябинская государственная медицинская академия» Росздрава (454092, г. Челябинск, ул. Воровского, 64).
Автореферат разослан « »______________2008 г.
Ученый секретарь диссертационного совета
доктор медицинских наук,
профессор КРИВОХИЖИНА Людмила Владимировна
ОБЩАЯ ХАРАКТЕРИСТИКА ДИССЕРТАЦИИ
Актуальность темы
Клеточные и гуморальные кооперации представлены при многих патологических процессах: воспалении, опухолевом росте, тромботических состояниях, атеросклерозе, аутоиммунных поражениях, сепсисе и др. Они определяют как типовые, так и специфические проявления болезни, могут иметь положительное значение, а также инициировать или развивать патологический процесс (Кузник Б.И. и др., 1981, 1989; Цыбиков Н.Н., 1984; Пальцев М.А. и др., 2003; Goel M.S. et al., 2002; Jawien J. et al., 2002).
В 2005г. Кузник Б.И. и соавт. высказали предположение, что клеточные и гуморальные факторы представляют собой единую функциональную систему, активация которой может быть представлена при различных физиологических и патологических процессах. В состав этой системы входят эндотелиоциты, все клетки крови, плазменные протеолитические системы фибринообразования, фибринолиза, комплемента, калликреин-кининовая, ренин-ангиотензиновая.
В литературе накоплен обширный материал по нарушениям отдельных элементов (Попов Г.К. и др., 1982, 1991; Гольдберг Е.Д. и др., 1999; Захаров Ю.М. и др., 2002; Ястребов А.П. и др., 1988; Кривохижина Л.В., 1993; Долгушин И.И. и др., 2001), однако малочисленны сведения о связи и взаимодействиях между клетками и гуморальными факторами в крови в рамках единой клеточно-гуморальной системы. Не определены маркеры активации клеточно-гуморальной системы при различных патологиях. Требует доказательства предположение, что активация этой системы как единого целого является проявлением типового патологического процесса.
Представители единой клеточно-гуморальной системы организма могут выступать в качестве мишеней, эффекторов и регуляторов. Взаимосвязь между составными частями системы осуществляется посредством цитокинов, гормонов, аутокоидов и др. соединений (Ярилин А.А., 1997; Фрейдлин И.С. и др., 2001; Симбирцев А.С., 2002; Nijm J. et al., 2005). В качестве регуляторов могут выступать реактанты острой фазы (РОФ), для которых характерна специфическая временная динамика, определяющая активацию или ингибицию отдельных представителей клеточно-гуморальной системы. Вызывает интерес участие РОФ в регуляции процессов взаимодействия клеток в крови, активности плазменных протеолитических систем, клеточно-гуморальной кооперации. К числу РОФ, в том числе, относятся фибриноген, плазминоген, компоненты комплемента. Эндотелиоциты и клетки крови могут синтезировать и фиксировать на своей поверхности РОФ (Назаров П.Г., 2001).
Приоритет в исследовании таких РОФ как альфа-1-кислый гликопротеин (КГП) и церулоплазмин (ЦП) принадлежит ученым Челябинской государственной медицинской академии (Саломатин В.В., 1993; Рассохин А.Г., 1997; Кривохижина Л.В. и др., 2001). Определены некоторые механизмы действия КГП и ЦП относительно отдельных представителей клеточно-гуморальной системы. КГП изменяет функцию тромбоцитов, фагоцитов, иммунореактивность, протеолиз в плазме (Fiedel B. et al., 1983; Cheresh D.A. et al., 1984; Boncela J. et al., 2001). ЦП – известный антиоксидант, изменяет количество и функцию клеток периферической крови, является иммуномодулятором, вмешивается в эндотелий-зависимые процессы (Бердинских Н.К. и др., 1992; Кривохижина Л.В. и др., 2005; Halliwell В. et al., 1982; Cappelli-Bigazzi M. et al., 1997). Локусы для связывания КГП обнаружены на эндотелиоцитах, рецепторы для ЦП – на эритроцитах, лейкоцитах, эндотелиоцитах (Kataoka M. et al., 1984, 1985; Sorrenson J. et al., 1999).
Выяснение механизмов реализации и регуляции кооперативных взаимоотношений клеток и гуморальных систем в крови позволит выяснить их фундаментальную роль в норме и при патологиях и рассматривать РОФ как биорегуляторы в рамках единой клеточно-гуморальной системы организма.
Цель работы
Доказать единство реактивных изменений клеточных и гуморальных факторов в крови как типового патологического процесса и установить роль реактантов острой фазы в его регуляции.
Задачи исследования
- Изучить изменения клеточного гомеостаза в крови, иммунореактивности, активности плазменных протеолитических систем при острой почечной недостаточности, острой печеночной недостаточности, перитонитах септического и асептического генеза.
- Исследовать наличие и выраженность окислительного стресса в клетках и жидких средах организма при острой почечной недостаточности, острой печеночной недостаточности, перитонитах септического и асептического генеза.
- Установить общие и специфические особенности развития эндогенной интоксикации при воздействии повреждающих факторов различного генеза.
- Изучить наличие и характер взаимосвязи изменений активности клеток крови и плазменных протеолитических систем при острых повреждениях различного генеза.
- Определить маркеры активации компонентов единой клеточно-гуморальной системы организма.
- Установить ведущие факторы активации единой клеточно-гуморальной системы организма, определяющие патогенез острой почечной недостаточности, острой печеночной недостаточности, асептического перитонита, септического перитонита.
- Установить роль альфа-1-кислого гликопротеина в регуляции единой клеточно-гуморальной системы организма.
- Установить роль церулоплазмина в регуляции единой клеточно-гуморальной системы организма.
Научная новизна исследования
Впервые экспериментально доказано, что эндотелиоциты, фагоциты, тромбоциты, эритроциты, иммунореактивность, активность систем протеолиза в плазме составляют единую клеточно-гуморальную систему организма. Активация единой клеточно-гуморальной системы организма является одним из механизмов формирования эндогенной интоксикации, представленной веществами низкой и средней молекулярной массы, продуктами перекисного окисления липидов (ПОЛ), показателями хемилюминесценции в плазме, гомогенатах печени, гомогенатах почек. Активация единой клеточно-гуморальной системы организма – типовой патологический процесс, протекающий по общим механизмам при острых повреждениях различного генеза. Впервые с использованием методов многомерного статистического анализа выявлены ведущие факторы активации единой клеточно-гуморальной системы организма в зависимости от патологии; маркерами выступают изменения систем плазменного протеолиза – при острой почечной недостаточности (ОПН) и септическом перитоните (СП), изменения иммунореактивности – при острой печеночной недостаточности (ОПечН) и СП, изменения эритроцитов – при ОПечН и асептическом перитоните (АсП), показатели эндогенной интоксикации – при ОПечН и АсП. Впервые доказано, что РОФ являются самостоятельными участниками единой клеточно-гуморальной системы организма; повышение концентрации КГП в интактном организме активирует функцию фагоцитов, тромбоцитов, эндотелиоцитов; повышение концентрации ЦП – стабилизирует единую клеточно-гуморальную систему организма. КГП и ЦП обладают иммуностимулирующими, антипротеолитическими, антиоксидантными и мембранопротекторными свойствами. Впервые продемонстрировано, что КГП и ЦП изменяют продукцию интерлейкинов (ИЛ) мононуклеарами периферической крови. КГП и ЦП синтез ИЛ-2, ИЛ-4 повышают, ИЛ-3 – снижают; продукцию ИЛ-1 КГП повышает, ЦП – снижает. Установлено регуляторное влияние КГП и ЦП при патологиях на компоненты единой клеточно-гуморальной системы организма, показана способность КГП и ЦП проявлять дезинтоксикационные свойства, что приводит к повышению выживаемости животных. Впервые выявлена специфичность эффектов КГП на состояние эритроцитов и иммунореактивности, эффектов ЦП – на активность плазменных протеолитических систем.
Теоретическая и практическая значимость исследования
Работа имеет фундаментальный характер. На основании комплексного исследования функциональной активности клеток крови, эндотелиоцитов, плазменных протеолитических систем, состояния эндогенной интоксикации, процессов свободно-радикального окисления вскрыты фундаментальные закономерности активации единой клеточно-гуморальной системы организма. С использованием методов математического анализа выбраны маркеры активации единой клеточно-гуморальной системы организма при острых повреждениях различного генеза. Результаты проведенного исследования существенно дополнили и расширили имеющиеся представления о роли клеточных и гуморальных факторов в патогенезе острых повреждений различного генеза. Полученные результаты установили регуляторный характер влияния КГП и ЦП на активность всех элементов единой клеточно-гуморальной системы организма. Эффекты КГП и ЦП при острых повреждениях различного генеза направлены на нормализацию активности единой клеточно-гуморальной системы организма и приводят к повышению выживаемости животных.
Основные положения, выносимые на защиту
- Клетки крови, эндотелиоциты, иммунореактивность, плазменные протеолитические системы составляют единую клеточно-гуморальную систему организма.
- Активация единой клеточно-гуморальной системы организма – типовой патологический процесс, протекающий по общим механизмам независимо от этиологии повреждающего фактора.
- Маркерами активации единой клеточно-гуморальной системы организма выступают изменения активности систем плазменного протеолиза – при ОПН и СП; изменения иммунореактивности – при ОПечН и СП; изменения эритроцитов – при ОПечН и АсП; показатели интоксикации – при ОПечН и АсП.
- КГП и ЦП являются самостоятельными участниками единой клеточно-гуморальной системы организма. В условиях интактного организма КГП выступает в роли активатора, ЦП – стабилизатора эффекторных компонентов системы; КГП и ЦП проявляют мембранопротекторные, антипротеолитические, антиоксидантные свойства.
- КГП и ЦП при острых повреждениях различного генеза являются регуляторами активности единой клеточно-гуморальной системы организма.
Публикации
По материалам диссертации опубликовано 42 научных работы, из них 25 журнальных статей, в том числе 12 – в изданиях, рекомендованных ВАК Минобрнауки РФ для докторских диссертаций.
Апробация работы
Основные положения диссертации представлены на I-ой и II-ой Всероссийских конференциях с международным участием «Микроциркуляция в клинической практике» (Москва, 2004, 2006); научно-практической конференции молодых ученых с международным участием «Современные направления теоретической и практической медицины» (Воронеж, 2005); 70-й юбилейной итоговой научной конференции с международным участием «Вопросы теоретической и практической медицины» (Уфа, 2005); III и V итоговых научно-практических конференциях молодых ученых ЧелГМА (Челябинск, 2005, 2007); международной конференции «Гемореология в макро- и микроциркуляции» (Ярославль, 2005); I съезде физиологов СНГ (Сочи, 2005); VI и VII Международных научно-практических конференциях «Здоровье и образование в XXI веке» (Москва, 2005, 2006); конференции «Актуальные проблемы медицинской науки, технологий и профессионального образования» (Челябинск, 2005); международном молодежном медицинском конгрессе «Санкт-Петербургские научные чтения» (Санкт-Петербург, 2005); I Всероссийской молодежной медицинской конференции «Экстремальные и терминальные состояния» (Омск, 2006); XXXII и XXXIV ежегодных конгрессах Европейского общества искусственных органов (XXXII Annual ESAO Congress, Bologna, Italy, 2005; XXXIV Congress of ESAO, Krems, Austria, 2007).
Внедрение результатов исследования
Результаты исследования внедрены в преподавание патофизиологии, иммунологии, биохимии в разделах «Патофизиология воспаления, ответ острой фазы», «Патофизиология системы крови», «Вспомогательные клетки иммунной системы», «Регуляция иммунитета», «Обмен белков», «Свободно-радикальное окисление» в ГОУ ВПО «Челябинская государственная медицинская академия Росздрава», ГОУ ВПО «Омская государственная медицинская академия Росздрава». Методы исследования эритроцитов внедрены в научную работу кафедры патофизиологии ГОУ ВПО «Челябинская государственная медицинская академия Росздрава» и в практику отделения диализа ГМЛПУЗ «Челябинская областная клиническая больница».
Объем и структура диссертации
Диссертация изложена на 427 страницах, содержит 220 таблиц и 104 рисунка; состоит из введения, обзора литературы, описания материалов и методов исследования, трех глав результатов собственных исследований и их обсуждения, главы заключения, выводов и списка литературы. Список литературы включает 905 источников (260 отечественных и 645 зарубежных).
СОДЕРЖАНИЕ ДИССЕРТАЦИИ
Материалы и методы исследования
Эксперименты выполнены на 976 белых нелинейных крысах обоего пола массой 200 – 240 г. в соответствии с правилами гуманного отношения к животным, методическими рекомендациями по их выведению из опыта и эвтаназии, регламентированными «Правилами проведения работ с использованием экспериментальных животных (Приказ МЗ СССР № 775 от 12.08.1977 г.) и положениями Хельсинской Декларации ВОЗ (1997). Для отдельных исследований использовали цельную кровь 230 практически здоровых людей – кадровых доноров Челябинской областной станции переливания крови.
Острую почечную недостаточность моделировали подкожным однократным введением хлорида ртути (II) (Черненко Г.П., 1965; Gstraunthaler G. et al., 1983). Острую печеночную недостаточность вызывали подкожным однократным введением 50%-ного масляного раствора CCl4 (Фишер А., 1961; William M. et al., 2003). Гипераммониемию моделировали по Lotspeich W.D. et al. (1965). Асептический перитонит индуцировали внутрибрюшинным введением 10% суспензии крахмала (Волчегорский И.А. и др., 2000). Септический перитонит моделировали внутрибрюшинным введением аутокаловой суспензии с добавлением аутокрови (Струков А. И., 1987).
Использовали препарат «Церулоплазмин» (НПО «Иммунопрепарат», г. Уфа) и препарат «Орозин» (Челябинская областная станция переливания крови). КГП и ЦП при ОПН применяли трехкратно, суммарная доза КГП – 450 мг/кг, ЦП – 60 мг/кг. КГП и ЦП при ОПечН и перитонитах применяли двукратно, суммарная доза КГП – 300 мг/кг, ЦП – 40 мг/кг.
Гематологические методы. Общепринятыми методами определяли количество эритроцитов, тромбоцитов, лейкоцитов в периферической крови, лейкоформулу. Адгезивную способность клеток крови изучали по их способности прилипать к эндотелию сосудистой стенки по разработанной оригинальной методике. АДФ-индуцированную агрегацию тромбоцитов определяли турбидиметрическим методом Борна (Born G.V.R. et al., 1963). Эритроцитарно-тромбоцитарные взаимодействия исследовали в суспензии эритроцитов и тромбоцитов. О величине поверхностного заряда эритроцитов судили на основании показателей агрегации эритроцитов, индуцированной альциановым голубым (Bernard A.M. et al., 1988; Halbhuber K.J. et al., 1977). Деформабильность эритроцитов исследовали методом эктацитометрии (Сторожок А.Г. и др., 1997; Bessis M.A. et al., 1980). Использован полупроводниковый лазер LDM 635.3.S.5 (ООО НТЦ «Лазерные технологии», г. Новосибирск). Результат выражали в ед. индекса деформабильности. Оценивали кислотную резистентность эритроцитов (Сахарчук И.И. и др., 1991; Тодоров Й., 1968). Сорбционную способность эритроцитов определяли по Тогайбаеву А.А. и др. (1988).
Гемостазиологические методы. С использованием наборов реагентов фирмы «Технология-Стандарт» (Барнаул) и реактивов фирмы «Зеро-мед» (Челябинск) определяли тромбиновое время, протромбиновое время, активированное частичное тромбопластиновое время, время рекальцификации, активированное время рекальцификации, концентрацию фибриногена, активность фактора P3 тромбоцитов, активность антитромбина, фибринолитическую активность плазмы (Баркаган З.С. и др., 2001).
Биохимические методы. Активность церулоплазмина определяли по методу Тэна Э.В. (1981). Концентрацию альфа-1-кислого гликопротеина определяли на флюориметре «Fluoroscan – II» («Labsystems», Финляндия) по методу Imamura H. A. et al. (1994). Содержание креатинина, мочевины, билирубина, АсАТ, АлАТ, общего белка, общих липидов в сыворотке определяли при помощи наборов Bio-La-Test (PLIVA-Lachema). Продукты перекисного окисления липидов (ПОЛ) определяли спектрофотометрическим методом в изопропанольной фракции липидного экстракта (Волчегорский И.А. и др., 1989, 2000; Львовская Е.И. и др., 1991). Определяли уровень ТБК-положительных продуктов (Коробейникова Э.Н., 1989). Показатели эндогенной интоксикации определяли по содержанию веществ низкой и средней молекулярной массы (Оболенский С.В. и др., 1993) и Лоури-позитивных веществ (олигопептидов) (Lowry O.H. et al., 1951) в плазме и в эритроцитарной массе. Уровень конечных стабильных метаболитов NO (![]() ) оценивали с помощью реакции Griess (Емченко Н.Л. и др., 1994).
) оценивали с помощью реакции Griess (Емченко Н.Л. и др., 1994).
Хемилюминесцентные методы. Регистрацию хемилюминесценции (ХЛ) осуществляли на аппарате «ХЛ-003» (Фархутдинов Р.Р. и др., 1998). Исследовали ХЛ плазмы, эритроцитов, тромбоцитов, лейкоцитов, гомогенатов печени, гомогенатов почек.
Иммунологические методы. Фагоцитарную способность лейкоцитов периферической крови оценивали по поглощению частиц монодисперсного ( 1,7 мкм) полистирольного латекса (Фрейдлин И.С., 1986). Уровень общей активности комплемента в плазме определяли методом титрования по 50 % гемолизу (Кэбот, Э. и др., 1968; Резникова Л.С., 1967). Клеточный Т-хелпер-1-зависимый иммунный ответ исследовали по реакции гиперчувствительности замедленного типа (Landgrade P.H. et al., 1980). Гуморальный Т-хелпер-2-зависимый иммунный ответ оценивали по количеству антителообразующих клеток (АОК) в селезенке крыс, иммунизированных аллогенными эритроцитами по методу Jerne N.K. et al. (1963) в модификации Cunningham A.J. (1965). Продукцию интерлейкинов ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4 мононуклеарами периферической крови определяли методом иммуноферментного анализа на «Multiscan plus» («Labsystems», Финляндия) с использованием тест-систем фирмы «Протеиновый контур» (ГНЦ НИИ ОЧБ, Санкт-Петербург) и фирмы «Цитокин» (ГНЦ НИИ ОЧБ, Санкт-Петербург).
Морфологические методы. Получение и анализ серийных гистологических срезов печени и почек крыс проводили общепринятыми способами.
Статистические методы. Полученные данные обрабатывали методами вариационной статистики с использованием пакета прикладных программ «Statistica for Windows 6.0» и «SPSS for Windows 13.0» (Гланц С.,1999; Реброва О.Ю., 2006). Для анализа нормальности распределения данных применяли критерий Шапиро-Уилка, для проверки гипотез о равенстве генеральных дисперсий – критерий Левена. Проверку статистических гипотез в группах проводили с использованием параметрических (t – критерий Стьюдента, парный t – критерий Стьюдента, F – точный критерий Фишера) и непараметрических (U – критерий Манна-Уитни, WW – критерий Вальда-Вольфовитца, КС – критерий Колмогорова-Смирнова, критерий Крускала-Уолиса, W – парный критерий Вилкоксона, критерий Данна) критериев. Для выявления связи между изучаемыми параметрами использовали коэффициенты корреляции Пирсона (r), Спирмена (R), Тау Кэндалла (ТК). Силу влияния факторов на исследуемые показатели оценивали методами дисперсионного анализа (Плохинский Н.А., 1978). Отличия считали статистически значимыми при р0,05. Для редукции данных и определения структуры взаимосвязей между показателями применяли метод главных компонент факторного анализа (Дубров А. М., 1978) с использованием критериев Кайзера и «каменистой осыпи» (Cattell R. B.,1966; Kaiser H.F., 1960).
Приносим благодарность за помощь и содействие при выполнении иммунологического фрагмента диссертации проф. С.Н. Тепловой (ГОУ ВПО ЧелГМА Росздрава), гемостазиологического фрагмента – доц. Е.В. Макарову (ГОУ ВПО ЧелГМА Росздрава), статистической обработки данных – ст. препод. К.Н. Кудрявцеву (ГОУ ВПО ЮУрГУ).
Результаты исследования и их обсуждение
1. Активация клеточно-гуморальной системы организма при острых повреждениях различного генеза – типовой патологический процесс
Установлено, что при ОПН, ОПечН, АсП, СП наблюдаются изменения функции эндотелиоцитов, лейкоцитов, тромбоцитов, эритроцитов, изменяется состояние систем плазменного протеолиза.
При ОПН, ОПечН и СП изменяется функция эндотелиоцитов по показателям продукции NO и адгезии к нему клеток крови. Увеличение в сыворотке крыс суммарного содержания продуктов NO (![]() ) связано с ростом нитритов и нитратов, в большей степени наблюдается прирост нитритов. При ОПечН и СП установлено изменение адгезии к эндотелию лейкоцитов. При ОПечН снижается адгезия агранулоцитов, при СП увеличивается адгезия гранулоцитов.
) связано с ростом нитритов и нитратов, в большей степени наблюдается прирост нитритов. При ОПечН и СП установлено изменение адгезии к эндотелию лейкоцитов. При ОПечН снижается адгезия агранулоцитов, при СП увеличивается адгезия гранулоцитов.
При всех патологиях наблюдается лейкоцитоз и активация фагоцитов, что проявляется усилением адгезивной и фагоцитарной функции лейкоцитов при всех моделях, но наиболее значимо при СП и ОПечН (рис. 1, 2).
 а) а) | 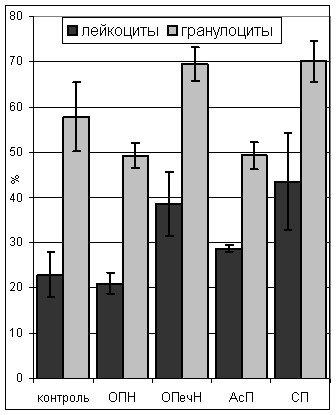 б) б) |
Рис. 1. Количество (а) и адгезивная способность (б) лейкоцитов

Рис. 2. Фагоцитарная функция лейкоцитов периферической крови
Способность фагоцитов генерировать АФК повышается при ОПН, подавляется – при ОПечН и не изменяется при перитонитах. Активация фагоцитов при ОПН, в т.ч. обусловлена уремическими токсинами. Мочевина (30 ммоль/л) в условиях in vitro повышает продукцию АФК лейкоцитами периферической крови. При ОПечН определенный вклад в снижение процессов СРО в фагоцитах вносят продукты метаболизма аммиака. В условиях изолированной гипераммониемии спонтанная и индуцированная ХЛ лейкоцитов снижается в 4 раза.
Специфический иммунный ответ крыс при патологиях изменяется, но неоднозначно (рис. 3). Клеточный ответ подавлен при ОПН, АсП, СП, гуморальный – активирован при ОПН и АсП. При ОПечН зафиксировано увеличение содержания АОК в селезенке только в пересчете на количество ЯСК, абсолютное их содержание достоверно не изменяется. Возможно, при ОПечН нарушены механизмы презентации антигенов, т.к. киллинговая способность фагоцитов подавлена. Подавление клеточного иммунитета при уремии связано с расстройствами Т-клеточной активации из-за снижения экспрессии костимулирующих молекул В7-2 (CD86) на поверхности моноцитов (Ghielli M. et al., 1997; Girndt M. et al., 2001; Portilla D., 2006).
 |
Рис 3. Специфический иммунитет при исследуемых патологиях
Изменения функциональной активности тромбоцитов обнаружены при всех патологиях (рис. 4). При ОПН адгезия и агрегация тромбоцитов снижаются. Полагают, что дисфункция тромбоцитов при уремии вторична по отношению к накоплению токсинов в плазме, прежде всего, гуанидинянтарной кислоте и обусловлена дефектами в структуре мембранных гликопротеинов IIb-IIIа, Ib и др. (Davis J.W. et al., 1972; Escolar G. et al., 1990; Noris M. et al., 1999; Pietrzak I. et al.,2001; Sloand E.M. et al., 1991). При ОПечН и перитонитах наблюдается угнетение адгезии и стимуляция агрегации тромбоцитов. Следует учитывать последовательность реализации функции тромбоцитов при активации, определяемую сменой адгезивных молекул на тромбоцитах и эндотелиоцитах. Изменение агрегации тромбоцитов при всех патологиях, в т.ч. связано с процессами СРО в тромбоцитах. ХЛ-ответ тромбоцитов в процессе их агрегации при ОПН снижается, при ОПечН, АсП, СП – возрастает. Cветосумма свечения тромбоцитов коррелирует со скоростными показателями агрегации тромбоцитов (r![]() (0,78; 0,98), р<0,05). При ОПН и СП снижается активность фактора Р3 на тромбоцитах. Данный факт при ОПН может быть следствием изменения мембранной поверхности тромбоцитов под влиянием уремических токсинов или их дериватов, что находило свое отражение в нарушении адгезивной и агрегационной функции клеток. Снижение Р3 на тромбоцитах при СП может быть связано с действием активированных плазменных протеолитических ферментов и метаболитов СРО. При СП установлена положительная достоверная корреляция между показателем АЧТВ и активностью фактора Р3 (R = 0,95; р=0,014) и отрицательная между ХЛ тромбоцитов и активностью фактора Р3 (R = 0,87; р=0,027).
(0,78; 0,98), р<0,05). При ОПН и СП снижается активность фактора Р3 на тромбоцитах. Данный факт при ОПН может быть следствием изменения мембранной поверхности тромбоцитов под влиянием уремических токсинов или их дериватов, что находило свое отражение в нарушении адгезивной и агрегационной функции клеток. Снижение Р3 на тромбоцитах при СП может быть связано с действием активированных плазменных протеолитических ферментов и метаболитов СРО. При СП установлена положительная достоверная корреляция между показателем АЧТВ и активностью фактора Р3 (R = 0,95; р=0,014) и отрицательная между ХЛ тромбоцитов и активностью фактора Р3 (R = 0,87; р=0,027).
 |
Рис. 4. Функциональная активность тромбоцитов
При всех патологиях снижается деформабильность, поверхностный заряд эритроцитов, изменяется резистентность и усиливаются процессы СРО в клетках (рис. 5). Снижение деформабильности эритроцитов прогрессирует при увеличении скорости сдвига. На малых скоростях сдвига (10,50 Н/м2 – 28,00 Н/м2) деформабильность снижается только при ОПечН и СП. При увеличении скорости сдвига (36,75 Н/м2 – 47,25 Н/м2) деформабильность эритроцитов достоверно снижается при всех патологиях. При ОПН кислотная резистентность эритроцитов повышается, эритрограмма смещается вправо, высота ее купола уменьшается (рис. 6). Кислотная эритрограмма при ОПечН смещается влево, ее высота увеличивается. При СП гемолиз начинается позже и протекает длительнее, эритрограмма незначительно смещается вправо. Изменения деформабильности и величины заряда на эритроцитах связаны с активацией в них процессов СРО (ТК![]() (0,60; 0,83), р<0,05). Методом ХЛ анализа установлено, что при всех патологиях снижается антиокислительная активность эритроцитов, увеличивается интенсивность и скорость пероксидации мембранных липидов. Изменения показателей эритроцитов имеет достоверную корреляцию с увеличением метаболитов NO в сыворотке (r
(0,60; 0,83), р<0,05). Методом ХЛ анализа установлено, что при всех патологиях снижается антиокислительная активность эритроцитов, увеличивается интенсивность и скорость пероксидации мембранных липидов. Изменения показателей эритроцитов имеет достоверную корреляцию с увеличением метаболитов NO в сыворотке (r![]() (0,91; 0,93), р<0,01).
(0,91; 0,93), р<0,01).
 а) а) |  б) б) |
Рис. 5. Поверхностный заряд (а) и деформабильность (б) эритроцитов
 |  |
Рис. 6. Кислотные эритрограммы при исследуемых патологиях
Известно, что деструктивным действием на эритроциты обладает пероксинитрит ОNОO, образующийся при взаимодействии NO c О2. Кроме этого, повышение продукции NO приводит к увеличению количества HbNO в эритроцитах, изменению физико-химических свойств цитоплазмы, что имеет существенное значение в реализации деформабильности (Bateman R.M. et al., 2001; Carvalho F.A. et al., 2006). Изменения эритроцитов при ОПечН, в т.ч., обусловлены продуктами метаболизма аммиака. При гипераммониемии снижается поверхностный заряд, усиливаются процессы СРО в эритроцитах. На ХЛ-граммах возрастает амплитуда медленной и быстрой вспышек, укорачивается латентный период.
Обнаружено, что эритроциты взаимодействуют с тромбоцитами и эндотелиоцитами. При ОПН, ОПечН количество эритроцитарно-тромбоцитарных коагрегатов увеличивается с заинтересованностью малых и больших форм. Манифестация перитонита независимо от этиологии сопровождается ослаблением эритроцитарно-тромбоцитарных взаимодействий. Полагают, что эритроцитарно-тромбоцитарные взаимодействия в крови могут быть опосредованы тромбоцитарными рецепторами СD36 и GP Ib, но не vWF, тромбоспондином, Р-селектином и СD47 (Goel M.S. et al., 2002). Адгезия эритроцитов к эндотелию увеличивается при СП достоверно, при других исследуемых состояниях – на правах тенденции. Полагают, что адгезия эритроцитов связана с адгезивными молекулами или экстернализацией фосфатидилсерина в мембране эритроцитов, что определяет их взаимодействие с матричным тромбоспондином (Bonomini M. et al., 2002; Chappey O. et al., 1994; Setty B.N. et al., 2002; Wautier J.L. et al., 2004).
При всех рассматриваемых патологиях наблюдается изменение активности плазменных протеолитических систем (рис. 7).
 |  |
Рис. 7. Активность систем плазменного протеолиза при патологиях
Общим является угнетение системы фибринолиза и активности антитромбина. Системы фибринообразования и комплемента реагируют неоднозначно. Коагуляционный каскад активируется при всех состояниях, кроме ОПечН, активность системы комплемента снижается при ОПечН и СП, возрастает – при ОПН.
При ОПечН снижение функциональной активности протеолитических систем связано с угнетением белоксинтетической функции печени и эффектами «печеночных» токсинов (Подымова С.Д., 2001; Arriaga S.M. et al., 1999; Pernambuco J.R. et al., 1993). Активации гемокоагуляции при ОПН и перитонитах вызвана контактом с полианионными поверхностями, например, уремическими токсинами при ОПН, измененными клетками крови и эндотелиоцитами. В свою очередь, активация гемокоагуляционного каскада приводит к истощению компонентов противосвертывающей и фибринолитической систем. Система комплемента активируется при ОПН по альтернативному пути уремическими токсинами (Thurman J.M. et al., 2005). При СП – по классическому пути с истощением активности системы на момент исследования. Необходимо учитывать взаимные регуляторные влияния систем плазменного протеолиза, они отражены достоверными корреляционными связями между показателями. В частности, компоненты комплемента активируют на различных этапах систему фибринообразования (Кузник Б.И., 2004; Ince A. et al., 2002; Mahajan S. et al., 2005; Monsinjon T. et al., 2003).
Следствием активации клеточных и гуморальных факторов в крови при патологиях является синдром эндогенной интоксикации, презентируемый накоплением ВНиСММ и усилением процессов СРО (рис. 8, 9).
 а) а) |  б) б) |
Рис. 8. Выраженность интоксикации в плазме (а) и в эритроцитах (б)
 а) а) |  б) б) |
Рис. 9. Показатели ХЛ (а) и содержание продуктов ПОЛ (б) в плазме
Особенностью распределения эндотоксинов в крови при патологиях является их концентрация в плазме при ОПН и АсП, в эритроцитах – при ОПечН, равнозначная локализация при СП. Преимущественной формой накопления токсинов являются ЛПВ. Окислительный стресс в плазме наблюдается при всех патологиях. Это отражается на ХЛ-граммах увеличением интенсивности и скорости процессов ПОЛ, снижением антиокислительной активности. В изопропанольных экстрактах плазмы возрастает содержание первичных и вторичных продуктов ПОЛ, в плазме увеличивается количество ТБК-положительных продуктов.
Выраженность активации процессов СРО во внутренних органах определяется их первичным поражением: в гомогенате почек наиболее значима при ОПН, в гомогенате печени – при ОПечН (рис. 10, 11). В гомогенатах печени при Fe2+-индуцированной ХЛ увеличивается амплитуда медленной вспышки и укорачивается латентный период, при биохимическом анализе – возрастает содержание первичных и вторичных продуктов ПОЛ в изопропанольном экстракте. Усиление процессов СРО в почках доказывается показателями Fe2+-индуцированной ХЛ и содержанием продуктов ПОЛ в изопропанольном экстракте.
Процессы СРО в гомогенатах печени и почек относительно компенсированы. По показателям ХЛ констатируется готовность к активации процессов ПОЛ, конечные продукты ПОЛ в гомогенатах не накапливаются. Происходит первичное истощение антиоксидантной защиты клеток печени и почек, о чем свидетельствует укорочение латентного периода на ХЛ-граммах с последующим накоплением продуктов ПОЛ в самих органах и в плазме.
Таким образом, при всех патологиях наблюдается активация клеточных и гуморальных факторов в крови (рис. 12).
 а) а) |  б) б) |
Рис. 10. Показатели ХЛ (а) и содержание продуктов ПОЛ (б) в гомогенате печени
 а) а) |  б) б) |
Рис. 11. Показатели ХЛ (а) и содержание продуктов ПОЛ (б) в гомогенате почек


Рис. 12. Изменения активности компонентов клеточно-гуморальной системы организма при рассматриваемых патологиях относительно контрольной группы.
Пропущены показатели, изменения которых не имеют стат. значимости
Большое число исследуемых показателей (в совокупности около 130) не позволяет выявить характер связи между ними и доказать факт активации клеточно-гуморальной системы при рассмотренных острых повреждениях. Для выделения и обоснования главных компонент – системы взаимозависимых признаков, наиболее существенно влияющих на развитие исследуемых патологий, использованы методы многомерного статистического анализа, в частности, компонентный анализ. Механизм отбора главных компонент показан на рис. 13 на примере эндотелиоцитов. Показатели объединены в 2 главные компоненты (F1 и F2), т.к. факторная нагрузка каждой превышает 10%. Оставшиеся компоненты представляют «факториальную осыпь» (Cattell R. B.,1966).

Рис. 13. Собственные значения корреляционной матрицы (![]() ) главных компонент эндотелиоцитов.
) главных компонент эндотелиоцитов.
Суммарная дисперсия, объясняемая F1…F2 (заштрихованная область), составляет при ОПН – 60,4%, при ОПечН – 63,9%, при АсП – 61,9%, при СП – 68,6%
Независимо от вида патологии в составе главных компонент оказались показатели одинаковые, но с разным относительным вкладом. Состояние эндотелиоцитов характеризуют адгезия к нему лейкоцитов и концентрация метаболитов NO. Иммунореактивность определяют количество, адгезивная и фагоцитарная способности лейкоцитов, показатели специфического иммунитета. Активность тромбоцитов презентируют агрегация, адгезия, фактор Р3. Состояние эритроцитов определяется поверхностным зарядом, деформабильностью, показателями СРО. Активность систем плазменноного протеолиза определяют показатели фибринообразования, фибринолиза, комплемента, активность антитромбина. Интоксикацию характеризуют концентрация ВНиСММ и продуктов ПОЛ, показатели ХЛ в плазме, гомогенатах почек и печени.
Для доказательства единства активации клеточных и гуморальных факторов введена интегральная функция F (1)
F![]() , (1)
, (1)
где ![]() – 11 ключевых показателей, обладающих максимальной факторной нагрузкой на основании синтеза главных компонент при ОПН, ОПечН, АсП и СП: 1) суммарное содержание конечных метаболитов оксида азота (II) –
– 11 ключевых показателей, обладающих максимальной факторной нагрузкой на основании синтеза главных компонент при ОПН, ОПечН, АсП и СП: 1) суммарное содержание конечных метаболитов оксида азота (II) – ![]() , мкмоль/л; 2) общее количество лейкоцитов в периферической крови,•109/л; 3) генерация активных форм кислорода фагоцитами периферической крови по показателю светосуммы хемилюминесценции, у.е.•мин; 4) скорость агрегации тромбоцитов, %/мин; 5) деформабильность эритроцитов при напряжении сдвига 36,75 Н/м2; 6) фибринообразование по показателю тромбинового времени, с; 7) общая фибринолитическая активность плазмы, мин; 8) активность системы комплемента по показателю СН50, у.е.; 9) активность антитромбина, с; 10) активность процессов свободно-радикального окисления в плазме по величине амплитуды медленной вспышки на хемилюминограммах, у.е. 11) общее количество ВНиСММ в крови, у.е.;
, мкмоль/л; 2) общее количество лейкоцитов в периферической крови,•109/л; 3) генерация активных форм кислорода фагоцитами периферической крови по показателю светосуммы хемилюминесценции, у.е.•мин; 4) скорость агрегации тромбоцитов, %/мин; 5) деформабильность эритроцитов при напряжении сдвига 36,75 Н/м2; 6) фибринообразование по показателю тромбинового времени, с; 7) общая фибринолитическая активность плазмы, мин; 8) активность системы комплемента по показателю СН50, у.е.; 9) активность антитромбина, с; 10) активность процессов свободно-радикального окисления в плазме по величине амплитуды медленной вспышки на хемилюминограммах, у.е. 11) общее количество ВНиСММ в крови, у.е.;
Изменение активности клеточно-гуморальной системы организма может рассматриваться как единый комплекс событий, запускаемых действием повреждающих факторов различной этиологии. Установлено, что по показателю F между группами «Контроль», «ОПН», «ОПечН», «АсП», «СП» имеются статистически значимые различия (критерий Краскела – Уоллиса; р<0,01) (табл. 1).
Таблица 1
Значения интегральной функции F в исследуемых группах животных (M±m; s)
| Контроль | ОПН | ОПечН | АсП | СП |
| 30,83±0,43; 1,74 | 32,71±0,29; 0,97 | 34,46±0,69; 1,85 | 36,37±0,67; 1,65 | 31,77±0,64; 2,13 |
С использованием непараметрического множественного «стягивающего» сравнения по критерию Данна (вариант критерия Ньюмена – Кейлса) доказано, что между группами «Контроль» – «ОПН», «Контроль» – «ОПечН», «Контроль» – «АсП», «Контроль» – «СП» имеются статистически значимые различия (критерий Данна Q = 4,05; критическое Q при р = 0,01 составляет 3,02). Учитывая, что значение функции F при ОПН, ОПечН, АсП, СП выше, чем в группе контроля, можно заключить, что активация единой клеточно-гуморальной системы организма представлена при всех патологиях. Более того, активация единой клеточно-гуморальной системы организма не зависит от вида патологии, т.к. между группами «ОПН», «ОПечН», «АсП» и «СП» не обнаружено статистически значимых различий по интегральному показателю F (Q = 2,59; критическое Q при р = 0,05 составляет 2,81).
Итак, активация клеточно-гуморальной системы организма при воздействии повреждающих факторов может рассматриваться как типовой патологический процесс (рис. 14). Активация клеточно-гуморальной системы организма:
- является стереотипной и универсальной (монопатогенетичность), имеет типичные черты независимо от локализации в структуре различных нозологических единиц;
- не зависит от этиологии (полиэтиологичность), т.к пусковыми факторами являются различные по своей природе воздействия;
- отвечает представлениям об аутохтонных и эквифинальных процессах, при всех моделируемых ситуациях воздействие повреждающего фактора было однократным и достаточным для дальнейшего саморазвития процесса через все запрограммированные этапы с участием клеток крови, эндотелиоцитов, систем плазменного протеолиза.
Повышение активности компонентов единой клеточно-гуморальной системы организма приводит к вторичным изменениям клеток и плазменных протеолитических систем в крови. Сопутствующими факторами активации системы выступают гипоксия смешанного генеза и эндогенная интоксикация. Эндогенная интоксикация возникает в ответ на первичное повреждение тканей, а также является интегральным следствием активации клеточно-гуморальной системы организма.
2. Выявление ведущих факторов активации единой клеточно-гуморальной системы организма при острых повреждениях различного генеза
С целью ранжирования и определения удельного веса компонентов единой клеточно-гуморальной системы в патогенезе ОПН, ОПечН, АсП и СП применили метод дисперсионного анализа.
Исследуемые модели различаются по количественному представительству ведущих факторов патогенеза (рис. 15-18). 2/3 всех факторов патогенеза представлены изменениями плазменных протеолитических систем, иммунореактивности, эритроцитов, интоксикацией. Вклад дисфункции эндотелия и тромбоцитов при всех рассматриваемых патологиях незначителен и составляет от 5% до 13%. Ведущими факторами патогенеза ОПН являются изменения активности систем плазменного протеолиза, эритроцитов и интоксикация, занимающие 64% в общей сумме факторов. Развитие ОПечН и АсП характеризуется изменениями эритроцитов, иммунореактивности и накоплением эндотоксинов соответственно на 62% и 72%. При СП в роли факторов патогенеза выступают изменения плазменного протеолиза, иммунореактивности, интоксикация – они составляет 64% от всей суммы факторов.

Рис. 14. Активация единой клеточно-гуморальной системы организма при рассматриваемых патологиях и ее последствия

Рис. 15. Удельный вес компонентов клеточно-гуморальной системы при ОПН

Рис. 16. Удельный вес компонентов клеточно-гуморальной системы при ОПечН

Рис. 17. Удельный вес компонентов клеточно-гуморальной системы при АсП

Рис. 18. Удельный вес компонентов клеточно-гуморальной системы при СП
Итак, специфика активации единой клеточно-гуморальной системы при острых повреждениях различного генеза проявляется лишь в количественном представительстве ее отдельных компонентов.
В изменениях активности плазменных протеолитических систем имеют значение три компонента, два из которых одинаковы для ОПН и СП – системы фибринолиза и комплемента, в роли третьей при ОПН выступает активность антитромбина, при СП – активность системы фибринообразования. Изменения эритроцитов проявляются снижением заряда эритроцитов, их деформабильности, усилением интенсивности процессов СРО. Изменения иммунореактивности представлены количеством и функциональной активностью фагоцитов. На первом месте изменений фагоцитов при патологиях выступает количество клеток в крови, затем следуют фагоцитарная функция и адгезия. Накопление эндотоксинов происходит преимущественно в крови, затем следуют гомогенаты печени и почек. Формой накопления эндотоксинов являются ВНиСММ, первичные и вторичные продукты ПОЛ.
3. Роль альфа-1-кислого гликопротеина и церулоплазмина в регуляции единой клеточно-гуморальной системы организма при острых повреждениях различного генеза
Для выяснения характера регуляторного влияния КГП и ЦП на главные компоненты единой клеточно-гуморальной системы использованы данные факторного анализа главных компонент.
Для демонстрации регуляторных эффектов ЦП и КГП введен термин «остаточная патология» и использована одномерная ось координат, где 0 у.е. – это уровень интактных животных (норма), 100 у.е. – уровень патологии. «Остаток патологии» по главной компоненте рассчитывали по формуле разности математических ожиданий (2):
(патология+препарат) – интактные
патология – интактные (2)
При ОПН на главные компоненты эндотелиоцитов КГП не оказывает влияния, ЦП – повышает продукцию оксида азота (II) (табл. 2). Регуляция иммунореактивности КГП и ЦП происходит через изменение количества лейкоцитов в периферической крови и показателей фагоцитоза в составе соответственно 1-ой и 2-ой главных компонент. Влияние ЦП и КГП на тромбоциты идет через показатели агрегации, адгезии и количественного представительства в крови, находящихся в составе соответственно 1-ой, 2-ой и 3-ей главных компонент. КГП нормализует адгезивную и агрегационную способности тромбоцитов. ЦП восстанавливает агрегацию тромбоцитов, но не адгезию. Регуляция состояния эритроцитов реализуется КГП за счет их поверхностного заряда. Активность плазменных протеолитических систем регулируется КГП через все главные компоненты, ЦП – через 1-ую и 3-ю. Изменение интоксикации КГП и ЦП осуществляют через ВНиСММ и продукты ПОЛ в крови на основании 1-ой главной компоненты.
Таблица 2
Влияние КГП и ЦП на количество «остаточной патологии» (у.е.) по показателям главных компонент клеточно-гуморальной системы при ОПН
| Главные компоненты | ОПН+КГП | ОПН+ЦП | |
| Эндотелиоцитов | F1 – адгезия лейкоцитов | – | – |
| F2 – метаболиты NO | – | 209 | |
| Иммунореактивности | F1 – количество лейкоцитов | 4,35 | – |
| F2 – показатели фагоцитоза | -49 | 35,7 | |
| F3 – адгезия лейкоцитов | – | – | |
| Тромбоцитов | F1 – показатели агрегации | -59,5 | 45,2 |
| F2 – адгезия | 16,39 | 218,6 | |
| F3 – количество в крови | -37,07 | 114 | |
| Эритроцитов | F1 – поверхностный заряд | 15,84 | – |
| F2 – процессы СРО | – | – | |
| F3 – деформабильность | – | – | |
| Активность систем плазменного протеолиза | F1 – АТ, фибринолиз, комплемент | 54,73 | 143,49 |
| F2 – фибринообразование | 52,28 | – | |
| F3 – фибриноген в крови | 29,9 | 48,91 | |
| Интоксикации | F1 – в плазме | 37,55 | 65,17 |
| F2 – в гомогенате печени | – | – | |
| F3 – в гомогенате почек | – | – | |
Примечание. Пропущены значения главных компонент, не имеющих статистической значимости.
Таким образом, КГП оказывает выраженный нормализующий эффект на все главные компоненты единой клеточно-гуморальной системы организма при ОПН, в том числе, на ведущие: активность плазменного протеолиза, изменения эритроцитов, выраженность интоксикации. ЦП в отношении главных факторов патогенеза ОПН оказывает только дезинтоксикационный эффект. ЦП в меньшей степени по сравнению с КГП приближает к уровню интактных животных главные компоненты интоксикации, патологии иммунореактивности. Под влиянием ЦП удельный вес главных компонент систем плазменного протеолиза, дисфункции эндотелия и тромбоцитов смещается в сторону увеличения «остаточной патологии».
Для математической оценки интегрального влияния КГП или ЦП на главные компоненты единой клеточно-гуморальной системы при ОПН использована аналоговая формула полной вероятности (3):
 , (3)
, (3)
где К – суммарный «остаток патологии» после применения КГП (ЦП),
А – «остаток патологии» по главной компоненте, рассчитанный по формуле (2),
В – уровень относительной значимости главной компоненты по данным дисперсионного анализа,
n – общее количество главных компонент при данной патологии.
Суммарная «остаточная патология» при ОПН после применения препаратов составила: для КГП – 61,61%, для ЦП – 113,92% (рис. 19).

Рис. 19. Интегральное влияние КГП и ЦП на главные компоненты единой клеточно-гуморальной системы организма при ОПН
При ОПечН КГП и ЦП регулируют функциональную активность иммунокомпетентных клеток, эндотелиоцитов, состояние эритроцитов, активность систем плазменного протеолиза и снижают выраженность интоксикации. Влияние КГП при ОПечН преимущественно направлено на показатели иммунореактивности, эритроцитов и интоксикации. ЦП, кроме этого, регулирует активность эндотелиоцитов и систем плазменного протеолиза (табл. 3). При ОПечН регуляция активности эндотелиоцитов осуществляется ЦП за счет продукции NO и адгезивного потенциала эндотелиоцитов, КГП – только за счет адгезивного потенциала. Действие КГП и ЦП на иммунореактивность осуществляется через количество лейкоцитов в крови, их фагоцитарную и адгезивную способности, входящих в состав соответственно 1-ой, 2-ой и 3-ей главных компонент. Влияние КГП и ЦП на тромбоциты при ОПечН не имеет статистической значимости. Регуляция КГП и ЦП состояния эритроцитов идет через изменение поверхностного заряда и деформабильности в составе 1-3 главных компонент. Регуляция активности систем плазменного протеолиза при ОПечН осуществляется ЦП за счет всех главных компонент, КГП – только первой. Изменение показателей интоксикации реализуется КГП и ЦП в плазме, гомогенатах почек и печени, что отражается 1-3 главными компонентами.
Таблица 3
Влияние КГП и ЦП на количество (у.е.) «остаточной патологии» по показателям главных компонент клеточно-гуморальной системы при ОПечН
| Главные компоненты | ОПечН+КГП | ОПечН+ЦП | |
| Эндотелиоцитов | F1 – метаболиты NO | – | 55,6 |
| F2 – адгезия лейкоцитов | 34,5 | -10,2 | |
| Иммуно-реактивности | F1 – количество лейкоцитов | -5 | – |
| F2 – показатели фагоцитоза | -13 | 6 | |
| F3 – адгезия лейкоцитов | 41,3 | 8 | |
| Тромбоцитов | F1 – показатели агрегации | – | – |
| F2 – фактор Р3 | – | – | |
| F3 – количество в крови | – | – | |
| Эритроцитов | F1 – поверхностный заряд | -181 | -50,6 |
| F2 – деформабильность | 25 | -52,5 | |
| F3 – поверхностный заряд | -25,7 | -21,1 | |
| Активности систем плазменного протеолиза | F1 – фибринолиз,комплемент | -143,3 | -188,5 |
| F2 – фибринообразование | – | 185,9 | |
| F3 – антитромбин | – | -169 | |
| Интоксикации | F1 – в плазме | 88,76 | 46,07 |
| F2 – в гомогенате почек | -127 | -61 | |
| F3 – в гомогенате печени | -64 | -62 | |
Примечание. Пропущены значения главных компонент, не имеющих статистической значимости.
Эффекты КГП и ЦП направлены на ведущие факторы патогенеза ОПечН: изменения эритроцитов, иммунореактивности, интоксикацию. Интегральные эффекты КГП и ЦП при ОПечН равнозначны (рис. 20). После применения КГП доля «оставшейся патологии» составляет 76,89%, после применения ЦП – 76,56%.

Рис. 20. Интегральный эффект КГП и ЦП на компоненты единой клеточно-гуморальной системы организма при ОПечН
При АсП действие КГП и ЦП направлено на патогенетически значимые компоненты единой клеточно-гуморальной системы организма: иммунореактивность, эритроциты и интоксикацию (табл. 4).
Таблица 4
Влияние КГП и ЦП на количество (у.е.) «остаточной патологии» по показателям главных компонент клеточно-гуморальной системы при АсП
| Главные компоненты | АсП+КГП | АсП+ЦП | |
| Эндотелиоцитов | F1 – метаболиты NO | – | – |
| F2 – адгезия лейкоцитов | – | – | |
| Иммуно-реактивности | F1 – специф. иммунитет | 32,1 | 48,1 |
| F2 – количество лейкоцитов | -71 | – | |
| F3 – показатели фагоцитоза | – | – | |
| Тромбоцитов | F1 – показатели агрегации | – | – |
| F2 – количество в крови | – | – | |
| F3 – фактор Р3 | – | – | |
| Эритроцитов | F1 – показатели СРО (ПОЛ) | 46,4 | – |
| F2 – поверхностный заряд | – | – | |
| F3 – показатели СРО (АОА) | 59,4 | 62,5 | |
| Активности систем плазменного протеолиза | F1 – коагуляция и фибринолиз | – | – |
| F2 – комплемент | – | – | |
| F3 – антитромбин | – | – | |
| Интоксикации | F1 – в плазме | 81,7 | 30,1 |
| F2 – в гомогенате печени | – | – | |
| F3 – в гомогенате почек | 146,8 | 158,7 | |
Примечание. Пропущены значения главных компонент, не имеющих статистической значимости.
КГП и ЦП регулируют специфический иммунитет и процессы СРО в эритроцитах. Дезинтоксикационный эффект КГП и ЦП проявляется только в плазме. При АсП КГП и ЦП не оказывают статистически значимого влияния на главные компоненты показателей эндотелиоцитов, тромбоцитов, систем плазменного протеолиза.
Регуляция иммунореактивности при АсП осуществляется КГП через изменение специфического иммунитета и количества лейкоцитов в крови, входящих в состав соответственно 1-ой и 2-ой главных компонент, ЦП изменяет только специфический иммунитет. Действие КГП и ЦП на эритроциты реализуется за счет показателей СРО в составе 1-ой и 3-ей главных комопонент. КГП и ЦП изменяют выраженность интоксикации при АсП в плазме и почках на основании 1-й и 3-ей главных компонент. Несмотря на некоторые различия в действиях КГП и ЦП при АсП, их суммарный эффект оказывается практически равнозначным (рис. 21). Совокупный «остаток патологии» по показателям в составе главных компонент составил для КГП 71,79%, для ЦП – 70,43%.

Рис. 21. Интегральное влияние КГП и ЦП на компоненты единой клеточно-гуморальной системы организма при АсП
При СП КГП и ЦП регулируют активность единой клеточно-гуморальной системы организма через изменение иммунореактивности, состояния тромбоцитов, эритроцитов и систем плазменного протеолиза. Эффекты КГП и ЦП носят нормализующий характер и направлены на ведущие патогенетические факторы СП. Отличительной особенностью действия КГП являются иммунотропные эффекты, ЦП – выраженное изменение активности антитромбина и эфферентные свойства в плазме (табл. 5). При СП КГП и ЦП статистически значимо не влияют на показатели эндотелиоцитов. Регуляция иммунореактивности при СП осуществляется КГП и ЦП через изменение количества, адгезии и фагоцитоза лейкоцитов, входящих в состав соответственно 1-ой, 2-ой и 3-ей главных компонент. Влияние КГП и ЦП на тромбоциты реализуется через показатели агрегации в составе 1-ой главной компоненты. КГП и ЦП изменяют состояние эритроцитов по показателям деформабильности, поверхностного заряда и кислотной резистентности, находящихся в составе трех главных компонент. Регуляция систем плазменного протеолиза при СП осуществляется КГП и ЦП через изменение активности антитромбина в составе 2-ой главной компоненты. Влияние на показатели интоксикации при СП статистически значимо проявилось только у ЦП в отношении показателей плазмы в составе 1-й главной компоненты.
Таблица 5
Влияние КГП и ЦП на количество (у.е.) «остаточной патологии» по показателям главных компонент клеточно-гуморальной системы при СП
| Главные компоненты | СП+КГП | СП+ЦП | |
| Эндотелиоцитов | F1 – метаболиты NO | – | – |
| F2 – адгезия лейкоцитов | – | – | |
| Иммуно-реактивности | F1 – количество лейкоцитов | 3,3 | – |
| F2 – адгезия лейкоцитов | -45,8 | 14,5 | |
| F3 – показатели фагоцитоза | -308,7 | -61 | |
| Тромбоцитов | F1 – показатели агрегации | 17,1 | 46 |
| F2 – количество в крови | – | – | |
| F3 – адгезия тромбоцитов | – | – | |
| Эритроцитов | F1 – деформабильность | 1,3 | 18,4 |
| F2 – поверхностный заряд | 51,6 | 38 | |
| F3 – кислотная резистентность | -138,5 | -174,7 | |
| Активности систем плазменного протеолиза | F1 – фибринообразование, фибринолиз, комплемент | – | – |
| F2 – антитромбин | -13,8 | -272 | |
| F3 – концентрация фибриногена | – | – | |
| Интоксикации | F1 – в плазме | – | 65 |
| F2 – в гомогенате печени | – | – | |
| F3 – в гомогенате почек | – | – | |
Примечание. Пропущены значения главных компонент, не имеющих статистической значимости.
Интегральный эффект на активность компонентов единой единой клеточно-гуморальной системы организма при СП более выражен у КГП. Суммарная «остаточная патология» после применения КГП составила – 59,0%, после применения ЦП – 70,21% (рис. 22).
Итак, КГП и ЦП вмешиваются в реализацию активности единой клеточно-гуморальной системы организма при всех рассматриваемых патологиях – ОПН, ОПечН, АсП и СП. Специфика действия КГП и ЦП при патологиях связана с выраженностью эффектов в отношении отдельных элементов единой клеточно-гуморальной системы организма. Влияние КГП преимущественно направлено на изменение иммунореактивности и состояние эритроцитов, что наиболее значимо проявилось при ОПечН и СП. Особенностью эффектов ЦП является направленность на активность систем плазменного протеолиза при ОПН, ОПечН и СП. КГП и ЦП солидарно проявляют дезинтоксикационные и антиоксидантные свойства при рассматриваемых патологиях.

Рис. 22. Интегральное влияние КГП и ЦП на компоненты единой клеточно-гуморальной системы организма при СП
4. Патофизиологическая роль альфа-1-кислого гликопротеина в единой клеточно-гуморальной системе организма
Эффекты КГП при патологиях носят регуляторный характер, направлены на нормализацию активности компонентов единой клеточно-гуморальной системы в условиях ее активации при острых повреждениях.
- КГП изменяет активность эндотелиоцитов (увеличивает концентрацию конечных метаболитов NO, адгезивную способность по отношению к эритроцитам – повышает, по отношению к лейкоцитам – регулирует);
- КГП снижает представительство в крови и функциональную активность фагоцитов по показателям адгезии и поглотительной способности, влияние на продукцию АФК зависит от исходного уровня и направлено на его нормализацию;
- в отношении специфического звена иммунореактивности КГП выступает в роли иммуномодулятора. КГП стимулирует сниженные или неизменные показатели клеточного и гуморального ответов, но подавляет увеличенные;
- КГП регулирует функциональную активность тромбоцитов по показателям адгезии, агрегации, процессов свободно-радикального окисления в клетках;
- КГП нормализует транспортные свойства эритроцитов, восстанавливая их деформабильность, поверхностный заряд, устойчивость к повреждающему воздействию. Одним из механизмов действия КГП выступает регуляция процессов свободно-радикального окисления в эритроцитах;
- КГП является мембранопротектором, так как увеличивает антиокислительную активность эритроцитов, гомогенатов почек и печени;
- КГП угнетает гемокоагуляцию, активирует фибринолиз и регулирует активность системы комплемента;
- дезинтоксикационный эффект КГП реализуется за счет снижения концентрации ВНиСММ в крови. Особенностью дезинтоксикационного действия КГП при ОПН является перераспределение ВНиСММ между плазмой и эритроцитами;
- КГП выступает в роли антиоксиданта, т.к. снижает интенсивность процессов свободно-радикального окисления и содержание первичных и вторичных продуктов ПОЛ в плазме, гомогенатах почек и печени.
Указанные эффекты КГП могут снижать выраженность вторичной альтерации в очаге повреждения, что имеет протекторное значение в рамках острофазового ответа. Нормализуя активность клеток первой линии обороны при повреждении – фагоцитов и тромбоцитов, КГП одновременно активирует специфическое звено защиты. Способствующим фактором выступает улучшение гемореологии в связи с регуляцией агрегатного состояния крови – нормализацией транспортных свойств эритроцитов, угнетением фибринообразования, восстановлением фибринолиза. Эфферентные и антиоксидантные свойства КГП снижают дистантное воздействие первичных и вторичных эндотоксинов и препятствуют реализации системного воспалительного ответа. Следствием регуляции активности единой клеточно-гуморальной системы организма является повышение выживаемости животных при моделируемых патологиях. КГП повышает выживаемость крыс при ОПН – на 23%, при ОПечН – на 10%, при СП – на 20%. Итак, КГП – участник единой клеточно-гуморальной системы организма, его эффекты играют защитную роль при острых повреждениях различного генеза.
КГП может вмешиваться в реализацию неспецифических и специфических защитных механизмов через изменение концентрации цитокинов. КГП повышает продукцию мононуклеарами периферической крови ИЛ-1, ИЛ-2, ИЛ-4, снижает синтез ИЛ-3. Эффекты КГП статистически значимо проявились в диапазоне доз 50%-100% от его физиологического уровня в крови.
КГП самостоятельно дестабилизирует единую клеточно-гуморальную систему организма (рис. 23). Повышение концентрации КГП в интактном организме вызывает эффекты, аналогичные таковым при рассматриваемых острых повреждениях различного генеза.
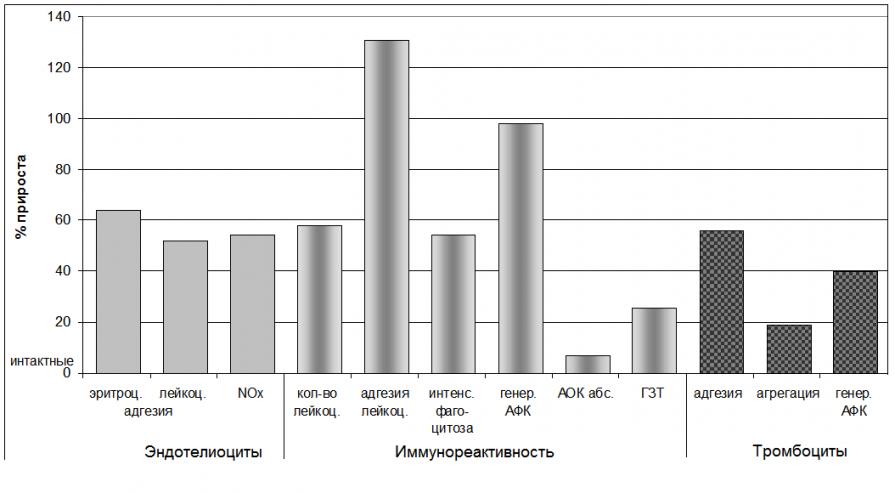
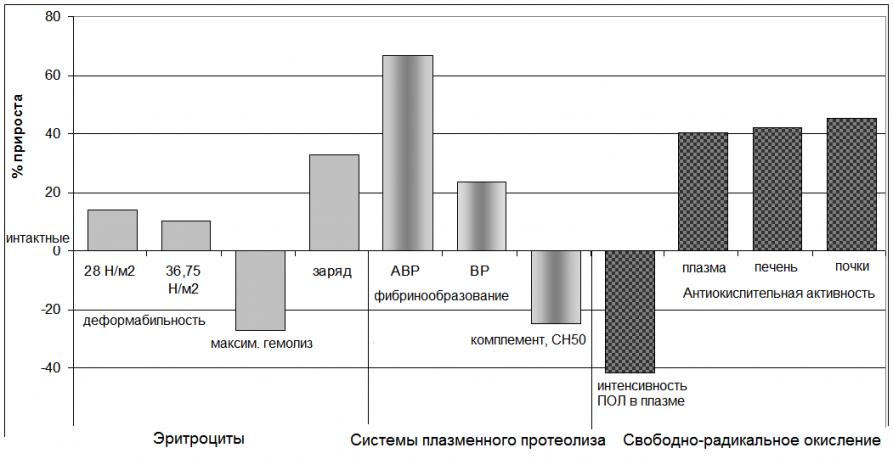
Рис. 23. Влияние КГП на компоненты единой клеточно-гуморальной системы организма у интактных животных.
Показан прирост средних значений показателей относительно интактных животных. Все показатели достоверно (р<0,05) отличаются от показателей в группе интактных животных
КГП активирует эффекторные механизмы резистентности организма, связанные с реализацией функции фагоцитов, клеточного звена специфического иммунитета, тромбоцитов и эндотелиоцитов. КГП оказывает мембранопротекторное действие в отношении эритроцитов, улучшает их транспортные свойства, что наряду с угнетением системы фибринообразования и комплемента способствует улучшению гемореологической обстановки. КГП проявляет антиоксидантные свойства в плазме и паренхиматозных органах, снижает интенсивность процессов ПОЛ и повышает их антиокислительную активность, препятствуя таким образом повреждающему действию оксидативного стресса в условиях активации эффекторных элементов единой клеточно-гуморальной системы организма.
5. Патофизиологическая роль церулоплазмина в единой клеточно-гуморальной системе организма
Применение церулоплазмина при острых повреждениях различного генеза приводит к изменению активности клеточно-гуморальной системы организма. Церулоплазмин:
- изменяет функциональное состояние эндотелиоцитов по показателям адгезии к нему клеток крови и продукции NO;
- снижает количество в крови лейкоцитов, изменяет функциональную активность фагоцитов по показателям адгезии, поглотительной способности, генерации АФК;
- обладает иммуностимулирующими свойствами по показателям клеточного и гуморального ответов (интенсивность реакции ГЗТ и количество АОК в селенке);
- снижает функциональную активность тромбоцитов по показателям адгезии, агрегации, генерации АФК;
- нормализует транспортные свойства эритроцитов, повышая их деформабильность, поверхностный заряд, устойчивость к повреждающим воздействиям и антиокислительную активность;
- является мембранопротектором, т.к. повышает антиокислительную активность эритроцитов, гомогенатов почек и печени;
- обладает антикоагулянтным действием, повышает активность антитромбина, систем фибринолиза и комплемента;
- проявляет антиоксидантные свойства, снижая интенсивность процессов СРО в плазме, клетках крови и в гомогенатах почек, печени;
- снижает выраженность интоксикации за счет уменьшения концентрации ВНиСММ в плазме и эритроцитах.
ЦП по совокупности исследуемых показателей является регулятором активности клеточно-гуморальной системы организма, т.к. его эффекты в отношении элементов системы имеют неоднозначную направленность и приводят к нормализации большинства параметров. ЦП при острых повреждениях проявляет свойства противовоспалительного медиатора. В механизмах действия ЦП необходимо учитывать, что он принадлежит к РОФ III эшелона, максимальный пик концентрации ЦП в сыворотке наблюдается через 72 ч от острого повреждения и сохраняется до завершения репаративных реакций. При этом, эффекты ЦП не ограничиваются общеизвестным антиоксидантным действием, ЦП изменяет функционирование всей клеточно-гуморальной системы, одни элементы которой активирует, другие – подавляет, способствуя тем самым, включению репаративных механизмов в очаге повреждения. Так, ЦП приводит к снижению активности эффекторных клеток острого повреждения фагоцитов и тромбоцитов, процессов СРО в организме. ЦП нарушает автономию очага повреждения за счет угнетения фибринообразования, повышения фибринолиза, восстановления транспортных свойств эритроцитов. Известно, что антипротеолитическое действие ЦП способствует уменьшению степени повреждения и приводит к ускорению морфологического восстановления тканей в очаге воспаления (Миндюк М.В., 1988). Приводя к затуханию острых альтеративных и экссудативных изменений в очаге повреждения и тем самым участвуя в преиммунном ответе организма, ЦП готовит плацдарм для реализации специфических иммунных механизмов. Это подтверждается иммуностимулирующими свойствами ЦП в отношении эффекторов клеточного и гуморального иммунного ответа. Иммунокомпетентные клетки являются элементами второй линии обороны при повреждении и регуляторами репаративных реакций. В эксперименте показано, что применение ЦП при гриппозной инфекции увеличивает резистентность мышей к вирусу гриппа, уменьшает иммунодепрессивное действие вируса и активирует специфические механизмы защиты (Бердинских Н.К., 1994).
Влияние ЦП на активность компонентов единой клеточно-гуморальной системы организма может быть опосредовано изменением продукции цитокинов. ЦП повышает синтез мононуклеарами периферической крови ИЛ-2 и ИЛ-4, снижает продукцию ИЛ-1 и ИЛ-3. Эффекты ЦП значимо проявились в дозах 50%-100% от его физиологического уровня в крови.
Отражением регуляторного характера влияния ЦП на активность единой клеточно-гуморальной системы организма при острых повреждениях различного генеза является повышение выживаемости животных. При ОПН этот эффект проявляется на правах тенденции, выживаемость составляет 73% против 60% в контрольной группе (р=0,14; критерий хи-квадрат по Пирсону). Применение ЦП при ОПечН достоверно увеличивает выживаемость на 10%, с 90% в контрольной группе до 100% при введении ЦП (р=0,04; критерий хи-квадрат по Пирсону). Аналогичный показатель при СП возрастает на 17%, с 70% в контроле до 87% в условиях применения ЦП (р=0,04; точный критерий Фишера).
Повышение концентрации ЦП в интактном организме приводит к стабилизации единой клеточно-гуморальной системы организма. Здесь ЦП функционирует как иммуностимулятор, обладает антипротеолитическим, антиоксидантным, мембранопротекторным действием (рис. 24).


Рис. 24. Влияние ЦП на компоненты единой клеточно-гуморальной системы организма у интактных животных.
Показан прирост средних значений показателей относительно интактных животных. * – достоверные (р<0,05) отличия от показателей в группе интактных животных
ЦП улучшает гемореологическую обстановку, т.к. повышает деформабильность, заряд, устойчивость к повреждению эритроцитов периферической крови, угнетает процессы фибринообразования. Антипротеолитическое действие реализуется также за счет угнетения активности комплемента. ЦП проявляет антиоксидантные свойства в плазме, выступает в роли мембранопротектора эритроцитов, клеток почек и печени.
ВЫВОДЫ
- Эндотелиоциты, тромбоциты, эритроциты, иммунореактивность, плазменные протеолитические системы составляют единую клеточно-гуморальную систему.
- Активация единой клеточно-гуморальной системы организма – это типовой патологический процесс. Активация системы протекает по общим механизмам независимо от этиологии повреждающего фактора.
- Маркерами активации эндотелиоцитов выступают адгезивная способность и концентрация метаболитов оксида азота (II) в сыворотке; иммунореактивности – количество, адгезия и фагоцитарная функция лейкоцитов, показатели специфического иммунитета; тромбоцитов – адгезия, агрегация, фактор Р3; эритроцитов – деформабильность, поверхностный заряд, процессы свободно-радикального окисления; систем плазменного протеолиза – активность фибринообразования, фибринолиза, антитромбина и комплемента.
- Характер внутригруппового количественного перераспределения компонентов единой клеточно-гуморальной системы организма определяется видом патологии. При острой почечной недостаточности и септическом перитоните маркерами активации системы выступают изменения плазменного протеолиза; при острой печеночной недостаточности и асептическом перитоните – изменения эритроцитов.
- Активация систем плазменного протеолиза и клеток крови в рамках единой клеточно-гуморальной системы организма является одним из механизмов формирования эндогенной интоксикации.
- Альфа-1-кислый гликопротеин и церулоплазмин – самостоятельные участники единой клеточно-гуморальной системы организма, обладающие общими и специфическими эффектами в условиях интактного организма. Альфа-1-кислый гликопротеин и церулоплазмин проявляют иммуностимулирующие, мембранопротекторные, антипротеолитические, антиоксидантные свойства; альфа-1-кислый гликопротеин активирует функцию фагоцитов, тромбоцитов, эндотелиоцитов.
- Альфа-1-кислый гликопротеин и церулоплазмин изменяют продукцию мононуклеарами периферической крови цитокинов – регуляторов активности единой клеточно-гуморальной системы организма. Альфа-1-кислый гликопротеин синтез ИЛ-1 стимулирует, церулоплазмин – подавляет. Альфа-1-кислый гликопротеин и церулоплазмин продукцию иммунорегуляторных цитокинов ИЛ-2 и ИЛ-4 повышают, мультигемопоэтического фактора ИЛ-3 – снижают.
- Эффекты альфа-1-кислого гликопротеина и церулоплазмина при острых повреждениях различного генеза зависят от исходной активности компонентов единой клеточно-гуморальной системы организма, направлены на их нормализацию и приводят к повышению выживаемости животных. Выявлена специфичность эффектов альфа-1-кислого гликопротеина на состояние эритроцитов и иммунореактивности, эффектов церулоплазмина – на активность плазменных протеолитических систем.
- Протекторное действие альфа-1-кислого гликопротеина и церулоплазмина реализуется за счет изменения иммунореактивности: нормализации активности системы комплемента, количества и функции фагоцитов, активации специфического звена иммунитета. Альфа-1-кислый гликопротеин и церулоплазмин улучшают гемореологию через восстановление функции тромбоцитов, деформабильности, поверхностного заряда эритроцитов, активности системы фибринолиза, угнетения фибринообразования.
- Альфа-1-кислый гликопротеин и церулоплазмин выступают в роли мембранопротекторов в связи с повышением антиокислительной активности в эритроцитах, гомогенатах печени и почек, увеличением кислотной резистентности эритроцитов. Альфа-1-кислый гликопротеин и церулоплазмин при патологиях проявляют дезинтоксикационный эффект за счет влияния на концентрацию веществ низкой и средней молекулярной массы в крови и антиоксидантного эффекта на уровне клеток крови и плазмы, тканей организма.
Список работ, опубликованных по теме диссертации
- Осиков, М.В. Значение межклеточных взаимодействий в дисфункции клеток крови под влиянием мочевины / М.В. Осиков, Л.В. Кривохижина, Д.М. Смирнов // Ангиология и сосудистая хирургия. – 2004. – Т.10. – № 3. – С. 43-44.
- Кривохижина, Л.В. Церулоплазмин – регулятор клеточного состава периферической крови / Л.В. Кривохижина, Е.Н. Ермолаева, М.В. Осиков, О.А. Солодовникова, С.А. Кантюков, Е.В. Климова // Тезисы докладов III Российского конгресса по патофизиологии «Дисрегуляторная патология органов и систем (экспериментальная и клиническая патофизиология). – Москва : Изд-во НИИ ОПП РАМН, 2004. – С. 70.
- Осиков, М.В. Антиоксидантный эффект церулоплазмина при почечной недостаточности / М.В. Осиков // Материалы научно-практической конференции молодых ученых с международным участием «Современные направления теоретической и практической медицины». – Воронеж : Изд-во Воронежской гос. мед. академии, 2005. – С. 260-262.
- Осиков, М.В. Влияние белков острой фазы на агрегацию эритроцитов / М.В. Осиков, Л.В. Кривохижина // Материалы I съезда физиологов СНГ. – Сочи, 2005. – С. 23.
- Осиков, М.В. Влияние белков острой фазы на эритроцитарно-тромбоцитарные взаимодействия / М.В. Осиков // Тезисы международного молодежного медицинского конгресса «Санкт-Петербургские научные чтения». – СПб, 2005. – С. 116.
- Осиков, М.В. Влияние мочевины на функциональное состояние клеток крови и эндотелия / М.В. Осиков, Л.В. Кривохижина // Вестник Южно-Уральского государственного университета. Cepия «Oбpaзовaниe, здpaвooxpaнeниe, физичecкaя кyльтypa». – 2005. – № 4 (44). – С. 277-279.
- Осиков, М.В. Влияние мочевины на функциональное состояние эритроцитов / М.В. Осиков // Материалы 70-й юбилейной итоговой научной конференции с международным участием «Вопросы теоретической и практической медицины».– Уфа : Изд-во Башкирского гос. мед. университета, 2005. – С. 23-24.
- Осиков, М.В. Влияние уремических токсинов на адгезивную способность клеток крови и эндотелия / М.В. Осиков, Д.М. Смирнов, А.В. Мальцев, О.И. Симаков, С.А. Соколов // Тюменский медицинский журнал. – 2005. – № 1. – С. 44-45.
- Осиков, М.В. Влияние церулоплазмина на агрегацию тромбоцитов при почечной недостаточности / М.В. Осиков // Материалы III итоговой научно-практической конф. молодых ученых ЧелГМА. – Челябинск : Изд-во ЧелГМА, 2005. – С. 136-139.
- Кривохижина, Л.В. Влияние церулоплазмина на показатели коагуляционного гемостаза при экспериментальной острой почечной недостаточности / Л.В. Кривохижина, М.В. Осиков, Е.В. Макаров // Омский научный вестник. – 2005. – № 30 (май 2005). – С. 166-168.
- Осиков, М.В. Гипокоагуляционный эффект альфа-1-кислого гликопротеина / М.В. Осиков, Е.В. Макаров // Тезисы международного молодежного медицинского конгресса «Санкт-Петербургские научные чтения». – СПб, 2005. – С. 116-117.
- Осиков, М.В. К патогенезу нарушений гемореологии при печеночной недостаточности и их коррекция церулоплазмином / М.В. Осиков, Л.В. Кривохижина // Тромбоз, гемостаз и реология. – 2005. – № 4. – С. 55-60.
- Осиков, М.В. Коррекция церулоплазмином нарушений эндотелиально-клеточных взаимодействий при почечной недостаточности / М.В. Осиков, О.И. Симаков, Е.Ю. Борюшкин, Е.А. Гафнер // Материалы VI Международной научно-практической конференции «Здоровье и образование в XXI веке». – Москва : Изд-во РУДН, 2005. – С. 367-368.
- Кривохижина, Л.В. Патофизиологические эффекты церулоплазмина / Л.В. Кривохижина, М.В. Осиков, Е.Н. Ермолаева, Е.В. Климова, Е.В. Макаров, С.А. Кантюков // Здравоохранение Башкортостана. – 2005. – № 7. – С. 99-100.
- Осиков, М.В. Показатели коагуляционного гемостаза при экспериментальной гипераммониемии / М.В. Осиков, Л.В. Кривохижина, Е.В. Макаров // Материалы международной конференции «Гемореология в макро- и микроциркуляции». – Ярославль : Изд-во ЯГПУ им. К.Д. Ушинского, 2005. – С. 111.
- Осиков, М.В. Применение орозина при экспериментальной острой почечной недостаточности / М.В. Осиков, Е.В. Макаров // Материалы III итоговой научно-практической конф. молодых ученых ЧелГМА. – Челябинск : Изд-во ЧелГМА, 2005. – С. 134-136.
- Осиков, М.В. Роль церулоплазмина в кооперации клеток крови при экспериментальной острой почечной недостаточности / М.В. Осиков, Л.В. Кривохижина // Материалы конференции «Актуальные проблемы медицинской науки, технологий и профессионального образования». – Челябинск, 2005. – С. 137-139.
- Кривохижина, Л.В. Современные представления о регуляции неспецифической защиты в организме / Л.В. Кривохижина, М.В. Осиков // Вестник Южно-Уральского государственного университета. Cepия «Oбpaзовaниe, здpaвooxpaнeниe, физичecкaя кyльтypa». – 2005. – № 4(44). – С. 88-94.
- Осиков, М.В. Церулоплазмин повышает устойчивость эритроцитов при печеночной недостаточности / М.В. Осиков, Е.Ю. Борюшкин // Тезисы международного молодежного медицинского конгресса «Санкт-Петербургские научные чтения». – СПб, 2005. – С. 117.
- Осиков, М.В. Церулоплазмин – регулятор функциональной активности фагоцитов / М.В. Осиков, Л.В. Кривохижина // Иммунология Урала. – 2005. – № 1(4). – С. 21-22.
- Makarov, E.V. Alpha-1-acid glycoprotein as detoxifying agent in acute hepatic failure / E.V. Makarov, M.V. Osikov, L.V. Krivohizhina // The International Journal of Artificial Organs. – 2005. – Vol. 28, № 9. – Р. 931.
- Osikov, M.V. Detoxifying action of cerulopasmin in acute renal failure / M.V. Osikov, E.V. Makarov, L.V. Krivohizhina // The International Journal of Artificial Organs. – 2005. – Vol. 28, № 9. – Р. 915.
- Осиков, М.В. Анализ эфферентных свойств церулоплазмина и альфа-1-кислого гликопротеина при экспериментальном перитоните / М.В. Осиков, Л.В. Кривохижина, А.В. Мальцев // Эфферентная терапия. – 2006. – № 4. – С. 36-39.
- Осиков, М.В. Влияние церулоплазмина на коагуляционный гемостаз при экспериментальном перитоните / М.В. Осиков, Е.В. Макаров // Вестник Российского государственного медицинского университета. – 2006. – № 2 (49). – С. 410.
- Осиков, М.В. Гемореологические эффекты реактанта острой фазы церулоплазмина / М.В. Осиков // Материалы II Всероссийской конференции с международным участием «Микроциркуляция в клинической практике». – Москва : ИНФОМЕДИА Публишерз, 2006. – С. 91-92.
- Осиков, М.В. К патогенезу нарушений гемореологии при печеночной недостаточности / М.В. Осиков // Тезисы докладов I Всероссийской молодежной медицинской конференции «Экстремальные и терминальные состояния». – Омск : Изд-во Омской гос. мед. академии, 2006. – С. 58-60.
- Осиков, М.В. Реактанты острой фазы как эфферентные агенты при экспериментальном перитоните / М.В. Осиков, Е.В. Макаров // Тезисы докладов I Всероссийской молодежной медицинской конференции «Экстремальные и терминальные состояния». – Омск : Изд-во Омской гос. мед. академии, 2006. – С. 60-62.
- Симаков, О.И. Реактивные изменения клеток крови при экспериментальном перитоните / О.И. Симаков, М.В. Осиков, Е.А. Гафнер, А.В. Мальцев, Е.Ю. Борюшкин // Вестник Российского государственного медицинского университета. – 2006. – № 2 (49). – С. 422.
- Осиков, М.В. Роль альфа-1-кислого гликопротеина в коррекции нарушений гемореологии при экспериментальном перитоните / М.В. Осиков, Л.В. Кривохижина, Е.В. Макаров // Вестник Челябинского государственного педагогического университета. – 2006. – № 5. – С. 249-256.
- Гафнер, Е.А. Роль альфа-1-кислого гликопротеина в реализации неспецифической резистентности при печеночной недостаточности / Е.А. Гафнер, М.В. Осиков, Е.Ю. Борюшкин // Материалы VII Международной научно-практической конференции «Здоровье и образование в XXI веке». – Москва : Изд-во РУДН, 2006. – С. 124.
- Осиков, М.В. Церулоплазмин устраняет нарушения гемостаза при экспериментальной гипераммониемии / М.В. Осиков, Л.В. Кривохижина, Е.В. Макаров // Бюллетень экспериментальной биологии и медицины. – 2006. – Т. 142, № 10. – С. 396-399.
- Осиков, М.В. Эфферентные свойства альфа-1-кислого гликопротеина при почечной недостаточности / М.В. Осиков, Л.В. Кривохижина // Эфферентная терапия. – 2006. – № 2. – С. 43-46.
- Осиков, М.В. Влияние альфа-1-кислого гликопротеина на продукцию цитокинов мононуклеарами периферической крови / М.В. Осиков, Л.В. Кривохижина, Е.В.Макаров, В.Ю. Ахматов // Медицинская иммунология. – 2007. – Т.9, № 1. – С. 47-52.
- Осиков, М.В. Влияние альфа-1-кислого гликопротеина на процессы свободно-радикального окисления при экспериментальной печеночной недостаточности / М.В. Осиков // Бюллетень экспериментальной биологии и медицины. – 2007. – № 7. – С. 29-31.
- Осиков, М.В. Влияние альфа-1-кислого гликопротеина на реологические параметры крови / М.В. Осиков, Л.В. Кривохижина, Е.В. Макаров // Патологическая физиология и экспериментальная терапия. – 2007. – № 3. – С. 20-21.
- Осиков, М.В. Влияние альфа-1 кислого гликопротеина на состояние клеточного звена гемостаза при экспериментальной почечной недостаточности / М.В. Осиков // Известия Челябинского научного центра. – 2007. – Вып.1 (35). – С. 183-187.
- Осиков, М.В. Влияние альфа-1-кислого гликопротеина на функциональное состояние тромбоцитов при печеночной недостаточности / М.В. Осиков // Вестник Российского государственного медицинского университета. – 2007. – № 2. – С. 300.
- Осиков, М.В. Гемостазиологические эффекты альфа-1-кислого гликопротеина при экспериментальном септическом перитоните / М.В. Осиков, Е.В. Макаров, Л.В. Кривохижина // Бюллетень экспериментальной биологии и медицины. – 2007. – № 8. – С. 143-145.
- Осиков, М.В. К патогенезу дисфункции тромбоцитов при уремии / М.В. Осиков, В.Ю. Ахматов, Л.В. Кривохижина // Уральский медицинский журнал. – 2007. – № 9 (37). – С. 83-87.
- Осиков, М.В. Роль уремических токсинов в дисфункции клеток крови / М.В. Осиков, А.В. Мальцев // Материалы V-ой итоговой научно-практической конференции молодых ученых ЧелГМА. – Челябинск : Изд-во ЧелГМА, 2007. – С. 50-52.
- Osikov, M.V. Hemostasiologic effects of alpha-1-acid glycoprotein in acute renal failure / M.V. Osikov, E.V. Makarov, L.V. Krivohizhina // The International Journal of Artificial Organs. – 2007. – Vol. 30, № 8. – Р. 186.
- Осиков, М.В. Эндотелиотропные свойства альфа-1-кислого гликопротеина / М.В. Осиков // Вестник Российского государственного медицинского университета. – 2008. – № 2. – С. 323.
СПИСОК СОКРАЩЕНИЙ
| АОА | антиокислительная активность |
| АОК | антителообразующие клетки |
| АсП | асептический перитонит |
| АТ | антитромбин |
| АФК | активные формы кислорода |
| АЧТВ | активированное частичное тромбопластиновое время |
| ВНиСММ | вещества низкой и средней молекулярной массы |
| ГА | гипераммониемия |
| ГЗТ | гиперчувствительность замедленного типа |
| ИИ | индекс интоксикации |
| ИЛ | интерлейкин |
| КГП | альфа-1-кислый гликопротеин |
| ЛПВ | Лоури-позитивные вещества |
| ОПечН | острая печеночная недостаточность |
| ОПН | острая почечная недостаточность |
| ПОЛ | перекисное окисление липидов |
| РОФ | реактанты острой фазы |
| СА | скорость агрегации |
| СИ | степень интоксикации |
| СП | септический перитонит |
| СРО | свободно-радикальное окисление |
| СС | светосумма |
| ТБК | 2-тиобарбитуровая кислота |
| ТВ | тромбиновое время |
| ХЛ | хемилюминесценция |
| ЦП | церулоплазмин |
| ЭТК | эритроцитарно-тромбоцитарные коагрегаты |
| ЯСК | ядросодержащие клетки |
| GP | гликопротеин |
| vWF | фактор фон Виллебранда |

