Молекулярно-генетические механизмы врожденного иммунитета на уровне слизистых оболочек при патологии инфекционного генеза
на правах рукописи
ГАНКОВСКАЯ Оксана Анатольевна
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ВРОЖДЕННОГО ИММУНИТЕТА НА УРОВНЕ СЛИЗИСТЫХ ОБОЛОЧЕК ПРИ ПАТОЛОГИИ ИНФЕКЦИОННОГО ГЕНЕЗА
14.03.09 – Клиническая иммунология, аллергология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Москва - 2010
Работа выполнена в Учреждении Российской академии медицинских наук
Научно-исследовательском институте вакцин и сывороток
им. И.И. Мечникова РАМН
Научный консультант академик РАМН, доктор биологических наук
профессор Виталий Васильевич ЗВЕРЕВ
Официальные оппоненты доктор медицинских наук
профессор Ирина Петровна БАЛМАСОВА
доктор медицинских наук
профессор Людмила Ивановна КРАСНОПРОШИНА
доктор медицинских наук
профессор Александр Александрович ЯРИЛИН
Ведущая организация Институт иммунологии и физиологии УрО РАН
Защита состоится «___» ____________201_ г. в ____ часов на заседании диссертационного Совета Д 001.035.01 при НИИВС им. И.И. Мечникова РАМН по адресу: 105064, Москва, Малый Казенный пер., д. 5а.
С диссертацией можно ознакомиться в библиотеке НИИВС им. И.И. Мечникова РАМН (Москва, Малый Казенный пер., д. 5а).
Автореферат разослан «___» _________________ 201_ г.
Ученый секретарь
диссертационного совета
кандидат биологических наук И.В. Яковлева
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. Всемирная организация здравоохранения ставит инфекционные заболевания на одно из ведущих мест среди главных причин смертности (после ишемической болезни сердца, инсульта и др.) [ВОЗ, 2009]. По данным ВОЗ, ежегодно в мире умирает около 51 млн. человек, треть из них – от инфекционных болезней. Инфекционные заболевания остаются актуальной проблемой не только для развивающихся, но и для благополучных стран. В Российской Федерации ежегодно регистрируют около 35 млн. случаев инфекционных болезней [Онищенко Г.Г., 2006; Пальцев М.А., 2007].
В последние годы, благодаря прогрессу таких научных дисциплин как молекулярная биология, генетика, иммунология и клеточная биология, происходит накопление знаний о механизмах развития различных инфекционных заболеваний, а также становится возможным их точная диагностика и прогнозирование. Известно, что состояние резистентности к инфекции формируется с помощью многочисленных реакций иммунной системы, основная функция которой заключается в распознавании и элиминации инфекционных агентов, а также продуктов их жизнедеятельности [Ярилин А.А., 1999; Хаитов Р.М., 2010; Ковальчук Л.В., 2010].
В последнее время все большее подтверждение получает гипотеза К. Janeway об исключительной важности системы врожденного иммунитета в защите от патогенов и в реализации начальных стадий реакций адаптивного иммунитета [Кокряков В.Н., 2006; Janeway, 2007; Лебедев К.А., 2008]. Клетки системы врожденного иммунитета распознают консервативные в эволюционном отношении молекулы, присущие одновременно большим систематическим группам микроорганизмов. Среди распознающих рецепторов системы врожденного иммунитета ключевая роль принадлежит Toll-подобным рецепторам (TLR). После взаимодействия TLR с лигандом происходит активация сигнальных путей, в результате которой продуцируются эффекторные молекулы, такие, как цитокины, противомикробные пептиды и др. При скоординированном функционировании факторов врожденного иммунитета в большинстве случаев происходит элиминация патогена. Однако гиперактивация или угнетение механизмов врожденного иммунитета в свою очередь может приводить к развитию патологического процесса [Kopp E., 2003; Назаров П.Г., 2005; Макаров О.В., 2007; Семенов Б.Ф., 2009].
Исследования по оценке патологических состояний с точки зрения функционирования молекулярных механизмов системы врожденного иммунитета фактически начались совсем недавно [Семенов Б.Ф., Зверев В.В., 2007; Ковальчук Л.В., 2007].
Общепризнано, что развитие большинства инфекций, с которыми встречается организм, начинается с проникновения патогенов через барьерные ткани, в том числе через слизистые оболочки. Известно, что слизистые, являясь физиологическим барьером, участвуют в развитии защитных реакций врожденного иммунитета в ответ на патогены, в инициации реакций адаптивного иммунитета, в формировании толерантности к комменсалам, а также в развитии патологических процессов (аллергии, острого и хронического воспаления и др.). Таким образом, в настоящее время клетки (в том числе эпителиальные) слизистых оболочек рассматриваются в качестве одного из факторов врожденного иммунитета [Хаитов Р.М., 2005; Лебедев К.А., 2008; Artis D., 2008; Coombes J.L., 2008; Семенов Б.Ф., 2009; Ярилин А.А., 2010].
Комплексное исследование вышеперечисленных процессов при патологии инфекционного генеза (урогенитальной инфекции, внутриутробной инфекции, вирусном кератите и др.) позволит приблизиться к пониманию роли механизмов врожденного иммунитета и определить тонкую грань между процессами функционирования системы врожденного иммунитета, обеспечивающими защиту организма, и процессами, приводящими в конечном итоге к развитию патологии. Выяснение роли Toll-подобных рецепторов, цитокинов и противомикробных пептидов, экспрессированных в слизистых при инфекционных заболеваниях позволит более точно провести своевременную диагностику, заблаговременно спрогнозировать характер течения заболевания, изучить патогенетические аспекты развития патологии, а также обосновать выбор адекватной терапии.
Оценка системы врожденного иммунитета слизистых оболочек с использованием современных методов молекулярной биологии и генетики даст возможность выявить маркеры внутриутробного инфицирования плода, преждевременных родов и других патологических состояний. В дальнейшим накопленный фундаментальный базис позволит научно обосновать и разработать новые подходы к выбору адекватной терапии инфекционных заболеваний с учетом индивидуальных особенностей иммунной системы.
Цель работы - комплексное исследование на генетическом, экспрессионном и функциональном уровнях компонентов системы врожденного иммунитета (Toll-подобных рецепторов, противомикробных пептидов, цитокинов) в слизистых оболочках организма при патологии инфекционного генеза, а также разработка на основе полученных данных прогностических и диагностических критериев течения инфекционного процесса.
Задачи исследования:
1. Разработать системы ПЦР в режиме реального времени для количественной оценки экспрессии генов Toll-подобных рецепторов (TLR1, TLR2, TLR4, TLR6, TLR9), противомикробных пептидов (HNP-1, HBD-1, HBD-2), цитокина (ФНО) и других молекул (NF-kB, каспазы 3, каспазы 8, ингибиторов каспаз FLIP и XIAP).
2. С помощью разработанных тест-систем на экспериментальных моделях инфекционного процесса in vitro и in vivo определить уровни экспрессии генов молекул врожденного иммунитета (TLRs, противомикробных пептидов, цитокинов).
3. Изучить изменение уровней экспрессии генов TLRs, дефенсинов и продукции цитокинов при урогенитальной инфекции (УГИ), внутриутробной инфекции (ВУИ) и преждевременных родах и определить их роль как возможных маркеров невынашивания беременности и реализации ВУИ.
4. Оценить значимость активации апоптоза в клетках плаценты, как одного из механизмов развития преждевременных родов у беременных женщин с урогенитальной инфекцией.
5. Изучить ассоциацию полиморфных маркеров, локализованных в генах TLR2, TLR4, TLR9 и HBD-1, с риском развития преждевременных родов, внутриутробного инфицирования плода.
6. Определить диагностическую значимость выявленных изменений уровней экспрессии генов TLRs, противомикробного пептида HBD-1 в клетках слизистой оболочки урогенитального тракта и продукции цитокинов у больных хроническим простатитом.
7. Изучить роль сигнального рецептора TLR9 и противомикробного пептида -дефенсина 2 в эпителиальных клетках роговицы в развитии герпетического кератита.
8. Обосновать комплексный подход к оценке TLR-опосредованных механизмов врожденного иммунитета на уровне слизистых оболочек, основанный на 1) изучении полиморфизма генов TLR и противомикробных пептидов, 2) определении уровня их экспрессии и 3) функциональной активности для выявления маркеров течения инфекционного процесса.
Научная новизна
- Впервые представлен комплексный подход к оценке функционирования системы Toll-подобных рецепторов, основанный на изучении: экспрессии генов TLRs, транскрипционных факторов, эффекторных молекул (цитокинов, противомикробных пептидов и др.).
- Впервые показано, что гиперэкспрессия TLR2 в эпителиальных клетках цервикального канала беременных женщин с урогенитальной инфекцией, сопровождающаяся повышенной продукцией ИЛ-8, ИФН и сниженной экспрессией HBD-1, приводит к реализации внутриутробного инфицирования плода и к преждевременным родам. Выявлены новые маркеры ранней диагностики неразвивающейся беременности, преждевременных родов, внутриутробного инфицирования плода при урогенитальной инфекции, основанные на оценке уровня экспрессии генов TLR2, HBD-1 в эпителиальных клетках цервикального канала и HNP-1-3 в сыворотке периферической крови.
- Впервые в клетках плаценты при преждевременных родах выявлен дисбаланс в экспрессии генов каспазы 3, каспазы 8 и ингибиторов апоптоза FLIP и XIAP, который заключается в повышении уровня экспрессии генов каспаз, коррелирующих с увеличенной экспрессией генов TLRs и со сниженной экспрессией генов ингибиторов каспаз.
- Впервые исследована ассоциация полиморфных маркеров Arg677Trp и Arg753Gln в гене TLR2, Asp299Gly и Thr399Ile в гене TLR4, 2848G/A в гене TLR9, G(-20)A, C(-44)G, и G(-52)A в гене DEFB1 с урогенитальной инфекцией у беременных, преждевременными родами, реализацией внутриутробного инфицирования плода. Показана ассоциация аллеля A(-20) и генотипа GG (-52) гена DEFB1 с увеличением уровня экспрессии -дефенсина 1 в эпителиальных клетках цервикального канала при выше указанной патологии.
- Впервые определены прогностические критерии иммунодефицитного состояния при хроническом простатите на основе данных о снижении уровня экспрессии TLR2 в эпителиальных клетках уретры и дисбалансе про- и противовоспалительных цитокинов в секрете простаты.
- Впервые изучены показатели системы врожденного иммунитета в конъюнктиве и роговице глаза у детей - уровень экспрессии распознающего рецептора TLR9 и противомикробного пептида HBD-2, обеспечивающего противовирусную и антибактериальную защиту тканей глаза. Установлено, что комплекс природных цитокинов и противомикробных пептидов приводит к нормализации экспрессии гена TLR9 в эпителиальных клетках роговицы глаза детей с древовидным герпетическим кератитом и оказывает положительный терапевтический эффект.
- Получены новые данные по межлинейным различиям в развитии вирусного кератита и экспрессии гена TLR9 в роговице мышей линий С57BL/6 и BALB/с.
- На клетках Vero изучена экспрессия генов TLR1, TLR2, TLR4, TLR9 и др. и определена функциональная активность клеток по выработке цитокинов в ответ на воздействие различных патогенов (вируса простого герпеса (ВПГ), C.albicans и др.).
Практическая значимость
Разработаны и внедрены в клиническую практику системы на основе ПЦР-РВ для определения экспрессии генов TLRs, цитокинов и противомикробных пептидов в качестве прогностических и диагностических критериев у женщин с преждевременными родами, реализацией внутриутробного инфицирования плода, а также у пациентов с хроническим простатитом и герпетическим кератитом.
С использованием разработанных систем определены маркеры риска развития преждевременных родов, внутриутробного инфицирования плода. Комплекс маркеров на основе исследования экспрессии генов TLRs, дефенсинов, продукции противомикробных пептидов и цитокинов в цервикальном канале женщин, позволяет с большей долей вероятности прогнозировать преждевременные роды и развитие внутриутробного инфицирования плода. При гиперэкспрессии TLR2 более, чем в 5 раз и снижении экспрессии HBD-1 (в 2,5 раза и более) в 70% случаев наблюдаются преждевременные роды.
Определена панель полиморфных маркеров генов-кандидатов (TLR2, TLR9 DEFB-1) реализации внутриутробного инфицирования плода, преждевременных родов, что позволяет оценить риск развития патологического процесса во время беременности.
Разработаны экспериментальные системы оценки экспрессии генов и эффекторных молекул в культурах клеток (Vero, HeLa), что позволяет исследовать действие препаратов на компоненты врожденного иммунитета.
Внедрен новый метод лабораторной диагностики определения уровня экспрессии гена сигнального рецептора TLR9 в эпителиальных клетках роговицы и конъюнктивы при герпетическом древовидном кератите у детей. Обосновано применение препарата Суперлимф в комплексной терапии герпетических кератитов у детей, позволяющей снизить уровень осложнений и добиться нормализации экспрессии TLR9.
Основные положения, выносимые на защиту
1. Разработаны системы для определения экспрессии генов молекул врожденного иммунитета Toll-подобных рецепторов (TLR1, TLR2, TLR4, TLR6, TLR9), противомикробных пептидов (HNP-1, HBD-1, HBD-2), цитокина (ФНО) и других молекул (NF-kB, каспазы 3, каспазы 8, ингибиторов каспаз FLIP и XIAP) и апробированы в моделях инфекционного процесса in vitro и in vivo.
2. С использованием разработанных систем определены новые маркеры ранней диагностики неразвивающейся беременности, преждевременных родов при урогенитальной инфекции, внутриутробного инфицирования плода, основанные на оценке уровня экспрессии генов TLR2, HBD-1 в эпителиальных клетках цервикального канала и на ассоциации полиморфных маркеров генов, белковые продукты которых участвуют в реакциях врожденного иммунитета. Разработана концепция развития преждевременных родов, заключающаяся в гиперактивации TLR2-опосредованного апоптоза клеток плаценты. При преждевременных родах в клетках плаценты наблюдается дисбаланс в экспрессии генов каспазы 3, каспазы 8 и ингибиторов апоптоза FLIP и XIAP.
3. Развитие хронического простатита сопровождается снижением уровня экспрессии TLR2 в эпителиальных клетках уретры и дисбаланс про- и противовоспалительных цитокинов в секрете простаты.
4. При изучении уровня экспрессии распознающего рецептора TLR9 и противомикробного пептида HBD-2 в клетках конъюнктивы и роговицы глаза у детей, установлено, что комплекс природных цитокинов и противомикробных пептидов (препарат Суперлимф) приводит к нормализации экспрессии гена TLR9 в эпителиальных клетках роговицы глаза детей с древовидным герпетическим кератитом, а также снижает частоту осложнений при указанной патологии.
5. Разработан комплексный подход к оценке TLR-опосредованных механизмов врожденного иммунитета, основанный на изучении экспрессии генов TLR (при действии различных лигандов); сигнальных молекул и транскрипционных факторов; эффекторных молекул (цитокинов, противомикробных пептидов и др.). Анализ компонентов TLR-системы проведен на уровне полиморфизма генов, экспрессии мРНК, секреции эффекторных молекул.
Внедрение результатов работы
Результаты исследований, представленных в диссертационной работе, внедрены в учебный процесс студентов, ординаторов и аспирантов, а также курс лекций по повышению квалификации врачей в Российской медицинской академии последипломного образования, Смоленской Государственной Медицинской Академии и Медицинском институте Орловского государственного университета.
Применение исследования экспрессии генов TLRs представлено в Патенте на изобретение №2334233: «Способ прогнозирования преждевременных родов при урогенитальной инфекции». Официальный Бюллетень Федеральной службы по интеллектуальной собственности, патентам и товарным знакам РФ №17 «Изобретения. Полезные модели» 20.09.2008 г.
Получено положительное решение о выдачи патента на изобретение (Заявка №2009108294/15(011092), дата подачи заявки 10.03.2009 г.).
Апробация работы.
Основные результаты диссертационной работы доложены на заседании Бюро Отделения профилактической медицины РАМН (2009), Всероссийском научном Форуме с международным участием им. академика В.И. Иоффе «Дни иммунологии в Санкт-Петербурге» (Санкт-Петербург 2004, 2006, 2007, 2009), Республиканской научной конференции «Иммунология репродукции» (Иваново, 2005), Международной пущинской школе-конференции молодых ученых «Биология – наука XXI века» (Пущино, 2005, 2007, 2010), Российском Национальном Конгрессе «Человек и Лекарство» (Москва 2005, 2006, 2007, 2008, 2009, 2010), Российской научно-практической конференции «Современные технологии в иммунологии: иммунодиагностика и иммунотерапия» (Курск, 2006), Международной конференции «Генетика в России и в мире» (Москва, 2006), V конференции иммунологов Урала «Актуальные вопросы фундаментальной и клинической аллергологии и иммунологии» (Оренбург, 2006), Четвертом Московском международном конгрессе «Биотехнология: состояние и перспективы развития» (Москва, 2007), 6-th Parnas Conference Molecular Mechanisms of Cellular Signalling (Poland, Krakow, 2007), Конференции молодых ученых, аспирантов и студентов по молекулярной биологии и генетике, посвященной 120-летию Н.И.Вавилова (Киев, 2007), 8-th John Humphrey advanced summer school in immunology: Immunology and Viral Infection (Москва, 2007), VI конференции иммунологов Урала (Ижевск, 2007), IV съезде Российского общества биохимиков и молекулярных биологов (Новосибирск, 2008), XXVII Congress of the European Academy of Allergology and Clinical Immunology (Barcelona, Spain 2008), 6-th European Congress of Reproductive Immunology (Москва, 2008), IV Объединенном иммунологическом форуме (Санкт-Петербург, 2008), X Международном Конгрессе «Современные проблемы аллергологии, иммунологии и иммунофармакологии», посвященном 100-летию со дня рождения академика АМН А.Д.Адо (Казань, 2009), Съезде офтальмологов России (Москва, 2009), GA2LEN/EAACI Summer Allergy School (Great Britain, Norwich, 2009), 29-th Congress of the European Academy of Allergology and Clinical Immunology (Great Britain, London, 2010).
Апробация диссертации состоялась ___ мая 2010 года на заседании Ученого совета НИИ вакцин и сывороток им. И.И. Мечникова РАМН.
Публикации
По теме диссертационной работы опубликовано в 68 печатных работы, в том числе 19 в изданиях, рекомендованных ВАК, материалы включены в монографию «Невынашивание беременности, инфекция, врожденный иммунитет» // М. :«ГЭОТАР-Медиа». – 2007 и методическое пособие «Иммунология. Практикум.» // М. :«ГЭОТАР-Медиа». - 2010.
Структура и объем диссертации
Диссертационная работа состоит из введения, главы «Обзор литературы», главы «Материалы и методы», 4-х глав результатов собственных исследований, заключения, выводов, списка литературы, содержащего 392 источника, из которых 105 отечественных и 287 зарубежных. Работа выполнена на 300 страницах машинописного текста, иллюстрирована 50 рисунками и 51 таблицей.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Материалы
В работе использованы штаммы ВПГ-1 (VR-3) и ВПГ-2 (MS), полученные из Национальной вирусной коллекции (Великобритания). До начала экспериментов вирусы прошли 5-7 последовательных пассажей на культуре клеток Vero. Инактивированные образцы Candida albicans (АТСС 885-653) любезно предоставлены профессором Л.П. Блинковой (ГУ НИИ вакцин и сывороток им. И.И. Мечникова РАМН).
Для стимуляции мононуклеарных клеток и нейтрофилов использованы антигены ВПГ [Королюк М.А., 2002] и лизат Candida albicans, а также липополисахарид (ЛПС) (Sigma, США), комплекс природных цитокинов и противомикробных пептидов - препарат Суперлимф («Центр иммунотерапии «Иммунохелп», РФ).
Для проведения экспериментов in vitro использованы культура клеток почек зеленой мартышки - Vero (НИИ эпидемиологии и микробиологии им. Пастера, г.Санкт-Петербург) и культура клеток HeLa (аденокарцинома), которая любезно предоставлена к.б.н. Т.М. Парфеновой (ГУ НИИ эпидемиологии и микробиологии имени Н.Ф Гамалеи РАМН). В качестве культуральной среды использована среда DMEM (ПанЭко, РФ), содержащая 10% или 2% эмбриональной телячьей сыворотки (ЭТС) (PAA Laboratories GmbH, Австрия).
Модели вирусного кератита и генитального герпеса были воспроизведены на мышах линий C57Bl/6 и BALB/c, самцах и самках, весом 18-19 г. Животные были получены из питомника «Андреевка» ГУ НЦБМТ РАМН (Москва, РФ) и содержались в виварии НИИ вакцин и сывороток им. И.И. Мечникова РАМН (на территории 1-й Дубровской ул., д. 15).
Получение и обработку клинического материала проводили в соответствии с методическими рекомендациями «Забор, транспортировка, хранение клинического материала для ПЦР - диагностики» Центрального НИИ эпидемиологии МЗ РФ (2004г.). В качестве клинического материала в работе использованы соскобы эпителиальных клеток из цервикального канала, соскобы эпителиальных клеток из уретры, соскобы клеток эпителия роговицы, ткань плаценты, сыворотка или плазма периферической крови, секрет предстательной железы.
Характеристика клинических групп
Исследования показателей в группе беременных женщин с физиологически протекающей беременностью и в группе женщин с урогенитальной инфекцией были проведены в 2004 – 2009 гг. совместно с сотрудниками кафедры акушерства и гинекологии лечебного факультета (заведующий кафедрой профессор, д.м.н., заслуженный врач РФ О.В. Макаров), на базе родильного дома при городской больнице №8 ДЗ г. Москвы (главный врач А.Б. Дуленков), на базе гинекологического отделения ГКБ №55 и женской консультации при родильном доме №10 (главный врач Е.П. Озимковская) и совместно с сотрудниками кафедры иммунологии ГОУ ВПО РГМУ Росздрава (заведующий кафедрой проф. Л.В. Ковальчук, проф каф. Л.В. Ганковская) Большая часть исследований проведена в рамках совместной темы НИР №50в в период 2007-2010 гг.
Общее количество обследуемых женщин составило 409 человек, среди них 57 небеременных женщин (у 20 из которых определялась урогенитальная инфекция) и 352 беременные женщины. Возраст всех пациенток находился в интервале от 19 до 42 лет. Беременные женщины были разделены на две группы: на первом триместре (85 женщин) и на третьем триместре (267 женщин). В основную группу на первом триместре беременности входили женщины с неразвивающейся беременностью, закончившейся выкидышем на 5 – 13 недели гестации. Гиперандрогения была выявлена у 29% женщин, хронический цервицит – 10,5%, вирусная инфекция (ВПГ-2, ЦМВ) – 7,9%, хронический двусторонний сальпингоофорит – 23,7%. Группу сравнения составляли женщины с физиологически протекающей беременностью на сроке 5-13 недель. К критериям исключения пациентов из группы сравнения относили следующие показатели: гиперандрогения, маточные кровотечения, эндокринная патология, инфекционные и воспалительные заболевания, аутоиммунная патология.
Основная группа женщин, находящихся на третьем триместре, была разделена на две подгруппы: в первую входили 83 беременные женщины с вирусной инфекцией (ВПГ-2, ЦМВ), во вторую группу - 65 беременных женщин с урогенитальной инфекцией различной этиологии. Новорожденные от 20 матерей этой подгруппы имели локальные и системные проявления внутриутробной инфекции. Вторую подгруппу составили 45 беременных, с преждевременными родами без реализации ВУИ. Группу сравнения составили 25 беременных женщин с урогенитальной инфекцией, беременность которых закончилась своевременными родами. Контрольную группу составили 94 беременных с физиологически протекающей беременностью после своевременных родов с рождением здорового жизнеспособного ребенка. У всех женщин контрольной группы была исключена урогенитальная инфекция.
Исследования клинического материала у больных с диагнозом хронический простатит были проведены в 2006 – 2008 гг. совместно с сотрудниками кафедры урологии ГОУ ВПО РГМУ Росздрава (заведующий кафедрой член-корреспондент РАМН, заслуженный деятель науки РФ, д.м.н., профессор Е.Б.Мазо). Определение уровней экспрессии генов в клетках слизистой уретры и исследование уровня цитокинов в сыворотке периферической крови и секрете предстательной железы проводили у 55 больных хроническим бактериальным простатитом, 55 больных хроническим абактериальным простатитом и 30 здоровых добровольцев (средний возраст больных составлял 25±4 года, здоровых - 20±2,1 года). У больных хроническим бактериальным простатитом выделено и идентифицировано 19 штаммов бактерий, из которых 68,4% грамположительных и 31,6% грамотрицательных. У больных хроническим абактериальным простатитом были выявлены Сlamydia trachomatis, Mycoplasma genitalium, Ureaplasma urealiticum. При этом у 40% больных отмечена смешанная инфекция.
Молекулярно-биологические исследования проведены в 2008 – 2010 гг. на базе кафедры офтальмологии педиатрического факультета ГОУ ВПО РГМУ Росздрава в Морозовской детской городской клинической больнице г. Москвы (заведующий кафедрой член-корреспондент РАМН Е.И.Сидоренко). Материалом исследования служили соскобы клеток эпителия роговицы, полученные от 37 детей в возрасте от 2 до 14 лет. Дети были разделены на две группы: здоровые (n=23) и с диагнозом герпетический древовидный кератит (n=14).
Методы
Работа с культурами клеток. Пересев клеток (Vero, HeLa) проводили на 3-4 сутки [Лацис Р.В., 2000]. Для проведения опытов использовали 96-луночные плоскодонные планшеты (COSTAR, США). В каждую лунку вносили по 200 мкл клеточной суспензии (концентрация 200 тыс. клеток в 1 мл). Через 24 ч (48ч) инкубации при 37оС в атмосфере СО2 в лунках формировался монослой клеток. При проведении экспериментов использовали среду DMEM с 2% ЭСТ. Для определения жизнеспособности клеток использовали 0,2% раствор трипанового синего (Serva, США) в культуральной среде (маточный раствор) и 0,75М NaCl (ОАО Красфарма). Для оценки цитотоксического и цитопатического действия использовали краситель Neutral Red (1,11мг/мл) и витальный краситель МТТ (Sigma, США).
Заражение культуры клеток вирусами герпеса простого. Монослой клеток заражали вирусом (ВПГ-1, ВПГ-2) в дозе 0,1 ТЦД50/кл. Клетки инкубировали в культуральной среде при 37°С в атмосфере СО2 до появления вирусиндуцированного цитопатического эффекта. Через 5 суток определяли титр вируса с помощью метода Рида и Менча [Reed L., Muench H.A., 1938].
Заражение мышей ВПГ. Самок мышей инфицировали ВПГ-2 внутрибрюшинно (или интравагинально) вводя им по 500 мкл (100 мкл) вируссодержащего материала. Для исследований были взяты соскобы из цервикального канала через 7 и 21 дней после инфицирования.
Для создания модели вирусного кератита мышам в конъюнктивальный мешок после скарификации роговицы стерильной иглой закапывали 3 мкл вируссодержащей жидкости (титр ВПГ-1 - 105 ЦПД50/0,1мл). Мышам группы сравнения в конъюнктивальный мешок после аналогичной травмы закапывали 3 мкл среды RPMI-1640. Интактным животным не наносили повреждений роговицы. Для определения уровня экспрессии генов TLR9 и BD2 методом ПЦР в режиме реального времени на 1-е, 3-и и 7-е сутки после скарификации осуществляли соскоб клеток роговицы.
Выделение нуклеиновых кислот из клеток. Выделение ДНК проводили по известным протоколам [Херрингтон С., 1999; Sambrook J., 2001]. Для выделения РНК использовали метод кисло-фенольной экстракции, а также использовали наборы “Рибо-сорб” (ФГУН ЦНИИЭ Роспотребнадзора, АмплиСенс, РФ) и RNeasy Mini Kit (Qiagen, Германия). Полученные образцы нуклеиновых кислот хранили при температуре минус 700С.
Реакцию обратной транскрипции (ОТ) проводили по известным протоколам [Edwards K., 2004; Dennis Y.M., 2006]. Часть реакций обратной транскрипции проведена с использованием наборов: Sensiscript RT Kit (Qiagen, Германия) и Реверта (ИЛС, РФ) в соответствии с инструкцией фирмы-производителя.
Полимеразная цепная реакция в режиме реального времени (ПЦР-РВ). Праймеры и зонды для ПЦР-РВ моделированы в программе Vector NTI 8,0, в соответствии с последовательностями мРНК исследуемых генов (из базы данных GenBank), и синтезированы в фирме Синтол (РФ). Для приготовления ПЦР-смеси в реакциях использовали Hot Start Taq DNA Polymerase (СибЭнзим, РФ), Hot Start Taq DNA Polymerase (Qiagen, Германия), TaqBead HotStart Polymerase (Promega, США), а также наборы «Набор реактивов для проведения ПЦР-РВ в присутствии интеркалирующего красителя SYBR Green I (Буфер Б)» (Синтол, РФ). Для определения экспрессии гена актина, помимо имеющейся системы, использовали «Набор реактивов для обнаружения и определения кДНК -актина человека» (Синтол, РФ). Реакцию проводили согласно рекомендациям фирмы-производителя в амплификаторе АНК-32 или АНК-16 (Институт Аналитического Приборостроения РАН, РФ) при следующей программе: 500С – 2 мин., 950С – 10 мин., (56 - 680С– 50 секунд, 950С – 15 секунд) 40 циклов. Программное обеспечение приборов АНК-16 и АНК-32 позволяет получить данные по пороговому циклу.
Рестрикционный анализ. Для определения полиморфных маркеров Arg677Trp и Arg753Gln в гене TLR2 использовали рестриктазу AciI (Fermentas, Литва), Asp299Gly в гене TLR4 - рестриктазу Nco-I (Fermentas, Литва), Thr399Ile в гене TLR4 - рестриктазу Hinf-I (СибЭнзим, РФ). Температурный и временной режимы реакции полностью соответствовали таковым в инструкции фирмы-производителя.
Выделение клеток из периферической крови. Выделение мононуклеарных клеток (МНК) из периферической крови здоровых доноров и больных с урогенитальной инфекцией проводили по стандартной методике с помощью одноступенчатого градиента плотности фиколл-пака (=1,077; Pharmica, Швеция) по методу A.Boyum [Boyum, 1968]. Выделения нейтрофилов (НФ) из периферической крови проводили по стандартной методике [Ковальчук Л.В., 2010].
Стимуляция и культивирование мононуклеарных клеток и нейтрофилов проводили с помощью ЛПС (100, 10, 1, 0,1 и 0,01 нг на лунку), антигенов ВПГ-1, ВПГ-2 (100 мкл вируссодержащей жидкости на лунку), препарата Суперлимф (100 мкг/ на лунку), антигенов Candida alb и др. Через 3, 6, 12, 18, 24 часа определяли цитокины в культуральной жидкости методом ИФА.
Иммуноферментный анализ (ELISA). Концентрацию цитокинов в культуральной жидкости, слизи цервикального канала, секрете простаты или сыворотке, плазме периферической крови определяли с помощью коммерческих ИФА наборов: ИЛ-1, диапазон измерений 0-250 пг/мл (BioSource, Бельгия), ИЛ-4 (BioSource, Бельгия), ИЛ-6 - 0-500 пг/мл (Invitrogen, США), ИЛ-8 - 0-1000 пг/мл (BioSource, Бельгия), ИЛ-10 - 0-500 пг/мл (BioSource, Бельгия), ИЛ-12 - 0-500 пг/мл (Invitrogen, США), ФНО - 0-1000 пг/мл (BioSource, Бельгия), ТФР - 0-2000 пг/мл (BioSource, Бельгия), ИФН - 0-1000пг/мл (BioSource, Бельгия) и противомикробных пептидов HNP1-3 - 0-10000пг/мл (HBT, Нидерланды) и LL-37 (HBT, Нидерланды). В данных тест-системах использовали «сэндвич»-вариант твердофазного иммуноферментного метода с применением пероксидазы хрена в качестве индикаторного фермента. Анализ проводили по предложенной производителями (BioSource, Invitrogen, HBT) методике. Для определения оптической плотности использовали анализатор иммуноферментных реакций (Пикон, РФ).
Статистические методы обработки данных. Статистический анализ проводили с использованием общепринятых статистических методов [Гланц С., 1999]. Применяли компьютерную статистическую программу BioStat, а также программу Excel. В таблицах и рисунках результаты представлены в виде Х±. Для сравнения групп данных использовали параметрический критерий Стьюдента (t), а также непараметрические методы статистической обработки данных (критерий Манна-Уитни). Для статистической обработки результатов по качественным признакам (полиморфным маркерам - сравнение частот аллелей и генотипов) использовали критерий 2 и точный критерий Фишера. Достоверными считались различия при p<0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В настоящей работе разработаны молекулярные и генетические подходы к изучению TLR-опосредованных механизмов врожденного иммунитета при патологии инфекционного генеза на уровне слизистых оболочек. Сформулированные подходы включает оценку Toll-подобных рецепторов, сигнальных и эффекторных молекул (цитокинов и противомикробных пептидов). Каждый компонент системы TLRs может быть изучен на различных уровнях: на уровне нуклеотидной последовательности гена (полиморфизм, мутации), уровне экспрессии мРНК, уровне синтеза белковой молекулы, уровне функциональной активности (эффекта). Методические подходы исследования системы TLRs на различных уровнях представлены в таблице 1.
Таблица 1.
Методические подходы, используемые в работе.
| Уровень исследования | Предмет исследования | Метод исследования |
| Геномный уровень | SNP (single nucleotide polymorphism) | ПЦР, рестрикционный анализ |
| Уровень экспрессии гена | Количественное изменение экспрессии гена | Обратная транскрипция, ПЦР-РВ |
| Уровень синтеза белка | Продукция белков в жидкостях | Иммуноферментный анализ |
| Функциональный уровень | Активация рецепторов, маркеры на поверхности клеток | Эксперименты с лигандами на моделях in vitro и in vivo |
Разработка систем ОТ-ПЦР в режиме реального времени для оценки экспрессии генов Toll-подобных рецепторов, противомикробных пептидов, цитокина ФНО и других молекул
Первоочередной задачей исследования являлась разработка систем на основе ОТ-ПЦР в режиме реального времени для определения уровней экспрессии генов, белковые продукты которых участвуют в реакциях врожденного иммунитета при таких патологических состояниях, как урогенитальная инфекция женщин, внутриутробное инфицирование плода, преждевременные роды, кератит, простатит и другие. Помимо этого, были отработаны системы для определения экспрессии генов TLR2, TLR9, BD-2 мыши. Данные системы были созданы для исследования уровней экспрессии генов на модели вирусного кератита и на модели генитального герпеса in vivo. В таблице 2 представлены данные по разработанным системам. Экспериментально были подобраны условия проведения реакции обратной транскрипции, а также концентрации праймеров, зондов, MgCl2 в реакционной смеси и температура отжига праймеров.
Таблица 2.
Условия проведения ПЦР в режиме реального времени для определения уровня экспрессии исследуемых генов.
| Система | Концентрации праймеров (пМ/мкл) | Концен-трация зонда (пМ/мкл) | Температура отжига праймеров (оС) | MgCl2 (mM) | |
| «прямой» | «обратный» | ||||
| TLR1 | 4,6 | 4,0 | 3,0 | 64 | 2,5 |
| TLR2 | 2,3 | 3,2 | 5,0 | 62 | 2,5 |
| TLR4 | 4,7 | 4,3 | 2,3 | 62 | 2,5 |
| TLR6 | 4,0 | 3,9 | 2,6 | 64 | 2,5 |
| TLR9 | 2,0 | 2,7 | 5,0 | 64 | 5,0 |
| HNP-1 | 10 | 10 | 7,6 | 62 | 5,0 |
| HBD-1 | 10 | 10 | 7,0 | 62 | 5,0 |
| HBD-2 | 10 | 10 | 3,6 | 62 | 2,5 |
| NF-kB | 10 | 10 | 7,0 | 64 | 2,5 |
| Caspase 3 | 4,3 | 4,1 | 7,0 | 64 | 5,0 |
| Caspase 8 | 3,8 | 4,0 | 3,0 | 64 | 2,5 |
| FLIP | 2,8 | 3,0 | 5,0 | 54 | 5,0 |
| XIAP | 10 | 10 | 3,0 | 60 | 10,0 |
| ФНО | 10 | 10 | 5,0 | 60 | 2,5 |
| -актин чел. | 3,96 | 3,66 | 4,0 | 62 | 2,5 |
| Mus mus TLR22 | 4 | 4 | 5,0 | 62 | 5,0 |
| Mus mus TLR9 | 4 | 4 | 5,0 | 64 | 5,0 |
| Mus mus BD-2 | 4 | 4 | 5,0 | 60 | 2,5 |
| -актин мыши | 4 | 4 | 5,0 | 60 | 5,0 |
Оценка экспрессии генов молекул врожденного иммунитета в экспериментальных моделях инфекционного процесса in vitro и in vivo
С помощью разработанных тест систем проведено изучение экспрессии генов TLRs, дефенсинов и цитокинов в моделях инфекционного процесса, вызванного ВПГ-1, ВПГ-2 и др.
Модели in vitro
В моделях in vitro использовали культуру клеток Vero и культуру клеток цервикального канала HeLa. На основании проведенных исследований установлено, что клетки Vero конститутивно экспрессировали гены TLR1, TLR2, TLR3, TLR4, TLR6, TLR9. Наиболее выражена экспрессия генов TLR2, распознающего гликопротеины вирусной оболочки, и TLR9, распознающего неметилированные CpG-богатые повторы ДНК вируса. В культуральной среде не выявлены цитокины с противовирусным действием (ФНО и ИФН). В то же время ТФР и ИЛ-12 определялись в значительных концентрациях (436±64 пг/мл и 348±27 пг/мл соответственно).
При заражении клеток Vero ВПГ-1 наблюдали значительное увеличение уровня экспрессии гена TLR2 (в 35 раз) по сравнению с неинфицированной культурой. Изменение уровней экспрессии генов эндосомальных рецепторов TLR3 и TLR9 в культуре Vero менее выражено, значения отличались от контрольных показателей (возрастали) не более, чем в 5 раз. При этом следует отметить, что оптимальная доза заражения ВПГ-1 составила 0,000001 ТЦД50/кл. При указанной дозе цитопатическое действие вируса наблюдалось в 12,5 – 25% клеток, экспрессия генов TLR при этом была максимальной. Если цитопатическое действие вируса проявлялось более, чем у 50% клеток монослоя, изменение уровня экспрессии генов TLRs были не столь выражены, что можно объяснить снижением количества клеток, способных экспрессировать исследуемые рецепторы. Достоверных изменений в выработке цитокинов не выявлено. Таким образом, ВПГ-1 активирует экспрессию TLRs. TLR-опосредованная активация синтетических процессов [Liu X., 2008], а также отсутствие синтеза противовирусных цитокинов в клетках Vero приводят к усилению репликации ВПГ-1. Этим объясняется широкое использование культуры Vero в качестве одной из наиболее чувствительных клеточных линий, применяемых для изучения цитопатического действия вирусов [Королюк М.А., 2002].
В культуре эпителиальных клеток цервикального канала линии HeLa был изучен TLR-опосредованный ответ на инфекцию, вызванную вирусом герпеса простого 2 типа. Монослой клеток HeLa обрабатывали вируссодержащей жидкостью (титр ВПГ-2 - 3,5 ТЦД50/0,1мл), было показано, что ВПГ-2 увеличивал экспрессию TLR9 на 3-й час после заражения, к 6-му часу уровень экспрессии возвращалась к исходному показателю. Активация экспрессии NF-kB сохранялась в течение всего периода наблюдения. Максимальная экспрессия гена ФНО была определена на 6-й час после инфицирования. Таким образом, увеличение экспрессии гена ФНО, непосредственно защищающего клетки слизистой от вирусной инфекции, является следствием активации сигнального рецептора TLR9 в клетках HeLa при действии ВПГ-2. Культура клеток HeLa может быть использована для исследования TLR-опосредованных механизмов врожденного иммунитета на уровне клеток слизистой.
Одной из задач настоящего исследования являлось сопоставление уровней экспрессии и продукции молекул врожденного иммунитета на примере дефенсина HNP-1 в культуре нейтрофилов периферической крови здоровых беременных. При исследовании динамики экспрессии гена HNP-1 при стимуляции липополисахаридом было показано, что ЛПС в концентрации 0,1 нг/мл индуцировал экспрессию HNP-1 нейтрофилами на 6 час культивирования, а концентрация ЛПС 0,01 нг/мл не оказывала стимулирующего эффекта. При действии ЛПС в дозе 0,01 нг/мл выработка HNP-1 нейтрофилами беременных с физиологически протекающей беременностью наблюдалась на высоком уровне (не менее 8000 пг/мл) в течение всего периода наблюдения (уже с 3-его часа до 24-х часов). Экспрессия гена этого дефенсина была максимальной на 6-ом часу культивирования. Следовательно, можно предположить, что в течение 6-ти часов наблюдался выброс HNP-1 из гранул, и лишь позже наблюдался его синтез, индуцированный ЛПС.
Таким образом, перспективным является параллельный анализ экспрессии противомикробных пептидов на уровне генов и синтеза белка в клетках периферической крови в связи с поиском критериев прогноза течения инфекционного процесса.
Модель вирусного кератита
Следующей задачей явилось изучение экспрессии генов TLR9 и эффекторной молекулы -дефенсина-2 (BD-2), обладающего прямым противовирусным действием, в клетках роговицы при герпетическом кератите у мышей линий С57Bl/6 и BALB/c. За основу нами была взята модель вирусного кератита, предложенная Wuesta T. с соавторами, с некоторыми модификациями [Wuesta T., 2006]. Животных каждой линии разделили на три группы. Мышам 1-ой группы в конъюнктивальный мешок после скарификации роговицы стерильной иглой закапывали 3 мкл вируссодержащей жидкости (титр ВПГ-1 равен 105 ЦПД50/0,1мл) (n=10). Мышам 2-ой группы в конъюнктивальный мешок после аналогичной травмы вводили 3 мкл среды RPMI-1640 (n=10). Третья группа включала интактных мышей (n=10). Наблюдение проводилось в динамике в течение 7 дней. Для доказательства развития инфекции в роговице определяли ВПГ-1 с помощью метода nested-ПЦР в режиме реального времени. Для определения уровня экспрессии генов TLR9 и BD-2 методом ПЦР в режиме реального времени на 1-е, 3-и и 7-е сутки после скарификации забирали клетки эпителия роговицы.
Использование модели вирусного кератита позволило выявить существенную разницу в течение вирусного процесса в эпителиальных клетках роговицы мышей исследуемых линий. Мыши линии C57Bl/6 были более чувствительны к инфекции, вызванной ВПГ-1. К 3-м суткам у 90% мышей развивалась вирусная инфекция в роговице, в то время как у мышей линии BALB/c – лишь у 50% животных.
У мышей линии C57Bl/6, инфицированных ВПГ-1, наблюдается достоверное снижение экспрессии гена TLR9 в роговице в течение всех сроков наблюдения относительно группы сравнения (Рис. 1А). В роговице мышей линии BALB/c, инфицированных вирусом, не обнаружено статистически значимых различий по сравнению с интактными животными (Рис. 1Б). Чем обусловлены выявленные межлинейные различия в экспрессии TLR9? Сравнительный анализ нуклеотидных последовательностей гена TLR9 мышей линий С57Bl/6 и BALB/c в базе данных GeneBank показал наличие единичных нуклеотидных замен, которые приводят к изменению аминокислотной последовательности доменов TLR9. Выявленные различия, по-видимому, играют важную роль в распознавании ДНК вируса рецептором, что в конечном итоге может влиять на течение герпесвирусной инфекции.
Рис. 1. Изменение количественных уровней экспрессии гена TLR9 в эпителиальных клетках роговицы у мышей линии C57Bl/6 (А) и BALB/c (Б).
по оси абсцисс – сроки наблюдения (сутки); по оси ординат – lg(количество копий мРНК гена) относительно 103 копий мРНК -актина мыши.
- зона значений показателя в группе интактных мышей (группа 3).
* - значение достоверно отличается от показателя в группе 2 (скариф.) (p<0,05).
ВПГ-1 может вызывать снижение экспрессии распознающего рецептора TLR9 у мышей линии С57Bl/6, что объясняет их высокую чувствительность к развитию вирусного кератита. Наряду с этим механизмом уклонения от иммунного надзора ВПГ может ингибировать Toll-опосредованный воспалительный ответ [Liu X., 2008]. Согласно этого механизма вирусный белок ICP0, играющий важную роль в переходе ВПГ-1 из латентного состояния в состояние реактивации, блокирует ядерный фактор транскрипции NF-kB через адапторную молекулу TRAF6 сигнального пути TLR9. Это снижение соответственно приводит к супрессии выработки провоспалительных цитокинов, в частности, ФНО, блокирующего репликацию ВПГ-1 [Wuesta T., 2006]. Уровень экспрессии противомикробного пептида BD-2 в роговице мышей исследуемых линий не изменялся. Полученные данные о разном течении герпетической инфекции у мышей исследуемых линий в большей степени связаны с различиями в экспрессии сигнального рецептора TLR9, а не молекулы противомикробного пептида BD-2.
Проведенные исследования раскрывают новые подходы к оценке роли врожденного иммунитета тканей глаза при герпетической инфекции. Модель вирусного кератита и определение экспрессии распознающего рецептора TLR9, а также эффекторных молекул, позволят оценить возможности применения иммунотропных препаратов в комплексной терапии офтальмогерпеса.
Комплексный анализ изменений показателей врожденного иммунитета у женщин с физиологически протекающей беременностью и у беременных с урогенитальной инфекцией
Слизистые оболочки урогенитального тракта представляют естественный физиологический барьер. Эпителиальные клетки слизистых контактируют с окружающей средой, первыми реагируют на патогены и включают механизмы врожденного иммунитета.
Таблица 3.
Экспрессия генов TLRs эпителиальными клетками цервикального канала при беременности.
| Исследуемая группа | Экспрессия исследуемого гена | |||
| TLR1 | TLR2 | TLR4 | TLR6 | |
| Здоровые небеременные женщины | 3,81±1,39 (0,06х105) | 4,18±0,38 (0,15х105) | 3,98±0,49 (0,09х105) | 4,72±0,58 (0,52х105) |
| Группа женщин с физиологически протекающей беременностью | 4,27±0,97 (0,19х105) | 4,97±0,35 (0,93х105) | 4,32±0,13 (0,21х105) | 4,68±0,49 (0,48х105) |
| Группа женщин с преждевременными родами (УГИ) | 5,99±0,39* (9,77х105) | 6,58±0,95* (38,02х105) | 4,71±0,35 (0,51х105) | 4,7±0,26 (0,50х105) |
| Отношение показателя при патологии к показателю в норме (при физиологически протекающей беременности)** | 52,5 | 40,7 | 2,4 | 1,0 |
| Группа женщин с преждевременными родами (ВУИ) | 6,18±0,54* (15,14х105) | 6,77±1,08* (58,88х105) | 4,87±0,32 (0,74х105) | 4,78±0,23 (0,60х105) |
| Отношение показателя при патологии к показателю в норме (при физиологически протекающей беременности)** | 81,3 | 63,1 | 3,5 | 1,3 |
* – показатель достоверно отличается от значения в группе женщин с физиологически протекающей беременностью (p<0,05).
** - в строке представлено отношение показателей в скобках
В таблице представлено относительное количество копий исследуемого гена в десятичных логарифмах, в скобках даны значения количества копий кДНК относительно 106 копий актина.
В последние годы одной из главных проблем репродуктивного здоровья являются инфекции, передаваемые половым путем, которые связаны с такими осложнениями, как бесплодие, внутриутробное инфицирование и преждевременные роды. В данном разделе представлены результаты сравнительного анализа роли ключевых компонентов системы врожденного иммунитета: распознающих Toll-подобных рецепторов и эффекторных молекул (дефенсинов и цитокинов) у здоровых женщин, у здоровых беременных женщин (1 и 3 триместр) и у беременных с УГИ (Таблица 3).
Эпителиальные клетки цервикального канала небеременных женщин экспрессируют TLRs. В группе беременных женщин в клетках слизистой цервикального канала отмечено увеличение уровней экспрессии генов TLR1 в 2,88 раз, TLR2 в 6,16 раз, TLR4 в 2,19 раз по сравнению со здоровыми небеременными женщинами.
Известно, что -дефенсина-1 (НBD-1) экспрессируется конститутивно клетками цервикального канала и выполняет важную защитную функцию, оказывая местное противомикробное действие, предотвращая проникновение патогенов. Особое значение приобретает экспрессия НBD-1 при беременности. Нами показано увеличение экспрессии гена HBD-1 в слизистой цервикального канала в 64 раза у беременных в первом триместре по сравнению с небеременными женщинами. К третьему триместру беременности уровень экспрессии гена HBD-1 снижался у женщин с физиологически протекающей беременностью, но остается выше, чем в группе небеременных женщин. Повышение экспрессии генов TLRs и HBD-1 можно объяснить возрастанием роли врожденного иммунитета на уровне слизистой при беременности.
В отличие от -дефенсинов, экспрессируемых эпителиальными клетками слизистой, -дефенсины (HNP1-3) выделяются из азурофильных гранул нейтрофилов при инфекции и определяют в основном развитие системного воспалительного ответа. Показано, что эти катионные пептиды активируют миграцию и фагоцитоз нейтрофилов и макрофагов, увеличивают проницаемость сосудов, секрецию ИЛ-8 клетками эндотелия [Espinoza J., 2003].
Следующий этап исследований включал определение -дефенсинов HNP1-3 в сыворотке периферической крови беременных женщин с нормально протекающей беременностью. При физиологически протекающей беременности концентрация, -дефенсинов в плазме периферической крови возрастают в десятки раз и составляет 6,7±3,4 нг/мл. Это свидетельствует об активации врожденного иммунитета, а именно функции нейтрофилов, при беременности. Крайне низкий показатель продукции нейтрофильных пептидов в плазме (менее 0,1 нг/мл) в 70% случаев является прогностическим фактором неразвивающейся беременности.
Выявленные изменения исследуемых показателей, по-видимому, можно объяснить тем, что происходящее при беременности снижение активности адаптивного иммунитета компенсируется за счет активации факторов врожденного иммунитета, осуществляющих противомикробную защиту матери и плода [Макаров О.В., 2007].
Урогенитальная инфекция, оставаясь ведущей проблемой акушерства и гинекологии, приводит к различным патологиям беременности, в частности к одной из основных причин невынашивания беременности, внутриутробного инфицирования и других патологий. В данной работе представлены данные по комплексному изучению компонентов врожденного иммунитета (TLRs, противомикробных пептидов, цитокинов и др.) на уровне слизистой оболочки цервикального канала. В структуре урогенитальной инфекции у беременных женщин основной группы преобладали Ureaplasma urealyticum (29,7%), Gardnerella vaginalis (19,5%), Chlamydia trachomatis (11,9%), ВПГ-2 (28,8%), ЦМВ (33,6%). При бактериологическом исследовании рост микрофлоры был выявлен у 39,5% беременных в подгруппе с бактериальной инфекцией, у 27,3% беременных со смешанной инфекцией, при этом результаты достоверно отличаются от данного показателя в контрольной группе (4,6%; p<0,05).
Обследовано 90 женщин с УГИ различной этиологии. У 25 беременных женщин с УГИ, беременность закончилась своевременными родами, у 65 женщин развивались преждевременные роды. Новорожденные от 20 матерей этой группы имели локальные и системные проявления ВУИ.
На первом этапе исследованы уровни экспрессии генов TLRs клетками слизистой цервикального канала - TLR1, TLR2, TLR4, TLR6 в группах здоровых беременных и беременных с преждевременными родами. Результаты исследований представлены в таблице 3. У здоровых беременных женщин наиболее выражена экспрессия гена TLR2, распознающего широкий спектр патогенов. У беременных с преждевременными родами и урогенитальной инфекцией экспрессия генов TLR1, TLR2, TLR4 клетками цервикального канала возрастала в среднем в 52,5, в 40,7 и в 2,4 раза соответственно по сравнению с группой женщин с физиологически протекающей беременностью (Табл. 3). Еще более выраженное увеличение экспрессии TLR1 и TLR2 наблюдалось в группе женщин с реализацией внутриутробной инфекции. Гиперэкспрессия генов TLRs в слизистой у женщин с преждевременными родами инфекционного генеза сопровождалась увеличением выработки провоспалительных цитокинов ИЛ-8 и ИФН. У 70% женщин с прервавшейся беременностью концентрация ИЛ-8 в цервикальной слизи была выше 3000 пг/мл, в группе здроровых беременных этот показатель был ниже 2600 пг/мл. Средние значения ИФН в слизи цервикального канала у женщин с прервавшейся беременностью были достоверно выше, чем в группе женщин с УГИ, родившими в срок и составили 114±53,4 пг/мл и 3,8±1,9 пг/мл соответственно (р < 0,05).
Наряду с увеличением выработки провоспалительных цитокинов у беременных женщин с урогенитальной инфекцией снижена экспрессия гена HBD-1 в клетках слизистой цервикального канала в 2,5 раза по сравнению со здоровыми беременными. Можно предположить, что развитие урогенитальной инфекции у беременных спровоцировано изначально сниженной выработкой противомикробных пептидов клетками слизистой. Одной из причин этого может быть полиморфизм генов, кодирующих молекулы врожденного иммунитета (TLR, цитокинов, противомикробных пептидов, ферментов и др.) [Milanese M, 2006; Tesse R, 2008]. У женщин, родивших детей с признаками внутриутробного инфицирования, наблюдалось наиболее выраженное угнетение экспрессии гена НBD-1 в 10 раз и более по сравнению с группой беременных с урогенитальной инфекцией. Согласно полученным результатам, определение недостаточной экспрессии противомикробного пептида HBD-1 является чувствительным тестом, позволяющим выделить группу риска по возникновению осложнений – преждевременных родов, внутриутробной инфекции плода и новорожденного.
Оценка роли TLR-опосредованного апоптоза в ткани плаценты при патологии инфекционного генеза у беременных
В настоящее время показано, что клетки плаценты экспрессирует практически все TLRs [Fazeli A., 2005]. Известно, что апоптоз может быть индуцирован активацией TLR4 и TLR2 [Lopez M., 2003; Chan G., 2006]. В связи с этим, нами были изучены уровни экспрессии генов TLR2 и TLR4 в клетках плаценты женщин с преждевременными родами инфекционного генеза и у женщин с урогенитальной инфекцией и срочными родами.
При сопоставлении уровня экспрессии TLR2 клетками плаценты у беременных при урогенитальной инфекции (за исключением женщин со срочными родами) отмечено значительное увеличение уровней экспрессии TLR2 (в 8,51 раз, а при реализации внутриутробной инфекции - в 7,08 раз). Далее нами были исследованы уровни экспрессии генов каспазы-3, каспазы-8 и их ингибиторов (FLIP, XIAP) в клетках плаценты. Наибольшее увеличение числа копий гена каспазы-8 и каспазы-3 наблюдалось в группе беременных с урогенитальной инфекцией и преждевременными родами, при этом количество копий этих генов превышал показатель в группе здоровых в 6 раз (р = 0,03) и в 53,7 раза (р=0,015), соответственно. Достоверного отличия уровня экспрессии гена c-FLIP в исследуемых группах женщин с урогенитальной инфекцией от группы здоровых рожениц выявлено не было (Табл. 4).
Таблица 4.
Экспрессия генов CASP 8, CASP3, XIAP, FLIP в клетках плаценты в исследуемых группах.
| Параметр Исследуемая группа | TLR2 | TLR4 | CASP 8 | CASP 3 | FLIP | XIAP |
| Здоровые беременные | 6,77±0,67 (58,88х105) | 4,77±0,49 (0,59х105) | 5,56±0,66 (3,63х105) | 5,03±0,52 (1,07х105) | 4,73±0,60 (0,54х105) | 6,19±0,73 (15,49х105) |
| Беременные женщины с УГИ и срочными родами | 7,09±0,97 (123,03х105) | 4,77±0,63 (0,59х105) | 5,79±1,16 (6,17х105) | 4,79 ±0,09 (0,62х105) | 4,95±0,50 (0,89х105) | 6,32±0,42 (20,89х105) |
| Отношение показателя при патологии к показателю в норме** | 2,09 | 1,00 | 1,70 | 0,57 | 1,66 | 1,35 |
| Беременные женщины с УГИ и преждевременными родами | 7,70±0,55* (501,19х105) | 5,03±0,71 (1,07х105) | 6,34±1,30* (21,88х105) | 6,76±0,74* (57,54х105) | 4,63±0,30 (0,43х105) | 5,11±0,35* (1,29х105) |
| Отношение показателя при патологии к показателю в норме** | 8,51 | 1,82 | 6,02 | 53,70 | 0,79 | 0,08 |
| Беременные женщины с ВУИ и преждевременными родами | 7,62±0,65* (416,87х105) | 5,25±0,84 (1,778х105) | 6,06±0,51* (11,48х105) | 6,08 ±1,06 (12,02х105) | 4,44±0,30 (0,27х105) | 5,86±0,59 (7,24х105) |
| Отношение показателя при патологии к показателю в норме** | 7,08 | 3,02 | 3,16 | 11,22 | 0,51 | 0,47 |
* – показатель достоверно отличается от значения в группе женщин с физиологически протекающей беременностью (p<0,05).
** - в строке представлено отношение показателей в скобках
В таблице представлено относительное количество копий исследуемого гена в десятичных логарифмах, в скобках даны значения количества копий кДНК относительно 106 копий актина.

Рис. 2. Схема активации апоптоза в клетках плаценты при активации TLRs.
(в красные рамки обведены исследуемые нами параметры).
Таким образом, можно сделать вывод о том, что в плаценте беременных с урогенитальной инфекцией и срочными родами, и беременных с преждевременными родами, белок c-FLIP экспрессируется в физиологических концентрациях. Другим исследуемым ингибитором каскада апоптоза является представитель семейства IAP белок XIAP. Во всех исследуемых группах, за исключением группы женщин с УГИ и срочными родами, уровень экспрессии гена XIAP был снижен (Табл. 4).
Для установления взаимосвязи этих процессов проведен корреляционный анализ экспрессии изучаемых генов в каждой группе. Показана положительная корреляция между уровнями экспрессии каспазы - 8/TLR2 и каспазы - 3/TLR2, при этом коэффициент корреляции составлял 0,72 и 0,60, соответственно. Показана обратная корреляция между экспрессией генов каспаз и их ингибиторами. Эти данные позволяют говорить о том, что в ткани плаценты у здоровых рожениц уровень экспрессии гена CASP 3 ассоциирован с уровнем экспрессии гена CASP 8. Определена обратная корреляция между уровнями экспрессии генов CASP 3 и XIAP, а также CASP 8 и FLIP. Ассоциаций между уровнями экспрессии генов CASP 3 и FLIP и генов CASP 8 и XIAP, а также между генами двух ингибиторов выявлено не было.
На основании наших данных и данных литературы [Koga К., 2009] можно представить следующую схему TLR-опосредованного апоптоза в клетках плаценты (Рис. 2). Активация TLR2 через домен смерти (DD) приводит к последовательной активации инициаторных каспаз (каспаза - 8) и эффекторных каспаз (каспаза - 3). Этот процесс может быть заблокирован белками FLIP и XIAP. При недостаточности ингибиторов апоптоза, клетки плаценты погибают посредством программируемой гибели. TLR4-опосредованная активация макрофагов приводит к выработке ФНО, индуцирующего также апоптоз в клетках плаценты.
Исследование ассоциации полиморфных маркеров в генах Toll-подобных рецепторов и -дефенсина-1 с риском развития патологии инфекционного генеза у беременных женщин
Накапливается все больше данных, свидетельствующих о том, что SNPs за счет наличия различных аллельных вариантов, вносят важный вклад в индивидуальные особенности иммунного ответа. Роль генетических факторов в инфекционной патологии, в том числе в риске развития преждевременных родов инфекционного генеза общепризнанна [Wang Z.C., 2002, Hrtel Ch., 2004, Goepfert A.R., 2005, Stonek F., 2008].
Одной из задач нашего исследования являлся поиск ассоциации между SNP-маркерами, локализованными в генах TLR2, TLR4, TLR9), и патологическими состояниями при беременности (преждевременные роды, реализация внутриутробной инфекции). Исследуемые SNP находились как в районе гена, кодирующего TIR-домен, так и - LRR-домен Toll-подобного рецептора.
При исследовании распределения аллелей и генотипов полиморфного маркера Arg677Trp гена TLR2 в исследуемых группах беременных женщин обнаружено преобладание частоты аллеля Trp над частотой аллеля Arg и встречаемости генотипа TrpTrp над встречаемостью генотипов TrpArg и ArgArg. Отличия распределения аллелей и генотипов между группами были недостоверны. Другой полиморфный маркер Arg753Gln также локализован в районе TIR-домена TLR2, и по данным литературы этот маркер также ассоциируется с развитием инфекционных процессов. Нами было показано, что риск развития внутриутробного инфицирования плода связан с носительством аллеля Arg (относительный риск - 4,533), в то же время аллель Gln связан с пониженным риском реализации ВУИ (относительный риск - 0,221). Таким образом, можно сделать вывод об ассоциации полиморфного маркера Arg753 с риском реализации ВУИ (Табл. 5). Полученные результаты можно объяснить тем, что замена Gln на Arg в положении 753 приводит к конформационным изменениям в TIR-домене и к нарушению передачи сигнала с TLR2, что сопровождается дисбалансом выработки противомикробных пептидов и цитокинов, следствием чего является активное распространение инфекции, приводящее к инфицированию плода.
В группах беременных женщин с УГИ, преждевременными родами и реализацией ВУИ не выявлено статистически значимых различий частот аллелей и генотипов полиморфных маркеров Asp299Gly и Thr399Ile гена TLR4. Возможно другие полиморфные маркеры в генах сигнальных рецепторов врожденного иммунитета, могут быть ассоциированы с риском развития преждевременных родов или реализацией внутриутробной инфекции.
Одним из таких генов – кандидатов является ген TLR9. Для изучения ассоциаций с инфекционными патологиями при беременности нами был выбран полиморфный маркер A2848G, локализованный в районе TIR-домена Toll-подобного рецептора 9. Распределение частот аллелей в группе с преждевременными родами составило 0,58 (аллель G) и 0,42 (аллель A), со срочными родами - 0,44 (аллель G) и 0,56 (аллель A) (Таблица 6). Сравнительный анализ выявил достоверные различия частот аллелей и генотипов полиморфного маркера A2848G гена TLR9; аллель А и генотип АА являлись «протективными» в случае преждевременных родов инфекционного генеза.
Таблица 5.
Распределение частот аллелей и генотипов полиморфного маркера Arg753Gln в гене TLR2 в исследуемых клинических группах.
| Исследуемая группа | Частота аллеля | Относительный риск** | р** | ||||||
| Arg | Gln | Arg | Gln | ||||||
| Здоровые беременные | 0,49 | 0,51 | - | - | - | ||||
| Беременные женщины с УГИ | 0,47 | 0,53 | 1,43 | 0,70 | 0,147 | ||||
| Берем. женщины с УГИ и сроч.родами | 0,49 | 0,51 | 1,51 | 0,66 | 0,149 | ||||
| Беременные с УГИ и прежд. родами | 0,46 | 0,54 | 1,34 | 0,75 | 0,153 | ||||
| Беременные с ВУИ и прежд. родами | 0,74* | 0,26* | 4,53* | 0,22* | 0,011* | ||||
| Исследуемая группа | Частота генотипа | Относительный риск** | |||||||
| Arg/Arg | Arg/ Gln | Gln / Gln | Arg/Arg | Arg/ Gln | Gln / Gln | ||||
| Здоровые беременные | 0,38 | 0,22 | 0,40 | - | - | - | |||
| Беременные женщины с УГИ | 0,34 | 0,26 | 0,40 | 0,84 | 1,25 | 1,00 | |||
| Берем. женщины с УГИ и сроч.родами | 0,34 | 0,30 | 0,36 | 0,84 | 1,52 | 0,84 | |||
| Беременные с УГИ и прежд. родами | 0,36 | 0,20 | 0,44 | 0,92 | 0,89 | 1,18 | |||
| Беременные с ВУИ и прежд. родами | 0,52 | 0,44* | 0,04* | 1,77 | 2,79* | 0,06* | |||
* - значение достоверно отличается от показателя в норме (р<0,05),
** - относительный риск и р были посчитаны относительно контрольной группы.
Другой аллель А полиморфного маркера A2848G гена TLR9 ассоциирован со срочными родами при урогенитальной инфекции (относительный риск – 2,030). Следует отметить, что реализации внутриутробного инфицирования плода при этом не происходило. Таким образом, полиморфный маркер A2848 можно расценивать в качестве «протективного».
Таблица 6.
Распределение частот аллелей и генотипов полиморфного маркера A2848G в гене TLR9 в исследуемых клинических группах.
| Исследуемая группа | Частота аллеля | Относительный риск** | р** | ||||
| G | A | G | A | ||||
| Здоровые беременные | 0,61 | 0,39 | - | - | - | ||
| Беременные женщины с УГИ | 0,50 | 0,50 | 0,64 | 1,57 | 0,10 | ||
| Беременные женщины с УГИ и сроч.родами | 0,44* | 0,56* | 0,49* | 2,03* | 0,05* | ||
| Беременные с УГИ и прежд. родами | 0,58 | 0,42 | 0,88 | 1,13 | 0,16 | ||
| Беременные с ВУИ и прежд. родами | 0,62 | 0,38 | 1,04 | 0,96 | 0,20 | ||
| Исследуемая группа | Частота генотипа | Относительный риск** | |||||
| G/G | G/A | A/A | G/G | G/A | A/A | ||
| Здоровые беременные | 0,53 | 0,17 | 0,30 | - | - | - | |
| Беременные женщины с УГИ | 0,32* | 0,35* | 0,33 | 0,42* | 2,63* | 1,15 | |
| Беременные женщины с УГИ и сроч. родами | 0,26* | 0,36* | 0,38 | 0,31* | 2,82* | 1,41 | |
| Беременные с УГИ и прежд. родами | 0,44 | 0,28 | 0,28 | 0,70 | 1,90 | 0,91 | |
| Беременные с ВУИ и прежд. родами | 0,52 | 0,20 | 0,28 | 0,94 | 1,28 | 0,89 | |
* - значение достоверно отличается от показателя в норме (р<0,05),
** - относительный риск и р были посчитаны относительно контрольной группы.
Помимо SNP, локализованных в генах TLRs, нами были выбраны полиморфные маркеры G(-20)A, C(-44)G, и G(-52)A, расположенные в нетранслируемой области гена DEFB1. Предположительно данные SNPs могут влиять на уровень экспрессии гена дефенсина. При изучении распределения аллелей и генотипов полиморфного маркера G(-20)A в исследуемых группах носили недостоверный характер. Впрочем, следует отметить, что частота аллелей в группах беременных с УГИ и в контрольной группе составили: аллель G - 0,48 и 0,61, а аллель A - 0,52 и 0,39, соответственно. При этом урогенитальная инфекция у беременных женщин (как со срочными родами, так и с преждевременными родами) была ассоциирована с генотипом G/G. Различия в распределении аллелей и генотипов полиморфного маркера C(-44)G между исследуемыми группами были статистически недостоверными. Анализ частот аллелей и генотипов полиморфного маркера G(-52)A в исследуемых группах выявил, что частоты аллелей данного маркера в группе беременных женщин с УГИ и с преждевременными родами, в группе беременных женщин с реализацией ВУИ и в контрольной группе были следующими: аллель G - 0,88, 0,91 и 0,67, аллель А - 0,12, 0,09 и 0,33, соответственно. Риск развития преждевременных родов оказался связан с носителем аллеля G и генотипа G/G.
Нами было показано, что гаплотипы G(-20)С(-44), G(-20)A(-52) и C(-44)G(-52) ассоциированы со сниженным риском развития урогенитальной инфекцией при беременности (как у женщин со срочными родами, так и у женщин с преждевременными родами). Следует отметить, что гаплотип А(-20)G(-52) связан с развитием преждевременных родов (OR=2,012). Наиболее четкие результаты получены при исследовании ассоциации гаплотипов всех трех полиморфных маркеров с патологией беременности. Нами были выделены два основных гаплотипа А(-20)G(-44)G(-52) и G(-20)C(-44)A(-52).
Первый гаплотип ассоциирован с развитием урогенитальной инфекции у беременных женщин (с преждевременными родами и внутриутробным инфицированием плода). При этом относительный риск составляет 6,14, 6,36 и 8,833, соответственно. У женщин с гаплотипом G(-20)C(-44)A(-52) урогенитальная инфекция и патология, связанная с ней (преждевременные роды, внутриутробное инфицирование плода), развиваются значительно реже, таким образом, вышеуказанный гаплотип можно считать «протективным».
Анализ ассоциации полиморфизма в нетранслируемой области DEFB1 с уровнем экспрессии -дефенсина 1 показал, что аллель A(-20) ассоциирован с увеличением уровня экспрессии дефенсина в клетках цервикального канала. Так, частоты аллеля А(-20) в группе беременных женщин с повышенным уровнем экспрессии дефенсина и с низким - составляли 0,58 и 0,22, соответственно. Генотип GG(-52) также коррелировал с повышенной экспрессией дефенсина, частота данного генотипа составила 0,71 при повышенной экспрессии и 0,25 – при низкой. Другой генотип - GА(-52), был ассоциирован с пониженной экспрессией. Другие аллели и генотипы (полиморфных маркеров G(-20)A, C(-44)G, G(-52)A) не были ассоциированы с изменениями уровня экспрессии HBD-1 в исследуемой нами группе.
Роль TLRs, противомикробных пептидов и цитокинов слизистой уретры в патогенезе хронического простатита
Эпителиальные клетки уретры и простаты выступают в роли ранних сенсоров инфекции [Gatti G., 2006]. В настоящее время появляются первые работы о роли TLRs в активации механизмов воспаления в клетках эпителия уретры и простаты. Нами было проведено изучение уровня экспрессии генов TLR2, TLR4 и TLR9 в клетках слизистой уретры больных хроническим простатитом (Табл. 7). У всех больных хроническим бактериальным и абактериальным простатитом уровень TLR2 был снижен в 13,49 и 18,20 раз, соответственно, относительно показателя в группе здоровых добровольцев. Выраженное снижение уровня экспрессии гена TLR2 наблюдалось у больных хроническим бактериальным простатитом с инфекцией, вызванной энтерококком или гемолитическим стрептококком. Схожая картина наблюдалась у больных с хроническим абактериальным простатитом, у которых был выявлен гемолитический стрептококк или энтерококк в комплексе с уреоплазмой или гарденерелезом. Достоверно значимого отличия уровней экспрессии генов TLR4 и TLR9 в клетках слизистой уретры больных ХП и здоровых добровольцев выявлено не было. Полученные данные можно объяснить тем, что TLR2 распознает широкий спектр лигандов патогенов и включает механизмы, направленные на их элиминацию из организма. Можно предположить, что энтерококки и другие бактерии вызывают снижение экспрессии TLR2, что является одним из возможных механизмов «ускользания» инфекции от надзора иммунной системы.
В группе пациентов с бактериальным простатитом наблюдалось достоверное снижение в 4,78 раз экспрессии гена HBD-1, также отмечалась тенденция к снижению этого показателя в группе с абактериальном простатитом.
Таблица 7
Уровни экспрессии и процент выявления генов TLR2, TLR4, TLR9 в клетках слизистой уретры больных хроническим простатитом и здоровых добровольцев
| Параметр Исследуемая группа | Количество пациентов (%) | TLR2 | TLR4 | TLR9 |
| Здоровые добровольцы | 100 | 6,61±0,38 (40,74х105) | 4,59±0,22 (0,39х105) | 2,25±0,86 (0,002х105) |
| Больные с хроническим бактериальным простатитом | 60 | 5,48±0,36* (3,02х105) | 4,51±0,21 (0,32х105) | 3,93±2,26 (0,08х105) |
| 40 | 6,39±0,15 (24,55х105) | |||
| Отношение показателя в норме к показателю при патологии ** | 60 | 13,49 | 1,20 | 0,02 |
| 40 | 1,66 | |||
| Больные с хроническим абактериальным простатитом | 50 | 5,35±0,31* (2,24х105) | 4,25±0,29 (0,18х105) | 2,67±0,34 (0,005х105) |
| 50 | 6,79±0,18 (61,66х105) | |||
| Отношение показателя в норме к показателю при патологии ** | 50 | 18,20 | 2,19 | 0,38 |
| 50 | 0,66 |
* – показатель достоверно отличается от контрольного значения (p<0,05),
** - в строке представлено отношение показателей в скобках
В таблице представлено относительное количество копий исследуемого гена в десятичных логарифмах, в скобках даны значения количества копий кДНК относительно 106 копий актина.
Анализ цитокинов в семенной плазме показал повышение уровня ИЛ-6 у больных хроническим простатитом. В 43-85% случаев в семенной плазме определялись высокие уровни ИЛ-6 по сравнению со здоровыми добровольцами. В тоже время, уровень продукции противовоспалительного цитокина ИЛ-10 был снижен. Таким образом, повышенная концентрация ИЛ-6 в семенной плазме может быть использована в диагностике воспаления в простате у больных хроническим простатитом.
Полученные результаты показали, что в качестве прогностических критериев течения хронического простатита можно выделить сниженный уровень экспрессии гена TLR2 в клетках слизистой уретры и повышение продукции цитокина ИЛ-6 в семенной плазме. Снижение уровня экспрессии TLRs в клетках слизистой уретры и изменение цитокинового профиля семенной плазмы могут служить показанием к локальному и системному применению иммунотропных препаратов в комплексной терапии хронического простатита, которые позволят восстановить баланс факторов врожденного иммунитета, следствием чего будет улучшение качества лечения данной категории больных [Мазо, 2006].
Изменение уровня экспрессии генов TLR9 и HBD-2 в эпителиальных клетках конъюнктивы и роговицы детей с герпетическим древовидным кератитом
На следующем этапе работы перед нами стояла задача изучить, как изменяются уровни экспрессии генов TLR9 и HBD-2 в эпителиальных клетках конъюнктивы и роговицы детей с диагнозом герпетический древовидный кератит. У детей с герпетическим кератитом стерильно брали мазок с конъюнктивы и роговицы в зоне поражения двукратно - до лечения и через 7 дней после лечения.
Можно отметить, что у детей с древовидным кератитом наблюдалось достоверное увеличение экспрессии гена TLR9 в 17 раз и более (p<0,05) по сравнению с показателем в группе здоровых детей. При действии вирусной инфекции также была выявлена тенденция к увеличению уровня экспрессии гена HBD-2 (Рис. 3).
Включение в комплексное лечение иммунотропного препарата Суперлимф вызывало нормализацию экспрессии гена TLR9 (3,7±0,56 lg). Полученные данные могут свидетельствовать об иммуномодулирующем действии Суперлимфа на уровне экспрессии гена TLR9 при вирусном кератите. Достоверных отличий в экспрессии гена HBD-2 в процессе лечения не установлено.

Рис. 3. Количественные уровни экспрессии генов TLR9 и HBD2 в эпителиальных клетках конъюнктивы и роговицы здоровых детей, детей с герпесвирусным кератитом до и после лечения.
по оси абсцисс – клинические группы,
по оси ординат – lg(количество кДНК TLR9 или HBD-2) относительно -актина,
* - показатель в исследуемой группе достоверно отличается от уровня показателя в контроле (р< 0,05),
** - показатель в исследуемой группе достоверно отличается от уровня показателя в группе с герпетическим древовидным кератитом после традиционного лечения (р< 0,05).
При применении цитокинотерапии Суперлимфом купирование отека роговицы произошло на 4,8±0,4 сутки, тогда как в контрольной группе - на 7,1±0,2 сутки. Полная эпителизация при комбинированной терапии произошла на 7,4±0,4 сутки, тогда как в контрольной группе – на 4 дня позже.
Полученные данные будут в дальнейшем использованы для разработки новых лекарственных средств на основе противомикробных пептидов, которые обладают не только прямым противовирусным и антибактериальным действием, но также участвуют в реакциях врожденного иммунитета и в процессе репарации. Новейшие технологии помогут значительно снизить процент послеоперационных осложнений при лечении патологических состояний глаз различных возрастных группах.
На основании полученных данных и данных литературы можно представить следующие маркеры развития преждевременных родов, реализации внутриутробного инфицирования и развития хронического простатита (Рис. 4).
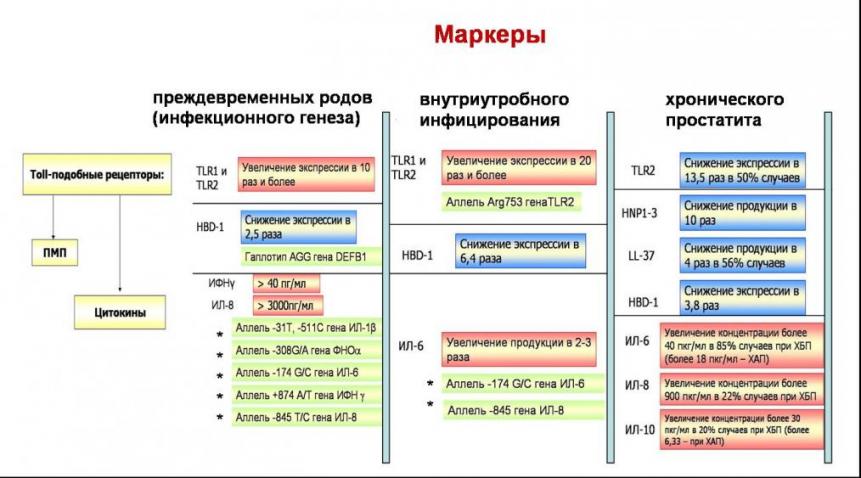
Рис. 4. Маркеры развития преждевременных родов (а), внутриутробного инфицирования (б) и хронического простатита (в) * - данные литературы
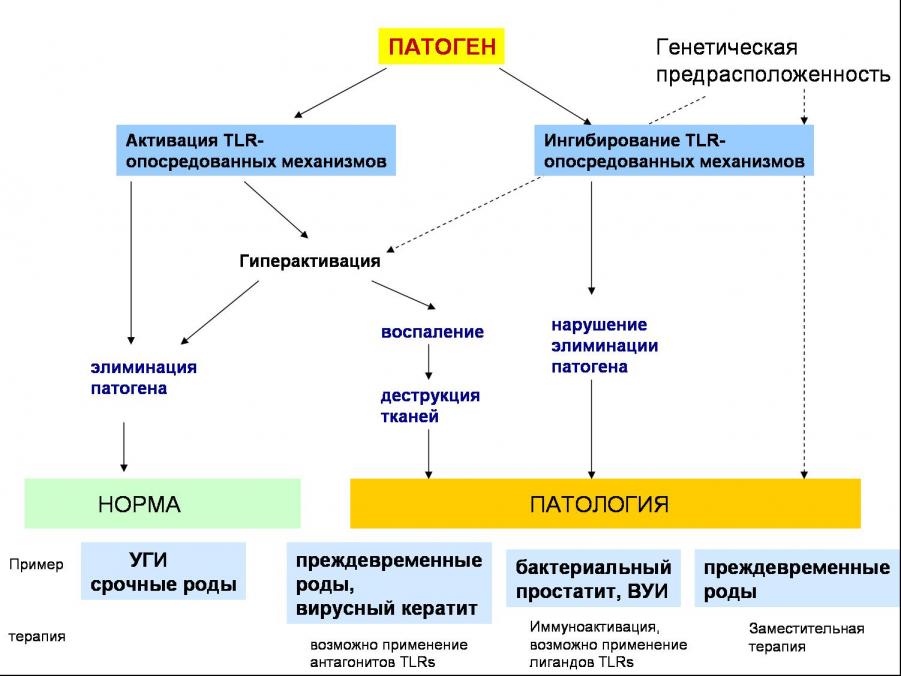
Рис. 5. Роль TLR-опосредованных механизмов в развитии патологических состояний.
Обобщая полученные нами данные по исследованию системы TLR при различных патологических состояниях можно предложить следующую схему участия TLR-опосредованных механизмов в развитии патологии (Рис. 5).
В случае распознавания патогена Toll-подобными рецепторами включаются механизмы врожденного иммунитета, направленные на его элиминацию. Гиперэкспрессия TLRs не безопасна для организма, т.к. приводит к повышенной выработке провоспалительных цитокинов, оксида азота, вызывающих патологическое повреждение тканей. Так гиперэкспрессия TLR2 в клетках слизистой цервикального канала и плаценте приводят к преждевременным родам и внутриутробному инфицированию плода, гиперэкспрессия TLR9 в роговице при вирусном кератите вызывает глубокие повреждения в ткани роговицы, вызывающие снижение зрения. Ингибирование TLR-опосредованных механизмов, обусловленное снижением экспрессии генов этих рецепторов под действием патогенов, или полиморфизмом в генах рецепторов, сигнальных и эффекторных молекул, приводит к развитию хронических воспаления.
Новый взгляд на механизмы врожденного иммунитета и, в первую очередь, на систему распознающих рецепторов, противомикробных пептидов, открывает совершенно иные подходы к диагностике и лечению воспалительных заболеваний вирусной и бактериальной этиологии. Представленный подход дает возможность создать комплекс диагностических и прогностических критериев. Разработка и внедрение в клиническую практику тестов для определения экспрессии генов TLR, цитокинов и противомикробных пептидов в качестве прогностических и диагностических критериев у больных с различными инфекционными патологиями. Индивидуальный подход к лечению инфекционных заболеваний, а также новые инновационные технологии (основанные на применении агонистов TLRs, растворимых рецепторов TLRs, микроРНК) позволят повысить эффективность терапии.
ВЫВОДЫ:
- Разработаны лабораторные варианты систем ПЦР-РВ для количественного определения экспрессии генов Toll-подобных рецепторов (TLR1, TLR2, TLR4, TLR6, TLR9), противомикробных пептидов (HNP-1, HBD-1, HBD-2), цитокина (ФНО) и других молекул (NF-kB, каспазы 3, каспазы 8, ингибиторов каспаз FLIP и XIAP).
- Впервые в качестве модели in vitro для изучения действия на экспрессию факторов врожденного иммунитета (Toll-подобных рецепторов, противомикробных пептидов, цитокинов) при воздействии различных лигандов TLRs использованы культуры клеток Vero и HeLa.
- На модели герпетического кератита установлено, что вирус-индуцированная экспрессия Toll-подобного рецептора 9 связана с межлинейными различиями в строении гена TLR9 у мышей линий C57Bl/6 и BALB/c.
- Установлено, что при беременности происходит активация факторов врожденного иммунитета, которая выражается в повышении уровня экспрессии генов TLR1, TLR2, TLR4 и дефенсина HBD-1 (в эпителиальных клетках цервикального канала), что свидетельствует об активации факторов врожденного иммунитета для обеспечения защиты организма матери и плода от патогенных микроорганизмов на уровне слизистых оболочек.
- Выявлены диагностические критерии неразвивающейся беременности у женщин с гиперандрогенией. Показано, что при неразвивающейся беременности происходит снижение экспрессии гена TLR2 клетками цервикального канала и уменьшение продукции HNP1-3 в плазме периферической крови.
- Впервые выявлены иммунологические маркеры, свидетельствующие о возможности развития преждевременных родов и внутриутробного инфицирования плода. Установлен дисбаланс в системе врожденного иммунитета, который выражается в гиперэкспрессии генов TLR1, TLR2, TLR4 и угнетении экспрессии гена НBD-1 в эпителиальных клетках цервикального канала. Увеличение экспрессии гена TLR2 более, чем в пять раз и снижение HBD-1 (клетками эпителия цервикального канала) можно рассматривать как показатели риска развития преждевременных родов.
- Обоснована концепция TLR2-опосредованной активации апоптоза клеток плаценты, как возможного механизма развития преждевременных родов инфекционного генеза. Выявлена положительная корреляция экспрессии генов TLR2, каспазы 3 и каспазы 8 в плаценте женщин с преждевременными родами.
- Выявлена ассоциация полиморфных маркеров, локализованных в генах TLR2 (Arg753Gln), TLR9 (2848G/A) и DEFB-1 (G(-20)A и G(-52)A), с риском развития внутриутробного инфицирования плода, преждевременных родов и со срочными родами.
- Установлена ассоциация между уровнями экспрессии гена HBD-1 и полиморфными маркерами G(-20)A, C(-44)G, и G(-52)A в нетранслируемой области гена DEFB1. Показано, что аллель A(-20) и генотип GG (-52) ассоциированы с увеличением уровня экспрессии дефенсина, а генотип GА (-52) - ассоциирован с пониженной экспрессией -дефенсина клетками цервикального канала.
- Установлено, что снижение уровня экспрессии гена TLR2 клетках слизистой уретры и увеличение концентрации цитокина ИЛ-6 в семенной плазме могут служить прогностическими критериями течения хронического простатита, вызванного энтерококком или гемолитическим стрептококком.
- Обосновано применение комплекса природных цитокинов и противомикробных пептидов (препарата Суперлимф) в комбинированной терапии герпетического древовидного кератита у детей. Отмечена нормализация экспрессии гена TLR9 в клетках роговицы, повышение эффективности проводимой комплексной терапии и снижение числа осложнений при герпетической патологии.
- Разработан подход к оценке TLR-опосредованных реакций системы врожденного иммунитета слизистых оболочек, основанный на поэтапном исследовании Toll-подобных рецепторов, адапторных и эффекторных молекул (цитокинов и противомикробных пептидов) на уровне полиморфизма гена, уровне экспрессии мРНК, уровне белка и уровне функционирования эффекторных молекул.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ:
1. Ковальчук Л.В. Противовирусное действие препарата суперлимф и его фракции, содержащей противомикробные пептиды. / Ганковская Л.В., Лавров В.Ф., Баркевич О.А.*, Эбралидзе Л.К. // Тезисы докл. XI Нац. Конгресс «Человек и лекарство XI». - Москва - 2004. - С. 445.
2. Ковальчук Л.В. Опыт клинического применения комплекса природных цитокинов и противомикробных пептидов. / Ганковская Л.В., Долгина Е.Н., Аведова Т.А., Вирясов А.В., Баркевич О.А.* // Аллергология и иммунология. - 2004. - т.5. - №1. - С.43.
3. Ковальчук Л.В. Противогерпетический эффект комплекса природных цитокинов и противомикробных пептидов. / Ганковская Л.В., Лавров В.Ф., Баркевич О.А.*, Лотте В.Д. // Медицинская Иммунология. - 2004. – т.6. - №3-5. - С. 234.
4. Ганковская Л.В. Некоторые механизмы противогерпетического действия иммуномодулирующего препарата «Суперлимф». / Ковальчук Л. В., Лавров В.Ф., Лотте В.Д., Баркевич О.А.*, Долгина Е.Н. // Биопрепараты. – 2004. - № 4(16). - С. 18-22.
5. Ковальчук Л.В. Суперлимф – новый иммуномодулятор с прямым и опосредованным противогерпетическим действием. / Ганковская Л.В., Лавров В.Ф., Лотте В.Д., Баркевич О.А.* // Тезисы докл. XII Российском Национальном Конгрессе «Человек и Лекарство». - Москва – 2005. - С. 671.
6. Gankovskaya L.V. Mechanisms of antiviral innate immunity, approaches to immunotherapy. / Lavrov V.F., Barkevich O.A.* // J. of the association of pediatric allergitis and immunologists of Russia. - 2005. - v.6. - sup.1. - P.103.
7. Ганковской Л.В. Механизмы противогерпетического действия комплекса природных цитокинов и противомикробных пептидов. / Ковальчук Л.В., Лавров В.Ф., Лотте В.Д., Баркевич О.А.* // Иммунология Урала. – 2005. - №1(4). - С. 123-124.
8. Ковальчук Л.В. Подавление цитопатического действия вируса герпеса простого 1 типа комплексом природных цитокинов (препаратом Суперлимф) in vitro. / Лавров В.Ф., Ганковская Л.В., Эбралидзе Л.К., Баркевич О.А.* // Журнал микробиологии, эпидемиологии и иммунобиологии – 2005. - № 1. - С.57-60.
9. Ковальчук Л.В. Изучение механизмов противогерпетического действия препарата Суперлимф. / Лавров В.Ф., Ганковская Л.В., Лотте В.Д., Эбралидзе Л.К., Баркевич О.А.* // Актуальные вопросы эпидемиологии инфекционных болезней, сборник научных трудов (выпуск 7). – М. – 2005. - С. 237-24.
10. Ковальчук Л.В. Суперлимф - новый иммуномодулятор с прямым противовирусным действием. Опыт клинического применения в комплексном лечении герпетической инфекции. / Ганковская Л.В., Юдина С.М., Лавров В.Ф., Баркевич О.А.* // Российский иммунологический журнал. – 2005. - v.9. - sup. 2. - P.37-42.
11. Ганковская О.А. Экспрессия Toll-подобных рецепторов у беременных женщин больных генитальным герпесом. / Романовская В.В., Сомова О.Ю. // Тезисы докладов Международной конференции «Генетика в России и в мире». – Москва - 2006. - С.43.
12. Макаров О.В. Экспрессия TLR-4 клетками цервикального канала у беременных женщин при урогенитальной инфекции. / Ковальчук Л.В. Бахарева И.В., Ганковская О.А., Романовская В.В.// Вопросы практической педиатрии. – 2006. - т.1. - №4. - С.37.
13. Ганковская Л.В. Повышение выработки цитокинов (ИЛ-12, ФНО) и экспрессии гена TLR-9 мононуклеарными клетками беременных с урогенитальной инфекцией вирусного генеза. / Ковальчук Л.В., Макаров О.В., Ганковская О.А., Гришук А.Ю. // Сб. тезисов докл. Всеросийской научно-практической конф. «Вакцинология 2006. Совершенств. Иммунобиол. средств профилактики, диагн. и лечения инфекц. болезней». – Москва – 2006. - С.33.
14. Ковальчук Л.В. Сигнальные рецепторы врожденного иммунитета (TOLL-подобные рецепторы) при урогенитальной инфекции у беременных. / Макаров О.В., Бахарева И.В., Романовская В.В., Ганковская Л.В., Ганковская О.А. // Сборник тезисов докладов V конференции иммунологов Урала «Актуальные вопросы фундаментальной и клинической аллергологии и иммунологии». - Оренбург – 2006. - С.47.
15. Ковальчук Л.В. Экспрессия TLR-4 клетками цервикального канала у беременных женщин при урогенитальной инфекции. / Бахарева И.В., Ганковская О.А. // Аллергология и иммунология в педиатрии. – 2006. - №2-3(9). - С. 74.
16. Ганковская Л.В. Экспрессия TLR-9 и выработка цитокинов мононуклеарными клетками больных генитальным герпесом. / Лавров В.Ф., Ганковская О.А. // Медицинская иммунология. – 2006. – т.8. - №2-3. - С. 255-256.
17. Лавров В.Ф. Индукция экспрессии TLR-9 мононуклеарными клетками больных генитальным герпесом. / Ковальчук Л.В., Ганковская О.А. // Российский иммунологический журнал. - 2006. - v.9. - sup.3. - P. 158.
18. Лавров В.Ф. Естественный иммунитет и герпетическая инфекция. / Ковальчук Л.В., Ганковская Л.В., Баркевич О.А.*, Кузин С.Н.// Вопросы вирусологии. – 2006. - №3. – С. 4-9.
19. Ганковская Л.В. Механизмы врожденного иммунитета к вирусу герпеса простого. / Ковальчук Л.В., Лавров В.Ф., Ганковская О.А. // Аллергология и иммунология. – 2006. – 3. - С. 460-465.
20. Лавров В.Ф. Профилактика рецидивов герпетической инфекции с помощью комплекса природных цитокинов и противомикробных пептидов (экспериментальное исследование). / Ганковская Л.В., Ганковская О.А. // Сборник научных трудов (выпуск 8) Актуальные вопросы эпидемиологии инфекционных болезней. – М. – 2006. - С.441-446.
21. Ганковская О.А. Анализ выработки цитокинов у беременных женщин с вирусной инфекцией. / Лавров В.Ф., Ганковская Л.В., Бахарева И.В., Гришук А.Ю., Зверев В.В. // Биотехнология. – 2007. - С. 101.
22. Макаров О.В. Роль врожденного иммунитета при невынашивании беременности инфекционного генеза. / Ганковская Л.В., Бахарева И.В., Романовская В.В., Ганковская О.А. // Тезисы докладов First International Seminar “Infections in Obstetris and Perinatology”. – Москва – 2007. - С.94.
23. Ганковская Л.В. Роль Toll-подобных рецепторов при патологии беременности. / Бахарева И.В., Ковальчук Л.В., Романовская В.В., Ганковская О.А. // Медицинская иммунология. – 2007. – т.9. - №2-3. - С.256-257.
24. Gankovskaya O.A. Herpes viral infection induces the expression of Toll-like receptors, pro-inflammatory сytokines and human b-defensin-1 in cervical epithelial cells. / Lavrov V.F., Koval'chuk L.V., Gankovskaya L.V., Bahareva I.V., Zverev V.V. // Acta Biochimica Polonica. – 2007. - v. 54. - sup 2. - P.45-46.
25. Ганковская Л.В. Экспрессия генов Toll-подобного рецептора-2 и -дефензина -1 человека при урогенитальной инфекции беременных. / Ковальчук Л.В., Бахарева И.В., Ганковская О.А. // РАЖ. – 2007. - №3. - С.261-262.
26. Макаров О.В. Toll-подобные рецепторы в инициации невынашивания беременности. / Ганковская Л.В., Бахарева И.В., Романовская В.В., Ганковская О.А. // Вопросы практической педиатрии. – 2007. – т.2. - №5. - С.26.
27. Макаров О.В. Показатели врожденного иммунитета при невынашивании беременности инфекционного генеза. / Ганковская Л.В., Бахарева И.В., Романовская В.В., Ганковская О.А. // Материалы IХ Всероссийского научного форума "Мать и дитя". – Москва – 2007. - С.150 – 151.
28. Gankovskaya O.A. TLR and antimicrobial peptide genes expression during prenatal infection. / Romanovskaya V.V., Kusnecov P.A., Fenzeleva V.A., Kartashov D.D. // Тезисы докладов на «Conference for young scientists, PhD students and students n molecular biology and genetics». – Киев – 2007. – P. 165.
29. Gankovskaya O.A. Analyze of TLR genes expression and cytokines production during prenatal herpes virus infection. / Koval’chuk L.V., Lavrov V.F. // Тезисы докладов на 8th John Humphrey advanced summer programme in immunology: Immunology and viral infection. – 2007. - P.16.
30. Макаров О.В. Toll-подобные рецепторы как маркеры осложнений беременности. / Бахарева И.В., Ковальчук Л.В., Ганковская Л.В., Романовская В.В., Ганковская О.А. // Аллергология и иммунология. – 2007. - т.8, №3. - С.236.
31. Ганковская Л.В. Вирус герпеса простого и Toll-подобные рецепторыю. / Ганковская О.А., Ковальчук Л.В. // Тезисы докладов на VI конференци иммунологов Урала. – Ижевск – 2007. – С.7-8.
32. Ганковская Л.В. Оценка уровней цитокинов у беременных женщин с вирусной инфекцией. / Ковальчук Л.В., Бахарева И.В., Гришук А.Ю., Gankovskaya O.A., Макаров О.В. // Вопросы гинекологии, акушерства и перинатологии. – 2007. – т.6. - №2. - С. 11-13.
33. Koval’chuk L.V. Herpes simplex virus: treatment with antimicrobial peptides. / Gankovskaya L.V., Gankovskaya O.A. Lavrov V.F. // Adv. Exp. Med. Biol. – 2007. – 601. – P.369-76.
34. Козырева О.В. Опыт применения суперлимфа в лечении герпесвирусной инфекции. / Матушевская Е.В., Баркевич О.А.*, Ковальчук Л.В. // Клиническая дерматология и венерология. - 2007. - №1. - С.16-19.
35. Макаров О.В. Невынашивание беременности, инфекция, врожденный иммунитет. / Ковальчук Л.В., Ганковская Л.В., Бахарева И.В., Ганковская О.А. // М. :«ГЭОТАР-Медиа». - 2007. – 172 С.
36. Gankovskaya O.A. Antiviral effects of complex of native cytokines and cationic antimicrobial peptides. // Allergy. – 2008. – sup.88. - v. 3. - P.200.
37. Gankovskaya O.A. A new role of receptors of innate immunity (TLR) in infection-associated preterm birth. / Koval'chuk L., Gankovskaya L., Makarov O. // Тез. докл.European congress of Reproductive immunology. – 2008.
38. Ганковская О.А. Изучение in vitro роли факторов врожденного иммунитета в защите от инфекции, вызванной Candida albicans. / Блинкова Л.П., Лавров В.Ф. // Тезисы докладов на втором съезде микологов России «Современная микология в России». – 2008. - С.485-486.
39. Ковальчук Л.В. Создание и введение в клиническую практику нового иммунотропного препарата на основе комплекса природных цитокинов и противомикробных пептидов. / Ганковская Л.В., Долгина Е.Н., Василенкова Л.В., Образцова Е.Н., Пчеленок С.В., Вирясов А.В., Аведова Т.А., Ганковская О.А. // Сборник тезисов Научно-практической конференции «Медико-биологические науки для теоретической и клинической медицины». – 2008. - С.55.
40. Ганковская Л.В. Новые механизмы TLR – опосредованной активации врожденного иммунитета в патологии беременности инфекционного генеза. / Ковальчук Л.В., Макаров О.В., Бахарева И.В., Ганковская О.А., Карташов Д.Д., Акимова Е.А., Скрипник В.В. // Сборник тезисов Научно-практической конференции «Медико-биологические науки для теоретической и клинической медицины». – 2008. - С.30.
41. Лавров В.Ф. Изучение экспрессии генов Toll-подобных рецепторов и цитокинов при инфекции, вызванной Candida albicans in vitro. / Блинкова Л.П., Ковальчук Л.В., Ганковская О.А. // Российский иммунологический журнал. – 2008. - т.2(11). - №2-3. - С.148.
42. Ганковская О.А. Анализ уровней экспрессии генов TLR9-сигнального пути при герпесвирусной инфекции во время беременности. / Сомова О.Ю., Ганковская Л.В., Ковальчук Л.В., Лавров В.Ф. // Российский иммунологический журнал. – 2008. - т.2(11). - №2-3. - С.286.
43. Ганковская Л.В. Анализ уровня экспрессии генов каспазы 3 и каспазы 8 в плаценте при преждевременных родах. / Ковальчук Л.В., Ганковская О.А., Акимова Е.А., Романовская В.В. // Российский иммунологический журнал. – 2008. – т.2(11). - №2-3. – С.286.
44. Мазо Е.Б. Изменение показателей врожденного иммунитета у больных хроническим бактериальным простатитом и хроническим абактериальным простатитом/синдром хронической тазовой боли с наличием урогенитальной инфекции. / Ковальчук Л.В., Ганковская Л.В., Вирясов А.В., Ганковская О.А., Суренков Д.Н. // Российский иммунологический журнал. – 2008. - т.2(11). - №2-3. - С.150-151.
45. Ганковская О.А. Изучение экспрессии генов сигнальных рецепторов врожденного иммунитета (TLR) и противомикробных пептидов в клетках слизистой при урогенитальной инфекции. / Ковальчук Л.В., Ганковская Л.В., Бахарева И.В. // Тезисы докладов на IV съезде Российского общества биохимиков и молекулярных биологов. – 2008. - С. 238.
46. Ганковская О.А. Роль Toll-подобных рецепторов и дефенсинов в противомикробной защите урогенитального тракта женщин. / Ковальчук Л.В., Ганковская Л.В., Лавров В.Ф., Романовская В.В., Карташов Д.Д., Фензелева В.А.// Журнал микробиологии, эпидемиологии и иммунобиологии. – 2008. – 1. – С.46-50.
47. Ганковская Л.В. Экспрессия противомикробных пептидов клетками слизистой цервикального канала и нейтрофилами периферической крови у беременных с урогенитальной инфекцией. / Ковальчук Л.В., Макаров О.В., Лавров В.Ф., Ганковская О.А., Карташов Д.Д., Кузнецов П.А. // Вестник РГМУ. – 2008. - №5. - С. 26-29.
48. Макаров О.В. Toll-подобные рецепторы в генезе невынашивания беременности. / Бахарева И.В., Ганковская Л.В., Романовская В.В., Ганковская О.А. // Акушерство и гинекология. - 2008. - №2. - С. 22-28.
49. Мазо Е.Б. Изменение показателей цитокинов и Toll- рецепторов у больных хроническим бактериальным простатитом и хроническим абактериальным простатитом/ синдромом хронической тазовой боли воспалительного характера с наличием внутриклеточной инфекции. / Ковальчук Л.В., Ганковская Л.В., Вирясов А.В., Ганковская О.А., Суренков Д.Н.// Фарматека: медицинский журнал. - 2008. - N 16. - С. 68-71.
50. Патент на изобретение №2334233: «Способ прогнозирования преждевременных родов при урогенитальной инфекции». Патентообладатели: Ганковская Л.В., Макаров О.В., Ковальчук Л.В., Бахарева И.В., Романовская В.В., Ганковская О.А. Официальный Бюллетень Федеральной службы по интеллектуальной собственности, патентам и товарным знакам РФ №17 «Изобретения. Полезные модели» 20.09.2008 г.
51. Ганковская О.А. Ассоциация полиморфизма гена сигнального рецептора врожденного иммунитета TLR9 с преждевременными родами инфекционного генеза. / Ганковская Л.В., Макаров О.В., Лавров В.Ф., Зверев В.В. // Медицинская иммунология. – 2009. – т.11. - №4-5. - С.406.
52. Ганковская Л.В. Анализ противомикробных пептидов человека в биологических жидкостях. / Карташов Д.Д., Ковальчук Л.В., Ганковская О.А. // Тез. докл. X Междун. конгр. «Соврем. пробл. аллергологии, иммунологии и иммунофармакологии. – Казань – 2009. - С.354.
53. Ганковская Л.В. Исследование экспрессии генов TLR9 и BD-2 в клетках роговицы на модели вирусного кератита у мышей. / Черешнева М.В., Ковальчук Л.В., Ганковская О.А. // Тезисы докладов на Научно-практической конференции с международным участием Российский общенац. офтальмологич. Форум. – Москва – 2009.
54. Ганковская О.А. Исследование экспрессии генов TLR9, NF-kB, ФНО в клетках слизистой цервикального канала беременных с герпесвирусной инфекцией. / Бахарева И.В., Ганковская Л.В., Сомова О.Ю., Зверев В.В. // Журнал микробиологии, эпидемиологии и иммунобиологии. – 2009. – 2. – С.61-65.
55. Ганковская О.А. Toll-подобные рецепторы, распознающие лиганды вируса герпеса. / Ганковская Л.В., Сомова О.Ю., Зверев В.В. // Журнал микробиологии, эпидемиологии и иммунобиологии. – 2009. – 2. – С.108-111.
56. Ганковская О.А. Изменение уровня экспрессии сигнальных рецепторов врожденного иммунитета при инфекции, вызванной Candida albicans in vitro и in vivo. / Зверев В.В., Лавров В.Ф., Блинкова Л.П., Ганковская Л.В., Кузнецов П.А. // Журнал микробиологии, эпидемиологии и иммунобиологии. – 2009. – 3. – С.60-64.
57. Еричев В.П. Интерлейкин-17 и его возможное участие в репаративных процессах при глаукоме. / Ганковская Л.В., Ковальчук Л.В., Дугина А.Е., Ганковская О.А. // Глаукома. – 2009. – 1. – C. 23-26.
58. Макаров О.В. Прогностическое значение компонентов врожденного иммунитета у беременных с высоким риском реализации внутриутробной инфекции. / Ганковская Л.В., Ковальчук Л.В., Бахарева И.В., Романовская В.В., Ганковская О.А. // Вестник РГМУ. – 2009. - №4. – C. 27-33.
59. Ганковская Л.В. Экспрессия генов Toll-подобных рецепторов слизистой цервикального канала при нормальной и патологически протекающей беременности. / Ковальчук Л.В., Бахарева И.В., Кузнецов П.А., Романовская В.В., Ганковская О.А., Карташов Д.Д., Макаров О.В. // Вестник РГМУ. – 2009. - №4. – C. 34-37.
60. Лавров В.Ф. Перспективная модель для тестирования функций Toll-подобных рецепторов in vitro. / Ганковская О.А., Кривцов Г.Г., Парфенова Т.М., Попова В.С., Парастаев С.А., Витвицкий В.Н., Зверев В.В. // Ж. физиология и патология иммунной системы. – 2009. - т.13. - №12. - С.3-6.
61. Макаров О.В. Развитие преждевременных родов сопровождается снижением экспрессии гена В дефенсина 1 клетками слизистой цервикального канала. / Бахарева И.В., Кузнецов П.А., Ганковская Л.В., Ганковская О.А. // Сборник Материалов XVII Российского национального конгресса «Человек и лекарство». – Москва – 2010. - С.176.
62. Воробьева Ю.А. Анализ экспрессии генов TLR9 и В-дефенсина-2 (HBD-2) в эпителиальных клетках конъюнктивы глаза больных вирусным кератитом, обоснование применения иммунотропной терапии. / Ганковская О.А., Бадинова Н.С. // Сборник Материалов XVII Российского национального конгресса «Человек и лекарство». – Москва – 2010. - С.395.
63. Ганковская О.А. Исследование ассоциации полиморфных маркеров генов TLR2 и TLR9 с преждевременными родами и внутриутробным инфицированием. // Медицинская иммунология. – 2010. - Т.12. - № 1-2. - С. 87-94.
64. Ганковская Л.В. Роль экспрессии генов Toll-подобного рецептора 2, каспаз и их ингибиторов в ткани плаценты в норме и при преждевременных родах инфекционного генеза. / Ковальчук Л.В., Макаров О.В., Ганковская О.А., Акимова Е.А. // Российский иммунологический журнал. – 2010. - 4(13). - № 1. - С. 48–53.
65. Еричев В.П. Изменение некоторых иммунологических показателей слезной жидкости при избыточном рубцевании у пациентов с первичной открытоугольной глаукомой после антиглаукомных операций. / Ганковская Л.В., Ковальчук Л.В., Дугина А.Е., Ганковская О.А. // Вестник Офтальмологии – 2010. – 2. – С. 19-22.
66. Ганковская О.А. Взаимодействие вирусов и Toll-подобных рецепторов. / Зверев В.В. // Журнал микробиологии, эпидемиологии и иммунобиологии. - 2010. – 2. – С. 101-5.
67. Ковальчук Л.В. Иммунология. Практикум. / Игнатьева Г.А., Ганковская Л.В., Хорева М.В., Сеславина Л.С., Соколова Е.В., Ганковская О.А., Никонова А.С., Левченко В.А. // М. :«ГЭОТАР-Медиа». - 2010. – 174 С.
68. Положительное решение о выдачи патента на изобретение (Заявка №2009108294/15(011092), дата подачи заявки 10.03.2009)
* - Баркевич О.А. = Ганковская О.А.

