Особенности иммунных дисфункций у больных послеоперационными вентральными грыжами
На правах рукописи
Романова Светлана Олеговна
ОСОБЕННОСТИ ИММУННЫХ ДИСФУНКЦИЙ У БОЛЬНЫХ ПОСЛЕОПЕРАЦИОННЫМИ ВЕНТРАЛЬНЫМИ ГРЫЖАМИ
14.00.16 – патологическая физиология
14.00.36 – аллергология и иммунология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Томск 2007
Работа выполнена в Государственном образовательном учреждение высшего профессионального образования «Сибирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Научный руководитель:
доктор медицинских наук Кологривова Елена Николаевна
Научный консультант:
доктор медицинских наук, профессор Дерюгина Мария Степановна
Официальные оппоненты:
доктор медицинских наук Уразова Ольга Ивановна
доктор медицинских наук Селедцова Галина Викторовна
Ведущая организация: ГОУ ВПО Кемеровская государственная медицинская академия Росздрава
Защита состоится «____» ____________ 2007 г. в ____ ч. на заседании диссертационного совета Д 208.096.01 при Сибирском государственном медицинском университете (634050, Томск, Московский тракт, 2).
С диссертацией можно ознакомиться в научно-медицинской библиотеке Сибирского государственного медицинского университета (634050, г. Томск, пр. Ленина, 107).
Автореферат разослан «____» ____________ 2007 г.
Ученый секретарь
диссертационного совета Суханова Г.А.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Проблема лечения больных сложными послеоперационными вентральными грыжами является одной из актуальных и трудных задач современной хирургии [Бородин И.Ф. с соавт., 1986; Cоrnell R.B., Kerlakian G.M., 1994; Дерюгина М.С., 1999; Федоров В.Д. с соавт., 2000; Натрошвили Г.С. с соавт., 2002; Cobajo M.A. et al., 2002; Smith G.V., Senni M.R., 2003; Белоконев В.И. с соавт., 2005]. Удельный вес данной патологии в структуре грыжевой болезни достигает в настоящее время 21-30,7% и не имеет тенденции к снижению [Тоскин К.Д. с соавт., 1982; Галимов О. В., Мусин Р.З., 2001]. Послеоперационные вентральные грыжи составляют 5 – 11% от всех осложнений после лапаротомий [Бородин И.Ф. с соавт., 1986; Альджафари М., 1995; Галимов О.В., Мусин Р.З., 2001; Чистяков А.А. с соавт., 2003]. Актуальность проблемы обусловлена также высокой частотой раневых осложнений после герниопластики [Steinau G. et al., 1988; Шевченко П.В., 1989; Дерюгина М.С., 1999], рецидивов грыжеобразования [Егиев В.Н., 2000; Гузеев А.И., 2001; Натрошвили Г.С., 2002; Carbajo M.A., 2002; Toniato A. et al., 2002].
Основными причинами образования послеоперационных вентральных грыж являются местные раневые осложнения [Рудин Э.П., 1997; Федоров В.Д., 2000]. У 44% больных грыжи формируются после первичного заживления [Дерюгина М.С., 1999]. Формированию и рецидивированию грыж после операций на органах брюшной полости способствуют также факторы, повышающие внутрибрюшное давление, нарушение регенераторных процессов, неадекватная коррекция сопутствующей патологии, несовершенство хирургической техники [Тоскин К.Д., Жебровский В.В., 1990; Gecim I.E., 1996; Павленко В.В., 2004]. Таким образом, причины образования послеоперационных грыж имеют полифакторный характер.
Ведущим фактором, обуславливающим адекватную реабилитацию после оперативного лечения, является полноценное функционирование иммунной системы [Китиашвили И.З. с соавт., 2005]. Комплексное воздействие повреждающих факторов (оперативная травма, общая анестезия, кровопотеря, интенсивная антибиотикотерапия) неблагоприятно влияет на иммунную систему [Караулов А.В., 2002; Бунятян К.А, 2005]. Послеоперационные иммунологические сдвиги могут сохраняться длительное время и способствовать формированию вторичных иммунодефицитов, которые проявляются острыми и хроническими инфекционно-воспалительными процессами [Пинегин Б.В. с соавт., 1998; Смирнов В.С., Фрейдлин И.С., 2000]. Данные о состоянии иммунитета у больных с вентральными грыжами приведены в единичных работах [Дерюгина М.С., 1999; Шурыгин С. Н. с соавт., 2003]. Углубленное изучение состояния иммунной системы у этой категории герниологических больных является несомненно важным с целью уточнения патогенетических механизмов формирования и рецидивирования грыжевой болезни, обоснования назначения иммунотропных препаратов для профилактики и лечения местных и общих послеоперационных осложнений.
Цель исследования - охарактеризовать особенности функционирования иммунной системы у больных послеоперационными вентральными грыжами.
Задачи исследования:
- Охарактеризовать состояние врожденного и адаптивного иммунитета у больных послеоперационными вентральными грыжами.
- Охарактеризовать динамику параметров системного иммунитета после герниопластики у больных послеоперационными вентральными грыжами в раннем послеоперационном периоде и на этапе реабилитации.
- Охарактеризовать динамику иммунологических параметров раневого экссудата у больных послеоперационными вентральными грыжами.
- Оценить уровень продукции провоспалительных (TNF-, IFN-) и противовоспалительных (IL-4) цитокинов у герниологических больных до операции и в раннем послеоперационном периоде.
- Оценить влияние основных факторов грыжеобразования на иммунореактивность больных послеоперационными вентральными грыжами.
- Оценить целесообразность применения иммунокорригирующих препаратов в комплексной терапии больных послеоперационными вентральными грыжами.
Научная новизна. Впервые проведено комплексное исследование клеточных и гуморальных факторов врожденного и адаптивного иммунитета, продукции провоспалительных (TNF-, IFN-) и противовоспалительных цитокинов (IL-4) у больных послеоперационными вентральными грыжами до операции и после герниопластики с применением сетчатого лавсанового эндопротеза. Установлено, что грыжевая болезнь протекает на фоне вторичной иммунной недостаточности, характеризующейся угнетением параметров клеточного иммунитета и неспецифической резистентности. При сложных послеоперационных вентральных грыжах выявлен дисбаланс провоспалительных (TNF-, IFN-) и противовоспалительных (IL-4) цитокинов, проявляющийся в низкой способности иммунокомпетентных клеток к базальной и индуцированной продукции TNF- и IL-4 и усилении базальной продукции IFN-. Впервые оценена активность нейтрофилов крови и раневого экссудата в НСТ-тесте у больных послеоперационными вентральными грыжами и выявлена функциональная неполноценность фагоцитов. Доказано негативное влияние ожирения, сопутствующего грыжевой болезни, на исходное состояние и послеоперационную динамику параметров локального и системного иммунитета.
Впервые исследована динамика иммунологических показателей врожденного иммунитета у больных сложными послеоперационными вентральными грыжами в раннем послеоперационном периоде и на этапах реабилитации. Низкая функциональная активность клеточного звена адаптивного иммунитета и неспецифической защиты сохраняется после устранения грыжевого дефекта в течение 12 месяцев.
Практическая значимость. Полученные в ходе исследования данные о нарушении функционирования иммунной системы у больных послеоперационными вентральными грыжами необходимо учитывать при комплексной подготовке герниологических пациентов к хирургическому лечению с целью своевременного предупреждения раневых осложнений и повышения устойчивости к инфекционным возбудителям в раннем и позднем послеоперационных периодах. Знание направленности нарушений иммунной реактивности больных послеоперационными вентральными грыжами позволит обоснованно применять иммуномодулирующие средства в комплексной терапии при подготовке к герниопластике, что повысит эффективность оперативного лечения и снизит риск развития раневых осложнений и рецидива заболевания. Доказана необходимость адекватной коррекции нарушений иммунитета у пациентов со сложными послеоперационными вентральными грыжами перед герниопластической операцией с применением сетчатых полимерных (лавсановых) имплантатов. Показана клинико-иммунологическая эффективность назначения ликопида в комплексной подготовке больных послеоперационными вентральными грыжами к герниопластике.
Положения, выносимые на защиту:
- При послеоперационных вентральных грыжах имеют место нарушения функционирования иммунной системы.
- Неадекватная регуляция иммунных процессов у больных послеоперационными вентральными грыжами способствует развитию местных и общих послеоперационных осложнений.
- Одним из наиболее важных факторов, влияющих на степень выраженности иммунных дисфункций у больных послеоперационными вентральными грыжами, является сопутствующее ожирение.
- Грыженосителям группы высокого риска возврата заболевания необходимо проведение комплексного иммунологического обследования для выявления степени выраженности нарушений со стороны иммунной системы.
- Необходим индивидуальный подход к назначению иммуномодуляторов герниологическим пациентам в зависимости от степени выраженности нарушений иммунной реактивности.
Апробация. Основные положения работы доложены и обсуждены на заседаниях четвертого (2003) пятого (2004), шестого (2005) международных конгрессов молодых ученых и специалистов «Науки о человеке» (Томск). Результаты представлены в виде тезисов на международных конгрессах и конференциях: Россия, Москва (2004), Тайланд, Бангког (2004).
Публикации. По теме диссертации опубликовано 10 печатных работ, из них 5 - в центральных реферируемых журналах.
Внедрение. Разработанные в диссертации подходы к назначению иммуномодулирующих препаратов используются в комплексной терапии больных послеоперационными вентральными грыжами в клинике общей хирургии СибГМУ. Положения и выводы выполненной работы внедрены в процесс преподавания фундаментальных основ клинической медицины, клинической иммунологии и аллергологии студентам Сибирского государственного медицинского университета.
Структура и объем диссертации. Диссертация изложена на 163 страницах машинописного текста и состоит из введения, 4-х глав, обсуждения, выводов, практических рекомендаций и указателя литературы. Работа иллюстрирована 13 таблицами, 31 рисунком. Список литературы включает 277 источников, в том числе 199 отечественных и 78 иностранных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования. Обследовано 103 пациента с послеоперационными вентральными грыжами (ПВГ), поступивших в плановом порядке для оперативного лечения в герниологический центр клиники общей хирургии Сибирского государственного медицинского университета. Биосинтетическая герниопластика с применением полимерных сетчатых лавсановых эндопротезов по методикам Дерюгиной М.С. выполнена 99 больным сложными послеоперационными вентральными грыжами. 4 грыженосителя не были прооперированы в связи с обострением сопутствующей хронической патологии.
Диагноз ПВГ выставлялся на основании жалоб (на наличие выпячивания в области передней брюшной стенки, уточнялись характер, продолжительность время появления болей), анамнеза (в прошлом оперативные вмешательства на органах брюшной полости, малого таза), клинического осмотра (с учетом размера грыжевого дефекта, характера содержимого грыжевого мешка, возможности его вправления в брюшную полость и анатомо-функционального состояния передней брюшной стенки). Дополнительные методы исследования включали общий анализ крови, мочи, кала на наличие гельминтов, определение глюкозы крови, факторов свертывающей системы, ВИЧ-антител, реакцию Вассермана, флюорографию, электрокардиографию, спирографию, миографию брюшного пресса, рентгенологическое и ультразвуковое исследование органов брюшной полости, передней брюшной стенки. Индекс массы тела (ИМТ) рассчитывали по формуле: масса тела в килограммах, делённая на рост человека в метрах, возведённый в квадрат (кг/м2) (по критериям ВОЗ 1997 года). Все пациенты были осмотрены терапевтом, анестезиологом, женщины - гинекологом.
В качестве контрольной была сформирована группа соматически здоровых доноров добровольцев в количестве 24 человек. По половозрастному составу группа здоровых доноров соответствовала группе пациентов с послеоперационными вентральными грыжами.
Иммунологическое обследование проводилось до операции и через 1, 3, 6, 12 месяцев после герниопластики с помощью расширенного набора иммунологических тестов. В качестве основных биологических материалов для исследования служили венозная кровь, супернатант 3-х суточной культуры мононуклеаров периферической крови, раневой экссудат. Относительное и абсолютное количество Т- (CD3+, CD4+, СD8+) и В- (CD72+) лимфоцитов, NК-клеток (CD16+) исследовали в иммунофлуоресцентном тесте на основе использования моноклональных антител, содержание сывороточных иммуноглобулинов определяли методом радиальной иммунодиффузии в агаре по Манчини, концентрацию циркулирующих иммунных комплексов (ЦИК) исследовали с помощью метода селективной преципитации в ПЭГ-6000 [Стручков П.В., 1985, Афримзон Е.А. с соавт., 1996, Сизякина Л.П., 2005]. Функциональную активность нейтрофилов оценивали на основании показателей НСТ-теста спонтанного и стимулированного пирогеналом. Соотношение результатов индуцированного пирогеналом и спонтанного НСТ-теста обозначали как «коэффициент стимуляции нейтрофилов» [Сизякина Л.П., 2005]. Определение уровня спонтанной и митоген-индуцированной продукции мононуклеарами IL-4, IFN-, TNF- проводили до операции и на 10-11 сутки после герниопластики с помощью иммуноферментного анализа (ИФА) в соответствии с прилагаемыми к тест-системам рекомендациями. В раннем послеоперационном периоде в раневом экссудате (на 1, 3, 5, 7, 9, 11 сутки после герниопластики) и периферической крови (на 1, 3, 5, 7, 9, 11, 15 сутки после герниопластики) оценивали содержание иммуноглобулинов классов А, М, G, активность нейтрофилов в НСТ-тесте.
Статистический анализ полученных данных проводили с использованием пакета программ Statistica for Windos 6,0 фирмы Statsoft и пакета программ Microsoft Exel (2002) корпорации Microsoft. Для всех имеющихся выборок данных проверяли соответствие закону нормального распределения по критерию Колмогорова–Смирнова. В случае нормального распределения признака данные представляли в виде M±m, где М – среднее значение, m – стандартная ошибка среднего. В случае распределения, отклоняющегося от нормального, указаны медиана, верхний и нижний квартели. При нормальном распределении признака для сравнения нескольких групп использовали параметрический однофакторный дисперсионный анализ, при сравнении двух групп использовали t-критерий Стьюдента. Для оценки достоверности значений выборок, не подчиняющихся закону нормального распределения, использовали непараметрические тесты Вилконсона и Манна–Уитни. Сравнение частот признаков осуществлялась с помощью критериев с поправкой Фишера. Непараметрический корреляционный анализ применяли для оценки связи двух различных количественных признаков. С целью уточнения влияния клинических факторов на иммунологические параметры применяли регрессионный анализ. Во всех процедурах статистического анализа уровень значимости р 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Главным моментом в анализе клинического материала явилось изучение факторов, способствующих формированию вентральных грыж после ранее перенесенных абдоминальных операций и возврата заболевания после грыжесечений. Наибольший процент ПВГ встречается после лечения хирургической патологии органов брюшной полости – 59,22% и акушерско-гинекологических заболеваний - 32,03%. Реже причинными операциями являлись урологические – в 5 (4,85%) случаях и торако-абдоминальные – в 4 (3,90%). Экстренная лапаротомия осложнилась грыжеобразованием у 67 (65,05%) больных, плановая – у 36 (34,95%). Ведущими факторами грыжеобразования являлись местные послеоперационные осложнения (нагноение ран, лигатурные абсцессы, свищи, гранулемы), имевшие место у 54 (52,43%) больных, 18 из них перенесли релапаротомию по поводу перитонита, межкишечных абсцессов. У 48 пациентов сформировались послеоперационные келоидные рубцы. 32 (31,06%) человека страдали рецидивными ПВГ, из них у 17 причиной возврата заболевания являлись осложнения в области хирургического вмешательства. Во всех случаях рецидивы заболевания возникли после неоднократных неудачных аутопластических грыжесечений, что позволяет выделить эту категорию больных в группу высокого риска возврата заболевания [Белоусов Д.В., 1999; Дерюгина М.С., 1999].
Из общего числа 82 (79,62%) пациента страдали ПВГ больших, 16 (15,53%) - гигантских размеров. Грыжевые выпячивания небольших размеров во всех случаях были множественными или дополнительными и в общей сложности соответствовали размерам грыжевых ворот гигантских грыж. Множественные грыжи имели место у 16 (15,53%) больных. 47 (45,63%) грыженосителей имели вправимые ПВГ, 51 (49,52%) - невправимые. 6 (5,83%) больных страдали неумещающимися ПВГ. Стаж грыженосительства более 5-ти лет отмечен у 39 человек (37,86%). Вышеизложенная характеристика оправдывает термин "сложные" послеоперационные вентральные грыжи (СПВГ) и позволяет отнести данную категорию грыженосителей к группе высокого полифакторного риска оперативного лечения и возврата заболевания.
Обследованные нами грыженосители страдали полиморбизмом. Число сопутствующих заболеваний достигало от 3 до 9 у одного больного. У 67 (65,04%) пациентов наблюдалась сочетанная торакоабдоминальная патология, у 44 (44,66%) – сердечно – сосудистые заболевания, у 77 (74,75%) – ожирение. Все больные страдали спаечной болезнью.
У 89 (86,4%) грыженосителей отмечено наличие инфекционного синдрома, который оценивали по манифестации заболеваний микробной этиологии. Выявлена высокая восприимчивость больных ПВГ к бактериальной и вирусной инфекции дыхательных путей. Согласно анамнестическим данным заболевания дыхательной системы, в том числе острые респираторные вирусные инфекции у 40 грыженосителей имели затяжное течение и сопровождались выраженным кашлевым синдромом, являющимся фактором повышения внутрибрюшного давление. 26 пациентов были прооперированы в заведомо инфицированных условиях (т. е. на период проведения герниопластики в проекции грыжевого мешка у этих пациентов имели место гранулемы, абсцессы, лигатурные свищи).
Учитывая угнетающее влияние на иммунную систему оперативного вмешательства, которое обследуемые больные перенесли от 1 до 9 раз и проявления инфекционного синдрома, еще на этапе клинического анализа материала мы предположили наличие иммунных дисфункций у больных ПВГ.
При оценке результатов иммунологического обследования выявлены различия параметров системного иммунитета грыженосителей и здоровых доноров. У лиц, страдающих ПВГ, выявлено низкое процентное содержание лимфоцитов, CD3+-, CD4+-, CD8+-, CD72+-, CD16+-клеток и снижение абсолютного количества CD3+-, CD4+- и CD16+- лимфоцитов (Рис. 1). На фоне снижения, в сравнении с группой здоровых доноров, количественных показателей, характеризующих численность основных популяций лимфоцитов, у грыженосителей регистрировались более высокие значения процентного содержания сегментоядерных нейтрофилов, CD4+/CD8+, концентрации IgM, IgG, IgA, ЦИК и функциональной активности нейтрофилов в спонтанном НСТ-тесте (Рис. 2). В то же время отмечены низкие значения коэффициента стимуляции нейтрофилов в НСТ-тесте.
С учетом клинической гетерогенности грыжевой болезни у обследованных пациентов была проведена оценка влияния ряда клнических факторов на иммунную систему герниологических больных с помощью методов системного анализа.


Рис. 1. Относительное и абсолютное содержание CD3+, CD4+, CD8+, CD72+, CD16+-лимфоцитов в периферической крови больных сложными послеоперационными вентральными грыжами (%)
* – р<0,05 в сравнении с показателями группы здоровых доноров.

Рис. 2. Содержание иммуноглобулинов (IgМ, IgG, IgА), циркулирующих иммунных комплексов (ЦИК) и показатели НСТ-теста у больных сложными послеоперационными вентральными грыжами и здоровых доноров
* – р<0,05 в сравнении с показателями группы здоровых доноров.
При проведении корреляционного анализа между иммунологическими показателями и количественными характеристиками клинических параметров определялись связи клеточных и гуморальных факторов иммунной системы с индексом массы тела (ИМТ). Графическое изображение корреляционных взаимоотношений представлено на рисунке 3. При проведении регрессионного анализа также выявлена зависимость ряда иммунологических параметров (IgG, активности нейтрофилов в спонтанном и стимулированном НСТ-тесте) от ИМТ.
Рис. 3. Структура корреляционных связей параметров системного иммунитета и клинических характеристик больных послеоперационными вентральными грыжами
С учетом ИМТ в качестве ведущего фактора, влияющего на параметры системного иммунитета, все больные ПВГ были разделены на четыре группы в зависимости от степени ожирения. Первую группу составили 26 (25,24%) больных послеоперационными вентральными грыжами, которые имели нормальную массу тела (индекс массы тела 18,5 – 24,9 кг/м2), вторую –23 (22,33%) пациента с I-ой степенью ожирения (индекс массы тела 25 – 29,9 кг/м2), третью - 26 (25,24%) больных со II-ой степенью ожирения (индекс массы тела 30 – 39,9 кг/м2), четвертую - 28 (27,18 %) грыженосителей с III-ей степенью ожирения (индекс массы тела >40 кг/м2).
Проведена оценка частоты инфекционного синдрома в зависимости от степени ожирения. Из общего числа проявлений инфекционного синдрома, более часто заболевания микробной этиологии отмечались у больных со II-ой и III-ей степенями ожирения (p<0,05).
При исследовании параметров системного иммунитета в группах грыженосителей с различными степенями ожирения выявлены межгрупповые различия средневыборочных характеристик. У больных ПВГ с нормальной массой тела отмечались низкие уровни CD3+-, CD8+-, CD16+-клеток в сравнении с контрольной группой. У грыженосителей с сопутствующим ожирением также регистрировались низкие значения абсолютного и относительного количества CD3+-, CD16+-лимфоцитов по сравнению с контрольной группой. Минимальный уровень CD16+ -клеток характеризовал группу больных со II-ой и III-ей cтепенями ожирения. У пациентов с III-ей степенью ожирения определено более высокое содержание CD8+-лимфоцитов (цитотоксические-супрессорные клетки) по отношению к показателям остальных групп грыженосителей. Выявлено низкое содержание относительного и абсолютного количества CD72+-лимфоцитов у больных с избыточной массой тела в сравнении с аналогичным параметром здоровых доноров.
У грыженосителей без ожирения содержание IgG в сыворотке крови не отличалось от аналогичного показателя контрольной группы. Уровни сывороточных IgA, IgG, IgM у пациентов с избыточной массой тела превышали содержание иммуноглобулинов у лиц контрольной группы. При этом только у пациентов с I-ой и II-ой степенью ожирения показатели, характеризующие концентрацию сывороточного IgA, выходили за рамки условно допустимых значений (0,7 – 3,0 г/л).
Во всех группах больных ПВГ было отмечено высокое содержание ЦИК в сыворотке крови, что косвенно указывает на недостаточно эффективную их элиминацию клетками макрофагально-моноцитарной системы.
О недостаточности функциональной активности нейтрофилов свидетельствует достоверно низкое в сравнении с контрольной группой соотношение НСТст/НСТсп, наиболее выраженное у пациентов с III-ей степенью ожирения. У них же наблюдались более высокие показатели спонтанного и стимулированного НСТ-теста, что может указывать на наличие персистирующей инфекции в организме.
Таким образом, мы выявили у больных ПВГ наличие вторичной иммунной недостаточности, характеризующейся угнетением клеточных механизмов адаптивного иммунитета и неспецифической резистентности. Сопутствующее ожирение оказывает негативное влияние на степень выраженности иммунологических нарушений у больных ПВГ.
В раннем послеоперационном периоде у герниологических больных отмечено повышение функциональной активности нейтрофилов периферической крови в спонтанном НСТ–тесте, причем максимум значений регистрировался на 3-5 сутки после операции. Минимальные значения в этот период регистрировались у больных со II-ой степенью ожирения. В последующем выявлено существенное снижение исследованного параметра, что можно рассматривать как адекватную реакцию со стороны нейтрофильных клеток в ответ на хирургическое вмешательство [Смирнов В. С., Фрейдлин И. С., 2000]. На 15 сутки послеоперационного периода наиболее глубокое угнетение спонтанного НСТ-теста регистрировалось у тучных пациентов. Коэффициент стимуляции нейтрофилов у больных со II-ой и III-ей степенями ожирения в течение 3-5 суток после герниопластики снижался по отношению к исходным данным и оставался на низком уровне, по сравнению со значениями лиц контрольной группы, так же, как и до операции.
В последующем в течение 11 месяцев, несмотря на динамическое повышение данного показателя у больных ПВГ всех групп, его значение оставалось низким по отношению к показателям здоровых людей. Причем, более низкие значения коэффициента стимуляции нейтрофилов отмечены у пациентов со II-ой и III-ей степенями ожирения.
У всех пациентов в первые сутки (1-3 сутки) после операции наблюдалось снижение уровня сывороточных иммуноглобулинов классов М, G, А по отношению к исходному уровню. Содержание IgG у больных с III-ей cтепенью ожирения было сниженным в течение первых пяти суток после операции. В последующие дни после герниопластики наблюдалось повышение концентрации всех определяемых изотипов иммуноглобулинов. Уровень ЦИК у всех грыженосителей в течение 12-и месяцев после герниопластики оставался высоким по сравнению с показателем здоровых людей.
К концу первого месяца послеоперационного периода у всех пациентов регистрировалось низкое содержание CD3+-лимфоцитов периферической крови по отношению к показателям дооперационного периода. Количество CD3+-лимфоцитов в группах с ожирением через 1 месяц после герниопластики было ниже популяционной нормы (62-76%) и только в группе без ожирения не выходило за пределы допустимых значений. В это же время содержание CD3+-лимфоцитов у больных без ожирения было ниже, чем в контрольной группе. Отсутствие отличий по содержанию CD3+-клеток в группе больных без ожирения и контрольной группе зарегистрировано через 3 месяца после операции, в группе больных с III-ей степенью ожирения - через 6 месяцев, с I-ой через 12 месяцев. Низкое содержание зрелых Т-лимфоцитов (CD3+-клетки) у больных с сопутствующим ожирением можно объяснить негативным влиянием апопротеинов (липопротеидов низкой и очень низкой плотности) на пролиферативную способность Т-лимфоцитов, опосредованным через лимфоцитарные рецепторы к белковой части липопротеидов низкой плотности [Кравец Е. Б., 1989; Карпов, Р. С., 1990], или снижением чувствительности лимфоцитарных рецепторов к инсулину на фоне дислипидемии у тучных больных [Prentice A.M., 2001]. Продукты липидного обмена стимулируют интенсивность гликолиза в лимфоцитах, что также способствует энергетическому голоданию [Савченко, А. А., 1996; Маршалл, В. Дж., 2002]. Снижение количества циркулирующих Т-лимфоцитов является характерным признаком хронического воспаления [Пальцин, А. А., 1995; Насонов, Е. П., 2000; Колесников, А. П., 2001] и может служить одним из факторов, способствующих персистенции инфекции в области послеоперационного рубца, формированию местных осложнений и тем самым приводящим к рецидиву грыжи. В группах больных с ожирением через 1 месяц после операции содержание CD4+-лимфоцитов было низким по сравнению с контрольными данными. При постепенном увеличении CD4+-клеток периферической крови тучных больных эти отличия нивелировались в группе пациентов с I-ой степенью ожирения через 3 месяца после операции, с III-ей степенью ожирения – через 6 месяцев, со II-ой cтепенью ожирения – через 12 месяцев.
В течение первых 6 месяцев после грыжесечения у всех пациентов наблюдалась тенденция к повышению процентного содержания CD8+-клеток периферической крови по отношению к исходным значениям. У больных с нормальной массой тела и с I-ой cтепенью ожирения, низкий уровень CD8+-клеток, по сравнению с показателями здоровых людей наблюдался на протяжении всего периода наблюдений. К концу 1-го месяца после операции процентное содержание CD8+-лимфоцитов у больных со II-ой и III-ей степенями ожирения было достоверно выше, чем у больных с нормальной массой тела и с I-ой степенью ожирения, а с 3-го месяца не отличалось от показателей контрольной группы.
Дисбаланс регуляторных субпопуляций лимфоцитов при хроническом воспалении отмечается многими исследователями [Долгов Г. В., 1998, Колесников А. П., 2001, Инвияева Е. В., 2002]. Дефицит хелперной популяции лимфоцитов приводит к недостаточной активации эффекторных клеток воспаления, отсутствию адекватной стимуляции фибробластов и, как следствие, неэффективной регенерации ткани в области операционной раны, возникновению очагов персистирующей инфекции, местных послеоперационных осложнений, что способствует рецидиву грыжи [Дерюгина М.С., 1999, Кетлинский, С. А., 2002].
У пациентов с разной степенью ожирения содержание CD72+-лимфоцитов до операции было снижено в сравнении с показателем группы здоровых. После хирургического лечения количество В-лимфоцитов у больных всех выделенных групп повышалось и через 6 месяцев не отличалось от показателей группы здоровых лиц.
Количество циркулирующих в крови CD16+-лимфоцитов (натуральных киллерных клеток, NK) в группах обследованных пациентов на протяжении всего периода наблюдений было ниже показателей здоровых людей и существенно не изменялось после проведения оперативного вмешательства. NK-клетки относятся к факторам неспецифической резистентности и являются наряду с макрофагами и нейтрофилами первой линией защиты от внутриклеточных патогенов [Хаитов, Р. В., 2000; Фрейдлин, И. С., 2001]. NK-клетки осуществляют санацию очага воспаления от некротизированных клеток и стимулируют репаративные процессы в ране за счет эффекта "предоставления места" для роста грануляционной ткани [Долгушин, И. И., 1989]. Выраженное снижение количества NK-клеток способствует замедлению процессов регенерации, активации сапрофитной микрофлоры и возникновению очага хронической инфекции [Пауков, В. С., 1998; Сепиашвили, Р. И., 2003].
Оперативное вмешательство оказывает супрессирующее влияние на функционирование иммунной системы. Сопутствующее ожирение, согласно полученным результатам, негативно влияет на процесс восстановления иммунной системы после хирургического лечения послеоперационной вентральной грыжи, а, следовательно, и на возможность ее рецидива. Угнетение параметров клеточного звена иммунитета и неспецифической защиты сохраняется и после устранения грыжи. При этом наиболее выраженные изменения отмечены у пациентов со II-ой и III-ей степенями ожирения.
Оценка динамики изменения состава раневого экссудата показала, что концентрация IgА в первые 11 суток после герниопластики у пациентов с ожирением была повышена по сравнению с больными без ожирения. Более высокий уровень IgА у прооперированных больных с избыточной массой тела может быть связан с функциональной недостаточностью фагоцитирующих клеток и, вероятно, отражает усиленную антигенную стимуляцию на уровне клеток слизистых оболочек вследствие активации условно-патогенной флоры. Сохраняющаяся тенденция к повышению содержания IgА свидетельствует о большей продолжительности воспалительного процесса у пациентов с ожирением. После герниопластики на местном уровне отмечена также тенденция к повышению иммуноглобулинов классов М и G, что может быть обусловлено повышенной проницаемостью сосудистого русла на фоне интенсивных воспалительных реакций в области операционной раны. Сравнительно низкое содержания IgG в раневом экссудате на первые сутки после операции выявлено у больных с III-ей степенью ожирения, при этом второй пик низкой концентрации этого изотипа иммуноглобулинов приходился на 5-е сутки послеоперационного периода. В более поздние сроки наблюдения уровень IgG в экссудате резко повышался. У остальных больных с 3-5-ых суток также наблюдалась тенденция к повышению IgG. IgМ и IgG обладают высокой способностью к активации системы комплемента, что способствует развитию и поддержанию локального воспаления. Отмеченная тенденция к дальнейшему повышению IgМ может быть расценена как неблагоприятная, так как отражает недостаточность иммунного ответа и склонность к более длительному течению воспалительного процесса, а, значит, и к увеличению сроков заживления послеоперационной раны.
Динамика функциональной активности нейтрофилов раневого экссудата больных с нормальной массой тела и с I-ой степенью ожирения расценивалась как закономерная реакция со стороны фагоцитов в ответ на хирургическое вмешательство и проявлялась в повышении функциональной активности в первые пять суток после герниопластики. У пациентов со II-ой и III-ей степенями ожирения прослеживалось угнетение активности нейтрофилов в НСТ-тесте, не имеющее тенденции к повышению. Определение функционального резерва в форме коэффициента стимуляции выявило функциональную неполноценность нейтрофилов раневого экссудата грыженосителей с избыточной массой тела. Наиболее низкие значения этого параметра определялись у больных со II-ой и III-ей степенями ожирения.
Несмотря на то, что данные, полученные при исследовании параметров гуморального звена системного иммунитета, отражают адекватный ответ организма на хирургическое вмешательство, анализ тех же показателей в зоне оперативного вмешательства указывает на функциональную неполноценность иммунной защиты на местном уровне. Угнетение функциональной активности нейтрофилов у тучных пациентов наблюдалось как на уровне системного, так и на уровне местного иммунитета. Анализируя полученные результаты, можно говорить о неполноценности воспалительной реакции в ответ на хирургическую травму, снижении противоинфекционной устойчивости, наличии благоприятных условий для активации условно-патогенной флоры.
Уровень продукции цитокинов IFN, TNF и IL-4 исследован у 28 больных ПВГ. Контрольную группу составили 12 соматически здоровых доноров. Частота выявления TNF- в пробах сыворотки и в супернатантах культур мононуклеаров крови не различалась в группах больных и здоровых доноров. Количественная оценка показала низкое содержание сывороточного TNF- у больных сложными послеоперационными вентральными грыжами до операции, угнетение в сравнении с показателями здоровых лиц базальной и митоген-индуцированной продукции TNF- в супернатанте культур мононуклеаров крови (Рис. 4). На 10–11-е сутки после операции наблюдалось еще более выраженное угнетение его индуцированной продукции (Р<0,00005) (Рис. 5).


Рис. 4. TNF- (пкг/мл), INF- (пкг/мл) у больных сложными послеоперационными грыжами до операции и здоровых доноров в различных биологических жидкостях
Примечания: * – достоверность отличий от показателей группы здоровых доноров, р<0,05.

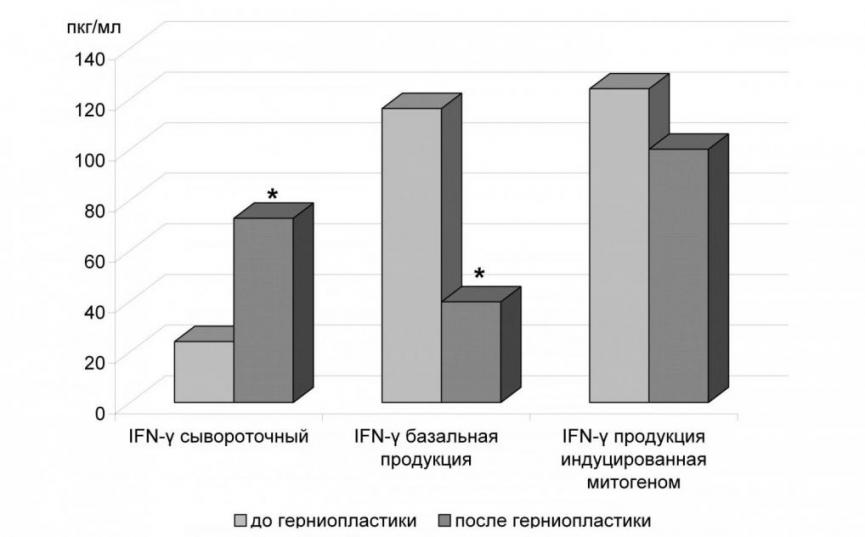
Рис. 5. TNF- (пкг/мл), INF- (пкг/мл) у больных сложными послеоперационными грыжами до операции и на 10 – 11 сутки после операции в различных биологических жидкостях
Примечания: * - достоверность отличий от показателей до герниопластики, р<0,05.
Согласно данным литературы, при восстановлении поврежденных тканей в благоприятных случаях должно происходить снижение продукции TNF- [Сепиашвили, Р. И., 2003]. В то же время у обследованных нами пациентов выявлен изначально низкий уровень этого цитокина, что может вести к нарушению запуска полноценных воспалительных механизмов на ранних этапах репарации. Отмечено наличие отрицательной корреляционной связи ИМТ с базальной продукцией TNF- до операции (R = -0,495, p = 0,0062).
У больных с послеоперационными вентральными грыжами до операции не выявлены различия по содержанию сывороточного IFN- и его индуцированной продукции по сравнению с контрольной группой (Рис. 4). У всех грыженосителей базальная продукция IFN- в супернатантах клеточных культур была более высокой по сравнению со здоровыми донорами, что свидетельствует о функциональном напряжении Т-хелперов 1 типа (Тh1). На 10–11-е сутки после операции у больных наблюдалось увеличение содержания сывороточного IFN- и снижение уровня базальной продукции IFN- по сравнению с показателями до операции (Рис. 5). Установлена отрицательная корреляционная взаимосвязь между индексом массы тела и уровнем содержания этого цитокина в сыворотке до (R = - 0,375; p = 0,045) и после операции (R = - 0,524; р = 0,0035), его базальной продукцией до герниопластики (R = - 0,664, p = 0,000086), митоген-индуциованной до (R = -0,826, p = 0,000001) и после (R = - 0,593, p = 0, 00069) хирургического лечения.
IL-4 в сыворотке крови определялся у всех лиц контрольной группы (100%) и у 3 (10,71%) грыженосителей с нормальной массой тела до операции (р=0,00001, 2 = 47,077, df = 2). При этом в положительных пробах у больных ПВГ уровень цитокина был выше, чем у здоровых людей. В остальных случаях до герниопластики, а также во всех пробах после операции IL-4 в сыворотке крови больных ПВГ не определялся. Базальная и индуцированная ФГА продукция IL-4 у лиц контрольной группы регистрировалась во всех случаях и составила соответственно 15,5 пкг/мл и 49,3 пкг/мл. Продукция IL-4 в супернатанте культур мононуклеаров, индуцированных ФГА регистрировалась у 6 больных СПВГ и была ниже, чем у лиц контрольной группы (р<0,05).
У грыженосителей, страдающих ожирением, до операции, а также у всех обследованных в пробах после операции IL-4 не выявлялся методом ИФА. Этот факт обращает на себя внимание и требует дальнейшего изучения. IL-4 отражает функциональное состояние Т-хелперов 2 типа (Th2), которые контролируют гуморальный ответ, ответственный за защиту от бактериальной инфекции. Учитывая, что действие большинства цитокинов дублируется посредством наличия общих рецепторов или систем внутриклеточных регуляторных посредников у разных типов рецепторов, то «выпадение» действия отдельных цитокинов, как правило, не приводит к фатальным последствиям [Симбирцев А. С. 2004; Ярцев М. Н., 2005]. Выявлены отрицательные корреляционные связи между ИМТ, базальной (R = -0,664, p = 0,000086) и индуцированной (R = -0, 826, р = 0,00000) продукцией IL-4 до операции. Отсутствие или низкий уровень IL-4 в сыворотке крови на 10-11-е сутки после операции является показателем недостаточности иммунного ответа в условиях хирургического вмешательства, а также маркером нарушения репаративных процессов [Минаев С. В., 2004; Santora T. A, 1993]. Подобные проявления свидетельствуют о затяжном течении (хронизации) воспалительного процесса [Фёдоров Д. Н., 2002; Китиашвили И. З., 2005]. Особую актуальность приобретает данный показатель у больных со спаечным процессом. Недостаточная продукция противовоспалительных цитокинов в раннем послеоперационном периоде является фактором, способствующим развитию адгезивного процесса в области хирургического вмешательства. При этом интенсивность спайкообразования увеличивается с каждой последующей операцией [Женчевский Р. А., 1989; Федоров В. Д., 2004].
Динамическое исследование состояния цитокинопродукции позволило определить у пациентов со СПВГ не только концентрацию медиаторов воспаления крови, но и характер течения воспалительно-регенеративных процессов в целом. Низкая продукция TNF- клетками периферической крови больных СПВГ до операции обуславливает развитие неадекватной активации иммунной системы в ответ на хирургическое вмешательство, что ведет, в частности, к нарушениям процессов репарации и регенерации поврежденных тканей и, вероятно, способствует снижению противоинфекционной защиты в послеоперационном периоде.

Рис. 6. Возможная роль иммунной системы в образовании послеоперационных вентральных грыж
Учитывая полученные в ходе исследования данные, мы считаем, что нарушения со стороны иммунной системы являются одним из важных патогенетических факторов формирования и рецидивирования СПВГ. Возможная роль дисфункций иммунной системы в сложном патогенезе грыжевой болезни представлена на схеме (Рис. 6).
Особенности функционирования иммунной системы у пациентов со СПВГ свидетельствуют о том, что наиболее целесообразным в данной клинической ситуации является применение иммуномодуляторов с преимущественным влиянием на фагоцитарную систему. Назначая ликопид в дозе 2-3 мг в сутки 10 пациентам на этапе дооперационной подготовки, мы выявили, что в группе больных с иммунокоррекцией не было отмечено местных и системных осложнений в раннем послеоперационном периоде. В группе больных с иммунокоррекцией отмечено укорочение сроков раневой экссудации (р<0,05) по сравнению с лицами группы сравнения (13 человек, не получавших ликопид).
По данным ультразвукового исследования передней брюшной стенки у больных, получавших ликопид, начало созревания грануляционной ткани на каркасе сетчатого лавсанового эндопротеза отмечено через 2 недели после проведения операции, у пациентов группы сравнения – на 1-2 недели позднее (р<0,05).
При сравнительной оценке параметров системного иммунитета отмечено положительное влияние ликопида на показатели неспецифической резистентности в раннем и позднем послеоперационных периодах, относительное и абсолютное содержание лимфоцитов, CD16+-клеток. В группе пациентов с иммунотерапией после операции в течение года не было отмечено случаев заболевания вирусными инфекциями, бактериальные инфекции регистрировались только у 1-го человека. Нормализация иммунологического фона, повышение устойчивости по отношению к инфекционным возбудителям в послеоперационном периоде и на этапе реабилитации свидетельствуют о целесообразности и перспективности коррекции иммунной реактивности больных ПВГ. Данная проблема в герниологическом аспекте нуждается в дальнейшей, более детальной разработке и требует соответствующей преемственности между хирургами и иммунологами.
ВЫВОДЫ
- Нарушения функционирования иммунной системы у больных сложными послеоперационными вентральными грыжами характеризуются снижением количественных параметров клеточного иммунитета (CD3+-, CD16+-лимфоциты), угнетением функциональной активности фагоцитарного звена и умеренной активацией гуморального звена.
- Динамика параметров системного иммунитета в раннем послеоперационном периоде у пациентов со сложными послеоперационными вентральными грыжами характеризуется временным снижением (в течение 1-3 суток) с последующим повышением концентрации иммуноглобулинов и снижением функционального резерва нейтрофилов. В течение 12 месяцев после устранения грыжевого дефекта регистрируется низкое содержание в крови CD16+-клеток и угнетение функциональной активности нейтрофилов.
- Максимальная активность нейтрофилов раневого экссудата регистрируется в НСТ-тесте на 1-5 сутки после герниопластики. В течение всего периода исследования раневого экссудата (1-11 сутки) отмечаются низкие показатели функционального резерва локального пула нейтрофилов.
- При сложных послеоперационных вентральных грыжах имеет место дисбаланс провоспалительных (TNF-, IFN-) и противовоспалительных (IL-4) цитокинов, проявляющийся в низкой способности иммунокомпетентных клеток к базальной и индуцированной продукции TNF- и IL-4 и усилении базальной продукции IFN-.
- Сопутствующее ожирение оказывает негативное влияние на степень выраженности иммунологических нарушений у больных послеоперационными вентральными грыжами.
- Применение ликопида в комплексном лечении больных сложными послеоперационными вентральными грыжами повышает качество герниопластической операции, способствует нормализации функциональной активности нейтрофилов и содержания CD16+-лимфоцитов, что клинически проявляется в повышении сопротивляемости к инфекционным возбудителям.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- При подготовке больных со сложными послеоперационными вентральными грыжами к хирургическому лечению показано проведение комплексного исследования параметров иммунного статуса в предоперационном периоде, а также через 1 месяц после герниопластики.
- При выявлении клинико-лабораторных признаков иммунной недостаточности комплексная подготовка пациентов со сложными послеоперационными вентральными грыжами к герниопластике должна включать в себя средства, обладающие иммуномодулирующей активностью. Герниологическим больным целесообразно назначение препаратов с преимущественным воздействием на фагоцитарное звено иммунной системы (ликопид).
- При выявлении клинико-лабораторных признаков иммунной недостаточности пациентам рекомендуется динамическое наблюдение врача-иммунолога в течение первого года после герниопластики.
СПИСОК ОПУБЛИКОВАННЫХ РАБОТ
- Романова, С.О. Оценка системного иммунитета больных грыжевой болезнью, страдающих ожирением 3-4 степени / С.О. Романова, О.Н. Афанасьева, Р.А. Брыксин // Науки о человеке: сборник статей по материалам четвертого конгресса молодых ученых и специалистов. – Томск, 2003. – С. 54–55.
- Прогнозирование инфекционного риска у больных со сложными вентральными грыжами и диастазами прямых мышц живота / М.С. Дерюгина, В.В. Климов, С.О. Романова и др. // Тезисы докладов межрегиональной научной конференции, посвещенной 100-летию со дня рождения академика АМН СССР С.П. Карпова. – Томск, 2003. – С. 128–130.
- Клинико-иммунологическая оценка эффективности локальной иммунокоррекции при герниопластике гигантских вентральных грыж / М.С. Дерюгина, С.О.Романова, Р.А. Брыксин и др. // Аллергология и иммунология. – 2003. – Т. 4, № 2. – С. 141.
- Дерюгина, М.С. Состояние системного иммунитета больных со сложными вентральными грыжами передней брюшной стенки / М.С. Дерюгина, Т. П. Оспельникова, С.О. Романова // International journal on immunorehadilitation. – 2003. – Т. 5, № 2. – С. 270.
- Анализ факторов, влияющих на состояние иммунной системы больных сложными вентральными послеоперационными грыжами / М.С. Дерюгина, С.О. Романова, Т. П. Оспельникова и др. // International journal on immunorehadilitation. – 2004. – Т. 6, № 1. – С. 130-131.
- Иммунная реактивность больных с послеоперационными грыжами передней брюшной стенки / М.С. Дерюгина, Е.Н. Кологривова, С.О. Романова и др. // Аллергология и иммунология. – 2004. – Т. 5, № 1. – С. 183.
- Романова, С.О. Состояние системного иммунитета у больных послеоперационными вентральными грыжами до и после герниопластики / С.О. Романова, Р.А. Брыксин, А.Г. Ходос // Науки о человеке: сборник статей по материалам пятого конгресса молодых ученых и специалистов. – Томск, 2004. – С. 93–94.
- Состояние нейтрофилов как факторов тканевой резистентности у больных с послеоперационными вентральными грыжами / М.С. Дерюгина, Е.Н. Кологривова, С.О. Романова и др. // Аллергология и иммунология. – 2005. Т. 6, № 2. – С. 271.
- Особенности иммунного статуса и клинические проявления иммунной недостаточности у больных с послеоперационными вентральными грыжами / Е.Н. Кологривова, М.С. Дерюгина, С.О. Романова, В.С. Муравьева // Медицинская иммунология. – 2005. – Т. 7, № 5–6. – С. 563–568.
- Анализ эффективности иммунокорригирующей терапии в раннем послеоперационном периоде у больных со сложными послеоперационными вентральными грыжами / М.С. Дерюгина, Е.Н. Кологривова, С.О. Романова и др. // Аллергология и иммунология. - 2006.- Т. 7, № 3. – С. 375.
Список сокращений
ИМТ - индекс массы тела
ИФА – иммуноферментный анализ
НСТ – нитросиний тетразолий
НСТ-тест сп – спонтанный НСТ – тест
НСТ – тест ст – стимулированный НСТ – тест
ПВГ – послеоперационные вентральные грыжи
СПВГ – сложные послеоперационные вентральные грыжи
ФГА - фитогемагглютинин
ЦИК – циркулирующие иммунные комплексы
CD – моноклональные антитела соответствующего дифференцировочного кластера
Ig – иммуноглобулины
IFN – интерферон
IL - интерлейкин
NK – натуральные киллеры
Th – Т-хелперы
TNF –фактор некроза опухолей

