Патогенетическое обоснование и основные принципы противотромботической и противогеморрагической терапии беременных с отслойкой хориона
на правах рукописи
Кунешко Нарт Фарук
Патогенетическое обоснование и основные принципы противотромботической и противогеморрагической терапии беременных с отслойкой хориона
14.01.01 – «Акушерство и гинекология»
автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2010
Работа выполнена в ГОУ ВПО
Московская медицинская академия им. И.М. Сеченов Росздрава
Научный руководитель:
Доктор медицинских наук Бицадзе Виктория Омаровна
Официальные оппоненты:
Доктор медицинских наук, профессор Сичинава Лали Григорьевна
Доктор медицинских наук, профессор Торчинов Амирхан Михайлович
Ведущее учреждение:
Московский областной научно-исследовательский институт акушерства и гинекологии
Защита диссертации состоится «___» ___________ 2010 г. в ____ часов на
заседании диссертационного совета Д.208.040.03 при Московской медицинской
академии им. И.М.Сеченова по адресу: 119991 г. Москва, ул. Трубецкая, дом 8, строение 2.
С диссертацией можно ознакомиться в библиотеке Московской Медицинской Академии им. И.М.Сеченова по адресу: 117998 г. Москва, Нахимовский
проспект, дом 49.
Автореферат разослан «____» _________________ 2010 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Шулутко Александр Михайлович
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы: Отслойка хориона и как следствие потеря плода на ранних сроках беременности является частым осложнением периода гестации, составляя 20-25% от числа всех беременностей (Фадеева Н.И., 2004г.; Стрижаков А.Н., 2007г.; Кирющенков П.А., 2010г.). Причины и механизмы развития отслойки хориона разнообразны и зависят от многих факторов.
Согласно исследованиям последних лет, в развитии привычного невынашивания беременности велика роль тромбофилии. По мнению Макацария А.Д. и соавт., 2007г., генетические формы тромбофилии и антифосфолипидный синдром являются одной из ведущих причин невынашивания беременности. Их диагностируют у 70-77% пациенток с потерями плода в анамнезе.
Успешное развитие беременности во многом зависит от адекватной имплантации, трансформации спиральных артерий (в результате инвазии трофобласта) и плацентации с установлением полноценного кровотока в системе мать-плацента-плод и формирования сигналов в организме матери, запускающих адаптационные механизмы беременности. Обеспечивает эти процессы гармоничная работа иммунной, эндокринной систем и системы гемостаза (Серов В.Н.,2008г.; Бицадзе В.О., 2009г.; Кирющенков П.А., 2010г.; Hill J.A., 2000; Maso G., D’Ottavio G., 2005).
Роль тромбофилии в развитии акушерских осложнений и репродуктивных потерь активно изучается с 90-х годов прошлого столетия, когда были открыты ряд генетических форм тромбофилии и антифосфолипидный синдром.
Тромбофилии через тромботические и нетромботические эффекты приводят к нарушению процессов имплантации, инвазии трофобласта и дальнейшего функционирования плаценты (Сидельникова В.М., 2004г.; Стрижаков А.Н., 2007г.; Макацария А.Д. и соавт., 2007г., 2009г.), которые представляются многоступенчатым процессом эпителиально-гемостазиологических взаимодействий со сложной аутокринной-паракринной регуляцией.
Так, антифосфолипидные антитела (АФА) способны изменять адгезивные характеристики предимплантационного эмбриона через прямое взаимодействие с клетками эмбриона, повреждать трофобласт активированным комплементом и формировать аномальный трофобласт в результате непосредственного связывания с АФА, нарушать слияние синцития, подавлять продукцию хорионического гонадотропина, снижать глубину инвазии трофобласта в результате связывания АФА с эндотелием материнских сосудов, нарушать взаимодействие трофобласт-эндотелий за счет изменения экспрессии молекул адгезии трофобласта (снижение 1 и повышение 5 – интегринов), нарушать целостность аннексинового щита и, как следствие, снижать естественные противотромботические эффекты на границе материнской крови и трофобласта путем предоставления фосфолипидных матриц для реакций свертывания крови, активировать макрофаги, клетки естественных киллеров, усиливать продукцию провоспалительных цитокинов, снижать активность фибринолиза путем повышения уровня PAI-1 и TAFI.
Это определяет подходы к терапии и профилактике осложнений беременности, предусматривающие применение препаратов, нормализующих функции свертывающей системы крови: антиагрегантов и антикоагулянтов.
Тем не менее, несмотря на выяснение некоторых механизмов патогенеза такого осложнения беременности и родов как отслойка ворсин хориона, вопросы разработки эффективных и оптимальных методов терапии и профилактики возникающих тромбогеморрагических осложнений продолжают оставаться открытыми, что свидетельствует об актуальности проведенного исследования.
Цель исследования: совершенствование принципов профилактики геморрагических и тромботических осложнений при отслойке ворсин хориона.
Задачи исследования:
1. Изучить частоту и структуру генетических форм тромбофилии у беременных с отслойкой ворсин хориона.
2. Изучить частоту циркуляции антифосфолипидных антител у беременных с отслойкой ворсин хориона.
3. Изучить возможность и эффективность противогеморрагической терапии препаратами транексамовой кислоты при возникновении отслойки ворсин хориона, определить условия и показания к их назначению.
4. Изучить возможность и эффективность противотромботической профилактики препаратами низкомолекулярных гепаринов, определить условия и показания к их назначению у пациенток с отслойкой ворсин хориона.
Научная новизна работы:
Впервые в нашей стране исследована роль тромбофилии в развитии такого осложнения беременности как отслойка хориона.
Изучены частота и структура генетической тромбофилии, частота и спектр антифосфолипидных антител у пациенток с отслойкой ворсин хориона.
Изучена возможность и эффективность противогеморрагической терапии препаратами транексамовой кислоты при возникновении отслойки ворсин хориона, определены условия и показания к их применению.
Изучены возможность и эффективность противотромботической профилактики препаратами низкомолекулярных гепаринов, определены условия и показания к их назначению у пациенток с отслойкой ворсин хориона.
Практическая значимость:
Выполнение работы дало возможность оценить частоту циркуляции антифосфолипидных антител и генетических форм тромбофилии как фактора риска отслойки ворсин хориона, что позволило обогатить знания в отношении патогенетических механизмов развития данного осложнения беременности.
Выявление частоты и структуры тромбофилии как независимого фактора риска отслойки ворсин хориона позволило совершенствовать принципы патогенетической терапии и профилактики указанного осложнения.
Клинически оценен эффект применения препаратов транексамовой кислоты в качестве противогеморрагического препарата и препаратов низкомолекулярного гепарина с целью противотромботической терапии и профилактики в процессе ведения беременных с отслойкой ворсин хориона и тромбофилией.
Основные положения диссертации, выносимые на защиту:
1. Тромбофилия, обусловленная генетическими мутациями и полиморфизмами и циркуляцией антифосфолипидных антител, является независимым фактором риска развития отслойки хориона.
2. Применение препаратов транексамовой кислоты в сочетании с низкомолекулярным гепарином при отслойке хориона позволяют сохранить беременность и избежать неблагоприятного ее исхода у пациенток с тромбофилией.
3. Применение противотромботических препаратов с фертильного цикла и ранних сроков беременности позволяет предупредить повторную отслойку хориона у пациенток с тромбофилией.
Личный вклад соискателя.
Личный вклад автора в работу заключается в определении цели и задач исследования, анализе и обобщения результатов, а также в непосредственном участии в их получении. Автором лично проводились все ультразвуковые исследования и диагностика отслойки хориона, осмотр и консультация пациенток, отбор в исследуемые группы, назначение терапии, направление на исследования и наблюдение вплоть до родоразрешения (как через естественные родовые пути, так и путем операции кесарево сечение), в котором автор также принимал личное участие. В процессе работы над диссертационной работой, автором освоены методики проведения гемостазиологического исследования, методы выявления циркуляции антифосфолипидных антител и генетических форм тромбофилии. Самостоятельно проведено более 1000 исследований по диагностике патологии в системе гемостаза. В целом по диссертации и по результатам научных публикаций, отражающих ее содержание, личный вклад может быть оценен как превышающий 80%.
Апробация диссертационного материала.
Диссертация обсуждена и апробирована на расширенной конференции кафедры акушерства и гинекологии медико-профилактического факультета Московской медицинской академии им. И.М. Сеченова г. Москвы 13 января 2010 г. (Протокол № 9). Диссертация рекомендована к защите.
Внедрение результатов в практику:
Полученные результаты исследования и основные рекомендации используются в практической работе Одинцовского родильного дома, Медицинского Женского Центра г. Москвы и внедрены в учебный процесс кафедры акушерства и гинекологии медико-профилактического факультета Московской медицинской академии им. И.М. Сеченова.
Публикации:
По представленной работе опубликовано 5 научных работ, в том числе 1 в журнале, рекомендованном ВАК РФ.
Объем и структура диссертации:
Диссертационная работа изложена в традиционной форме, состоит из введения, обзора литературы, глав собственных исследований, выводов, практических рекомендаций и списка литературы. Работа представлена на 121 страницах машинописного текста, иллюстрирована рисунками и таблицами. Библиографический указатель включает 183 источника литературы, из которых 70 – отечественных и 113 – иностранных авторов.
Содержание диссертации
Материалы и методы исследования
Для решения поставленных задач было обследовано 157 пациенток с отслойкой хориона, из которых у 127 отслойка хориона диагностирована в настоящую беременность (I группа), у 30 отслойка хориона была в анамнезе (II группа). Контрольную группу составили 50 пациенток с неосложненным течением беременности и неотягощенным акушерским и тромботическим анамнезом. Возраст пациенток составил от 21 до 35 лет.
Во всех случаях проводился проспективный анализ полученных данных. Обследование включало клинические, лабораторные и инструментальные методы. При клиническом обследовании оценивалось состояние менструальной и репродуктивной функции пациенток, собирался гинекологический и соматический анамнез. Особое внимание уделялось особенностям течения и исходам предыдущих беременностей у повторнородящих, а также наличию в анамнезе тромботических и/или тромбоэмболических осложнений. Изучался семейный тромботический и акушерский анамнез.
Исследовался инфекционный профиль пациенток. Проводилось бактериологическое и бактериоскопическое исследование содержимого из заднего свода влагалища и цервикального канала шейки матки, определение возбудителей Ureaplasma Urealiticum, Mycoplasma hominis, Chlamydia trachomatis, Candida albicans в пробе из цервикального канала методом ПЦР, и выявление антител к возбудителям Rubella, Cytomegalovirus, Papillomavirus, энтеровирус, вирус гепатита С.
Обследование на причины невынашивания беременности включало определение гормонального статуса, генетические исследования, HLA-типирование, УЗИ, гистеросальпингографию, которые проводились по показаниям в зависимости от клинической ситуации.
Исследование системы гемостаза проводилось при первичном обследовании, через 10 дней после назначения противотромботической терапии, далее ежемесячно, перед родами и в послеродовом/ послеоперационном периодах.
Гемостазиологическое исследование включало общеоценочные тесты: определение концентрации фибриногена по методу Clauss; активированного частичного тромбопластинового времени (АЧТВ); тромбоэластографию крови (ТЭГ) на приборе тромбоэластографе; определение маркеров тромбофилии: комплексов тромбин-антитромбин (ТАТ) и фрагментов протромбина F1+2 с помощью набора Enzynost-TAT и F1+2 (Boehringwerke, Germany) иммуноферментным способом на спектрофотометре Boehnringer ELISA-Photometer, Д-димера при помощи иммуноферментного анализа.
Оценка тромбоцитарного звена гемостаза осуществлялась с помощью изучения агрегационной активности тромбоцитов на приборе агрегометре Solar (Белоруссия) по методу Воrn с графической регистрацией интенсивности и динамики агрегации тромбоцитов с помощью индукторов агрегации (раствора аденозиндифосфата (АДФ), адреналина 1x10-4М, ристомицина 1,5 г/л). Контроль количества тромбоцитов в периферической крови производили на автоматическом счетчике «Trombocounter» (France).
Выявление антифосфолипидных антител основывалось на рекомендациях Международного Общества по тромбозу и гемостазу, опубликованных в материалах XVI Всемирного конгресса по тромбозу и гемостазу (Флоренция, Италия; июль 1997 г.) и XV Международного конгресса по тромбозу (Анталия, Турция; октябрь 1998 г.). Определение волчаночного антикоагулянта (ВА) включало 3 этапа: скрининг-тесты, коррекционную и подтверждающую пробы. Скрининговые методы осуществлялись с помощью фосфолипид-зависимых тестов: АЧТВ с низким содержанием фосфолипидов (РТТ - LA; STAGO, France), протромбиновое время с разведенным тромбопластином (TTI, STAGO, France). При их удлинении с целью исключения дефицита факторов проводилась коррекционная проба (исследуемая плазма смешивалась с нормальной плазмой в соотношении 1:1; 1:4 и 4:1 соответственно). Если фосфолипид-зависимые тесты оставались удлиненными, проводились тесты, подтверждающие направленность циркулирующих ингибиторов против фосфолипидов. Для этого использовались лизаты тромбоцитов (PNP, STAGO, France) и гексагональный фосфолипид (Staclot, Stago, France). Укорочение АЧТВ до нормы свидетельствовало об антифосфолипидной природе циркулирующих ингибиторов.
Концентрации АФА (IgA, IgG, IgM) определялись иммуноферментным методом (Orgenteg АРА, AT к 2Gpla, Pt, аннексину V). Средние титры – 15-40 GPlU/ml; высокие - > 40.
Выявление генетической тромбофилии включало ПЦР-диагностику мутаций FV Leiden, протромбина G20210A, MTHFR C677T, полиморфизмов, ассоциированных с гипофибринолизом (PAI-1«675 4G/4G», «675 4G/5G», фибриногена, АПФ «D/D», «I/D»), полиморфизмов тромбоцитарных рецепторов GpIa«807С/Т» и GpIIIa «1565Т/С», а также полиморфизмов генов цитокинов, кодирующих ранние этапы воспаления и иммунного ответа: «5032 C/G» в гене CD 46, «-31 T/C» в гене интерлейкина 1 (IL-1), «-174 G/C» в гене интерлейкина 6 (IL-6) и « 308 G/A в гене фактора некроза опухоли (TNF-).
Результаты исследования и обсуждение
Результаты исследования показали, что особенностью репродуктивной функции обследованных 119 (75,8%) повторнобеременных пациенток явилась высокая частота неблагоприятных исходов и осложнений беременности в анамнезе. У 95 из них диагностирован синдром потери плода, у 30 – ПОНРП, что составило 79,8% и 25,2% соответственно среди повторнобеременных пациенток (рис. 1).
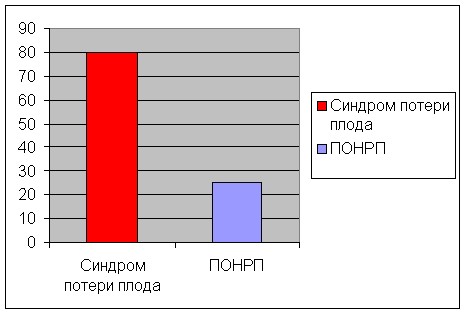
Рис. 1. Частота СПП и ПОНРП в анамнезе у повторнобеременных пациенток.
Структура СПП была представлена самопроизвольными прерываниями беременности (40,3%) на разных сроках гестации, включая преэмбрионическую и раннюю эмбрионическую стадии. У 57,9% в анамнезе была неразвивающаяся беременность, у 10,1% – неонатальная смерть как осложнение преждевременных родов, тяжелого гестоза или плацентарной недостаточности.
Тромботические осложнения в анамнезе имели место у 13 (8,3%) пациенток (11 – в I группе и 2 – во II группе), причем у 10 (8,4%) из них тромботические осложнения были ассоциированы с беременностью.
Семейный тромботический анамнез был отягощен у 63 пациенток (40,1%). У 31 пациентки (19,7%) родственницы по материнской линии имели осложнения беременности.
Обследование на тромбофилию показало наличие генетических форм тромбофилии у 134 (85,4%) пациенток с отслойкой хориона, циркуляцию антифосфолипидных антител у 102 (65%). У 86 (54,8%) пациенток выявлено сочетание циркуляции антифосфолипидных антител и генетических форм тромбофилии (рис. 2).

Рис. 2. Частота цикркуляции АФА и генетической тромбофилии у пациенток с отслойкой хориона
Структура генетической тромбофилии у обследованных пациенток представлена в таблице 1. Высокая частота генетических форм тромбофилии у пациенток с отслойкой хориона по сравнению с контрольной группой, вероятно, связана с исследованием широкого спектра наследственных форм.
Мутация FV Leiden была обнаружена у 21 (13,4%) пациенток с отслойкой хориона, при этом у 7 (4,5%) из них – гомозиготная и у 14 (8,9%) – гетерозиготная формы.
У 4 (2,5%) пациенток с отслойкой хориона выявлена мутация протромбина G20210A, во всех случаях гетерозиготная форма.
Таблица 1
Структура генетической тромбофилии у пациенток с отслойкой хориона
| Форма генетической тромбофилии | Пациентки с отслойкой хориона, n=157 | Контрольная группа, n=50 |
| Тромбофилии (всего) | 134(85,4%) | 13 (26,0%) |
| FV Leiden гомозиготная гетерозиготная | 7 (4,5%) 14 (8,9%) | - 1 (2,0%) |
| Мутация протромбина G20210A гомозиготная гетерозиготная | - 4 (2,5%) | - - |
| Мутация MTHFR C677T гомозиготная гетерозиготная | 33 (21,0%) 42 (26,8%) | 1 (2,0%) 3 (6,0%) |
| Полиморфизм PAI-1 гомозиготный «675 4G/4G» гетерозиготный «675 4G/5G» | 22 (14,0%) 43 (27,4%) | 1 (2,0%) 3 (6,0%) |
| Полиморфизм фибриногена гомозиготный гетерозиготный | 5 (3,2%) 12 (7,6%) | - 1 (2,0%) |
| Полиморфизм «807С/Т» тромбоцитарного рецептора GpIa гомозиготный гетерозиготный | 2 (1,3%) 10 (6,4%) | 1 (2,0%) 2 (4,0%) |
| Полиморфизм «1565Т/С» тромбоцитарного рецептора GpIIIa гомозиготный гетерозиготный | 2 (1,3%) 12 (7,6%) | - 1 (2,0%) |
| Полиморфизм АПФ гомозиготный («D/D») гетерозиготный («I/D») | 5 (3,2%) 15 (9,6%) | 1 (2,0%) 2 (4,0%) |
| Полиморфизм «1166А/С» рецептора к ангиотензину II гомозиготный гетерозиготный | 4 (2,5%) 8 (5,1%) | 1 (2,0%) 1 (2,0%) |
| Полиморфизм «5032 C/G в гене CD 46 | 94 (59,9%) | |
| Полиморфизм «-31 T/C» в гене интерлейкина 1 (IL-1) и «-174 G/C» в гене интерлейкина 6 (IL-6) | 115 (73,2%) | |
| Полиморфизм «308 G/A в гене фактора некроза опухоли (TNF-) | 27 (17,2%) |
Мутацию MTHFR C677T имели 75 (47,8%) пациенток с отслойкой хориона. Гомозиготная форма выявлена у 33 (21,0%) пациенток, гетерозиготная – у 42 (26,8%).
Полиморфизм гена PAI-1 был обнаружен у 65 (41,4%) обследованных. Гомозиготная форма имела место у 22 (14,0%), гетерозиготная – у 43 (27,4%). У 17 (10,8%) пациенток выявлен полиморфизм гена фибриногена; у 5 (3,2%) – гомозиготный, у 12 (7,6%) – гетерозиготный.
Полиморфизмы тромбоцитарных гликопротеинов GP Ia «807 С/Т» и GP IIIа «1565 Т/С» обнаружены у 12 (7,7%) и 14 (8,9%) пациенток соответственно. Гетерозиготные формы составили 10 (6,4%) и 12 (7,6%), гомозиготные – 2 (1,3%) и 2 (1,3%) по группам соответственно.
Полиморфизмы гена АПФ были обнаружены у 20 (12,8%) пациенток, при этом гомозиготная форма полиморфизма «D/D» была у 5 (3,2%) пациенток, гетерозиготна форма («I/D») – у 15 (9,6%).
У 12 (7,6%) женщин с отслойкой хориона выявлены полиморфизмы рецептора к ангиотензину II «1166 А/С». У 4 (2,5%) имелась гомозиготная форма, у 8 (5,1%) – гетерозиготная форма полиморфизма.
Частота полиморфизмов генов цитокинов у пациенток с отслойкой хориона оказалась необычайно высокой. Полиморфизм «5032 C/G» в гене CD 46 имел место у 94 (59,9%) беременных. Полиморфизмы «-31 T/C» в гене интерлейкина 1 (IL-1) и «-174 G/C» в гене интерлейкина 6 (IL-6) были обнаружены у 115 (73,2%) пациенток. У 27 (17,2%) был обнаружен полиморфизм «308 G/A» в гене фактора некроза опухоли (TNF-) (рис. 3).
Проведение анализа на полиморфизм генов цитокинов позволило обнаружить наличие у пациенток так называемых провоспалительных вариантов генов, кодирующих ранние этапы воспаления и иммунного ответа. Носители подобных генов обладают повышенной склонностью к активации иммунной системы при хирургических вмешательствах, инфекциях, механическом воздействии на ткань (забор яйцеклетки, подсадка зародыша при ЭКО). Кроме того, провоспалительные цитокины (ФНО, интерлейкины-1, -6) действуют на эндотелиальные клетки и приводят к высвобождению I типа ингибитора активатора плазминогена (РА1-1), который в свою очередь ингибирует тканевой активатор плазминогена и подавляет фибринолиз, что приводит к отложению фибрина в микроциркуляции большинства органов и ведет к их недостаточности. Наличие провоспалительных вариантов генов предрасполагает к невынашиванию беременности.

Рис. 3. Частота полиморфизмов генов цитокинов у пациенток с отслойкой хориона
В контрольной группе обследованных с физиологическим течением беременности отмечалась достоверно более низкая частота генетических форм тромбофилии (26,0%).
Все обследованные пациентки с отслойкой хориона составили 2 группы:
Частота и структура тромбофилии у пациенток с отслойкой хориона в I и II группах достоверно не различалась.
Всем пациенткам I группы проводилась терапия, направленная на пролонгирование беременности.
В зависимости от клинической ситуации и результатов лабораторно-инструментального исследования назначались противогеморрагические (транексамовая кислота) и противотромботические (НМГ, аспирин) препараты.
У 102 (80,3%) пациенток I группы отслойка хориона сопровождалась кровянистыми выделениями. У остальных пациенток признаком отслойки хориона являлась визуализация ретрохориальной гематомы при ультразвуковом исследовании – наличие области отслойки оболочек от стенки матки с формированием экстрахориально расположенной полости в виде полумесяца. Размеры ретрохориальных гематом были от 3 мм до 40 мм.
При лабораторном исследовании обнаруживалась хронометрическая гиперкоагуляция, незначительное снижение функции тромбоцитов, активация системы гемостаза по данным маркеров тромбофилии – повышение Д-димера, РКМФ (от «+» до «+++»).
Наличие кровянистых выделений и визуализация участков отслойки хориона по данным ультразвукового исследования (ретрохориально расположенной гематомы) являлось показанием для применения противогеморрагических препаратов.
С гемостатической целью нами использовался препарат транексамовой кислоты (Транексам). Этот препарат не имеет эмбриотоксического и тератогенного эффектов, оказывает быстрое и эффективное действие, не вызывает кумулятивного эффекта и выраженных изменений в системе гемостаза.
Последний фактор является особенно важным, так как активация внутрисосудистого свертывания, с одной стороны может вести к микротромбозу, что нарушает плацентацию, особенно в условиях физиологической гиперкоагуляции при беременности, а с другой стороны, небезопасна для организма матери в связи с опасностью развития тромбоза.
Транексам назначался по 1-2 табл. (250 мг) 4 раза в сутки до прекращения кровянистых выделений. Остановка кровотечения наступала в среднем на 2-е сутки от начала терапии, длительность кровотечения составила в среднем 2,1+0,27 дня. Эти данные коррелировали с ультразвуковой картиной, свидетельствующей о регрессе гематом в полости матки. Объем гематом значительно уменьшался. Стадия организации гематомы занимала от 3 до 7 дней.
Учитывая высокую частоту циркуляции антифосфолипидных антител и генетически детерминированную тромбофилическую наклонность, отражением которых была активация свертывания крови по данным гемостазиологического исследования, всем пациенткам с отслойкой хориона назначались противотромботические препараты.
Основу противотромботической терапии составило применение низкомолекулярного гепарина (Фраксипарин в дозе 0.3-0.6 мл 1 раз в сутки подкожно). В зависимости от функции тромбоцитов назначался ТромбоАСС (от 25 до 100 мг).
Применение низкомолекулярного гепарина (НМГ) начиналось на фоне терапии Транексамом, что представляется важным с учетом имеющейся генетической и приобретенной тромбофилии и высокого риска микротромбирования сосудов плацентарного ложа, а также развития тромбоза у матери в связи с активацией внутрисосудистого свертывания при применении антифибринолитического препарата (Транексама).
Дополнительно назначалась витаминотерапия, включающая фолиевую кислоту (1 мг в сутки), витамин Е 400МЕ, полиненасыщенные жирные кислоты (омега-3). Пациентки с мутацией MTHFR С677Т и гипергомоцистеинемией получали дополнительно витамины группы В в таблетированной форме и фолиевую кислоту (до 4 мг в сутки).
Проводимая терапия способствовала значительному улучшению показателей гемостазиограммы. К 10 дню Д-димер снизился до 0.5 ед. (N<0.5), РКМФ стал слабоположительным.
Противотромботическая терапия проводилась в течение всего периода гестации. Пациентки оставались под наблюдением вплоть до родоразрешения. Доза применяемых препаратов корректировалась в зависимости от уровня маркеров тромбофилии (TAT, Д-Димер), агрегационной активности тромбоцитов и результатов глобального теста, оценивающего функцию протеина С.
Во II и III триместрах в ряде случаев доза НМГ была увеличена в связи с ростом гемостатического потенциала, обусловленным пролонгированием беременности.
Пациентки с выявленной прогестероновой недостаточностью получали терапию препаратами прогестеронового ряда.
Причиной прогестероновой недостаточности у обследованных пациенток с тромбофилией могла быть циркуляция антифосфолипидных антител, которые способны изменять адгезивные характеристики эмбриона, нарушать слияние синцития, снижать глубину инвазии трофобласта, разрушать защитный слой аннексина V на поверхности плаценты и подавлять продукцию хорионического гонадотропина, который стимулирует синтез прогестерона, ответственного за поддержание беременности. Возникающий вторичный дефицит прогестерона является дополнительным фактором в патогенезе невынашивания беременности при АФС.
Из препаратов прогестеронового ряда применялся Утрожестан - микронизированный прогестерон для перорального и вагинального применения (мягкие капсулы, содержащие 100 мг прогестерона в арахисовом масле).
Утрожестан применялся в дозе 400-600 мг в сутки до 12–20-й недели беременности в зависимости от показателей гормонов и клинической картины. При отсутствии кровотечения предпочтение отдавалось интравагинальной форме препарата, из-за следующих ее преимуществ: быстрая абсорбция, первичное прохождение через матку и эндометрий, снижение концентрации в общем кровотоке, отсутствие системного действия.
В 8 случаях, несмотря на проводимое лечение, беременность сохранить не удалось. Следует отметить, что у этих пациенток объем гематомы превышал 2/3 объема плодного яйца, что, вероятно, обусловило его гибель. Таким образом, эффективность терапии отслойки хориона составила 93,7%.
В случаях неэффективного лечения, когда, несмотря на проводимую терапию, беременность сохранить не удалось, пациентки получали рекомендации по планированию беременности. В дальнейшем 5 из этих пациенток вошли во II группу исследования, пациенткам которой проводилась подготовка к беременности, начиная с фертильного периода и ведение беременности вплоть до родоразрешения.
Беременность 119 пациенток с отслойкой ворсин хориона была доведена до родоразрешения. Во всех случаях родоразрешение произведено после 38 недели беременности. Частота родоразрешения путем операции кесарево сечение составила 29,4% (35 случаев).
Противотромботические препараты во избежание геморрагических осложнений за сутки до родов или кесарева сечения отменялись. Через 8 часов после родоразрешения терапия была продолжена в течение 10 дней послеродового или послеоперационного периода с дальнейшей оценкой состояния гемостаза.
Из 30 пациенток II группы 16 наблюдались нами с этапа планирования беременности (среди них 5 пациенток, ранее вошедших в I группу), остальные 14 – с ранних сроков беременности (менее 9 недель). У 11 пациенток на момент обследования были признаки угрозы прерывания беременности (боли внизу живота, повышение тонуса матки). Ультразвуковые признаки отслойки хориона не выявлялись.
Все были нами консультированы, обследованы и находились под наблюдением в течение всего периода гестации вплоть до родоразрешения и послеродового периода.
В комплексе подготовки к беременности пациенткам назначались витаминотерапия, включающая фолиевую кислоту (минимум 1 мг в сутки), витамин Е 400МЕ, полиненасыщенные жирные кислоты (омега-3), при наличии циркуляции АФА или полиморфизма тромбоцитарных рецепторов – мини-дозы аспирина (75 мг в сутки). Пациентки с мутацией MTHFR С677Т и гипергомоцистеинемией получали более высокие дозы фолиевой кислоты (4 мг в сутки), а также дополнительно витамины группы В в таблетированной форме (витаминный комплекс «Мультитабс» группа В).
В процессе подготовки к беременности проводилась терапия выявленных при обследовании хламидийной, уреаплазменной и микоплазменной инфекций.
У всех 16 пациенток беременность наступила спонтанно. С наступлением беременности к проводимой ранее терапии добавлялся низкомолекулярный гепарин (НМГ) в профилактической дозе. Пациенткам с высокими уровнями маркеров тромбофилии НМГ был назначен уже в фертильном цикле.
Пациентки, наблюдаемые с ранних сроков беременности (14 женщин), с учетом обнаруженных нарушений стали получать НМГ, аспирин, антиоксиданты и витаминотерапию с I триместра.
Учитывая наличие у пациенток с отслойкой хориона генетической и приобретенной тромбофилии, терапия противотромботическими препаратами (аспирином и низкомолекулярным гепарином) являлась базисной. Проводилась она с учетом степени риска развития тромботических осложнений и выявленных нарушений.
Аспирин назначался в зависимости от агрегационной активности тромбоцитов, циркуляции АФА или полиморфизма тромбоцитарных рецепторов в мини-дозах (75 мг в сутки).
Из низкомолекулярных гепаринов в большинстве случаев использовался фраксипарин, реже – клексан и фрагмин в разных дозах в зависимости от показателей гемостазиограммы.
Доза НМГ корректировалась в зависимости от уровней маркеров тромбофилии, агрегационной активности тромбоцитов и веса женщины. Препарат вводился 1 - 2 раза в сутки подкожно в непрерывном режиме в течение всей беременности. За сутки до родов или кесарева сечения препараты отменялись во избежание геморрагических осложнений. Через 8 часов после родов или операции терапия была продолжена в течение 10 дней послеродового или послеоперационного периода с дальнейшей оценкой состояния гемостаза.
У пациенток с повышенными маркерами активации внутрисосудистого свертывания препараты назначались сразу в лечебных дозах с дальнейшей коррекцией дозы под контролем гемостазиограммы.
Перед назначением НМГ обязательно производилось УЗИ с целью уточнения маточной локализации плодного яйца и исключения участков отслойки хориона.
У всех 30 обследованных имела место маточная беременность. Участки отслойки хориона не выявлялись.
Для оценки исходного уровня тромбофилии и выбора исходно адекватной дозы антикоагулянта и антиагреганта, проводилось гемостазиологическое исследование.
Исследование системы гемостаза до назначения противотромботических препаратов ни в одном случае не показало повышенной геморрагической наклонности. Уровень молекулярных маркеров тромбофилии при первичном обследовании женщин с отслойкой хориона в анамнезе до наступления беременности и в I триместре беременности был повышен: Д-димер – у 10 (33,3%) пациенток, ТАТ – у 16 (53,3%), PAI-1 – у 13 (43,3%).
Агрегационная активность тромбоцитов при первичном обследовании в целом была повышена у 11 пациенток (36,7%) (табл. 2).
Таблица 2
Структура тромбофилических нарушений у пациенток II группы
(до терапии фраксипарином).
| Показатели | Количество больных (n=30) |
| ТАТ | 16 (53,3%) |
| Д-димер | 10 (33,3%) |
| Гомоцистеин | 6 (20%) |
| ВА (+) | 8 (26,7%) |
| Анти 2-GpI антитела | 4 (13,3%) |
| Анти-протромбиновые антитела | 2 (6,7%) |
| АКА | 10 (33,3%) |
| PAI-1 | 13 (43,3%) |
| Агрегационная активность | 11 (36,7%) |
У пациенток с тромбозами в анамнезе (2 женщины) уровни маркеров тромбофилии (ТАТ, Д-димер, агрегационная активность тромбоцитов) были более высокие, чем по группе в целом. Этим пациенткам НМГ был назначен в более высоких (лечебных) дозах (фраксипарин по 250 ICU/кг).
После назначения фраксипарина и аспирина уже по истечении 10 дней была отмечена положительная динамика – снижение маркеров тромбофилии.
Пациентки с метаболическими расстройствами (ожирением, СПКЯ), кроме ранее описанной терапии, в I триместре беременности получали Магне В6, поскольку установлено, что пациенты с метаболическими расстройствами имеют выраженный дефицит магния. Пациентки с выявленной прогестероновой недостаточностью – утрожестан до 14-16 недель беременности.
Пациентки с рецидивирующей герпесвирусной инфекцией и циркуляцией АФА, получали внутривенно иммуноглобулин (ВВИ Г) человеческий 25,0 мл №3 через день, как до беременности, так и во время беременности каждый триместр.
У 1 пациентки с хламидийной и уреаплазменной инфекцией, выявленной в I триместре беременности, после 20 недель беременности была проведена терапия ровамицином (6 млн/сутки в течение 7 дней).
Контроль уровня маркеров тромбофилии ТАТ, Д-димера, уровня гомоцистеина в плазме, агрегационной активности тромбоцитов, значения МНО, глобального теста оценки функции протеина С («Парус»-тест) и уровня PAI-1, проводился ежемесячно. Это было необходимо с точки зрения определения эффективности и безопасности назначенной дозы.
К III триместру на фоне антикоагулянтной терапии уровень исследуемых маркеров тромбофилии ТАТ, Д-димера был сравним с таковым в контрольной группе пациенток с физиологическим течением беременности и составил, соответственно, до терапии 3,9±1,1 и после терапии 1,1±0,9 мкг/мл, р<0,05.
В процессе ведения беременных контроль эффективности проводимой терапии регулярно осуществлялся также и клинико-функциональными методами. К ним мы относили отсутствие признаков развития ФПН, СЗВРП, гестоза и ПОНРП.
У всех женщин в 32, 34, 36 и 38 недель помимо УЗИ, осуществлялся контроль маточно-плацентарного и плодово-плацентарного кровотока с использованием цветного допплера.
Течение беременности у 5 пациенток осложнилось гестозом легкой степени, у 3 пациенток – СЗВРП. Не было ни одного случая тромбоза или ТЭЛА, равно как и ПОНРП. Пациентки с СЗВРП дополнительно получали актовегин внутривенно капельно. В процессе ведения беременности у 4 женщин отмечалось снижение кровотока в маточных артериях IБ степени. У одной пациентки при неизмененном маточно-плацентарном кровотоке отмечалось преждевременное созревание плаценты и симметричная гипотрофия в сроке 38 недель. Инфекционный профиль у данной популяции не выявил наличия какой-либо вирусной или бактериальной инфекции.
У всех пациенток произошли срочные роды. 9 пациенток были родоразрешены путем операции кесарева сечения. Показанием для оперативного родоразрешения были несостоятельность рубца на матке (8), миопия высокой степени (5). С целью исключения тромботической и геморрагической наклонности накануне родоразрешения проводилось гемостазиологическое исследование с определением как общеоценочных тестов, так и молекулярных маркеров тромбофилии.
Родилось 30 живых детей, средняя масса которых составила 3580±250 г, рост 51±2,0 см. Новорожденные были оценены по шкале Апгар 7-8 баллов (13,3%), 8-9 баллов (86,7%). Ранний неонатальный период протекал без особенностей.
В послеоперационном периоде все пациентки получали антикоагулянтную профилактику фраксипарином (через 8 часов) в дозе 0,3 мл, а пациентки с тромбозом в анамнезе в дозе 0,6 мл в течение месяца. Пациентки с тромбозом в анамнезе и комбинированными формами тромбофилии затем переводились на варфарин в дозе, поддерживающей МНО в пределах 2,0-3,0 в течение 6 месяцев.
ВЫВОДЫ:
1. Наличие генетической и приобретенной тромбофилии (антифосфолипидный синдром или циркуляция антифосфолипидных антител) является независимым фактором риска отслойки хориона.
2. Циркуляция антифосфолипидных антител выявляется у 65% пациенток с отслойкой хориона, у 54,8% она сочетается с генетическими формами тромбофилии.
3. Генетическая тромбофилия выявляется у 85,4% беременных с отслойкой хориона, среди которых преобладают полиморфизмы генов, способствующие гипофибринолизу и полиморфизмы генов провоспалительных цитокинов.
4. Применение с гемостатической целью антифибринолитического препарата - транексамовой кислоты (Транексама) способствует быстрой (в течение 2 суток) остановке кровотечения и, как следствие, организации гематом в полости матки в короткие сроки (от 3 до 7 суток).
5. У 93.7% пациенток с отслойкой хориона гемостатическая терапия транексамовой кислотой (Транексамом) в сочетании с низкомолекулярным гепарином в профилактических дозах позволила пролонгировать беременность до доношенного срока.
6. У пациенток, имевших в анамнезе отслойку хориона в предшествующие беременности при наличии тромбофилии, назначение низкомолекулярного гепарина и/или аспирина в комплексе с витаминами (группы В), антиоксидантами, натуральным прогестероном, начиная с ранних сроков беременности, позволило предупредить повторные потери плода в 100% случаев.
Практические рекомендации:
1. При ведении пациенток с отслойкой хориона следует учитывать возможную патогенетическую роль приобретенной и генетической тромбофилии, а также их сочетания в развитии отслойки хориона.
2. С целью оптимизации ведения беременности пациенток с отслойкой хориона, в особенности при наличии отягощенного личного и семейного тромботического анамнеза, следует обследовать на предмет наличия генетических форм тромбофилии и АФС.
3. С гемостатической целью при отслойке хориона мы рекомендуем применение антифибринолитического препарата - транексамовой кислоты (Транексама), не имеющего эмбриотоксического и тератогенного эффектов, не вызывающего выраженных изменений в системе гемостаза и кумулятивного эффекта. Применение Транексама способствует быстрой и эффективной остановке кровотечения и организации гематом.
4. При условии повышения концентрации маркеров тромбофилии (ТАТ, Д-димера) проведение гемостатической терапии у пациенток с отслойкой хориона и тромбофилией следует сочетать с применением низкомолекулярного гепарина. Терапия низкомолекулярным гепарином должна проводиться на протяжении всей беременности. Препарат необходимо отменять за сутки до родов или кесарева сечения во избежание геморрагических осложнений. Через 8 часов после родов или операции терапия должна быть продолжена в течение 10 дней послеродового или послеоперационного периода с дальнейшей оценкой состояния гемостаза.
5. В случае выявления циркуляции антифосфолипидных антител и генетической тромбофилии у пациенток с отслойкой хориона в анамнезе, показана противотромботическая терапия в сочетании с витаминами и антиоксидантами, позволяющая предотвратить повторное развитие отслойки хориона и других осложнений беременности и пролонгировать беременность до оптимального для родоразрешения срока.
Список работ, опубликованных по теме диссертации
1. Кунешко Н.Ф., Бицадзе В.О., Баймурадова С.М. Патогенетческое обонование и основные принципы противотромботической и противогеморрагической терапии при отслойке ворсин хориона. // Журнал Российское Общество акушер-гинекологов (РОАГ), 2008. -№3.-с. 17-18.
2. Kuneshko N.F. Detachment of chorion (Отслойка хориона) // 8 Congress of the European Society of Gynecology. Roma 10-13 September 2009.- с- 131.
3. Кунешко Н.Ф. Патогенетическое обоснование противотромботической и противогеморрагической терапии при отслойке хориона// Х юбилейный Всероссийский научный форум «Мать и Дитя», Москва, 29 сентября –2 октября 2009 г.- с. 108.
4. Kuneshko N, Makatsaria A,Samburova N /Antiphospholipid syndrome and detachment of chorion.(Антифосфолипидный синдром и отслойка хориона)//The 13th International Congress on Antiphospholipid Antibodies April 13-16 2010,Galveston,Texas,USA с-515
5. Кунешко Н.Ф. Препараты прогестерона в комплексной терапии отслойки хориона у пациенток с тромбофилией. // Врач, 2010г.-№4.- с. 45-46.

