Роль полиморфных вариантов гена индуцибельной no-синтазы в формировании инфаркта мозга у больных с каротидным ишемическим атеротромботическим инсультом
На правах рукописи
БОЦИНА Александра Юрьевна
РОЛЬ ПОЛИМОРФНЫХ ВАРИАНТОВ ГЕНА ИНДУЦИБЕЛЬНОЙ
NO-СИНТАЗЫ В ФОРМИРОВАНИИ ИНФАРКТА МОЗГА
У БОЛЬНЫХ С КАРОТИДНЫМ ИШЕМИЧЕСКИМ АТЕРОТРОМБОТИЧЕСКИМ ИНСУЛЬТОМ
14.00.13 – «Нервные болезни»
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2009
Работа выполнена в ГОУ ВПО «Российский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию».
Научный руководитель:
Член-корреспондент РАМН, профессор Вероника Игоревна Скворцова
Официальные оппоненты:
Доктор медицинских наук, профессор Алла Борисовна Гехт
Доктор медицинских наук, профессор Марина Юрьевна Максимова
Ведущая организация:
ГОУ ВПО «Московская медицинская академия им. И.М. Сеченова Федерального агентства по здравоохранению и социальному развитию».
Защита состоится «15» мая 2009 года в 14.00 часов на заседании диссертационного совета Д 208.072.09 при ГОУ ВПО РГМУ Росздрава по адресу: 117997, г. Москва, ул. Островитянова, д.1.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО РМГУ Росздрава по адресу: 117997, Москва, ул. Островитянова, д.1.
Автореферат разослан «13» мая 2009 года.
Ученый секретарь диссертационного совета
профессор Л.В.Губский
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Введение
Сосудистые заболевания головного мозга и, в частности, ишемический инсульт – одна из наиболее важных и актуальных медицинских проблем нашего общества. Широкое распространение инсульта, высокий процент смертности и тяжелой инвалидизации определяют приоритетность исследований в области изучения патогенеза развития этого заболевания.
В настоящее время в изучении генетической предрасположенности инсульта, равно как и других мультифакторных заболеваний, используется анализ генетических ассоциаций, с помощью которого проводится изучение кандидатных генов, участвующих в формировании основных факторов риска сосудистой патологии. В последние несколько лет анализ генетических ассоциаций используется и для изучения аспектов индивидуальной чувствительности мозга к ишемическому повреждению и возможному прогнозированию течения и исхода заболевания.
Избыточная продукция оксида азота (NO) при обязательном участии фермента индуцибельной NO-синтазы (iNOS) с последующим образованием токсического соединения пероксинитританиона (ONOO-) в настоящее время рассматривается как один из важнейших пусковых механизмов гибели клеток пенумбры в рамках нейроиммунного ответа. К основным нейротоксическим эффектам ONOO- относят выработку провоспалительных цитокинов, инактивацию ферментов антиоксидантной защиты, участие в окислении белков, что приводит к повреждению и дисфункции клеток, а также фрагментации ДНК [Гусев Е.И., Скворцова В.И., 2001]. Особое внимание привлекает факт относительно поздней экспрессии iNOS на этапе доформирования очага инфаркта [Samdani A.F. и соавт., 1997; Niwa M. И соавт., 2001], что в дальнейшем возможно определит избирательное применение селективных ингибиторов фермента в условиях стационаров. Участие гена NOS2, кодирующего синтез фермента iNOS, в формировании очага инфаркта мозга было многократно продемонстрировано на различных моделях экспериментальной ишемии с применением нокаутных животных [Iadecola C. и соавт., 1997; Loihl A.K. и соавт., 1999].
В связи с изложенным выше, представляет несомненный интерес проведение анализа структурных особенностей гена NOS2 и оценка их роли в формировании инфаркта мозга у больных с ишемическим инсультом в остром периоде.
Цель исследования
Изучение роли полиморфных вариантов гена индуцибельной NO-синтазы (NOS2) в формировании инфаркта мозга, течении и исходе заболевания у больных с каротидным ишемическим атеротромботическим инсультом.
Задачи исследования
1. Изучить клинические особенности развития каротидного ишемического атеротромботического инсульта и закономерности динамики формирования инфаркта мозга в остром периоде заболевания.
2. Проанализировать полиморфные варианты –2447C/G, -1659C/T, -0,7 (ТААА)n I/D и Ser608Leu(150C/T) гена NOS2 и их влияние на динамику формирования инфаркта мозга.
3. Оценить связь анализируемых полиморфных вариантов гена NOS2 с течением и исходом ишемического инсульта.
Научная новизна
Впервые проведено комплексное динамическое клиническое, МР-морфометрическое и молекулярно-генетическое исследование пациентов в остром периоде ишемического инсульта с целью изучения роли полиморфных вариантов –2447C/G, -1659C/T, -0,7 (ТААА)n I/D и Ser608Leu(150C/T) гена NOS2 в динамике формирования инфаркта мозга, течении и исходе заболевания.
Обнаружены статистически значимые ассоциации полиморфизмов Ser608Leu(C/T) и -1659C/T гена NOS2 c динамикой формирования очага инфаркта мозга, что косвенно может свидетельствовать о функциональной значимости вышеуказанных полиморфных вариантов.
Выявлено достоверное преобладание носителей гомозиготного С/C генотипа по полиморфизму Ser608Leu(C/T) гена NOS2 среди больных с отрицательной динамикой в неврологическом статусе в период с 1-х по 3-и сутки и в группах больных с умеренной и тяжелой инвалидизацией, по сравнению с носительством аллеля Т, независимо от исходного объема инфаркта мозга.
Практическая значимость работы
1. Полученная взаимосвязь полиморфизма Ser608Leu(C/T) гена NOS2 c динамикой формирования очагов инфаркта мозга, течением и исходом ишемического инсульта позволит применять анализ генотипов Ser608Leu(C/T) в качестве критерия прогнозирования течения и исхода заболевания.
2. Выявление генетических маркеров индивидуальной чувствительности мозга к ишемии расширяет возможности индивидуализированной профилактики ишемического инсульта и позволяет разработать новые подходы к диспансеризации здоровых лиц из группы риска.
3. Изучение генетических основ повреждающего действия ишемии позволяет выявить новые мишени для лечения инсульта. Ассоциация полиморфного варианта Ser608Leu(C/T) гена NOS2 с динамикой формирования инфаркта мозга показывает перспективность использования нейропротекторов, реализующих свое действие через высокоселективное ингибирование фермента iNOS.
Положения, выносимые на защиту
- Формирование объема инфаркта мозга, динамика неврологического статуса и степень функционального восстановления при ишемическом инсульте статистически значимо ассоциированы с полиморфным вариантом Ser608Leu(C/Т) 16-го экзона гена NOS2, что косвенно свидетельствует о функциональной значимости данного участка, определяющего замену аминокислоты серина на лейцин в последовательности первичной структуры белка фермента iNOS.
- Высокодостоверное различие в относительной динамике объема исходно малых очагов инфаркта мозга у носителей С/С генотипа в сравнении с носителями аллеля Т по Ser608Leu(C/Т) гена NOS2, позволяет предположить различную степень значимости избыточного синтеза NO для формирования очагов разного объема.
- Обнаруженная связь полиморфизма гена NOS2, кодирующего синтез iNOS, с динамикой формирования инфаркта мозга, подтверждает участие важнейших медиаторов нейроиммунного ответа NO и ONOO- в ишемическом повреждении головного мозга у больных с каротидным ишемическим атеротромботическим инсультом и обосновывает изучение и необходимость разработки нейропротекторов, реализующих свое действие путем высокоселективного ингибирования фермента iNOS.
Внедрение результатов исследования
Результаты настоящего исследования применяются в работе неврологических отделений ГКБ №20 и №31 г.Москвы.
Апробация работы
Апробация диссертации состоялась на совместной конференции кафедры фундаментальной и клинической неврологии и нейрохирургии медико-биологического факультета ГОУ ВПО Российского государственного медицинского университета Росздрава и отдела молекулярных основ генетики человека Института молекулярной генетики РАН (протокол №7 от 12 декабря 2008 года).
Публикации:
По теме диссертации опубликовано 6 печатных работ, из них 3 в центральной отечественной печати и 3 – в зарубежной.
Объем и структура работы
Диссертация изложена на 115 страницах машинописного текста, включает 16 рисунков, 10 таблиц. Работа состоит из введения, обзора литературы, описания применяемых методов, 2 глав собственных результатов исследований и их обсуждения, заключения, выводов, практических рекомендаций и списка цитируемой литературы. Список цитируемой литературы состоит их 113 источников, включая 13 отечественных и 100 зарубежных.
СОДЕРЖАНИЕ РАБОТЫ
Общая характеристика больных и методы исследования
В основу работы положены результаты исследования 80 пациентов (славян из Московской популяции) с острым каротидным ишемическим атеротромботическим инсультом, поступивших в неврологические клиники РГМУ (ГКБ № 20 и ГКБ № 31 г. Москвы) за период 2002 - 2005 гг., соответствовавших критериям включения в исследование.
В исследование были включены 54 женщины и 26 мужчин в возрасте от 47 до 89 лет (средний возраст 69,8+1,14). Все пациенты получали унифицированную базисную терапию, реперфузионную и нейропротективную терапию.
Из исследования исключались больные с перенесенными ранее инсультами, острыми заболеваниями воспалительной и невоспалительной природы, острым инфарктом миокарда, сердечной, печеночной и почечной недостаточностью, эндокринными и аутоиммунными заболеваниями и другими состояниями, сопровождающимися нарушениями системной гемодинамики и метаболизма, а также пациенты с онкологической патологией.
В качестве сравнения использовалась группа славян из Московской популяции в количестве 50 человек, сравнимых по полу и возрасту с основной группой не, без инсультов в анамнезе и согласно данным нейровизуализации (КТ/МРТ головного мозга). Все данные о группе сравнения, включая образцы ДНК, были предоставлены Отделом Молекулярных Основ Генетики Человека ИМГ РАН.
Методы исследования
1. Клинико-инструментальные методы
Для стандартизации обработки клинического материала и проведения статистического анализа тяжесть состояния больных с ишемическим инсультом и выраженность у них неврологического дефицита оценивали по балльным шкалам Оргогозо [Orgogozo J.M., 1986] и NIHSS [Brott T.G. и соавт., 1989] на 1-е, 3-и, 7-е и 21-е сутки от развития ишемического инсульта. Группировка пациентов в зависимости от динамики тяжести состояния определялась по шкале Оргогозо. Динамика оценивалась как положительная в случае прибавления минимум пяти баллов по шкале в течение анализируемого периода наблюдения, и как отрицательная в случае уменьшения минимум на пять баллов по шкале. Состоянием без динамики считалось отсутствие прироста или уменьшения баллов по шкале Оргогозо в течение анализируемого периода. Степень функционального восстановления утраченных оценивалась по индексу Бартел [Barthel D., 1965] на 21-е сутки инсульта.
Ишемический характер инсульта был установлен по данным анамнеза и клинической картины заболевания, данных МРТ-исследования головного мозга. Патогенетический характер инсульта устанавливался в соответствии с критериями TOAST, на основании данных анамнеза и особенностей клинической картины заболевания, данных ультразвуковой допплерографии (УЗДГ) и дуплексного сканирования (ДС) магистральных артерий головы (МАГ), ЭКГ и ЭХО-КГ.
Для оценки изменения объема ишемического повреждения головного мозга всем пациентам проводилась магнитно-резонансная томография (МРТ) головного мозга и МР-морфометрия на 1-е, 3-и, 7-е и 21-е сутки от развития инсульта. Исследования выполняли на магнитно-резонансном томографе " Эллипс" ТМП-150, с индукцией магнитного поля 0,15 Тесла (научно-производственная фирма "АЗ", Россия). Морфометрическую обработку полученных изображений выполняли с применением программных пакетов "OSIRIS" и "TOMOSOFT-Net"- комплекса прикладных программ томографа "Эллипс", который включает набор последовательностей сканирования, а также среду для редактирования и анализа получаемых изображений.
2. Молекулярно-генетическое исследование
Молекулярно-генетическое исследование проводилось на базе Отдела Молекулярных Основ Генетики Человека ИМГ РАН. При проведении генетического анализа экстракцию геномной ДНК производили из лейкоцитов свежей незамороженной венозной крови по стандартной методике (9,0 мл крови с добавлением 1,0 мл ЭДТА) с применением экстракции смесью фенол/хлороформ. Прямая ДНК-диагностика полиморфных участков промотерной области –2447C/G, -1659C/T, -0,7 (ТААА)n I/D и Ser608Leu(C/T) 16-го экзона гена NOS2 производилась путем амплификации в ПЦР участков с последующей их обработкой эндонуклеазами рестрикции и электрофорезом в полиакриламидном геле.
Выбор полиморфизмов гена NOS2 для анализа их роли в формировании инфаркта мозга определялся прежде всего частотой распределения минорных аллелей в популяции. На основании опубликованных данных по частоте распределения минорных аллелей полиморфных вариантов гена NOS2 в близкородственных европейских популяциях нами были выбраны для изучения вышеуказанные участки гена. Распределение аллельных вариантов изучаемых полиморфизмов соответствовало закону Харди-Вайнберга. Анализ полиморфизма гена NOS2 в группе сравнения показал, что выбранные участки гена отличаются достаточно высокими частотами распределения минорных аллелей.
3. Статистический анализ
Статистическая обработка проводилась с помощью пакета статистических программ Statistica 7.0 с использованием стандартных методов вариационной статистики. Учитывая, что большинство совокупностей данных имели распределение отличное от нормального, для характеристики центральной тенденции значений была использована медиана; а достоверность различий устанавливали с помощью непараметрического U-критерия Манна-Уитни. Анализ связи двух признаков проводился с использованием метода корреляции гамма. Качественные признаки оценивались с помощью критерия 2 с поправкой Йетса и двустороннего критерия Фишера. В качестве порогового уровня статистической значимости было принято значение 0,05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты клинико-инструментального исследования пациентов
При поступлении в клинику состояние 34 больных (42,5%) расценивалось, как тяжелое (< 40 баллов по шкале Оргогозо). У 44 пациентов (57,5%) отмечалось состояние средней тяжести (>40 баллов по шкале Оргогозо), характеризовавшееся, в основном, отсутствием или незначительно выраженным общемозговым и менингеальным синдромами, умеренно выраженным очаговым дефектом.
Данные МР-морфометрии позволили нам разделить всех больных на 3 группы в зависимости от объема инфаркта мозга. В первую группу вошли пациенты с малым объемом ишемического очага (до 40 см3), во вторую - со средним объемом (40 – 90 см3). Третью группу составили больные с большим объемом инфаркта (более 90 см3).
Использование непараметрического метода анализа корреляции гамма выявило тесную связь между выраженностью неврологического дефицита по шкалам Оргогозо и NIHSS на 1-е, 3-и, 7-е и 21-е сутки и объемами очага инфаркта мозга на те же сутки (таблица 1).
На основании данных МР-морофометрии проводилась оценка изменений объема очага инфаркта в остром периоде ишемического инсульта. Необходимо отметить, что средняя динамика очага рассматривалась не как разница средних объемов за определенный период, а как среднее их изменений в указанные промежутки времени.
Таблица 1. Коэффициенты корреляции выраженности неврологического дефицита на 1-е, 3-е, 7-е и 21-е сутки с объемами очага на те же сутки
| Vочага,1-е сут | V очага,3-е сут | V очага,7-е сут | V очага,21-е сут | |
| ш.Оргогозо,1-е сут | -0,536023 | |||
| NIHSS,1-е сутки | 0,502385 | |||
| ш.Оргогозо,3-е сут | -0,508358 | |||
| NIHSS,3-е сутки | 0,479487 | |||
| ш.Оргогозо,7-е сут | -0,650485 | |||
| NIHSS,7-е сутки | 0,558074 | |||
| ш.Оргогозо,21-есут | -0,661597 | |||
| NIHSS,21-е сутки | 0,549451 |
Примечание: р<0,05 для всех представленных коэффициентов корреляции
В периоды с 1-х по 3-и и с 3-х по 7-е сутки отмечалось увеличение объема очага на 7,84 (1,9-47,3) мл и 2,5 (-3,7-19,94) мл соответственно. Наблюдались пациенты с прогрессирующим увеличением объема очага с 7-и по 21 сутки, но в целом достоверно чаще отмечалось уменьшение объема на 3,9 [-18,7-(-0,15)] мл (рис. 1). Полученные результаты отражают максимальную выраженность отека мозга в период с 3-х по 7-е сутки ишемического инсульта.
Рисунок 1. Динамика объема инфаркта мозга в остром периоде ишемического инсульта, см3

1-3 – период наблюдения с 1 по 3 сутки;
3-7 – период наблюдения с 3 по 7 сутки;
7-21- период наблюдения с 7 по 21 сутки.
С целью нивелирования исходных объемов и увеличения значимости вклада малых очагов была проведена оценка динамики в процентах. В период с 1-х по 3-и сутки отмечалось наибольшее увеличение очага – на 26,45 (6,74-83,33)%. В период с 3-х по 7-е сутки увеличение объема составило всего 6,46 (-22-26,04)%. С 7-х по 21-е сут наблюдалось уменьшение объемов инфаркта на 26,42 [-46,87-(-2,7)]% (рис. 2).
Рисунок 2. Динамика объема инфаркта мозга в остром периоде ишемического инсульта, %
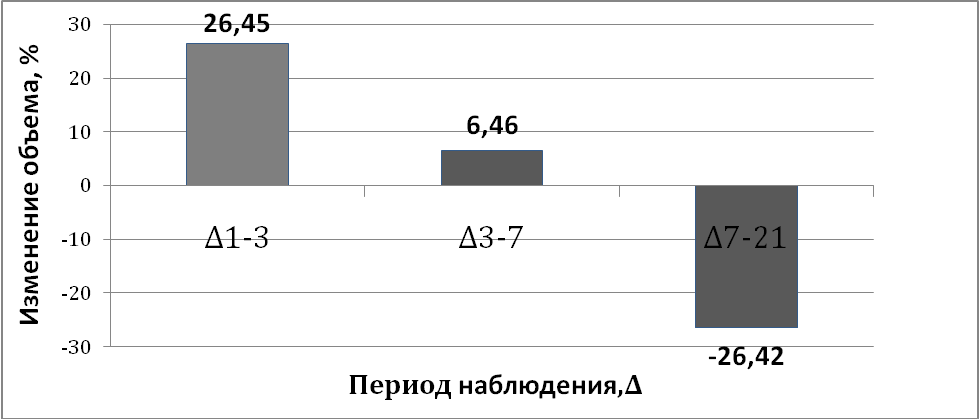
1-3 – период наблюдения с 1 по 3 сутки;
3-7 – период наблюдения с 3 по 7 сутки;
7-21- период наблюдения с 7 по 21 сутки.
Таким образом, при сравнении изменений объема очага в абсолютных и относительных величинах можно наблюдать, что в том и в другом случае увеличение объема очага инфаркта происходит в период с 1-х по 7-е сутки, в дальнейшем же следует его уменьшение. Не было отмечено достоверной разницы между увеличением объема инфаркта мозга в периоды с 1-х по 3-и и с 1-х по 7-е сутки. Полученные результаты относятся к оценке динамики объема очага, как в абсолютных, так и в относительных значениях.
При анализе динамики очагов исходно малого (<40 cм3), среднего (40-90 см3) и большого (>90 см3) объемов в относительных величинах необходимо отметить, что объем исходно больших очагов инфаркта мозга менее других меняется на протяжении периода наблюдения (рис.3).
Рисунок 3. Динамика инфаркта мозга в остром периоде ишемического инсульта в зависимости от исходного объема очага, %

1-3 – период наблюдения с 1 по 3 сутки;
3-7 – период наблюдения с 3 по 7 сутки;
7-21- период наблюдения с 7 по 21 сутки.
Несмотря на значительное увеличение объема малых и средних очагов с 1-х по 3-и сутки, отражающего развитие отдаленных последствий ишемии, в том числе локального воспаления в зоне ишемического повреждения, регресс объема на 7-21-е также значителен. Причем, чем больше объем очага к 1-м суткам, тем менее выражено его уменьшение в период с 7-х по 21-е сутки. В случае развития очага инфаркта большого объема процессы репарации продолжаются в течение более длительного периода времени, вероятно поэтому не наблюдается значительного регресса очага исходно большого объема в период с 7-х по 21-е сутки.
Результаты молекулярно-генетического исследования пациентов
Результаты анализа полиморфизма гена NOS2 у больных с каротидным ишемическим атеротромботическим инсультом продемонстрировали высокую частоту распределения минорных аллелей анализируемых структурных вариантов (таб. 2).
| Общее число больных с инсультом (n=80) | |||||
| -2447 С/G | CC 34 | CG 35 | GG 11 | C (%) 66,25 | G (%) 33,75 |
| -1659 C/T | CC 53 | CT 25 | TT 2 | C (%) 84,8 | T (%) 15,2 |
| -0.7 rep. I/D | DD 58 | ID 22 | II 0 | D (%) 86,25 | I (%) 13,75 |
| Ser608Leu (C/T) | CC 54 | CT 23 | TT 3 | C (%) 82,2 | T (%) 17,8 |
Таблица 2. Генотипы и частоты аллелей полиморфизмов гена NOS2
Необходимо отметить, что частоты распределения минорных аллелей анализируемых полиморфизмов гена NOS2 в группе больных с инсультом и в группе сравнения значимо не различались. При анализе распределения основных факторов риска ишемического инсульта у больных с разными генотипами по данным полиморфным вариантам статистических различий выявлено не было (р>0,05). Полученные данные позволяют заключить, что анализируемые в нашей работе полиморфные варианты гена NOS2, кодирующего синтез iNOS, не участвует в формировании как независимой генетической предрасположенности к развитию ишемического инсульта, так основных факторов его риска.
1.Анализ связи полиморфных вариантов гена NOS2 с динамикой объема очага инфаркта мозга
Статистический анализ с использованием метода корреляции гамма не выявил достоверной ассоциации между объемом инфаркта мозга на 1-е, 3-и, 7-е и 21-е сутки со всеми изучаемыми полиморфными вариантами гена NOS2 (р>0,05). Для выявления связи полиморфизма гена NOS2 с динамикой объема очага инфаркта мозга в абсолютных и относительных значениях проводился непараметрический метод корреляции гамма.
Обнаружена статистически значимая сильная прямая связь генотипа -1659С/T с динамикой объема инфарктов мозга в абсолютных значениях с 7-х по 21-е сутки (р<0,05); а также обратная связь средней силы генотипа Ser608Leu(C/T) с абсолютной динамикой объема очагов в тот же период наблюдения (р<0,05). Выявлены обратные корреляции между носительством генотипа Ser608Leu(C/T) и изменением объема очага с 1-х по 3-и сутки в абсолютных и относительных значениях. Следует отметить, что характер связи генотипа с динамикой очага в абсолютных значениях слабее таковой с динамикой объема, оцениваемой в относительных значениях (таб.3)
Таблица 3. Коэффициенты корреляции анализ полиморфизма гена NOS2 с динамики объема очага инфаркта мозга
| 1-3, см3 | 1-3% | 3-7, см3 | 3-7% | 7-21, см3 | 7-21% | |
| -2447 С/G | -0,143226 | -0,145806 | -0,037433 | 0,047619 | 0,210084 | 0,176471 |
| -1659 C/T | -0,269231 | 0,092077 | -0,468750 | -0,274194 | 0,750000* | 0,478261 |
| -0,7 repeat I/D | -0,211045 | -0,003953 | -0,312500 | -0,045161 | 0,433333 | 0,182609 |
| Ser608Leu C/T | -0,295038* | -0,376414* | -0,202346 | -0,119266 | -0,422222* | -0,292453 |
Примечание: *- p<0,05
В отношении полиморфных вариантов Ser608Leu (C/T) и -1659С/T, статистически значимая связь которых с динамикой объема очага инфаркта мозга была предварительно выявлена методом корреляционного анализа, проводилась оценка различия по динамике объема очага в группах носителей разных генотипов. Для этого все больные с инсультом были разделены на подгруппы в зависимости от носительства генотипов по полиморфным вариантам Ser608Leu(C/T) и -1659С/T. Учитывая незначительное число пациентов – гомозигот по Т аллелю, пациенты с C/T и T/T генотипами по Ser608Leu(C/T) были объединены в одну группу. Аналогичным образом были объединены пациенты, являющиеся носителями C/T и T/T генотипов по полиморфизму -1659С/T.
Выявлено статистически значимое различие в относительной динамике объема инфаркта мозга с 1-х по 3-и сутки между носителями С/С и С/Т+Т/Т генотипов по Ser608Leu(C/T) независимо от исходного объема очага (р=0,03). У больных с ишемическим инсультом, гомозиготных по аллелю С, отмечается достоверно более выраженное увеличение очага инфаркта с 1-х по 3-и сутки, чем у носителей аллеля Т (рис.4)
Рисунок 4. Различие в динамике объема инфаркта мозга на 1-3-и сутки у больных с разными генотипами по полиморфизму Ser608Leu(C/T)

Примечание: * р=0,03 по сравнению с С/С генотипом Ser608Leu (150C/T)
Как было отмечено ранее, увеличение объема очага инфаркта происходит с 1-х по 3-и и далее с 3-х по 7-е сутки. Если рассматривать изменение объема в относительных величинах, то приростом очага с 3-х по 7-е сутки можно пренебречь и принять, что увеличение очага с 1-х по 3-и сутки соответствует его распространению с 1-х по 7-е сутки. Выявлено статистически значимое различие в относительной динамике инфаркта с 1-х по 7-е сутки между носителями С/С и С/Т+Т/Т генотипов по Ser608Leu(C/T) независимо от исходного объема очага (р=0,04).
Полученные данные косвенно подтверждает функциональную значимость данного полиморфизма, которая на современном этапе не доказана в экспериментальных работах, однако предполагается, что нуклеотидная замена, способна влиять на стабильность структуры белка в связи с потерей дисульфидных связей между серинами. Нестабильность фермента может отрицательно повлиять на его функциональную активность и соответственно привести к снижению синтеза оксида азота, который катализируется iNOS.
Обнаружено статистически значимое различие в абсолютной динамике инфаркта в период с 7-х по 21-е сутки между носителями С/С и С/Т+Т/Т генотипов по полиморфным вариантам -1659С/Т и Ser608Leu(C/T). У носителей аллелей Т по -1659С/Т и Ser608Leu(C/T) отмечался более выраженный регресс объема очага, у носителей гомозиготных генотипов С/С (р=0,02 и р=0,03 соответственно) (рис.5,6).
Рисунок 5. Различие в динамике объема инфаркта мозга на 7-21-е сутки у больных с разными генотипами по полиморфизму -1659С/Т

Примечание: * р=0,02 по сравнению с С/C генотипом -1659 С/T
Рисунок 6. Различие в динамике объема инфаркта мозга на 7-21-е сутки у больных с разными генотипами по полиморфизму Ser608Leu(C/T)

Примечание: * р=0,03 по сравнению с С/C генотипом Ser608Leu (C/T)
Выявлено высокодостоверное различие в относительной динамике объема исходно малых очагов инфаркта мозга с 1-х по 3-и сутки между носителями С/С генотипа и аллеля Т по Ser608Leu(C/T) (р=0,005). У больных, гомозиготных по аллелю С, отмечалось достоверно более выраженное увеличение очага инфаркта с 1-х по 3-и сутки, чем у носителей аллеля Т (рис.7). Также отмечалось статистически значимое различие в относительной динамике объема малого очага инфаркта с 1-х по 7-е сутки в группах носителей С/С и С/Т+Т/Т генотипов по данному полиморфному варианту (р=0,04).
Достоверность различия выраженности динамики объема инфаркта мозга с 1-х по 3-и сутки между носителями гомозиготного генотипа С/C и носителями аллеля Т терялась при оценке подгрупп с очагами исходно среднего и большого объема. С учетом полученных данных можно предположить, что снижение количества синтезируемого оксида азота не влияет на динамику доформирования исходно средних и больших очагов за счет действия множества других факторов гибели клеток в условиях ишемии.
Рисунок 7. Различие в динамике объема малого очага инфаркта мозга на 1-3-е сутки у больных с разными генотипами по Ser608Leu(C/T)

Примечание: * р=0,005 по сравнению с генотипом С/C Ser608Leu (C/T)
2. Распределение генотипов полиморфных вариантов гена NOS2 в зависимости от динамики тяжести состояния
Распределение генотипов по полиморфному варианту Ser608Leu(C/T) у пациентов с разной динамикой неврологического дефицита в период с 1-х по 7-е сутки независимо от исходного объема очага представлено в таблице 4. Выявлено относительно равномерное распределение генотипов полиморфизма Ser608Leu(C/T) в группе больных с положительной динамикой в неврологическом статусе и, напротив, преобладание носителей генотипа С/С в двух других группах больных. Статистический анализ выявил, что в группе больных с отрицательной динамикой в неврологическом статусе по шкале Оргогозо в период с 1-х по 7-е сутки достоверно преобладают носители генотипа С/С полиморфного варианта Ser608Leu (C/T), по сравнению с группой пациентов, характеризующихся положительной динамикой, в которой распределение генотипов анализируемого полиморфизма относительно равномерно (критерий 2 с поправкой Йетса=5,75, р=0,02; двусторонний критерий Фишера р=0,006).
Таблица 4. Распределение генотипов по Ser608Leu(C/T) у пациентов с различной динамикой состояния по шкале Оргогозо с 1-х по 7-е сутки
| С/С | С/Т+Т/Т | Число пациентов | |
| Отрицательная динамика | 17(94,4%)* | 1(5,6%) | 18 |
| Без динамики | 14(70%) | 6(30%) | 20 |
| Положительная динамика | 25(59,5%) | 17(40,5%) | 42 |
Примечание: р=0,006 по сравнению с группой положительной динамики
При анализе распределения генотипов полиморфного варианта Ser608Leu(C/T) у пациентов с разной динамикой тяжести состояния с 1-х по 3-е сутки и с 7-х по 21-е сутки независимо от объема исходного очага также отмечалось относительно равномерное распределение С/С и С/Т+Т/Т генотипов полиморфизма Ser608Leu(C/T) в группе больных с положительной динамикой в неврологическом статусе и, напротив, в двух других группах больных преимущественно наблюдались носители аллеля Т. Однако достоверного преобладания носителей генотипа С/С среди пациентов с отрицательной динамикой в указанные периоды наблюдения по сравнению с двумя другими группами выявлено не было (p>0,05).
При анализе распределения генотипов полиморфного варианта Ser608Leu(C/T) у пациентов с разной динамикой тяжести состояния отдельно в подгруппах исходно малого, среднего или большого объема очага инфаркта мозга не отмечалось достоверного преобладания того или иного генотипа полиморфизма (р>0,05).
Анализ распределения генотипов полиморфных вариантов -2447С/G, -1659C/T и -0,7 (ТААА)n гена NOS2 в зависимости от динамики тяжести состояния по шкале Оргогозо не выявил достоверных различий по генотипам ни в целом по группе, ни отдельно в подгруппах исходно малого, среднего или большого очага инфаркта мозга (p>0,05).
3. Распределение генотипов полиморфных вариантов гена NOS2 в зависимости от степени функционального восстановления
Распределение генотипов по полиморфному варианту Ser608Leu(C/T) у пациентов в зависимости от степени функционального восстановления представлено в таблице 5. Статистический анализ выявил, что в группе с умеренной инвалидизацией достоверно преобладают носители генотипа С/С по Ser608Leu(C/T), по сравнению с группой минимальной инвалидизации, в которой распределение генотипов анализируемого полиморфизма равномерно (критерий 2 с поправкой Йетса=4,85, р=0,03; двусторонний критерий Фишера р=0,01).
| С/С | С/Т+Т/Т | Число пациентов | |
| Тяжелая инвалидизация | 14(73,7%) | 5(26,3%) | 19 |
| Умеренная инвалидизация | 18(90%)* | 2(10%) | 20 |
| Минимальная инвалидизация | 14(48,3%) | 15(51,7%) | 29 |
Таблица 5. Распределение генотипов по Ser608Leu(C/T) в зависимости от степени функционального восстановления по индексу Бартел
на 21 сутки
Примечание: р=0,01 по сравнению с группой положительной динамики
При анализе распределения генотипов полиморфного варианта Ser608Leu(C/T) у пациентов с разной степенью функционального восстановления по индексу Бартел отдельно в подгруппах исходно малого, среднего или большого объема очага инфаркта мозга не отмечалось достоверного преобладания того или иного генотипа полиморфизма (р>0,05). Анализ распределения генотипов полиморфных вариантов -2447С/G, -1659C/T и -0,7 (ТААА)n гена NOS2 в зависимости от степени функционального восстановления по индексу Бартел не выявил достоверных различий в генотипах ни в целом по группе, ни отдельно в подгруппах исходно малого, среднего или большого очага инфаркта мозга (p>0,05).
Исследование полиморфных вариантов –2447C/G и -0,7 (ТААА)n I/D не выявило их корреляции с динамикой объема очага инфаркта мозга, динамикой тяжести состояния и степенью функционального восстановления (р>0,05). Это может быть обусловлено отсутствием функциональной значимости анализируемых полиморфных вариантов, либо отсутствием статистической достоверности в связи с относительно малым объемом выборки.
ВЫВОДЫ
1. Комплексный клинический, молекулярно-генетический и МР-морфометрический анализ выявил взаимосвязь полиморфного варианта Ser608Leu(C/T) гена NOS2 с динамикой формирования очага инфаркта мозга в период с 1-х по 3-и и с 1-х по 7-е сутки от развития заболевания (r = -0,376 и r = -0,295, p<0,05), а также связь Ser608Leu(C/T) и –1659С/T гена NOS2 с динамикой формирования очага инфаркта мозга в период с 7-х по 21-е сутки от развития заболевания (r = -0,422 и r =0,75 соответственно p<0,05) независимо от исходного объема независимо от исходного объема.
2. Установлено статистически значимое различие по выраженности динамики объема очага церебральной ишемии в группах носителей гомозиготного генотипа С/C и носителей аллеля Т полиморфного варианта Ser608Leu(C/T). Для носителей аллеля Т характерно менее выраженное увеличение объема очага с 1-х по 3-и сутки по сравнению с носителями гомозиготного генотипа С/С независимо от исходного объема очага (р=0,03).
3. В группе пациентов с малым объемом очага церебральной ишемии носительство гомозиготного генотипа С/С по полиморфизму Ser608Leu(C/T) высоко достоверно связано с более выраженным увеличением объема малого очага в период с 1-х по 3-и сутки по сравнению с носительством аллеля Т (р=0,005).
4. Установлено достоверное различие по выраженности динамики объема очага церебральной ишемии в группах носителей гомозиготного генотипа С/C и носителей аллеля Т полиморфных вариантов Ser608Leu(C/T) и –1659С/T. Для носителей протективной аллели Т характерно более выраженное уменьшение объема очага с 7-х по 21-е сутки по сравнению с носителями гомозиготного генотипа С/С (р=0,03 и р=0,02 соответственно).
5. Частота С/С генотипа достоверно преобладает у больных с отрицательной динамикой в неврологическом статусе (по балльной шкале Оргогозо) в периоды с 1-х по 3-и и с 7-х по 21-е сутки, а также среди пациентов с замедленным восстановлением нарушенных неврологических функций к концу острого периода ишемического инсульта (тяжелая или умеренная инвалидизация) по сравнению с носительством аллеля Т, независимо от исходного объема инфаркта мозга (р=0,006 и р=0,01 соответственно).
6. Исследование полиморфных вариантов –2447C/G и -0,7 (ТААА)n I/D не выявило их корреляции с динамикой объема очага инфаркта мозга, динамикой тяжести состояния и степенью функционального восстановления (р>0,05).
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Целесообразно включить молекулярно-генетическую диагностику полиморфного варианта Ser608Leu(C/T) гена NOS2 в качестве молекулярно-генетического маркера индивидуальной чувствительности ткани мозга к ишемии с целью выявления группы риска по неблагоприятной динамике объема очага инфаркта мозга в случае острого сосудистого мозгового эпизода.
2. Рекомендуется использовать в группах риска по развитию ишемического инсульта своевременную превентивную нейропротективную терапию, стимулирующую синтез защитных нейротрофических факторов.
3. Целесообразна разработка и включение в комплекс интенсивной терапии ишемического инсульта нейропротекторов, избирательно подавляющих фермент iNOS.
СПИСОК НАУЧНЫХ РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Скворцова В.И., Кольцова Е.А., Боцина А.Ю. Генетика ишемического инсульта.//Ж. неврологии и психиатрии им. С.С. Корсакова, приложение ИНСУЛЬТ, 2001, №4, с.10-18.
- Скворцова В.И., Лимборская С.А., Сломинский П.А., Кольцова Е.А., Шетова И.М., Тупицина Т.В., Боцина А.Ю. Изучение pоли миссенс-мутации (М235Т) гена ангиотензиногена в pазвитии ишемической болезни мозга.//Молекулярная генетика, микробиология и вирусология, 2003, №1, с.53-54.
- Скворцова В.И., Лимборская С.А., Сломинский П.А., Кольцова Е.А., Шетова И.М., Боцина А.Ю., Шамалов Н.А. Роль полиморфных вариантов генов ренин-ангиотензиновой системы в развитии ишемического инсульта в московской популяции.//Ж. неврологии и психиатрии им. С.С. Корсакова, 2003, 103, №3 с.47-51.
- Skvortsova V.I., Limborska S.A., Shetova I.M., Koltsova E.A., Botsina A.Yu., Tupitsina T.V., Slominsky P.A. The role of polymorphisms of candidate genes (angiotensin converting enzyme, angiotensinogen and endothelial nitric oxide synthase) in the carotid ischemic atherothrombotic stroke.//Abstracts of the 5th World Stroke Congress, 22-26 June 2007, Vancouver, Canada, p 211.
- Dmitrieva V.G., Dergunova L.V., Botsina A.Yu., Platonova I.A., Tvorogova T.V., Shaykhutdinova E.F., Torshina E.V., Skvortsova V.I., Limborska S.A. Analysis of iNOS expression in rats under brain experimental ischemia.// European Journal of Human Genetics. 2005, v. 13, p. 365.
- Botsina A.Yu, Tupitsina T.V., Shetova I.M., Slominsky P.A., Limborska S.A., Skvortsova V.I. Association of NOS2 polymorphisms Ser608Leu(150C/T) and -1659C/T with brain infarction formation in patients with ischemic atherothrombotic stroke from Moscow population.// Abstracts of the XVIIIth European Stroke Conference, 26-29 May 2009, Stochkholm, Sweden.PO №12.
СПИСОК СОКРАЩЕНИЙ
ДНК – дезоксирибонуклеиновая кислота
ДС – дуплексное сканирование
КТ – компьютерная томография
МАГ – магистральные артерии головы
МР – магнитно-резонансный
МРТ – магнитно-резонансная томография
п.н. – пара нуклеотидов
ПЦР – полимеразная цепная реакция
УЗДГ – ультразвуковая доплерография
ЭКГ - электрокардиография
ЭХО-КГ – эхокардиография
iNOS – inducible NO-synthase (индуцибельная NO-синтаза)
NO – оксид азота
NOS2 – inducible NO-synthase 2 (ген, кодирующий синтез фермента)
ONOO- - пероксинитританион

