Цитокинопосредованная дисфункция локомоторной активности фагоцитов и ее коррекция у детей с травматической болезнью
На правах рукописи
Злакоманова
Ольга Николаевна
ЦИТОКИНОПОСРЕДОВАННАЯ ДИСФУНКЦИЯ ЛОКОМОТОРНОЙ АКТИВНОСТИ ФАГОЦИТОВ И ЕЕ КОРРЕКЦИЯ У ДЕТЕЙ С ТРАВМАТИЧЕСКОЙ БОЛЕЗНЬЮ
14.00.36 – аллергология и иммунология
14.00.35 – детская хирургия
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Челябинск, 2008
Работа выполнена в лаборатории диагностики иммунодефицитных состояний Научно-исследовательского института иммунологии и на кафедре хирургии, травматологии и ортопедии детского возраста Государственного образовательного учреждения высшего профессионального образования «Челябинская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию».
Научные консультанты:
Заслуженный деятель науки РФ, член-корреспондент РАМН, доктор медицинских наук, профессор Долгушин Илья Ильич
доктор медицинских наук, профессор Чукичев Александр Викторович
Официальные оппоненты:
доктор медицинских наук, профессор Симбирцев Андрей Семенович
доктор медицинских наук, профессор Ярилин Александр Александрович
доктор медицинских наук, профессор Рудакова Эмилия Акиндиновна
Ведущая организация: Государственное образовательное учреждение высшего профессионального образования Российский государственный университет Росздрава (г. Москва)
Защита состоится «25» ноября 2008 г. в ______ час. на заседании диссертационного совета Д. 208.117.03. при Государственном образовательном учреждении высшего профессионального образования «Челябинская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию» по адресу 454092, г. Челябинск, ул. Воровского, д. 64.
С диссертацией можно ознакомиться в библиотеке Государственного образовательного учреждения высшего профессионального образования «Челябинская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию».
Автореферат разослан «___» _______________2008 г.
Ученый секретарь
диссертационного совета
доктор медицинских наук, профессор Л.Ф. Телешева
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
В последние десятилетия отмечается устойчивая тенденция к росту травматизма, что определяет актуальность данной медицинской проблемы. Около 25% пациентов с травмой составляют дети, у которых механические повреждения выступают на первое место как причина заболеваемости, инвалидности и смертности. Посттравматические состояния, приводящие к инвалидности, наблюдаются у 4,5 %, а длительные функциональные расстройства, затрудняющие учебу – у 38 % детей (Кузнечихин Е.А., Немсадзе В.П., 1999; Баиров Г.А., 2000).
Закономерным следствием травмы являются изменения со стороны иммунной системы. Несмотря на непрерывное совершенствование антибактериальной терапии и хирургической техники, инфекционные осложнения, являющиеся одним из основных клинических проявлений иммунной недостаточности, остаются главной причиной смерти у пациентов, особенно детей, с серьезными повреждениями (Баиров Г.А., 2000; Деллинджер Э.П., 2001; Белобородов В.Б., Митрохин С.Д., 2003; Пхакадзе Т.Я. и соавт., 2003; Калинина Н.М. с соавт., 2005; Страчунский Л.С. и соавт., 2007).
После воздействия повреждающего фактора в ткани развивается острое экссудативно-деструктивное воспаление, основными эффекторами которого являются фагоциты. Результативность формирующейся фагоцитарной реакции во многом определяется характером и интенсивностью ее начального этапа – хемотаксиса.
Способность к направленной миграции составляет основу функциональной пластичности фагоцитов, но из-за своей сложности хемотаксис является одной из наиболее уязвимых форм реактивности нейтрофилов и моноцитов. Поэтому многие дисфункции фагоцитов и других иммуноцитов связаны с патологией движения клетки. Снижение двигательной активности фагоцитов может быть результатом не только их повреждения, но и хемотаксиской деактивации, развивающейся после контакта с различными хемоаттрактантами и приводящей к угнетению хемотаксиса.
Известно, что механическая травма вызывает индуцированную форму вторичного иммунодефицитного состояния, характеризующуюся количественными и функциональными изменениями различных гуморальных факторов, активности иммунокомпетентных клеток и приводит к расстройству их цитокиновой регуляции (Хаитов Р.М., 2000; Долгушин И.И., Бухарин О.В., 2001; Фрейдлин И.С. и соавт., 2002; Симбирцев А.С., 2004; Малыш И.Р., Козлов В.К., Згржебловская Л.В., 2005). Поэтому было логично предположить, что аномалии миграции клеток наряду с дефектами цитокиновой регуляторной сети, развивающимися после механической травмы, могут являться одной из главных причин развития гнойного воспаления и нарушения репаративных процессов в поврежденной ткани.
Изучение роли фагоцитов и секретируемых ими медиаторов воспаления в патогенезе травматической болезни и процессах репаративной регенерации костной ткани является весьма актуальной проблемой, еще далекой от окончательного разрешения. Её дальнейшее исследование позволить разработать новые подходы к диагностике и лечению иммунодефицитного состояния при травматических повреждениях, а также определить возможность коррекции нарушенных звеньев гомеостаза.
Цель исследования
Целью настоящей работы является исследование роли нарушений двигательных функций фагоцитов (нейтрофилов и моноцитов) в патогенезе травматической болезни у детей, взаимосвязи таких изменений с уровнем цитокинов, активностью репаративной костной регенерации, возникновением гнойно-воспалительных осложнений, а также разработка патогенетически обоснованных подходов к коррекции выявленных нарушений.
Задачи работы
1. Оценить функциональное состояние (фагоцитарная, лизосомальная, НСТ-редуцирующая, секреторная активность) нейтрофилов и моноцитов и показатели гуморального иммунитета при деструкции костной ткани в различные периоды травматической болезни у детей с неосложненным и осложненным ее течением.
2. Изучить базальную и индуцированную митогенами (ЛПС и ФГА) продукцию ИЛ-1, ИЛ-10, ИЛ-8, ИЛ-4 и ИНФ- клетками периферической крови здоровых и травмированных детей.
3. Исследовать хемотаксическую и миграционную активности нейтрофилов и моноцитов периферической крови в ответ на различные хемоаттрактанты у здоровых и травмированных детей и установить взаимосвязь между степенью изменения кинетической функции фагоцитов и уровнем цитокинов.
4. Определить уровни биохимических маркеров костного ремоделирования (кальцитонина, остеокальцина и С-телопептидов коллагена I типа CrossLaps) у здоровых и травмированных детей и их взаимосвязь со степенью нарушения цитокинпродуктивной и локомоторной функций клеток периферической крови у пациентов с механической травмой.
5. Изучить хемотаксические свойства и способность индуцировать “хемотаксическую деактивацию” нейтрофилов у возбудителей, наиболее часто вызывающих развитие посттравматических гнойно-воспалительных осложнений у детей (Staphylococcus aureus, Escherichia coli, Proteus vulgaris, Pseudomonas aeruginosa).
6. Исследовать хемотаксические свойства и способность вызывать “хемотаксическую деактивацию” нейтрофилов у антибиотиков, применяемых при лечении посттравматических гнойно-воспалительных осложнений у детей (амоксиклав, гентамицин, линкомицин, цефотаксим).
7. Выяснить влияние антибактериальных препаратов (амоксиклав, гентамицин, линкомицин, цефотаксим) на спонтанную и индуцированную ЛПС продукцию цитокинов – ИЛ-1, ИЛ-4, ИЛ-8, ИЛ-10, ИНФ- клетками периферической крови при травматической болезни у детей.
8. Изучить действие иммунотропных препаратов (метилурацил, нуклеинат натрия и АТФ) на подвижность фагоцитов in vitro у здоровых детей и у травмированных пациентов – до и после лечения, и на основе этого разработать патогенетически обоснованные подходы к коррекции выявленных нарушений фагоцитарных функций у детей с травматической болезнью.
Научная новизна
В работе впервые установлено, что у детей в процессе развития травматической болезни происходит изменение секреции медиаторов воспаления, проявляющееся в гиперпродукции провоспалительных индукторов и приводящее к дисбалансу в цитокиновой сети регуляции, в большей степени в системе хемокиновых интерлейкинов.
Установлена взаимосвязь между уровнями продукции цитокинов и нарушениями локомоторных функций фагоцитов у детей с травматической болезнью, свидетельствующая о роли дефекта миграции клеток в развитии дисбаланса постоянства внутренней среды организма после травмы.
Представлены новые сведения об участии фагоцитарных реакций в восстановлении костной ткани при травматических повреждениях опорно-двигательной системы. Установлена существенная роль фагоцитов в резорбции костной ткани. Определена динамика маркеров костного метаболизма в зависимости от периодов травматической болезни у детей.
Впервые показано, что антибиотики, используемые в лечении гнойно-воспалительных осложнений при травматической болезни у детей, выступают как модуляторы воспалительной реакции, изменяющие цитокин-продуктивную активность фагоцитов. Определены хемотаксические и хемокинетикотропные эффекты амоксиклава, гентамицина, линкомицина, цефотаксима in vitro в норме и при лечении детей с гнойно-воспалительными осложнениями травматической болезни. Обнаружено, что они усугубляют двигательные дисфункции фагоцитов и опосредованно способствуют замедлению процессов репарации костной ткани.
Разработан оригинальный подход к подбору индивидуальной дозы нуклеината натрия, метилурацила и АТФ на основе оценки их влияния на хемотаксис нейтрофилов и моноцитов in vitro, что позволяет не только снизить уровень интоксикации, но и восстановить у травмированных детей кинетическую функцию фагоцитов, предотвращая развитие посттравматических гнойно-воспалительных осложнений.
Практическая значимость работы
Доказано, что в раннем посттравматическом периоде происходит изменение продукции цитокинов, которое приводит к дисбалансу в системе про- и противовоспалительных цитокинов, наиболее выраженному в хемокиновом звене. Дисбаланс системы цитокинов является одной из причин локомоторных дисфункций фагоцитов и нарушения процессов репаративной регенерации костной ткани.
Исследованы хемокинетикотропные эффекты антибактериальных препаратов, применяемых при лечении хирургических инфекций. Выявлено, что антибиотики усугубляют двигательные дисфункции фагоцитов и опосредованно способствуют замедлению процессов репарации костной ткани.
Разработан метод коррекции нарушений локомоторной функции фагоцитов у детей с травматической болезнью, основанный на изучении хемотаксиса фагоцитов под воздействием различных концентраций препаратов на клетки in vitro, позволяющий эффективно применять лекарственный препарат через 4–5 часов с момента начала исследования и оптимизировать процесс лечения больных с повреждением опорно-двигательного аппарата, снижая риск развития гнойно-воспалительных осложнений.
На основании полученных данных разработаны “Способ изучения хемокинеза нейтрофилов под воздействием биологических веществ”, “Способ индивидуального подбора дозы АТФ” и “Способ прогнозирования эффективности нуклеината натрия у детей с травматической болезнью” (рационализаторские предложения: № 149 от 20.03.2000, № 183 от 14.03.2002 года, № 184 от 14.03.2002).
Положения, выносимые на защиту
- Клетки периферической крови здоровых детей обладают выраженной цитокин-продуктивной активностью. Стандартные митогены индуцируют продукцию цитокинов, амплитуда и направленность которой имеют феноменологическое сходство у оппозитных пулов цитокинов, что свидетельствует о состоятельности регуляторных и эффекторных функций цитокиновой системы в норме.
- Нейтрофилы и моноциты периферической крови здоровых детей проявляют хемотаксическую активность к регуляторам иммунного воспаления: ИЛ-1, ИЛ-2, ИЛ-8, ГМ-КСФ, смесь ИНФ2(c)2(d), лейкинферон, А5-фракция пептидосодержащих секреторных продуктов нейтрофилов, активированных латексом, к живым суточным культурам бактерий, наиболее часто вызывающих хирургическую инфекцию, к антибактериальным препаратам – амоксиклаву, гентамицину, линкомицину, цефотаксиму. Непосредственный контакт in vitro биорегуляторов, микроорганизмов и антибактериальных препаратов вызывает двигательную рефрактерность данных клеток.
- Одним из проявлений развивающегося иммунодефицитного состояния у детей при травматической болезни является гиперпродукция провоспалительных цитокинов с дисбалансом в цитокиновой регуляторной сети, преимущественно в системе хемокиновых интерлейкинов.
- Дефекты цитокиновой регуляторной сети детерминируют развитие мобилизационной блокады фагоцитов, наиболее выраженной в остром периоде травматической болезни и при развитии гнойно-воспалительных осложнений. Кинезия нейтрофилов и моноцитов взаимосвязана с уровнем остеорепарации. Локомоторная дисфункция фагоцитов влияет на интенсивность резорбтивных процессов и может приводить к замедленному сращению перелома.
- Антибактериальные препараты, применяемые в качестве средств этиотропной терапии при лечении гнойно-воспалительных осложнений травматической болезни, выступают как модуляторы цитокин-продуктивной активности фагоцитов и, в целом, воспалительной реакции, что усугубляет двигательные дисфункции данных клеток.
- Метилурацил, нуклеинат натрия и АТФ обладают выраженным стимулирующим влиянием на угнетенную кинетическую функцию фагоцитов детей с механической травмой. Максимальная эффективность кинетикостимулирующего действия этих препаратов достигается подбором индивидуальной дозы, основанным на оценке хемотаксиса клеток к стандартному хемоаттрактанту под действием различных концентраций препаратов in vitro.
Внедрение результатов исследования
Разработанный методический подход внедрен в практику работы детского городского ортопедотравматологического отделения МУЗ ГП№1 г. Челябинска и ортопедотравматологического отделения ГМЛПУЗ «Челябинская областная клиническая больница» и в лаборатории диагностики иммунодефицитных состояний НИИ иммунологии ГОУ ВПО «Челябинская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию».
Результаты исследований используются в учебном процессе на кафедрах хирургии, ортопедии и травматологии детского возраста и микробиологии, вирусологи, иммунологии ГОУ ВПО «Челябинская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию».
Апробация работы
Основные положения диссертации доложены и обсуждены на постерной сессии конкурса молодых ученых VI конгресса педиатров России (Москва, 2000); на I научно-практической конференции “Вклад молодых ученых и специалистов в развитие науки и культуры г. Челябинска. Состояние. Проблемы. Перспективы” (Челябинск, 2000); на XIV Российской научной конференции “Факторы клеточного и гуморального иммунитета при различных физиологических и патологических состояниях” (Челябинск, 2000); на конференции, посвященной 20-летию ЦНИЛ Челябинской государственной медицинской академии “Современные технологии в биологии и медицине” (Челябинск, 2000); на III Российской межрегиональной конференции, посвященной 60-летнему юбилею Челябинской государственной медицинской академии «Новые технологии и фундаментальные исследования в медицине» (Челябинск, 2002); на межрегиональной конференции биохимиков Урала, Западной Сибири и Поволжья “Биохимия: от исследования молекулярных механизмов до внедрения в клиническую практику и производство” (Оренбург, 2003); на Российской научно-практической конференции “Актуальные вопросы аллергологии и иммунологии в педиатрии” (Оренбург, 2003); на VII Всероссийском научном Форуме с международным участием имени академика В.И. Иоффе «Дни иммунологии в Санкт-Петербурге» (Санкт-Петербург, 2003); на Первой Международной Конференции “Проблемы популяционного здоровья” (Челябинск-Монреаль, 2003); на III конференции иммунологов Урала (Челябинск, 2003); на научной сессии, посвященной 60-летию Челябинской государственной медицинской академии «Актуальные проблемы медицинской науки и практического здравоохранения» (Челябинск, 2004); на конференции, посвященной 10-летию НПЦ диагностики, лечения и профилактики дисбактериозов НИИ иммунологии ЧелГМА и 60-летию ГОУ ВПО “Челябинская государственная медицинская академия МЗ РФ” “Современные проблемы диагностики и лечения дисбактериозов” (Челябинск, 2004);на VIII Всероссийском научном Форуме с международным участием имени академика В.И. Иоффе Дни иммунологии в Санкт-Петербурге. «Молекулярные основы иммунорегуляции, иммунодиагностики и иммунотерапии» (Санкт-Петербург, 2004); на Объединенном Иммунологическом Форуме (Екатеринбург, 2004); на IV конференции иммунологов Урала (Уфа, 2005).
Публикации
По теме диссертации опубликовано 28 научных работ. Издана монография.
Структура и объем диссертации
Работа изложена на 360 страницах текста, набранного на компьютере в текстовом редакторе Microsoft Word, иллюстрирована 46 таблицами, 43 рисунками и 5 фотографиями, состоит из введения, обзора литературы, главы с описанием материалов и методов исследования, 4 глав собственных исследований, заключения, выводов, практических рекомендаций, списка литературы, содержащего 366 источников, в том числе 241 отечественных и 125 зарубежных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Нами проведено клинико-иммунологическое обследование 235 детей с механической травмой в различные периоды травматической болезни, находившихся на лечении в детских травматологоортопедическом и хирургическом отделениях Челябинской областной клинической больницы. Преимущественно это были мальчики – 172 (73,19 %). Средний возраст детей составил 9,5 лет. 109 (46,38%) пострадавших поступили в первые 24 часа после травмы. У 165 (70,21%) больных были выявлены изолированные, у 52 (22,12%) – множественные и у 12 (7,67%) – сочетанные повреждения. У 222 (94,46%) пациентов травма носила закрытый характер. У 27 % детей при множественной и сочетанной травме были повреждены одновременно 2 и 3 сегмента. Ведущим было повреждение трубчатых костей скелета. Из 293 переломов 72% приходились на сегменты верхней конечности. Переломы плечевой кости – в 35,15% (103) случаях, переломы костей предплечья – в 31,3% (92) эпизодах. Повреждения костей нижней конечности диагностированы у 81 (27,65%) ребенка. Переломы бедра выявлены в 13% (38) случаях, а переломы костей голени – в 14,68% (43) наблюдений.
Исследование показателей общей реактивности организма проводились в различные сроки после травмы: 1–2, 3–7, 8–14, 15–21 сутки, что соответствовало периодам течения травматической болезни: острый период, период развернутой клинической картины болезни и период реабилитации [по классификации Ю.Г. Шапошникова и соавт. (1989)]. В острый период травматической болезни нами были обследованы 109 детей, в катаболическую и анаболическую фазы периода развернутой клинической картины – соответственно 103 и 85 пострадавших и к моменту выздоровления – 85 детей. Группу контроля составил 41 здоровый ребенок. При анализе результатов обследования детей с переломами трубчатых костей нами было установлено, что у 88,1% из них травматическая болезнь протекала в целом благоприятно, а у 27 больных (12 %) развились гнойно-воспалительные осложнения, среди которых наиболее часто встречались нагноения ран. Возбудитель был идентифицирован только у 9 пациентов и представлен золотистым стафилококком.
Большинство (211 детей – 89,8 %) обследованных детей с травмой поступали в клинику в удовлетворительном и средней степени тяжести состоянии. Все они были беспокойны и жаловались на боли различной интенсивности в зоне повреждения. У 65,1% пострадавших болевой синдром был значительно выражен. У всех детей отмечено повышение местной температуры в области поражения, которое сопровождалось умеренной гиперемией кожных покровов. Выраженный отек области перелома с распространением на соседние участки выявлен у 65,11%, кровоизлияние в ткани в месте перелома – у 23,25% пострадавших. Видимая деформация поврежденного сегмента наблюдалась у 79 % пациентов, ограничение функции – у 82,36% детей. Патологическая подвижность и крепитация наблюдались у 13,95% больных.
Общая температурная реакция характеризовалась кратковременным повышением температуры чаще до субфебрильных цифр.
О развитии острофазовой воспалительной реакции мы судили по уровню гаптоглобина, 1-антитрипсина, 2-макроглобулина, трансферрина, С-реактивного белка, который определяли иммунонефелометрическим методом на аппарате ‘”ARRAY” фирмы “Beckman” (USA).
Состояние гуморального звена иммунитета оценивали по уровню сывороточных иммуноглобулинов классов A, G и M, а также по содержанию С3- и С4-фрагментов комплемента, изучаемых с помощью иммунонефелометрического метода на аппарате ‘”ARRAY” фирмы “Beckman” (USA).
О характере изменений фагоцитарной системы судили по количеству циркулирующего пула поли- и мононуклеарных фагоцитов периферической крови и их функциональной способности.
Эффекторную функцию фагоцитов оценивали по спонтанной миграции, хемокинезу и хемотаксису (Nelson R.D. et al., 1975; Эберт Л.Я. и соавт., 1985), способности поглощать частицы полистирольного латекса (Эберт Л.Я. и соавт., 1985), по восстановлению нитросинего тетразолия в частицы дифармозана (Маянский А.Н., Виксман М.Е., 1979; Segal A.W., 1974) и по уровню суммарного свечения лизосом в цитоплазме клеток (Хейфец Л.Б., Абалакин В.А., 1973; Фрейдлин И.С. и соавт., 1977; Gordon S., 1973). Нейтрофилы и моноциты из периферической крови получали методом, предложенным Wong L., Wilson R.D, 1975.
Цитокиновый профиль оценивали по спонтанной и индуцированной продукции стандартными митогенами – липополисахаридом (ЛПС) E. coli и ФГА цитокинов: ИЛ-1, ИЛ-4, ИЛ-8, ИЛ-10 и ИНФ- в супернатантах клеток периферической крови. Для этого были использованы соответствующие тест-системы для ИФА, произведенные ООО «Цитокин» (Санкт-Петербург). В наборах применен “сандвич”– вариант твердофазного ИФА. Результат анализа вычисляли по калибровочному графику после измерения оптической плотности с помощью микропланшетного ридера “ANTHOS 2020” при длине волны 492 нм.
Определение уровня маркеров костного метаболизма производили ИФА-методом на иммуноферементном анализаторе Personal Lab (Италия) с использованием тест-систем Calcitonin ELISA (США), N-MID Osteocalcin ELISA (США), Serum Cross-Laps ELISA (США).
Статистическая обработка результатов проведена с использованием компьютерной программы «STATISTICА» (StatSoft, USA), компьютер на базе процессора Intel® Pentium® (ОС Microsoft® Windows® XP Professional). Оценку полученных результатов проводили методами стандартной вариационной статистики. Для проверки гипотезы о нормальности распределения использовали критерии Колмогорова-Смирнова и 2 (Боровиков В.П., 2001). Сравнивали дисперсии изучаемых выборок, применяя F-критерий Фишера (Зайцев В.М., с соавт., 2003). Оценку достоверности различий между средними при нормальном распределении проводили с использованием t-критерия Стьюдента с поправкой Бонферрони (Гланц С., 1998). Для оценки зависимости локомоторной функции фагоцитов от уровня цитокинов определяли коэффициент ранговой корреляции Спирмена (rs), р<0,01. Проверку статистической значимости новой технологии проводили с использованием двухстороннего t-критерия Стьюдента, tкрит.: 2,00 – 2,06, при р<0,05 (Зайцев В.М., с соавт., 2003).
Обследование выполнено после одобрения этическим комитетом ЧелГМА протокола клинико-экспериментального исследования на соответствие предлагаемой работы требованиям Хельсинской декларации всемирной медицинской ассоциации.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Динамика травматической болезни в значительной степени определяется ее тяжестью, которая, в свою очередь, является результирующей от степени нарушения функционирования различных органов и систем, интенсивности “реакции защиты” в отдельных ее периодах и фазах.
Существенную роль в формировании устойчивости при травме играют белки и их фракции, белки острой фазы, а также гуморальные факторы естественного иммунитета, в число которых входит система комплемента, иммуноглобулины, провоспалительные цитокины.
При динамическом наблюдении за содержанием общего белка в сыворотке крови установлено, что развитие острого периода, а в последующем и катаболической фазы периода развернутой клиники, сопровождалось умеренной, но достоверной гипопротеинемией. Снижение уровня общего белка сопровождалось диспротеинемией, которая характеризовалась падением концентрации альбумина и количественным перераспределением белков глобулиновой фракции. При сохраняющемся нормальном уровне глобулиновой фракции в целом, концентрация 1-, 2-, -глобулинов достоверно повышалась, а содержание -глобулинов падало. Изменение величины альбуминового индекса было обусловлено снижением в сыворотке крови только количества альбумина. В реабилитационном периоде отмечалась тенденция восстановления уровня общего белка, его фракций и их соотношения.
Уровень гаптоглобина во все изучаемые периоды травматической болезни превышал норму, достигая максимальных значений в период развернутой клиники. Концентрация С-реактивного белка возрастала во втором периоде болезни, достигая максимума в анаболическую фазу. Содержание антитрипсина, одного из главных ингибиторов протеиназ (Lauer D., 2001), хотя и повышалось, но не достигало достоверно значимого различия в сравнении с нормой. Уровни 2-макроглобулина и трансферрина оставались в пределах нормы.
Развитие травматической болезни у детей сопровождалось активацией системы комплемента и характеризовалось достоверным повышением С3- и С4-компонента комплемента в острый период и период развернутой клинической картины и постепенной нормализацией их уровня в периоде реабилитации.
В ранний посттравматический период концентрация Ig G в сыворотке крови детей достоверно снижалась, а содержание Ig M до периода реабилитации оставалось неизменным. Установленная отрицательная корреляционная связь (r= -0,67, р<0,05) между уровнями С3-компонента комплемента и Ig G позволяет предположить, что снижение концентрации Ig G при травме может быть связано с его интенсивным потреблением в реакциях активации системы комплемента (Калинина Н.М. и соавт., 2005; Ertel W. et al., 1989).
Содержание сывороточного Ig A, играющего важную роль в формировании местного иммунитета, достоверно возрастало лишь в катаболическую фазу периода развернутой клинической картины, что, по мнению K. Buttenschoen et al. (2000), может быть связано с эндотоксемией, развивающейся у пациентов с множественными повреждениями в течение первых суток.
Количественные и качественные изменения со стороны клеточных пулов периферической крови при повреждениях ткани на ранних этапах посттравматического периода во многом отражают развитие “защитной” воспалительной реакции. Достоверное снижение количества эритроцитов и падение уровня гемоглобина в них мы регистрировали во все исследуемые периоды после травмы, наиболее выраженным оно было у детей с осложнениями. СОЭ у детей с осложненным течением болезни в остром периоде возрастала в среднем в 3,9 раза как по сравнению с нормой, так и в сравнении с группой пациентов с неосложненной травмой.
Реакция белой крови в острый период характеризовалась лейкоцитозом, который был менее выражен у детей с осложненным течением травматической болезни, чем у пациентов без осложнений (р<0,01). Максимальное повышение количества нейтрофилов наблюдалось у детей с неосложненной травмой в острый период (в 2,32 раза) и достоверно меньше – при развитии осложнений (в 2,08 раза). Увеличение общего количества лейкоцитов обусловлено нейтрофилезом. Схожая картина отмечена и в период развернутой клиники болезни. Нейтрофилез при травме сопровождался относительной моно- и лимфоцитопенией. Абсолютное же количество лимфоцитов у детей с неосложненной травмой не только не уменьшалось, а наоборот, увеличивалось по сравнению с нормой (р<0,05). Рост числа лимфоцитов был характерен для всех исследуемых периодов. При развитии гнойно-воспалительных осложнений травмы, напротив, этот показатель у детей имел тенденцию к снижению. Аналогичные изменения наблюдались и со стороны популяции моноцитов.
Лейкоинтоксикационный индекс, отражающий состояние иммунной системы в целом, достоверно повышался во все изучаемые периоды травматической болезни, что свидетельствовало о продолжающейся мобилизации лейкоцитарного пула.
При благоприятно протекающей травме кинетическая подвижность фагоцитов достоверно снижалась только в острый и период развернутой клинической картины. При развитии гнойного осложнения угнетение спонтанного движения нейтрофилов и моноцитов оставалось практически без динамики.
В процессе развития травматической болезни направленное движение, как нейтрофилов, так и моноцитов к стандартному хемоаттрактанту – С5а-компоненту комплемента, достоверно снижалось. При этом наиболее выраженное угнетение хемотаксиса нейтрофилов выявлено в первом, а моноцитов – во втором изучаемом периоде болезни. Развитие гнойно-воспалительных осложнений травмы характеризовалось стойким угнетением целенаправленной локомоторной реакции фагоцитов на протяжении всех периодов травматической болезни.
Изменения двигательной активности фагоцитов сопровождались и резким нарушением их поглотительной способности, особенно у детей с развившимися гнойно-воспалительными осложнениями. В острый период травматической болезни достоверно угнетались как активность, так и интенсивность нейтрофильного и моноцитарного фагоцитоза. В период развернутой клиники у детей выявлена лишь тенденция к восстановлению изучаемых показателей до нормального уровня.
Лизосомальная активность фагоцитов при благоприятном течение травматической болезни изменялась мало, тогда как при развитии осложнений количество лизосом в цитоплазме клеток возрастало почти в 1,5 раза.
Активность и интенсивность спонтанного преобразования нитросинего тетразолия в дифармозан нейтрофилами в остром периоде при неосложненном течении травматической болезни достоверно возрастали, а в период развернутой клинической картины, наоборот, снижались. При осложненной травме эти показатели были резко повышены и имели почти одинаковый уровень, как в остром периоде, так и в периоде развернутой клинической картины. Активность и интенсивность спонтанной НСТ-реакции моноцитов оставались практически без динамики во все исследуемые периоды при неосложненном течении травматической болезни и достоверно угнетались в периоде развернутой клинической картины у пациентов с развившимися гнойно-воспалительными осложнениями.
Таким образом, в ответ на механическое повреждение в организме развивалась воспалительная реакция, которая характеризовалась не только изменением уровня острофазовых белков, диспротеинемией, уменьшением продукции сывороточного Ig G, но рядом существенных изменений нейтрофильного и моноцитарного звена защиты. Последние были наиболее выражены у детей с гнойно-воспалительными осложнениями.
Нейтрофилы и моноциты, обеспечивая первую линию противоинфекционной защиты, относительно легко активируются и под влиянием микроорганизмов и их продуктов вырабатывают цитокины, инициирующие функциональную перестройку клеток-эффекторов, клеток-регуляторов и межклеточные коммуникации при воспалении, что в конечном итоге определяет характер воспалительной реакции по амплитуде и продолжительности.
Для выявления нарушений цитокин-продуктивной активности фагоцитов в процессе развития «защитной» реакции организма при травматической болезни нами проведено исследование спонтанной и индуцированной продукции цитокинов в супернатантах цельной периферической крови и рассчитаны коэффициенты соотношения их продукции в различные периоды болезни у детей. Исследования проведены у 2 групп обследуемых: 1) здоровые дети (15 детей), в возрасте от 6 до 14 лет, 2) дети с неосложненной механической травмой скелета (15 пациентов).
Исследование спонтанной и стимулированной продукции цитокинов клетками периферической крови здоровых детей выявило следующие закономерности (табл. 1):
– клетки периферической крови здоровых детей обладают цитокин-продуктивной активностью;
– стандартные митогены индуцируют эффективную стимуляцию цитокиновой продукции, амплитуда и направленность которой имеют феноменологическое сходство у оппозитных цитокинов (ИЛ-1 и ИЛ-10; ИЛ-8 и ИЛ-4), что может быть интерпретировано как состояние баланса провоспалительных и противовоспалительных цитокинов в норме;
– более мощным стимулятором цитокиновой продукции для интерлейкинов является «бактериальный» митоген – ЛПС, при этом профиль стимуляции, как липополисахаридом, так и фитогемаллютинином аналогичен у оппозитных цитокинов;
– стандартные митогены активно стимулируют выработку ИНФ- клетками периферической крови здоровых детей, с преобладанием ФГА-индуцированной продукции.
Таблица 1.
Показатели спонтанной и митоген-индуцированной продукции цитокинов in vitro клетками периферической крови здоровых детей
| Цитокины | Уровень цитокинов (М±m), пкг/мл, (n=15) | ||||
| Без митогена (контроль) | ЛПС | ИС лпс | ФГА | ИС фга | |
| ИЛ-1 | 57,1±8,2 | 1380,5±23,54* | 24,18±2,8 | 226,8±5,61* | 3,97±0,1** |
| ИЛ-4 | 15,5±1,9 | 39,4±2,45* | 2,54±0,13 | 22,78±1,45* | 1,47±0,15** |
| ИЛ-8 | 337,0 ±10,1 | 2143,78±38,2* | 6,36±0,2 | 1013,45±27,62* | 3,01±0,01** |
| ИЛ-10 | 4,98±0,51 | 197,48±37,92* | 39,65±1,4 | 43,12±4,23* | 8,66±0,56** |
| ИНФ- | 53,1±2,56 | 1393,38±25,15* | 26,241±1,9 | 3957,92±59,4* | 73,54±2,9** |
Примечание: * – достоверные различия с контролем при уровне значимости р<0,01, ** – достоверные различия средних исследуемых показателей ЛПС- и ФГА-индуцированной продукции цитокинов при уровне значимости р<0,001.
Эти закономерности свидетельствуют, с одной стороны, о полноценности интегративных механизмов эндогенной системы цитокинов и способности к саморегуляции, а с другой стороны, о высоком активационном потенциале клеток здоровых детей к синтезу и секреции цитокинов.
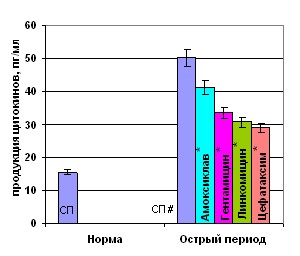
Патогенетическая неоднородность или стадийность заболевания сочетается с неодинаковыми реакциями в цитокиновой сети, и по-разному от них зависят. Это подтверждается результатами исследования спонтанной и митоген-индуцированной продукции цитокинов ИЛ-1, ИЛ10, ИЛ-8, ИЛ-4 и ИНФ- у детей с травматической болезнью в различные стадии процесса (табл. 2). Уже в дебюте травматической болезни резко увеличивалась спонтанная продукция как про-, так и противовоспалительных цитокинов, с максимальной концентрацией ИЛ-8. При этом спонтанная продукция ИЛ-1 в остром периоде травмы превосходила таковую у здоровых детей почти в 7 раз, в то же время продукция амбивалентного цитокина ИЛ-10 возрастала – в 15 раз. Нестимулированная выработка ИЛ-8 достоверно увеличивалась в остром периоде травматической болезни по сравнению с нормой в 4,5 раз, в то время
Таблица 2.
Показатели продукции цитокинов in vitro клетками периферической крови здоровых детей и пациентов с травматической болезнью
| Показатели продукции цитокинов | Статисти- ческие показатели | Уровень продукции цитокина, пг/мл | ||
| Здоровые дети (n=15) | Острый период (n=15) | Период развер- нутой клиники (n=15) | ||
| ИЛ-1 спонт., пг/мл | M±m | 57,1±8,2 | 393,13±10,58* | 185,67±7,45*# |
| ИЛ-1+ЛПС, пг/мл ИС, усл. ед | M±m | 1380,8±23,54 24,18±2,8 | 612,38±8,51* 1,56±0,02* | 554,33±6,56*# 2,98±0,03*# |
| ИЛ-1+ФГА, пг/мл ИС, усл. ед | M±m | 226,8±5,61 3,97±0,1 | 514,13±9,09* 1,31±0,15* | 569,33±6,98*# 3,06±0,08*# |
| ИЛ-4 спонт., пг/мл | M±m | 15,5±1,9 | 50,25±3,03* | 25,33±1,84*# |
| ИЛ-4+ЛПС, пг/мл ИС, усл. ед | M±m | 39,4±2,45 2,54±0,13 | 31,13±1,92* 0,62±0,03* | 14,39±1,33*# 0,57±0,004* |
| ИЛ-4+ФГА, пг/мл ИС, усл. ед | M±m | 22,78±1,45 1,47±0,15 | 51,13±3,42* 1,02±0,08* | 48,00±3,0* 1,89±0,02*# |
| ИЛ-8 спонт., пг/мл | M±m | 337,0±10,1 | 1503,25±19,35* | 867,33±11,36*# |
| ИЛ-8+ЛПС, пг/мл ИС, усл. ед | M±m | 2143,78±38,2 6,36±0,2 | 1845,58±14,38* 1,23±0,04* | 1909,0±20,93*# 2,2±0,01*# |
| ИЛ-8+ФГА, пг/мл ИС, усл. ед | M±m | 1013,45±27,62 3,01±0,01 | 1846,25±18,13* 1,23±0,1* | 1607,67±18,43*# 1,85±0,006*# |
| ИЛ-10 спонт., пг/мл | M±m | 4,98±0,51 | 76,25±4,36* | 33,67±3,84*# |
| ИЛ-10+ЛПС, пг/мл ИС, усл. ед | M±m | 197,48±37,92 39,65±1,4 | 42,63±5,80* 0,55±0,03* | 63,0±9,43* 1,87±0,01*# |
| ИЛ-10+ФГА, пг/мл ИС, усл. ед | M±m | 43,12±4,23 8,66±0,56 | 280,88±24,47* 3,68±0,2* | 144,67±18,64*# 4,3±0,003*# |
| ИНФ- спонт., пг/мл | M±m | 53,1±2,56 | 21,05±1,75* | 16,45±0,57*# |
| ИНФ-+ЛПС, пг/мл ИС, усл. ед | M±m | 1393,38±25,15 26,24±1,9 | 15,86±0,39* 0,75±0,01* | 16,17±0,41* 0,98±0,001*# |
| ИНФ-+ФГА, пг/мл ИС, усл. ед | M±m | 3957,92±59,4 73,54±2,9 | 22,24±2,03* 1,06±0,05* | 16,08±0,3*# 0,98±0,002* |
Примечание: * – достоверные различия с нормой при уровне значимости р<0,02, # – достоверные различия с острым периодом при уровне значимости р<0,05.
как синтез ИЛ-4, который подавляет продукцию хемокина (Ковальчук Л.В., Сайгитов Р.Т., 2000; Фрейдлин И.С. с соавт., 2002), возрастал только в 3 раза, одновременно с этим концентрация ИЛ-8 превосходила концентрацию ИЛ-4 почти в 30 раз.
В период развернутой клиники клетки периферической крови травмированных детей (табл. 2) продолжали активно секретировать весь исследуемый спектр цитокинов даже в режиме спонтанного культивирования. Наиболее высокий уровень продукции демонстрировал ИЛ-10 и оппозитный острофазозый цитокин – ИЛ-1. Выработка ИЛ-8 в 2,6 раза была выше, чем показатели у здоровых детей, а ИЛ-4 лишь в 1,6 раза. Несмотря на относительно высокие параметры базальной продукции тестируемых медиаторов в данный период травматической болезни, нами отмечена относительная стабилизация повышенного уровня цитокинов, проявляющаяся в снижении секреции исследуемых цитокинов в среднем в 2 раза по сравнению с острым периодом, что возможно связано с активацией механизмов ауто- и паракринной регуляции секреции цитокинов (Козлов В.А., 2002).
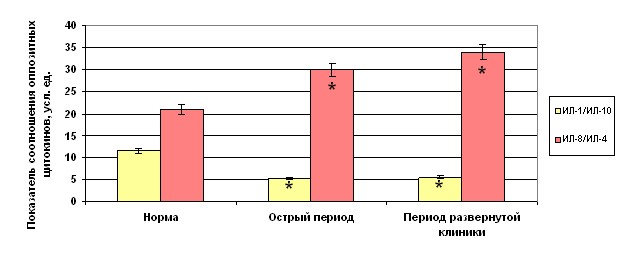
Об относительности стабилизации и патогенетической незавершенности травматического процесса свидетельствуют и показатели соотношения оппозитных цитокинов (рис. 1). Если соотношение уровня ИЛ-1/ИЛ-10 на фоне их активной продукции не меняется, то соотношение продукции ИЛ-8 к
 Примечание: * – достоверные различия с нормой при уровне значимости р<0,05
Примечание: * – достоверные различия с нормой при уровне значимости р<0,05
Рисунок 1. Динамика соотношения оппозитных цитокинов в норме и при травматической болезни.
ИЛ-4 прогрессивно растет, что еще больше усугубляет цитокиновый дисбаланс в период развернутой клиники уже развившийся в более раннем посттравматическом периоде. При этом нарушения цитокиновой сети касаются преимущественно ее хемокинового звена, а именно снижение продукции ИЛ-4, как регулятора (ингибитора) избыточной продукции хемокинов, на фоне активной секреции ИЛ-8.
Уровень ИНФ- в раннем посттравматическом периоде достоверно уменьшался почти в 2,5 раза в сравнении с нормой и продолжал прогрессивно падать в период развернутой клинической картины болезни.
Особенности функционирования цитокиновой сети, как в норме, так и при патологических состояниях наиболее ярко проявляются в условиях активации иммунокомпетентных клеток. Нами установлено, что в раннем посттравматическом периоде ЛПС инициировал разнонаправленные эффекты цитокин-продуктивной активности клеток периферической крови. Эндотоксин и ФГА лишь умеренно стимулировали продукцию ИЛ-1. Индекс стимуляции (ИС) был в 15 раз ниже для ЛПС и в 3 раза – для ФГА. Динамика секреции ИЛ-10 в присутствии бактериального митогена была противоположной. Клетки периферической крови травмированных детей отвечали на ЛПС не усилением продукции ИЛ-10, а наоборот, ее угнетением, при этом индекс стимуляции был более чем в 70 раз ниже, чем у здоровых детей. ФГА, напротив, вызывал стимуляцию продукции ИЛ-10. В период развернутой клиники бактериальный митоген реализовывал свой стимулирующий эффект в большей степени, увеличивая секрецию ИЛ-1 в 3 раза и ИЛ-10 в 1,8 раза, что может свидетельствовать о частичном восстановлении регуляторного потенциала цитокиновой системы.
Уровни секреции оппозитных цитокинов ИЛ-1 и ИЛ-10, как и уровни ИЛ-8 и ИЛ-4, продуцируемых ex vivo, в ответ на стимуляцию эндотоксином и ФГА отличались и в раннем посттравматическом, и в более позднем, периодах болезни. Их профиль не имел такого феноменологического сходства, как у здоровых детей и характеризовался асинхронностью ответа на индуктор.
Таким образом, патологическая активация фагоцитов и других иммуноцитов, проявляющаяся, в частности, в повышенной продукции острофазовых цитокинов – ИЛ-1, ИЛ-8, наиболее выраженной в ранний период посттравматической деструкции, направлена скорее на эффекторное обеспечение повреждающих, нежели репарирующих механизмов иммунного ответа. По нашему мнению, именно высокие уровни продукции цитокинов, в частности, ИЛ-8 определяют развитие мобилизационной блокады фагоцитов, подвижных продуцентов и носителей регуляторов воспаления. Поскольку эти клетки приходят в очаг воспаления или повреждения главным образом из других мест и являются необходимыми элементами процесса, то наряду с вопросами о природе медиаторов, их секреции и механизмах активации, возникает вопрос о том, как изменяется и регулируется их миграционная активность?
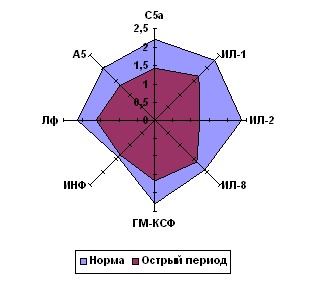
Локомоторная функция Нф и Мн исследовалась у 235 детей с переломами костей скелета. Контрольную группу составил 41 здоровый ребенок. В качестве хемоаттрактантов нами были использованы известные регуляторы иммунного воспаления (ИЛ-1, ИЛ-2, ИЛ-8, ГМ-КСФ, смесь ИНФ-2(с)2(d), лейкинферон (естественный цитокиновый комплекс), А5-пептидосодержащее вещество, выделенное из супернатантов активированных нейтрофилов). Контролем служил стандартный хемоаттрактант – С5а-фрагмент комплемента.
Установлено, что изучаемые регуляторы иммунного воспаления обладают выраженными хемокинетикотропными свойствами как по отношению к нейтрофилам, так и к моноцитам здоровых детей (рис. 2).
После травмы происходит снижение целенаправленного движения нейтрофилов и моноцитов ко всем изучаемым хемоаттрактантам (рис. 2). Такая «функциональная рефрактерность» к хемоаттрактантам развивается после контакта с раздражителем и носит системный характер, не связанный с локализацией очага воспаления. В её основе лежит сокращение числа рецепторов, доступных для взаимодействия с новыми порциями лиганда. Негативный эффект потенцируется, если за связыванием следует эндоцитоз, ведущий к структурной изоляции рецептора (Маянский А.Н., Пикуза О.И., 1993).
 Индекс хемотаксиса нейтрофилов, усл. ед. Индекс хемотаксиса нейтрофилов, усл. ед. | 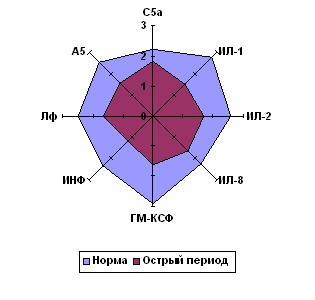 Индекс хемотаксис моноцитов, усл. ед. Индекс хемотаксис моноцитов, усл. ед. |
Рисунок 2. Хемотаксис фагоцитов периферической крови здоровых детей (n=41) и пациентов с ТБ (n=109) в острый период к биологически активным веществам различной природы.
 Спонтанная миграция нейтрофилов Спонтанная миграция нейтрофилов | 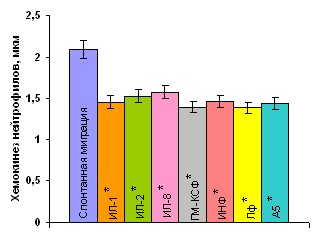 Хемокинез нейтрофилов Хемокинез нейтрофилов |
Примечание * – достоверность различий с нормой при р<0,01.
Рисунок 3. Спонтанная миграция и хемокинез нейтрофилов периферической крови здоровых детей (n=41) и пациентов с ТБ (n=211) под действием биологически активных веществ различной природы.
Сравнение результатов исследования влияния регуляторов цитокиновой сети на хемокинетическую функцию фагоцитов здоровых и травмированных детей, показало, что характер изменений хемокинеза Нф и Мн, наблюдаемый после травмы и у здоровых детей, индуцируемых исследуемымицитокинами, почти полностью совпадает (рис. 3). По сути дела при непосредственном воздействии данными веществами на фагоциты здоровых детей in vitro мы фактически моделировали состояние этих клеток, схожее с тем, которое развивается после тканевой деструкции.
Далее предстояло выяснить, насколько изменения локомоторной функции Нф и Мн у детей с травматической болезнью играют отрицательную роль в плане развития гнойно-воспалительных осложнении. Для этого нами были обследованы 27 детей, у которых в посттравматическом периоде развились гнойно-воспалительные осложнения.
Осложненное течение травматической болезни характеризовалось еще более выраженным угнетением целенаправленной подвижности фагоцитов уже в остром периоде. Почти ко всем изучаемым регуляторным факторам отмечалось снижение направленной миграции как Нф, так и Мн. При этом Нф становились наиболее рефрактерны к ИЛ-1 и еще менее чувствительны к ИЛ-8 и ГМ-КСФ. Повышением чувствительности Нф отвечали только на смесь ИНФ 2(с)2(d).
Таким образом, развитие гнойно-воспалительных осложнений у травмированных детей сопровождается еще более выраженным угнетением как хемокинетической, так и хемотаксической функции фагоцитов. Запоздалая миграция фагоцитов в очаг тканевой деструкции не позволяет данным клеткам эффективно реализовать элиминационный потенциал, а также участвовать в процессах репаративной регенерации костной ткани.
Далее необходимо было выяснить, как изменяется соотношение процессов формирования и резорбции костной ткани в условиях мобилизационной блокады нейтрофилов и моноцитов.
Индикаторами костного метаболизма являются маркеры костного ремоделирования – продукты костного матрикса и клеток кости.
Нами были исследованы три маркера метаболизма костной ткани кальцитонин (специфический гормональный ингибитор паратгормона), остеокальцин (костный глутаминовый белок – BGP – биохимический маркер формирования кости, характеризующий функцию остеобластов) и С-телопептиды коллагена I типа (CrossLaps) (маркер костной резорбции, характеризующий функцию остеокластов).
Содержание сывороточного кальцитонина у здоровых детей, составило 2,13±0,03 пг/мл. В раннем посттравматическом периоде отмечалась лишь тенденция к его повышению в сыворотке (3,06±0,18 пг/мл) в пределах возрастной нормы (рис. 4). В катаболическую фазу второго периода нами было зафиксировано достоверное повышение сывороточной концентрации кальцитонина более чем в 35 раз в сравнении со здоровыми детьми.
 Примечание * – достоверность различий с нормой при р<0,001.
Примечание * – достоверность различий с нормой при р<0,001.
Рисунок 4. Уровень кальцитонина в сыворотке крови здоровых детей (n=15) и пациентов с травматической болезнью в острый период (n=15) и катаболическую фазу (n=15) периода развернутой клинической картины.
У здоровых детей содержание остеокальцина составило 95,97±4,87 пг/мл, а С-телопептидов коллагена I типа (CrossLaps) – 0,59±0,01 нг/мл (рис. 5). При травматическом повреждении костной ткани в острый период уровень остеокальцина колебался в пределах возрастной нормы. В то время как концентрация маркера остеогенной деструкции достоверно увеличивалась почти в 2,5 раза, что свидетельствует об усилении в первые часы после травмы только резорбтивных процессов.
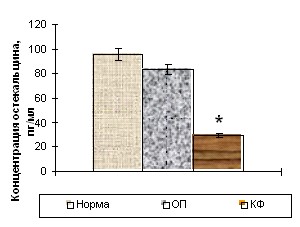 Уровень остекальцина Уровень остекальцина | 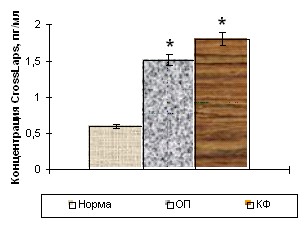 Уровень CrossLaps Уровень CrossLaps |
Примечание * – достоверность различий с нормой при р<0,01.
Рисунок 5. Уровни остеокальцина и С-телопептидов коллагена I типа (CrossLaps) в сыворотке крови здоровых детей (n=15) и пациентов с травматической болезнью в острый период (n=15) и катаболическую фазу (n=15) периода развернутой клинической картины.
Концентрация остеокальцина сыворотки крови в катаболическую фазу снижалась как по отношению к норме более чем в 3 раза и в сравнении с острым периодом – на 60%. Концентрация же маркера остеогенной резорбции продолжала увеличиваться и в катаболическую стадию процесса.
Итак, механическое повреждение костной ткани уже в первые часы после травмы индуцирует резорбтивные процессы, приводя к дисбалансу остеогенеза и резорбции, интенсивность которой коррелирует со степенью нарушения локомоторной активности фагоцитов.
Учитывая, что риск перехода «физиологического» воспаления в инфекционный процесс во многом будет зависеть от функционального кинетического резерва фагоцитов важно было установить насколько эти клетки способны в условиях посттравматического воспаления отвечать на дополнительную хемотаксическую нагрузку бактериями и их дериватами.
С этой целью мы исследовали локомоторную функцию Нф у 134 детей с неосложненной и у 27 пациентов с осложненной механической травмой скелета. Контрольную группу составил 41 здоровый ребенок. В качестве хемоаттрактантов использовали вещества как бактериального, так и небактериального происхождения. Живые суточные бактериальные культуры Staphylococcus aureus, Escherichia coli, Proteus vulgaris, Pseudomonas aeruginosa, а также супернатанты нейтрофилов, полученные после инкубации с данными микроорганизмами (САН).
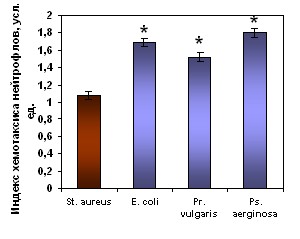
Изучаемые суточные культуры живых бактерий обладали выраженной хемотаксической активностью. Индекс хемотаксиса нейтрофилов здоровых детей к бактериям достоверно превышал уровень их спонтанного радиального движения. Аналогичные изменения хемотаксиса нейтрофилов здоровых детей нами зарегистрированы и к САН (рис. 6).
 Хемотаксис нейтрофилов к живым суточным культурам бактерий Хемотаксис нейтрофилов к живым суточным культурам бактерий |  Хемотаксис нейтрофилов к супернатантам нейтрофилов доноров, активированных живыми бактериями Хемотаксис нейтрофилов к супернатантам нейтрофилов доноров, активированных живыми бактериями |
Примечание * – достоверность различий с контролем при р<0,01.
Рисунок 6. Хемотаксиса нейтрофилов здоровых детей (n=41) к живым суточным культурам бактерий и к супернатантам нейтрофилов доноров, полученных после инкубации с различными видами живых суточных культур бактерий.
После часовой инкубации нейтрофилов с живыми бактериями они утрачивали двигательную активность к бактериям того вида, которые они фагоцитировали, но при этом сохраняли способность целенаправленного движения в сторону других микроорганизмов (рис. 7). Напротив, САН, полученные при активации бактериями, вызывали выраженный положительный хемотаксис интактных нейтрофилов.
 Хемотаксис нейтрофилов здоровых детей, инкубированных со St. aureus Хемотаксис нейтрофилов здоровых детей, инкубированных со St. aureus |  Хемотаксис нейтрофилов здоровых детей, инкубированных со E. coli Хемотаксис нейтрофилов здоровых детей, инкубированных со E. coli |
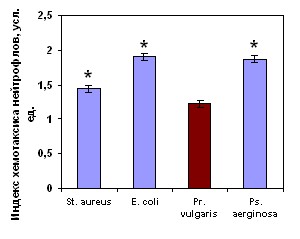 Хемотаксис нейтрофилов здоровых детей, инкубированных с Pr. vulgaris Хемотаксис нейтрофилов здоровых детей, инкубированных с Pr. vulgaris | 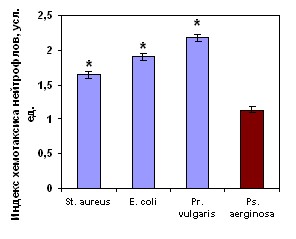 Хемотаксис нейтрофилов здоровых детей, инкубированных с Ps. aeruginosa Хемотаксис нейтрофилов здоровых детей, инкубированных с Ps. aeruginosa |
Примечание * – достоверность различий с контролем при р<0,01.
Рисунок 7. Индекс хемотаксиса нейтрофилов периферической крови здоровых детей (n=41), инкубированных с различными видами бактерий, к живым суточным культурам бактерий.
Наблюдаемые нами эффекты действия секреторных продуктов нейтрофилов на хемотаксическую реакцию донорских клеток, свидетельствуют с одной стороны, о том, что «запредельная бактериальная инвитровая нагрузка» приводит к блокаде рецепторов и развитию двигательного «паралича» именно к конкретному возбудителю – бактерии, а с другой – к секреции продуктов с кинетикотропной активностью именно к тому «микробу-контактеру».
В процессе фагоцитоза бактерий происходит изменение хемотаксической активности нейтрофилов не только здоровых детей, но и пациентов с травматической болезнью, в том числе при развитии гнойно-воспалительных осложнений. При этом характер хемотаксической реакции клеток и к живым бактериям, и к САН, полученным при стимуляции бактериями, является однотипным.
САН с кинетикотропным действием являются элементом саногенеза в патогенезе травматической болезни. Они, усиливая избирательно локомоторную функцию фагоцитов в отношении этиологического фактора, вызвавшего гнойно-воспалительный процесс, эффективно противостоят антифагоцитарному эффекту бактерий. Именно поэтому, течение травматической болезни, как правило, благоприятное (по нашим данным в 88,08% случаев). Тем не менее, у части пациентов (12% случаев) гнойно-воспалительные осложнения все же развиваются. Одной из вероятных причин, по нашим данным, является подавление способности фагоцитов к продукции как неспецифических (цитокины), так и специфических (секреторные продукты нейтрофилов) регуляторов воспаления под действием дополнительных индукторов (бактерий и их дериватов). Неспособность фагоцитов отвечать на дополнительную стимуляцию, в особенности, бактериальную, связана с тем, что гиперпродукция цитокинов, гормонов и других индукторов воспаления, уже в раннем посттравматическом периоде приводит к острейшему энергетическому и пластическому дефициту. При этом многократно угнетается способность клеток секретировать необходимые в данных условиях и в данной ситуации факторы, эффективно регулирующие функциональную активность участников воспалительной реакции, потенцируя дефекты цитокиновой сети, которые сказываются на эффективности противомикробной защиты организма.
Коррекция таких дефектов, очевидно, может способствовать повышению эффективности профилактических и лечебных мер.
Традиционно в лечении хирургических инфекций основную ставку, помимо вскрытия и дренирования гнойного очага, делают на антимикробную терапию, в частности на антибиотики. Антибактериальные препараты (АБП), при явном приоритете этиотропной направленности своего действия, согласно полученных нами данных также влияют на продукцию цитокинов.
Исследуя влияние амоксиклава, гентамицина, линкомицина и цефотаксима в соответствующих концентрациях (0,15 мг/мл, 0,05 мг/мл, 0,1 мг/мл и 0,5 мг/мл) на продукцию цитокинов клетками периферической крови у детей в острый период травматической болезни, нами установлено их неоднозначные эффекты.
На фоне гиперпродукции ИЛ-1 амоксиклав, гентамицин и линкомицин индуцировали дальнейший рост спонтанной выработки ИЛ-1 (рис. 8). Наиболее выраженную стимуляцию продукции данного цитокина вызывал гентамицин. Аналогичные результаты были получены при оценке влияния анти-
 Спонтанная продукция ИЛ-1 под влиянием АБ Спонтанная продукция ИЛ-1 под влиянием АБ |  ЛПС-продукция ИЛ-1 под влиянием АБ ЛПС-продукция ИЛ-1 под влиянием АБ |
Примечание: # – достоверные различия с нормой при уровне значимости р<0,001, * – достоверные различия с продукцией без АБП при уровне значимости р<0,01.
Рисунок 8. Показатели спонтанной и ЛПС-стимулированной продукции ИЛ-1 клетками периферической крови здоровых (n=15) и травмированных детей (n=15) под действием антибактериальных препаратов.
биотиков и на ЛПС-стимулированную продукцию ИЛ-1. Добавление амоксиклава, гентамицина и линкомицина к культуре клеток достоверно увеличивало ЛПС-секрецию ИЛ-1. Исключение составил цефотаксим, под действием которого снижалась как спонтанная, так и ЛПС-стимулированная продукция ИЛ-1.
 Спонтанная продукция ИЛ-10 под влиянием АБ Спонтанная продукция ИЛ-10 под влиянием АБ |  ЛПС-продукция ИЛ-10 под влиянием АБ ЛПС-продукция ИЛ-10 под влиянием АБ |
Примечание: # – достоверные различия с нормой при уровне значимости р<0,01, * – достоверные различия с продукцией без АБП при уровне значимости р<0,05.
Рисунок. 9. Показатели спонтанной и ЛПС-стимулированной продукции ИЛ-10 клетками периферической крови здоровых (n=15) и травмированных детей (n=15) под действием антибактериальных препаратов.
Все антибиотики на фоне гиперпродукции ИЛ-10 в большей или меньшей степени стимулировали его спонтанную секрецию (рис. 9). Максимум стимуляции инициировал цефотаксим. ЛПС-стимулированная секреция ИЛ-10 под действием всех АБП также достоверно увеличивалась.
Уровень спонтанной и ЛПС-продукции ИЛ-8 под влиянием практически всех изучаемых антибиотиков не изменялся (рис. 10). Исключение составили гентамицин и линкомицин. Первый, из них, достоверно стимулировал спонтанный синтез цитокина, а второй – угнетал его ЛПС-продукцию. Подобная толерантность клеток к действию антибиотиков в отношении секреции ИЛ-8, на наш взгляд, обусловлена достаточно высоким уровнем его базальной и ЛПС-стимулированной продукции, уже в раннем посттравматическом периоде, что свидетельствует о «хемокиновой» гиперактивации in vivo.
 Спонтанная продукция ИЛ-8 под влиянием АБ Спонтанная продукция ИЛ-8 под влиянием АБ |  ЛПС-продукция ИЛ-8 под влиянием АБ ЛПС-продукция ИЛ-8 под влиянием АБ |
Примечание: # – достоверные различия с нормой при уровне значимости р<0,001, * – достоверные различия с продукцией без АБП при уровне значимости р<0,05.
Рисунок 10. Показатели спонтанной и ЛПС-стимулированной продукции ИЛ-8 клетками периферической крови здоровых (n=15) и травмированных детей (n=15) под действием антибактериальных препаратов.
 Спонтанная продукция ИЛ-4 под влиянием АБ Спонтанная продукция ИЛ-4 под влиянием АБ | 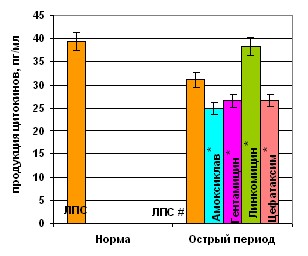 ЛПС-продукция ИЛ-4 под влиянием АБ ЛПС-продукция ИЛ-4 под влиянием АБ |
Примечание: # – достоверные различия с нормой при уровне значимости р<0,02, * – достоверные различия с продукцией без АБП при уровне значимости р<0,05.
Рисунок 11. Показатели спонтанной и ЛПС-стимулированной продукции ИЛ-4 клетками периферической крови здоровых (n=15) и травмированных детей (n=15) под действием антибактериальных препаратов.
Несколько иное влияние АБП оказывали на продукцию ИЛ-4 (рис. 11). Амоксиклав, гентамицин, линкомицин и цефотаксим угнетали его спонтанную и ЛПС-стимулированную продукцию. Исключение составил лишь линкомицин, который инициировал увеличение ЛПС-секреции ИЛ-4, восстанавливая ее до нормального уровня.
Продукция ИНФ- под действием антибактериальных препаратов практически не менялась.
Таким образом, изучаемые антибиотики являются модуляторами цитокин-продуктивной активности клеток, в первую очередь, фагоцитов, участвующих в формировании посттравматической воспалительной реакции. Амплитуда и направленность этой модуляции, безусловно, детерминирует и состояние эффекторного звена иммунитета, т. е. тех факторов, которые определяют устойчивость организма и непосредственно участвуют в элиминации патогена. В этой связи важно было определить возможность оценки функционального состояния фагоцитарного звена, в целом, и хемотаксиса в частности, в качестве интегрального критерия оценки эффективности этиотропной терапии. Для этой цели мы изучили влияние АБП на хемотаксис нейтрофилов периферической крови детей с травматической болезнью к живым суточным бактериальным культурам и изучаемым АПБ.
Установлено, что АБП инициируют положительную хемотаксическую реакцию нейтрофилов периферической крови здоровых детей и пациентов с неосложненной механической травмой, которая совпадает с таковой к живым суточным культурам бактерий, наиболее часто вызывающих хирургическую инфекции. Феноменологическое сходство целенаправленной двигательной активности нейтрофилов к бактериям и антибактериальным препаратам, на наш взгляд, обусловлено происхождением антибиотиков.
Интересные данные были получены при изучении влияния антибактериальных препаратов на двигательную активность нейтрофилов в условиях непосредственного контакта (табл. 3). Все исследуемые АБП достоверно угнетали целенаправленную двигательную активность нейтрофилов здоровых детей к ИЛ-1, ИЛ-8 и лейкинферону. Максимальный эффект оказывал амоксиклав.
Хемотаксис нейтрофилов к С5а-компоненту комплемента также угнетался под действием амоксиклава и линкомицина, только с меньшей амплитудой. Гентамицин и линкомицин не вызывали достоверных изменений хемотаксической реакции нейтрофилов к С5а.
Таблица 3.
Индекс хемотаксиса нейтрофилов периферической крови здоровых детей (n=41) к бактериям и небактериальным хемоаттрактантам под действием антибактериальных препаратов
| Хемоаттрактанты | Статистические показатели | Индекс хемотаксиса Нф без АБП (контроль), усл. ед., | Индекс хемотаксиса нейтрофилов под действием АБП, усл. ед. | |||
| Амоксиклав | Гентамицин | Линкомицин | Цефотаксим | |||
| С5а-комп. ком-та | M±m | 2,19±0,1 | 1,754±0,05* | 1,927±0,1 | 2,165±0,14 | 1,825±0,09* |
| ИЛ-1 | M±m | 2,32±0,11 | 1,429±0,05* | 1,569±0,12* | 1,639±0,09* | 1,713±0,14* |
| ИЛ-8 | M±m | 1,92±0,08 | 1,390±0,06* | 1,444±0,07* | 1,540±0,09* | 1,471±0,1* |
| Лейкинферон | M±m | 2,13±0,09 | 1,529±0,11* | 1,665±0,1* | 1,768±0,11* | 1,761±0,13* |
| St. aureus | M±m | 1,971±0,01 | 1,700±0,08* | 1,439±0,12* | 1,413±0,1* | 1,438±0,09* |
| E. coli | M±m | 1,356±0,03 | 1,591±0,04* | 1,703±0,02* | 1,487±0,03* | 1,916±0,1* |
| Pr. vulgaris | M±m | 1,590±0,001 | 1,305±0,13* | 1,285±0,1* | 1,418±0,1 | 1,277±0,08* |
| Ps. aeruginosa | M±m | 1,430±0,031 | 1,281±0,02* | 1,330±0,02* | 1,219±0,01* | 1,403±0,01 |
Примечание: *– достоверные различия с контролем при уровне значимости р<0,05.
Хемотаксический ответ нейтрофилов периферической крови здоровых детей на бактерии под влиянием антибиотиков отличался разнонаправленностью. Антибактериальные препараты в той и или иной степени вызывали угнетение хемотаксиса Нф к взвеси суточных культур стафилококка, протея и синегнойной палочки, при этом линкомицин максимально тормозил хемотаксис к стафилококку и синегнойной палочке, а цефотаксим – к протею. Противоположный эффект антибиотики оказывали на хемотаксический ответ Нф к взвеси суточной культуры E. coli. В отличие от грамположительных и других грамотрицательных бактерий, целенаправленная двигательная активность к ней нейтрофилов под действием всех исследуемых антибиотиков увеличивалась. Достоверно более высокий уровень хемотаксической реакции к E. coli инициировал цефотаксим.
Итак, антибиотики инициируют положительную хемотаксическую реакцию нейтрофилов периферической крови здоровых детей, которая совпадает с таковой к живым суточным культурам бактерий, являющихся, как правило, возбудителями хирургической инфекции. При непосредственном контакте с нейтрофилами периферической крови здоровых детей антибактериальные препараты оказывают блокирующее действие на целенаправленную двигательную активность данных клеток. Данный феномен, по нашему мнению, связан с тем, что, антибиотики конкурируют с бактериями и другими хемоаттрактантами за общие рецепторы нейтрофилов, количество которых на покоящихся клетках невелико, вызывая тем самым рецепторную блокаду и ослабление хемотаксической реакции нейтрофилов.
Локомоторная активность нейтрофилов периферической крови пациентов изменялась и после применения антибиотиков по поводу гнойно-воспалительных осложнений травматической болезни. Антибактериальные препаратов усугубляли развивающиеся после механического повреждения нарушения локомоторной функции нейтрофилов (табл. 4). Нами зарегистри-
Таблица 4.
Хемотаксис нейтрофилов периферической крови здоровых детей и пациентов с осложненным течением травматической болезни, получавших антибактериальные препараты
| Хемоаттрак- танты | Статистические показатели | Здоровые дети, (n=41) | Индекс хемотаксиса нейтрофилов пациентов с осложненной травмой (n=27), усл.ед. | |
| До приема АБП (контроль) | После приема АБП | |||
| С5а-компонент комплемента | M±m | 2,19±0,1 | 1,25±0,03* | 1,12±0,001* # |
| ИЛ-1 | M±m | 2,32±0,11 | 1,68±0,01* | 1,21±0,05* # |
| ИЛ-8 | M±m | 1,92±0,08 | 1,34±0,004* | 1,08±0,01* # |
| Лейкинферон | M±m | 2,13±0,09 | 1,51±0,005* | 1,17±0,001* # |
| Staphylococcus aureus | M±m | 1,971±0,017 | 1,856±0,09 | 1,283±0,001*# |
| Escherichia coli | M±m | 1,356±0,031 | 1,425±0,02 | 1,466±0,04 |
| Proteus vulgaris | M±m | 1,590±0,038 | 1,425±0,005* | 1,30±0,001* # |
| Pseudomonas aeruginosa | M±m | 1,430±0,031 | 1,555±0,07 | 1,236±0,001* # |
Примечание: * – достоверные различия с нормой при уровне значимости р<0,001, # – достоверные различия с контролем при уровне значимости р<0,001.
ровано достоверное снижение хемотаксической реакции к С5а, ИЛ-1, ИЛ-8 и лейкинферону, а также к живым суточным культурам стафилококка, протея и синегнойной палочки. Динамика уровня хемотаксиса нейтрофилов к кишечной палочке характеризовалась лишь тенденцией к повышению.
Таким образом, фагоциты, являющиеся универсальным эффектор гомеостаза, в условиях инфекционного воспаления при травме становятся еще и мишенью для негативного воздействия антибактериальных препаратов, что еще раз подтверждает необходимость коррекции функции этих клеток, в том числе и их двигательных нарушений при травматической болезни.
Эти обстоятельства и определили следующую задачу нашего исследования – определить возможность индивидуального подбора ряда иммунотерапевтических препаратов для коррекции нарушений миграционной способности фагоцитов у детей с травмой на основе результатов влияния их различных доз на хемотаксис клеток in vitro.
Исследования проведены у 30 здоровых детей и 91 ребенка с ТБ, которые были разделены на 4 группы: I группа – 30 детей – контрольная (с традиционным лечением), II группа – 30 пациентов получали на фоне традиционного лечения метилурацил (М), III группа – 15 детей, получавших нуклеинат натрия (НН) и IV группа – 25 детей, получавших АТФ.
Подбор больных в группы осуществлялся методом сплошной выборки. Группы сравнения были идентичны по возрасту, полу, характеру и течению травмы, по виду хирургического лечения (2>3,841). Выбор препаратов для иммунокорригирующей терапии был обусловлен их доступностью и низкой стоимостью препаратов, широким применением в клинической практике и отсутствием побочных эффектов.
Для оценки кинетикотропного эффекта препаратов in vitro использовали следующие концентрации: метилурацила –2,0, 1,5, 1,0, 0,5 мг/мл; нуклеината натрия – 0,3, 0,23, 0,15, 0,03 мг/мл, АТФ –1,0, 0,75, 0,5, 0,1 мг/мл среды 199. После 3-х (18-ти) часовой инкубации нейтрофилов и моноцитов с препаратом определялась его иммунотропная эффективность по отношению уровня показателя хемотаксиса до и после инкубации клеток с препаратом.
Прежде чем приступить к изучению влияния М, НН и АТФ на кинетическую функцию нейтрофилов и моноцитов периферической крови травмированных пациентов, мы исследовали действие препаратов in vitro на фагоциты здоровых детей.
Почти все исследуемые препараты у здоровых детей вызывали in vitro достоверное угнетение целенаправленной двигательной активности нейтрофилов.
Далее мы сопоставили степень нарушения кинетической функции нейтрофилов и моноцитов во всех исследуемых группах (показатель больного/показатель нормы – 1) 100%) с тяжестью посттравматического эндотоксикоза, оцениваемой по уровню лейкоцитарного индекса интоксикации, являющегося интегральным показателем, отражающим состояние иммунной системы в целом (табл. 5). Степень нарушения локомоторной функции нейтрофилов и моноцитов превышала 40%, что соответствовало второму уровню
Таблица 5.
Степень нарушения локомоторной функции фагоцитов и степень
тяжести эндотоксикоза в исследуемых группах пациентов
| Группы пациентов | Нейтрофилы | Моноциты | ЛИИ, усл. ед. | ||
| Индекс хемотаксиса, усл. ед | Степень нарушения функции, %. | Индекс хемотаксиса, усл. ед | Степень нарушения функции, %. | ||
| Здоровые дети (контроль), n=41 | 2,19±0,10 | – | 2,20±0,1 | – | 1,23±0,13 |
| I (n=30) | 1,31±0,01* | 40,18±1,09 | 0,91±0,001* | 58,64±3,56 | 4,39±1,08* |
| II (n=30) | 1,25±0,003* | 42,91±2,07 | 1,2±0,003* | 45,45±1,78 | 3,15±0,38* |
| III (n=15) | 1,2±0,001* | 42,92±3,36 | 1,16±0,001* | 46,95±3,16 | 3,01±0,37* |
| IV (n=25) | 1,27±0,008* | 42,15±2,58 | 1,0±0,001* | 54,54±2,28 | 4,32±0,7* |
Примечание: * – достоверные различия с контролем при р<0,01.
изменения данного параметра и позволяло отнести пациентов всех исследуемых групп к иммунологически компроментированным и нуждающимся в назначении иммунокорректоров. Все наблюдаемые нами пациенты имели тяжелую степень эндотоксикоза (ЛИИ превышал 3,0 усл. ед.). При оценке корреляционных взаимоотношений выявлена прямая связь (r= + 0,86, р<0,01) между хемотаксической функцией нейтрофилов и интоксикацией и обратная связь между интоксикацией и хемотаксисом моноцитов (r= – 0,95, р<0,01). Высокий уровень ЛИИ является дополнительным маркером посттравматической иммунодепрессии и подтверждает необходимость назначения корректоров с детоксицирующими свойствами.
Изучение влияния различных концентраций метилурацила, нуклеината натрия и АТФ на кинетическую функцию нейтрофилов и моноцитов периферической крови проводили у детей в острый период травматической болезни.
У всех 30 детей с травматической болезнью, у которых в последующем был применен метилурацил (табл. 6), в острый период обнаружено достоверное (р<0,001) снижение исходного уровня хемотаксиса нейтрофилов к стандартному хемоаттрактанту (С5а-компоненту комплемента) в 1,67 раза (степень изменения показателя – 42,9%), а моноцитов – в 1,86 раза (степень изменения показателя – 45,5%) в сравнении со здоровыми детьми. Лейкоцитарный индекс интоксикации – 3,15 усл. ед.
Таблица 6.
Индекс стимуляции хемотаксической функции фагоцитов различными концентрациями метилурацила in vitro (n=30)
| Фагоциты | Индекс стимуляции хемотаксиса фагоцитов (усл. ед.) под действием различных концентраций метилурацила | |||
| Концентрация препарата, мг/мл | ||||
| 2,0 | 1,5 | 1,0 | 0,5 | |
| Нейтрофилы | 1,154±0,08* | 1,173±0,08* | 1,092±0,1* | 1,581±0,1 |
| Моноциты | 1,097±0,07* | 1,069±0,08* | 1,266±0,13 | 1,568±0,09 |
Примечание: * – достоверные различия минимальной концентрации препарата с более высокими, при уровне значимости р<0,01.
Максимальным стимулирующим эффектом на сниженную локомоторную функцию, как нейтрофилов, так и моноцитов, обладала минимальная концентрация метилурацила – 0,5 мг/мл, которая эффективно стимулировала угнетенный хемотаксис в 21 наблюдений на модели нейтрофилов и у 19 пациентов – на модели моноцитов. Из них у 9 пациентов кинетическая активность ПМЯЛ и у 5 – моноцитов усиливалась и под влиянием более высоких концентраций метилурацила. Однако, ее уровень не достигал величины показателей хемотаксиса, индуцированного минимальной дозой препарата.
У всех 15 пациентов, которые впоследствии получали НН (табл. 7), в остром периоде после травмы мы также регистрировали достоверное (р<0,001) снижение исходного уровня хемотаксиса нейтрофилов к стандартному хемоаттрактанту в 1,75 раза (степень изменения показателя – 42,9%), а моноцитов – в 2,02 раза (степень изменения показателя – 47%) в сравнении со здоровыми детьми и высокий ЛИИ – 3,01 усл. ед.
Таблица 7.
Индекс стимуляции хемотаксической функции фагоцитов различными концентрациями нуклеината натрия in vitro
| Фагоциты | Индекс стимуляции хемотаксиса фагоцитов (усл. ед.) под действием различных концентраций нуклеината натрия | |||
| Концентрация препарата, мг/мл | ||||
| 0,3 | 0,23 | 0,15 | 0,03 | |
| Нейтрофилы | 1,161±0,12* | 1,143± 0,11* | 1,154±0,13* | 1,73±0,13 |
| Моноциты | 1,143±0,21* | 1,25±0,08* | 1,251±0,19 | 1,75±0,18 |
Примечание: * – достоверные различия минимальной концентрации препарата с более высокими, при уровне значимости р<0,01.
Максимальный стимулирующий эффект на угнетенную двигательную функцию нейтрофилов и моноцитов НН оказывал в минимальной концентрации – 0,03 мг/мл. У 6 пострадавших кинетическую функцию усиливали и более высокие концентрации препарата. Однако, ее уровень не достигал показателей целенаправленной миграции, индуцированной минимальной дозой препарата.
У пациентов IV наблюдаемой группы с механической травмой (табл. 8), получавших АТФ, в остром периоде выявлено достоверное (р<0,001) снижение направленной миграции нейтрофилов в 1,58 раза (степень нарушения хемотаксиса – 42,2%), а моноцитов – в 2,32 раза (степень нарушения функции – 54,5%) и высокий лейкоцитарный индекс интоксикации – 4,32 усл. ед.
Таблица 8.
Индекс стимуляции хемотаксической функции фагоцитов различными концентрациями АТФ in vitro
| Фагоциты | Индекс стимуляции хемотаксиса фагоцитов (усл. ед.) под действием различных концентраций АТФ | |||
| Концентрация препарата, мг/мл | ||||
| 1,0 | 0,75 | 0,5 | 0,1 | |
| Нейтрофилы | 1,42±0,11* | 1,17± 0,07* | 1,23±0,09* | 2,13±0,08 |
| Моноциты | 1,43±0,13* | 1,48±0,13* | 1,5±0,23* | 2,5±0,18 |
Примечание: * – достоверные различия минимальной концентрации препарата с более высокими, при уровне значимости р<0,01.
Максимальную стимуляцию угнетенной кинетической функции нейтрофилов в 22 наблюдениях и моноцитов – в 21 случаях вызывала минимальная концентрация АТФ – 0,1 мг/мл.
Восстановление хемотаксиса фагоцитов периферической крови под действием той или иной концентрации метилурацила, нуклеината натрия и АТФ in vitro мы расценивали как критерий, отражающий положительное действие этого препарата в указанной дозе. Поэтому в выборе дозы для лечения пациентов мы ориентировались на максимальный уровень инвитровой стимуляции хемотаксической функции нейтрофилов. Как правило, это были низкие концентрации препарата (метилурацил – в 93% случаев, нуклеинат натрия – в 95% наблюдений, АТФ – в 96% случаев).
Для расчета лечебной дозы использовалась концентрация препарата, которая in vitro вызывала максимальную инициацию двигательной активности, как нейтрофилов, так и моноцитов. Расчет индивидуальной дозы препарата осуществляли по формуле1 (Чукичев А.В., 1984):
0,075Н(М)СmV
D= ––––––––––––––––––––, где
108
D – доза препарата (мг); 75 – объем крови на 1 кг массы тела в (мл/кг); m – масса тела (кг); С – концентрация исследуемого препарата в качестве хемокина (мг/мл); Н(М) – количество клеток в 1 мл крови (клеток/мл); 108 – количество клеток в лунке; V – объем лунки (0,02 мл).
Индивидуальные подобранные дозы метилурацила и нуклеината натрия назначали per os трехкратно в течение 10 дней, АТФ – в/мышечно, однократно в течение 10 дней.
Максимально высокий процент совпадений действия индивидуально подобранных доз in vitro и in vivo отмечен у метилурацила и АТФ на модели «препарат + нейтрофилы» (табл. 9).
Оценку собственно эффекта иммунокорректоров по абсолютным значениям показателей локомоторной функции фагоцитов и ЛИИ проводили по формуле – [(Рис – Рm) : Рис] – [(Рис – Рм) : Рис]100%, (Земсков А.М., 2006), где
Р ис – значение параметра в абсолютных величинах до начала лечения, Р т – то же после традиционной терапии, Р м – то же, после проведения традиционного лечения с модулятором.
Таблица 9.
Результаты применения индивидуально подобранных доз препаратов и собственного эффекта иммунокорректора
| Группа | Препарат | % совпадения действия индивидуальной подобранных доз препаратов iv vitro и in vivo на модели: | Собственный эффект иммунокорректора по абсолютным значениям показателей (%): | |||
| нейтрофилов | моноцитов | хемотаксиса нейтрофилов | хемотаксиса моноцитов | ЛИИ | ||
| II | М | 96,67 | 93,33 | 91 | 43 | – 41 |
| III | НН | 93,33 | 93,33 | 91 | 65 | – 33,5 |
| IV | АТФ | 96 | 92 | 139 | 65 | – 86 |
Наибольший вклад в восстановление хемотаксиса данных клеток и нормализацию лейкоцитарного индекса интоксикации отмечен у АТФ, при этом более активно на коррекцию реагировало нейтрофильное звено, что опосредованно приводило к нормализации ЛИИ. Эффект метилурацила и нуклеината натрия был аналогичен АТФ по направленности, но отличался меньшей амплитудой.
Для сравнительной оценки эффективности традиционного лечения и предлагаемой технологии с использованием способа подбора индивидуальных доз иммунотропных препаратов мы изучали: лабораторные критерии – показатели кинетической функции фагоцитов, лейкоцитарный индекс интоксикации; эффективность профилактического действия препаратов, с вычислением показателя защищенности = (1 – Р1/Р2) 100%, где Р1 – количество пациентов с осложнениями (в %) в опытной группе, Р2 – количество пациентов с осложнениями (в %) в контрольной группе (Семененко Т.Н., 1987); безопасность применения препаратов, о которой судили по отсутствию побочных реакций (аллергические проявления, зуд, жжение, недомогание, головная боль, отрицательная динамика гематологических параметров).
Таблица 10.
Показатели кинетической функции фагоцитов и ЛИИ у пациентов с травматической болезнью, получавших различные кинетикотропные препараты
| Показатели | Группы пациентов | |||
| I (n=30) (традиционное лечение) контроль | II (n=30) (традиционное лечение + М) | III (n=15) (традиционное лечение + НН) | IV (n=25) (традиционное лечение + АТФ) | |
| Индекс хемотаксиса нейтрофилов до лечения, усл.ед. | 1,31±0,01 | 1,25±0,003 | 1,2±0,001 | 1,27±0,008 |
| Индекс хемотаксиса нейтрофилов после лечения, усл.ед. | 1,57±0,004# | 2,71±0,13*# | 2,65±0,17*# | 3,33±0,16*# |
| ИС хемотаксиса нейтрофилов in vitro (min доза препарата), усл. ед. | – | 1,58±0,1 | 1,73±0,13 | 2,13±0,08 |
| ИС хемотаксиса нейтрофилов in vivo (инд. доза препарата), усл. ед. | 0,89±0,05 | 2,21±0,13*# | 2,34±0,21*# | 2,68±0,13*# |
| Индекс хемотаксиса моноцитов до лечения, усл.ед. | 0,91±0,001 | 1,2±0,003 | 1,16±0,06 | 1,0±0,005 |
| Индекс хемотаксиса моноцитов после лечения, усл.ед. | 1,75±0,05# | 2,27±0,08*# | 2,5±0,21*# | 2,4±0,1*# |
| ИС хемотаксиса моноцитов in vitro (min доза препарата), усл. ед. | – | 1,57±0,09 | 1,75±0,18 | 2,5±0,19 |
| ИС хемотаксиса моноцитов in vivo (инд. доза препарата), усл. ед. | 1,4±0,12 | 1,91±0,1*# | 2,0±0,20* | 2,6±0,21* |
| ЛИИ до лечения, усл.ед. | 4,39±1,08 | 3,15±0,38 | 3,01±0,37 | 4,32±0,7 |
| ЛИИ после лечения, усл. ед. | 3,23±0,43 | 1,93±0,17*# | 2,07±0,15*# | 1,81±0,26*# |
| Показатель защищенности, % | – | 100 | 100 | 70 |
Примечание: * – достоверные различия с контролем при р<0,05, # – достоверные различия средних исследуемых величин с аналогичными показателями до коррекции при р<0,05.
Исследования показали (табл. 10), что при традиционном способе лечения (без корректоров) происходило достоверное усиление хемотаксиса, как нейтрофилов, так и моноцитов, однако показатели локомоторной реакции данных клеток не восстанавливались до уровня здоровых детей. При этом уровень эндотоксикоза оставался значительным.
Применение в схеме традиционной терапии травматической болезни индивидуально подобранных доз иммунокорректоров способствовало не только восстановлению, но и стимуляции хемотаксической функции фагоцитов и нормализации показателя эндотоксикоза. Максимальный эффект стимуляции хемотаксиса фагоцитов и нормализации ЛИИ отмечен под влиянием АТФ. При этом индекс стимуляции хемотаксиса фагоцитов in vivo (индивидуальная доза) почти во всех наблюдениях превосходил аналогичный in vitro. Более высокий показатель защищенности демонстрировали метилурацил и нуклеинат натрия.
Ни в одном случае применения метилурацила, нуклеината натрия и АТФ в индивидуально подобранных дозах не было отмечено ни местных, ни общих побочных реакций, не зарегистрировано также отрицательной динамики гематологических параметров. После 10-дневного курса корригирующей терапии пациенты находились под наблюдением в течение месяца.
Выводы
- В процессе развития травматической болезни у детей формируется иммунодефицитное состояние, характеризующееся изменением клеточного и гуморального звеньев иммунной системы, наиболее выраженном в остром периоде болезни и при развитии гнойно-воспалительных осложнений.
- Клетки периферической крови здоровых детей обладают цитокин-продуцирующей активностью. Стандартные митогены стимулируют продукцию цитокинов, амплитуда и направленность которой имеют феноменологическое сходство у оппозитных пулов цитокинов, что свидетельствует о состоятельности регуляторных и эффекторных функций цитокиновой системы в норме. Механическое повреждение костной ткани индуцирует гиперпродукцию провоспалительных цитокинов и развитие дисбаланса в цитокиновой регуляторной сети, преимущественно в системе хемокиновых интерлейкинов.
- Нейтрофилы и моноциты периферической крови здоровых детей проявляют выраженную хемотаксическую активность к таким регуляторам иммунного воспаления как ИЛ-1, ИЛ-2, ИЛ-8, ГМ-КСФ, смесь ИНФ2(c)2(d), лейкинферон, А5-фракция пептидосодержащих секреторных продуктов нейтрофилов, активированных латексом, к живым суточным культурам бактерий, наиболее часто вызывающих хирургическую инфекцию, к антибактериальным препаратам – амоксиклаву, гентамицину, линкомицину, цефотаксиму. Непосредственный контакт биорегуляторов, микроорганизмов и антибактериальных препаратов вызывает двигательную деактивацию данных клеток.
- Механическая деструкция костной ткани приводит к угнетению хемотаксиса и хемокинеза нейтрофилов и моноцитов как к стандартному хемоаттрактанту, так и к изучаемым провоспалительным цитокинам, наиболее выраженному в остром периоде травматической болезни и при развитии гнойно-воспалительных осложнений. Развивающаяся системная мобилизационная блокада фагоцитов детерминирована гиперпродукцией провоспалительных цитокинов, в частности, хемокинов.
- Увеличение концентрации кальцитонина и С-телопептидов коллагена I типа и снижение уровня остеокальцина в сыворотке крови детей с травматической болезнью свидетельствуют об усилении процессов костной резорбции и угнетении способности к остеобразованию с максимальной выраженностью в катаболическую фазу посттравматического периода.
- Локомоторные дисфункции фагоцитов, развивающиеся в посттравматическом периоде у детей, обусловливают интенсивность резорбтивных процессов, которая коррелирует с уровнем продукции провоспалительных цитокинов.
- В условиях контакта с микроорганизмами, вызывающими двигательный «паралич» нейтрофилов, данные клетки секретируют продукты, избирательно усиливающие их локомоторную функцию в отношении этиологического фактора, вызвавшего гнойно-воспалительный процесс в поврежденной ткани.
- Антибактериальные препараты, применяемые в качестве средств этиотропной терапии при лечении гнойно-воспалительных осложнений травматической болезни у детей, приводят к цитокин-продуктивной активности фагоцитов, что усугубляет двигательные дисфункции данных клеток.
- Препараты с иммунотропной активностью (метилурацил, нуклеинат натрия и АТФ) вызывают снижение целенаправленной двигательной активности нейтрофилов и моноцитов in vitro у здоровых детей и обладают выраженным кинетикостимулирующим действием на фагоциты детей с травматической болезнью.
- Максимальная эффективность кинетикостимулирующего действия метилурацила, нуклеината натрия и АТФ достигается подбором индивидуальной дозы, основанном на оценке хемотаксиса фагоцитов к стандартному хемоаттрактанту под действием его различных концентраций in vitro, что позволяет оптимизировать процесс лечения больных с повреждением опорно-двигательного аппарата.
Практические рекомендации
- Для комплексной оценки иммунных дисфункций при травматической болезни у детей мы рекомендуем исследование цитокинового профиля, который обязательно должен включать хемокиновые интерлейкины (ИЛ-8, ИЛ-4 и др.).
- Для оценки репаративных процессов и выраженности остеогенной резорбции при механической травме необходимо исследование маркеров костного ремоделирования и резорбции в динамике болезни.
- С целью своевременной диагностики дефектов целенаправленной миграции фагоцитов при травме и проведении патогенетически обоснованного лечения рекомендуется проводить исследование хемотаксической активности (спонтанной миграции, хемокинеза и хемотаксиса) нейтрофилов и моноцитов в острый период болезни
- При обнаружении в раннем посттравматическом периоде нарушений хемотаксической активности фагоцитов необходимо назначение препаратов с кинетикотропной свойствами. При выборе таких препаратов целесообразно ориентироваться на действие их различных концентраций на хемотаксическую активность фагоцитов in vitro. При клиническом применении препарата целесообразно использовать концентрацию препарата, оказывающую максимальный кинетикотропный эффект. Лечебная доза определяется с обязательным учетом этой концентрации, абсолютного количества нейтрофилов (моноцитов) крови, ОЦК и массы тела по предлагаемой формуле:
0,075Н(М)СmV
D = –––––––––––––––––––––, где
108
D – доза препарата (мг), 0,075 – объем крови на 1 кг массы тела в л/кг; m – масса тела (кг); С – концентрация исследуемого препарата (мг/мл); Н(М) – количество клеток в 1 мл крови (клеток/мл); 108 – количество клеток в лунке; V – объем лунки (0,02 мл).
- При развитии гнойно-воспалительных осложнений травматической болезни и назначении антибактериальных препаратов необходимо в схему традиционной терапии включать препараты с кинетикотропной активностью.
Список работ, опубликованных по теме диссертации
- Злакоманова, О.Н. Влияние травмы на спонтанную миграцию фагоцитов / О.Н. Злакоманова // Факторы клеточного и гуморального иммунитета при различных физиологических и патологических состояниях: тез. докл. XIV Рос. науч. конф. – Челябинск, 2000. – 40 с.
- Студеникина, Ю.Н. Локомоторные реакции нейтрофилов в ответ на бактериальные хемоаттрактанты / Ю.Н. Студеникина, О.Н. Злакоманова, А.В. Чукичев, А.В. Зурочка, А.Н. Котляров // Факторы клеточного и гуморального иммунитета при различных физиологических и патологических состояниях: тез. докл. XIV Рос. науч. конф. – Челябинск, 2000. – 113 с.
- Студеникина, Ю.Н. Исследование специфического реагирования нейтрофилов в ответ на бактериальные хемоаттрактанты как метод идентификации возбудителя хирургической инфекции / Ю.Н. Студеникина, А.В. Чукичев, А.В. Зурочка, О.Н. Злакоманова // Актуальные проблемы медицинской науки и профессионального образования: тр. науч. сессии ЧелГМА. – Челябинск, 2000. – С. 20-22.
- Чукичев, А.В. Прогнозирование эффективности нуклеината натрия у детей с травматической болезнью / А.В. Чукичев, О.Н. Злакоманова // Современные технологии в биологии и медицине: материалы конф., посвящ. 20-летию ЦНИЛ ЧелГМА / под ред. В.В. Турыгина, А.В. Зурочки, А.В. Чукичева. – Челябинск, 2000. – С. 93-95.
- Злакоманова, О.Н. Стимуляция хемотаксической активности фагоцитов у детей с переломами трубчатых костей препаратом АТФ / О.Н. Злакоманова, А.В. Чукичев, А.В. Зурочка // Новые технологии и фундаментальные исследования в медицине: материалы III Рос. межрегион. конф., посвященной 60-летнему юбилею ЧелГМА – Челябинск, 2002. – С. 87-88.
- Злакоманова, О.Н. Хемокинетикотропные свойства АТФ / О.Н. Злакоманова, А.В. Чукичев, А,В. Зурочка // Гомеостаз и инфекционный процесс: Тез. докл. III Общерос. конф. с междунар. участием. – Сочи, 2002. – 42 с.
- Злакоманова, О.Н. Подбор индивидуальной дозы препаратов для коррекции дефектов хемотаксиса у детей с травматической болезнью / О.Н. Злакоманова, А.В. Чукичев, А.В. Зурочка // Актуальные вопросы аллергологии и иммунологии в педиатрии. Материалы Российской научно-практической конференции. – Оренбург, 2003. – С. 73-74.
- Зурочка, А.В. Цитокиновая регуляция миграционной активности фагоцитов при травматической болезни у детей / А.В. Зурочка, А.В. Чукичев, О.Н. Злакоманова // Актуальные вопросы аллергологии и иммунологии в педиатрии: Материалы Рос. науч.-практ. конф. – Оренбург, 2003. – С. 95-97.
- Злакоманова, О.Н. Подбор индивидуальной дозы иммунопрепаратов для коррекции дефектов хемотаксиса у детей с травматической болезнью / О.Н. Злакоманова, А.В. Чукичев, А.В. Зурочка // Биохимия: от исследования молекулярных механизмов – до внедрения в клиническую практику и производство: материалы межрегион. конф.биохимиков Урала, Западной Сибири и Поволжья / под ред. В.П. Твердохлиба. Оренбург, Юж. Урал, 2003. – С. 489-491.
- Злакоманова, О.Н. Посттравматические дефекты кинетических функций фагоцитов / О.Н. Злакоманова // Мед. иммунология. – 2003. – Т.5, № 3-4. – 398.
- Злакоманова, О.Н. Коррекция нарушений миграционной функции фагоцитов у детей с травматической болезнью препаратом АТФ / О.Н. Злакоманова, А.В. Чукичев, А.В. Зурочка // Мед. иммунология. – 2003. – Т.5, № 3-4. – 399 с.
- Злакоманова, О.Н. Двигательные нарушения фагоцитов у детей с травмой / О.Н. Злакоманова, А.В. Чукичев, А.В. Зурочка // Проблемы популяционного здоровья: материалы 1-й междунар. конф. – Челябинск; Монреаль, 2003. – С. 110-112.
- Чукичев, А.В. Исследование локомоторной функции фагоцитов – перспективный путь оптимизации диагностики и лечения заболеваний / А.В. Чукичев, О.Н. Злакоманова, А.В. Зурочка // Актуальные проблемы медицинской науки и практического здравоохранения: тр. науч.-практ. конф. –. Трехгорный, 2003. – С. 53-55.
- Злакоманова, О.Н. Двигательные дисфункции фагоцитов у детей с травматической болезнью и их коррекция метилурацилом и АТФ / О.Н. Злакоманова, А.В. Чукичев, А.В. Зурочка // Материалы III конференции иммунологов Урала. – Челябинск, 2003. – № 1(3). – 89 с.
- Злакоманова, О.Н. Использование хемотаксического метода исследования для подбора дозы и оценки эффективности иммунотропных препаратов у детей с травматической болезнью / О.Н. Злакоманова, А.В. Чукичев, А.В. Зурочка // Вестн. Акад. Рос. энциклопедий. – 2003. – № 4(10). – С. 57-59.
- Злакоманова, О.Н. Влияние цитокинов на хемотаксис фагоцитов при травме / О.Н. Злакоманова // Объединенный Иммунологический Форум: тез. докл. – Екатеринбург, 2004. – С. 58.
- Злакоманова, О.Н. Обоснование применения АТФ в лечении детей с травматической болезнью / О.Н. Злакоманова, А.В. Чукичев, А.В. Зурочка // Современные проблемы диагностики и лечения дисбактериозов: материалы конф., посвящ. 10-летию НПЦ диагностики, лечения и профилактики дисбактериозов НИИ иммунологии ЧелГМА и 60-летию ГОУ ВПО “Челябинская государственная медицинская академия МЗ РФ”. – Челябинск, 2004. – С. 71-73.
- Злакоманова, О.Н. Влияние антибиотиков на хемотаксическую функцию нейтрофилов / О.Н. Злакоманова, А.В. Чукичев, А.В. Зурочка, Е.А. Елизарьева // Мед. иммунология. – 2004. – Т.6, № 3-5. – С. 230-231.
- Злакоманова, О.Н. Хемокинетикотропные эффекты антибиотиков / О.Н. Злакоманова, А.В. Чукичев, А.В. Зурочка, Е.А. Елизарьева // Актуальные проблемы медицинской науки и практического здравоохранения: тр. науч. сессии, посвящ. 60-летию ЧелГМА. – Челябинск, 2004. – С. 141-144.
- Злакоманова, О.Н. Хемотаксический ответ нейтрофилов, инкубированных с антибиотиками / О.Н. Злакоманова, А.В. Зурочка, А.В. Чукичев, Т.В. Журавлева, П.П. Городечный // Материалы IV конференции иммунологов Урала. – Уфа, 2005. – № 1(4). – С. 130-131.
- Злакоманова, О.Н. Регуляторные эффекты цитокинов при исследовании двигательных функций фагоцитов у детей с травматической болезнью / О.Н. Злакоманова, А.В. Чукичев, А.В. Зурочка // Цитокины и воспаление. – 2006. – Т. 5, № 2. – С. 30-36.
- Долгушин, И.И. Хемотаксис фагоцитов: клиническое значение / И.И. Долгушин, А.В. Зурочка, А.В. Чукичев, О.Н. Злакоманова. – Челябинск: Изд-во ЧелГМА, 2006. – 183 с.
- Злакоманова, О.Н. Хемотаксис фагоцитов: значение в подборе индивидуальной дозы лекарственного препарата для коррекции локомоторных дисфункций фагоцитов у детей с травмой / О.Н. Злакоманова, А.В. Зурочка, А.В. Чукичев // Мед. иммунология. – 2007. – Т. 9, № 4-5. – С. 479-493.
- Злакоманова, О.Н. Подбор индивидуальной дозы и оценка эффективности иммунотропных препаратов у детей с травматической болезнью с использованием хемотаксического метода исследования / О.Н. Злакоманова // Дет. хирургия. – 2007. – № 6. – С. 6-9.
- Чукичев, А.В. Дисбаланс цитокинов и состояние маркеров костного метаболизма в посттравматическом периоде у детей / А.В. Чукичев, И.И. Долгушин, О.Н. Злакоманова, Ю.И. Чепуров // Дет. хирургия. – 2007. – № 6. – С. 9-13.
- Злакоманова, О.Н. Оценка хемокинетикотропной активности антибиотиков в норме и при гнойно-воспалительных осложнениях травматической болезни у детей / О.Н. Злакоманова // Вестн. новых мед. технологий. – 2008. – № 1-3. – С. 112-116.
- Злакоманова, О.Н. Исследование цитокинового профиля у детей с травматической болезнью под действием антибактериальных препаратов / О.Н. Злакоманова // Вестн. новых мед. технологий. – 2008. – № 4-6. – С. 108-110.
- Злакоманова, О.Н. Состояние системы цитокинов у детей с травматической болезнью / О.Н. Злакоманова // Травматология и ортопедия России. – 2008. – № 4-6. – С. 65-71.

