Направленный поиск и фармакологические свойства веществ с антиоксидантной активностью среди конденсированных и неконденсированных производных бензимидазола
На правах рукописи
ТИБИРЬКОВА ЕЛЕНА ВИКТОРОВНА
НАПРАВЛЕННЫЙ ПОИСК И ФАРМАКОЛОГИЧЕСКИЕ
СВОЙСТВА ВЕЩЕСТВ С АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ СРЕДИ КОНДЕНСИРОВАННЫХ И НЕКОНДЕНСИРОВАННЫХ ПРОИЗВОДНЫХ БЕНЗИМИДАЗОЛА
14.03.06 – фармакология, клиническая фармакология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
ВОЛГОГРАД – 2010
Работа выполнена в ГОУ ВПО «Волгоградский государственный медицинский университет Росздрава»
Научный руководитель: Член-корреспондент РАМН,
Заслуженный деятель науки РФ,
доктор медицинских наук,
профессор
Спасов Александр Алексеевич
Официальные оппоненты: доктор медицинских наук,
профессор
Островский Олег Владимирович
доктор медицинских наук,
профессор
Макляков Юрий Степанович
Ведущая организация: ГОУ ВПО «Саратовский государственный
медицинский университет Росздрава»
Защита состоится «____»________________2010 г. в _____ ч. на заседании Диссертационного Совета Д 208.008.02 при ГОУ ВПО «Волгоградский государственный медицинский университет Росздрава» по адресу: 400131, г. Волгоград, пл. Павших борцов, 1
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Волгоградский государственный медицинский университет Росздрава»
Автореферат разослан «____»_________________ 2010 г.
Ученый секретарь
Диссертационного Совета,
доктор медицинских наук,
профессор А.Р. Бабаева
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Свободнорадикальное окисление играет важную роль как в нормальной жизнедеятельности клеток, так и в развитии патологического процесса [Моругова Т.В., Лазарева Д.Н., 2000; Бульон В.В. и др., 2006]. Избыточная продукция свободных радикалов и (или) нарушение функционирования антиоксидантной системы рассматриваются в качестве одних из наиболее значимых факторов патогенеза старения [Голубев А.Г., 2003; Арутюнян А.В., Козина Л.С., 2009; Golden T.R. et al., 2002], сердечно-сосудистых заболеваний [Неверов И.В., 2001; Капелько В.И., 2003; Ланкин В.З. и др., 2004; Ковалева О.Н. и др., 2005; Tardif J.C., 2005], бронхолегочной патологии [Фархутдинов У.Р., Фархутдинов Р.Р., 2000; Камышников В.С., 2003], заболеваний печени [Девяткина Т.А. и др., 2003; Камышников В.С., 2003], нейродегенеративных заболеваний [Федин А.И., 2002; Дзюба А.Н., Сорокин Ю.Н., 2004; Катунина Е.А., 2005; Bonnefont-Rousselot D. et al., 2000; Buhmann C. et al., 2004], ишемии мозга и поражения нейронов [Зозуля Ю.А. и др., 2000; Спасов А.А. и др., 2003; Бизенкова М.Н. и др., 2006], сахарного диабета и его сосудистых осложнений [Балаболкин М.И., Клебанова Е.М., 2000; Бардымова Т.П. и др., 2006; Vincent A.M. et al., 2004] и т.д.
Важную роль в клинической практике играют антиоксидантные средства, способные поддерживать структурный гомеостаз организма в условиях патологии [Шанин Ю.Н., 2003; Меньщикова Е.Б. и др., 2008; Gutterjdge J.M.C., Halliwell B.H., 2000; Guerra E.J., 2001]. Однако, несмотря на широкий спектр препаратов для подавления реакций свободнорадикального окисления, возникают проблемы, связанные с использованием существующих средств, такие как токсичность некоторых фенольных антиоксидантов, вытеснение эндогенных антиоксидантов при использовании синтетических соединений и т.д. [Оковитый С.В., 2003; Шанин Ю.Н., 2003; Лукк М.В. и др., 2008]. В связи с этим является актуальным поиск новых антиоксидантных веществ, на основе которых могут быть созданы лекарственные препараты для лечения заболеваний, сопровождающихся избыточной активацией процессов пероксидации.
Производные бензимидазола имеют -электронноизбыточную структуру, что позволяет предполагать наличие у них антиоксидантной активности [Авдюнина Н.И., 1979; Пожарский А.Ф., 1985; Анисимова В.А. и др., 1996]. На протяжении ряда лет на кафедре фармакологии и в НИИ фармакологии Волгоградского государственного медицинского университета широко исследуются различные виды биологической активности данного класса соединений, в том числе показана их способность ингибировать свободнорадикальные реакции [Спасов А.А., 1983; Островский О.В., 1996; Косолапов В.А., 2005]. Учитывая вышесказанное, были проведены поиск новых высокоактивных антиоксидантных веществ среди конденсированных и неконденсированных производных бензимидазола и изучение их влияния на процессы пероксидации при различных патологических состояниях.
Диссертационная работа выполнена в рамках Федеральной целевой научно-технической программы «Исследования и разработки по приоритетным направлениям развития науки и техники гражданского назначения» (№ государственной регистрации 01200116045), является составной частью научно-исследовательской программы «Поиск, разработка и фармакологическое изучение веществ, проявляющих антиоксидантные свойства» (№ государственной регистрации 01200609434), включенной в план НИР Волгоградского государственного медицинского университета. Тема работы утверждена на заседании Учёного Совета Волгоградского государственного медицинского университета (протокол № 8 от 20.04.2007 г.).
Целью настоящего исследования являлся направленный поиск высокоактивных антиоксидантных соединений в ряду конденсированных и неконденсированных производных бензимидазола с последующим детальным изучением влияния наиболее активных веществ на процессы пероксидации и доклиническим исследованием их специфической активности на различных патологических моделях.
Для достижения указанной цели представлялось необходимым решить следующие задачи:
- Провести прогноз наличия высокоактивных антиоксидантных веществ среди ранее неиспытанных соединений из ряда конденсированных и неконденсированных производных бензимидазола, а также изучить антиоксидантные и антирадикальные свойства веществ, отобранных при проведении прогноза, и препаратов сравнения на моделях in vitro.
- Определить зависимость действия изучаемых соединений на свободнорадикальные процессы от их химических структур и физико-химических свойств.
- Исследовать механизмы действия наиболее активных веществ и препаратов сравнения на различные звенья свободнорадикальных процессов на моделях in vitro.
- Изучить острую токсичность наиболее активных соединений, рассчитать их терапевтический индекс и выбрать наиболее эффективные вещества для доклинического изучения их специфической активности.
- Исследовать защитное действие наиболее активных соединений и препаратов сравнения на различных моделях острой гипоксии.
- Изучить противоишемические свойства наиболее активных веществ и препаратов сравнения на модели ишемии головного мозга путем билатеральной окклюзии сонных артерий.
- Исследовать влияние наиболее активных соединений и препаратов сравнения на процессы перекисного окисления липидов и активность ферментов антиоксидантной системы, а также их гемореологические свойства при билатеральной окклюзии сонных артерий с контролируемой гипотензией.
- Изучить влияние наиболее активных веществ и препаратов сравнения на показатели перекисного окисления липидов и активность ферментов антиоксидантной системы, а также их защитное действие в отношении -клеток поджелудочной железы в условиях стрептозотоциновой интоксикации.
Научная новизна. Впервые для новых оригинальных химических соединений из ряда конденсированных и неконденсированных производных бензимидазола был проведен прогноз уровня антиоксидантной активности в программном комплексе «Микрокосм» 4.2 с последующим экспериментальным изучением антиоксидантных и антирадикальных свойств веществ, выбранных на основе прогноза. Обнаружено, что наиболее активными являются производные N1-замещенных пирроло[1,2-]бензимидазолов, а также N9-пиперидиноэтильные производные имидазо[1,2-]бензимидазолов, имеющие в качестве радикала R2 фенил, замещенный фенил (п-оксифенил, 4-фторфенил, 3,4-дихлорфенил) или -нафтил. В ходе выявления взаимосвязи между действием изучаемых веществ на свободнорадикальные процессы и их физико-химическими свойствами были установлены параметры, детерминирующие наличие выраженных антиоксидантных свойств у производных бензимидазола, что позволило дать рекомендации по направленному синтезу высокоактивных антиоксидантных соединений. Были исследованы механизмы действия наиболее активных веществ, относящихся к ряду производных пирроло[1,2-]бензимидазолов, под лабораторными шифрами РУ-642 и РУ-643 на различные звенья свободнорадикальных процессов in vitro и установлена их наибольшая эффективность в отношении липопероксильного радикала и (в высоких концентрациях) стабильного свободного радикала 2,2-дифенил-1-пикрилгидразил. Впервые были обнаружены противогипоксические и противоишемические свойства у нового высокоактивного и умеренно токсичного антиоксидантного вещества РУ-642, а также его способность нормализовать гемореологический статус организма при ишемии головного мозга с последующей реперфузией и проявлять защитное действие в отношении -клеток поджелудочной железы при интоксикации стрептозотоцином. Доказано, что в основе эффективности исследуемого соединения в условиях данных патологий лежит антиоксидантный механизм его действия.
Научно-практическая значимость работы. Прогноз уровня антиоксидантной активности в программном комплексе «Микрокосм» 4.2 с последующей экспериментальной проверкой может быть эффективно использован для целенаправленного поиска новых гетероциклических производных с высокой антиоксидантной активностью. Полученные данные свидетельствуют о целесообразности поиска ингибиторов перекисного окисления липидов среди производных пирроло[1,2-]бензимидазолов. На основании выявленной зависимости антиоксидантной активности изучаемых соединений от их физико-химических параметров были даны рекомендации по оптимизации поиска субстанций в аналогичных рядах веществ и направленному синтезу эффективных антиоксидантных соединений. Получены данные о наличии у вещества РУ-642 противогипоксических и противоишемических свойств, обнаружена его способность снижать количество продуктов перекисного окисления липидов, повышать активность ферментов антиоксидантной системы и улучшать реологические параметры крови при ишемии головного мозга с последующей его реперфузией, а также уменьшать образование продуктов перекисного окисления липидов, увеличивать активность антиоксидантных ферментов и проявлять протекторное действие в отношении -клеток поджелудочной железы в условиях интоксикации стрептозотоцином. Выраженное защитное действие соединения РУ-642 при различных патологических состояниях, сопровождающихся активацией свободнорадикальных процессов, определяет перспективность проведения дальнейших фармакологических и токсикологических исследований данного вещества.
Реализация результатов исследования. Прогноз уровня антиоксидантной активности в программном комплексе «Микрокосм» 4.2 с последующей экспериментальной проверкой используется на кафедре фармакологии и в НИИ фармакологии Волгоградского государственного медицинского университета для целенаправленного поиска высокоактивных антиоксидантных веществ среди новых конденсированных и неконденсированных производных бензимидазола. Выявленные закономерности между химическими структурами изученных производных бензимидазола и их способностью ингибировать процессы перекисного окисления липидов принимаются во внимание при синтезе новых антиоксидантных соединений в НИИ физической и органической химии Южного федерального университета, а также в экспериментальной работе лаборатории органического синтеза НИИ фармакологии Волгоградского государственного медицинского университета. Результаты работы используются в лекционных курсах на кафедрах фармакологии, химии, фармакологии и биофармации ФУВ Волгоградского государственного медицинского университета, на кафедре фармакологии Ростовского государственного медицинского университета.
Основные положения, выносимые на защиту
- Производные N1-замещенных пирроло[1,2-]бензимидазолов являются перспективным классом соединений в плане поиска новых веществ, способных ингибировать процессы перекисного окисления липидов.
- Прогноз уровня антиоксидантной активности производных бензимидазола в программном комплексе «Микрокосм» 4.2 с последующей экспериментальной проверкой позволяет оптимизировать поиск высокоактивных антиоксидантных соединений среди веществ данного ряда.
- Наиболее выраженную антиоксидантную активность среди новых конденсированных и неконденсированных производных бензимидазола проявляют производные N1-замещенных пирроло[1,2-]бензимидазолов, а также N9-пиперидиноэтильные производные имидазо[1,2-]бензимидазолов, имеющие в качестве радикала R2 фенил, замещенный фенил (п-оксифенил, 4-фторфенил, 3,4-дихлорфенил) или -нафтил. К физико-химическим параметрам, детерминирующим наличие выраженных антиоксидантных свойств у производных бензимидазола, относятся: молекулярная рефракция ароматического цикла молекулы вещества 45,90; 22,48 молекулярная рефракция радикала R3 < 30,83; липофильность ароматического цикла молекулы вещества 2,47; 1,41 липофильность радикала R3 < 2,20; суммарный заряд радикала R1 0,076; -0,062 суммарный заряд радикала R3 < -0,004.
- Производное N1-замещенных пирроло[1,2-]бензимидазолов соединение РУ-642 превосходит по условному терапевтическому индексу антиоксидантной активности, полученной на модели аскорбат-зависимого перекисного окисления липидов, остальные исследуемые производные бензимидазола, а также препараты сравнения тролокс, дибунол и мексидол. Вещество РУ-642 эффективнее мексидола на различных моделях острой гипоксии; не уступает ему по выраженности противоишемических свойств; оказывает большее, чем препарат сравнения липоевая кислота, защитное действие при интоксикации стрептозотоцином, что является предпосылкой для дальнейших расширенных фармакологических исследований данного соединения.
Апробация работы. Материалы диссертации докладывались и обсуждались на XII-XIII Региональных конференциях молодых исследователей Волгоградской области (Волгоград, 2007-2008 гг.); 65-67-й итоговых научных конференциях студентов и молодых ученых Волгоградского государственного медицинского университета (Волгоград, 2007-2009 гг.); Пятой Российской конференции «Гипоксия: механизмы, адаптация, коррекция» (Москва, 2008 г.).
Публикации
По теме диссертации опубликовано 17 работ (из них две – в центральной печати).
Объем и структура работы
Диссертация изложена на 213 страницах машинописного текста, иллюстрирована 40 рисунками и 50 таблицами. Состоит из введения, обзора литературы, экспериментальной части (главы 2-4), обсуждения результатов, выводов, списка литературы, включающего 159 отечественных и 46 зарубежных источников.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Эксперименты выполнены на 130 белых неинбредных крысах обоего пола массой 200-400 г. и 263 белых неинбредных мышах обоего пола массой 17-36 г., содержащихся в условиях вивария с естественным световым режимом на стандартной диете (ГОСТ Р 50258-92), согласно методическим руководствам и нормативным документам – ГОСТ З 51000.3-96 и 51000.4-96; правила и Международные рекомендации Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997); правила лабораторной практики (GLP) в РФ, утвержденные приказом Минздрава РФ от 19 июня 2003 г. №267. Острую токсичность соединений исследовали в соответствии с требованиями и инструкциями Федеральной службы по надзору в сфере здравоохранения и социального развития [Хабриев Р.У., 2005].
В работе изучены 27 веществ под лабораторными шифрами «РУ», синтезированные в НИИ физической и органической химии Южного федерального университета[1]. Из них 21 соединение относится к производным N9-замещенных имидазо[1,2-]бензимидазолов, 6 соединений – к производным N1-замещенных пирроло[1,2-]бензимидазолов. В качестве препаратов сравнения использовали тролокс (Fluka, Швейцария), дибунол (Merck, Германия), мексидол (НИИ фармакологии РАМН, Россия), липоевую кислоту (ICN Марбиофарм, Россия).
Прогноз антиоксидантной активности у 100 новых конденсированных и неконденсированных производных бензимидазола из компьютерной базы данных Волгоградского государственного медицинского университета проводили в программном комплексе «Микрокосм» 4.2[2].
Антиоксидантную активность отобранных при прогнозе веществ изучали в экспериментах in vitro на модели аскорбат-зависимого перекисного окисления липидов (ПОЛ) [Ланкин В.З. и др., 1975]. Антирадикальные свойства соединений оценивали по их способности инактивировать стабильный свободный радикал 2,2-дифенил-1-пикрил-гидразил (ДФПГ) (Sigma, США) [Glavind J., 1963].
Для выявления взаимосвязи между антиоксидантной активностью и физико-химическими свойствами изучаемых веществ использовали подструктурный анализ [Васильев П.М., 1983]. Предварительно рассчитывали стерические [Arup K.G., Gordon M.C., 1987], липофильные [Vellarkad N.V. et al., 1989] и электронные [Кларк Т., 1990] параметры, используя квантово-химические методы, реализованные в программном обеспечении CS Chem3D® 8.0.
Влияние наиболее активных веществ на процессы хемилюминесценции (ХЛ) изучали на хемилюминометре «ХЛ-003» (Уфа, Россия). Фиксировали показатель суммарной светимости в условных единицах. Для исследования антиоксидантной активности соединений использовали метод Fe2+-индуцированной ХЛ липидов [Фархутдинов Р.Р., Лиховских В.А., 1995]. Антирадикальные свойства веществ изучали с помощью метода люминол-зависимой ХЛ [Фархутдинов Р.Р., Лиховских В.А., 1995] и системы с генерацией пероксильного радикала (ROO•) в ходе термического разложения 2,2'-азобис(2-метилпропионамидин)дигидрохлорида (АБАП) [Клебанов Г.И., 2001]. Антирадикальную активность оценивали также по способности соединений подавлять окисление 2,2'-азино-бис-(3-этилбензтиазолин)-6-сульфоновой кислоты (АБТС) [Rice-Evans С., 1994]. Ингибирующую концентрацию ИК50 рассчитывали методом регрессионных уравнений в программе Statistica 6.0 (StatSoft, США).
О влиянии веществ на процессы ПОЛ in vivo судили по концентрации малонового диальдегида (МДА) в плазме крови [Андреева Л.И., Кожемякин Л.А., 1988] и гомогенатах тканей [Гаврилов В.Б. и др., 1987]. Активность супероксиддисмутазы (СОД) определяли по методу В.А. Костюка и др. [1990], глутатионпероксидазы (ГП) – по методу В.М. Моина [1986].
Оптическую плотность измеряли на спектрофотометре PD-303 UV (APEL, Япония) в кюветах с длиной оптического пути 1 см.
Измерение вязкости крови проводили на анализаторе крови реологическом АКР-2 (Россия). Вязкость крови определяли при скоростях сдвига 300, 200, 100, 50 и 20 с-1 [Добровольский Н.А., 1998]. Влияние веществ на агрегацию тромбоцитов оценивали на двухканальном лазерном анализаторе агрегации тромбоцитов (модель 220 LA) («Биола», Москва) по методу G. Born [1962] в модификации З.А. Габбасова [1989]. Исследовали богатую тромбоцитами плазму [Люсов В.А., Белоусов Ю.Б., 1971].
Противогипоксическую активность соединений изучали согласно методическим рекомендациям под редакцией Л.Д. Лукьяновой [1990]. Острую гипобарическую гипоксию (ОГБГ) моделировали в проточной барокамере «Биоконт-Б» («Парус», Москва). Мышей помещали в условия, соответствующие подъему на высоту 11 000 м. Оценивали время их жизни до второго агонального вдоха или летального исхода. ЕД50 (дозу, в которой вещество повышает время жизни на 50%) рассчитывали методом регрессионных уравнений в программе Statistica 6.0 (StatSoft, США). Острую гемическую гипоксию (ОГеГ) создавали путем однократного внутрибрюшинного введения натрия нитрита в дозе 225 мг/кг. Острую гистотоксическую гипоксию (ОГТГ) вызывали однократным внутрибрюшинным введением натрия нитропруссида в дозе 20 мг/кг. Регистрировали продолжительность жизни мышей от момента введения до гибели. Для воспроизведения гипоксии с гиперкапнией в гермообъеме животных поодиночке помещали в стеклянные банки объемом 200 мл, которые герметически закрывали. Фиксировали время жизни мышей до второго агонального вдоха.
Ишемию головного мозга создавали под наркозом хлоралгидратом (400 мг/кг, внутрибрюшинно) окклюзией общих сонных артерий [Мирзоян Р.С. и др., 2000]. В течение 3-х суток после операции оценивали выживаемость крыс, локомоторную активность в актометре («Ugo Basile», Италия), поведение в тесте «открытое поле», сохранность рефлексов [Буреш Я., Бурешова О., 1991]. Неврологический дефицит определяли по шкале Stroke-index McGrow в модификации И.В. Ганнушкиной [1977]. Ишемически-реперфузионное повреждение головного мозга моделировали под наркозом хлоралгидратом (400 мг/кг, внутрибрюшинно) окклюзией общих сонных артерий в течение 30 минут с последующей реперфузией [Мирзоян Р.С., 2006]. Операцию проводили под контролем артериального давления (80/60 мм.рт.ст.). Через 30 минут реперфузии забирали кровь из брюшной аорты, а после эвтаназии крыс методом декапитации – мозговую ткань. В плазме крови и мозге определяли содержание МДА, активность СОД и ГП. В отдельной серии экспериментов изучали влияние веществ на вязкость крови и АДФ-индуцированную агрегацию тромбоцитов.
Стрептозотоциновую интоксикацию моделировали путем однократного внутривенного введения раствора стрептозотоцина (Sigma, США) в 1 моль/л цитратном буфере pH 4,5 в дозе 50 мг/кг [Srinivasan K., Ramarao P., 2007]. Оценивали потребление животными воды и корма, их вес. Через 72 часа после введения стрептозотоцина [Akbarzadeh A. et al., 2007] регистрировали выживаемость крыс, определяли уровень глюкозы в плазме крови и моче с помощью набора «Глюкоза-ФКД» (Россия), а также содержание кетоновых тел в моче с использованием диагностических полосок «Кетофан» (PLIVA-Lachema Diagnostika, Чехия). После забора крови из брюшной аорты у наркотизированных хлороформом животных осуществляли их эвтаназию методом декапитации и извлекали поджелудочную железу, сердце, почки [Dincer Y. et al., 2002; Maritim AC et al., 2003]. В плазме крови и гомогенатах органов изучали процессы ПОЛ по накоплению МДА, оценивали активность СОД и ГП. Островковый аппарат селезеночного отдела поджелудочной железы исследовали морфологически[3]. Морфометрический анализ проводили с помощью компьютерной системы «ВидеоТестМорфо-4». Определяли процентное соотношение площади, занимаемой -эндокриноцитами, к общей площади островка, которую принимали за 100%.
Острую токсичность соединений изучали на мышах при внутрибрюшинном введении. Величину LD50 определяли по методу Личфилда-Вилкоксона. Для расчета показателя условной широты терапевтического действия выводили условный терапевтический индекс (УТИ).
Статистическую обработку данных проводили с использованием пакета программ Statistica 6.0 (StatSoft, США) и Excel 2007 (MS Office 2007, США) с применением парного критерия Стьюдента (t) и точного метода Фишера.
Результаты исследования и их обсуждение
В ходе прогноза антиоксидантной активности у новых производных бензимидазола из 100 неиспытанных соединений, содержащихся в компьютерной базе данных Волгоградского государственного медицинского университета, отобрано 27 веществ с достоверными расчетными оценками наличия выраженных антиоксидантных свойств. При изучении их антиоксидантной активности установлено, что в ряду производных N1-замещенных пирроло[1,2-]бензимидазолов все соединения (6/6) проявляют высокую активность, в то время как среди производных N9-замещенных имидазо[1,2-]бензимидазолов доля высокоактивных веществ составляет 33,3% (7/21). Таким образом, антиоксидантные свойства бензимидазольных соединений усиливаются при наличии в их структуре пиррольного кольца, что согласуется с представлениями о значении определенной -избыточности для проявления веществами антиоксидантной активности. Отдельные радикалы в различных положениях гетероцикла могут усиливать донорно-акцепторные свойства производных бензимидазола. Так, присутствие пиперидиноэтильного радикала в положении N9 гетероциклического кольца производных имидазо[1,2-]бензимидазолов в сочетании с фенилом, замещенным фенилом (п-оксифенилом, 4-фторфенилом, 3,4-дихлорфенилом) или -нафтилом в качестве радикала R2 приводит к появлению высокой антиоксидантной активности у соединений данного класса.
При изучении зависимости антиоксидантных свойств исследуемых веществ от их физико-химических параметров методом подструктурного анализа были выявлены признаки, детерминирующие высокую антиоксидантную активность у данного ряда соединений: молекулярная рефракция ароматического цикла молекулы вещества 45,90; 22,48 молекулярная рефракция радикала R3 < 30,83; липофильность ароматического цикла молекулы вещества 2,47; 1,41 липофильность радикала R3 < 2,20; суммарный заряд радикала R1 0,076; -0,062 суммарный заряд радикала R3 < -0,004. Данные факты могут учитываться при направленном синтезе высокоактивных бензимидазольных соединений.
По результатам прогноза и экспериментального изучения антиоксидантной активности у новых производных бензимидазола для детального исследования антиоксидантных и антирадикальных свойств in vitro были выбраны наиболее активные вещества под лабораторными шифрами РУ-642 и РУ-643, относящиеся к производным N1-замещенных пирроло[1,2-]бензимидазолов. При изучении механизмов их действия на свободнорадикальные процессы обнаружено, что данные соединения проявляют высокую эффективность в отношении липопероксильного радикала, ингибируя Fe2+-индуцированную ХЛ липидов, менее активны в отношении радикалов люминола и супероксида в системе с аутоокислением люминола, а также АБТС• в методе окисления АБТС (рис. 1). В высоких концентрациях оба вещества подавляют образование ROO• в ходе термического разложения АБАП и полностью обесцвечивают раствор ДФПГ•.
 |  |
| А. | Б. |
Рис. 1. Активность веществ РУ-642 (А) и РУ-643 (Б) в концентрации 1 мкмоль/л на моделях изучения антиоксидантных и антирадикальных свойств, % ингибирования реакции
Обозначения: * – данные статистически значимы (t) по отношению к контролю, р0,05.
Наиболее позитивные характеристики по показателям антиоксидантной и антирадикальной активности, а также острой токсичности имеет вещество РУ-642 (табл. 1), которое и было выбрано для доклинического исследования его специфической активности на патологических моделях, сопровождающихся активацией свободнорадикальных процессов.
Таблица 1
Показатели антиоксидантной и антирадикальной активности (ИК50), острой токсичности (LD50), условного терапевтического индекса веществ РУ-642, РУ-643 и препаратов сравнения
| № | Шифр вещества | LD50, мг/кг | Аскорбат-зависимое ПОЛ | Fe2+-индуцированная ХЛ липидов | Взаимодействие с ДФПГ | |||
| ИК50, мкмоль/л | УТИ | ИК50, мкмоль/л | УТИ | ИК50, мкмоль/л | УТИ | |||
| 1. | РУ-642 | 792 | 0,32 | 4517,5 | 3,26 | 442,3 | 9,83 | 146,6 |
| 2. | РУ-643 | 262 | 0,32 | 1534,9 | 1,09 | 444,2 | 7,28 | 66,7 |
| 3. | Тролокс | 17001 | 2,76 | 2457,3 | 1,13 | 6026,5 | 6,78 | 1002,4 |
| 4. | Дибунол | 490 | 3,16 | 701,0 | 0,48 | 4628,8 | 15,56 | 142,5 |
| 5. | Мексидол | 4752 | 480,0 | 3,9 | 192,13 | 9,7 | 20,94 | 89,0 |
Примечание:
1 – Cort W.M. et al., 1975; 2 – Воронина Т.А., 2005; 3 – Косолапов В.А. и др., 2005.
При изучении антигипоксических свойств соединения РУ-642 установлено, что исследуемое вещество в дозе 0,176 мг/кг увеличивает продолжительность жизни животных на 160,27 (p0,05); 74,13; 73,88 (p0,05) и 26,96 (p0,05) % по отношению к контролю при ОГБГ, ОГеГ, ОГТГ и гипоксии с гиперкапнией в гермообъеме соответственно (рис. 2). Мексидол в дозе 122,4 мг/кг повышает время жизни мышей на 182,14 (p0,05); 17,30; 48,40 (p0,05) и 21,86% в тех же условиях. Десяти- и стократное увеличение дозы соединения РУ-642 на модели ОГБГ привело к возрастанию его противогипоксического эффекта. При расчете величины ЕД50 было выявлено значительное превосходство исследуемого вещества (ЕД50=0,055 мг/кг) над мексидолом (ЕД50=14,22 мг/кг) на данной модели. Наиболее вероятно, что в основе обусловленного соединением РУ-642 повышения резистентности организма животных к острой гипоксии лежит торможение свободнорадикальных процессов.
| А. |  | Б. |  |
| В. |  | Г. |  |
Рис. 2. Влияние вещества РУ-642 и мексидола на время жизни мышей при острых гипобарической (А), гемической (Б), гистотоксической (В) и гиперкапнической в гермообъеме (Г) гипоксиях
Обозначения: по оси абсцисс – доза вещества, мг/кг; по оси ординат – время жизни животных по отношению к контролю, %; * – данные статистически значимы (t) относительно контроля, p0,05.
При изучении противоишемических свойств вещества РУ-642 на модели билатеральной окклюзии сонных артерий была обнаружена тенденция к повышению выживаемости животных на 12,5% относительно ишемии в течение всего опыта. В то же время мексидол проявил сходный эффект только на 2-е и 3-и сутки после операции. Наиболее выраженное защитное действие соединение РУ-642 оказывало в 1-е сутки после перевязки сонных артерий: статистически значимо увеличивало локомоторную активность животных в 6,3 раза по отношению к ишемии, повышало их горизонтальную активность в тесте «открытое поле» на 80,69%, а также снижало выраженность неврологических нарушений (по шкале Stroke-index McGrow) на 57,65% относительно ишемии (табл. 2). Мексидол несколько превосходил исследуемое вещество по влиянию на горизонтальную активность, но данные являлись статистически незначимыми.
Таблица 2
Влияние вещества РУ-642 и мексидола на локомоторную (в актометре), горизонтальную (в тесте «открытое поле») активности и неврологический статус (по шкале McGrow) животных в первые сутки после билатеральной окклюзии сонных артерий (M±m)
| Группа животных | Доза вещества, мг/кг | Локомоторная активность, усл.ед. | Горизонтальная активность, количество пересеченных квадратов | Неврологический статус, баллы |
| Контроль | – | 33,78 ± 9,98 | 32,44 ± 4,77 | 0,06 ± 0,06 |
| Ишемия | – | 1,38 ± 0,94* | 16,88 ± 4,45* | 4,72 ± 1,18* |
| Ишемия + РУ-642 | 0,176 | 8,63 ± 2,78*,** | 30,50 ± 3,03** | 2,00 ± 0,33*,** |
| Ишемия +Мексидол | 122,4 | 4,33 ± 3,84* | 34,67 ± 10,28 | 3,31 ± 1,47 |
Примечание: * – данные статистически значимы (t) относительно группы ложнооперированных крыс, p0,05; ** – данные статистически значимы (t) относительно группы крыс с ишемией, p0,05.
С целью выяснения механизма противоишемического действия соединения РУ-642 была использована модель ишемии головного мозга с последующей его реперфузией. При этом у крыс с патологией, получавших исследуемое вещество, содержание МДА в плазме крови и мозговой ткани снижалось на 34,88 и 26,77 (p0,05) % по отношению к ишемии соответственно (рис. 3). Мексидол продемонстрировал сходную активность, уменьшая данный показатель на 31,61% в плазме крови и на 27,01% (p0,05) относительно ишемии в мозге.

Рис. 3. Влияние вещества РУ-642 и мексидола в дозах 0,176 и 122,4 мг/кг соответственно на содержание малонового диальдегида в плазме крови и мозге при ишемии-реперфузии головного мозга
Обозначения: по оси абсцисс – группа животных; по оси ординат – дельта к ложнооперированному контролю, %; * – данные статистически значимы (t) относительно группы ложнооперированных крыс, p0,05; ** – данные статистически значимы (t) относительно группы крыс с ишемией, p0,05.
Вещество РУ-642 повышало активность СОД на 52,35 и 32,68% (p0,05) по отношению к ишемии в плазме крови и головном мозге соответственно (рис. 4). Мексидол был менее эффективен и в плазме крови увеличивал активность фермента на 47,41% (p0,05), в мозге – на 27,87% относительно ишемии.
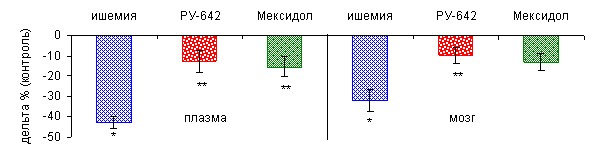
Рис. 4. Влияние вещества РУ-642 и мексидола в дозах 0,176 и 122,4 мг/кг соответственно на активность супероксиддисмутазы в плазме крови и мозге при ишемии-реперфузии головного мозга
Обозначения: по оси абсцисс – группа животных; по оси ординат – дельта к ложнооперированному контролю, %; * – данные статистически значимы (t) относительно группы ложнооперированных крыс, p0,05; ** – данные статистически значимы (t) относительно группы крыс с ишемией, p0,05.
При введении соединения РУ-642 наблюдалась тенденция к повышению активности ГП на 21,43 и 86,87% по отношению к ишемии в плазме крови и мозге соответственно. Мексидол не влиял на активность фермента в плазме крови, но увеличивал ее в мозге на 47,86% относительно ишемии.
В ходе изучения гемореологической активности вещества РУ-642 при ишемии-реперфузии головного мозга была обнаружена его способность статистически значимо снижать вязкость крови на 8,80; 9,47; 10,72; 12,24 и 16,26% по отношению к ишемии при скоростях сдвига 300; 200; 100; 50 и 20 с-1 соответственно, что свидетельствует о нормализации способности эритроцитов к деформации и их агрегационной способности. Мексидол уменьшал показатели вязкости крови при скорости сдвига 300 с-1 на 12,00%, 200 с-1 – на 12,59%, 100 с-1 – на 13,65%, 50 с-1 – на 15,02% и 20 с-1 – на 18,84% относительно ишемии. Изучаемое соединение продемонстрировало значительный антиагрегантный эффект, снижая индекс агрегации тромбоцитов и максимальный наклон агрегатограммы на 33,13 и 80,11% (p0,05) относительно ишемии соответственно. Мексидол также уменьшал функциональную активность тромбоцитов, но данные были статистически незначимыми. Учитывая роль активации свободнорадикальных процессов в гемореологических нарушениях, можно предположить, что полученный эффект соединения РУ-642 обусловлен его антиоксидантными свойствами.
Выраженное позитивное влияние на состояние крыс со стрептозотоциновой интоксикацией вещество РУ-642 оказывало в дозе 26,6 мг/кг: повышало выживаемость до 100% (p0,05); уменьшало потребление воды на 65,31% (p0,05); увеличивало потребление корма и массу тела на 40,74 (p0,05) и 10,48% соответственно; проявляло тенденцию к снижению уровня глюкозы в плазме крови и моче на 20,54 и 22,28% соответственно, а также кетоновых тел в моче – на 52,22% по отношению к патологии. Липоевая кислота в дозе 10 мг/кг была менее эффективна: повышала выживаемость на 25%, снижала потребление воды на 7,14% (p0,05), увеличивала потребление корма на 20,16% (p0,05), уменьшала содержание кетоновых тел в моче на 11,11% относительно группы животных с интоксикацией стрептозотоцином.
В ходе изучения механизма защитного действия соединения РУ-642 при стрептозотоциновой интоксикации установлено, что исследуемое вещество статистически значимо снижало уровень МДА: в плазме крови – на 25,59; 26,35; 26,47 и 46,75% в дозах 0,176; 1,76; 8,8 и 26,6 мг/кг соответственно; в поджелудочной железе – на 59,50; 62,92 и 69,49% в дозах 1,76; 8,8 и 26,6 мг/кг соответственно; в сердце – на 45,66% в дозе 26,6 мг/кг; в почках – на 33,62 и 35,39% по отношению к патологии в дозах 8,8 и 26,6 мг/кг соответственно (рис. 5). Липоевая кислота уменьшала содержание МДА в плазме крови и поджелудочной железе на 40,25 и 24,52% (p0,05) относительно патологии соответственно.

Рис. 5. Влияние вещества РУ-642 и липоевой кислоты (10 мг/кг) на содержание малонового диальдегида в плазме крови и гомогенатах органов крыс с интоксикацией стрептозотоцином
Обозначения: по оси абсцисс – исследуемый материал; по оси ординат – дельта к интактному контролю, %; * – данные статистически значимы (t) относительно группы интактных крыс, p0,05; ** – данные статистически значимы (t) относительно группы крыс с патологией, p0,05.
Под действием соединения РУ-642 в дозах 1,76; 8,8 и 26,6 мг/кг активность СОД в плазме крови повышалась на 27,95; 28,85 и 36,11% (p0,05) по отношению к патологии соответственно. В поджелудочной железе отмечалось увеличение активности фермента на 41,94% (p0,05) при введении изучаемого вещества в дозах 0,176 и 1,76 мг/кг и на 51,15 и 62,21% (p0,05) при использовании доз 8,8 и 26,6 мг/кг соответственно. Повышение активности СОД в сердце на 47,03% (p0,05) относительно патологии наблюдалось под влиянием соединения РУ-642 в дозе 26,6 мг/кг. Липоевая кислота существенно увеличивала активность фермента в плазме крови и поджелудочной железе на 31,78 и 36,41% (p0,05) соответственно.

Рис. 6. Влияние вещества РУ-642 и липоевой кислоты (10 мг/кг) на активность супероксиддисмутазы в плазме крови и гомогенатах органов крыс при интоксикации стрептозотоцином
Обозначения: по оси абсцисс – исследуемый материал; по оси ординат – дельта к интактному контролю, %; * – данные статистически значимы (t) относительно группы интактных крыс, p0,05; ** – данные статистически значимы (t) относительно группы крыс с патологией, p0,05.
При введении вещества РУ-642 во всех изучаемых дозах наблюдалась тенденция к повышению активности ГП в плазме крови и исследуемых органах, в то время как под действием липоевой кислоты активность фермента в плазме крови и почках оставалась без изменений.
Морфологическое исследование островкового аппарата поджелудочной железы крыс, получавших соединение РУ-642 в дозе 26,6 мг/кг, выявило умеренные признаки воспаления и деструкции. По результатам морфометрического анализа процентное соотношение площади, занимаемой -клетками, к общей площади панкреатического островка увеличилось в 4,6 и 19,7 раз (p0,05) относительно патологии при введении доз 8,8 и 26,6 мг/кг соответственно (табл. 3). Липоевая кислота оказывала менее выраженное защитное действие в отношении -клеток поджелудочной железы при интоксикации стрептозотоцином.
Таблица 3
Влияние вещества РУ-642 и липоевой кислоты на распределение -клеток в панкреатических островках при стрептозотоциновой интоксикации (M±m)
| Группа животных | Доза вещества, мг/кг | -клетки, % |
| Интактный контроль | – | 85,58 ± 5,72 |
| Стрептозотоциновая интоксикация | – | 3,03 ± 1,48* |
| Стрептозотоциновая интоксикация + РУ-642 | 0,176 | 9,33 ± 4,28 |
| 1,76 | 9,02 ± 4,59 | |
| 8,8 | 13,98 ± 4,19** | |
| 26,6 | 59,17 ± 9,64** | |
| Стрептозотоциновая интоксикация + Липоевая кислота | 10,0 | 9,11 ± 5,11 |
Примечание: * – данные статистически значимы (t) относительно группы интактных крыс, p0,05; ** – данные статистически значимы (t) относительно группы крыс с патологией, p0,05.
Таким образом, в результате прогноза уровня антиоксидантной активности у новых производных бензимидазола в программном комплексе «Микрокосм» 4.2 с последующей экспериментальной проверкой было установлено, что производные N1-замещенных пирроло[1,2-]бензимидазолов, а также N9-пиперидиноэтильные производные имидазо[1,2-]бензимидазолов, имеющие в качестве радикала R2 фенил, замещенный фенил (п-оксифенил, 4-фторфенил, 3,4-дихлорфенил) или -нафтил, обладают выраженными антиоксидантными свойствами. Наиболее активные вещества под лабораторными шифрами РУ-642 и РУ-643, относящиеся к производным N1-замещенных пирроло[1,2-]бензимидазолов, особенно эффективны в отношении липопероксильного радикала и (в высоких концентрациях) стабильного свободного радикала ДФПГ. При исследовании фармакологического действия вещества РУ-642 установлено наличие у данного соединения противогипоксических и противоишемических свойств, а также гемореологической активности, выраженность которых сопоставима с таковыми у мексидола. При интоксикации стрептозотоцином исследуемое соединение оказывает защитное действие в отношении -клеток поджелудочной железы и превосходит по эффективности липоевую кислоту. Снижение количества продуктов перекисного окисления липидов и увеличение активности антиоксидантных ферментов под действием вещества РУ-642 позволяют объяснить его эффективность в условиях данных патологий. Учитывая вышесказанное, можно считать перспективным дальнейшее изучение фармакологических и токсикологических свойств соединения РУ-642.
ВЫВОДЫ
- Производные N1-замещенных пирроло[1,2-]бензимидазолов являются перспективным классом веществ в плане поиска новых соединений, способных ингибировать процессы перекисного окисления липидов. В ходе изучения антиоксидантной активности новых бензимидазольных веществ в ряду производных N1-замещенных пирроло[1,2-]бензимидазолов все соединения (6/6) оказались высокоактивными. При этом 33,3% веществ (2/6) превосходили по активности тролокс, дибунол и мексидол, 16,7% веществ (1/6) – дибунол и мексидол, 50% веществ (3/6) – мексидол. Среди производных N9-замещенных имидазо[1,2-]бензимидазолов доля высокоактивных соединений составила 33,3% (7/21). При этом 9,5% веществ (2/21) превосходили по антиоксидантным свойствам дибунол и мексидол, 61,9% веществ (13/21) – мексидол.
- Прогноз уровня антиоксидантной активности у новых конденсированных и неконденсированных производных бензимидазола с помощью программного комплекса «Микрокосм» 4.2 с последующей экспериментальной проверкой позволил оптимизировать поиск высокоактивных антиоксидантных соединений среди веществ данного ряда.
- Антиоксидантные свойства бензимидазольных соединений усиливаются при наличии в их структуре пиррольного кольца. Присутствие пиперидиноэтильного радикала в положении N9 гетероцикла производных имидазо[1,2-]бензимидазолов в сочетании с фенилом, замещенным фенилом (п-оксифенилом, 4-фторфенилом, 3,4-дихлорфенилом) или -нафтилом в качестве R2 приводит к появлению высокой антиоксидантной активности у веществ данного ряда. Изучение зависимости антиоксидантных свойств исследуемых соединений от их физико-химических параметров методом подструктурного анализа позволило выявить признаки, детерминирующие высокую антиоксидантную активность у данного класса веществ.
- Наиболее высокую антиоксидантную активность проявили производные N1-замещенных пирроло[1,2-]бензимидазолов вещества РУ-642 и РУ-643, относящиеся к классу умеренно токсичных соединений (3 класс). Вещество РУ-642 с условным терапевтическим индексом антиоксидантной активности, полученной на модели аскорбат-зависимого перекисного окисления липидов, 4517,5 превосходило по данному параметру препараты сравнения тролокс (2457,3), дибунол (701,0) и мексидол (3,9).
- Вещество РУ-642 проявило выраженные защитные свойства в условиях острой гипобарической гипоксии, превосходя по величине ЕД50 (0,055 мг/кг) препарат сравнения мексидол (14,22 мг/кг). При гемической, гистотоксической и гиперкапнической в гермообъеме острых гипоксиях соединение РУ-642 в дозе 0,176 мг/кг увеличивало продолжительность жизни животных на 74,1; 73,9 и 27,0% по отношению к контролю соответственно и было эффективнее мексидола в дозе 122,4 мг/кг (17,3; 48,4 и 21,9%).
- Вещество РУ-642 (0,176 мг/кг) в условиях ишемии головного мозга, вызванной перевязкой сонных артерий, повышало выживаемость животных на 12,5% в течение всего опыта (мексидол в дозе 122,4 мг/кг проявил сходный эффект на 2-е и 3-и сутки после операции); увеличивало двигательную активность крыс в актометре, превосходя по эффективности мексидол, а также горизонтальную и поисковую активности в тесте «открытое поле», несколько уступая препарату сравнения по влиянию на горизонтальную активность; снижало, также как и мексидол, выраженность неврологических нарушений.
- На модели ишемии головного мозга с последующей его реперфузией соединение РУ-642 снижало содержание малонового диальдегида в плазме крови и мозговой ткани на 34,9 и 26,8% соответственно, не уступая мексидолу (31,6 и 27,0%), а также повышало активность супероксиддисмутазы на 52,4 и 32,7% по отношению к ишемии в плазме крови и мозге соответственно, превосходя по эффективности препарат сравнения (47,4 и 27,9%). Исследуемое вещество уменьшало индекс агрегации эритроцитов на 7,0% относительно ишемии, незначительно превосходя по гемореологическим свойствам мексидол (6,6%), а также индекс агрегации тромбоцитов и максимальный наклон агрегатограммы на 33,1 и 80,1% соответственно (мексидол – на 28,2 и 71,0%).
- При интоксикации стрептозотоцином вещество РУ-642 в дозе 26,6 мг/кг оказывало выраженное позитивное влияние на состояние крыс в виде повышения выживаемости до 100%, уменьшения потребления воды, увеличения потребления корма и массы тела, тенденции к снижению уровня глюкозы в плазме крови и моче, а также кетоновых тел в моче. Липоевая кислота (10 мг/кг) была менее эффективна по влиянию на данные показатели. В указанной дозе исследуемое соединение снижало уровень малонового диальдегида на 46,8; 69,5; 45,7 и 35,4% в плазме крови, поджелудочной железе, сердце и почках соответственно, а также увеличивало активность супероксиддисмутазы в плазме крови, поджелудочной железе и сердце на 36,1; 62,2 и 47,0% относительно стрептозотоциновой интоксикации соответственно. Липоевая кислота в дозе 10 мг/кг была менее эффективна и уменьшала содержание малонового диальдегида на 40,3 и 24,5%, а также повышала активность супероксиддисмутазы на 31,8 и 36,4% в плазме крови и поджелудочной железе соответственно.
- При интоксикации стрептозотоцином вещество РУ-642 в дозе 26,6 мг/кг увеличивало процентное соотношение площади, занимаемой -клетками, к общей площади панкреатического островка с 3,0±1,5 до 59,2±9,6, тогда как препарат сравнения (10 мг/кг) оказывал менее выраженное протекторное действие в отношении -клеток поджелудочной железы.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Тибирькова, Е.В. Антиоксидантные свойства тролокса / Е.В. Тибирькова, В.А. Косолапов // Материалы 4-ой Международной конференции «Биологические основы индивидуальной чувствительности к психотропным средствам». 13-16 марта 2006 г. д/о «Подмосковье». Москва: ГУ НИИ фармакологии им. В.В. Закусова РАМН. 2006. с. 71-72 [русский], с. 141 [английский].
- Тибирькова, Е.В. Исследование антиоксидантной активности новых конденсированных и неконденсированных производных бензимидазола / Е.В. Тибирькова // Актуальные проблемы экспериментальной и клинической медицины: материалы 65-й открытой итоговой научной конференции молодых ученых и студентов / Под общей ред. акад. В.И. Петрова. – Волгоград: Изд-во ВолГМУ, 2007. – С. 152.
- Косолапов, В.А. Экспериментальная проверка точности компьютерного прогноза антиоксидантной активности новых гетероциклических соединений / В.А. Косолапов, П.М. Васильев, Е.В. Тибирькова и др. // Фармакология – практическому здравоохранению: Материалы III съезда фармакологов России / Психофармакол. биол. наркол. – 2007. – Т. 7, спец. вып. (сентябрь). – Ч. 1. – С. 1743.
- Косолапов, В.А. Антиоксиданты как средства коррекции ишемических нарушений головного мозга / В.А. Косолапов, Л.В. Ельцова, Е.В. Тибирькова, В.А. Анисимова // Фармакология – практическому здравоохранению: Материалы III съезда фармакологов России / Психофармакол. биол. наркол. – 2007. – Т. 7, спец. вып. (сентябрь). – Ч. 1. – С. 1743-1744.
- Косолапов, В.А. Компьютерный прогноз и экспериментальная проверка антиоксидантной активности азотсодержащих гетероциклических соединений / В.А. Косолапов, П.М. Васильев, Е.В. Тибирькова, В.А. Анисимова // XIV Российский национальный конгресс «Человек и лекарство»: Сборник материалов конгресса. – М., 2007. – С. 294-295.
- Косолапов, В.А. Антиоксидантные вещества – как основа для создания средств коррекции ишемии головного мозга / В.А. Косолапов, А.А. Спасов, Л.В. Ельцова, Е.В. Тибирькова, В.А. Анисимова // Лекарственные средства и биологически активные соединения: Материалы конф. / Международная научная конференция, посвященная 40-летию НПЦ «Институт фармакологии и биохимии НАН Беларуси». Гродно, 2007. – С. 82-83.
- Тибирькова, Е.В. Изучение антиоксидантных и антирадикальных свойств новых производных бензимидазола методами хемилюминесценции / Е.В. Тибирькова // XII Региональная конференция молодых исследователей Волгоградской области: Тезисы докладов / Под общей ред. акад. В.И. Петрова. – Волгоград: Изд-во ВолГМУ, 2007. – С. 47-49.
- Тибирькова, Е.В. Противогипоксические свойства нового производного пирролобензимидазола / Е.В. Тибирькова // Актуальные проблемы экспериментальной и клинической медицины: материалы 66-й открытой итоговой научно-практической конференции молодых ученых и студентов с международным участием / Под ред. акад. РАМН В.И. Петрова. – Волгоград: Изд-во ВолГМУ, 2008. – С. 161-162.
- Тибирькова, Е.В. Противогипоксическая активность нового производного пирролобензимидазола на модели острой гипобарической гипоксии / Е.В. Тибирькова, И.Е. Толпыгин // Тезисы V Конференции молодых ученых России с международным участием «Фундаментальные науки и прогресс клинической медицины». – М., 2008. – С. 431-432.
- Тибирькова, Е.В. Изучение противогипоксической активности нового производного пирролобензимидазола / Е.В. Тибирькова, В.А. Косолапов, А.А. Спасов // Пятая Российская конференция «Гипоксия: механизмы, адаптация, коррекция» / Патогенез. – 2008. – Т. 6, № 3. – С. 88-89.
- Тибирькова, Е.В. Противогипоксическая активность нового производного пирролобензимидазола / Е.В. Тибирькова // XIII Региональная конференция молодых исследователей Волгоградской области. Волгоград, 11-14 ноября 2008 г. [Направления: 17. Актуальные проблемы экспериментальной медицины. 18. Клинические аспекты медицины]: Тез. докл. / Под общ. ред. В.И. Петрова. – Волгоград: Изд-во ВолГМУ, 2008. – С. 101-105.
- Косолапов, В.А. Поиск новых веществ с антиоксидантными и церебропротекторными свойствами среди привилегированных молекул / В.А. Косолапов, Л.В. Ельцова, Е.В. Тибирькова, А.А. Спасов // 55-я юбилейная региональная научная конференция профессорско-преподавательского коллектива Волгоградского государственного медицинского университета «Современная инновационная медицина – населению Волгоградской области» / Под ред. акад. РАМН В.И. Петрова. – Волгоград: Изд-во ВолГМУ, 2008. – С. 147-148.
- Тибирькова, Е.В. Антиоксидантные и мембранопротекторные свойства тролокса / Е.В. Тибирькова, В.А. Косолапов, А.А. Спасов // Экспериментальная и клиническая фармакология. – 2009. – Т. 72, №2. – С. 47-50.
- Тибирькова, Е.В. Противоишемические свойства нового производного пирролобензимидазола / Е.В. Тибирькова // Актуальные проблемы экспериментальной и клинической медицины: Материалы 67-й открытой научно-практической конференции молодых ученых и студентов с международным участием / Под ред. акад. РАМН В.И. Петрова. – Волгоград: Изд-во ВолГМУ, 2009. – С. 183-184.
- Анисимова, В.А. Синтез и фармакологическая активность дигидрохлоридов 3-(2,2,2-трихлор-1-гидроксиэтил)имидазо[1,2-а]бензимидазола / В.А. Анисимова, А.А. Спасов, В.А. Косолапов, И.Е. Толпыгин, В.И. Поротиков, А.Ф. Кучерявенко, В.А. Сысоева, Е.В. Тибирькова, Л.В. Ельцова // Химико-фармацевтический журнал. – 2009. – Т. 43, №9. – С. 9-12.
- Макаренко, В.И. Изучение противоишемической активности нового производного пирроло[1,2-а]бензимидазола РУ-642, с выраженными антиоксидантными свойствами / В.И. Макаренко, Е.В. Тибирькова // Кислород и антиоксиданты. – 2009. – Выпуск 1. – С. 85-86.
- Косолапов, В.А. Отбор антиоксидантных веществ с церебропротекторными свойствами среди привилегированных молекул / В.А. Косолапов, А.А. Спасов, Л.В. Ельцова, Е.В. Тибирькова, В.А. Анисимова // Тезисы докладов V международной Крымской конференции «Окислительный стресс и свободнорадикальные патологии». – Судак, Крым, Украина, 21-30 сентября 2009. – С. 33.
[1] Выражаем глубокую признательность ведущему научному сотруднику НИИ физической и органической химии Южного федерального университета, к.х.н. В.А. Анисимовой за синтез и предоставление субстанций веществ для данной работы.
[2] Выражаем глубокую признательность старшему научному сотруднику лаборатории лекарственной безопасности НИИ фармакологии Волгоградского государственного медицинского университета, к.б.н., с.н.с. П.М. Васильеву за содействие при исполнении данной работы.
[3] Выражаем глубокую признательность доценту кафедры патологической анатомии Волгоградского государственного медицинского университета, к.м.н. Г.Л. Снигуру за содействие в проведении исследований.

