Оценка перфузии и метаболизма миокарда у больных ибс с пароксизмальной фибрилляцией предсердий методом однофотонной эмиссионной компьютерной томографии при лечении препаратами полиненасыщенных жирных
На правах рукописи
ИСМАИЛОВ
Азирхан Асрудинович
ОЦЕНКА ПЕРФУЗИИ И МЕТАБОЛИЗМА МИОКАРДА У БОЛЬНЫХ ИБС С ПАРОКСИЗМАЛЬНОЙ ФИБРИЛЛЯЦИЕЙ ПРЕДСЕРДИЙ МЕТОДОМ ОДНОФОТОННОЙ ЭМИССИОННОЙ КОМПЬЮТЕРНОЙ ТОМОГРАФИИ ПРИ ЛЕЧЕНИИ ПРЕПАРАТАМИ ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
14.01.05 – кардиология
14.01.13 - лучевая диагностика, лучевая терапия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт–Петербург – 2013
Работа выполнена в Федеральном государственном бюджетном военном образовательном учреждении высшего профессионального образования "Военно-медицинская академия имени С.М. Кирова" Министерства обороны Российской Федерации
| Научные руководители: доктор медицинских наук доцент Гришаев Сергей Леонидович кандидат медицинских наук Сухов Вячеслав Юрьевич |
| Официальные оппоненты: Кицышин Виктор Петрович – доктор медицинских наук профессор, ФГБВОУ ВПО «Военно-медицинская академия имени С.М. Кирова» МО РФ, 1 кафедра (терапии усовершенствования врачей), профессор кафедры Поздняков Александр Владимирович – доктор медицинских наук профессор, ГБОУ ВПО «Северо-западный государственный медицинский университет им. И.И.Мечникова» Министерства здравоохранения Российской Федерации, кафедра лучевой диагностики и лучевой терапии, профессор кафедры. |
Ведущая организация: ФГБУ «Федеральный Центр сердца, крови и эндокринологии имени В.А. Алмазова» Министерства здравоохранения Российской Федерации.
Защита диссертации состоится 02 декабря 2013 г. в 11-00 часов на заседании совета по защите кандидатских и докторских диссертаций Д 215.002.06 на базе ФГБВОУ ВПО «Военно-медицинская академия имени С.М. Кирова» МО РФ (194044, г. Санкт-Петербург, ул. Академика Лебедева, д. 6)
С диссертацией можно ознакомиться в фундаментальной библиотеке ФГБВОУ ВПО «Военно-медицинская академия имени С.М. Кирова» МО РФ.
Автореферат разослан «____» __________ 2013 г.
| Ученый секретарь совета доктор медицинских наук | Черкашин Дмитрий Викторович |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования
Сердечно-сосудистые заболевания (ССЗ) атеросклеротического генеза, особенно ишемическая болезнь сердца, остаются основной причиной преждевременной смерти во всем мире. ССЗ возникают как у мужчин, так и у женщин; из всех смертей в Европе, произошедших в возрасте до 75 лет, 42% у женщин и 38% у мужчин связаны с ССЗ. Смертность от ССЗ меняется: стандартизированные по возрасту показатели снижаются в большинстве европейских стран, но остаются высокими в странах Восточной Европы. Совершенствование методов диагностики и лечения заболеваний сердечно-сосудистой системы относится к числу наиболее актуальных задач клинической медицины (Рекомендации ЕОК по профилактике ССЗ, 2012).
Профилактика эффективна: снижение смертности от ИБС на 50% связано с воздействием на факторы риска и на 40% с улучшением лечения. Профилактика ВСС — сложная проблема, поскольку медикаментозное лечение зачастую не дает ожидаемого эффекта. Одним из многообещающих направлений лечения злокачественных аритмий является использование омега-3-полиненасыщенных жирных кислот (-3-ПНЖК). Так, в исследовании GISSI-Prevenzione было показано, что применение -3-ПНЖК у больных, перенесших инфаркт миокарда, сопровождалось снижением смертности от всех причин, внезапной смерти и числа случаев повторного инфаркта миокарда. Анализ данных литературы видетельствует о том, что одним из наиболее перспективных неинвазивных методов исследования миокарда является однофотонная эмиссионная компьютерная томография (ОФЭКТ) сердца с метаболическими агентами – жирными кислотами, в частности с 123I-15-(р-йодфенил)-3R,S-мeтил пентадекановой кислотой (123I-ВМIPР), характеризующейся замедленным метаболизмом в сердечной мышце и широко применяющейся в последние десятилетия при оценке регионарного метаболизма жирных кислот в клиниках Европы, Америки и Японии.
Одним из самых частых нарушений ритма при ИБС является фибрилляция предсердий (ФП). На сегодняшний день не вызывает сомнения тот факт, что использование антиаритмической терапии ФП имеет ограниченную эффективность и сопряжено со значимым риском возникновения проаритмических и органно-токсических эффектов. Эти ограничения в применении антиаритмических препаратов (ААП) послужили толчком к разработке новых специфических терапевтических стратегий. Одна из них - возможность подавления ФП с помощью препаратов, не относящихся к антиаритмическим средствам, так называемая «uрstream» терапия. Под этим термином понимают лечебную тактику, целью которой является лечение основного заболевания, приводящего к ФП путем дезорганизации гемодинамики или развития предсердной патологии (ингибиторы АПФ, блокаторы рецепторов ангиотензина II, ингибиторы ГМГ-КoA редуктазы и -3-ПНЖК). Представляется достаточно перспективным использование -3-ПНЖК для профилактики возникновения ФП. Несмотря на то, что предложено несколько механизмов антиаритмического эффекта -3-ПНЖК, до настоящего времени точного определенного механизма не было установлено.
Цель исследования
С помощью однофотонной эмиссионной томографии сердца изучить динамику перфузии и метаболизма миокарда у больных ИБС с пароксизмальной формой фибрилляции предсердий при лечении препаратами из группы полиненасыщенных жирных кислот в дополнении к базисной антиангинальной терапии.
Задачи исследования
1.Сравнить влияние стандартной антиангинальной терапии и дополнительного применения препаратов на основе полиненасыщенных жирных кислот на перфузию миокарда у больных ИБС с пароксизмальной фибрилляцией предсердий по данным ОФЭКТ миокарда с Тс99–технетрилом.
2.Изучить изменение макроэнергетического состояния метаболизма кардиомиоцитов у больных ИБС с пароксизмальной фибрилляцией предсердий при лечении препаратами на основе полиненасыщенных жирных кислот с помощью ОФЭКТ сердца с I123–йодофеном.
3.Провести сопоставление клинических проявлений ишемической болезни сердца, сократительной функции левого желудочка, вариабельности сердечного ритма и аритмогенного потенциала миокарда с характером и выраженностью нарушений перфузии и миокардиального метаболизма при использовании препарата, содержащего -3 полиненасыщенные жирные кислоты, для дополнительной терапии ишемической болезни сердца.
4.Установить наиболее значимые изменения клинико-инструментальных показателей эффективной 6-ти месячной антиангнальной терапии больных ИБС с пароксизмальной фибрилляцией предсердий с добавлением препарата на основе -3 полиненасыщенных жирных кислот.
5.Оценить антиаритмический эффект препарата на основе -3 полиненасыщенных жирных кислот в дополнении к антиаритмической терапии препаратами III класса у больных ИБС с пароксизмальной фибрилляцией предсердий.
Научная новизна
Научная новизна исследования определяется тем, что впервые установлен факт плейотропного влияния препаратов из группы полиненасыщенных жирных кислот на перфузию и метаболизм миокарда, способствующего расширению представлений по подбору оптимальной профилактики и терапии ИБС у больных с фибрилляцией предсердий.
Впервые при помощи перфузионно-метаболической ОФЭКТ у пациентов при применении полиненасыщенных жирных кислот для лечения ИБС, в дополнении к стандартной антиангинальной терапии, одновременно определяется коронарный кровоток и энергопотребление тканями сердца.
Впервые при помощи разработанного комплексного метода обследования (эхокардиография, вариабельность сердечного ритма, холтеровское мониторирование ЭКГ) оценивается аритмогенный потенциал сердца у пациентов с ИБС при применении полиненасыщенных жирных кислот.
Теоретическая и практическая значимость
В результате проведенного исследования установлено, что применение Омакора в дополнение к стандартной антиангинальной терапии у больных ИБС с рецидивирующей пароксизмальной фибрилляцией предсердий ведет к улучшению систолической функции левого желудочка, обратному ремоделированию левого предсердия и может быть рекомендовано пациентам с постинфарктным кардиосклерозом, диастолической дисфункцией и со сниженной фракцией выброса.
Результаты нашего исследования показали, что -3 ПНЖК оказывают положительное влияние на параметры ВСР у больных ИБС, осложненной рецидивирующей пароксизмальной фибрилляцией предсердий, усиливают протекторный парасимпатический тонус и нормализуют общую вариабельность сердечного ритма.
Приём препарата Омакор в дополнение к притивоаритмической терапии препаратами III класса является патогенетически обоснованным методом купирования эпизодов ФП у пациентов с ИБС.
Положения, выносимые на защиту
1.Метод однофотонной эмиссионной томографии сердца с перфузионными (Тс99–технетрил) и метаболическими (I123–йодофен) агентами позволяет эффективно оценивать изменения коронарного кровотока и метаболизм жирных кислот в сердце, что дает полную картину изменений происходящих в миокарде у больных ИБС с пароксизмальной фибрилляцией предсердий.
2.Применение -3 полиненасыщенных жирных кислот дополнительно к стандартной антиангинальной терапии в течение 6-ти месяцев влияет на морфофункциональные показатели сердца: улучшает его сократительную функцию, ведет к обратному ремоделированию левого предсердия и нормализует вариабельность сердечного ритма.
3.Применение -3 полиненасыщенных жирных кислот дополнительно к стандартной протекторной терапии ААП 3 класса уменьшает число развития новых пароксизмов фибрилляции предсердий и время купирования развившегося пароксизма, в большей степени у больных без перенесенного ранее в анамнезе инфаркта миокарда.
Личное участие автора в получении результатов, изложенных в диссертации
Автор лично участвовал в получении научных результатов, изложенных в диссертации, вел и обследовал пациентов кардиологического профиля, непосредственно выполнял сбор материала, участвовал в выполнении однофотонной эмиссионной томографии сердца, анализировал результаты лабораторных и инструментальных исследований, проводил статистический анализ полученных результатов и подготовку материалов к публикациям.
Апробация и публикация материалов исследования
Основные положения работы доложены на Международной научно-практической конференции «Многопрофильная клиника ХХI века: передовые медицинские технологии», (Санкт-Петербург, 2011 г.), 10-м Международном славянском Конгрессе по электростимуляции и клинической электрофизиологии сердца «КАРДИОСТИМ», (Санкт-Петербург, 2012 г.), VIII-й Международной научно-практической конференции «Внезапная смерть: от оценки риска к профилактике», (Санкт-Петербург, 2012 г.), Международном VI Невском радиологическом форуме, (Санкт-Петербург, 2013 г.), 1-м Международном образовательном форуме «Российские дни сердца», (Москва, 2013 г.), Российском национальном конгрессе кардиологов «От науки – к практике», (Санкт-Петербург, 2013 г.).
По теме диссертации опубликовано 12 печатных работ, в том числе 3 в журналах, включенных в перечень ведущих рецензируемых научных журналов и изданий, рекомендованных Высшей аттестационной комиссией для опубликования основных результатов диссертаций на соискание ученых степеней кандидата наук и доктора наук.
Реализация результатов исследования
Результаты исследования используются в научной и клинической работе кафедры и клиники военно-морской терапии Военно-медицинской академии, в лекционных курсах для факультетов подготовки врачей и для клинических ординаторов 1 – 2 годов обучения.
Структура и объем диссертации
Диссертация изложена на 164 страницах машинописного текста, состоит из введения, 5 глав, выводов, практических рекомендаций и указателя литературы, включающего 182 источника, в том числе 51 отечественного и 131 зарубежного. Текст иллюстрирован 41 таблицей и 26 рисунками.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Для реализации целей и задач исследования в него изначально было включено 129 пациентов, проходивших обследование и лечение в клиниках военно-морской терапии и 1-й кафедры (терапии усовершенствования врачей) Военно-медицинской академии им. С.М.Кирова. В исследование включены пациенты обоего пола, ограничение по возрасту—до 70 лет.
У всех пациентов была верифицирована ИБС на основании жалоб, анамнеза, объективного исследования, суточного мониторирования ЭКГ по Холтеру, ВЭМ или коронарографии. Неосложненный инфаркт миокарда в анамнезе имели 52 пациента (40 % обследуемых лиц). У всех пациентов ишемическая болезнь сердца сопровождалась пароксизмальной формой фибрилляции предсердий.
В основную группу изначально вошли 66 пациентов в возрасте 48 – 68 лет (средний возраст 58,9 года), у которых в результате проведенных нагрузочных проб было подтверждено наличие стабильной стенокардии напряжения I – II функционального класса с диагностически значимой депрессией сегмента ST на ЭКГ при нагрузочной пробе, либо гемодинамически значимый стеноз коронарной артерии по данным КАГ. Кроме этого, у пациентов основной группы по результатам теста 6-минутной ходьбы было подтверждено наличие 1-2 функционального класса сердечной недостаточности.
В основную группу включались пациенты с пароксизмальной формой мерцательной аритмии, имеющие приступы фибрилляции предсердий не реже, чем раз в месяц за последние 6 месяцев (один или более пароксизмов длительностью свыше 30 секунд, восстановление синусового ритма происходило самостоятельно, либо после фармакологической или электрической кардиоверсии, длительность пароксизма не превышала 2 суток). Приступ ФП подтверждался электрокардиографически.
Контрольная группа изначально включила в себя 63 пациента ишемической болезнью сердца, подтвержденной при нагрузочной пробе и/или при КАГ. Средний возраст пациентов составил 59,6 лет (от 47 до 69 лет). У всех включенных было так же подтверждено наличие фибрилляции предсердий серией электрокардиограмм.
Пациентам основной группы к базисной антиангинальной терапии, включающей АВК, статины, бета-адреноблокаторы, нитраты, ингибиторы АПФ и АРА, дополнительно в течении шести месяцев назначалась одна капсула препарата Омакор® (Abbott), содержащий 1000 мг длинноцепочечных -3 полиненасыщенных жирных кислот (ПНЖК), включая 460 мг эйкозапентаеновой и 380 мг докозагексаеновой ПНЖК (ЭПК и ДГК). Группа контроля получала только базисную антиангигальную и антиаритмическую терапию. Самостоятельно из за нежелания дальнейшего участия в исследовании прекратили прием Омакора 5 пациентов, и в последующем они были исключены из исследования.
Препарат переносился больными хорошо, однако у 2 пациентов отмечались диспептические расстройства, и они тоже были исключены из исследования с отменой препарата -3 полиненасыщенных жирных кислот. У 3 пациентов развился пароксизм фибрилляции предсердий, который за период исследования не удалось устранить методами кардиоверсии. Таким образом, в окончательном варианте основная группа была сформирована из 56 пациентов.
В контрольной группе, также 12 пациентов по тем или иным причинам были выведены из исследования, таким образом, контрольная группа в окончательном варианте составила 51 человек. В результате, в окончательную выборку вошли 107 пациентов. Общая характеристика пациентов обследованных групп представлена в таблице 1.
Таблица 1.
Клиническая характеристика обследованных больных.
| Группы обследованных Средние показатели | Основная группа Пациенты с ИБС и ФП + лечение -3 ПНЖК | Контрольная группа Пациенты с ИБС и ФП – стандартная терапия | |||
| Количество пациентов | 56 | 51 | |||
| Возраст, лет | 58,9±4,8 | 59,6±3,9 | |||
| Границы возраста, лет | 48-68 | 47-69 | |||
| Рост, см | 172,4±15,8 | 174,9±12,9 | |||
| Масса тела, кг | 78,6±5,9 | 77,4±6,1 | |||
| Длительность ИБС в анамнезе, лет | 11,3±5,9 | 13,9±6,2 | |||
| Перенесенный ОИМ в анамнезе | 25 | 19 | |||
| Функциональный класс стенокардии | I | 43 | 59 | ||
| II | 57 | 41 | |||
| Процент верифицирования ИБС по данным КАГ, % | 7 | 13 | |||
| Длительность ХСН, лет | 7,2±4,6 | 9,8±5,1 | |||
| Функциональ-ный класс ХСН | 1 | 53 | 55 | ||
| 2 | 41 | 36 | |||
| 3 | 6 | 9 | |||
| Длительность пароксизмальной ФП в анамнезе, месяцы | 7,4±4,5 | 8,2±3,2 | |||
| Степень артериальной гипертензии | 1 | 46 | 41 | ||
| 2 | 54 | 59 | |||
Все больные основной и контрольной групп до включения в исследование получали различную антиангинальную, гипотензивную и антиагрегантную терапию. После включения в исследования антиангинальная терапия стандартизировалась. Всем больным назначался варфарин под контролем МНО.
Приверженность пациентов к назначенному лечению была различной. В результате по завершении исследования 60,3% больных основной и контрольной групп получили блокаторы ренин-ангиотензиновой системы, 28,9% — антагонисты рецепторов ангиотензина II, 61,8% — статины, 46,7% — пролонгированные нитраты, 87,9% — варфарин, 17,3% — диуретики, 81,4% — -адреноблокаторы. После фармакологической кардиоверсии новокаинамидом, пропафеноном или амиодароном и восстановления синусового ритма, больные на протяжении всего исследования получали протекторную антиаритмическую терапию, в том числе 51,6% — соталол, 48,4% — амиодарон.
Алгоритм формирования групп.
При формировании всех групп проводился расспрос жалоб, изучался анамнез. Осуществлялось стандартное лабораторно-инструментальное обследование для выявления хронической ишемической болезни сердца, стабильной стенокардии напряжения I – II функционального класса. В исследование не включались пациенты со стенокардией напряжения III – IV функционального класса, некоронарогенными заболеваниями миокарда (кардиомиопатиями, пороками сердца, обменно-дистрофическими, эндокринными и воспалительными заболеваниями сердца). У 89 больных всех групп имела место гипертоническая болезнь II-III стадии. Диагноз артериальной гипертензии ставился на основании наличия умеренного или стойкого повышение АД по результатам его суточного мониторирования, наличия гипертрофии миокарда левого желудочка по данным эхокардиографии. Степень артериальной гипертензии определялась на уровне 1 – 2 по классификации ESH-ESC, 2012. Пациенты, имеющие артериальную гипертензию 3 степени, в исследование не включались.
В дальнейшем осуществлялась верификация хронической коронарной недостаточности по общепринятым критериям с помощью нагрузочных электрокардиографических проб (велоэргометрии), суточного мониторирования ЭКГ и/или коронарографии. Функциональный класс (ФК) стенокардии (в соответствии с Канадской классификацией) устанавливался на основании данных функциональных нагрузочных проб. В основной и контрольной группах ФК стенокардии существенным образом не различался и составлял I-II.
Из 107 пациентов неосложненный инфаркт миокарда в анамнезе имели 44 пациента (41 % обследуемых лиц), 25 человек в основной группе и 19 пациентов в контрольной. Срок перенесенного инфаркта до включения в исследование составлял от 5-ти лет до 1-го года (в среднем 2,7 года). У всех пациентов ишемическая болезнь сердца сопровождалась пароксизмальной формой фибрилляции предсердий. Таким образом, пациенты были разделены на 4 подгруппы, характеристика которых представлена ниже. Для удобства восприятия материала в последующем они называются группами.
Основная подгруппа с ПИКС (группа № 1) — n=25,
Основная подгруппа без ПИКС (группа № 2) — n=31,
Контрольная подгруппа с ПИКС (группа № 3) — n=19,
Контрольная подгруппа без ПИКС (группа № 4) — n=32.
Между исходными показателями – вес, рост, длительность существования ИБС, функциональный класс стенокардии и ХСН – достоверных отличий выявлено не было.
Для оценки глобальной и локальной сократимости сердца и его камер проводили эхокардиографическое исследование на аппарате «ACUSONSEQUOIA 512», (США). Вегетативные влияния на сердце и его автономную вегетативную активность исследовали методом оценки вариабельности сердечного ритма (ВСР) способом длинных записей при холтеровском мониторировании ЭКГ. Аритмогенный потенциал сердца определяли по характеру наджелудочковой и желужочковой эктопической активности за сутки: общее количество желудочковых и наджелудочковых экстрасистол, количество желудочковых и наджелудочковых экстрасистол за 1 час, количество пароксизмов неустойчивой желудочковой тахикардии.
Лучевые методы исследования.
Перфузионную однофотонную эмиссионную компьютерную томографию (ОФЭКТ) миокарда проводили на двухдетекторной гамма-камере SIEMENS. Cam, применялся меченый 99mTc препарат «Myoview» (тетрофосмин), производства Великобритании. При выполнении ОФЭКТ миокарда соблюдались нормы радиационной безопасности.
Использовали однодневный протокол исследования. Радиофармпрепарат (РФП) вводили внутривенно. Считывание начинали через 25 30 минут после введения РФП. Сканирование обследуемого проводили в положении лёжа. Для увеличения информативности методики выполнялась синхронизация ОФЭКТ с интервалами R–R на ЭКГ-мониторе. Использовался режим сбора: настройка гамма-камеры на фотопик 99mTc (140 кэВ), вращение детектора по кругу на 180o, шаг 3o, 60 проекций (по 25 секунд на каждую), импульсов на проекцию не менее 100 тысяч, матрица 64 х 64 пиксела, низкоэнергетический параллельный коллиматор с шириной симметричного энергетического окна дифференциального дискриминатора, равной 20 %.
Проводили компьютерную реконструкцию серии томосрезов по трём стандартным осям (продольная вертикальная, продольная горизонтальная, короткая) левого желудочка. Результаты компьютерной обработки суммы срезов по короткой оси приводили в виде:
– полярной карты (polarmap), отражающей распространённость дефектов перфузии левого желудочка в условных проекциях коронарных артерий (LAD – передней ветви левой коронарной артерии, LCX – огибающей ветви левой коронарной артерии, RCA – правой коронарной артерии); оценку производили по трём шкалам: Nml (normal) – зона нормальной перфузии, Fix (fixed) – распространённость устойчивых дефектов перфузии, Rev (rever-sible) – зона транзиторной ишемии миокарда;
–полярных карт, условно представленных в виде 17 сегментов отражающих распространённость нарушений перфузии миокарда (%) в каждом из сегментов до и после нагрузки;
При разделении левого желудочка на 17 сегментов выделяли 3 зоны верхушку (APEX), срединную (MID) и основание (BASE). Зону APEX в свою очередь делили непосредственно на верхушку (Apex) и четыре сегмента: Anterior – передний, Left – боковой, Inferior – нижний, Septum – перегородочный. Зоны MID и BASE делили на шесть сегментов: Anterior – передний, Left – боковой, Posterior – задний, Inferior – нижний, Septum – перегородочный, AnteriorSeptum – передне-перегородочный. Одним из важных преимуществ полярного картирования с 17-сегментным делением стала возможность сопоставления полученных данных перфузии с подвижностью, систолическим утолщением и локальной адреноактивностью миокарда, что значительно повысило точность диагностики ишемических изменений.
Измерялись (или вычислялись) следующие показатели перфузии:
— сумма баллов при нагрузке (PSSS);
— сумма баллов в покое (PSRS);
— разница суммарных баллов (PSDS).
Исследования метаболизма миокарда проводили исходно и через шесть месяцев (контрольное) на однофотонном эмиссионном компьютерном томографе E.Cam Var (Siemens) после введения 300-400 МБк 123I-ВМIPР (123I-Йодофен, Россия), раствора в альбумине. Процедуру исследования начинали через 20-30 мин после введения РФП в медленную фазу трансфера РФП. Реконструкцию проводили методом обратного проецирования с использованием фильтра Humming согласно руководству оператора програмно-аппаратного комплекса Esoft (Siemens), для постобработки использовали программу построения полярных диаграмм и трехмерной реконструкции в режиме реального времени 4DMSPECT (Мичиганский Университет, США).
Проводили компьютерную реконструкцию серии томосрезов по трём стандартным осям (продольная вертикальная, продольная горизонтальная, короткая) левого желудочка. Результаты компьютерной обработки суммы срезов по короткой оси приводили в виде:
–полярных карт (polarmap) левого желудочка, условно представленных в виде 17 сегментов, отражающих распространённость снижения метаболической активности миокарда в процентах (MetSr) в каждом из сегментов;
– полярных карт, отражающих выраженность изменений метаболизма в кардиомиоцитах с вычислением суммарных баллов (MetSa), которые рассчитывали по количеству сегментов с нарушениями, оценивавшимися согласно 5-ти балльной шкале, где 0 – нормальный метаболизм, 1 – незначительное снижение метаболизма, 2 – умеренное снижение метаболизма, 3 – выраженное снижение метаболизма и 4 – отсутствие метаболической активности.
Методы статистической обработки результатов.
Статистический анализ проводился с использованием статистического пакета STATISTICA, v7.0 (StatSoft, USA). Были выполнены первичный и разведочный статистический анализ с целью оценки вида распределения основных показателей в подгруппах и выявления возможных выбросов по критерию 2. Было выявлено, что выбросов в данных нет, но распределения большинства показателей достаточно сильно различаются по вариабельности и имеют распределения, отличающиеся от нормального. Поэтому дальнейший анализ (сравнение подгрупп) проводился с использованием, как параметрических, так и непараметрических критериев. Для сравнения подгрупп внутри первого или второго обследований и для сравнения эффектов лечения между подгруппами использовались однофакторный дисперсионный анализ, ANOVA с критерием Шеффе для множественных сравнений post hoc, и непараметрические критерии Краскела-Уоллиса и медианный с критерием множественных сравнений Краскела-Уоллиса. Для оценки эффекта лечения использовались критерии для связных, парных выборок: параметрический t-критерий для связанных выборок и непараметрические критерии — знаков и Вилкоксона. Учитывая требования принципа Бонферрони, при параллельном сравнении нескольких показателей пороговое значение уровня значимости было выбрано равным менее 0,005.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Оценка результатов 6-ти месячного курса лечения -3 ПНЖК больных ИБС в сочетании с рецидивирующей фибрилляцией предсердий свидетельствовала о хорошей переносимости препарата Омакор.
Хотя оценка поглощения [F18] 2-фтор-2-дезоксиглюкозы (ФДГ) при ПЭТ считается «золотым» стандартом для оценки жизнеспособности миокарда, исследования показали, что измерения метаболической активности по уровню поглощения свободных жирных кислот более чувствительны, чем поглощение ФДГ, для прогнозирования восстановления систолической функции в результате лечения. Оценка метаболизма миокарда оказалась очень полезной для понимания влияния различных видов терапии при ИБС. При сравнении регионов нарушения обмена веществ, изменений реполяризации и снижения поглощения перфузионного трейсера в 92% было отмечено совпадение показателей (di=0,615-0,998), в 8% - несоответствие (di= 0,002-0,385). Повторная ОФЭКТ с йодофеном после лечения -3 ПНЖК показала улучшение накопления агента в ранее отмеченных секторах. В группе сравнения, получавшей только стандартную терапевтическую схему, значимого улучшения не наблюдалось.
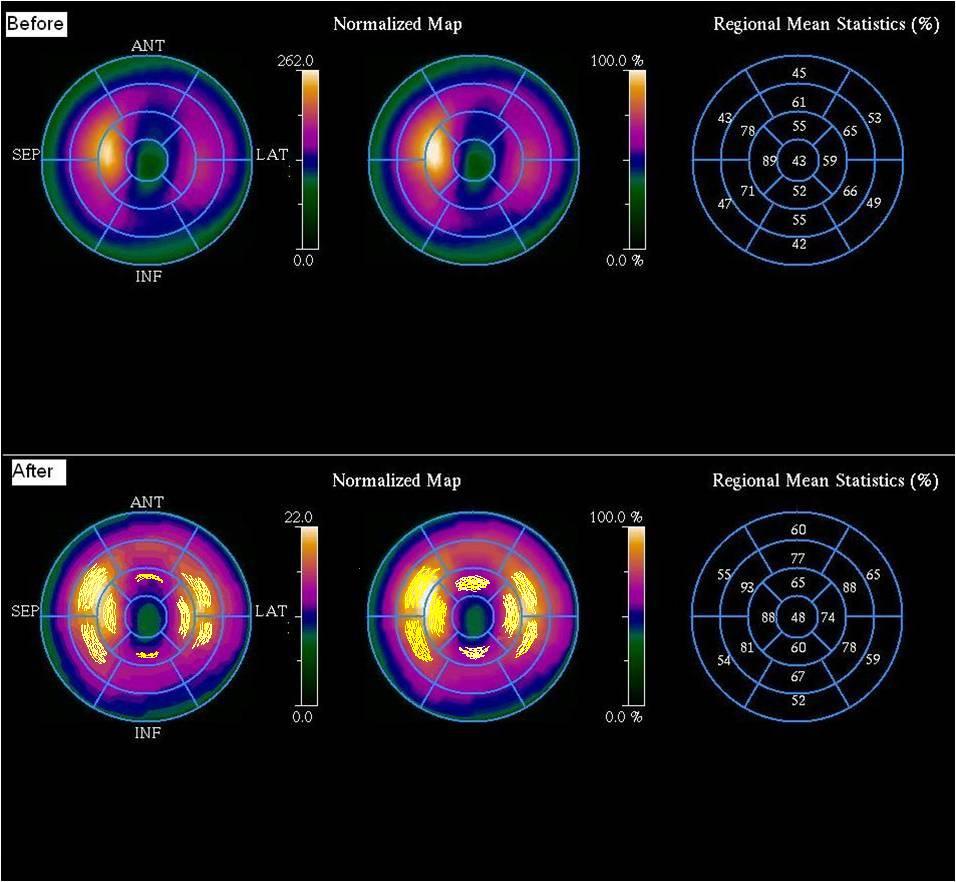
Рисунок 1. Полярные диаграммы пациента N исходного и контрольного исследования метаболизма сердечной мышцы с 123I-ВМIPР препарат (123I-Йодофен).
К наиболее значимым изменениям показателей ОФЭКТ после 6-ти месячной антиангинальной терапии больных ИБС с пароксизмальной фибрилляцией предсердий с добавлением препарата на основе полиненасыщенных жирных кислот можно отнести различия в корреляционной структуре перфузионно-метаболических эффектов и величине изменения этих показателей с информативностью до 81%. Наиболее значимые изменения (р<0,001) наблюдаются в улучшении показателей метаболизма миокарда (сумма баллов снижения метаболизма и процент снижения метаболизма). Полярные диаграммы изменений метаболизма миокарда после 6-ти месяцев лечения -3 ПНЖК по данным ОФЭКТ представлены на рисунке 1.
При включении в исследование состояние центральной гемодинамики больных характеризовалось умеренным увеличением конечного диастолического (КДр) и систолического размеров (КСр) левого желудочка, небольшим снижением фракции выброса (ФВ) у больных, прежде всего, с постинфарктным кардиосклерозом как основной, так и контрольной групп. Индекс массы миокарда левого желудочка во всех группах составил от 102,4±18,9 до – 115,3±32,2 г, значимого различия исходно и после лечения не отмечалось.
Через 6 месяцев лечения при анализе морфофункциональных показателей у больных трех групп (1, 2 и 4), кроме контрольной с ПИКС, отмечалась значимая тенденция к уменьшению КДр, КСр, и увеличению фракции выброса. У больных контрольной группы отмечены несколько меньшие сдвиги по сравнению с основной группой как с ПИКС, так и без ПИКС. Значимые различия исходно (до включения в исследование) имелись попарно между 1 и 2, 3 и 4 группами (p<0,001).
Через 6 месяцев лечения у больных основной группы с ПИКС, принимавших 1,0 г омакора уменьшились по сравнению с исходным значением КДр на 2,74% (p<0,001), КСр – на 6,25% (p<0,001), ФВ увеличилась на 14,2% (p<0,001). В основной группе без ПИКС за этот же период лечения отмечена лишь тенденция к уменьшению размеров КДр, ФВ увеличилась на 10,3% (p<0,001), КСр значимо уменьшился на 5,23% (p<0,001). При анализе абсолютных величин ультразвуковых параметров в контрольной группе значимые структурно-функциональные изменения имели положительную динамику только в подгруппе пациентов без постинфарктного кардиосклероза. В группе 4 через 6 месяцев лечения был меньшим КСр на 5,32% (p=0,001) и увеличивалась ФВ левого желудочка на 11,3% (p<0,001) по сравнению с исходными показателями. Поскольку в развитии и поддержании фибрилляции предсердий существенную роль играет ремоделирование предсердий, изучалась динамика передне-заднего размера левого и правого предсердия. Значимые различия до включения в исследование имелись попарно между 1 и 2, 3 и 4 группами (p<0,001). Исходная величина показателя передне-заднего размера левого предсердия была значимо больше у лиц с постинфарктным кардиосклерозом, по сравнению с таковой у лиц без инфаркта миокарда в анамнезе. Через 6 месяцев лечения у больных основной группы 1 (с ПИКС), принимавших 1,0 г Омакора размеры ЛП уменьшились по сравнению с исходным значением на 4,61% (p<0,001), в группе 2 (без ПИКС) размеры ЛП уменьшились по сравнению с исходным значением на 3,54% (p<0,001). Менее значимая положительная динамика уменьшения размеров ЛП на 1,6% (р=0,02) отмечалась в контрольной группе 4 (без ПИКС). Значимых изменений динамики размеров правого предсердия в конце исследования не выявлено как у пациентов с ПИКС, так и без ПИКС, однако отмечена тенденция уменьшения передне-заднего размера ПП в основной группе (группы 1 и 2, р=0,04 и р=0,17, соответственно). Обратное ремоделирование левого предсердия может быть связано с доказанным нами улучшением обменно-метаболических процессов миокарда и снижением средней ЧСС на фоне на фоне 6-ти месячного приема антиаритмических препаратов III класса (Vaughan-Williams, 1971), обладающих ритм-урежающим эффектом.
Статистическая значимость изменений параметров ЭхоКГ в процессе лечения, систолической и диастолической функций левого желудочка и размеры камер сердца приведены в таблице 2.
Таблица 2.
Оценка значимости изменений значений показателей ЭхоКГ за 6 месяцев терапии.
| № | Показатель | Группа 1 | Группа 2 | Группа 3 | Группа 4 |
| 1. | ФВ,% | <0,001; <0,001; <0,001 | <0,001; <0,001; <0,001 | 0,02; 0,05; 0,02 | <0,001; 0,005; 0,001 |
| 2. | КДр, мм | <0,001; 0,004; 0,003 | 0,005; 0,006; 0,003 | 0,33; 0,45; 0,76 | 0,002; 0,005; 0,003 |
| 3. | КСр, мм | <0,001; 0,008; 0,002 | <0,001; 0,008; 0,008 | 0,05; 0,02; 0,02 | <0,001; 0,002; 0,001 |
| 4. | ЛП, мм | <0,001; 0,001; 0,001 | <0,001; <0,001; 0,001 | 0,45; 0,61; 0,33 | 0,002; 0,002; 0,004 |
| 5. | ТЗС, мм | 1,0; 1,0; 1,0 | 0,33; 1,0; 1,0 | 0,03; 0,08; 0,06 | 0,23; 1,0; 0,31 |
| 6. | ТМЖП, мм | 0,33; 1,0; 1,0 | 0,05; 0,02; 0,02 | 0,16; 0,48; 1,0 | 0,03; 0,02; 0,03 |
| 7. | ИММЛЖ, мм | 0,005; 0,05; 0,03 | 0,21; 0,33; 0,25 | 0,31; 0,82; 0,61 | 0,45; 0,34; 0,27 |
| 8. | ПП, мм | 0,04; 0,06; 0,13 | 0,17; 0,36; 0,17 | 0,06; 0,12; 0,09 | 0,02; 0,03; 0,12 |
| 9. | ПЖ, мм | 0,03; 0,08; 0,06 | 0,48; 0,14; 0,17 | 0,05; 0,12; 0,12 | 0,21; 0,04; 0,18 |
Приведены последовательно значения р для критериев: параметрического t-критерия для связанных выборок и непараметрических критериев — знаков и Вилкоксона.
Наличие перенесенного инфаркта миокарда оказывает существенное влияние на показатели вариабельности сердечного ритма. Поскольку у 44 пациентов (41 % обследуемых лиц), включенных в исследование, в анамнезе был перенесен инфаркт миокарда, группы больных, получавших 6 месяцев -3 ПНЖК в дополнение к стандартной антиангинальной и антиаритмической терапии и группа контроля были разделены подгруппы аналогично анализу показателям эхокардиографии.
Было проведено также измерение вариабельности ритма сердца, дважды до лечения и после 6 месячного курса терапии. При оценке исходных данных у всех пациентов было выявлено снижение параметров ВСР по сравнению с общепринятыми нормальными показателями. Неосложненный инфаркт миокарда в анамнезе имели 44 пациента. Влияние постинфарктного кардиосклероза (ПИКС) на показатели вариабельности ритма сердца были выявлены в ряде исследований (Амиров Н.Б. Вариабельность сердечного ритма у лиц с постинфарктным кардиосклерозом, 2008; Zipes D. P. Influence of myocardial ischemia and infarction on automatic innervation of heart // Circulation, 1990).
В нашем исследовании так же уровень SDNN, rMSSD, pNN50% и SDANN у пациентов с ПИКС был ниже по сравнению с этими показателями у больных без ПИКС, p<0,001 (значения р приведены для параметрического t-критерия для связанных выборок, только для различий между подгруппами в основной группе), что свидетельствует о более выраженном нарушении ВСР у больных, имевших постинфарктный кардиосклероз. Другие исходные показатели в подгруппах основной и контрольной группы достоверно не различались (p0,01).
Увеличение nHF у пациентов основной 1 и 2 группы свидетельствует об увеличении относительного уровня парасимпатических влияний ВНС на регуляцию миокарда. Достоверного изменения уровня nHF у больных контрольной группы с ПИКС (рис. 2) не наблюдалось. Имелось значимое повышение nHF на 17,5% (p=0,001) и в контрольной группе больных ИБС без ПИКС.
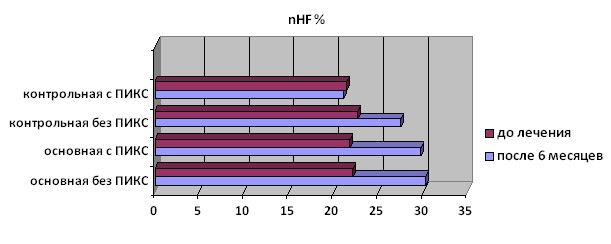
Рисунок 2. Изменение параметра nHF у больных основной и контрольной группы на фоне терапии омакором.
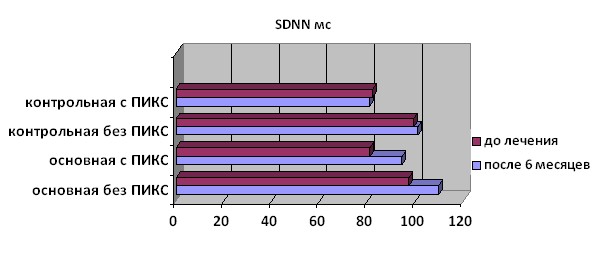
Рисунок 3. Изменение параметра SDNN у больных основной и контрольной группы на фоне терапии омакором.
К 6-му месяцу лечения у пациентов основной группы как с ПИКС, так и без ПИКС было выявлено значимое повышение уровня SDANN и показателя характеризующего общую вариабельность сердечного ритма SDNN (рис. 3), показатель увеличился на 13,9% и 11,6%, соответственно (p=0,002 и p<0,001). В других подгруппах динамики этого показателя не отмечалось.
Уровень pNN50 также значимо увеличился к 6-му месяцу терапии Омакором у всех пациентов основной группы (p=0,008 и p<0,001, соответственно) практически в 2 раза. Однако в подгруппе больных ПИКС этот показатель оставался ниже, чем у пациентов, не имеющих ПИКС в анамнезе. В контрольной группе величина этого параметра значимо не изменялась. (Рис. 4).
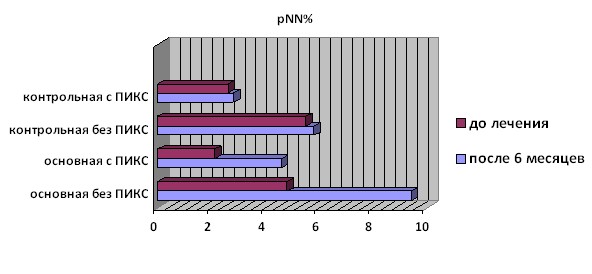
Рисунок 4. Изменение параметра pNN50 у больных основной и контрольной группы на фоне терапии омакором
Выявлено значимое (p=0,001) увеличение уровня rMSSD (Рис.5), показателя, который отражает напряжение парасимпатического отдела ВНС, у пациентов без ПИКС основной группы - этот показатель повысился на 22,4 %, в то время как у больных основной группы, перенесших в анамнезе инфаркт миокарда, а также у всех пациентов контрольной группы, он не изменился.
Достоверного изменения параметров SDNNidx, а также показателей частотной области (VLF, LF и HF) в нашем исследовании выявлено не было.
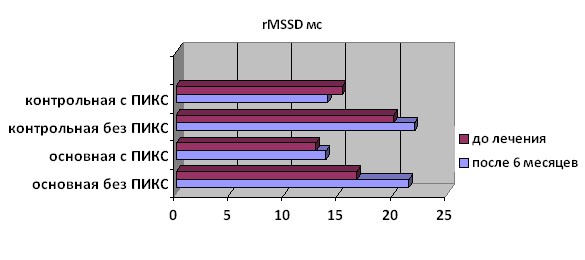 Рисунок 5. Изменение параметра rMSSD у больных основной и контрольной группы на фоне терапии омакором.
Рисунок 5. Изменение параметра rMSSD у больных основной и контрольной группы на фоне терапии омакором.
Для оценки аритмогенного потенциала сердца изначально в группу принимавших -3-ПНЖК было включено 66 пациентов. В основной группе самостоятельно (нежелание дальнейшего участия в исследовании) прекратили прием Омакора 5 пациентов, и в последующем они были исключены из исследования. Из-за развившихся нежелательных явлений (диспептические расстройства) 2 пациента тоже были исключены из исследования с отменой Омакора. У 3 пациентов развился пароксизм фибрилляции предсердий, который за период исследования не удалось устранить методами кардиоверсии.
В рамках исследования аритмогенного потенциала сердца в контрольной группе (63 пациента) было отмечено 126 эпизодов ФП за 6 месяцев наблюдения. Полный купирующий антиаритмический эффект был отмечен в 99 (78,6%) из 126 эпизодов. У 12 пациентов контрольной группы пароксизм фибрилляции предсердий купировать фармакологической кардиоверсией не удалось. У 5 пациентов контрольной группы пароксизмов ФП за время исследования зарегистрировано не было. У 46 оставшихся пациентов среднее время купирования пароксизмов ФП составило в среднем 550±96,8 минуты (р<0,05). Под временем купирования понимался временной промежуток от начала введения амиодарона в насыщающей дозе до прекращения развившегося пароксизма фибрилляции предсердий. В основной группе у 7 пациентов, принимавших -3-ПНЖК, прекративших прием самостоятельно или выбывших до окончания исследования в результате развившихся нежелательных явлений (в среднем в течение 76±27 дней), зарегистрирован 61 эпизод ФП. Среднее время купирования пароксизма в этой группе составило 259±56,8 минут (р<0,05). У 45 пациентов принимавших -3-ПНЖК в течение 6 месяцев, зарегистрировано 43 эпизода ФП. Прием препарата дополнительно к протекторной антиаритмической терапии оказался более эффективным методом профилактики повторных рецидивов у всех пациентов, а среднее время купирования составило 244,41±62,27 мин (p>0,05). У 11 пациентов основной группы пароксизмов ФП за время исследования зарегистрировано не было вовсе. Среднее время от момента включения в исследование до развития нового пароксизма в контрольной группе составило 1218±640 часов (51 день), среднее время до развития нового пароксизма в основной группе составило 2468±830 часов (103 дня). Рисунок 6 демонстрирует основные параметры развития и существования пароксизмальной фибрилляции предсердий у обследуемых групп.
Поскольку распределения основных показателей аритмогенного потенциала оказались либо далекими от нормального, либо с очень различными дисперсиями, сравнение производилось по непараметрическим критериям Краскела-Уоллеса и медианному. Результаты сравнения получились практически одинаковыми для всех 8 показателей: Везде получены сильно статистически значимые различия (кроме показателя «ЖЭС в час», у которого для критерия Краскела-Уоллиса было получено р=0,05, а для медианного — р=0,11). Критерий множественных сравнений показал, что везде различие определяется отличием основной группы от контрольной.

Рисунок 6. Диаграмма различий возникновения и длительности пароксизмов фибрилляции предсердий для исследуемых групп после завершения исследования.
Поэтому следующим шагом стало сравнение групп по непараметрическому критерию Вальда-Вольфовица. Этот критерий показал отсутствие различий для показателей «НЖЭС в час» (р=0,40) и «ЖЭС в час» (р=0,45). Выявлена явная тенденция к снижению средней ЧСС за сутки.
В таблице 3 приведены значения медиан и квартилей для 8 исследуемых показателей в двух основных группах.
Таблица 3.
Значения средних значений медиан и квартилей показателей аритмогенного потенциала по данным холтеровского мониторирования ЭКГ.
| № | Показатель | Основная группа n=45 | Контрольная группа n=46 | p Вальда-Вольфовица |
| 1. | Время до нового пароксизма ФП (дни) | 2468±830 2412 (1768; 3126) | 1218±640 963 (721; 1462) | 0,002 |
| 2. | Время длительности пароксизма ФП (часы) | 10,5±8,2 8 (4; 12) | 25,4±9,7 27 (18; 32) | 0,001 |
| 3. | Время купирования после введения ААП (минуты) | 259 (316; 415) | 550 (467; 630) | <0,001 |
| 4. | Количество пароксизмов в сутки | 3 (2; 4) | 6 (4; 10) | <0,001 |
| 5. | НЖЭС в час | 10 (8; 12,5) | 32 (24; 36) | 0,40 |
| 6. | ЖЭС в час | 32 (30; 33,5) | 30 (25; 32) | 0,45 |
| 7. | Пробежки ЖТ | 1 (0; 1) | 5 (3; 6) | <0,001 |
| 8. | Ср. ЧСС за сутки | 59 (47; 74) | 78 (62; 95) | 0,51 |
Из таблицы видно, что имеются значимые изменения в основной группе от контрольной прежде всего в увеличении среднего времени до развития нового пароксизма фибрилляции от включения в исследование, в контрольной группе медиана составила 963 часов (41 день), медиана среднего времени до развития нового пароксизма фибрилляции в основной группе составила 2412 часов (101 день), что доказывает усиление протекторного антиаритмического эффекта -3 ПНЖК в дополнение к антиаритмической терапии амиодароном и соталолом. При том, что медиана желудочковых экстрасистол в час достоверной динамики не имела, наблюдается отчетливый эффект снижения риска жизнеугрожающих аритмий в виде уменьшения эпизодов пробежек неустойчивой желудочковой тахикардии на 80% (р<0,001).
Ранее в исследованиях предполагались механизмы антиаритмического действия -3 ПНЖК, которые могут быть классифицированы следующим образом: модификация системы эйкозаноида; модификация состава жирных кислот мембраны фосфолипидов; прямой эффект неэстерифицированных жирных кислот на миокард; эффект -3 ПНЖК на инозитол липидный цикл и сигнальные клетки; влияние -3 ПНЖК на Са2+ - каналы.
Представляется, что снижение частоты рецидивов ФП после приема -3 ПНЖК является результатом взаимодействия двух или более этих механизмов. Не исключено, что протекторный механизм действия -3 ПНЖК обусловлен модулированием каналов кальция L-типа в сарколемме кардиальных миоцитов, что предотвращает увеличение цитозольных уровней кальция. Такая модуляция, контролируя вход и выход кальция, обеспечивает нивелирование предсердной дисперсии рефрактерности.
При исследовании перфузии миокарда методом ОФЭКТ статистически достоверные отличия площади дефектов перфузии между основной и контрольной группами 1 и 3 имеют место в 7-ми из 17-ти сегментов. Между группами 2 и 4 также достоверные отличия имеют место в 5-ти из 17-ти сегментов, тогда как лишь 1-н сегмент (П.Бок.Ср.) из 17-ти имеет значимые различия по дефектам перфузии при обобщенном сравнении основной и контрольной групп.
Статистический анализ перфузионных нарушений показал, что площадь нарушения перфузии миокарда как больных основной группы с ПИКС, так и больных ИБС без ПИКС значимо не отличается (в бассейнах LCX и RCA) от этого показателя у лиц, контрольной группы. Тогда как, при сравнении средних значений указанного показателя у пациентов группы 1 и группы 3, статистически значимые различия существовали только в бассейне передней межжелудочковой ветви левой коронарной артерии, при этом оценка общей площади дефекта перфузии (ТОТ) достоверных различий не выявила.
Глубина дефекта перфузии миокарда (снижение по отношению к максимуму) в большинстве сегментов ЛЖ была наименьшей у пациентов 3 группы. Статистически значимые отличия выраженности нарушения перфузии миокарда левого желудочка в обьединенной основной группе (1 и 2) по сравнению с пациентами контрольной группы (3 и 4) не выявлены.
Суммарный балл перфузии, как в покое, так и при нагрузке, определяется сложением балльной оценки каждого сегмента с нарушениями, т.е. чем больше балл, тем хуже. Различие суммарных баллов определяет выраженность транзиторной ишемии, чем выше балл, тем более выражена. То же положение применяется и для метаболизма - большие показатели определяют большую распространенность и выраженность метаболических нарушений.
Статистический анализ показал, что у всех больных ИБС с ПФП исходно имеет место снижение перфузии и метаболизма миокарда по данным ОФЭКТ. Для показателей PSSSи PSRS нет различий только между (1-й и 3-й) и (2-й и 4-й) группами. Это свидетельствует о том, что исходно перфузия в покое и при нагрузке в основной и контрольной группах с ПИКС и в основной и контрольной группах без ПИКС одинаковы. А именно, что группы с постинфарктным кардиосклерозом и без него достаточно стратифицированы.
Для показателя PSDS не различаются только 2-я и 4-я группы. Признаки транзиторной ишемии минимальны в основной группе с ПИКС, незначительно увеличены в контрольной группе без ПИКС и максимальны в контроле с ПИКС.
Прием Омакора слабее влияет на улучшение показателей метаболизма при наличии ИМ. Повышение метаболической активности во всех случаях более значимо после курса лечения Омакором. Практически нет изменений метаболизма в контрольной 3-й группе с ПИКС, слабо значимые изменения в группе 4.
Для показателя MetSr и MetSа исходно не различаются только (1-я и 3-я) и (2-я и 4-я) группы. Это свидетельствует о том, что исходно метаболизм в основной и контрольной группах с ПИКС и в основной и контрольной группах без ПИКС примерно одинаковый.
Для показателей MetSr и MetSа различаются все группы. Процент нарушения метаболизма после курса лечения оказался наименьший у пациентов без ПИКС, принимавших Омакор, по сравнению теми же, но с ПИКС, и с контролем, независимо от наличия или отсутствия ПИКС.
В таблице 6 обобщены результаты исследования метаболизма и перфузии в подгруппах пациентов основной и контрольной групп по двум точкам в ходе периода наблюдения (до и после курса лечения) для наглядности оценки динамики показателей ОФЭКТ.
Таблица 4.
Сравнение подгрупп больных ИБС с
ФП в основной и контрольной группе по изменениям показателей перфузионной и метаболической ОФЭКТ (d–разница показателей до и после лечения).
| Показатель | Группа 1 | Группа 2 | Группа 3 | Группа 4 | р1, р2, р3 |
| dPSSS | –2,9±1,8 | –0,8±2,7 | –0,7±2,1 | –0,1±3,2 | 0,21; 0,04; 0,07 |
| dPSRS | –2,1±1,5 | –0,5±2,4 | –1,0±2,2 | –0,3±2,8 | 0,32; 0,01; 0,09 |
| dMetSa | –3,9±2,7 | –5,0±3,0 | –0,2±3,0 | –1,6±2,2 | 0,001; 0,001; 0,002 |
| dMetSr | –3,8±3,2 | –5,2±3,8 | –0,2±1,5 | –1,4±2,5 | 0,004; 0,003; 0,005 |
Для разницы показателей dPSSS, dPSRS, dMetSa и dMetSr имеются значимые различия только для показателей метаболизма миокарда во всех группах. Данные исследования представлены в таблице 6. Изменения этих показателей до и после лечения существенно различаются в основной группе – без ИМ положительный эффект выше.
Таблица 5.
Динамика показателей (M±m ) перфузионной и метаболической ОФЭКТ у больных ИБС с ФП в подгруппах основной (n=56) и контрольной (n=51), *-р<0,005
| Показатели ОФЭКТ | Группа | Период наблюдения | ||
| До лечения | 6 мес. | |||
| MetSa сумма баллов снижения метаболизма | Основная группа | ПИКС (группа 1) | 26,1±7,7 | 22,2±7,2* |
| Без ПИКС (группа 2) | 17,9±5,3 | 12,9±4,3* | ||
| Контрольная группа | ПИКС (группа 3) | 27,8±8,2 | 27,6±7,6 | |
| Без ПИКС (группа 4) | 19,0±6,1 | 17,4±5,9 | ||
| MetSr % снижения метаболизма | Основная группа | ПИКС (группа 1) | 23,2±7,6 | 19,4±5,9* |
| Без ПИКС (группа 2) | 16,3±5,3 | 11,1±3,6* | ||
| Контрольная группа | ПИКС (группа 3) | 24,8±5,5 | 24,6±5,3 | |
| Без ПИКС (группа 4) | 17,4±3,7 | 15,8±3,2 | ||
ВЫВОДЫ
1. Результаты перфузионной ОФЭКТ миокарда с Тс99m-технетрилом свидетельствуют, что применение препаратов на основе полиненасыщенных жирных кислот, дополнительно к стандартной антиангинальной терапии, значимо не улучшает перфузионные показатели у больных ИБС с пароксизмальной фибрилляцией предсердий.
2. С помощью радиоизотопной сцинтиграфии с использованием 123I-Йодофена можно эффективно оценить степень снижения метаболизма миокарда и уровень его восстановления в ходе лечения, отслеживая активность процессов бета-окисления в кардиомиоцитах, что в совокупности с перфузионными исследованиями дает полную картину изменений, происходящих в сердечной ткани у пациентов с ИБС.
3. К наиболее значимым изменениям показателей ОФЭКТ после 6-ти месячной антиангинальной терапии больных ИБС с пароксизмальной фибрилляцией предсердий с добавлением препарата на основе полиненасыщенных жирных кислот можно отнести различия в корреляционной структуре перфузионно-метаболических эффектов и величине изменения этих показателей с информативностью до 81%. Наиболее значимые изменения (р<0,001) наблюдаются в улучшении показателей метаболизма миокарда (сумма баллов снижения метаболизма и процент снижения метаболизма).
4. После курсового 6-ти месячного приема препарата -3-ПНЖК в дополнение к стандартной терапии ишемической болезни сердца отмечено значимое увеличение ФВ левого желудочка (р<0,001), уменьшение размеров левого предсердия (р<0,001), прирост общей вариабельности ритма (p=0,002) и повышение парасимпатического тонуса (p=0,001), что расценивается как усиление лечебного эффекта.
5. Приём препарата -3-ПНЖК в дополнение к притивоаритмической терапии амиодароном или соталолом является патогенетически обоснованным методом купирования редких эпизодов ФП у пациентов при выраженных, либо слабо выраженных структурных заболеваниях сердца. Добавление к купирующей терапии -3-ПНЖК уменьшает число эпизодов фибрилляции предсердий (на 50% в среднем, р<0,001) и уменьшает время их купирования (на 291±61,2 мин. в среднем, р<0,001).
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Больным ишемической болезнью сердца осложненной пароксизмальной формой фибрилляцией предсердий рекомендовано проведение однофотонной эмиссионной томографии сердца с 123I-Йодофеном для оценки выраженности метаболических нарушений и возможности их последующей коррекции метаболически активными препаратами.
2. Больным ИБС с рецидивирующей пароксизмальной формой фибрилляции предсердий для протекторной терапии с целью удержания синусового ритма рекомендовано к проводимой антиаритмической терапии курсовой прием препаратов -3-полиненасыщенных жирных кислот, содержащих смесь очищенных этиловых эфиров эйкозапентаеновой и докозагексаеновой кислот в дозировке 1,0 грамм в сутки.
3. Больным с постинфарктным кардиосклерозом и пароксизмальной формой фибрилляции предсердий для улучшения сократительной функции, предотвращения тахизависимого ремоделирования камер сердца и восстановления параметров вариабельности ритма сердца показано в дополнение к стандартной антиангинальной терапии назначение -3-полиненасыщенных жирных кислот.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Гришаев, С.Л. ОФЭКТ-исследования метоболизма миокарда с [123i]-йодофеном у пациентов с различной кардиальной патологией / С.Л. Гришаев, В.Ю. Сухов, А.А. Исмаилов, Э.В. Гладышева // Вестн. Рос. ВМедА. – 2011. – Прил.1 (33). – С. 200 - 201.
- Гришаев, С.Л. Способ количественного определения показателя успешной возможности восстановления ритма сердца у больных с фибрилляцией предсердий / С.Л. Гришаев, В.Ю. Сухов, А.А. Исмаилов, Г.В. Дмитриев // Фундаментальные исслед. – 2011. – № 11. - С. 284-286.
- Гришаев, С.Л. ОФЭКТ-исследования метаболизма миокарда с [123i]-йодофеном у пациентов с ишемией сердца / С.Л. Гришаев, В.Ю. Сухов, А.А. Исмаилов // Мат. итог. конф. ВНОС и ординаторов I фак. ВМедА. - СПб.: ВМедА. – 2011. – С. 85-86.
- Гришаев, С.Л. Метаболическая ОФЭКТ- миокарда с [123i]-йодофеном у пациентов с ИБС / С.Л. Гришаев, В.Ю. Сухов, А.А. Исмаилов // Мат. межд. науч. – практ. конф. Многопрофильная клиника ХХI века: Передовые медицинские технологии. - СПб. - 2011. - С. 79.
- Sukhov, V.Y. Polyunsaturated Fatty Acids Effects Assessment in Patients with CAD by Means of Nuclear Medicine / V.Y. Sukhov, S.L. Grishaev, A.A. Ismailov // Eur. J. Nuclear Medicin & Molekular Imaging. – 2011. - Vol. 38. – Suppl. 2. - P. 319 - 320.
- Grishaev, S.L. Myoсardial G-spekt in patients with atrial fibrillation treated with pufa / S.L. Grishaev, V.Y. Sukhov, A.A. Ismailov, V.S. Nikiforov // Вестн. аритмологии. – Прил. А. – 2012. – С. 31.
- Гришаев, С.Л. Возможности коррекции метаболизма миокарда у больных ишемической болезнью сердца с нарушением сердечного ритма с помощью препарата омега-3-полиненасыщенных жирных кислот / С.Л. Гришаев, А.А. Исмаилов, В.Ю. Сухов, А.С. Свистов, В.С. Никифоров // VII Межд. науч. –практ. конф. Внезапная смерть: от оценки риска к профилактике. - СПб. - 2012. - С. 7.
- Сухов, В.Ю. Оценка изменения перфузии миокарда (по данным однофотонной эмиссионной компьютерной томографии сердца) на фоне базисной терапии ишемической болезни сердца в сопоставлении с клиническими данными / В.Ю. Сухов, С.Л. Гришаев, Г.В. Дмитриев, Д.Н. Елисеев, А.А. Исмаилов // Вест. Нац. мед. – хирургич. Центра им.Н.И. Пирогова. - 2012. - Т. 7, №2. - С. 93-98.
- Гришаев, С.Л. Оценка результатов лечения препаратами полиненасыщенных жирных кислот у больных ишемической болезнью сердца по данным однофотонной эмиссионной компьютерной томографии/ С.Л. Гришаев, А.А. Исмаилов, В.Ю. Сухов, А.С. Свистов // Мат. 1-го межд. образоват. форума: Российские дни сердца // Рос. кардиологич. журн. – 2013. - № 2 (100). – Прил. 2. -С. 45.
- Гришаев, С.Л. Оценка эффективности терапии препаратами полиненасыщенных жирных кислот с помощью однофотонной эмиссионной компьютерной томографии миокарда у пациентов с мерцательной аритмией / С.Л. Гришаев, А.А. Исмаилов, П.Ю. Кириченко, А.И. Марин, В.Ю Сухов // Межд. VI невский радиологический форум. – СПб. -2013. - С. 186.
- Гришаев, С.Л. Прогностическое значение перфузионно-метаболического несоответствия при исследовании миокарда у пациентов с ИБС / С.Л. Гришаев, А.А. Исмаилов, В.С. Никофоров, П.Ю. Кириченко, В.Ю. Сухов // Межд. VI невский радиологический форум. – СПб. - 2013. - С.182 - 183.
- Исмаилов, А.А. Влияние полиненасыщенных жирных кислот на метаболизм миокарда, сократительную функцию сердца и аритмогенный потенциал у больных ИБС с фибрилляцией предсердий / А.А. Исмаилов, С.Л. Гришаев, В.С.Никифоров, В.Ю. Сухов, В.Н. Солнцев // Мед. Вест. Юга Рос. - 2013. №4. - С. 103-108.
ПЕРЕЧЕНЬ ИСПОЛЬЗОВАННЫХ СОКРАЩЕНИЙ
ААП – антиаритмические препараты;
АТФ – аденозинтрифосфат;
ВДП – величина дефектов перфузии;
ВНС – вегетативная нервная система;
ВРС – варабельность ритма сердца;
ВПД – величина дефектов перфузии;
ГЛЖ – гипертрофия левого желудочка;
ГрЖЭС – групповая желудочковая экстрасистолия;
ГрНЭС – групповая наджелудочковая экстрасистолия;
ДГК – докозагексаеновая кислота;
ДФ – дискриминантная функция;
ЖЭС – желудочковые экстрасистолы;
ЖТ – желудочковая тахикардия;
ИМ – инфаркт миокарда;
ЙФПДК – йодфенилпентадекановая кислота;
КА – коронарная артерия;
КАГ – коронароангиография;
КДр – конечный диастолический размер;
КСр – конечный систолический размер;
ЛЖ – левый желудочек;
ЛКА – левая коронарная артерия;
ЛП – левое предсердие;
МЖП – межжелудочковая перегородка;
ММЛЖ – масса миокарда левого желудочка;
НЖЭС – наджелудочковые экстрасистолы;
ОКС – острый коронарный синдром;
ОФЭКТ – однофотонная эмиссионная компьютерная томография;
ПЖ – правый желудочек;
ПИКС – постинфарктный кардиосклероз;
ПКА – правая коронарная артерия;
ПП – правое предсердие;
ПФП – пароксизм фибрилляция предсердий;
РФП – радиофармпрепарат;
ТГ – триглицериды;
ТЗСЛЖ – толщина задней стенки левого желудочка;
ТМЖП – толщина межжелудочковой перегородки;
УО – ударный объём;
ФВ – фракция выброса;
ФЖ – фибрилляция желудочков;
ФК – функциональный класс;
ХМ – холтеровское мониторирование;
ЭПК – эйкозапентаеновая кислота;
-3-ПНЖК – омега-3-полиненасыщенные жирные кислоты.

