Исламовна проапоптотические факторы в структуре патогенеза гипоксически- ишемического поражения цнс у новорожденных детей
На правах рукописи
АЛБАГАЧИЕВА ДИАНА ИСЛАМОВНА
ПРОАПОПТОТИЧЕСКИЕ ФАКТОРЫ В СТРУКТУРЕ ПАТОГЕНЕЗА ГИПОКСИЧЕСКИ- ИШЕМИЧЕСКОГО ПОРАЖЕНИЯ ЦНС У НОВОРОЖДЕННЫХ ДЕТЕЙ
14.01.11 – Нервные болезни
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2010
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Российский Государственный Медицинский Университет» Федерального агентства по здравоохранению и социальному развитию.
Научный руководитель:
доктор медицинских наук,
профессор Голосная Галина Станиславовна
Официальные оппоненты:
доктор медицинских наук,
профессор Зыков Валерий Петрович
доктор медицинских наук,
профессор Маслова Ольга Ивановна
Ведущая организация:
Московский НИИ Педиатрии и Детской хирургии МЗ РФ.
Защита состоится «20» декабря 2010 года в 14.00 час. на заседании диссертационного совета Д 208.072.09 при ГОУ ВПО РГМУ Росздрава по адресу: 117997, Москва, ул. Островитянова, д. 1.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО РГМУ Росздрава по адресу: 117997, Москва, ул. Островитянова, д. 1.
Автореферат разослан «18» ноября 2010 года.
Ученый секретарь диссертационного совета
д.м.н., профессор Л.В. Губский.
Общая характеристика работы
Актуальность исследования. В последние два десятилетия актуальность проблемы прогнозирования перинатальных гипоксических поражений мозга у новорожденных различного гестационного возраста стала более очевидной, в связи с ростом числа детей родившихся раньше срока и увеличением их выживаемости благодаря развитию неонатологии. Применение методов интенсивной терапии в периоде новорожденности повысило шансы на выживание детей с тяжелыми поражениями ЦНС. Доказано, что даже среди крайне незрелых новорожденных с экстремально низкой массой тела выживаемость может достигать 70-80%. Однако эти успехи создали в свою очередь и новые проблемы, связанные с последующими тяжелыми отклонениями в состоянии здоровья и развитии этих детей. По данным А.А.Баранова ("Здоровье детей России", 1999г.) отмечен прогрессирующий рост распространенности патологии нервной системы в перинатальном периоде почти в 2 раза. Повреждения мозга, связанные с церебральной гипоксией, встречаются у 4,8% новорожденных. При асфиксии плода и новорожденного частота поражений мозга составляет 20-40%, у детей, родившихся с низкой массой тела 60-70%. Основной контингент детей с низкой массой тела при рождении составляют недоношенные, однако низкая масса может регистрироваться и у родившихся в срок – маленьких для соответствующего срока беременности (small for date), что свидетельствует о внутриутробной гипотрофии. Клиническое обследование новорожденных, особенно недоношенных, в первые часы, дни и месяцы жизни не всегда позволяет выявить четкую и ясную картину неврологического дефекта. Это связано с недостаточной зрелостью и дифференцированностью ЦНС недоношенных, когда при различных по характеру и локализации патологических процессах в нервной системе определяется ограниченный набор ответных реакций. Их однотипность и генерализованность не позволяют клиницисту судить о тяжести и локализации церебральных повреждений. Целый ряд состояний, связанных с явлениями постнатальной адаптации у новорожденных малого гестационного возраста, осложняют возможности клинической диагностики. Современные инструментальные методы диагностики перинатальных интракраниальных повреждений, такие как нейросонография (НСГ), электроэнцефалография (ЭЭГ), компьютерная томография (КТ), магнитно-резонансное исследование (МРТ), допплерография и др., не всегда дают исчерпывающую информацию, необходимую для качественной оценки степени тяжести повреждения ЦНС новорожденных и надежной дифференциальной диагностики с различными соматическими нарушениями, особенно в раннем периоде наблюдения. Прижизненная оценка изменений, возникающих в клетках нервной ткани в постнатальном периоде, остается мало изученной проблемой. В настоящее время ведется поиск ранних маркеров повреждения головного мозга, исследуются возможные пути защиты от повреждающих агентов, а также способы активации репаративных процессов. Поскольку причины хронизации нейродегенеративного процесса, являющегося определяющим для течения и исхода гипоксически-ишемических поражений головного мозга, не известны, необходимо проводить иммунохимическую верификацию нейродегенеративного процесса и состояния гематоэнцефалического барьера(ГЭБ) при этом, и на основе полученных данных проанализировать связь экспрессии различных факторов деструктивного процесса с нарушениями функции ЦНС. Данное направление имеет не только научно – практическую ценность, но и социальное значение. Изучение нейрохимических аспектов патогенеза гипоксического поражения головного мозга у новорожденных позволила выделить - проапоптотические факторы в патогенезе гипоксически-ишемических изменений, в частности, перивентрикулярной лейкомаляции. Расширение знаний о патогенезе ПВЛ позволит раскрыть неясные моменты, необходимые для правильного медикаментозного, а также для возможного превентивного воздействия, учитывая, что в основном это патология недоношенных новорожденных - детей, страдавших внутриутробно. Важным аспектом в патогенезе ПВЛ является изучение дополнительных механизмов - провоспалительных, участвующих в формировании очагов некроза - факторов апоптоза и клеточной адгезии, которые, несомненно, играют роль в формировании тяжелых ишемических повреждений головного мозга с последующей деструкцией мозговой ткани.
Перинатальная гипоксия инициирует процессы, приводящие к повышению проницаемости клеточных мембран, гибели нейронов и глиальных клеток вследствие некроза и апоптоза. Одним из индикаторов процесса запрограммированной гибели клеток является выбранный для исследования – «рецептор смерти» - Death Receptor (DR5).
К индуцирующим апоптоз факторам относятся также провоспалительные факторы - молекула клеточной адгезии ALCAM и белок астроцитарной глии S-100. К наиболее серьезным физиологическим ингибиторам апоптоза относятся ростовые факторы. В литературе представлены единичные работы, посвященные исследованиям проапоптотических антигенов, но еще меньше их связано с тяжелыми постгипоксическими изменениями, в частности, перивентрикулярной лейкомаляцией, в связи с чем, трудно полностью оценить их использование в качестве маркеров и предикторов деструктивных процессов в головном мозге.
Таким образом, целью исследования является: изучить клинико-иммунохимические особенности тяжелых форм гипоксически-ишемического поражения ЦНС у новорожденных различного гестационного возраста.
Задачи исследования:
- Провести клинический анализ тяжелых форм перинатальных гипоксических повреждений ЦНС у новорожденных различного возраста гестации.
- Проанализировать данные анамнеза у матерей во время беременности и родов, выделить факторы риска развития гипоксии у плода и новорожденного.
- Изучить уровни S-100, ALCAM и DR5 в сыворотке венозной крови у новорожденных различного гестационного возраста при тяжелом перинатальном повреждении ЦНС на протяжении первого месяца жизни (в динамике).
- Определить зависимость между тяжестью состояния при рождении, выраженностью клинических нарушений,характером постгипоксических церебральных повреждений (без структурных изменений - БСИ, лейкомаляция – ЛМ), и динамикой концентрации белка S-100, ALCAM и DR5 в сыворотке крови.
- Провести сравнительный клинико-биохимический анализ значимости изменений сывороточных концентраций белка S-100, ALCAM и DR5 для прогнозирования гипоксически-ишемических поражений головного мозга и оценки клинического исхода в периоде новорожденности.
Научная новизна:
- Клинический анализ позволил уточнить особенности неврологических нарушений при тяжелых формах перинатальных гипоксически-ишемических повреждений нервной системы у детей различного гестационного возраста.
- Проведено сравнение уровня концентрации S-100, ALCAM и DR5 при различных по степени тяжести и характеру гипоксических повреждениях ЦНС (ишемические) у новорожденных различного гестационного возраста, характера исхода заболевания по критерию «выжил-умер».
- Выявлена прогностическая значимость динамического контроля сывороточных концентраций S-100, ALCAM и DR5 при тяжелых гипоксических перинатальных повреждениях головного мозга.
Практическая значимость.
Наряду с клиническими признаками, уровни белка астроцитарной глии S-100, молекулы клеточной адгезии ALCAM и "рецептора смерти" 5 (DR5) в сыворотке крови отражают тяжесть состояния ребенка при рождении. Динамическое исследование сывороточных концентраций S-100, ALCAM и DR5 у детей первых недель жизни можно использовать для прогноза постгипоксических структурных нарушений в нервной ткани и исхода патологического процесса.
Комплексное использование данных иммуноферментного анализа в сочетании с нейросонографией и клиническим наблюдением позволит оценивать состояние ЦНС новорожденных в динамике и контролировать эффективность проводимой терапии. Полученные в исследовании данные демонстрируют роль провоспалистельных факторов в патогенезе перинатальных гипоксически-ишемических изменений головного мозга.
Малые количества сыворотки крови ребенка (50-150 мкл), необходимые для анализа, и относительная простота определения концентраций S-100, ALCAM и DR5 позволят использовать метод, наряду с НСГ, в качестве скрининга для выявления "групп риска" по развитию церебральных нарушений при гипоксии среди детей различного гестационного возраста. Это обеспечит более раннее начало терапии и впоследствии уменьшит затраты на реабилитацию.
Внедрение результатов исследования. Разработанные в ходе работы рекомендации применяются в отделении реанимации, интенсивной терапии, отделении патологии новорожденных и катамнеза Детского боксированного корпуса ГКБ№7. Материалы исследования используются в учебном процессе при подготовке студентов, врачей курсантов на кафедре неврологии и нейрохирургии с курсом медицинской генетики педиатрического факультета ГОУ ВПО РГМУ Росздрава.
Апробация работы состоялась на совместной научно-практической конференции коллектива кафедры неврологии и нейрохирургии педиатрического факультета ГОУ ВПО РГМУ Росздрава и сотрудников Детского боксированного корпуса ГКБ№7.
Публикации. По теме диссертации опубликовано 6 научных работ.
Объем и структура работы. Диссертация написана на русском языке, изложена на 173 страницах машинописного текста и состоит из введения, обзора литературы, описания материалов и методов исследования, 3-х глав, посвященных результатам собственных наблюдений, обсуждения полученных результатов, выводов, практических рекомендаций и списка литературы. Работа иллюстрирована таблицами, схемами, графиками и диаграммами, рисунками. Библиография включает 69 - источников отечественной и 135 - зарубежной литературы.
Работа выполнена на кафедре неврологии, нейрохирургии и медицинской генетики педиатрического факультета ГОУ ВПО РГМУ Росздрава ( ректор – академик РАМН, профессор Володин Н.Н.; заведующий кафедрой – профессор, д.м.н. Заваденко Н.Н.), на базе отделений реанимации, интенсивной терапии, патологии новорожденных и недоношенных детей Детского боксированного корпуса ГКБ№7 ( глав.врач- Афанасьев В.А., зам.гл.врача по детскому корпусу- Эрлих А.Л.).
Материалы и методы исследования.
Общая характеристика обследованных детей:
А) Новорожденные с тяжелым гипоксическим перинатальным поражением головного мозга (ГПП ГМ):
Под нашим наблюдением находилось 90 детей с гестационным возрастом от 26 до 42 недель, массой тела при рождении 890 - 4630 г. Длина тела составила от 32 до 54 см. Мальчиков - 59, девочек - 31, новорожденных из двоен - 8. Состояние всех детей при рождении расценивалось как тяжелое и средней степени тяжести. Новорожденным, родившимся в тяжелом состоянии (81 ребенок - 90,0%) проводился комплекс реанимационных мероприятий в родильном зале, включающий: ручную вентиляцию мешком Амбу, с дотацией 100%-О2 через маску, с последующей интубацией трахеи-74 ребенка (82,2%), непрямой массаж сердца – 14 новорожденных (15,6%), введение медикаментов (адреналин, альбумин, гидрокарбонат натрия) с целью коррекции нарушений гемодинамики – 14(15,6%) детей. Состояние средней тяжести было констатировано у 9(10,0%) пациентов, что потребовало проведения посиндромной терапии в условиях родильного дома. С ухудшением состояния (в среднем - конец 1-х суток жизни - 2-ые сутки) дети были переведены в отделение реанимации новорожденных. Тяжесть состояния была обусловлена тяжелым гипоксическим поражением ЦНС на фоне отдельных патологических синдромов и их сочетания, отягощавших течение постнатальной адаптации. Синдром дыхательных расстройств (СДР) с различной степенью тяжести дыхательной недостаточности диагностировался у 41 новорожденного (45,6%), из них 34(37,7%) были недоношенными. Наличие внутриутробной пневмонии было отмечено у 21(23,3%) ребенка. Коньюгационная гипербиллирубинемия - у 43 детей (47,8%), причем 2 детям (2,2%) с III степенью проводилась операция заменного переливания крови (ОЗПК). Общий отечный синдром I-II степени выявлен у 37(41,1%), а III степени - у 15(16,7%) новорожденных. Внутриутробная гипотрофия I-II степени отмечалась у 32(35,5%), III степени у 12(13,3%) детей.
Все новорожденные, родившиеся в тяжелом состоянии, нуждались в комплексной посиндромной терапии в условиях отделения реанимации, включавшей в себя: искусственную вентиляцию легких (ИВЛ) у 67(74,4%) детей, средняя продолжительность которой составила 18 суток, причем 39(43,3%) из них находились на ИВЛ длительно - до 32 дней; а также инфузионную, антибактериальную терапию, поддерживающую или заместительную терапию глюкокортикоидными гормонами. Лечение осуществлялось под постоянным контролем кислотно-основного и электролитного состава сыворотки крови. Проводился динамический мониторинг функционального состояния жизненно важных систем, а также уровней гематокрита, гемоглобина, общего белка, билирубина, глюкозы и мочевины.
На второй этап выхаживания, в связи с сохраняющейся неврологической симптоматикой, дыхательными расстройствами, инфекционными осложнениями, проявлениями морфофункциональной незрелости было переведено 63 ребенка (70,0%) в возрасте от 11 до 23 суток жизни. В качестве ведущего диагноза – гипоксическое перинатальное поражение головного мозга (ГППГМ) было зарегистрировано в 38(60,4%), а в качестве сопутствующего - в 25(39,6%) случаях. Из них домой под наблюдение участкового педиатра и невропатолога были выписаны 27(42,9%) детей в сроки от 27 до 53 суток жизни. В связи с тяжелой формой перинатального гипоксического поражения ЦНС, 36(57,1%) новорожденных переведены на третий этап выхаживания в специализированные неврологические стационары в возрасте от 37 до 72 суток жизни с целью проведения комплекса реабилитационных мероприятий.
Б) Контрольная группа:
Контрольная группа была представлена 20 здоровыми доношенными новорожденными и 20 недоношенными, без клинических и нейросонографических признаков поражения головного мозга. Доношенные дети родились от здоровых женщин с физиологически протекающей беременностью и родами. Гестационный возраст составил 38 -40 недель. Средняя масса при рождении равнялась 3310 ± 120,4 г, средняя длина тела 48,6 ± 0,6 см. Мальчиков было 12, девочек - 8. Состояние при рождении расценивалось как удовлетворительное. Оценка на первой минуте составила 8-10 баллов по Апгар. Период ранней адаптации протекал без особенностей. На 4-5 сутки дети были выписаны домой в удовлетворительном состоянии. Недоношенные новорожденные родились от матерей с отягощенным акушерско-гинекологическим анамнезом. Беременность у 7 женщин осложнялась угрозой прерывания в I и II триместрах. У такого же количества матерей наблюдался гестоз во второй половине беременности. Лечение по поводу истмико-цервикальной недостаточности проходили 10 женщин. Гестационный возраст этих детей составил 31-37(32,2 ± 0,4) недель. Средняя масса при рождении - 2230 ± 150 г, средняя длина тела - 45 ± 1,4 см. Мальчиков - 12, девочек - 8. У всех детей состояние при рождении расценивалось как удовлетворительное. Оценка по Апгар на первой минуте была 8-10 баллов. В периоде ранней адаптации у 3 детей отмечались признаки респираторного дистресс-синдрома легкой степени (в течение 4-8 часов). Новорожденные были выписаны домой (под наблюдение педиатра) на 5-6 сутки жизни в удовлетворительном состоянии.
В) В качестве группирующих факторов использовался гестационный возраст, наличие и характер структурных изменений головного мозга (по данным клиники и НСГ). Дополнительно проводился анализ изучаемых факторов в зависимости от исхода заболевания по критерию "выжил-умер" у новорожденных с различными структурными изменениями на нейросонограмме и без них.
Дети были разделены по сроку гестации на 3 группы: первая - 26-31 неделя (I), вторая - 32-37 недель (II), третья - 38-41 неделя (III). Каждая группа, в свою очередь, делилась на 2 подгруппы:
- А - без структурных изменений на НСГ (БСИ);
- Б - со структурными изменениями (в виде перивентрикулярной и субкортикальной лейкомаляции - ПВ+СКЛМ). Новорожденные в каждой группе были сопоставимы между собой по гестационному возрасту, состоянию при рождении, основным клиническим симптомам и объему оказываемой медицинской помощи. Так как определенному гестационному возрасту присущи свои особенности, важно было сравнивать между собой детей аналогичного срока гестации, т.е. в каждой группе сравнивались новорожденные со структурными изменениями на НСГ и без патологии при ультразвуковом сканировании головного мозга.
Характеристика анамнестических данных женщин.
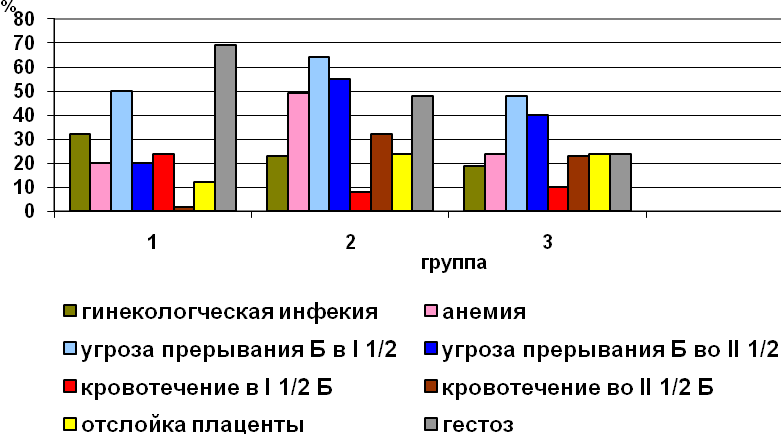
При сборе информации, определяющей образ жизни и здоровье женщин, нами проводился дополнительный опрос матерей по специально составленной карте. Среди гинекологической патологии доминирующими являлись воспалительные заболевания и осложнения предыдущих родов. Достоверная связь самопроизвольного прерывания беременности, привычного невынашивания, рождения детей - "small for date" и уменьшения возраста гестации была отмечена только в первой группе. При изучении детородной функции матерей выявлено: первобеременными превородящими были - 3,3% из II и - 6,7% женщин из III группы; повторнобеременные, первородящие составили в третьей группе - 66,7%, во второй – 23,3%, а в первой - 40,0%. Показатель искусственного прерывания беременности, в том числе и многократного, был высоким во всех группах, как и угроза самопроизвольного прерывания. У половины пациенток во второй и около – 95,0% в первой и третьей группах отмечался токсикоз первой половины беременности, гестозы составили - 30,0% в III группе и - 60,0%, 86,7% - во второй и первой соответственно. Оперативное родоразрешение проводилось в половине случаев (50,0%) в 1-й и 3-й группах и в 63,3% случаев - во второй. Профессиональные вредности указывались в анамнезе у 40,0% женщин первой группы и у - 90% и - 66,7% - во второй и третьей. Курили во время беременности соответственно - 40,0%, 50,0% и 93,3% женщин. Таким образом, в нашем исследовании отягощенный соматический и/или акушерско-гинекологический анамнез в I группе имел место в 92,3%, во II в – 87,9%, а III – в 93,6% случаев.
Рисунок 1. Характеристика течения беременности.
Основные методы, используемые в работе.
1. Анализ состояния здоровья матерей, акушерско-гинекологического анамнеза, течения беременности и родов.
Использовались - амбулаторные карты матерей, истории родов. Для определения степени риска акушерского анамнеза для здоровья ребенка применялась шкала, разработанная Ф. Ариас (1989 г.). По этой шкале оцениваются акушерский, соматический анамнез матери, течение данной беременности. Низкий риск определяется при сумме баллов – 0-2, высокий – 3-6, крайне высокий - > 6.
2. Ежедневное клиническое наблюдение за новорожденным от момента рождения, пребывания в отделении реанимации и интенсивной терапии, патологии новорожденных до выписки.
3. У новорожденных с интракраниальными кровоизлияниями и признаками прогрессирующей внутричерепной гипертензии с диагностической и лечебной целью проводились люмбальные и вентрикулярные пункции.
4. Комплексная оценка морфо-функциональной зрелости осуществлялась по системе Dubowitz (1981г.), являющейся наиболее оптимальной для определения зрелости недоношенных детей. Описание состояния ребенка проводилось по следующим признакам: привыкание (свет, трещетка), движение и мышечный тонус (поза; тонус, тракция с рук, ног; подколенный угол, отставание и поднимание головы, вентральная суспензия, высвобождение руки в положении лежа на животе, самопроизвольные движения, тремор, вздрагивания, аномалии движения или положения), рефлексы, поведенческие признаки. Использование этой схемы позволяет зафиксировать особенности неврологического статуса новорожденного на момент осмотра и при дальнейшем наблюдении определить динамику отдельных неврологических признаков и состояния новорожденного в целом.
5. Ультразвуковое сканирование головного мозга (НСГ) проводили в течение всего времени наблюдения за ребенком с 1-х суток поступления в стационар (среднем 1 раз в 5-7 дней, при необходимости – ежедневно; в катамнестическом наблюдении 1 раз в 2-4 недели). Использовали ультразвуковой аппарат "Aloka SSD-630", работающий в режиме реального времени и снабженный датчиками секторного сканирования с частотой 5,0 и 7,5 МГц. Датчик 5 МГц являлся универсальным для проведения исследования у большинства детей. Сканирование с частотой 7,5 МГц позволяло лучше оценивать процессы по конвекситальным отделам полушарий, а также использовалось для исследования у недоношенных новорожденных, имеющих маленькие размеры головы. Результаты нейросонографии, помимо протокола исследования, фиксировались в виде изображений (копирование через принтер) на термобумаге фирмы "Sony". Сканирование проводилось через передний (большой) родничок, во взаимно перпендикулярных плоскостях (сечениях) – фронтальных (коронарных), сагиттальных и парасагиттальных. Интерпретация данных ультразвукового исследования проводилась на основании отклонений от нормальной нейросонографической картины.
6. Иммуноферментный анализ применялся для определения уровня в сыворотке крови нейроспецифического белка (НСБ) астроцитарной глии S-100, маркера апоптоза, «рецептора смерти», DR5; молекулы клеточной адгезии ALCAM. Методики основаны на принципе количественного иммуноферментного анализа сэндвичевого типа. (ELISA – Enzyme Linked-Immuno-Sorbent Assay). Образцы крови отбирали из пупочной вены при рождении (новорожденные из контрольной группы), а в последующие сроки, путем аспирации из центральных катеторов (пупочный, подключичный, транскутанный) в объеме 0,3 – 1,0 мл. Кровь центрифугировали в течение 3-4 минут при 2000 g. Полученную сыворотку аликвотировали, замораживали и хранили при температуре – 200 С не более 2 месяцев. Точность определения внутри серии определялась путем 20 кратного тестирования 3 образцов с известной концентрацией в одном микропланшете. Точность определения между сериями определялась путем исследования 3 образцов с известной концентрацией в 40 различных постановках.
Содержание белка S-100 определяли твердофазным иммуноферментным методом, используя реактивы фирмы CanAg (Швеция).
При проведении исследования концентрации DR5 в сыворотке крови применялись реактивы фирмы "Biosource" (Бельгия). В комплектах (Biosource International) лунки микропланшета были покрыты моноклональными антителами (АТ), специфичными для человеческого DR5 (hDR5). Образцы включали: стандарты, с известным содержанием человеческого DR5, контрольные пробы и "неизвестные" – образцы пациентов.
Для определения уровня молекулы клеточной адгезии ALCAM применялись реактивы фирмы R&D (Англия). На графической бумаге фиксировались данные стандартов и стандартные концентрации; стандартные кривые для hDR5 строились в координатах: оптическая плотность против концентрации. Рабочим отрезком, была наиболее близкая к линейной часть кривой. Начало калибровочной кривой, при восстановлении перпендикуляра из этой точки на ось абсцисс, соответствовало значению чувствительности данной тест – системы, т.е. минимальному количеству вещества, которое можно определить с ее помощью. Образцы, дающие сигнал больший, чем в наибольшем стандарте (для hDR5 – 5000 pg/mL) разбавлялись Стандартным Буферным Растворителем (поставляемый реагент) и вновь подвергались анализу.
7.Статистический анализ данных проводился с использованием пакета Statistica 5.0. Группы обследованных новорожденных сравнивались между собой с использованием дисперсионного анализа (тест множественного сравнения средних ANOVA, с последующим сравнением групп по методу Манна - Уитни), внутри сравнение переменных производилось знаково-ранговым методом Вилкоксона (данный метод использовали, так как число наблюдений больше 12). С целью получения более точной информации о различиях между группами провели апостериорные сравнения средних показателей. Корреляционную зависимость вычисляли с помощью коэффициента ранговой корреляции Спирмена (R). Различия между показателями признавались существенными при 5% уровне во всех проведенных сравнениях по стандартной программе выявления достоверных различий.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ.
Клиническая характеристика тяжелых форм гипоксически-ишемического поражения ЦНС у обследованных новорожденных.
Из факторов риска гипоксически-ишемического поражения ЦНС II и III степени выделяют :
- курение во время беременности; хронические и острые соматические и/или гинекологические заболевания матери;
- патологическое течение настоящей беременности – сочетанный гестоз, в том числе поздний токсикоз - преэклампсия, развивающаяся после 20-й недели гестации; кровотечения во II-III триместрах; неоднократная угроза прерывания; преждевременные роды; экстренное оперативное родоразрешение (кесарево сечение) по поводу отслойки нормально расположенной плаценты;
- мекониальный характер околоплодных вод; задержка внутриутробного развития плода; недостаточная масса тела и рост, не соответствующие гестационному возрасту при рождении (гипотрофия);
- асфиксия средней тяжести (оценка по Апгар на 1 мин 3-6 баллов, через 5 мин – не достигает 7 баллов или становится ниже, чем через 1 мин после рождения); неэффективность самостоятельного дыхания с появлением повторных кратковременных апноэ, что требует интубации и санации трахеи с переводом на ИВЛ (нарастание ДН при внутриутробной пневмонии, СДР - чаще у недоношенных, синдроме аспирации мекония - у доношенных новорожденных);
- транзиторная и персистирующая легочная гипертензия; транзиторная дисфункция миокарда, протекающая у глубоко недоношенных как артериальная гипотензия и кардиогенный шок, а у детей, родившихся после 31 недели гестации – в виде застойной сердечной недостаточности.
Клинические проявления:
1. Церебральная ишемия II степени (средней тяжести). У новорожденных I группы (26-31 неделя гестации) на первом месте в неврологической симптоматике был синдром угнетения центральной нервной системы, с первых минут жизни проявляющийся резким снижением спонтанной двигательной активности, вялой реакцией на внешние раздражители, выраженной мышечной гипотонией. В большинстве случаев с рождения дети находились в тяжелом и крайне тяжелом состоянии: крик чаще отсутствовал или был слабым и непродолжительным, отмечалась неадекватность (нерегулярное или отсутствие) самостоятельного дыхания, диффузное симметричное снижение мышечного тонуса, (болевая) реакция на внешние раздражители проявлялась в виде гримас и кратковременного усиления спонтанной двигательной активности. Выраженное угнетение ЦНС нередко перерастающее в коматозное состояние, сопровождалось: констрикцией зрачков с постепенным снижением реакции на свет, мышечной гипотонией с разогнутыми во всех суставах конечностями, отсутствием реакции на болевые раздражения, угасанием сухожильных рефлексов, угнетением акта глотания, кашлевого рефлекса и других безусловных рефлексов. При прогрессировании комы, фиксировалось - расширение зрачков, без реакции на свет, выраженная мышечная гипотония, вплоть до атонии, арефлексия, отсутствие реакции на болевые раздражители, присоединялись нарушения ритма дыхания и сердцебиения, изменения со стороны желудочно-кишечного тракта, почек. Наиболее ранним и неспецифическим проявлением угнетения ЦНС в первые трое суток жизни у глубоко недоношенных новорожденных служило отсутствие рефлексов шагового и опоры, а признаками глубины угнетения – исчезновение или быстрое истощение сосательного и поискового рефлексов, ограничение подвижности (или "плавающие" движения) глазных яблок, снижение рефлекса Бабинского. Рефлекс Моро удавалось вызвать лишь при повторной стимуляции, но он был неполным. Судороги в этой группе дебютировали в первые сутки жизни (первые 6-12 часов), чаще в виде однократного эпизода, длительностью обычно менее одной минуты. Причем, судорожный синдром протекал в виде изолированных типов приступов, которые носили генерализованный тонический и атипичный характер. Судороги проявлялись: ретракцией шейных мышц, экстензией рук и ног с имитированием позы децеребрации, приступообразным нарушением дыхания, напоминающим затянувшийся вдох (генерализованный тонический тип приступа); спонтанными стереотипными движениями ног – "педалирование", "гребущими" движениями рук, сосательными и жевательными движениями, гримасничаньем, апноэ, не сопровождающегося брадикардией (атипичный вид приступа). Вегето-висцеральные нарушения манифестировали мраморностью кожных покровов, застойной окраской кожи нижележащих участков тела и бледностью вышележащих (так называемый симптом Арлекина или Финкельштейна). Возникали расстройства терморегуляции, нарушения ритма дыхания ("apnotic attacks") и сердечной деятельности, срыгивания.
У детей из II группы (32-37 недель гестации) в клинической картине наряду с синдромом угнетения фиксировались периоды повышенной нервно–рефлекторной возбудимости, в виде кратковременного повышения спонтанной двигательной активности, мышечного тонуса, сочетающегося с крупноразмашистым тремором конечностей, атетозом рук и локальными симптомами – клоническими подергиваниями глазных яблок, грубым горизонтальным нистагмом при изменении положения головы новорожденного в пространстве (вращение, подъем или опускание). Судорожный синдром в данной группе протекал как с изолированным, так и полиморфным характером приступов, в большинстве случаев сопровождая эпизоды повышенной возбудимости ЦНС. Миоклонические судороги фиксировались только при полиморфном характере приступа, часто сочетаясь с генерализованными тоническими, и проявлялись – быстрыми единичными или множественными подергиваниями мышц со сгибанием конечностей. Вегетативно–висцеральные нарушения складывались из мраморности кожных покровов, изменения ритма дыхания, желудочно-кишечных расстройств (пилороспазма, повышенной перистальтики кишечника), расстройств терморегуляции и сохранялись весь период наблюдения. Обратное же развитие других патологических знаков происходило в различное время, как в случаях с наличием структурного дефекта (перивентрикулярная киста), так и без него. Появлялось повышение двигательной активности, мышечного тонуса в верхних конечностях, хорошо вызывались рефлекс Бабинского, хватательный, Моро и другие рефлексы новорожденного. Мышечная гипотония (симметричная, больше в ногах), вегето-висцеральные нарушения, а также отдельная локальная симптоматика (нистагм, сходящееся косоглазие) сохранялись до 28-х суток.
В клинической картине гипоксически-ишемического поражения ЦНС II степени у доношенных новорожденных (III группа – 38-41 неделя гестации) превалировал синдром повышенной нервно-рефлекторной возбудимости или смена фаз церебральной активности с более продолжительными периодами возбуждения. Гипервозбудимость проявлялась: двигательным беспокойством, ритмичным тремором, в большинстве случаев ассоциирующимся с повышенным мышечным тонусом конечностей. Это отражалось на позе ребенка, которая свидетельствовала об общей скованности. Голова была несколько запрокинута назад, глаза открыты, взгляд напряженный, взор фиксирован, лоб наморщен. Лежа на спине, новорожденный держал руки согнутыми в локтевых суставах, кисти рук сжатыми в кулаки, ноги разогнутыми. Разведение ног в тазобедренных суставах затруднялось, угол разведения не превышал 45-500. При попытке поднять новорожденного за руки, он не менял позы и руки оставались согнутыми в локтях. Часто фиксировался спонтанный рефлекс Моро, отмечался низкий порог startle – реакций. Сухожильные рефлексы оказывались повышенными. Из глазодвигателных нарушений диагностировались – горизонтальный нистагм, преходящее сходящееся косоглазие. В дальнейшем в некоторых случаях (3-6 сутки жизни) к симптоматике возбуждения присоединялось выбухание большого родничка, симптом Грефе, гиперестезия, что расценивалось как проявления внутричерепной гипертензии, носящей транзиторный характер. Ее регресс начинался с момента "разрешения" структурного дефекта в паренхиме головного мозга. Судороги регистрировались в интервале от 24 до 48 часов жизни, в основном как однократные кратковременные приступы, носящие мультифокальный клонический характер. Они представляли собой ритмичные сокращения отдельных групп мышц на разной стороне тела. Вегето–висцеральная дисфункция определялась теми же симптомами, что и у недоношенных новорожденных. К 4-й неделе жизни у детей этой группы определялся повышенный мышечный тонус (чаще гипертонус в руках и разгибателях туловища). В положении на животе, в результате повышенного флексорного тонуса верхних конечностей, детям было трудно повернуть голову в сторону (отрицательный защитный рефлекс). При вертикальном подвешивании преобладала разгибательная реакция нижних конечностей. Поставленный на опору, ребенок резко разгибал ноги и иногда запрокидывал голову (положительная поддерживающая реакция). Фиксация патологических поз обуславливалась активизацией лабиринтных и шейных тонических рефлексов, например асимметричный шейный тонический рефлекс (АШТР) вызывал формирование позы «фехтовальщика». Ярко выраженными оставались безусловные рефлексы (орального автоматизма, рефлекс Моро, хватательный). Сухожильные и надкостничные - в подавляющем большинстве были высокими, иногда из-за выраженной мышечной гипертонии вызывались с трудом.
Таблица 1. Особенности неврологического статуса на первой неделе жизни у новорожденных с гипоксически-ишемическим поражением ЦНС (основные клинические синдромы и симптомы).
| Неврологические расстройства | Частота нарушений | |||||
| I (26-31 нед.) | II (32-37 нед.) | III (38-41 нед.) | ||||
| Абс. число | % | Абс. число | % | Абс. число | % | |
| Кома – II | 3 | 10,0 | 4 | 13,3 | 2 | 6,67 |
| Кома - III | 1 | 3,33 | 3 | 10,0 | 2 | 6,67 |
| Синдром угнетения | 20 | 66,67 | 20 | 66,67 | 16 | 53,3 |
| Синдром гипервозбудимости | 0 | 0 | 6 | 20,0 | 16 | 53,3 |
| Судорожный синдром: - атипичные приступы - генерализованные тонические приступы -полиморфные (атипичные + генер.) - мультифокальные клонические приступы | 11 5 3 3 0 | 36,67 16,67 10,0 10,0 0 | 13 3 2 7 1 | 40,0 10,0 6,67 23,3 3,33 | 7 1 0 2 4 | 23,3 3,33 0 6,67 13,3 |
| Синдром вегето-висцеральной дисфункции | 20 | 66,67 | 20 | 66,67 | 19 | 63,3 |
| Синдром внутричерепной гипертензии | 5 | 16,67 | 5 | 16,67 | 5 | 16,67 |
| Синдром повышенной нервно-рефлекторной возбудимости | 0 | 0 | 7 | 23,3 | 19 | 63,3 |
| ЧН: n. abducens(VI пара) | 2 | 6,67 | 3 | 10,0 | 4 | 13,3 |
| n.facialis(VII пара) по переферическому типу | 1 | 3,33 | 1 | 3,33 | 2 | 6,67 |
Церебральная ишемия III степени (тяжелая):
Во всех 3-х группах и у недоношенных и доношенных новорожденных первые 12 часов после рождения отмечалось резкое снижение мышечного тонуса, частичное угнетение кожных и в меньшей степени сухожильных рефлексов. Болевая реакция возникала только на сильные раздражители и проявлялась гримасами, генерализованными движениями конечностей. В других случаях, диагностировалась кома–II, которая характеризовалась узкими зрачками с вялой реакцией на свет, отсутствием реакции на болевые раздражители, угасанием сухожильных рефлексов, угнетением кашлевого рефлекса и акта глотания. Вследствие отсутствия или неадекватности самостоятельного дыхания все дети с рождения находились на аппаратной искусственной вентиляции легких. У новорожденных I группы регистрировались повторные приступы судорог, протекающие как генерализованные тонические и атипичные. В период от 12 до 24 часов у доношенных детей фиксировалось кратковременное нарастание уровня бодрствования с восстановлением уровня «сознания», появлением реакции зрачков на свет и реакции на болевые раздражители в виде крупноразмашистого тремора со скованностью (jitteriness). Судороги фиксировались чаще в виде нескольких эпизодов и носили мультифокальный клонический характер. В интервале от 24 до 72 часов во всех группах отмечалась отрицательная динамика состояния. Увеличение глубины комы у недоношенных новорожденных проявлялось дилатацией зрачков, без реакции на свет, мышечной атонией, арефлексией, отсутствием реакции на болевые раздражители, прекращением судорог. В группе доношенных детей диагностировалось нарастающее угнетение с переходом в коматозное состояние, сопровождающееся прогрессирующей внутричерепной гипертензией (глазодвигательные нарушения - симптом "заходящего солнца", сходящееся косоглазие; выбухание родничков). На этом фоне присоединялись нарушения ритма дыхания и сердечной деятельности - тахи-, брадикардия, аритмии, свидетельствующие о дисфункции стволовых отделов мозга. Отмечались выраженные вегето–висцеральные нарушения - акроцианоз, "мраморность" кожных покровов, профузная бронхиальная и слюнная секреция, изменения терморегуляции.
После 72 часов тяжесть состояния не всегда коррелировала с тяжестью деструктивного процесса в паренхиме мозга. В целом, доношенные дети по сравнению с новорожденными из I и II групп быстрее восстанавливали "уровень сознания", хотя и с более длительным сохранением очаговой симптоматики в виде изменений со стороны черепных нервов - нистагма, косоглазия, асимметрии лица. В дальнейшем в клинической картине отмечались варианты синдрома двигательных расстройств. Изменение мышечного тонуса по типу гипотонии («слабость ног» у недоношенных; «слабость плеч», симптом «тюленьей лапки» у доношенных новорожденных) наблюдалось в большинстве случаев в I-II группах детей и ~ у 30% доношенных новорожденных. Как правило, эти нарушения сопровождались снижением спонтанной двигательной активности и врожденных безусловных рефлексов - хватательного, Моро, опоры, ходьбы.
В III группе у 70% детей фиксировалось нарастание мышечной гипертонии. повышенние тонических рефлексов (асимметричный и симметричный шейные тонические рефлексы – АШТ и СШТ-рефлексы, лабиринтный тонический рефлекс) что приводило к возникновению патологических поз – «фехтовальщика», общего разгибания - «опистотонуса». Врожденные автоматизмы, сухожильные и надкостничные рефлексы были усилены. В положении на спине резко усиливался экстензорный тонус с появлением позы общего разгибания или реже общей скованности - поза «эмбриона». При вертикальном подвешивании фиксировалось ограничение попеременных движений поднимания и опускания ног, возникала положительная поддерживающая реакция. В ряде случаев преобладал сгибательный тонус, тогда ноги были полусогнуты в тазобедренных и коленных суставах. Синдром вегето–висцеральной дисфункции сохранялся у всех детей к концу 4-й недели жизни с разным набором симптомов, его составляющих («мраморность» кожных покровов, срыгивания, повышенная перистальтика кишечника, пилороспазм, нарушения ритма дыхания и терморегуляции, повышенная бронхиальная секреция).
Результаты ультразвукового исследования головного мозга у детей (НСГ):
В первые двое суток жизни при ультразвуковом сканировании головного мозга (во фронтальной плоскости) у недоношенных новорожденных (I-II группы) на фоне незрелости структур мозга отмечалась гиперэхогенность - двустороннее свечение, в области латеральных отделов передних и нижних рогов боковых желудочков. При дальнейшем динамическом наблюдении (9-11 сутки) в данных зонах выявлялась неоднородность структуры с наличием участков различной эхоплотности, в том числе анэхогенных полостей – лейкомаляционных кист. В последующем, к 18-24-м суткам жизни, фиксировались признаки атрофической гидроцефалии (hydrocephalus ex vacuo), в виде пассивной вентрикуломегалии с деформацией контуров стенок боковых желудочков. В группе доношенных новорожденных (2-3-е сутки жизни) при ультразвуковом сканировании определялось неоднородное диффузное повышение эхогенности отдельных групп ядер базальных ганглиев, визуализируемых участков внутренней капсулы и перивентрикулярных зон. Также часто встречался и другой вариант - со "смазанностью" борозд и компрессией боковых желудочков. Диагностировалась билатеральная гиперэхогенность, иногда с преобладанием поражения одного из полушарий, с распределением по парасагиттальной и супрамедиальной поверхности мозга в теменно–затылочной области. При динамическом наблюдении с 11-15-х суток визуализировались признаки атрофии коры больших полушарий - расширение межполушарной щели и субарахноидального пространства. Расширение ликворопроводящих путей сочеталось с атипичной деформацией борозд и извилин, а так же с трансформацией изменений в энцефаломаляционные кисты.
Иммуноферментный анализ уровня белка астроцитарной глии S-100 в сыворотке крови у новорожденных с тяжелым перинатальным гипоксическим поражением ЦНС.
В контрольной группе уровень белка S-100 в сыворотке крови составлял 0,18-0,3 мкг/л во все дни наблюдения. Достоверных различий между показателями у доношенных и недоношенных новорожденных установлено не было, M±SD: 0,2±0,08 мкг/л.
На основании результатов исследования мы изучили динамику концентрации антигена S-100 у новорожденных в зависимости от гестационного возраста, состояния при рождении и различных типах структурных поражений головного мозга, определяемых методом нейросонографии. При анализе полученных данных нами было выявлено, что исходные уровни сывороточной концентрации белка S-100, определенные в первые сутки жизни, были максимальными у всех обследованных пациентов.
По сроку гестации наблюдаемые новорожденные были разделены на 3 группы: до 32 недели, 32-37 недель, и 38-42 недели. Каждая группа была разделена на 2 подгруппы: со структурными изменениями на НСГ (подгруппа Б) и без них (подгруппа А). При сравнении динамики сывороточной концентрации белка S-100 у детей по гестационному возрасту в зависимости от наличия структурных изменений на НСГ были получены следующие данные (рисунок 2).
Рисунок 2. Динамика средних значений концентрации белка S-100 мкг/л в зависимости от гестационного возраста и наличия структурных изменений на НСГ.
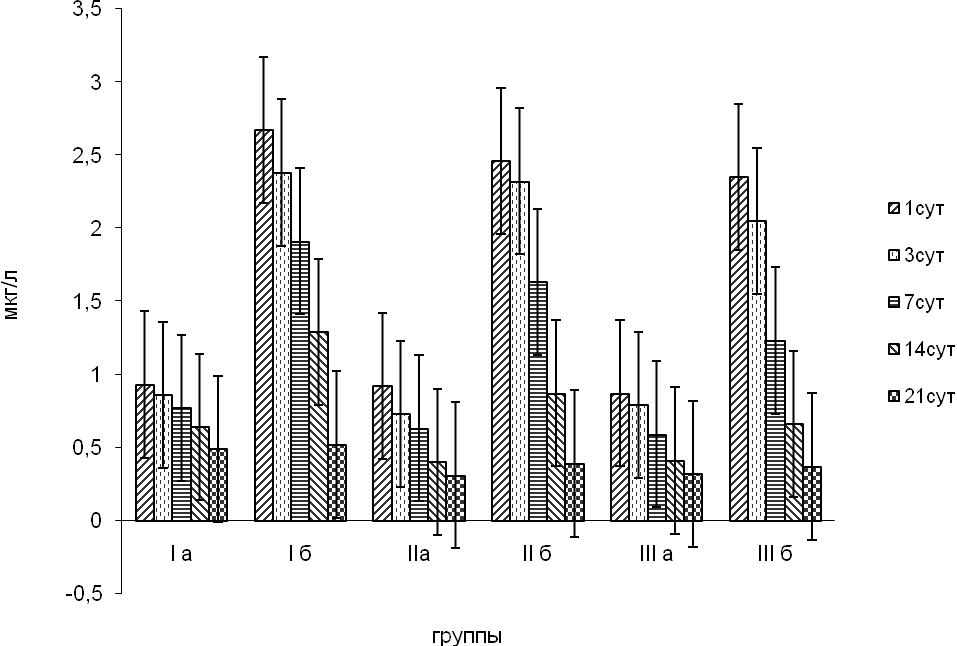
Максимальные значения антигена во всех группах регистрировалось в первые 48 часов жизни отмечалось увеличение сывороточной концентрации белка S-100 от 3 до 12 раз. Затем наблюдалось их постепенное снижение. При сравнении полученных данных самые высокие уровни концентрации белка S-100 были у недоношенных детей первой группы со структурными изменениями (ПВЛ) на НСГ. У них отмечалось повышение концентрации антигена более, чем в 10 раз по сравнению с верхней границей нормы. В группах новорожденных со структурными изменениями головного мозга на НСГ с гестационным возрастом 32-37 недель и 38-42 недель сывороточный уровень S-100 в первые сутки жизни был равен соответственно 2,46±0,06 мкг/л и 2,35±0,02мкг/л. Наиболее высокие уровни исследуемого антигена прямо коррелировали с неблагоприятным неврологическим прогнозом и формированием структурных изменений на НСГ.
Таблица 3. Динамика уровня белка S-100 (мкг/л) в сыворотке крови детей с ГППГМ в зависимости от тяжести состояния при рождении (оценка по Апгар на 1-й минуте жизни).
| Статистические показатели | Группа | ||
| I Оценка по шкале Апгар 0-4 балла | II Оценка по шкале Апгар 5-7 баллов | Контрольная | |
| M ± SD 1сут | 2,49± 0,8 *,** | 1,14± 0,27 *,** | 0,21±0,08 |
| M ± SD 3сут | 1,87± 0,54 *,** | 0,89± 0,16 *,** | 0,20±0,02 |
| M ± SD 7сут | 1,39± 0,27 *,** | 0,76± 0,37 *,** | 0,19±0,05 |
| M ± SD 14сут | 0,86±0,43 *,** | 0,48±0,08 *,** | 0,23±0,05 |
| M ± SD 21сут | 0,42±0,11 | 0,31±0,09 | 0,18±0,06 |
*-Достоверность различий между показателями исследуемых групп с контролем (Р <0,01) по методу Манна -Уитни
**- Достоверность различий показателей исследуемых групп (Р<0,01) по методу Вилкоксона.
Для анализа изменений сывороточной концентрации S-100 в зависимости от оценки по Апгар на 1-й минуте были сформированы две группы: новорожденные с оценкой 0-4 балла; новорожденные с оценкой 5-7 баллов.
Рисунок 3. Динамика сывороточной концентрации белка S-100 мкг/л в зависимости от характера поражения головного мозга на нейросонографии.

БСН- без структурных нарушений на НСГ
ПВЛ – перивентрикулярная лейкомаляция
При проведении исследования уровень S-100 в сыворотке крови детей с различным характером поражения ЦНС,важно было определить как влияет характер структурных изменений головного мозга (ишемия или постгтпоксическая перивентрикулярная лейкомаляция) на показатели сывороточной концентрации белка S-100. Максимальные значения сывороточной концентрации белка S-100 отмечались независимо от характера структурных изменений головного мозга, определяемых на НСГ, в первые сутки жизни у всех обследованных детей. Однако при сопоставлении средних значений антигена наибольшие показатели в первые сутки жизни регистрировались у детей с формированием ПВЛ. Динамика концентрации антигена в последующие сутки исследования характеризовалась снижением уровня. Но у новорожденных со структурными изменениями головного мозга к 7-м суткам жизни средние значения сывороточного уровня S-100 в сыворотке крови были больше нормативных в 5-6 раз.
При обработке данных включалось также изучение различий сывороточной концентрации S-100 при различных исходах заболевания по критерию «выжил-умер». Был проведен дисперсионный анализ (ANOVA), чтобы выявить зависимость исхода от значений этих переменных.
| Рисунок 4. Динамика уровня S-100 в зависимости от исхода заболевания I группа (без структурных изменений головного мозга на НСГ). | Рисунок 5. Динамика уровня S-100 в зависимости от исхода заболевания II группа (перивентрикулярная лейкомаляция). |
 | 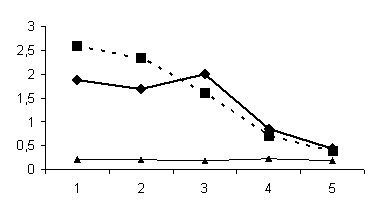 |
Примечание: 1-5 номер проб сыворотки крови соответственно: 1;3;7;14;21 сутки жизни.
Таблица4. Факторы, влияющие на исход заболевания.
| Факторы, влияющие на исход заболевания | Исход | Достоверность различий (р) | ||
| Выжил M | Смерть M | |||
| Изменения на НСГ(есть/нет) | +/- | +/- | p<0,05 | |
| Вес при рождении, кг | 2,36 | 2,02 | p<0,05 | |
| Длительность ИВЛ, сут | 7,7 | 13,75 | p<0,01 | |
| Внутриутробная гипотрофия (есть/нет) | +/- | +/- | p<0,01 | |
| Транспортировка в отделение реанимации (есть/нет) | +/- | +/- | p<0,05 | |
| Сывороточная концентрация белка S-100, мкг/л | 1 сутки | 1,7 | 2,3 | p<0,01 |
| 3 сутки | 1,48 | 2,0 | p<0,01 | |
| 7 сутки | 1,1 | 1,5 | p<0,05 | |
| 14 сутки | 0,7 | 0,98 | p<0,01 | |
| Судороги (есть/нет) | +/- | +/- | р<0,01 | |
| Оценка по Апгар на 1-й минуте | 3,89 | 3,18 | р<0,05 | |
| Оценка по Апгар на 5-й минуте | 5,9 | 5,2 | р<0,01 | |
M-медиана.
Из проведенного статистического анализа видно, что достоверно на летальный исход влияли такие факторы как: наличие структурных изменений на НСГ, длительность искусственной вентиляции легких, наличие внутриутробной гипотрофии, транспортировка новорожденного в отделение реанимации из другого родильного дома, наличие судорог, оценка по Апгар на 1-й и 5-й минуте, а также уровень сывороточной концентрации белка S-100 в 1; 3; 7-е и 14 сутки жизни.
Иммуноферментный анализ неспецифических провоспалительных антигенов: маркера апоптоза DR5 и молекулы клеточной адгезии ALCAM в сыворотке крови новорожденных различного гестационного возраста с тяжелым перинатальным гипоксическим поражением ЦНС.
По гестационному возрасту, наблюдаемые новорожденные были разделены на 3 группы: I – до 32 недели (26-31), II – 32-37 недель и III – 38-41 неделя. Пробы крови производились для DR5 – в интервале от 24 до 48 часов жизни, что соответствует максимуму активности апоптотических процессов.
Для получения нормативных показателей проапоптотического фактора использовались пробы сыворотки крови здоровых доношенных детей (N-20), а также недоношенных новорожденных без поражения ЦНС (N-20). Нормальные значения сывороточных концентраций для DR5: 1,24–8,67 мкг/л. Интервалы контрольных показателей не имели достоверных различий у доношенных и недоношенных новорожденных.
При сравнении средних значений сывороточного уровня DR5 в одинаковых группах детей по возрасту гестации без структурных нарушений на НСГ и с наличием таковых (аналогичное деление на подгруппы – А и Б) результаты были следующие (рисунок 4).
Рисунок 6. Динамика среднего уровня сывороточной концентрации DR5 у детей 24-48 часов жизни с тяжелым ГПП ГМ в зависимости от ГВ и наличия структурных изменений на НСГ.
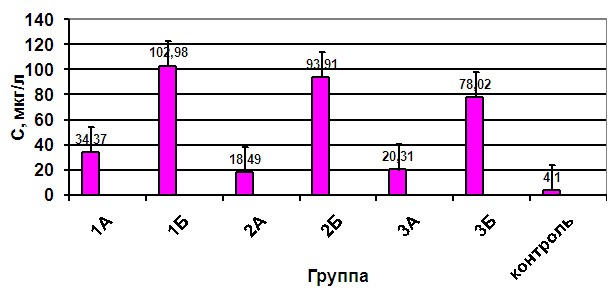
При рассмотрении полученных результатов выявлено, что во всех группах детей как со структурными изменениями на НСГ, так и без них уровень сывороточной концентрации белка DR5 был выше нормативных показателей, с прослеживанием обратной зависимости от возраста гестации. Однако в подгруппах Б (новорожденные, имеющие структурные изменения) концентрация маркера апоптоза превышала значения показателей из подгруппы А в 3-4 раза. Максимальные значения антигена соответственно были зафиксированы у детей с изменениями на НСГ, 26-ти - 31-ой недели гестации и составили –102,98 ± 32,75 мкг/л, при норме от 1,2 до 8,67 мкг/л.
Было проведено также изучение сывороточной концентрации уровня DR5 в сыворотке крови детей с различным характером поражения ЦНС в зависимости от характера поражения мозга. Для этого деление на группы производилось с учетом структурных изменений при ультразвуковом сканировании: I – новорожденные, у которых на НСГ выявлялось повышение эхогенности, от умеренной до выраженной, обозначаемой в протоколах описания как (++) и (+++) соответственно – (22 и 23 новорожденных); II – новорожденные с перивентрикулярной и субкортикальной лейкомаляцией (ПВ+СКЛМ - 30 и 15 детей). Кроме контрольной, группой сравнения была I, то есть дети, перенесшие гипоксию и не имеющие структурных нарушений на НСГ, но с верифицированными изменениями в виде гиперэхогенности не типичной локализации. Новорожденные в данных группах были сопоставимы по ГВ, состоянию при рождении, клинической симптоматике и объему оказанной медицинской помощи.
Таблица 5. Сывороточный уровень маркера апоптоза - DR5 у детей 24-48 часов жизни с различным характером изменений на НСГ, мкг/л.
| Статистические показатели | Группа | ||
| I | II | Контроль | |
| M±SD | 10,35± 9,98 | 73,22± 53,898*,** | 4,1± 0,9 |
| min-max | 2,3–26,05 | 48,1–112,47 | 1,22-8,67 |
* - достоверность различий средних показателей сывороточной концентрации DR5 от контрольной группы по методу Манна – Уитни (р<0,01).
** - достоверные различия средних показателей сывороточной концентрации DR5 от I группы по методу Манна – Уитни (р<0,01).
Рисунок 7. Динамика уровня DR5 у детей 24-48 часов жизни с различными по характеру изменениями на НСГ.
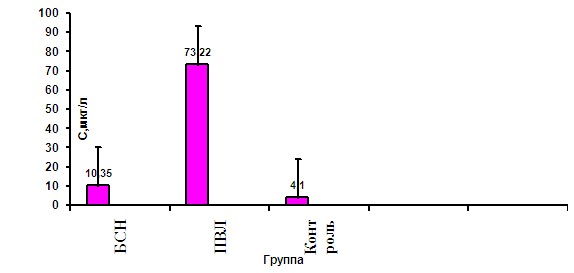
БСН- без структурных изменений
ПВЛ – перивентрикулярная лейкомаляция
Содержание DR5 в сыворотке крови у обследованных детей, перенесших родовую асфиксию в родах различной тяжести ( в зависимости от оценки по шкале Апгар) были следующими( рисунок 8, таблица 6) :
Рисунок 8. Динамика уровня DR5 в сыворотке детей с ГПП ГМ с различной тяжестью при рождении.

Таблица 6. Динамика уровня DR5 (мкг/л) в сыворотке детей с ГИПП ГМ с различной тяжестью состояния при рождении.
| Группы | 1 | 2 | Контроль |
| Тяжесть состояния Оценка по Апгар на 1-й минуте | Апгар 0-4 балла | Апгар 5-7баллов | 4,1±0,9 |
| Концентрация (М±SD), мкг/л | 51,4±8,3* | 27,8±11,1* |
*-достоверно отличаются от контрольной группы (p< 0,01)
В данном случае наблюдалась прямая зависимость показателей проапоптотического фактора от тяжести состояния, то есть чем выше сывороточный уровень DR5, тем тяжелее перенесенная асфиксия в родах.
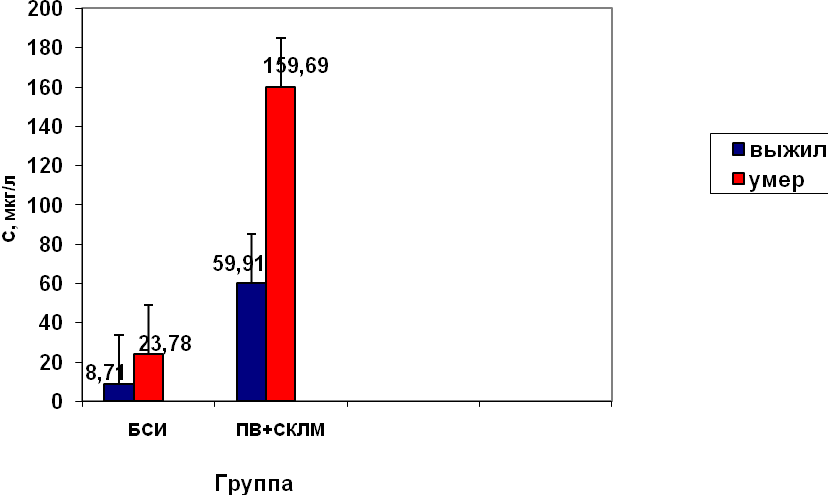
Дополнительно группы обсчитывались по переменной, учитывающей характер изменений на НСГ. Сывороточная концентрация белка DR5 в зависимости от критерия «выжил-умер» и характера нейросонографических изменений была следующей:
Рисунок 9. Динамика уровня DR5 в зависимости от исхода (по критерию «выжил-умер») у детей 24-48 часов жизни с различным характером изменений на НСГ.
В соответствии с избранными нами параметрами оценки уровня исследуемых факторов в сыворотке крови, мы проводили изучение концентрации молекулы клеточной адгезии ALCAM.
Пробы для определения уровня ALCAM в сыворотке крови проводились трижды: первая в возрасте до 48 часов жизни: вторая в 5-7 суток жизни; третья – в возрасте 12-14 суток жизни. Такие временные параметры были выбраны в закономерности с изменениями в микроциркуляторно-клеточном каскаде, разворачивающемся на фоне гипоксии-ишемии мозга. В контрольной группе значения ALCAM находились в пределах 0,013-0,06 мкг/л (M± SD: 0,036±0,015) и достоверно не различались у доношенных и недоношенных новорожденных за весь период наблюдения.
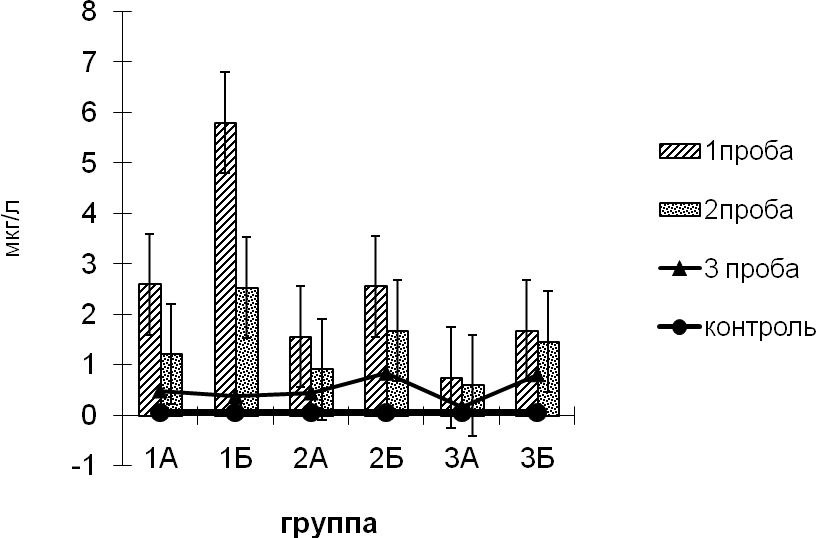
В соответствии с делением наблюдаемых новорожденных по гестационному возрасту на 3 группы, были получены следующие результаты концентрации молекулы клеточной адгезии ALCAM в сыворотке крови.
Таблица 7. Изменение средних значений сывороточной концентрации ALCAM (мкг/л) у новорожденных в зависимости от гестационного возраста.
| Статистические данные | Группа | |||
| недели жизни | ||||
| I (26-31) | II (32-37) | III (38-42) | ||
| 1 проба | M± SD | 3,53±3,4* | 2,62±1,34*,** | 1,49±0,32*,** |
| min-max | 0,92-9,0 | 0,64-4,3 | 0,19-2,66 | |
| 2 проба | M± SD | 2,86±1,54* | 1,83±0,27*,** | 1,24±0,67*,** |
| min-max | 0,76-4,8 | 0,56-2,9 | 0,1-1,99 | |
| 3 проба | M± SD | 1,24±0,28* | 0,46±0,5* | 0,62±0,54*,** |
| min-max | 0,31-1,93 | 0,1-1,93 | 0,04-1,6 | |
*- достоверность различий средних показателей сывороточной концентрации ALCAM от контрольной группы по методу Манна – Уитни (p<0,01)
**-достоверные различия концентрации ALCAM от I группы по методу Манна – Уитни (p<0,01).
Максимальные значения ALCAM были отмечены у всех наблюдаемых детей в первые 48 часов жизни. У новорожденных с гестационным возрастом 26-31 неделя средние значения сывороточной концентрации ALCAM составляли 3,53±3,4 мкг/л, у детей второй группы -2,62 ±1,34 мкг/л, а у доношенных новорожденных - 1,49±0,32 мкг/л.
При анализе концентрации молекулы клеточной адгезии ALCAM при сравнении показателей в идентичных по гестационному возрасту группах, но в зависимости от наличия или отсутствия структурных изменений на НСГ, были получены следующие данные. Результаты представлены на рисунке 9.
Рисунок 11. Изменение средних значений сывороточной концентрации ALCAM (мкг/л) у новорожденных в зависимости от гестационного возраста и изменений на НСГ.
Затем проводилось сравнение уровня ALCAM в зависимости от состояния новорожденных при рождении, в соответствии с оценкой по Апгар на 1-й минуте жизни. Данные представлены в таблице 8.
Таблица 8. Изменение средних значений сывороточной концентрации ALCAM (мкг/л) у новорожденных в зависимости от степени асфиксии при рождении (Оценка по Апгар на 1-й минуте).
| Статистические данные | Группа | ||
| I (0-4 балла) | II (5-7 баллов) | ||
| 1 проба | M± SD | 4,24±3,48*,** | 2,46±1,34* |
| min-max | 0,92-9,0 | 0,19-4,33 | |
| 2 проба | M± SD | 2,67±2,02* | 1,73±1,09* |
| min-max | 0,56-4,8 | 0,1-2,9 | |
| 3 проба | M± SD | 1,32±0,64*,** | 0,46±0,52* |
| min-max | 0,32-1,93 | 0,04-1,2 | |
*- достоверность различий средних показателей сывороточной концентрации ALCAM от контрольной группы по методу Манна – Уитни (p<0,01)
**-достоверные различия концентрации ALCAM от II группы по методу Манна – Уитни (p<0,01)
Рисунок 12. Изменение средних значений сывороточной концентрации ALCAM (мкг/л) у новорожденных в зависимости от степени асфиксии при рождении.
 Максимальные показатели концентрации антигена отмечались в первые 48 часов жизни у всех обследованных новорожденных. Однако у детей с тяжелой острой асфиксией в родах концентрация в первой пробе была выше в 1,72 раза, чем у новорожденных с оценкой 5-7 баллов.
Максимальные показатели концентрации антигена отмечались в первые 48 часов жизни у всех обследованных новорожденных. Однако у детей с тяжелой острой асфиксией в родах концентрация в первой пробе была выше в 1,72 раза, чем у новорожденных с оценкой 5-7 баллов.
Важным моментом было изучение изменение концентрации ALCAM в зависимости от структурных изменений головного мозга на НСГ. Новорожденные были разделены в соответствии с выявленными изменениями на нейросонографии. В соответствии с этим делением получены следующие изменения уровня молекулы клеточной адгезии ALCAM в сыворотке крови. Максимальные значения ALCAM, как и в предыдущих оценках сывороточного уровня, были отмечены в первой пробе, в возрасте до 48 часов жизни.
Рисунок 13. Изменение средних значений сывороточной концентрации ALCAM (мкг/л) у новорожденных в зависимости от результатов НСГ.
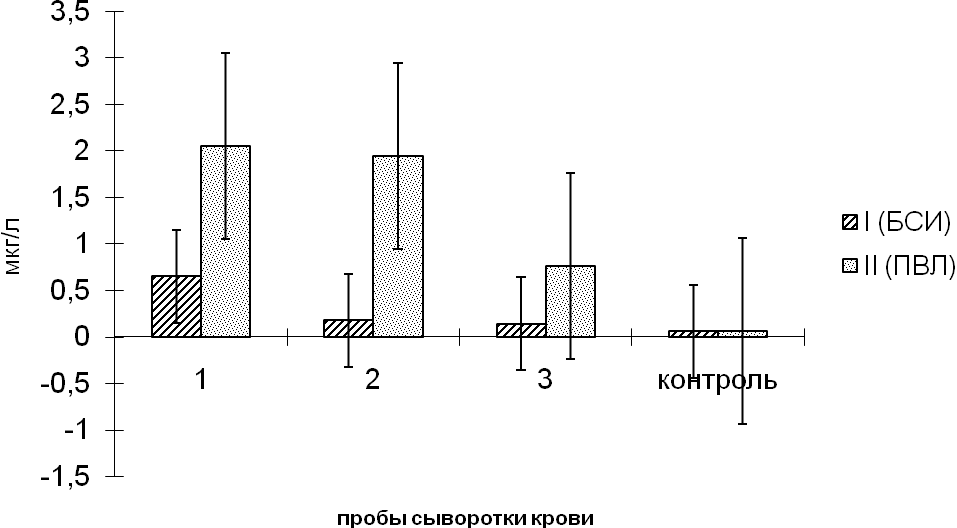
У новорожденных без структурных изменений на НСГ средние значения ALCAM в первой пробе составили 0,65 ±0,21мкг/л, а у детей со структурными изменениями на НСГ 2,05±0,3 мкг/л при формировании ПВЛ К первой неделе жизни у всех новорожденных концентрация ALCAM в сыворотке крови снижалась, минимальные средние значения выявлены в первой группе 0,18±0,12 мкг/л. К 12-14 дню жизни у новорожденных без структурных изменений головного мозга на НСГ концентрация ALCAM составляла 0,14±0,09 мкг/л, у детей с ПВЛ снизилась по сравнению с исходными значениями в 3 раза и равнялась 0,76±0,16 мкг/л.
При проведении статистической обработки была изучена динамика концентрации в выделенных группах, в соответствии с выявленными изменениями на НСГ, по критерию «выжил-умер».
Таблица 9. Изменение средних значений сывороточной концентрации ALCAM (мкг/л) у новорожденных в зависимости от исхода заболевания (выжил-умер).
| Исход заболевания | Концентрация, мкг/л | ||
| № пробы, сутки исследования | |||
| 1 проба (1-2 с/ж) | 2 проба (5-7 с/ж) | 3 проба (12-14 с/ж) | |
| I группа, БСН, M±SD | |||
| выжившие | 0,44±0,16 | 0,22±0,09* | 0,12±0,09* |
| умершие | 0,59±0,2 | 0,64±0,15* | 0,18±0,12* |
| II группа, ПВЛ, M±SD | |||
| выжившие | 1,34±0,16* | 1,29±0,2* | 1,09±0,026* |
| умершие | 2,2±0,09* | 2,18±0,12* | 1,56±0,14* |
БСН-без структурных нарушений (изменений) на НСГ
*- достоверные различия в концентрации у выживших и умерших новорожденных в каждой группе (сравнение по методу Манна-Уитни,р<0,01).
Сравнивая полученные результаты, следует отметить, что у выживших новорожденных уровень молекулы адгезии ALCAM были ниже, чем у умерших новорожденных.
Поскольку ALCAM является неспецифическим маркером поражения ткани головного мозга, важно было установить корреляционные связи с другими факторами, от которых может зависеть концентрация антигена в сыворотке крови у новорожденных в неонатальном периоде.
Таблица 14. Корреляционная зависимость показателей с уровнем ALCAM в сыворотке крови (концентрация в 1-й пробе)
| Попарная зависимость показателей | R | T(N-2) | p-level | |
| ПВЛ | ||||
| ALCAM & летальный исход | 0,575097 | 2,635376 | 0,02048 | |
| ALCAM & вес при рождении | -0,77854 | -3,33085 | 0,00562 | |
| ALCAM & изменения на НСГ | 0,93929 | 9,86968 | 0,0002 | |
| ALCAM & и в/утробное инфицирование | 0,74522 | 2,163289 | 0,0023 | |
| ALCAM & пневмония | 0,5676 | 2,43762 | 0,00143 | |
| Без структурных нарушений | ||||
| ALCAM & оценка по Апгар на 1-й минуте | -0,54314 | -3,71602 | 0,00075 | |
| ALCAM & длительная ИВЛ | 0,719185 | 5,946022 | 0,0002 | |
| ALCAM & в/у инфицирование | 0,530513 | 3,595199 | 0,00104 | |
Здесь была выявлена прямая корреляционная зависимость с внутриутробной пневмонией и внутриутробным инфицированием у новорожденных детей. Кроме того, прямая зависимость определена у всех детей со структурными изменениями на НСГ с гестационным возрастом, тяжестью асфиксии в родах, длительностью ИВЛ и летальным исходом.
Проведя многофакторный анализ динамики исследуемых антигенов в зависимости от гестационного возраста, состояния при рождении, наличия или отсутствия структурных изменений головного мозга на нейросонографии, мы пришли к заключению, что наиболее показательным для сравнения является их соотношение при различных типах структурных поражений головного мозга.
Характеризуя корреляционые связи у детей без структурных изменений головного мозга на НСГ, можно отметить, что уровни провоспалительных факторов и S-100 были повышены по сравнению с нормативными значениями, но это увеличение носило, скорее, компенсаторный и ответный характер на инициацию гипоксических изменений, являлось следствием процессов инфекционной интоксикации и других различных проблем, связанных с соматическим статусом новорожденного.
Факторы, определяющие выраженность деструктивного и воспалительного процесса (S-100, DR5, ALCAM) находились в прямой корреляционной связи с формированием ПВЛ у новорожденных.
При статистической обработке данных было выявлено, что с неблагоприятным (летальным) исходом заболевания прямо коррелируют белок астроцитарной глии S-100, маркер апоптоза DR5 и молекула клеточной адгезии ALCAM при формировании перивентрикулярной лейкомаляции. Результаты, полученные в исследовании, позволили во многом расширить понимание патогенеза гипоксически-ишемических изменений головного мозга у новорожденных, а также выделить факторы, которые возможно применять в диагностике патологических процессов в ткани мозга как маркеры неблагоприятного прогноза.
Выводы.
1. Определены нормальные значения нейроспецифических белков (S-100) и неспецифических факторов патогенеза гипоксических повреждений головного мозга (DR5; ALCAM) в сыворотке крови у новорожденных. Нормальная концентрация исследуемых факторов: S-100 = 0,21±0,08 мкг/л; DR5= 4,1±0,9 мкг/л; ALCAM: 0,036±0,015 мкг/л.
2. Повышение молекулы клеточной адгезии ALCAM в сыворотке крови у новорожденных свидетельствует о роли процессов воспаления в развитии перивентрикулярной лейкомаляции.
3. У новорожденных со всеми видами структурных постгипоксических изменений головного мозга концентрация S-100 в сыворотке крови в первые сутки увеличивалась более чем в 9 раз. Максимальные значения концентрации S-100 в сыворотке крови отмечались у новорожденных с ПВЛ, они превышали нормативные показатели в 10-12 раз
4. Повышение уровня маркера апоптоза DR5 имеет значение при определении прогноза по формированию структурного дефекта нервной ткани и выживаемости новорожденных
5. У детей с тяжелыми постгипоксическими изменениями ткани головного мозга в раннем неонатальном периоде в сыворотке крови преобладают факторы, способствующие деструктивным изменениям. Концентрация их тем выше, чем меньше гестационный возраст ребенка.
6. Проведенное исследование позволило выявить ранние маркеры патологического процесса в ткани головного мозга при гипоксических повреждениях в неонатальном периоде. К ним относятся: S-100. Неспецифические факторы патогенеза являются предикторами патологического процесса, но для прогноза посгипоксических структурных изменений головного мозга у новорожденных важно их определять совместно с нейроспецифическими белками.
Практические рекомендации
1.Важно выявлять беременных женщин группы высокого риска и проводить профилактику и лечение внутриутробной гипоксии плода, а также разрабатывать индивидуальную подготовку к родам.
2. У новорожденных детей группы риска по развитию неврологических нарушений необходимо проводить раннее определение нейроспецифических белка, а также МКА ALCAM для совокупной оценки компенсаторных возможностей каждого новорожденного индивидуально.
3. Снижение синтеза нейротрофических факторов у новорожденных со структурными изменениями головного мозга обусловлено еще внутриутробным влиянием гипоксии, поэтому дети с хронической внутриутробной гипоксией не устойчивы к воздействию повреждающих факторов и являются группой риска по развитию ПВЛ.
Список научных работ, опубликованных по теме диссертации:
- Г.С.Голосная, Д.И. Албагачиева Влияние проапоптотических факторов на формирование тяжелых структурных постгипоксических поражений мозга у новорожденных //Материалы III регионарного научного форума « Мать и дитя» 30 июня-2 июля 2009. С.70.
- Г.С. Голосная, Д.И. Албагачиева, О.Ю.Попов. Диагностическое и прогностическое значение определение уровня VЕGF, DR5 и ALCAM у новорожденных с постгеморрагическим поражением мозга // Материалы 17-ой Европейской школы по неонатологии. 23-26 сентября. Вила ду Конде, Португалия. // Jornal of Neonatal-perinatal Medicine. V 2,N 3,2009. р220.
- Г.С.Голосная, А.С.Петрухин, Д.И.Албагачиева, А.С.Трифонова, А.Ю.Герасимов, А.Б.Карпенко. Изменение сывороточного уровня молекулы клеточной адгезии ALCAM у новорожденных с перинатальными гипоксическими поражениями ЦНС //Материалы IV Ежегодного конгресса специалистов перинатальной медицины «Современная перинатология: организация, технологии и качество», Москва 28-29 сентября 2009 года. // Журнал Вопросы практической педиатрии 2009.том 4. приложение №1. с 14-15.
- Г.С.Голосная, А.С.Петрухин, Д.И.Албагачиева, А.С.Трифонова, А.Ю.Герасимов, А.Б.Карпенко, Н.С.Созаева. Сравнительная оценка уровней нейротрофического (BDNF) и васкулоэндотелиального (VEGF) факторов в сыворотке крови у новорожденных с тяжелым гипоксическим поражением ЦНС. // Материалы IV Ежегодного конгресса специалистов перинатальной медицины «Современная перинатология: организация, технологии и качество», Москва 28-29 сентября 2009 года. // Журнал Вопросы практической педиатрии 2009.том 4. приложение №1. с 14-15.
- Г.С.Голосная, А.С.Петрухин, Д.И. Албагачиева, Т.М.Красильщикова, А.Л.Эрлих, С.В.Трепилец, А.Б.Карпенко, А.Ю.Герасимов, А.С.Трифонова. Взаимодействие нейротрофических и проапоптотических факторов в патогенезе гипоксического поражения головного мозга у новорожденных. // Журнал «Педиатрия» М-2010. № 1.том.89. с 20-25.
- Г.С.Голосная, А.С.Петрухин, Д.И.Албагачиева, Т.М.Красильщикова, А.А.Терентьев, А.Л.Эрлих, А.Б.Карпенко, А.Ю.Герасимов. Провоспалительные маркеры в структуре постгипоксических изменений мозга у новорожденных детей. // Журнал «Вестник РГМУ». М.-2010. № 3. с 62-65.
СПИСОК СОКРАЩЕНИЙ :
АД артериальное давление
АТ антитело
АТФ аденозинтрифосфорная кислота
ГВ гестационный возраст
ГППГМ гипоксическое перинатальное поражение
головного мозга
ГКБ городская клиническая больница
ГЭБ гемато-энцефалический барьер
ДНК дезоксинуклеиновая кислота
ДЦП детский церебральный паралич
ИВЛ искусственная вентиляция легких
КОС кислотно-основное состояние
КТ компьютерная томография
МКА молекула клеточной адгезии
НСГ нейросонография
ПВЛ перивентрикулярная лейкомаляция
ПВО перивентрикулярная область
СДР синдром дыхательных расстройств
УЗИ ультразвуковое исследование
ALCAM активированная молекула лейкоцитарной
клеточной адгезии (Activated Leukocyte
Cell Adhesion Molecule)
DR 5 Death Receptor 5, TRAIL R2, TRICK 2,
KILLER/DR 5 ("рецептор смерти 5")
hDR5 Human Death Receptor 5
(человеческий"рецепторсмерти 5")
S-100 специфический белок астроцитарной глии

