Молекулярно-генетические маркеры метаболизма соединительной ткани при хронической обструктивной болезни легких и ее сочетании с ишемической болезнью сердца
На правах рукописи
ТИЛИК
Татьяна Валерьевна
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МАРКЕРЫ
МЕТАБОЛИЗМА СОЕДИНИТЕЛЬНОЙ ТКАНИ
ПРИ ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ И ЕЕ СОЧЕТАНИИ
С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА
14.01.04 – внутренние болезни
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Владивосток – 2012
| Работа выполнена в государственном бюджетном образовательном учреждении высшего профессионального образования «Владивостокский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации |
Научный руководитель: доктор медицинских наук, профессор
Невзорова Вера Афанасьевна
Официальные оппоненты: доктор медицинских наук, профессор
Кулаков Юрий Вячеславович
ГБОУ ВПО ВГМУ Минздравсоцразвития России
доктор медицинских наук, профессор
Шакирова Ольга Викторовна
ФГАОУ ВПО ДВФУ Минобрнауки России
Ведущая организация: государственное бюджетное
образовательное учреждение высшего профессионального образования
«Амурская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации
Защита диссертации состоится « 24 » февраля 2012 года
в « 10 » часов на заседании диссертационного совета К 208.007.01
при ГБОУ ВПО ВГМУ Минздравсоцразвития России
по адресу: 690002, г. Владивосток, проспект Острякова, 2
С диссертацией можно ознакомиться в библиотеке
Владивостокского государственного медицинского университета
Автореферат разослан « 20 » января 2012 года
Ученый секретарь диссертационного совета
кандидат медицинских наук, доцент Шестакова Н.В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Поиск эффективных методов предупреждения и лечения состояний с полиморбидным фоном является одной из важнейших медико-социальных проблем в связи с увеличением продолжительности жизни населения и накоплением в популяции пациентов с сочетанными заболеваниями, взаимоотягощающими течение друг друга [Бессонова Л.О., 2008]. Учитывая общность факторов риска, одним из которых является курение, наличие коморбидной патологии в виде хронической обструктивной болезни легких (ХОБЛ) и ишемической болезни сердца (ИБС) чаще является правилом, чем исключением. При ХОБЛ создаются условия для возникновения кардиоваскулярных нарушений и для усугубления проявлений коморбидности [Невзорова В.А., 2007; Boudestein L.C.M., 2009]. Среди лидирующих, но нераспознанных при жизни причин смерти у больных ХОБЛ является ИБС. По данным крупных популяционных исследований, риск смерти от сердечно-сосудистой патологии у больных ХОБЛ повышен в 2-3 раза [Huiart L., 2005]. ХОБЛ и ИБС рассматриваются в качестве никотинассоциированных заболеваний, с доказанным взаимоотягощающим течением, в патогенезе развития которых немаловажное значение имеет состояние соединительной ткани, составляющей основу сердечно-сосудистой и дыхательной систем [Suellen M. C., 2006]. Признается актуальным поиск наиболее информативных маркеров риска развития сердечно-сосудистых заболеваний при ХОБЛ, выявление которых на ранних стадиях до развития сердечно-сосудистых катастроф следует относить к вопросам предиктивной диагностики.
Целью исследования является поиск информативных маркеров риска развития ХОБЛ и ее сочетания со стабильной стенокардией напряжения на основе исследования содержания матриксной металлопротеиназы MMP-9, а также генетических полиморфизмов генов-кандидатов патологии метаболизма соединительной ткани.
Задачи исследования:
- Определить содержание матрикс-разрушающей металлопротеиназы MMP-9, ее комплекса с тканевым ингибитором TIMP-1, а также соотношение указанных показателей при ХОБЛ и ее сочетании со стабильной стенокардией напряжения.
- Изучить распределение делеций генов глутатионтрансфераз (GSTs) GSTT1 и GSTM1 при ХОБЛ и ее ассоциации с ИБС.
- Оценить содержание аллелей G и T гена коллагена I типа COL1A1 при изолированной ХОБЛ и ее ассоциации со стабильной стенокардией напряжения. Охарактеризовать состояние гомозиготных GG и TT, и гетерозиготного GT генотипов гена COL1A1 при ХОБЛ и ее сочетании с ИБС.
- Выяснить вклад изменения содержания MMP-9, комплекса MMP-9/TIMP-1, делеций генов GSTs, наличия аллелей G и T, генотипов GG, TT, GT гена COL1A1 в риск развития ХОБЛ и ее сочетания со стабильной стенокардией напряжения.
Научная новизна исследований. В результате проведенных исследований получены данные, расширяющие представления о патогенетических механизмах развития ХОБЛ и ее комбинации с ИБС. Установлен вклад дисбаланса системы «протеолиз-антипротеолиз» в формирование ХОБЛ и ее комбинации с ИБС. Выявлено, что наиболее выраженные изменения содержания MMP-9 и ее комплекса MMP-9/TIMP-1 зафиксированы при кардиореспираторной патологии. Охарактеризовано распределение аллелей и генотипов генов ферментов биотрансформации ксенобиотиков GSTs и коллагена I типа COL1A1 при ХОБЛ и ее ассоциации с ИБС, в том числе в зависимости от стадии ХОБЛ. Определены возможности предиктивной диагностики развития ХОБЛ и ее ассоциации с ИБС, основанной на данных исследования полиморфизма генов GSTs и COL1A1. Установлено, что наличие делеции GSTT1 увеличивает риск развития изолированной ХОБЛ и, особенно, сочетанной патологии. Наличие генотипа ТТ и увеличение доли генотипа GT гена COL1A1 наиболее значимо увеличивает риск развития ХОБЛ.
Практическая значимость работы. Расширены представления о патогенетических аспектах формирования изолированной ХОБЛ и кардиореспираторной патологии. Установлен вклад дисбаланса в системе «протеолиз-антипротеолиз» в развитие ХОБЛ и ее комбинации со стабильной стенокардией напряжения, с наиболее выраженными изменениями в последней группе. Определена значимость оценки генов ферментов биотрансформации ксенобиотиков при ХОБЛ, ассоциацированной с ИБС. Установлена необходимость оценки генотипов гена COL1A1 у пациентов с ХОБЛ. Результаты исследования могут найти применение в практической медицине в программах обследования и лечения ХОБЛ и ее комбинации с ИБС.
Основные положения, выносимые на защиту:
- Для ХОБЛ и ее комбинации с ИБС характерно возникновение дисбаланса в системе «протеолиз-антипротеолиз» со сдвигом в сторону активации протеолиза и максимальным повышением в сыворотке крови его маркеров – MMP-9 и комплекса MMP-9/TIMP-1 при сочетанной патологии.
- Среди выявленных полиморфизмов генов глутатионтрансфераз наибольшее значение в риске развития ХОБЛ и, особенно, сочетанной патологии, имеет нулевой генотип GSTT1.
- Важным фактором формирования соединительнотканного дисметаболизма при ХОБЛ и ее с ИБС является увеличение частоты содержания аллеля T, наличие генотипов TT и GT гена COL1A1. Наиболее высокая частота встречаемости генотипа TT и GT установлена при изолированной ХОБЛ.
Публикации. По теме диссертации опубликовано 17 работ, из них 5 – в рецензируемых журналах, рекомендованных ВАК.
Внедрение результатов исследования: Материалы диссертации внедрены в работу лечебно-профилактических учреждений г. Владивостока и используются в учебном процессе при подготовке интернов, ординаторов и врачей на кафедре терапии, функциональной и ультразвуковой диагностики ФПК и ППС.
Апробация работы. Основные результаты работы были представлены на научных конференциях регионального, российского и международного уровней: на ХVIII - ХХI Европейском респираторном конгрессе (Berlin, 2008; Vienna, 2009; Barcelona, 2010; Amsterdam, 2011); VI и VII Дальневосточном регионального конгресса с международным участием (Владивосток, 2009 и 2010); Российском Национальном конгрессе кардиологов (Москва, 2010).
Структура и объем диссертации. Диссертации изложена на 150 страницах, содержит 14 рисунков и 3 таблицы, состоит из введения, четырех глав, обсуждения результатов, выводов, практических рекомендаций и списка литературы, включающего 186 источников (33 – отечественных и 153 – зарубежных авторов).
Диссертации изложена на 150 страницах, содержит 14 рисунков и 3 таблицы, состоит из введения, четырех глав, обсуждения результатов, выводов, практических рекомендаций и списка литературы,
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования. Обследовано 120 пациентов, находившихся на амбулаторном наблюдении в аллерго-респираторном центре и поликлиниках г. Владивостока в течение 2008-2011 гг. Для диагностики ХОБЛ применялись рекомендации международной программы GOLD (Глобальная стратегия диагнос-тики, лечения и профилактики ХОБЛ, пересмотр 2010 г.). Подтверждение или исключение диагноза ИБС у всех обследованных осуществлялось согласно рекомендациям Всероссийского научного общества кардиологов и МКБ-10.
В исследование были включены лица обоего пола с фенотипическими признаками европейской расы. У 60 пациентов установлена изолированная ХОБЛ II-III стадии заболевания стабильного течения (I группа). У 60 пациентов ХОБЛ II-III стадии заболевания в сочетании со стабильной стенокардией напряжения I-II ФК (II группа). Группы обследованных делились на подгруппы в зависимости от стадии ХОБЛ: ХОБЛ II стадии – при 50%<ОФВ1<80% от должных величин, ХОБЛ III стадии – при 30%<ОФВ1<50% от должных величин, ОФВ1/ФЖЕЛ<70%. Соответственно, были выделены следующие подгруппы: IА – ХОБЛ II стадии (n=30); IВ – ХОБЛ III стадии (n=30); IIА – ХОБЛ II стадии, ассоциированная с ИБС (n=30); IIВ – ХОБЛ III стадии, ассоциированная с ИБС (n=30). Контрольную группу (n=30) составили условно здоровые добровольцы, соответствующие основной группе по возрасту, полу, этнической принадлежности. Определение содержания ММР-9 и комплекса ММР-9/ТІМР-1 проводилось методом иммуноферментного анализа [Mosman T.R., 1998] с помощью реактивов R&D Diagnostics Inc. (США). Учет результатов проводили с помощью анализатора Multiscan (Финляндия). Количество MMP-9 и MMP-9/TIMP-1 рассчитывали путем построения калибровочной кривой и выражали в нанограммах/мл (нг/мл). ДНК выделяли из лейкоцитов с использованием фенольно-хлороформной экстракции. Анализ полиморфных локусов проводили методом ПЦР. Амплификацию производили на амплификаторе GeneAmp PCR System 2700, Applied Biosystems производства США с использованием наборов реагентов для полиморфных маркеров: G1546T гена COL1A1 и генов GSTs (производства «ГосНИИгенетика» полиморфные маркеры: I/D гена GSTM1, I/D гена GSTT1, G1546T гена COL1A1) в соответствии с рекомендациями производителя. Продукты амплификации и гидролиза визуализировали на трансиллюминаторе при помощи гель-документирующей системы Bio-Print 1500/20M (Франция). Для генотипов GSTs гомозиготные делеции определялись наличием одного амплификационного фрагмента длиной 350 п.н. Генотипы COL1A1 по мутации G1546T определялись набором фрагментов: ТТ-генотип – 312 п.н.; GT-генотип – 312, 235 и 77 п.н.; GG - 235 и 77 п.н.
Результаты оценены с помощью программы STATISTICA 6.0. Достоверность различий в распределении частот аллелей и генотипов между группами и контролем оценивали по тесту. Вычисляли относительный риск по формуле: ОР=ахd/bхс, где а – число больных с наличием и b — с отсутствием признака у больных; с и d – число здоровых соответственно с наличием и отсутствием признака.
Автор выражает глубокую признательность сотрудникам Тихоокеанского института биоорганической химии ДВО РАН, на базе которых проведены биохимические и генетические исследования: руководителю лаборатории химии неинфекционного иммунитета д.х.н., профессору П.А. Лукьянову, старшему научному сотруднику лаборатории морской биохимии к.м.н. М.П. Исаевой.
Результаты собственных исследований и их обсуждение
MMP-9 является одним из основных протеолитических ферментов, отвечающих за ремоделирование соединительной ткани. Установлено повышение ее уровня с сыворотке как при ХОБЛ, так и при ИБС [Zourdidakis E., 2004; Kim S.E., 2009]. Однако в литературе отсутствуют сведения о содержании MMP-9 при сочетанной патологии. Согласно полученным результатам, при кардиореспираторной патологии содержание MMP-9 достоверно выше, чем в контроле и при изолированной ХОБЛ в 1,9 и в 1,5 раза соответственно (рис.1).
 Примечание: * - разница по сравнению с контролем достоверна при р<0,05, & - разница между I и II группами достоверна при р<0,05.
Примечание: * - разница по сравнению с контролем достоверна при р<0,05, & - разница между I и II группами достоверна при р<0,05.
Рис. 1. Содержание MMP-9 в сыворотке крови при ХОБЛ и ее сочетании с ИБС.
Полученные нами данные свидетельствуют о более значимом увеличении содержания MMP-9 именно при сочетании ХОБЛ и ИБС. Исходя из предыдущих исследований, указывающих на изменение уровня ММР-9 в зависимости от стадии ХОБЛ, нам представилось интересным исследовать состояние ММР-9 при различных стадиях ХОБЛ в обеих группах (рис. 2).
 Примечание: * - разница по сравнению с контролем достоверна при р<0,05, # - разница между подгруппами пациентов IА и IIА, IВ и IIВ достоверна при р<0,05, " - разница между подгруппами пациентов IА и IВ, IIА и IIВ достоверна при р<0,05.
Примечание: * - разница по сравнению с контролем достоверна при р<0,05, # - разница между подгруппами пациентов IА и IIА, IВ и IIВ достоверна при р<0,05, " - разница между подгруппами пациентов IА и IВ, IIА и IIВ достоверна при р<0,05.
Рис. 2. Содержание MMP-9 при II и III стадиях ХОБЛ в I и II группах пациентов.
Как следует из представленных данных, концентрация MMP-9 достигает максимальных значений при III стадии ХОБЛ в обеих группах. В то же время при III стадии ХОБЛ содержание ММР-9 выше при сочетанной патологии, чем при изолированной ХОБЛ (299,84±26,24, 445,17±43,32 нг/мл, соответственно, р<0,001). Повышение содержания MMP-9 по мере увеличения стадии ХОБЛ может быть связано с глубокими процессами ремоделирования легочной ткани при более тяжелых стадиях заболевания, что отмечено и в предыдущих исследованиях [Huiart L., 2005]. Увеличение содержания MMP-9 может быть рассмотрено в качестве индикатора более тяжелого течения ХОБЛ и одновременно быть связанным с риском развития ИБС. Для характеристики протеолитической активности используют не только концентрацию ММР-9, но и ее комплекс с ингибитором TIMP-1. В нашем исследовании содержание комплекса MMP-9/TIMP-1 имеет сходную динамику с ММР-9 (рис. 3).
 Примечание: * - разница по сравнению с контролем достоверна при р<0,05, & - разница между I и II группами достоверна при р<0,05
Примечание: * - разница по сравнению с контролем достоверна при р<0,05, & - разница между I и II группами достоверна при р<0,05
Рис. 3. Содержание MMP-9/TIMP-1 в сыворотке крови при ХОБЛ и ее сочетании с ИБС.
Уровень комплекса повышен в обеих группах по сравнению с контролем (11,44±0,72; 6,41±0,57; 3,15±0,3 нг/мл, соответственно; p<0,001, p<0,001). Установлена достоверная разница между содержанием комплекса при ХОБЛ и ее сочетании с ИБС в сторону увеличения в последнем случае (6,41±0,57; 11,44±0,72 нг/мл; p<0,001, соответственно). Концентрация комплекса MMP-9/TIMP-1, также как и содержание свободной ММР-9, зависит как от стадии ХОБЛ, так и от наличия или отсутствия ИБС (рис. 4).
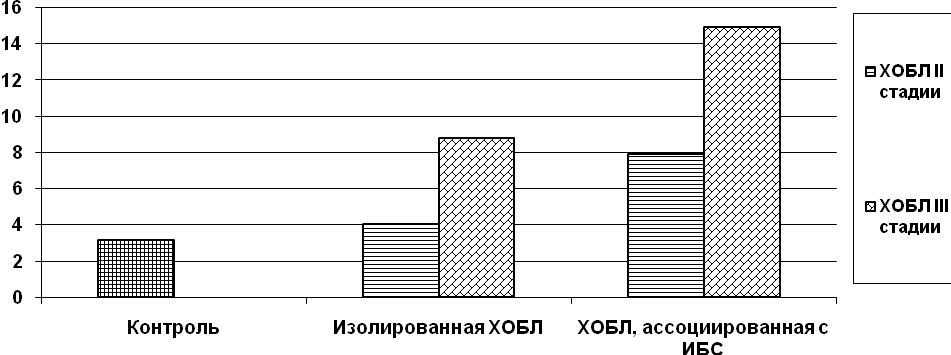 Примечание: * - разница по сравнению с контролем достоверна при р<0,05, # - разница между подгруппами пациентов IА и IIА, IВ и IIВ достоверна при р<0,05, " - разница между подгруппами пациентов IА и IВ, IIА и IIВ достоверна при р<0,05.
Примечание: * - разница по сравнению с контролем достоверна при р<0,05, # - разница между подгруппами пациентов IА и IIА, IВ и IIВ достоверна при р<0,05, " - разница между подгруппами пациентов IА и IВ, IIА и IIВ достоверна при р<0,05.
Рис. 4. Содержание MMP-9/TIMP-1 при II и III стадиях ХОБЛ в I и II группах пациентов
В обеих группах содержание MMP-9/TIMP-1 достоверно выше при III стадии ХОБЛ. Полученные данные о содержании MMP-9/TIMP-1 согласуются с результатами исследования свободной MMP-9 и указывают на наличие дисметаболизма соединительной ткани в сторону активации процессов протеолиза при стабильном течении ХОБЛ и при сочетании ХОБЛ и ИБС.
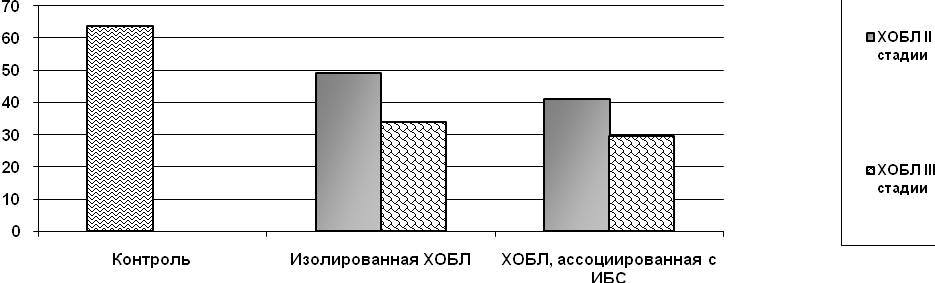
Помимо изучения процессов протеолиза нам представилось интересным оценить антипротеазную активность сыворотки, рассчитав соотношение содержания свободной MMP-9 к комплексу MMP-9/TIMP-1 (соотношение «M:К»). Результаты исследования соотношения «M:К» в группе пациентов представлены на рисунке 5.
 Примечание: * - разница по сравнению с контролем достоверна при р<0,05, & - разница между I и II группами достоверна при р<0,01
Примечание: * - разница по сравнению с контролем достоверна при р<0,05, & - разница между I и II группами достоверна при р<0,01
Рис. 5. Соотношение концентрации MMP-9 и MMP-9/TIMP-1при ХОБЛ и ее сочетании с ИБС
Соотношение «M:К» имеет противоположную тенденцию относительно содержания MMP-9 и комплекса MMP-9/TIMP-1. Так в контроле показатель «M:К» максимальный и составляет 63,61±5,69. В группе изолированной ХОБЛ показатели «M:К» меньше, чем в контроле. Наиболее низкие значения соотношения «M:К» установлены при сочетании ХОБЛ и ИБС. Если расценивать «M:К» в качестве косвенного показателя, отражающего состояние антипротеазной активности сыворотки крови, то следует предположить, что антипротеазная активность максимальна в контроле и снижена у пациентов ХОБЛ и, особенно, при ее сочетании с ИБС. Анализ соотношения «M:К» в зависимости от стадии ХОБЛ показал, что наименьшее значение «M:К» установлено при III стадии ХОБЛ в обеих группах обследованных (рис. 6). Итак, при ХОБЛ и ее сочетании с ИБС происходит сдвиг в сторону активации протеолиза с наибольшими изменениями в группе пациентов с кардиореспираторной патологией.
 Примечание: * - разница по сравнению с контролем достоверна при р<0,05, # - разница между подгруппами IА и IIА, IВ и IIВ достоверна при р<0,05, " - разница между подгруппами IА и IВ, IIА и IIВ достоверна при р<0,05.
Примечание: * - разница по сравнению с контролем достоверна при р<0,05, # - разница между подгруппами IА и IIА, IВ и IIВ достоверна при р<0,05, " - разница между подгруппами IА и IВ, IIА и IIВ достоверна при р<0,05.
Рис. 6. Соотношение концентрации MMP-9 и MMP-9/TIMP-1 при II и III стадиях ХОБЛ в I и II группах пациентов.
Соответственно, исследование содержания MMP-9, комплекса MMP-9/TIMP-1 и расчет их соотношения информативно для характеристики процессов соединительнотканного дисметаболизма при ХОБЛ и для дополнительной оценки сердечно-сосудистого риска.
ХОБЛ и ИБС относятся к никотин-ассоциированным заболеваниям. Гены GSTM1 и GSTT1 играют важную роль в биотрансформации продуктов сгорания табака. Согласно нашим исследованиям частота встречаемости делеции GSTТ1 в группе контроля составляет 3,33 % и не отличается от данных крупных популяционных исследований [Imboden M., 2007]. У пациентов с изолированной ХОБЛ частота делеции GSTT1 возрастает по сравнению с контролем в 4 раза (13,33%, =6,79, =0,009), а в группе пациентов с ХОБЛ в сочетании с ИБС – в 6 раз (20%, =14,20, =0,0002) (рис. 7).
 Примечание: * - разница по сравнению с контролем достоверна при р<0,05
Примечание: * - разница по сравнению с контролем достоверна при р<0,05
Рис. 7. Частота делеции GSTT1 у пациентов ХОБЛ и при ее сочетании с ИБС.
Исследование частоты делеции гена GSTТ1 в подгруппах пациентов со II и III стадией ХОБЛ показало отсутствие общей закономерности частоты делеции GSTT1 от стадии ХОБЛ (рис. 8). Хотя в ранее проведенном исследовании Imboden M. [2007] были получены данные о наличии прямой связи между частотой встречаемости делеции GSTТ1 и увеличением тяжести течения ХОБЛ.
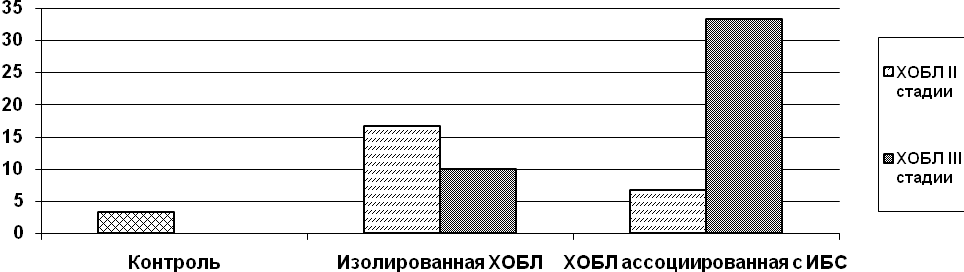 Примечание: * - разница по сравнению с контролем достоверна при р<0,05, # - разница между подгруппами IА и IВ, IIА и IIВ достоверна при р<0,05, " - разница между подгруппами IА и IIА, IВ и IIВ достоверна при р<0,05.
Примечание: * - разница по сравнению с контролем достоверна при р<0,05, # - разница между подгруппами IА и IВ, IIА и IIВ достоверна при р<0,05, " - разница между подгруппами IА и IIА, IВ и IIВ достоверна при р<0,05.
Рис. 8. Частота встречаемости гомозиготной делеции гена GSTT1 при II и III стадиях ХОБЛ в I и II группах пациентов
Обращает внимание факт наибольшей доли делеции GSTТ1 в группе с III стадией ХОБЛ в сочетании с ИБС, когда она составляет 33,33% и регистрируется практически у каждого третьего пациента,
Исследование полиморфизма гена GSTM1 показало, что в контроле делеция выявлена у 46,67%, что сопоставимо с данными исследований в других популяциях (42-46%) [Jian-Qing H., 2002]. Достоверных различий в частоте встречаемости полиморфизма GSTM1 между группами и подгруппами не установлено (48,33%, 58,33%, соответственно, =2,01, =0,16). Наличие сочетанного нулевого генотипа GSTM1 и GSTT1 зарегистрировано у четырех пациентов с III стадией ХОБЛ в сочетании с ИБС. Нулевые генотипы являются потенциально патологическими: они не кодируют функционально активные ферменты, которые являются важнейшим компонентом фазы детоксикации продуктов сгорания табака [Jeffery P.K., 2004].
Таким образом, установлено максимальное значение делеции GSTT1 в группе пациентов с сочетанной патологией при III стадии ХОБЛ, что позволяет рассматривать делецию GSTT1 в качестве потенциального маркера более тяжелого течения ХОБЛ в сочетании с ИБС. В то время как делеция GSTM1 не имеет существенного значения для оценки риска развития и ХОБЛ и ее сочетания с ИБС.
Вклад в формирование соединительной ткани сердечно-сосудистой и дыхательной систем вносит коллаген I типа COL1A1, противодействующий силам растяжения и создающий прочность соединительнотканного матрикса. Полученные ранее данные позволяют утверждать, что повышенная экспрессия гена COL1A1 связана с дисбалансом процесса синтеза — деградации коллагена при ХОБЛ [Nevzorova V.A., 2005]. Согласно результатам нашего исследования, частота аллеля Т по сравнению со здоровыми достоверно увеличивается при ХОБЛ в 5,3 раза (=61,89, p=0,00001) (табл. 1).
Таблица 1
Частота встречаемости аллелей G и T и генотипов GG, GT и TT гена COL1A1 при ХОБЛ и ее сочетании с ИБС
| маркер | контроль | I группа | II группа |
| Аллель G | 86,67% | 29,63%*# | 51,67%*# |
| Аллель T | 13,33% | 70,37% *# | 48,33%*# |
| Генотип GG | 70% | 1,85%*# | 23,33%*# |
| Генотип GT | 30% | 51,85%* | 56,67%* |
| Генотип TT | 0% | 46,3%*# | 20%*# |
Примечание: * - разница по сравнению с контролем достоверна при р<0,05, # - разница между группами достоверна при р<0,05.
При сочетании ХОБЛ и ИБС частота аллеля Т достоверно повышается по сравнению с контролем в 3,6 раза (=25,23, =0,00001), но менее значительно относительно изолированной ХОБЛ (=10,00, =0,0016). В ранее проведенных исследованиях показано, что аллель T является неблагоприятным и чаще встречается при ХОБЛ более тяжелого течения [Невзорова В.А., 2008; Herd R., 2009].
В литературе практически отсутствуют сведения о частоте встречаемости генотипов GG, GT и TT гена COL1A1 при ХОБЛ в сочетании с ИБС. Как следует из данных, представленных в таблице 1, первые два генотипа представлены у здоровых, причем гомозиготный генотип GG в данном случае является преобладающим. Патологический генотип TT в контроле не установлен. У пациентов с ХОБЛ и ее сочетании с ИБС доля генотипа GG уменьшается наиболее заметно в первом случае, составляя 1,85% (=100,35, =0,00001). В то время как доля генотипа TT резко увеличивается с максимальными значениями при ХОБЛ (46,3%, =63,16, p=0,00001). В обеих группах почти в 2 раза возрастает содержание гетерозигот GT (51,85%, =10,0, =0,0016 и 56,67%, =14,83, =0,0001, соответственно). Анализ аллелей и генотипов COL1A1 при различной тяжести ХОБЛ в обеих группах представлен в таблице 2.
Таблица 2
Частота встречаемости аллелей и генотипов гена COL1A1
при II и III стадиях ХОБЛ в I и II группах пациентов
| маркер, % | контроль | I группа | II группа | ||
| IА | IВ | IIА | IIВ | ||
| Аллель G | 86,67% | 40%*"# | 16,67%*"# | 70%*"# | 33,3%*"# |
| Аллель T | 13,33% | 60%*"# | 83,33% *"# | 30%*"# | 66,7%*"# |
| Генотип GG | 70% | 3,33%*# | 0%*# | 40%*"# | 6,7%*"# |
| Генотип GT | 30% | 83,33%*"# | 12,5%*"# | 60%*# | 53,3%*# |
| Генотип TT | 0% | 13,34% *"# | 87,5%*"# | 0%"# | 40%*"# |
Примечание: * - разница по сравнению с контролем достоверна при р<0,05, " - разница между подгруппами IА и IВ, IIА и IIВ достоверна при р<0,05, # - разница между подгруппами IА и IIА, IВ и IIВ достоверна при р<0,05.
Согласно данным, аллель Т в контроле выявлен у 13,33%, частота его встречаемости увеличивается по сравнению с контролем во всех группах (=43,20, =0,00001; =92,52, =0,00001; =6,45, =0,01; =55,89, =0,00001). Максимальное содержание аллеля Т установлено при III стадии ХОБЛ в обеих группах. Как следует из данных таблицы 2 наименьшее количество аллеля G и наибольшее аллеля Т установлено при III стадии изолированной ХОБЛ (16,67%, =92,52, =0,00001 и 83,33%, =6,83, =0,01 по отношению к контролю, соответственно). При сочетанной патологии достоверное уменьшение аллеля G и увеличение аллеля Т зарегистрировано только при III стадии ХОБЛ. При этом их количество достоверно отличается от содержания у пациентов с III стадией изолированной ХОБЛ.
Количество гомозигот GG резко уменьшается по мере нарастания тяжести ХОБЛ в каждой группе и не встречается при III стадией заболевания. Патологический генотип TT, напротив, преобладает в этой группе пациентов, достигая 87,5% (=157,14, =0,00001 по отношению к контролю), достоверно обнаруживаясь практически во всех подгруппах. Достоверно более высокая частота генотипа GT выявлена в IА подгруппе. Полученные данные могут свидетельствовать об ответственности генотипов GT и TT за развитие изолированной ХОБЛ [Nevzorova V.A., 2005]. При сочетанной патологии изменения в содержании генотипов COL1A1 установлены только при III стадии ХОБЛ. В этой группе значительно снижается доля гомозиготного генотипа GG и увеличивается доля генотипа TT (6,7%, =83,81, =0,00001 и 40%, =50,0, =0,00001, соответственно). Очевидно увеличение доли аллеля Т и появление патологического генотипа TT в большей степени связано с ремоделированием дыхательных путей. Однако высказанное предположение носит гипотетический характер и требует дальнейших исследований. Так или иначе, полученные результаты свидетельствуют о большей предрасположенности к значительным изменениям соединительнотканного метаболизма у пациентов с ХОБЛ при наличии аллеля Т и генотипов GT и TT гена COL1A1 [Nevzorova V.A., 2005; Гельцер Б.И., 2006].
Установленные в исследовании данные, касающиеся состояния дисбаланса в системе «протеолиз-антипротеолиз» и процессов соединительнотканного дисметаболизма, связанного с полиморфизмами генов GSTT1 и COL1A1, позволили выяснить вклад указанных изменений в ОР ХОБЛ и ассоциированной патологии.
Примененный в исследовании метод расчета ОР показал, что увеличение содержания свободной MMP-9 выше 200,37±19,54 нг/мл связано с повышением ОР ХОБЛ и ассоциированной ИБС в целом по группе в 13,95 раз (95%ДИ=8,18-23,76). Рассчитать ОР отдельно по группам невозможно, поскольку при сочетанной патологии у всех пациентов содержание MMP-9 выше контрольных значений 200,37±19,54 нг/мл. Также превышение содержания комплекса MMP-9/TIMP-1 выше 3,15±0,3 нг/мл (показатель контроля) увеличивает ОР ХОБЛ и ассоциированной ИБС в целом по группе в 136 раз (95% ДИ=20-914,62). Для того, чтобы рассчитать ОР развития ИБС у пациентов ХОБЛ нами было определено среднее значение MMP-9 и MMP-9/TIMP-1 в целом по группе, которые составили 320,48±29,8 нг/мл и 8,95±0,64 нг/мл, соответственно. При содержании MMP-9 выше 320,48±29,8 нг/мл, а комплекса более 8,95±0,64 нг/мл увеличивается ОР ИБС у пациентов ХОБЛ в 32 раза (95% ДИ=19,34-52,96) и 3,3 раза (95% ДИ=2,39-4,56), соответственно. Примененный метод расчета ОР подчеркнул информативность использования содержания MMP-9 и ее комплекса с TIMP-1 в сыворотке для оценки течения ХОБЛ и степени сердечно-сосудистого риска.
Изучение распределения делеций генов GSTT1 и GSTМ1 при ХОБЛ и ее комбинации с ИБС продемонстрировало существенные изменения только в состоянии гена GSTT1. Метод ОР показал, что наличие делеции GSTT1 увеличивает ОР изолированной ХОБЛ в 4,46 раза (95% ДИ=3,36-5,94), а сочетанной кардиореспираторной патологии - в 7,26 раза (95% ДИ=5,76-9,15). Соответственно, ухудшение процессов детоксикации ксенобиотиков значимо способствует развитию ХОБЛ, но еще более значительно увеличивает ОР развития ее ассоциации с ИБС.
Полученные данные выявили, что частота аллеля Т гена COL1A1 достоверно больше увеличивается при ХОБЛ, чем при сочетании ХОБЛ и ИБС. Наличие аллеля T увеличивает ОР изолированной ХОБЛ в 13,45 раза (95% ДИ=9,72-18,63), ее сочетания с ИБС – в 5,3 раза (95% ДИ=4,11-6,84). Частота встречаемости генотипа GT в обеих группах практически одинакова, тогда как частота генотипа TT достоверно повышается как при изолированной ХОБЛ, так и при сочетанной патологии, однако максимальное значение данный показатель имеет именно при изолированной ХОБЛ. Генотип GT более значимо увеличивает ОР изолированной ХОБЛ (ОР=65,4, 95% ДИ=15,62-273,78) по сравнению с сочетанной патологией (ОР=5,67, 95% ДИ=3,86-8,32). Присутствие комбинации генотипов ТТ и GT сопряжено с повышением ОР изолированной ХОБЛ в 126,13 раз (95% ДИ=30,32-524,66), а ее ассоциации с ИБС – в 7,67 (95% ДИ=5,29-11,11), что подчеркивает значимость указанных генотипов в развитии соединительнотканного дисметаболизма при ХОБЛ.
Итак, исследование состояния маркеров соединительнотканного метаболизма при ХОБЛ и ее сочетании с ИБС показало, что в обеих группах, несмотря на стабильное течение заболевания, присутствует активация процессов протеолиза в виде повышения содержания MMP-9 и ее комплекса с TIMP-1 с наиболее значимыми изменениями в группе пациентов с сочетанной патологией. Из генов детоксикации ксенобиотиков на развитие ХОБЛ и, особенно, ее сочетания с ИБС наиболее значим полиморфизм гена GSTT1. В то время как изменение содержания аллелей и генотипов COL1A1 более тесно связано с развитием изолированной ХОБЛ. Указанные изменения могут быть использованы для формирования программ предиктивной диагностики ХОБЛ и ее сочетания с ИБС.
ВЫВОДЫ
- При ХОБЛ и ее ассоциации с ИБС происходит активация протеолиза, о чем свидетельствует повышение содержания матриксной металлопротеиназы 9 и ее комплекса с тканевым ингибитором 1 в сыворотке крови с максимальными изменениями при III стадии ХОБЛ и ее сочетании с ИБС (445,17±43,32 нг/мл, 14,96±0,87 нг/мл). Антипротеазная активность, оцененная по соотношению матриксной металлопротеиназы 9 к ее комплексу с тканевым ингибитором 1 снижается по сравнению со здоровыми, как при изолированной ХОБЛ, так и, особенно, при коморбидной патологии (41,54±15,81 нг/мл, 35,33±22,93 нг/мл, соответственно). Минимальное значение соотношения установлено при ІІІ стадии ХОБЛ в обеих группах.
- Изучение полиморфизмов генов глутатионтрансфераз T1 и M1 показало достоверное увеличение делеций глутатионтрансферазы T1 у пациентов ХОБЛ и при наличии ее ассоциации с ИБС. Максимальное присутствие (до 33,33%) нулевого генотипа гена глутатионтрансферазы T1 установлено у пациентов с III стадией ХОБЛ в комбинации с ИБС.
- Исследование содержания аллелей G и T и генотипов гена коллагена I типа показало значительное увеличение частоты встречаемости аллеля T гена коллагена I типа как у пациентов ХОБЛ, так и при наличии ИБС с максимальный присутствием при III стадией ХОБЛ (83,33%). В обеих группах значительно увеличивается доля генотипа TT и гетерозигот GT по сравнению с контролем. Наибольшее количество гомозигот TT (87,5%) установлено при III стадии изолированной ХОБЛ.
- При повышение содержания матриксной металлопротеиназы 9 выше 200,37±19,54 нг/мл и ее комплекса с тканевым ингибитором 1 выше 3,15±0,3 нг/мл увеличивается относительный риск ХОБЛ, в том числе в сочетании с ИБС, в 13,95 раз и в 136 раз, соответственно. При содержании матриксной металлопротеиназы 9 выше 320,48±29,8 нг/мл, а комплекса более 8,95±0,64 нг/мл увеличивается относительный риск ИБС у пациентов ХОБЛ в 32 раза и 3,3 раза, соответственно.
- Полиморфизм генов глутатионтрансферазы T1 и коллагена I типа у пациентов ХОБЛ и при ассоциации с ИБС может быть использован в программах предиктивной диагностики указанных заболеваний. Так, наличие нулевого генотипа гена глутатионтрансферазы T1 в большей степени определяет относительный риск возникновения сочетанной патологии, чем изолированной ХОБЛ. Наличие аллеля Т, генотипа GT и комбинация генотипов ТТ и GT коллагена I типа более значимо увеличивает относительный риск изолированной ХОБЛ по сравнению с ассоциированной ИБС.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Для оценки протеолитической активности сыворотки крови при ХОБЛ и ее комбинации с ИБС может быть использован метод исследования свободной ММР-9 и ее комплекса с TIMP-1. В первом случае содержание выше 200,4 нг/мл, а во втором – выше 3,2 нг/мл в 13,9 и 136 раз, соответственно, увеличивает относительный риск ХОБЛ и ее сочетания с ИБС.
- Соотношение MMP-9 и комплекса может применяться для характеристики антипротеазной активности сыворотки крови. Для ХОБЛ характерно снижение этого соотношения до 41,5, а для ассоциированной патологии до 35,3.
- Исследование протеолитической активности сыворотки крови с помощью определения MMP-9 и комплекса MMP-9/TIMP-1 может быть использовано в программах оценки сердечно-сосудистого риска при ХОБЛ. Так превышение содержания MMP-9 и комплекса MMP-9/TIMP-1 выше 320,5 нг/мл, а комплекса более 8,9 нг/мл, увеличивает относительный риск ИБС у пациентов ХОБЛ в 32 раза и 3,3 раза, соответственно.
- Исследование полиморфизма генов глутатионтрансферазы GSTT1 и коллагена I типа COL1A1 может быть включено в программы предиктивной диагностики ХОБЛ и ее сочетания с ИБС. Для изолированной ХОБЛ более значимо определение наличия аллеля Т, гомозиготного патологического генотипа ТТ и его комбинации с GT гена коллагена I типа. В этом случае относительный риск изолированной ХОБЛ возрастает в 13,5 раза, 126,1 раза, 5,7 раза, соответственно. Для сочетанной патологии более значимо присутствие нулевого гомозиготного генотипа GSTT1, когда относительный риск ассоциированной патологии возрастает в 7,3 раза, а изолированной ХОБЛ – в 4,5 раза, соответственно.
СПИСОК НАУЧНЫХ РАБОТ,
ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Тилик Т.В., Невзорова В.А., Вахрушева С.Е., Панченко Е.А., Исаева М.П. Полиморфизм генов глутатионтрансфераз при хронической обструктивной болезни легких, ассоциированной с ишемической болезнью сердца // Тихоокеанский медицинский журнал. 2010. №1. С. 13-15.
- Невзорова В.А., Гилифанов Е.А., Тилик Т.В. Курение табака и функционально-морфологическое ремоделирование слизистой оболочки верхних дыхательных путей // Российская отоларингология. 2010. №4 (47). С. 115-120.
- Невзорова В.А., Гилифанов Е.А., Тилик Т.В. Клинические проявления патологии верхних дыхательных путей при хронической обструктивной болезни легких // Российская отоларингология. 2010. №6 (49). С. 83-85.
- Невзорова В.А., Тилик Т.В., Гилифанов Е.А., Панченко Е.А., Вахрушева С.Е. Роль матриксных металлопротеиназ в формировании морфофункционального дисбаланса воздухоносных путей при хронической обструктивной болезни легких // Тихоокеанский медицинский журнал. 2011. №2. С. 9-13.
- Невзорова В.А., Тилик Т.В., Гилифанов Е.А., Вахрушева С.Е., Панченко Е.А., Кудрявцева В.А., Лукьянов П.А. Содержание свободной металлопротеиназы MMP9 и комплекса MMP9/TIMP1 в сыворотке крови при стабильном течении хронической обструктивной болезни легких, ассоциированной с ишемической болезнью сердца // Пульмонология. 2011. № 2. С. 75-80.
- Kochetkova E., Maistrovskay U., Albavichus S., Tilik T., Massard G., Kessler R. Effect of the matrix metalloproteinase-9 on bone in chronic obstructive pulmonary disease // Abstract of 19-th European Respiratory Society Annual Congress. Vienna, Austria, Barcelona. 2009. P. 3253.
- Nevzorova V., Tilik T., Vakhrusheva S., Maistrovska J., Gilifanov E., Golotina O. The role of matrix metalloproteinase-9 in the formation of chronic obstructive pulmonary disease associated with coronary heart disease // Abstract of 20-th European Respiratory Society Annual Congress. Barcelona. 2010. P. 4296.
- Tilik T., Vakhrusheva S., Maistrovska J., Gilifanov E., Golotina O., Panchenko E., Nastradin O. Polymorphism of collagen I gene in chronic obstructive pulmonary disease associated with coronary heart disease // Abstract of 20-th European Respiratory Society Annual Congress. Barcelona. 2010. P. 4295.
- Tilik T., Nevzorova V., Vakhrusheva S., Nastradin O., Khasina M., Panchenko E. Association between glutation-S-transferases genotypes and risk of chronic obstructive pulmonary disease and coronary heart disease development.// Abstract of 20-th European Respiratory Society Annual Congress. Barcelona. 2010. P. 5211.
- Tilik T., Nevzorova V., Vakhrusheva S., Gilifanov E., Issaeva М. Polymorphism of collagen I gene and glutation-S-transferases T1 and M1 in chronic obstructive pulmonary disease associated with cardiovascular disease //Abstract of 20-th European Respiratory Society Annual Congress. – Amsterdam. 2011. P. 114.
- Vakhrusheva S., Nevzorova V., Tilik T., Gilifanov E., Issaeva М. Polymorphism of glutation-S-transferases T1 and M1 in chronic obstructive pulmonary disease // Abstract of 21-th European Respiratory Society Annual Congress. – Amsterdam. 2011. P. 114.
- Невзорова В.А., Тилик Т.В., Вахрушева С.Е., Минакова Е.Ю. Металлопротеиназа MMP9 как причина коморбидности хронической обструктивной болезни легких и ишемической болезни сердца // Вопросы повышения качества оказания медицинской помощи в муниципальном здравоохранении : Материалы научно-практической конференции. Владивосток. 2010. С. 22.
- Невзорова В.А., Гилифанов Е.А., Иченко В.Б., Лепейко Ю.Б., Тилик Т.В., Лобода О.В., Елецкая М.П., Красникова А.А. Ремоделирование слизистой оболочки и клинические аспекты влияния курения табака на органы дыхания // Актуальные вопросы оториноларингологии : Материалы научно-практической конференции оториноларингологов Южного и Северо-Кавказского федеральных округов РФ. Волгоград. 2010. С. 46 – 47.
- Тилик Т.В., Невзорова В.А., Вахрушева С.Е., Панченко Е.А., Настрадин О.В. Полиморфизм генов глутатионтрансфераз при ишемической болезни сердца в сочетании с хронической обструктивной болезнью легких // Российский Национального конгресс кардиологов: материалы конгресса. Москва. 2010. (Приложение 1 к журналу «Кардиоваскулярная терапия и профилактика». 2010. №9 (6)). С. 328.
- Тилик Т.В., Вахрушева С.Е. Содержание свободной металлопротеиназы MMP9 и комплекса MMP9/TIMP1 в сыворотке крови при стабильном течении хронической обструктивной болезни легких, ассоциированной с ишемической болезнью сердца // Человек и лекарство : Материалы VII Дальневосточного регионального конгресса ученых с международным участием. Владивосток : Медицина ДВ. 2010. №3. С.139 -140.
- Тилик Т.В., Вахрушева С.Е., Минакова Е.Ю. Полиморфизм генов глутатионтрансфераз GSTM1 и GSTT1 у курильщиков и при ранних стадиях хронической обструктивной болезни легких // Актуальные проблемы экспериментальной, профилактической и клинической медицины : Материалы XII Тихоокеанской научно-практической конференции студентов и молодых ученых с международным участием. Владивосток : Медицина ДВ. 2011. С. 76-77.
- Тилик Т.В., Вахрушева С.Е., Панченко Е.А., Исаева М.П., Невзорова В.А. Вопросы предиктивной диагностики развития ишемической болезни сердца у больных хронической обструктивной болезнью легких // Материалы VI Научно-практической конференции «Фундаментальная наука – медицине», 2011, Вла-дивосток, С.65-79.
СПИСОК ИСПОЛЬЗУЕМЫХ СОКРАЩЕНИЙ
ИБС – ишемическая болезнь сердца
ОР – относительный риск
ХОБЛ – хроническая обструктивная болезнь легких
COL1A1 – ген коллагена I типа 1 цепи
GSTТ1 – глутатион-S-трансфераза Т1
GSTM1 – гены глутатион-S-трансфераза М1
GSTs – гены глутатион-S-трансфераз
MMP-9 – матриксная металлопротеиназа
TIMP-1 – тканевой ингибитор металлопротеиназы MMP-9
MMP-9/TIMP-1 – комплекс MMP-9 с тканевым ингибитором TIMP-1
Работа выполнена при поддержке государственного контракта № 14.740.11.0186 в рамках федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы.
Тилик Татьяна Валерьевна
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МАРКЕРЫ
МЕТАБОЛИЗМА СОЕДИНИТЕЛЬНОЙ ТКАНИ
ПРИ ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ
И ЕЕ СОЧЕТАНИИ С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Подписано в печать 18.01.2012
Формат 6090 1/16. Усл. п.л. 1,0.
Уч. изд. л. 0,75. Тираж 100 экз. Заказ 18
Отпечатано на участке оперативной полиграфии
типографии ООО «Рея»
г. Владивосток, ул. Адм. Юмашева, 42б

