Альдостерон как фактор прогрессирования кардиоваскулярных осложнений при хронической болезни почек
На правах рукописи
Карабаева Айгуль Жумартовна
АЛЬДОСТЕРОН КАК ФАКТОР ПРОГРЕССИРОВАНИЯ КАРДИОВАСКУЛЯРНЫХ ОСЛОЖНЕНИЙ ПРИ
ХРОНИЧЕСКОЙ БОЛЕЗНИ ПОЧЕК
Специальность 14.00.05 – внутренние болезни
Автореферат диссертации на соискание ученой
степени доктора медицинских наук
Санкт-Петербург
2009
Работа выполнена в ГОУ ВПО «Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова»
Научный консультант: доктор медицинских наук, профессор
Ашот Мовсесович Есаян
Официальные оппоненты: доктор медицинских наук, профессор
Адольф Иванович Кирсанов
доктор медицинских наук, профессор
Александр Леонидович Арьев
доктор медицинских наук, профессор
Алексей Владимирович Панов
Ведущая организация: ФГОУ ВПО «Военно-медицинская академия им. С.М. Кирова» МОРФ
Защита состоится "_____"______________2009 г. в _______ час. на заседании
Диссертационного совета Д. 208.090.01 при
Санкт-Петербургском государственном медицинском университете им.акад. И.П.Павлова (197089, Санкт-Петербург, ул. Л.Толстого, д. 6/8)
С диссертацией можно ознакомиться в фундаментальной библиотеке Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова
Автореферат разослан "_____"___________________ 2009 года.
Ученый секретарь
Диссертационного совета,
доктор медицинских наук, профессор Т.В. Антонова
Актуальность проблемы. В настоящее время рост числа больных с хронической болезнью почек (ХБП) рядом авторов расценивается как пандемия [Norris K., Vaughn C. 2003; Томилина Н.А., Бикбов Б.Т., 2005]. В прогрессировании ХБП и развитии кардиоваскулярных осложнений при данном состоянии существенное значение придается ренин-ангиотензин-альдостероновой системе (РААС) [Weber К.Т. et al., 1992]. Эффекты ангиотензина II в этих процессах достаточно хорошо изучены. Однако значению альдостерона, как независимому фактору развития и прогрессирования кардиоваскулярных и почечных повреждений, стали уделять внимание сравнительно недавно, когда были открыты неэпителиальные минералокортикоидные рецепторы (МР). Последние локализованы в кардиомиоцитах, гладкомышечных клетках сосудов сердца, почек и центральной нервной системы [Weber К.Т. 2001; Epstein M. 2001, 2003; Fuller P.J., Young M.J. 2005].
Альдостерон способствует фиброзированию тканей посредством нескольких механизмов: индукцией воспаления и фибриноидного некроза мелких артерий и артериол; воздействием на соответствующие рецепторы, локализованные в цитозоле сосудистых фибробластов; стимуляцией апоптоза кардиомиоцитов [Rocha R. et al. 2000]. Кроме того, воздействие альдостерона на систему фибринолиза через влияние на ингибиторы и активаторы плазминогена, такие как ингибитор активатора плазминогена 1 типа (PAI-1) и тканевой активатор плазминогена (t-PA), также способствует процессам фиброзирования [Duymelinck C. et al. 1997; Ponda M.P. et al. 2006].
Нарушение соотношения PAI-1/t-PA приводит к развитию дисбаланса системы фибринолиза и свертывающей системы. Поэтому уровень ингибиторов и активаторов плазминогена, а также наличие продукта деградации фибрина Д-димера, является маркером угнетения системы гемостаза с повышением тромбогенного потенциала крови [Newby D.E. et al. 2001]. В свою очередь Д-димер, являясь независимым предиктором ишемической болезни сердца, ассоциируется с высоким риском кардиоваскулярных осложнений [Mills J.D. et al. 2002; Sabovic M. et al. 2005]. PAI-1 и t-PA синтезируются в основном эндотелием, поэтому повышенный уровень этих ферментов, так же как и повышенный уровень эндотелина-1, может рассматриваться как показатель дисфункции эндотелия (ДЭ). Обусловленная повышенным синтезом альдостерона ДЭ приводит к нарушению участия эндотелия в регуляции фибринолиза. С одной стороны это является важным звеном в патогенезе атеросклероза и формирования сердечно-сосудистых осложнений, а с другой – играет существенную роль в профиброзном эффекте альдостерона на миокард [Struthers A.D. 2005].
Исходя из вышеуказанного, становится очевидной необходимость блокирования неэпителиальных МР посредством назначения блокаторов альдостероновых рецепторов, среди которых наиболее известным является спиронолактон. В экспериментальных исследованиях было показано, что спиронолактон предотвращает вызываемое альдостероном ремоделирование кардиоваскулярной системы, а ко-инкубация эндотелиальных клеток совместно со спиронолактоном уменьшает эффект альдостерона по экспрессии PAI-1 [Weber K.T., Brilla C.G. 1991; Brown N.J. et al. 2002]. Доказана эффективность применения антагонистов рецепторов альдостерона и в клинических испытаниях. В частности, в исследовании RALES у пациентов с сердечной недостаточностью сообщается, что добавление к стандартной терапии спиронолактона достоверно значительно повышает уровень выживаемости [Pitt B. et al. 1999; Zannad F. et al. 2000].
Дополнительное назначение блокаторов альдостероновых рецепторов больным с ХБП, получающим ингибиторы АПФ или/и блокаторы ангиотензиновых рецепторов, приводит к дальнейшему снижению протеинурии и артериального давления – важнейших маркеров прогрессирования почечной недостаточности [Sato A., et al., 2003]. Однако ограничивает применение данного класса препаратов риск развития гиперкалиемии при сниженной скорости клубочковой фильтрации.
У больных с терминальной почечной недостаточностью, получающих диализную терапию уровень альдостерона остается высоким (McLaughlin N., et al., 2004). В то же время у данного контингента пациентов риск гиперкалиемии минимален вследствие отсутствия почечных эффектов альдостерона. Были проведены исследования и по применению спиронолактона у пациентов на гемодиализе (ГД), согласно которым при олигоанурии допустимо применение малых доз препарата без риска получения гиперкалиемии [Saudan P. et al. 2003; Gross E. et al. 2005]. Однако число таких работ крайне ограниченно, они были выполнены на небольшом числе пациентов и, в основном, преследовали цель изучить безопасность применения препарата. Работ, направленных на исследование долгосрочных терапевтических эффектов блокаторов альдостероновых рецепторов на кардиоваскулярные осложнения у гемодиализных больных с анурией другими авторами пока не опубликовано.
Сведения, приведенные выше, определяют актуальность изучения роли альдостерона в развитии и прогрессировании кардиоваскулярных осложнений при ХБП.
Цель исследования: определение роли неэпителиальных эффектов альдостерона в повреждении сердечнососудистой системы при хронической болезни почек и разработка подходов к коррекции данных нарушений
Задачи исследования:
- Проанализировать взаимоотношения между концентрацией альдостерона плазмы, состоянием миокарда, эндотелиальной функции и системы гемостаза при хронической болезни почек в клинике и эксперименте.
- Изучить влияние нуклеотидного полиморфизма гена альдостеронсинтазы на концентрацию альдостерона плазмы, функцию эндотелия и состояние гемостаза у больных с разной степенью снижения почечной функции.
- Проанализировать воздействия блокады альдостероновых рецепторов на прогрессирование экспериментальной уремии и состояние миокарда у крыс с субтотальной нефрэктомией.
- Оценить влияние терапии блокатором альдостероновых рецепторов спиронолактоном на ремоделирование миокарда и состояние функции эндотелия и гемостаза у гемодиализных больных с анурией.
- Разработать рекомендации по применению блокаторов альдостероновых рецепторов для коррекции структурно-функционального состояния миокарда и дисфункции эндотелия у пациентов на гемодиализе.
Научная новизна. На основе комплексного исследования определена роль альдостерона в ремоделировании миокарда и сосудов, развитии эндотелиальной дисфункции при прогрессирующем снижении функции почек. Впервые показано, что у больных, получающих терапию программным гемодиализом, блокада альдостероновых рецепторов в течение полугода спиронолактоном приводит к уменьшению ремоделирования миокарда и оказывает стабилизирующий эффект на состояние эндотелия и систему гемостаза. При этом у таких больных длительный прием спиронолактона, несмотря на блокаду минералокортикоидных рецепторов, приводит к существенному снижению концентрации альдостерона плазмы.
Выявлено, что у пациентов с хронической болезнью почек тип ремоделирования миокарда ассоциирован с полиморфизмом гена альдостеронсинтазы.
На модели экспериментальной уремии (5/6 нефрэктомии у крыс линии Wistar) выявлено снижение индекса гипертрофии миокарда под влиянием блокады альдостероновых рецепторов спиронолактоном.
Практическая значимость: уточнение роли альдостерона в структуре причин формирования кардиоваскулярных осложнений у пациентов с хронической болезнью почек и использование разработанного подхода к коррекции указанных нарушений существенно улучшает эффективность терапии, оказывает позитивное влияние на процессы ремоделирования в органах и тканях.
Основные положения, выносимые на защиту:
Альдостерон является важным независимым детерминантом ремоделирования сердца и сосудов, формирования дисфункции эндотелия и нарушений гемостаза при хронической болезни почек. При этом по мере нарастания концентраций циркулирующего альдостерона и эндотелина-1 наблюдается ухудшение параметров ремоделирования миокарда в сочетании с угнетением фибринолиза и активацией коагуляционного и тромбоцитарного звеньев гемостаза.
Концентрация альдостерона плазмы, выраженность дисфункции эндотелия и тромбогенного потенциала крови нарастают по мере снижения почечной функции и достигают максимума в V стадии хронической болезни почек у пациентов, получающих заместительную терапию гемодиализом.
Нуклеотидный полиморфизм гена альдостеронсинтазы у пациентов с хронической болезнью почек ассоциирован с типами гипертрофии миокарда.
Блокада альдостероновых рецепторов спиронолактоном, как у больных на гемодиализе, так и при экспериментальной почечной недостаточности приводит к уменьшению выраженности ремоделирования сердца и проявлений эндотелиальной дисфункции, причем данный эффект препарата не зависит от его влияния на системное артериальное давление.
Апробация работы. Результаты исследования доложены на Всероссийской научно-практической конференции «Актуальные проблемы кардиоренальных отношений в клинике внутренних болезней» (Санкт-Петербург, 2007), V конференции Российского диализного общества (Москва, 2007), Всероссийской конференции с международным участием «Тромбозы в клинической практике: факторы риска, диагностика, терапия» (Санкт-Петербург, 2007), VI школе-семинаре регионального филиала Российского диализного общества Северо-Западного федерального округа «Актуальные проблемы хронической болезни почек» (Архангельск, 2007), представлены в виде стендовых докладов на II Международном медицинском конгрессе (Ереван, 2007), XLIV и XLV конгрессах Европейской почечной ассоциации – Европейской ассоциации диализа и трансплантации (Барселона, 2007; Стокгольм, 2008).
Реализация результатов работы. Результаты работы внедрены в практику нефрологических отделений № 1 и 2, отделения хронического гемодиализа клиники СПбГМУ им. акад. И.П.Павлова, а также отделения гемодиализа городской клинической больницы № 15 г. Санкт-Петербурга, в практику учебной работы кафедры нефрологии и диализа факультета последипломного обучения и кафедры пропедевтики внутренних болезней СПбГМУ им. акад. И.П.Павлова. Получено положительное решение о выдаче патента на изобретение «Способ профилактики кардиоваскулярных осложнений у больных с хронической болезнью почек, находящихся на гемодиализе» (Заявка № 2007119515 от 22 мая 2007 г.).
Публикации. По теме диссертации опубликовано 39 печатных работ, из них 7 статей в журналах, рекомендованных ВАК РФ.
Объем и структура диссертации. Диссертация изложена на 274 страницах, состоит из введения, обзора литературы, материалов и методов исследования, результатах ретроспективного анализа, пяти глав собственных исследований, двух глав обсуждения, выводов и списка использованных источников. Работа содержит 41 таблицу и иллюстрирована 23 рисунками. Список использованных источников состоит из 470 работ, включающих 95 публикаций на русском и 375 на иностранных языках.
МАТЕРИАЛ И МЕТОДЫ
Клинические исследования. В соответствии с целью и задачами работы был проведен ретроспективный анализ архивного материала (214 наблюдений, выполненных на кафедрах нефрологии и диализа и пропедевтики внутренних болезней, в НИИ нефрологии СПбГМУ им. акад. И.П.Павлова). Также обследовано 250 пациентов с ХБП III-V ст. Из общего числа обследованных пациентов 142 получали консервативную терапию (ХБП III-IV ст.) и 108 находились на лечении программным гемодиализом (ХБП V ст.). В исследование были отобраны только гемодиализные пациенты с олигоанурией. Выборку больных с додиализными стадиями ХБП составили пациенты нефрологических отделений № 1 и 2 СПбГМУ им. акад. И.П.Павлова. В группу больных на ГД вошли пациенты отделений гемодиализа городской клинической больницы № 15 г. Санкт-Петербурга и Ленинградской областной клинической больницы (г. Санкт-Петербург). Большинство обследованных больных с ХБП III-IV ст. страдали хроническим гломерулонефритом (ХГН) – 39,4%, эссенциальной гипертензией (ЭГ) – 20%; сахарным диабетом (19%), хроническим пиелонефритом (16,9%). Пациенты с другими заболеваниями почек составили незначительную долю среди представителей изученной выборки. Из общего числа обследованных, за исключением больных с ЭГ, у 88,5% (108 человек) течение основного заболевания осложнилось развитием синдрома артериальной гипертензии (АГ), средняя длительность которого составила 11,8±10,7 лет. Среди пациентов с ХБП V ст. основной причиной развития хронической почечной недостаточности (ХПН) и перевода на программный ГД также являлся ХГН (65%). Реже отмечались аутосомно-доминантный поликистоз почек (15,8%), хронический пиелонефрит (13%); и другие заболевания почек. Из общего числа представителей этой группы, за исключением больных с ЭГ, у 81,6% (84 человека) течение основного заболевания осложнилось развитием синдрома АГ, продолжительность которого в среднем составила 13,4±9,3 лет. Средняя длительность гемодиализной терапии у пациентов с ХБП V ст. достигала 7,0±4,3 лет. Больные на ГД были разделены на две группы. Испытуемым в первой выборке назначали блокатор альдостероновых рецепторов спиронолактон в дозе 25 мг/сут в дополнение к стандартной антигипертензивной терапии (ингибиторы АПФ, блокаторы кальциевых каналов, диуретики). Пациенты во второй группе получали только стандартную терапию. У всех больных определялась концентрация альдостерона плазмы (КАП), изучалось функциональное состояние эндотелия и состояние системы гемостаза, проводилось аллельное типирование полиморфизма гена CYP11B2 (T-344C), оценивались эхокардиографические параметры.
Изучение функционального состояния эндотелия осуществлялось с помощью определения биохимических маркеров – PAI-1, t-PA, эндотелина-1. Состояние системы гемостаза оценивалось по уровням PAI-1, t-PA, D-димера, морфофункциональной активации и агрегации тромбоцитов, концентрации фибриногена по Клауcсу, активности антитромбина-III (АТ-III). Группы больных были сопоставимы по количеству проведенных исследований. У пациентов на ГД указанные параметры определялись дважды: в первой группе – до и после 6-месячного курса терапии спиронолактоном, во второй группе – исходно и через 6 месяцев наблюдения. Забор крови для выполнения гормональных и биохимических исследований осуществлялся строго утром натощак, а у больных на ГД – перед процедурой ГД. Все исследования (клинические и экспериментальные) выполнены в Центральной клинико-диагностической лаборатории СПбГМУ им.акад. И.П.Павлова.
КАП определяли с использованием иммуноферментного анализа (ИФА) на анализаторе иммуноферментных реакций АИФР-01 «Униплан» (Москва), набор реактивов EIA-4128 фирмы DRG (Германия). Определение активности PAI-1 производилось на автоматическом коагулометре «Sysmex СА-560» (Япония) методом хромогенных субстратов, набор реактивов Berichrom фирмы Dage Berhring (CША). Определение концентрации t-PA и эндотелина-1 осуществлялось по сэндвич-технологии методом ИФА на анализаторе АИФР-01 «Униплан» с использованием мышиных моноклональных антител к человеческому t-PA (реактивы Asserachrom t-PA, Diagnostica STAGO, Франция) и эндотелину (реактивы Endotelin 1-21 ELISA System, Германия). Д-димер определялся методом агглютинации частиц латекса, покрытых моноклональными антителами (реактивы D-Dimer Test, Roche Diagnostics). Концентрацию фибриногена определяли по Клауcсу. Генетическое типирование гена альдостеронсинтазы проводилось с помощью полимеразной цепной реакции (ПЦР) с использованием реактивов «ДНК-сорб», праймеров НПФ «ЛИТЕХ» (Россия). Эхокардиография (ЭхоКГ) выполнялась на аппарате «Aloka SSD 500» (Япония). Толщина стенок и размеры полостей определялись из парастернальной позиции. Измерения производились в М-режиме. Массу миокарда левого желудочка (ММЛЖ) рассчитывали на основании формулы, предложенной Американским обществом ЭхоКГ [Kucherer H.F., Kuebler W.W. 1990]. Индексацию ММЛЖ проводили к площади поверхности тела.
Экспериментальные исследования проводились на самцах крыс линии Wistar. С целью создания почечной недостаточности животные подверглись субтотальной резекции (5/6) почечной ткани под наркозом с применением тиопентала натрия (50 мг/кг). В контрольной группе животным выполнено «ложное» оперативное вмешательство: почки извлекали в операционную рану и без повреждения помещали обратно. После проведения нефрэктомии животные были разделены на две экспериментальных группы. Крысам в первой выборке назначали с питьевой водой блокатор альдостероновых рецепторов спиронолактон (Gedeon Richter, Венгрия) в дозе 0,2 мг/сут. Во вторую экспериментальную группу вошли крысы, не получавшие спиронолактон. Для предупреждения гиперкалиемии с питьевой водой животные также получали фуросемид (Aventis Pharma Ltd, Индия) 0,03 мг на 100 г массы. Срок наблюдения составил 10 недель после нефрэктомии. Перед забоем у всех крыс измеряли артериальное давление (АДср), частоту сердечных сокращений (ЧСС). Кровь для исследований собирали при декапитации. При оценке биохимических показателей учитывался объем крови и суточный диурез каждой крысы. У животных определяли КАП, в сыворотке крови и моче измеряли концентрацию мочевины, креатинина, калия, натрия, общего белка, взвешивали миокард и определяли индекс гипертрофии миокарда, равный отношению массы ЛЖ к массе крысы [Okoshi K. et al. 2004; Sevilla M. et al. 2004].
Статистическую обработку результатов проводили с использованием методов параметрической и непараметрической статистики. Применяли t-критерий Стьюдента для независимых и зависимых выборок. Наличие связи между признаками подтверждалось путем оценки линейного коэффициента корреляции Пирсона и непараметрического коэффициента корреляции Спирмена. Использовались также методы однофакторного дисперсионного и множественного линейного регрессионного анализов (процедура пошагового исключения). Результаты исследования представлены в виде средней арифметической (М) и ошибки средней (m, SE). Критический уровень отклонения нулевой статистической гипотезы принимали равным 0,05. Расчеты производились с использованием пакета прикладных программ Statistica 6.0.
РЕЗУЛЬТАТЫ
Альдостерон как независимый фактор прогрессирования почечных и кардиоваскулярных поражений при ХБП. В ходе ретроспективного анализа оценивались КАП, активность ренина плазмы (АРП), уровень "общего ренина" (ОР) плазмы и "неактивного ренина" (НР) плазмы. При анализе влияния клинико-лабораторных проявлений ХБП на КАП оказалось, что при скорости клубочковой фильтрации (СКФ) > 60 мл/мин данный показатель достоверно не отличался у здоровых лиц, у пациентов с изолированным мочевым синдромом, нефротическим синдромом или АГ. Однако дальнейшее ухудшение функции почек сопровождалось достоверным нарастанием КАП, с достижением максимума в V ст. ХБП (рис. 1).

0 - здоровые, 1 -ХГН с ИМС, 2 -ХГН с АГ, 3 -ХГН с НС,
4 -ХБП III-IV ст., ХБП V ст.
Рис 1. Уровень КАП в исследованных группах
Регрессионный анализ выявил обратную нелинейную зависимость между Cсr и КАП (r = -0,78; p < 0,01; y = 67,2 – 4,41x). Линейный корреляционный анализ показал высоко достоверную прямую зависимость между КАП и Sсr (r = 0,96; p<0,01) и подтвердил обратную связь между Ссr и КАП (r=-0,71 p<0,01). Не обнаружено взаимосвязей между компонентами РААС и АД, хотя выявлены ожидаемые корреляции АРП с ОР (r = 0,77; p<0,01) и НР с ОР (r = 0,96; p<0,01).
Использование непараметрического коэффициента корреляции Спирмена позволило обнаружить статистически значимую обратную связь между активностью ренина плазмы и концентрацией креатинина в сыворотке крови (rs = -0,58; р = 0,037).
Данные исследования свидетельствуют о нарастании КАП по мере прогрессирования ХБП. Это положение подтверждают и результаты других экспериментальных и клинических работ [Rocha R. et al. 1998; Epstein M. 2001; Blasi E.R. et al. 2003; Ribstein J. et al. 2005; Nishiyama A, Abe Y. 2006]. В комплексе с другими известными данными, такие сведения, сами по себе, могут косвенно свидетельствовать о роли альдостерона в качестве фактора, участвующего в развитии и прогрессировании кардиоваскулярных осложнений у пациентов с ХБП.
Концентрация альдостерона плазмы у больных с ХБП III-V стадий. КАП определена у больных с разными стадиями ХБП. В первую группу вошли 40 пациентов с ХБП III-IV ст. и у 90 % из, которых имела место АГ. Вторую группу составили 82 пациента с ХБП V ст. на ГД с олигоанурией. У 76,8% из них течение заболевания осложнилось развитием АГ. Пациенты с АГ обеих групп получали ингибиторы АПФ, -адреноблокаторы, блокаторы кальциевых каналов. КАП в группе диализных больных была существенно выше, чем у пациентов с III-IV стадией ХБП (рис. 2).
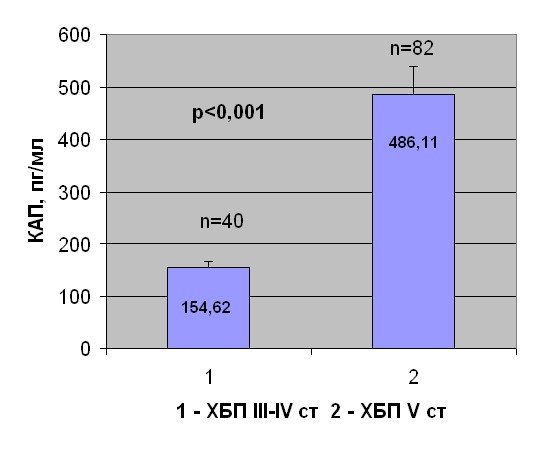
Рис. 2. КАП у больных с ХБП III-IV и ХБП V стадий.
КАП в группе больных с ХБП III-IV ст. находилась в пределах референтных величин (154,62±12,03 пг/мл, при норме 10-160 пг/мл), в то время как в группе больных с ХБП V ст. – достоверно выше (486,11±51,85 пг/мл). Показатели КАП у больных с ХБП III-IV ст. были весьма вариабельны. Так у 62,5% пациентов значения КАП не превышали 160 пг/мл, а у 37,5% – были выше этого уровня. В группе больных с ХБП V ст. в целом КАП значительно превышала норму. При этом только 17,1% пациентов отмечались допустимые значения, в то время как у 82,9% больных КАП оказалась намного выше верхней границы нормальных значений. Более подробный анализ показал, что уровень КАП ассоциирован с продолжительностью гипертензионного синдрома. При отсутствии АГ или ее длительности до 10 лет КАП была в пределах нормальных значений (111,4±7,9 пг/мл), тогда как при продолжительности АГ свыше 10 лет КАП была повышена, как у больных с ХБП III-IV ст. (189,17±18,61), так и у пациентов с ХБП V ст. (463,46±72,9). При этом в группе больных на ГД с АГ свыше 10 лет КАП резко возрастала по сравнению со значениями, выявленными у пациентов с додиализными стадиями ХБП (p<0,05). Таким образом, прогрессирующая ХБП и длительный стаж АГ являются факторами, способствующими нарастанию КАП.
При изучении связи КАП с показателями состояния миокарда, эндотелия и гемостаза у больных с ХБП в общей группе обнаружена достоверная прямая корреляция с ТМЖП (rs = 0,27; p=0,02) и концентрацией эндотелина-1 (rs=0,43; p=0,0001) и обратная – с t-PA (r s =-0,22; p=0,03).
Следовательно, высокие значения КАП у представителей общей группы испытуемых ассоциированы с большей степенью ремоделирования миокарда и выраженной активацией эндотелиоцитов. Корреляционный анализ выявил статистически достоверную связь между КАП и концентрацией эндотелина-1 у больных с ХБП III-IV ст. (rs = 0,50; p = 0,005).
Таким образом, у пациентов с ХБП III-IV ст., как и в общей группе, высокие значения КАП ассоциированы со значительной стимуляцией дисфункции эндотелия. Расчет коэффициента корреляции Спирмена в группе больных с ХБП V ст. установил достоверную отрицательную взаимосвязь между КАП и концентрацией t-PA (rs = 0,30; p = 0,01). Следовательно, у пациентов на ГД высокие значения КАП соответствуют наиболее низким показателям концентрации t-PA, что позволяет предполагать наличие дисбаланса в фибринолитическом звене системы гемостаза, ассоциированного с повышенным тромбогенным потенциалом крови.
Динамика КАП у больных ХБП V ст. под влиянием терапии спиронолактоном. Далее у пациентов с ХБП V ст. оценена динамика КАП относительно приема спиронолактона. Средний возраст принимавших спиронолактон составил 51,39±3,65 лет, не принимавших – 47,57±2,7. Сопоставление групп с помощью статистических критериев (по t-критерию Стьюдента р=0,09, по критерию Манна-Уитни р=0,09) указало на отсутствие возрастных различий. Исходно КАП в первой группе составила 478,03±71,69 пг/мл, во второй – 489,64±76,06 пг/мл. Таким образом, и по этому параметру сравниваемые выборки были сопоставимы. Через 6 мес. наблюдения в группе больных, принимавших спиронолактон, КАП достоверно снизилась до 346,45±58,1 пг/мл (р <0,001 по сравнению с исходным уровнем), а в группе не принимавших – значимо наросла и составила 635,62±91,01 пг/мл (p<0,05 по сравнению с исходным уровнем). Применение коэффициента Спирмена выявило у пациентов, не принимавших спиронолактон, прямую связь между КАП и PAI-1 через 6 мес. от начала наблюдения (rs = 0,55, р = 0,015), в то время как в группе принимавших спиронолактон такой закономерности не выявлено (p>0,05), что указывает на стабилизирующее влияние препарата на фибринолитическое звено гемостаза.
Функция эндотелия и состояние системы гемостаза у больных с ХБП III-IV ст. и ХБП V ст. Изучение функционального состояния эндотелия и гемостаза у больных с разными стадиями ХБП показало, что у больных как с ХБП III-IV ст., так и у пациентов с ХБП V ст. значения PAI-1 резко повышены (5,28±0,15 ед/мл и 5,13±0,1 ед/мл соответственно, p>0,05, при норме до 3,5 ед/мл). Показатели t-PA в обеих группах не превышали референтные значения (4,66±0,31 нг/мл и 4,93±0,2 нг/мл соответственно, p>0,05, при норме 1-12 нг/мл). Значения же эндотелина-1 (при норме 0,26±0,05 фмоль/мл) были умеренно повышены у додиализных пациентов (0,34±0,03 фмоль/мл) и резко повышены – у диализных (0,59±0,03, p<0,001).
Таким образом, обращает на себя внимание высокие значения PAI-1 в группах с СКФ < 60 мл/мин и, несмотря на нормальные значения t-PA, повышение активности PAI-1 свидетельствует об угнетении фибринолиза в указанных группах. При этом прогрессирующее повышение концентрации эндотелина-1 по мере нарастания степени ХБП позволяет говорить о значительном нарастании ДЭ по мере ухудшения функции почек, достигая максимума при развитии терминальной почечной недостаточности.
Применение коэффициента корреляции Спирмена выявило положительную корреляцию между концентрацией эндотелина-1 и КАП (rs=0,49; p=0,007) в группе больных с ХБП III-IV ст., а у пациентов с ХБП V ст. – отрицательную зависимость межу концентрацией t-PA и КАП (rs=-0,25; p=0,04). Таким образом, в обеих группах отмечалось повышение КАП, что, возможно, отчасти обусловливает ДЭ и дисбаланс в системе t-PA/PAI-1, приводящий к угнетению фибринолиза.
Показатели коагуляционного и тромбоцитарного звеньев гемостаза представлены в табл. 1, из которой видно, что число активных форм тромбоцитов увеличено в обеих группах, но у пациентов с ХБП V ст. концентрация фибриногена достоверно выше.
Таблица 1.
Показатели функциональной активности тромбоцитов, фибриногена и антитромбина-III у пациентов с ХБП III-IV ст. и ХБП V ст., М ± m
| Показатель | Норма | ХБП III-IV ст. (n=30) | ХБП V ст. (n=30) | Достоверность различий (р) между группами |
| Дискоциты, % | 81,5-91,6 | 73,55±1,73 | 75,92±1,74 | p>0,05 |
| Дикоэхиноциты, % | 5,4-14,2 | 23,29±1,73 | 20,32±1,62 | p>0,05 |
| Сфероциты, % | 0,5-3,0 | 1,7±0,29 | 2,67±0,64 | p>0,05 |
| Сфероэхиноциты, % | 0-2,65 | 0,67±0,19 | 0,85±0,29 | p>0,05 |
| Сумма активированных тромбоцитов, % | 7,9-17,7 | 26,45±1,73 | 24,07±1,74 | p>0,05 |
| Агрегаты тромбоцитов, % | 6,1-7,4 | 11,09±0,91 | 8,91±0,71 | p>0,05 |
| Малые агрегаты, % | 1,8-3,9 | 5,8±0,48 | 4,94±0,43 | p>0,05 |
| Средние и большие агрегаты, % | 0,07-0,23 | 0,16±0,03 | 0,09±0,04 | p>0,05 |
| Фибриноген, г/л | 1,8-3,5 | 4,0±0,17 | 4,68±0,22 | p<0,05 |
| Антитромбин-III, % | 75-125 | 95,61±3,73 | 84,52±2,88 | p>0,05 |
Таким образом, у пациентов с ХБП уже в III стадии заболевания отмечалось угнетение фибринолиза и активация тромбоцитарного звена гемостаза. Кроме того, имело место нарушение реологических свойств крови, более выраженное у пациентов на ГД.
Динамика функционального состояния эндотелия и показателей гемостаза у больных с ХБП V ст. на фоне терапии спиронолактоном. Далее нами было проанализировано исходное состояние системы гемостаза и функция эндотелия у больных с ХБП V ст. в двух группах – принимавших (группа 1) и не принимавших (группа 2) спиронолактон и динамика указанных показателей на фоне терапии. Данные анализа показали высоко достоверное снижение PAI-1 (5,23±0,12 ед/мл до 3,54±0,15 ед/мл; p<0,001) и эндотелина-1 (с 0,62±0,04 фмоль/мл до 0,25±0,01 фмоль/мл; p<0,001). Несмотря на исходно нормальный уровень t-PA (5,02±0,3 нг/мл) на фоне приема препарата отмечается его достоверное повышение (до 5,88±0,3; p<0,001). Иная ситуация прослеживается в группе больных на ГД, не принимавших спиронолактон, у которых значения PAI-1 (исходно – 5,02±0,16 ед/мл, через 6 мес. – 4,99±0,26 ед/мл; p>0,05) t-PA (исходно – 4,79±0,26 нг/мл, через 6 мес. – 4,74±0,28; p>0,05) остались на прежнем уровне, но отмечено статистически значимое повышение концентрации эндотелина-1 (с 0,56±0,03 фмоль/мл до 0,72±0,03 через 6 мес; p<0,01). Сравнительная оценка указанных показателей через 6 месяцев в группе принимавших спиронолактон в сравнении с не принимавшими показала достоверно более низкие показатели PAI-1 (3,54±0,15 ед/мл и 4,99±0,26 ед/мл соответственно; p<0,001) и эндотелина-1 (0,25±0,01 фмоль/мл и 0,72±0,03 фмоль/мл, соответственно; p<0,001), а также достоверно более высокие значение t-PA (5,88±0,3 нг/мл и 4,74±0,28 p<0,01).
Сравнительная характеристика показателей коагуляционного и тромбоцитарного звеньев системы гемостаза у больных с ХБП V ст. относительно приема спиронолактона показала достоверное снижение только одного показателя – концентрации фибриногена, в то время как активность тромбоцитарного звена системы осталась на том же уровне (см. табл. 1). Таким образом, терапия спиронолактоном у пациентов на ГД с олигоанурией приводит к улучшению состояния фибринолитического звена системы гемостаза, улучшению реологических свойств крови и функционального состояния эндотелия, что, несомненно, имеет положительное значение в снижении риска кардиоваскулярных осложнений.
Характеристика ЭхоКГ параметров у больных с разными стадиями ХБП. Эхокардиографическое исследование исходно проведено 138 пациентам, из них 46 - с ХБП III-IV ст. и 92 - с ХБП V ст. на ГД. Повторное исследование через 6 месяцев проведено 51 больному на ГД. Перед началом исследования группы были сопоставимы по степени поражения сердечно-сосудистой системы, наличию АГ, характеру проводимой терапии, основным параметрам ЭхоКГ. Установлено, что из 46 больных с ХБП III-IV ст. 47,8% (22 человека) страдали ИБС, при этом у 12 пациентов (26,1%) развились такие осложнения как инфаркт миокарда, нарушения ритма по типу фибрилляции предсердий и острое нарушение мозгового кровообращения (ОНМК). Из 92 больных на ГД ИБС была установлена у 13,04% пациентов (12 человек), при этом в анамнезе они имели такие осложнения, как инфаркт миокарда, ОНМК, гемофтальм, фибрилляция предсердий, уремический перикардит. Среди больных с ХБП III-IV ст. АГ констатирована у 89,1% пациентов (41 человек), а в группе больных с ХБП V ст. – у 79,3% (73 человека). По длительности АГ и уровню АД достоверных различий между группами не получено. У пациентов с ХБП V ст. длительность ГД составила 6,98±0,41 лет. При этом 28,3% пациентов (26 человек) находились на диализной терапии менее 3-х лет. Сравнительная оценка эхокардиографических параметров между указанными группами представлена в табл. 2.
Таблица 2
ЭхоКГ параметры у больных с ХБП III-IV ст. и ХБП V ст.
| Показатель, М±m | ХБП III-IV ст. (n=46) | ХБП V ст. (n=92) |
| Да, см | 3,44±0,06 | 3,42±0,04 |
| ЛП, см | 4,61±0,09 | 4,32±0,08* |
| КДР, см | 4,97±0,1 | 4,77±0,1 |
| КСР, см | 3,17±0,1 | 2,76±0,09** |
| КДО, мл | 126,13±2,16 | 117,28±2,8* |
| КСО, мл | 36,14±2,78 | 54,32±1,71*** |
| УО, мл | 89,89±2,77 | 64,15±2,16*** |
| иКДО, мл/м | 0,42±0,03 | 0,54±0,03* |
| Тзслж, см | 1,3±0,04 | 1,24±0,02 |
| Тмжп, см | 1,43±0,05 | 1,25±0,02*** |
| ММЛЖ, г | 347,89±21,12 | 264,56±13,06*** |
| ИММЛЖ, г/м | 179,35±10,21 | 152,26±7,8* |
| ОТС | 0,56±0,02 | 0,56±0,01 |
| ФВ, % | 65,1±1,76 | 66,8±0,92 |
| S, % | 36,44±1,27 | 40,21±0,92*** |
Примечание: * - р<0,05; ** - р<0,01; *** - р<0,001
Согласно данным табл. 2 в обеих группах больных выявлены утолщение стенки ЛЖ с увеличением его массы, увеличение диаметра ЛП и основания аорты. Обращала на себя внимание большая степень ремоделирования у больных с ХБП III-IV ст. по сравнению с больными с ХБП V ст. Возможным объяснением этому могло бы быть положительное влияние коррекции гемодинамики и водно-электролитного баланса у больных, получающих терапию программным гемодиализом.
При изучении влияния КАП на состояние эндотелия, структуру и функцию миокарда в группе больных с ХБП III-IV стадий выявлена прямая зависимость между концентрацией эндотелина-1 и величиной КДО (r=0,78; p<0,05) и обратная – между концентрацией t-PA и уровнем САД (r=-0,77; p<0,05). В группе пациентов с ХБП V ст. отмечена прямая связь Да с КАП (r =0,34; p<0,05), концентрацией эндотелина-1 (r =0,38; p<0,05) и длительностью АГ (r =0,3; p<0,05); прямая зависимость между величинами ЛП и концентрацией эндотелина-1 (r =0,31; p<0,05); ММЛЖ и концентрацией эндотелина-1 (r =0,41; p<0,05); ИММЛЖ и ДАД (r=0,38; p<0,05) или АДср и концентрацией эндотелина-1 (r =0,3; p<0,05); КДР и концентрацией эндотелина-1 (r =0,36; p<0,05), ДАД (r =0,46; p<0,05) и АДср. (r =0,36; p<0,05); КСР и ДАД (r =0,33; p<0,05); ТЗСЛЖ и КАП (r =0,35; p<0,05), ТЗСЛЖ и концентрацией эндотелина-1 (r =0,42; p<0,05); ТМЖП и КАП (r =0,3; p<0,05) и обратная связь между иКДО и концентрацией эндотелина-1 (r = -0,34; p<0,05).
Следующим этапом исследования явилось изучение влияния терапии спиронолактоном на параметры ЭхоКГ у больных на ГД. Сравнение групп больных перед началом исследования не выявило статистически значимых различий по основным показателям ЭхоКГ. Вместе с тем оценка состояния миокарда через 6 месяцев показала иную картину. Динамика данных эхокардиографии у больных, принимавших спиронолактон, приведена в табл. 3.
Таблица 3
Динамика ЭхоКГ данных у принимавших спиронолактон
| Показатель, М±SD | Группа 1 - принимали спиронолактон, (n=21) | |
| исходно | через 6 месяцев | |
| Да, см | 3,6±0,35 | 3,4±0,35** |
| ЛП, см | 4,63±0,57 | 4,31±0,52** |
| КДР, см | 4,7±0,85 | 3,94±0,78*** |
| КСР, см | 2,5±0,7 | 2,48±0,65 |
| КДО, мл | 120,55±13,16 | 120,45±14,0 |
| КСО, мл | 60,0±6,5 | 59,7±6,0 |
| УО, мл | 58,53±1,25 | 60,04±1,94 |
| иКДО, мл/м | 0,58±0,27 | 0,69±0,28** |
| Тзслж, см | 1,3±0,17 | 1,23±0,2* |
| Тмжп, см | 1,27±0,19 | 1,23±0,2 |
| ММЛЖ, г | 251,91±121,18 | 206,18±98,28** |
| ИММЛЖ, г/м | 138,41±69,75 | 113,32±53,86** |
| ОТС | 0,61±0,1 | 0,65±0,16 |
| ФВ, % | 65,29±10,76 | 66,38±11,24* |
| S, % | 41,05±4,98 | 41,57±4,85 |
Примечание: * - р<0,05; ** - р<0,01; *** - р<0,001
Данные табл. 3 свидетельствуют об улучшении ряда показателей: уменьшились диаметр аорты, размер ЛП и ЛЖ в диастолу, толщина ЗСЛЖ, а также масса миокарда и ее индексированное значение. На фоне исходно нормальных значений ФВ отмечается достоверное повышение этого показателя, что в совокупности со статистически значимым увеличением иКДО свидетельствует об улучшении функциональных возможностей ЛЖ.
Аналогично оценивалось изменение состояния миокарда через 6 месяцев и у не принимавших спиронолактон, что отображено в табл. 4.
Таблица 4
Динамика показателей ЭхоКГ у не принимавших спиронолактон
| Показатель, М±SD | Группа 2 - не принимали спиронолактон, (n=30) | |
| исходно | через 6 месяцев | |
| Да, см | 3,6±0,24 | 3,88±0,33* |
| ЛП, см | 4,33±0,28 | 4,75±0,21** |
| КДР, см | 4,99±0,44 | 4,94±0,45 |
| КСР, см | 2,76±0,25 | 3,72±0,44** |
| КДО, мл | 121,4±10,67 | 124,6±10,31** |
| КСО, мл | 63,6±4,34 | 65,8±4,6*** |
| УО, мл | 58,35±1,82 | 57,42±1,49 |
| иКДО, мл/м | 0,58±0,15 | 0,47±0,1 |
| Тзслж, см | 1,24±0,05 | 1,46±0,09*** |
| Тмжп, см | 1,24±0,15 | 1,26±0,34 |
| ММЛЖ, г | 280,95±104,68 | 330,49±75,11* |
| ИММЛЖ, г/м | 156,41±50,48 | 212,86±48,15** |
| ОТС | 0,54±0,05 | 0,62±0,05** |
| ФВ, % | 64,75±4,11 | 63,0±2,58 |
| S, % | 34,75±8,22 | 32,75±6,4 |
Примечание: * - р<0,05; ** - р<0,01; *** - р<0,001
Данные табл. 4 указывают на отрицательную динамику: наросли диаметр аорты, ЛП, КСР и КСО, КДО, толщина ЗСЛЖ и ОТС, масса и индекс массы миокарда ЛЖ. Следовательно, отчетливая разнонаправленная динамика показателей ЭхоКГ в 1-й и 2-й группах пациентов позволяет заключить, что спиронолактон обладает кардиопротективным действием у больных на ГД.
Типы геометрии левого желудочка у больных с ХБП III-V ст. Сравнительный анализ функционального состояния эндотелия и изменений в системе гемостаза при разных типах ремоделирования. При определении эхо-анатомии сердца выявлено, что наиболее распространенным типом являлась концентрическая гипертрофия левого желудочка (кГЛЖ) – 78 пациентов (56,5%), далее по частоте следуют концентрическое ремоделирование (КР) – 32 пациента (23,2%) и эксцентрическая гипертрофия левого желудочка (эГЛЖ) – 16 пациентов (11,6%). Нормальную геометрию (НГ) имели лишь 12 пациентов (8,7%). Далее проводился сравнительный анализ КАП, состояния эндотелиальной функции, системы гемостаза с ХБП III-IV ст. и ХБП V ст. в зависимости от типа ремоделирования ЛЖ. Данные анализа не выявили статистически достоверной разницы в этих показателях: при всех типах ремоделирования имели место повышенная секреция альдостерона, активация эндотелия и системы гемостаза.
Иная картина наблюдалась в отношении ЭхоКГ параметров (табл. 5). При этом наиболее выраженные структурно-функциональные нарушения были отмечены у больных с кГЛЖ, что не противоречит данным других авторов [Грачев А.В. и др. 2000; London G.M. 2003; Исаков А.П., Выжимов И.А. 2006] и позволяет отнести данный тип ремоделирования к прогностически наиболее неблагоприятному.
Таблица 5
Показатели ЭхоКГ у больных с ХБП III-V ст. при различных типах ремоделирования, М±m
| Показатель | НГ (I тип) | КР (II тип) | кГЛЖ (III тип) | эГЛЖ (IV тип) |
| n - 12 | n - 32 | n - 74 | n – 17 | |
| Да, см | 3,13±0,07 | 3,46±0,06* | 3,45±0,05* | 3,25±0,09 |
| ЛП, см | 3,57±0,15 | 4,6±0,11*** | 4,5±0,08*** | 4,25±0,16* |
| КДР, см | 4,5±0,07 | 4,4±0,19 | 4,7±0,08 | 5,2±0,16***###& |
| КСР, см | 2,67±0,11 | 2,57±0,16 | 2,88±0,08 | 2,99±0,16 |
| КДО, мл | 112,86±6,95 | 121,58±4,85 | 121,04±1,88 | 121,31±7,41 |
| КСО, мл | 28,21±2,58 | 40,35±3,46*** | 44,41±1,99*** | 44,71±3,94*** |
| иКДО, мл/м | 0,75±0,04 | 0,74±0,05 | 0,39±0,01***### | 0,46±0,03***& |
| ТЗСЛЖ, см | 0,86±0,04 | 1,16±0,02*** | 1,39±0,03***### | 1,19±0,03***&&& |
| ТМЖП, см | 0,93±0,02 | 1,14±0,02*** | 1,48±0,03***### | 1,24±0,03***&&& |
| ММЛЖ, г | 150,28±6,2 | 193,53±15,67 | 345,96±15,24***### | 296,78±22,7***### |
| ИММЛЖ, г/м | 86,47±2,8 | 105,65±8,5 | 187,91±7,51***### | 169,22±15,05**### |
| ОТС | 0,4±0,01 | 0,59±0,03** | 0,6±0,01*** | 0,48±0,02**&& |
| ФВ, % | 70,97±2,47 | 64,5±2,16 | 66,49±1,14 | 65,58±1,75 |
| S, % | 40,43±2,16 | 38,94±1,46 | 39,17±0,92 | 40,35±1,34 |
| Примечание - различие с группой: * - I, # - II, & - III типа; *, #, & - p<0,05; **, ##, && - p<0,01; ***, ###, &&& - p<0,001 | ||||
Влияние полиморфизма гена альдостеронсинтазы на течение ХБП, состояние эндотелия и миокарда. Обследовано 103 больных с ХБП III-V ст. Анализ распределений частот генотипов по полиморфному маркеру -344Т/С CYP11B2 показал, что 34% пациентов имели Т/Т генотип, 39,8% – Т/С генотип и 26,2% – С/С генотип, у которых были проанализированы КАП и состояние эндотелия. При этом выявлено, что КАП, PAI-1 и эндотелин-1 повышены у всех пациентов (КАП 466,59±84,43 пг/мл при генотипе Т/Т; 466,59±84,43 пг/мл при генотипе Т/С и 458,6±134,84 пг/мл при генотипе С/С; PAI-1 5,19±0,13 ед/мл при генотипе Т/Т; 5,09±0,13 ед/мл при генотипе Т/С и 5,27±0,2 ед/мл при генотипе С/С; эндотелин-1 0,59±0,04 фмоль/мл при генотипе Т/Т; 0,56±0,04 фмоль/мл при генотипе Т/С и 0,55±0,04 фмоль/мл при генотипе С/С). Концентрация t-PA при всех генотипах находилась в пределах референтных величин (4,73±0,26 нг/мл при генотипе Т/Т; 4,94±0,28 нг/мл при генотипе Т/С и 4,98±0,47 нг/мл при генотипе С/С). Таким образом, вне зависимости от генотипа отмечено резкое повышение КАП. У всех групп в одинаковой степени были повышены активность PAI-1 и концентрация эндотелина-1 при значениях t-PA в пределах референтных величин.
Далее изучено влияние нуклеотидного полиморфизма на уровень АД (табл. 6).
Таблица 6
Уровень САД, ДАД и АД ср. в зависимости от полиморфизма гена альдостеронсинтазы
| Показатель, М±m | Генотип Т/Т (n=35) | Генотип Т/С (n=41) | Генотип С/С (n=27) |
| САД, мм рт.ст | 133±2* | 134±2# | 142±2 |
| ДАД, мм рт.ст | 81±1& | 86±1## | 91±1** |
| АД ср. мм рт.ст | 102,97±1,22** | 106,47±1,32### | 112,99±1,53 |
Примечание:*- р<0,01, **- р<0,001 между 1 и 3 группами; & - р<0,01 между 1 и 2 группами; # - р<0,05, ## - р<0,001, ### - р<0,01 между 2 и 3 группами
Из данных табл. 6 следует, что больные с С/С генотипом имели более высокий уровень САД и АДср. в сравнении с генотипами Т/С и Т/Т, в то время как при Т/С и Т/Т генотипах разница в уровне САД практически отсутствовала. Уровень ДАД был достоверно различен во всех группах: самые высокие цифры – у пациентов с С/С генотипом, далее следовали пациенты с Т/С генотипом, а наиболее низкие значения – у пациентов с Т/Т генотипом. Таким образом, гомозиготы по аллелю С имели самые высокие цифры АД.
Также в зависимости от нуклеотидного полиморфизма оценивалось функциональное состояние ЛЖ (табл. 7).
Таблица 7
Показатели ЭхоКГ в зависимости от полиморфизма гена альдостеронсинтазы
| Показатель, М±m | Генотип Т/Т (n=28) | Генотип Т/С(n=26) | Генотип С/С (n=19) |
| Да, см | 3,46±0,07 | 3,29±0,07 | 3,42±0,1 |
| ЛП, см | 4,34±0,14 | 4,42±0,18 | 4,46±0,2 |
| КДР, см | 4,18±0,14 | 4,59±0,16* | 4,64±0,2* |
| КСР, см | 2,44±0,14 | 2,71±0,12 | 2,82±0,14 |
| КДО, мл | 116,94±5,69 | 115,69±5,24 | 109,05±5,92 |
| иКДО | 0,59±0,05 | 0,56±0,06 | 0,44±0,06 |
| КСО, мл | 55,55±2,97 | 50,93±4,71 | 50,96±3,89 |
| ММЛЖ, г | 219,93±14,28 | 251,79±23,15 | 311,45±34,35# |
| ИММЛЖ, г/м2 | 123,09±8,83 | 143,4±13,74 | 183,81±22,21# |
| ТЗСЛЖ, см | 1,24±0,03 | 1,27±0,05 | 1,31±0,06 |
| ТМЖП, см | 1,22±0,03 | 1,21±0,05 | 1,39±0,09## |
| ОТС | 0,6±0,02 | 0,61±0,02 | 0,6±0,04 |
| ФВ, % | 60,03±2,09 | 70,44±1,52 | 66,78±1,56 |
| S, % | 40,18±1,3 | 41,24±1,81 | 40,25±1,01 |
Примечание: * - р<0,05 между 1 и 2 группами, ** - р<0,05 между 1 и 3 группами, # - <0,001, ## - p<0,05 между 1 и 3 группами
Данные табл. 7 показывают, что пациенты с Т/Т генотипом имели достоверно меньшие ММЛЖ и ИММЛЖ в сравнении с пациентами с С/С генотипом и меньший КДР в сравнении с пациентами с Т/С генотипом. Сопоставление ЭхоКГ параметров выявило при С/С генотипе большую ММЛЖ, а при С/С и Т/С генотипах – больший размер ЛЖ в диастолу; это свидетельствует о том, что наличие аллеля С ассоциировано с повышенной ригидностью и более выраженным нарушением геометрии ЛЖ. Оценка типа ремоделирования ЛЖ показала, что носители С/С генотипа в 57,9% имели кГЛЖ, в 31,6% – КР, в 10,5% – эГЛЖ, НГ в данной группе отсутствовала. У носителей Т/С генотипа кГЛЖ выявлена у 57,7 % пациентов, КР– у 15,4%, эГЛЖ – у 15,4% и НГ – у 11,5%. При Т/Т генотипе кГЛЖ выявлена в 35,7%, КР – в 53,6%, эГЖ – в 7,1% и НГ – в 3,6%.
Изучение связи КАП с клинико-лабораторными показателями в группе больных с генотипом Т/Т не выявило достоверных взаимосвязей, а в группе больных с генотипом Т/С установлена прямая связь КАП с концентрацией эндотелина-1 (rs=0,63, р= 0,0001), ТМЖП (r s=0,43, р= 0,04) и диаметром ЛП (rs=0,48, р = 0,03). В группе с С/С генотипом выявлена прямая корреляция КАП с концентрацией эндотелина-1 (rs=0,46, р= 0,049) и обратная – с уровнем t-PA (rs= -0,47, р= 0,04). Результаты исходных данных показывают, что наличие аллеля С предопределяет дисбаланс в фибринолитическом звене системы гемостаза с развитием протромботической активности, ДЭ, фиброза миокарда ЛЖ с нарушением его сферичности; характеризуется наибольшим процентом неблагоприятных типов ремоделирования ЛЖ, что в совокупности с более высоким уровнем АД позволяет отнести данный аллель к более неблагоприятному в прогностическом отношении.
Динамика лабораторных и инструментальных показателей в группах разных генотипов на фоне терапии спиронолактоном. Изучение динамики биохимических показателей в зависимости от нуклеотидного полиморфизма на фоне терапии спиронолактоном показало улучшение всех параметров у больных с Т/Т и С/С генотипами; у пациентов с Т/С генотипом получено снижение активности PAI-1 и концентрации эндотелина-1 (табл. 8). Динамики КАП не получено ни в одной группе (см. табл. 8)
Таблица 8.
Динамика биохимических показателей в зависимости от генотипа
на фоне терапии спиронолактоном, М±m, (n=62)
| Гено-тип | КАП | PAI-1 | t-PA | Эндотелин-1 | ||||
| исходно | через 6 мес. | Исход-но | через 6 мес. | Исход-но | через 6 мес. | Исход-но | через 6 мес. | |
| Т/Т (n=24) | 466,59± 84,43 | 484,42±104,62 | 5,19± 0,13 | 3,89± 0,21*** | 4,73± 0,26 | 5,53± 0,29* | 0,62± 0,13 | 0,38± 0,05*** |
| Т/С (n=23) | 476,07± 86,46 | 485,61±118,81 | 5,09±0,13 | 3,84± 0,27** | 4,97±0,28 | 5,12±0,37 | 0,61± 0,04 | 0,49± 0,05** |
| С/С (n=15) | 455,1± 131,69 | 480,67±155,27 | 5,27± 0,2 | 3,6± 0,33*** | 4,98±0,47 | 5,75±0,6* | 0,6± 0,04 | 0,43± 0,08*** |
Примечание: * - p<0,05; ** - p<0,01; *** - p<0,001
Корреляционный анализ у гомозигот по Т аллелью выявил прямую связь КАП с концентрацией эндотелина-1 (rs=0,5, р= 0,01), САД max (rs=0,48, р= 0,04) и ДАД max (rs=0,66, р= 0,002).
В группе гетерозигот по Т аллелью отмечена положительная взаимосвязь между КАП и PAI-1 (rs= 0,5; р = 0,03), эндотелином-1 (rs=0,49; р=0,02), ММЛЖ (rs=0,51; р = 0,04), ИММЛЖ (rs=0,51; р = 0,04), ОТС (rs = 0,54; р = 0,03), ЛП (rs=0,79; р=0,0001), ТЗСЛЖ (rs = 0,56; р = 0,03), ТМЖП (rs = 0,62; р = 0,01).
Применение коэффициента корреляции Спирмена у гомозигот по С аллелью выявило достоверную взаимосвязь между КАП и активностью PAI-1 (rs = 0,54; р= 0,004). Таким образом, генотипу С/С соответствуют самые высокие уровни АД, выраженное нарушение сферичности ЛЖ, наибольший процент формирования концентрической ГЛЖ, что относит этих пациентов к группе высокого риска развития кардиоваскулярных осложнений.
Результаты экспериментального исследования. В работе изучалось также влияние альдостерона и его блокаторов на сердечно-сосудистую систему крыс линии Wistar с 5/6 нефрэктомией. Установлено, что у группы спиронолактона отмечена достоверно более высокая КАП по сравнению с контрольной группой (281,67±39,02 и 145,42±17,41 пг/мл, соответственно; р<0,01) и с группой без спиронолактона (207,55±32,86; р>0,05). Также у опытных групп имела место статистически более высокая концентрация калия и азотистых метаболитов сыворотки в сравнении с контрольной группой: калий в контрольной группе 4,34±0,1 ммоль/л, в группе спиронолактона - 7,92±0,26 (р<0,001), в группе без спиронолактона - 7,74±0,24 (р<0,001), мочевина в контрольной группе 6,08±0,19 ммоль/л, в группе спиронолактона - 18,6±0,47 (р<0,001), в группе без спиронолактона - 18,7 ±0,91 (р<0,001); креатинин в контрольной группе 0,04±0,002 ммоль/л, в группе спиронолактона - 0,07±0,001 (р<0,001), в группе без спиронолактона - 0,07±0,002 (р<0,001).
Из результатов исследования следует, что в опытных группах КАП превышает уровень контрольной группы, но разница достоверна лишь у животных группы спиронолактона. В опытных группах в сравнении с контрольной отмечены достоверно большие показатели калия, мочевины и креатинина.
Далее была измерена суточная экскреция электролитов, азотистых метаболитов и белка. При этом установлен достоверно более высокий суточный диурез, экскреция калия и суточная протеинурия у оперированных животных по сравнению с группой контроля: суточный диурез в контрольной группе – 3,79±0,36 мл, в группе спиронолактона – 13,56±1,78 мл (р<0,001), в группе без спиронолактона 12,16±1,26 мл (р<0,001), экскреция калия в контрольной группе 0,92±0,08 ммоль/24 ч, в группе спиронолактона - 2,02±0,15 (р<0,001), в группе без спиронолактона - 2,01±0,21 (р<0,001); протеинурия в контрольной группе – 0,01±0,001 ммоль/24ч, в группе спиронолактона – 0,04±0,01 (р<0,001), в группе без спиронолактона - 0,07±0,02 (р<0,001).
Из полученных результатов следует, что в опытных группах отмечена достоверно большая экскреция калия и белка с мочой в сравнении с контрольной группой, обусловленная развитием почечной недостаточности на фоне 5/6 нефрэктомии.
Достоверной разницы между суточной экскрецией белка и диуреза у животных, получавших спиронолактон, и у крыс с уремией без спиронолактона не получено, но прослеживается четкий тренд к уменьшению протеинурии (хотя и статистически недостоверный из-за относительной малочисленности наблюдений) в группе спиронолактона, что может свидетельствовать о нефропротективном эффекте препарата. Это не противоречит данным других исследований, выявивших значительное снижение протеинурии у другой линии крыс – спонтанно гипертензивных крыс линии SHR-SP при приеме спиронолактона [Rocha R.et al. 1998, 1999]. Далее мы оценили влияние терапии спиронолактоном на изменение массы миокарда животных по индексу гипертрофии [Okoshi K. et al. 2004; Sevilla M. et al. 2004]. В группе спиронолактона данный показатель оказался сопоставимым с таковым у животных контрольной группы, в отличие от группы крыс с ХПН без спиронолактона. У последних отмечалось достоверное увеличение массы миокарда через 10 недель после нефрэктомии. Полученные данные также подтверждает предположение о кардиопротективных свойствах препарата (рис. 3).

1 – спиронолактон, 2 – без спиронолактона, 3 – контроль
Рис. 3. Индекс гипертрофии миокарда экспериментальных животных.
Далее оценивалось влияние спиронолактона на АДср. и ЧСС. Выявлено, что в группе спиронолактона АДср составило 151,3±2,7 мм рт. ст., ЧСС 393,8±17,6 уд/мин; в группе без спиронолактона - АДср 151,4±2,3 мм рт. ст. (р<0,001 относительно группы контроля), ЧСС 369±14,1 уд/мин; в контрольной группе - АДср 121,15±1,8 мм рт. ст. (р<0,001 относительно группы контроля), ЧСС 347,8±10,3 уд/мин. Таким образом, ЧСС была сопоставима во всех группах, однако показатели АД в опытных группах были достоверно выше. Сравнение индекса гипертрофии миокарда с показателями гемодинамики в опытных группах показало меньшую массу миокарда у животных, принимавших спиронолактон, при сопоставимых значениях АДср и ЧСС во всех группах. Это является косвенным свидетельством того, что спиронолактон оказывает кардиопротективный эффект в первую очередь за счет блокады неэпителиальных минералокортикоидных рецепторов.
Таким образом, проведенное нами исследование выявило повышение КАП, активацию эндотелия и дисбаланс в системе гемостаза, характеризующийся угнетением фибринолиза. ДЭ, нарастающая по мере прогрессирования ХБП, и изменения в системе гемостаза приводят к повышению тромбогенного потенциала крови. Сочетанное воздействие указанных нарушений в определенной степени обусловливает ремоделирование кардиоваскулярной системы.
Изложенное достаточно убедительно демонстрирует существенную роль альдостерона в прогрессировании кардиоваскулярных осложнений при хронической болезни почек.
ВЫВОДЫ
1. У больных с хронической болезнью почек в целом отмечается нарастание концентрации альдостерона плазмы, носящее нелинейный характер, в зависимости от выраженности почечной дисфункции и ассоциированное с длительностью артериальной гипертензии. Максимальные значения концентрации альдостерона плазмы выявляются у пациентов, получающих лечение гемодиализом.
- При хронической болезни почек выявляется повышение концентрации эндотелина-1 в плазме крови, прямо связанное со степенью снижения функции почек, что указывает на нарастание выраженности эндотелиальной дисфункции по мере прогрессирования почечной патологии.
- У больных с хронической болезнью почек в III и более высоких стадиях отмечается выраженное повышение активности ингибитора активатора плазминогена 1 типа, отсутствие Д-димера и активация тромбоцитов. В то же время сохранность системы антитромбина-III препятствует развитию локальной и/или диссеминированной гиперкоагуляции.
4. У больных с хронической болезнью почек III-IV ст. по сравнению с пациентами с V ст. отмечается более выраженная структурная перестройка миокарда, характеризующаяся достоверно большим размером левого предсердия, размером и объемом левого желудочка, увеличением толщины межжелудочковой перегородки, массы миокарда левого желудочка и более низкими значениями индекса конечного диастолического объема. Это, в целом, может свидетельствовать о позитивном влиянии гемодиализа на ремоделирование сердца.
- Пациенты с хронической болезнью почек - гомозиготы по аллелю С гена альдостеронсинтазы характеризуются наиболее высокими цифрами артериального давления и наибольшей частотой развития концентрической гипертрофии левого желудочка.
- У крыс линии Wistar 5/6 нефрэктомия приводит к развитию отчетливой гипертрофии миокарда. Назначение спиронолактона в дозе 0,2 мг/сут таким экспериментальным животным в течение 10 недель достоверно уменьшает величину индекса гипертрофии миокарда левого желудочка, существенно не влияя на уровень артериального давления.
7. Прием спиронолактона в дозе 25 мг/сут в течение 6 месяцев приводит к уменьшению выраженности гипертрофии задней стенки левого желудочка и массы миокарда у больных на гемодиализе.
8. Назначение спиронолактона больным с V стадией хронической болезни почек способствует снижению концентрации эндотелина-1 и активности ингибитора активатора плазминогена 1 типа, что может указывать на позитивный эффект данного препарата в отношении дисфункции эндотелия и угнетения фибринолиза.
9. У гемодиализных больных, получающих постоянную терапию спиронолактоном, отмечается снижение концентрации альдостерона плазмы, по-видимому, обусловленное нарастанием уровня свободного циркулирующего альдостерона, легко диффундирующего через диализирующую мембрану.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Для определения функционального состояния эндотелия и системы гемостаза у больных с хронической болезнью почек рекомендуется исследование концентрации альдостерона плазмы, активности ингибитора активатора плазминогена I типа, концентрации тканевого активатора плазминогена, фибриногена, уровня Д-димера, морфофункциональной активации тромбоцитов, антитромбина III.
- Повышение активности ингибитора активатора плазминогена 1 типа и концентрации эндотелина-1 у пациентов с хронической болезнью почек рекомендуется оценивать как дисфункцию эндотелия.
- Повышение активности ингибитора активатора плазминогена 1 типа, отсутствие Д-димера и низкие значения антитромбина III у пациентов с кардиоренальной патологией рекомендуется расценивать как проявление угнетения фибринолитической активности плазмы.
- Пациентам с анурией, получающим программный гемодиализ возможно назначение спиронолактона в дозе 25 мг в сутки с целью кардиопротекции и уменьшения проявлений эндотелиальной дисфункции без риска развития гиперкалиемии.
- Снижение степени гипертрофии левого желудочка, уменьшение полостей сердца, диаметра аорты, улучшение функционального статуса левого желудочка, а также уменьшение проявлений эндотелиальной дисфункции у гемодиализных больных на фоне терапии спиронолактоном в дозе 25 мг в сутки позволяет рекомендовать прием блокаторов альдостероновых рецепторов как препараты кардиопротективного действия.
Список работ по теме диссертации
- Карабаева А.Ж. Альдостерон, сердечно-сосудистая система и почки.- Нефрология.- 2006.- №1 (10).- С.25-34
- Есаян А.М., Каюков И.Г., Карабаева А.Ж. Минералкортикоидные рецепторы: структура, механизмы активации.- Нефрология.- 2006.- №2 (10).- С. 28-31
- Карабаева А.Ж., Смирнов А.В., Каюков И.Г., Есаян А.М. Ренин-ангиотензин-альдостероновая система при хронической болезни почек.- Нефрология.- 2006.- №3 (10).- С. 43-48
- Карабаева А.Ж., Есаян А.М., Каюков И.Г. Влияние полиморфизма гена альдостеронсинтазы на концентрацию альдостерона плазмы, функцию эндотелия, величину артериального давления и состояние миокарда левого желудочка у больных с хронической болезнью почек. Вестник Санкт-Петербургского университета.- 2008.- № 1, серия 11.- С. 24-31.
- Карабаева А.Ж., Есаян А.М., Каюков И.Г., Эммануэль В.Л., Кадинская М.И. Влияние спиронолактона на показатели системы гемостаза и эндотелиальной функции у больных на программном гемодиализе. Вестник Санкт-Петербургского университета.- 2007.- № 4.- серия 11.- С. 47-53
- Карабаева А.Ж., Есаян А.М., Каюков И.Г. Характеристика ремоделирования левого желудочка у больных с хронической болезнью почек по данным эхокардиографии и влияние на него терапии спиронолактоном. Клиническая медицина.- 2007.- № 12.- С. 44-48.
- Карабаева А.Ж., Есаян А.М., Каюков И.Г., Парастаева М.М., Береснева О.Н., Котенко Л.В., Севастьянова И.Е. Влияние спиронолактона на гипертрофию миокарда левого желудочка у крыс генетической линии Wistar с экспериментальной уремией. Бюллетень экспериментальной биологии и медицины.- 2008.- № 6.- С. 659-663
- Есаян А.М., Каюков И.Г., Карабаева А.Ж. Альдостерон и его рецепторы. Медицина и экология.- 2006.- №3 (40).- С. 10-16
- Карабаева А.Ж. К оценке эффективности фармакологической блокады эффектов альдостерона. Проблемы социальной медицины и управления здравоохранением. - 2006.- №3 (40).- С. 91-95
- Карабаева А.Ж. Дисфункция эндотелия в патогенезе сердечно-сосудистых заболеваний. Терапевтический вестник.- 2006.- №3 (11).- С. 22-27
- Карабаева А.Ж., Есаян А.М., Каюков И.Г., Кадинская М.И. Состояние системы гемостаза у больных с ХБП, получающих консервативную терапию и лечение программным гемодиализом. Материалы VI научно-практической конференции «Методы исследования регионарного кровообращения и микроциркуляции в клинике и в эксперименте». Санкт-Петербург, 5-7 января 2007 г.- Регионарное кровообращение и микроциркуляция.- 2007.- №1 (6).- С. 60-61
- Есаян А.М., Каюков И.Г., Карабаева А.Ж. Альдостерон как фактор прогрессирования хронической болезни почек и ее кардиоваскулярных осложнений.- Материалы научно-практической конференции «Современная кардиология: наука и практика». Приложение к журналу Вестник Санкт-Петербургской Государственной медицинской академии им. И.И Мечникова.- 2007.- №2.- С. 60
- Карабаева А.Ж., Есаян А.М., Каюков И.Г. Уровень альдостерона и PAI-1 у пациентов с хронической болезнью почек и артериальной гипертензией. Материалы III Всероссийской научно-практической конференции «Теоретические и практические аспекты артериальной гипертензии». Казань 1-2 марта 2007 г. с.15.
- Карабаева А.Ж., Есаян А.М., Каюков И.Г. Состояние фибринолитической системы, системы гемостаза и функции эндотелия у больных с хронической болезнью почек. Клинико-лабораторный консилиум.- 2007.- № 16.- С. 20-25
- Essaian A., Kaukov I., Karabayeva A. Spironolactone effects on plasma level of activator inhibitor plasminogene type 1 (PAI-1) in anuric hemodyalisis patients. Second International Medical Cоngress in Armenia.- June 27-30, 2007.- Р.55
- Карабаева А.Ж., Есаян А.М., Каюков И.Г., М.М.Тимофеев, О.В.Волкова, А.Д.Христенко. Влияние терапии спиронолактоном на уровень альдостерона и дисфункцию эндотелия у больных на программном гемодиализе. Нефрология.- 2007.- №2 (11).- С.55-58
- Essaian A., Kaukov I., Karabayeva A., Kadinskaya M., Katysheva N. The influence of spironolactone on plasma level of plasminogen-activator inhibitor type 1 (PAI-1) in anuric hemodyalisis patients.- XLIV Congress ERA-EDTA (Barcelona), Nephrol. Dial.Transpl.- 2007.- Vol. 22, Suppl.6.- P.vi322
- Карабаева А.Ж., Есаян А.М., Каюков И.Г. Дисфункция эндотелия в патогенезе кардиоренальной патологии. Клинико-лабораторный консилиум.- 2007.- № 17.- С.15-21
- А.Ж. Карабаева, А.М. Есаян, И.Г. Каюков. Ассоциация полиморфизма гена альдостеронсинтазы с концентрацией альдостерона плазмы, артериальной гипертензией и ремоделированием миокарда у больных на программном гемодиализе. Нефрология.- 2007.- № 3 (11).- С.48-52
- Карабаева А.Ж., Есаян А.М., Каюков И.Г., Кадинская М.И. Состояние эндотелиальной функции и системы гемостаза у больных с хронической болезнью почек, получающих консервативную терапию и лечение программным гемодиализом. Материалы V конференции Российского диализного общества. Москва, 19 – 21 сентября 2007 г. – Нефрология и диализ.- 2007.- Т.9, N 3.-C. 258.
- Карабаева А.Ж., Есаян А.М., Каюков И.Г., Галкина О.В., Кадинская М.И. Динамика уровня альдостерона, показателей системы гемостаза и эндотелиальной функции у больных на программном гемодиализе под влиянием терапии спиронолактоном». Материалы Российского Национального конгресса кардиологов, конгресса кардиологов стран СНГ «Кардиология без границ. Москва, 9-11 октября 2007 г. Кардиоваскулярная терапия и профилактика.- 2007.- № 6 (5).- С. 129.
- Карабаева А.Ж., Есаян А.М., Каюков И.Г. Влияние полиморфизма гена альдостеронсинтазы на артериальное давление и состояние миокарда левого желудочка у больных с хронической болезнью почек. Материалы Российской научно-практической конференции «Актуальные проблемы современной нефрологии», 17-18 октября 2007. Москва.- С.34
- Карабаева А.Ж., Есаян А.М., Каюков И.Г., Кадинская М.И. Оценка влияния терапии спиронолактоном на концентрацию альдостерона, показатели системы гемостаза и эндотелиальную дисфункцию у больных на программном гемодиализе. Материалы III Съезда фармакологов России «Фармакология – практическому здравоохранению», 23-27 сентября 2007 г, Санкт-Петербург.- С.1-1716-1-1717
- Карабаева А.Ж., Есаян А.М., Каюков И.Г., Кадинская М.И. Оценка функционального состояния эндотелия у больных с хронической болезнью почек. Материалы VI Международной конференции «Гемореология и микроциркуляция» 10-13 июня 2007 г, Ярославль.- С. 63
- Карабаева А.Ж., Есаян А.М., Каюков И.Г., Кадинская М.И. Оценка влияния терапии спиронолактоном на концентрацию альдостерона, показатели системы гемостаза и эндотелиальную дисфункцию у больных на программном гемодиализе. Материалы Всероссийской конференции с международным участием «Тромбозы в клинической практике: факторы риска, диагностика, терапия», 5-7 июня 2007 г, г. Санкт-Петербург. Клинико-лабораторный консилиум.- 2007.- № 17.- С.54
- Заявка на изобретение № 2007119515 РФ, МПК 7 А 61 К 31/585, А 61 З 9/10 Карабаева А.Ж., Есаян А.М., Каюков И.Г. «Способ профилактики и лечения кардиоваскулярных осложнений у больных с хронической болезнью почек, находящихся на гемодиализе». Заявлено 27.05.2007, опубликовано в бюллетене № 33 от 27.11.2008.
- Karabayeva A.Zh., Esayan A.M., Kayukov I.G.. The interrelation of the polymorphism of the aldosterone-synthase gene with the hypertension severity and remodeling myocardium at patients receiving program of hemodialysis. Hypertension and the kidney. ISN Nexus Linking research to practice. November 29 – December 2, 2007, Vienna, Austria. P. 21.
- Есаян А.М, Карабаева А.Ж., Каюков И.Г. Показатели эхокардиографии у больных с хронической болезнью почек и их динамика под влиянием терапии спиронолактоном. Нефрология.- 2008.-. № 1(12).- С. 40-45.
- Карабаева А.Ж., Парастаева М.М., Береснева О.Н., Смирнов А.В., Есаян А.М., Каюков И.Г. Влияние спиронолактона на течение экспериментальной хронической почечной недостаточности и гипертрофию миокарда у крыс Wistar. Нефрология.- 2008.- № 1(12).- С. 64-68.
- Карабаева А.Ж., Есаян А.М., Каюков И.Г., Кадинская М.И. Влияние спиронолактона на концентрацию альдостерона плазмы и показатели коагуляционного и фибринолитического звеньев системы гемостаза у больных с хронической болезнью почек на лечении программным гемодиализом. Медицина и экология.- 2008.- № 1.- С. 71-75.
- Карабаева А.Ж., Есаян А.М., Каюков И.Г., Эмануэль В.Л., Кадинская М.И. Динамика показателей системы гемостаза у больных с хронической болезнью почек на программном гемодиализе под влиянием терапии спиронолактоном. Ученые записки СПбГМУ.- 2008.- № 1.- С. 34-37.
- Карабаева А.Ж. Минералкортикоидные рецепторы и альдостерон. Вестник Витебского Государственного медицинского университета. 2008.- № 2 (7).- С 11-17.
- Карабаева А.Ж., Есаян А.М., Каюков И.Г. Дисфункция эндотелия у больных с хронической болезнью почек. Сборник трудов V Международной научно-практической конференции «Дисфункция эндотелия: экспериментальные и клинические исследования». Витебск, 22-23 мая 2008 г, с. 17-19.
- Карабаева А.Ж. Экспериментальная оценка кардиопротективных свойств спиронолактона у субтотально нефрэктомированнных крыс Wistar. Вестник Южно-Казахстанской медицинской академии.- 2008.- № 2 (3).- С. 171-174.
- Карабаева А.Ж. Дисфункция эндотелия у больных на гемодиализе и ее коррекция под влиянием терапии спиронолактоном. Денсаулы сатауды дамыту журналы.- 2008.- № 2 (47).- С. 69-71.
- Карабаева А.Ж. Динамика показателей эхокардиографии под влиянием терапии спиронолактоном у больных с додиализными стадиями хронической болезни почек и на программном гемодиализе. Денсаулы сатауды дамыту журналы.- 2008.- № 2 (47).- С. 71-74.
- Карабаева А.Ж. Состояние системы гемостаза у больных на программном гемодиализе и его коррекция под влиянием терапии спиронолактоном. Здоровье и болезнь.- 2008.- № 2 (68).- С. 123-126.
- Карабаева А.Ж. Нарушение функции эндотелия у больных с разными стадиями хронической болезни почек. Клинико-лабораторный консилиум.- 2008.- № 21.- С. 49-52.
- Карабаева А.Ж. Влияние терапии блокатором альдостероновых рецепторов спиронолактоном на уровень альдостерона и ингибитора активатора плазминогена 1 типа у больных на программном гемодиализе. Медицина и экология. – 2008. – 49, № 4. – С. 63-67.
СПИСОК СОКРАЩЕНИЙ
АД – артериальное давление
АДср – среднее артериальное давление
АТ-III – антитромбин-III
АГ – артериальная гипертензия
АРП – активность ренина плазмы
ГД – гемодиализ
ГЛЖ – гипертрофия левого желудочка
Да – диаметр аорты
ДАД – диастолическое артериальное давление
ДЭ – дисфункция эндотелия
ЗСЛЖ – задняя стенка левого желудочка
иАПФ – ингибиторы ангиотензинпревращающего фермента
ИМС – изолированный мочевой синдром
ИФА – иммуноферментный анализ
КАП – концентрация альдостерона плазмы
КР – концентрическое ремоделирование
ЛЖ – левый желудочек
ММЛЖ – масса миокарда левого желудочка
МР – минералкортикоидные рецепторы
НГ – нормальная геометрия
НР – неактивный ренин
НС – нефротический синдром
ОНМК – острое нарушение мозгового кровообращения
ОР – общий ренин
ОТС – относительная толщина стенки левого желудочка
ПН – пиелонефрит
ПЦР – полимеразная цепная реакция
РААС – ренин-ангиотензин-альдостероновая система
САД – систолическое артериальное давление
СКФ – скорость клубочковой фильтрации
ТМЖП – толщина межпредсердной перегородки
ХБП – хроническая болезнь почек
ХПН – хроническая почечная недостаточность
ХГН – хронический гломерулонефрит
ЧСС – число сердечных сокращений
ЭГ – эссенциальная гипертензия
ЭхоКГ - эхокардиография
Сcr – клиренс креатинина
Scr – креатинин сыворотки
CYP11B2 – ген альдостеронсинтаза
PAI-1 – ингибитор активатора плазминогена 1 типа
t-РА – тканевой активатор плазминогена
S, % – сократительная способность миокарда

