Определение базовых прогностических маркеров рака молочной железы с использованием технологии тканевых матриц
На правах рукописи
ХРАМЦОВ
Андрей Ильич
ОПРЕДЕЛЕНИЕ БАЗОВЫХ ПРОГНОСТИЧЕСКИХ МАРКЕРОВ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ С ИСПОЛЬЗОВАНИЕМ ТЕХНОЛОГИИ ТКАНЕВЫХ МАТРИЦ
14.03.02 – патологическая анатомия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт-Петербург
2011
Работа выполнена в ГОУ ДПО «Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию»
Научный руководитель:
доктор медицинских наук,
профессор Хмельницкая Наталия Михайловна
Официальные оппоненты:
доктор медицинских наук
профессор Пожарисский Казимир Марианович
доктор медицинских наук
профессор Насыров Руслан Абдуллаевич
Ведущая организация: Государственное учреждение науки «Научно-исследовательский институт онкологии им. Н.Н. Петрова Федерального агентства по здравоохранению и социальному развитию»
Защита диссертации состоится «___» 2011 года в __ часов на заседании диссертационного совета Д.208.089.04 при ГОУ ДПО «Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию» (191015, г. Санкт-Петербург, ул. Кирочная, д.41)
С диссертацией можно ознакомиться в фундаментальной библиотеке ГОУ ДПО «Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию» по адресу: 195196, г. Санкт-Петербург, Заневский пр., 1/82
Автореферат разослан «___» _________________2011 г.
Ученый секретарь диссертационного совета
доктор медицинских наук М.А. Шевяков
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Рак молочной железы (РМЖ) занимает первое место среди всех онкологических заболеваний у женщин. По данным Всемирной Организации здравоохранения (ВОЗ), в мире каждый год регистрируется 1,1 млн. новых случаев заболевания. Ежегодно от РМЖ погибает более 411 тысяч женщин (World Health Organization, 2008). РМЖ является гетерогенной группой опухолей с широкой вариацией в отношении клинических проявлений, прогноза и морфологического спектра (Головин Д.И., 1982; Нейштадт Э.Л., Воробьева О.А., 2003; Makretsov N.A. и соавт., 2004; Weigelt B. и соавт. 2008). Проблема морфологической неоднородности РМЖ давно уже признана гистопатологами, которые прилагают многолетние усилия в разработке классификационных систем, учитывающих разнообразие этого рака (Ермилова В.Д.. 2002; Geyer F.C. и соавт., 2009). Классификация опухолей молочной железы, опубликованная ВОЗ включает многочисленные гистологические формы. Однако эта классификация не отражает внутриопухолевую гетерогенность и биологическую комплексность опухолей молочной железы. В настоящее время, только морфологическая верификация патологического процесса как злокачественного новообразования, недостаточна для индивидуального прогноза РМЖ (Мацко Д.Е., Шелихова К.В., 2007; Филатов А.В., 2008; Семиглазов В.Ф., 2009). Определение молекулярно-биологических маркеров (МБМ) в ткани опухоли может дать дополнительную информацию о быстроте ее роста, способности к метастазированию, устойчивости к химиопрепаратам (Аничков Н.М., Зиновьев А., 1993; Герштейн Е.С., Кушлинский Н.Е., 2002; Ориновский М.Б., и соавт. 2006). Характеризуя биологические особенности каждой конкретной опухоли, они могут помочь в прогнозировании исхода заболевания и в индивидуализации лечения (Имянитов Е.Н., Князев П.Г., 1991; Семиглазов В.Ф., 2000). Для изучения биологических свойств опухолей молочной железы в настоящее время широко используют технологию микрочиповых матриц. Эта технология позволила определить, что каждая опухоль имеет свой уникальный профиль экспрессии генов. На основе генной экспрессии выявлено несколько подтипов РМЖ (Perou C.M., и соавт., 2000; Sorlie T., и соавт., 2001). Однако исследование с помощью микрочипов является дорогостоящим и трудоемким. В последние годы во всем мире применяют тканевые матрицы (ТМА), известные в англоязычной литературе как tissue microarrays. Эта технология позволяет провести исследование множественных образцов тканей от разных пациентов с использованием одного парафинового блока. Срезы такого блока могут быть использованы в исследовании прогностических маркеров РМЖ с помощью иммуногистохимического анализа (ИГХ). Необходима разработка недорогих и более простых в использовании подходов, которые будут доступны в практике.
Все выше изложенное и определяет актуальность данного исследования.
Цель исследования
На основе изучения молекулярных подтипов РМЖ с использованием ТМА определить базовые прогностические маркеры РМЖ.
Задачи исследования
- Изучить данные современной литературы о возможностях использования ТМА в научной и практической деятельности врача РФ с учетом достоинств и недостатков этой технологии.
- Экономически обосновать необходимость использования ТМА технологии в современной морфологической диагностике РМЖ.
- Исследовать экспрессию прогностически значимых и таргетных (прицельных для терапии) молекулярно-биологических маркеров: рецепторов эстрогена (ER) и прогестерона (PR), Human Epidermal Growth Factor Receptor 2 (HER2), маркера базальных/миоэпителиальных клеток – цитокератинов 5/6 (СК 5/6), Epidermal Growth Factor Receptor (EGFR), а также дополнительных МБМ (-Catenin, B-crystallin, СD44, СD24) в опухолях молочной железы, используя ТМА технологию.
- Определить, на основании полученных данных, доминирующие биологические подтипы рака молочной железы у исследуемой когорты пациентов, применив метод иерархического кластерного анализа.
Научная новизна
На основании проведенного исследования показана возможность и необходимость определения молекулярных подтипов рака молочной железы с помощью иммуногистохимического метода. Предложен комплексный подход: сочетание ИГХ и новой ТМА технологии, что позволяет изучать широкую панель МБМ с минимальными экономическими затратами.
Впервые изучена панель МБМ (-Catenin, B-crystallin, СD44, СD24), связанных с базальноподобным или тройным негативным (ТНРМЖ) раком. Проанализированы особенности экспрессии и взаимного влияния этих протеинов на прогрессию РМЖ.
Изучено прогностическое значение определения молекулярных подтипов РМЖ для выживаемости.
Практическая значимость
Работа направлена на улучшение диагностики и индивидуализацию лечения пациентов. Для определения молекулярных РМЖ предложен альтернативный дорогостоящему методу микрочипов метод ИГХ в сочетании с ТМА. Полученные результаты могут использоваться для диагностики, планирования лечения и прогнозирования у пациентов с диагнозом РМЖ.
Основные положения, выносимые на защиту
- Многолетний опыт собственных исследований и анализ современной научной литературы позволяют рекомендовать использование ТМА технологии в сочетании с ИГХ для широкого использования в научной и практической деятельности врача-патологоанатома.
- Проведенный нами сравнительный анализ стоимости услуг на иммуногистохимические исследования базовых молекулярно-биологических диагностических маркеров РМЖ при использовании обычных подходов и расчет затрат на исследование при использовании технологии ТМА показывает явную экономическую выгоду последних.
- На основе иммуногистохимического анализа рецепторов эстрогена (ER) и прогестерона (PR), Human Epidermal Growth Factor Receptor 2 (HER2), маркера базальных/миоэпителиальных клеток – цитокератинов 5/6 (СК 5/6), Epidermal Growth Factor Receptor (EGFR) могут быть выделены несколько подтипов РМЖ: люминальный тип А, люминальный тип Б, базальноподобный тип, тип HER2+/ER-, неклассифицированный.
- Применение дополнительных молекулярно-биологических маркеров -Catenin, B-crystallin, СD44, СD24 является обоснованным при диагностике базальноподобного РМЖ, так как позволяет более точно прогнозировать исход заболевания и индивидуально подбирать терапию.
- Для анализа данных ИГХ исследования множественных МБМ наиболее удобным является метод иерархического кластерного анализа. Он быстро и наглядно позволяет определить доминирующие биологические подтипы рака молочной железы у исследуемой когорты пациентов.
Личный вклад автора в проведенное исследование
Автором определены основные идеи, цели и задачи исследования. Самостоятельно выполнены сбор материала, построение ТМА, проведение ИГХ реакций, анализ полученных результатов и их статистическая обработка.
Внедрение результатов исследования в практику
Теоретические положения работы используются при чтении лекций и проведении практических занятий на кафедре патологической анатомии им. О.К. Хмельницкого ГОУ ДПО СПб МАПО. Практические положения работы внедрены в диагностический процесс при постановке диагноза рака молочной железы в Ленинградском областном патологоанатомическом бюро.
Апробация материалов диссертации
Результаты и основные положения диссертации докладывались и обсуждались на Всероссийской конференции с международным участием, посвященной 100-летию Российского общества патологоанатомов (Санкт-Петербург, 2009); международном съезде Американской Ассоциации Исследования Рака (Вашингтон, США, 2010); международном съезде Американского Общества Клинической Онкологии (Чикаго, США, 2010).
Публикации
По теме диссертации опубликовано 8 печатных работ, из них 3 статьи – в журналах перечня изданий, рекомендованных ВАК РФ для публикации результатов кандидатских диссертаций.
Структура и объем диссертации
Диссертационная работа изложена на 123 страницах машинописного текста. Работа состоит из введения, обзора литературы, главы о материалах и методах исследования, главы результатов собственных исследований, обсуждения полученных результатов, заключения, выводов, практических рекомендаций, списка используемой литературы, включающего 210 источников, в том числе 42 отечественных и 168 зарубежных. Диссертация иллюстрирована 6 таблицами и 28 рисунками.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Материалом для диссертационного исследования послужил архивный консультативный материал Ленинградского областного бюро патологической анатомии от 186 пациентов (оперированных по поводу РМЖ различных гистологических форм и степени злокачественности), представленный тканевыми образцами, фиксированными в 10% растворе нейтрального забуференного формалина и залитые в парафин. Медицинская документация: выписки из историй болезни и протоколов исследования операционного материала. Для экономических расчетов - прайс-листы на платные услуги различных медицинских учреждений, доступные пользователям сети Интернет.
Гистологическое исследование и построение тканевой матрицы
Из архивных парафиновых блоков были изготовлены гистологические препараты с окраской гематоксилином и эозином. Исследование препаратов осуществлялось с помощью светового микроскопа при различных увеличениях (объективы 1,25х, 4х, 10х, 20х). Области интереса (участки опухоли) обводили маркером на поверхности покровных стекол микропрепаратов и парафиновых блоков. Для изготовления тканевой матрицы отливали из парафина блок-реципиент. С помощью цилиндрической трубки в блоке-реципиенте вырезали отверстия глубиной 5-6 мм. Цилиндрической трубкой из донорского блока в выбранном участке вырезали цилиндрический столбик ткани высотой до 5 мм и вставляли в отверстие блока-реципиента. Блоки ТМА резали на ротационном микротоме. Один срез окрашивали гематоксилином и эозином, на остальных срезах выполняли иммуногистохимические реакции.
ИГХ исследование и критерии оценки экспрессии МБМ в РМЖ
Срезы ТМА обрабатывали по стандартным ИГХ методикам. Панель используемых в работе антител представлена в таблицах 1 и 2. Во время окрашивания применялись соответствующие положительные и отрицательные контроли (ткани миндалины, рака толстого отдела кишки, рака и нормального эпителия молочной железы человека). Молекулярные профили РМЖ определяли с помощью ИГХ метода на основе уровней экспрессии протеинов следующим образом: люминальный А (ER+ и/или PR+, HER2–), люминальный Б (ER+ и/или PR+, HER2+), с характеристиками базальных/миоэпителиальных клеток (ER–, PR–, HER2–, CK5/6+ и/или EGFR+), HER2+/ER– подтип (HER2+, ER–, PR–), неклассифицированный (негативный в отношении всех пяти маркеров). Результаты и оценка ИГХ реакции производились по стандартам, разработанным для каждого маркера с учетом процента и интенсивности положительного окрашивания (табл.3).
Анализ данных: создана база цифровых изображений и использовались программы: «Cluster», «TreeView», «Stata 9.2» (College Station, TX, USA).
Таблица 1.
Антитела, используемые в работе для исследования базовых МБМ
| Маркер | Клон | Разведение | Фирма | Метод восстановления антигенной иммунореактивности | Система детекции |
| ER | SP1 | 1:50 | Lab Vision/ Thermo Fisher (Fremont, CA) | Демаскировка антигенов в микроволновой печи в течение 30 минут, 10 мМ цитратный буфер (рН 6,0) | EnVision+ (Dako), ДАБ |
| PR | SP2 | 1:50 | Lab Vision/ Thermo Fisher | Демаскировка антигенов в микроволновой печи в течение 30 минут, 10 мМ цитратный буфер (рН 6,0) | EnVision+ (Dako), ДАБ |
| HER2 | Hercep Test | Подготовлено к применению фирмой | Dako | Демаскировка в микроволновой печи в течение 15 минут, Epitope retrieval solution (HercepTest. № K5207) | EnVision+ (Dako), ДАБ |
| EGFR | 2-18C9 | Подготовлено к применению фирмой | Dako | Обработка протеолитическим ферментом – протеиназа К (Dako, PharmDX, №K1494) | EnVision+ (Dako), ДАБ |
| CK 5/6 | D5/16 B4 | 1:100 | Dako | Демаскировка антигенов в микроволновой печи в течение 30 минут, 10 мМ цитратный буфер (рН 6,0) | EnVision+ (Dako), ДАБ |
Таблица 2.
Антитела, используемые в работе для исследования дополнительных МБМ
| Маркер | Клон | Разведение | Фирма | Метод восстановления антигенной иммунореактивности | Система детекции |
| Vimentin | V9 | 1:50 | Dako | Без обработки | EnVision+ (Dako), ДАБ |
| -Catenin | 14 | 1:200 | Transduction Laboratories/ BD Biosciences (San Jose, CA) | Демаскировка антигенов в микроволновой печи в течение 30 минут, 10 мМ цитратный буфер (рН 6,0) | EnVision+ (Dako), ДАБ |
| CD24 | Ab-2, SN3b | 1:200 | Lab Vision/ Thermo Fisher | Обработка в пароварке в течение 20 минут при температуре 95-98 oC, target retrieval solution (Dako, №S1699) | Bond Polymer Refine Detection (Vision Biosystems/Leica), ДАБ |
| CD44 | Ab-4, 156-3C11 | 1:200 | Lab Vision/ Thermo Fisher | Обработка в пароварке в течение 20 минут при температуре 95-98 oC, target retrieval solution (Dako, №S1699) | Bond Polymer AP Red Detection (Vision Biosystems/Leica), Vulcan Fast Red Chromogen Kit 2 (№FR805H, Biocare Medical) |
| B-crystallin | SPA-222 | 1:200 | Stressgen Biotechnologies | Демаскировка антигенов в микроволновой печи в течение 30 минут, 10 мМ цитратный буфер (рН 6,0) | EnVision+ (Dako), ДАБ |
Таблица 3.
Антитела и методы оценки иммуногистохимического окрашивания
| Маркер | Оценка результатов окрашивания | |
| ER | Окрашивание ядерное: 0=1%, 1=1-30%, 2=30-70%, 3=70% (Reiner A и соавт., 1990). Оценка пороговых значений (ASCO/CAP, Hammond M.E. и соавт., 2010). | |
| PR | Окрашивание ядерное: 0=1%, 1=1-30%, 2=30-70%, 3=70% (Reiner A и соавт., 1990). Оценка пороговых значений (ASCO/CAP, Hammond M.E. и соавт., 2010). | |
| HER2 | Окрашивание мембранное: 0 – полное отсутствие или <10% клеток; (1+) – слабое, >10% клеток; (2+) – слабое или умеренное полное, >10% клеток, или окрашивание яркой интенсивности всей мембраны клетки <30% клеток; (3+) – окрашивание яркой интенсивности всей мембраны клетки >30% клеток (ASCO/CAP, Wolff AC и соавт., 2007). | |
| EGFR | Окрашивание мембранное: 0,1+,2+,3+ (Dako/ PharmDX); 0=0%; считается позитивным если присутствует любое окрашивание. | |
| CK 5/6 | Окрашивание цитоплазматическое: 0=5%, 1=6-30%, 2=31-60%, 3=>61% (Dabbs D.J. и соавт., 2006). | |
| Vimentin | Окрашивание цитоплазматическое. Оценивали антигенные свойства тканей (Battifora H., 1991). | |
| -Catenin | Окрашивание ядерное, мембранное, цитоплазматическое: 0=10%, 1=11-30%, 2=30-70%, 3=70% (Reiner A. и соавт., 1990). | |
| CD24 | Окрашивание цитоплазматическое: 0=0%, 1=1-10%, 2=11-50%, 3=51-75%, 4=76-100% ( Honeth G. и соавт., 2008). | |
| CD44 | Окрашивание цитоплазматическое: 0=0%, 1=1-10%, 2=11-50%, 3=51-75%, 4=76-100% ( Honeth G. и соавт., 2008). | |
| B-crystallin | Окрашивание цитоплазматическое, мембранное: 0 – полное отсутствие продукта реакции; (1+) – слабое позитивное окрашивание (<30% клеток); (2+) сильное позитивное окрашивание (30% клеток) (Moyano J.V. и соавт., 2006). | |
Используемые средства: микроскоп «Leica» с цифровой камерой, компьютер IBM-PC, инструмент «TMAjr» («Pathology Devices, Inc.»), программное обеспечение для работы с цифровыми и графическими данными («Image-ProExpress 6.3»).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На основании проведенного обзора современной литературы, анализа достоинств и недостатков метода тканевых матриц, а так же собственного опыта работы, были разработаны критерии для отбора материала, пригодного для построения ТМА блока и предложен наиболее оптимальный алгоритм-протокол его построения.
Экономическое обоснование необходимости использования ТМА технологии в современной морфологической диагностике РМЖ
Проведен анализ стоимости услуг в различных диагностических центрах России на ИГХ исследование маркеров РМЖ (ER, PR, HER2). По данным прайс-листов, доступных пользователям сети Интернет, произведен расчет затрат на ИГХ исследование ткани РМЖ десяти пациентов с использованием обычных подходов и расчет аналогичных затрат при использовании технологии ТМА. Стоимость услуг на исследование трех маркеров (ER, PR, HER2) с использованием трех микропрепаратов по стандартной методике в среднем составляет 3990 руб. для одного пациента и 39 900 руб. для десяти пациентов. Стоимость услуги на исследование трех маркеров с использованием ТМА в среднем составляет 399 руб. для одного пациента и 3 990 руб. для десяти пациентов. Кроме того, метод ТМА позволяет рационально использовать помещения для хранения архивного материала в патологоанатомических отделениях.
Определение экспрессии молекулярно-биологических маркеров в РМЖ с использованием ТМА
Для классификации РМЖ на подтипы и проведения исследования экспрессии МБМ в опухолях молочной железы были построены и использованы шесть ТМА блоков. Тканевые матрицы содержали 782 тканевых образца РМЖ различных гистологических форм и степени злокачественности от 186 пациентов. Из них 60 наблюдений были представлены неинфильтрирующим протоковым и дольковым раком, 126 – инвазивным раком различных гистологических форм. Средний возраст пациентов с неинфильтрирующим РМЖ составил 55,1±13,0 лет, в то время как средний возраст пациентов с инвазивной формой рака - 56,0±15,6 лет. На основании данных историй болезни и с учетом результатов гистологического исследования были установлены стадии онкологического заболевания, согласно Международной Классификации Опухолей (Greene F.L., и соавт., 2002; Tavassoli F.A., Devilee P., 2003). Рак молочной железы I стадии установлен у 30 пациенток, что составило 16,13% от всей группы наблюдения. Рак молочной железы стадии IIА был выявлен у 37 (19,90%) пациенток, стадии IIB – у 32 (17,20%), IIIА стадии – у 13 (6,98%), IIIB – у 8 (4,30%). Рак молочной железы IV стадии был установлен в 6 случаях, что составило 3,23%. Неинвазивный рак (0 стадия) был выявлен у 60 пациенток (32,26%). Наличие метастазов в регионарные лимфатические узлы обнаружено в 65 (35,0%) случаях. В основном имелось единичное метастазирование – 37 (19,89%) наблюдений; а наличие отдаленных метастазов выявлено у 7 (3,76%) пациенток. Морфологические формы опухоли РМЖ были определены при гистологическом исследовании и представлены в основном инвазивным протоковым раком - 104 (82,5%) наблюдения. Инвазивный дольковый рак диагностирован в 13 (10,3%) случаях, другие формы РМЖ составили 9 (7,2%).
Определение и описание молекулярных подтипов РМЖ рационально выполнять по алгоритму. На необходимость развития алгоритмизации, как наиболее совершенного и правильного процесса диагностирования указывали О.К. Хмельницкий (1994) и А.В. Смольянников и соавт. (1995). В ходе проведенной работы предложен модифицированный алгоритм классификации РМЖ на молекулярные подтипы, который может быть использован в практической работе патоморфологами и врачами-онкологами (рис.1).
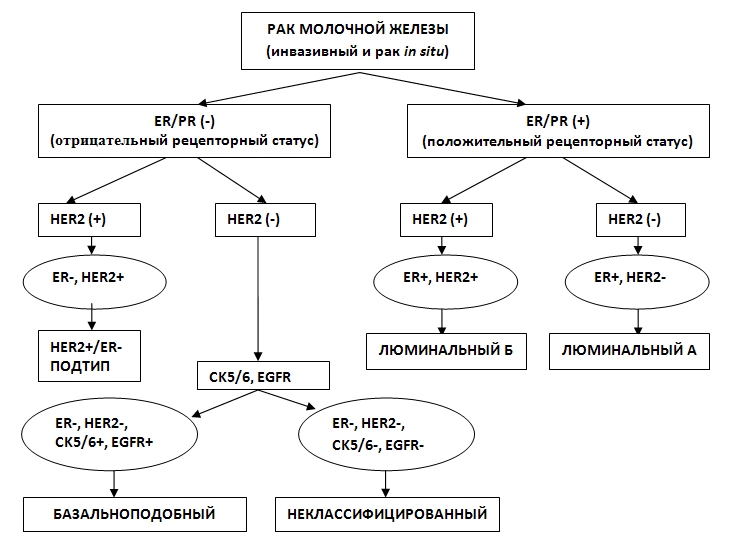
Рис.1. Блок-схема алгоритма определения молекулярных подтипов РМЖ.
На основании проведенного полуколичественного анализа было выявлено пять молекулярных подтипов опухолей, как в инвазивных, так и в неинвазивных формах РМЖ: люминальный тип А, люминальный тип Б, базальноподобный, HER2+/ER–, и неклассифицированный. Все инвазивные раки распределялись по подтипам: люминальный тип А – 81 (64,24%), люминальный тип Б – 11 (8,73%), базальноподобный – 23 (18,25%), HER2/ER– – 8 (6,4%), неклассифицированный – 3 (2,38%). Среди неинвазивных раков подтипы распределялись следующим образом: люминальный тип А – 38 (63,33%), люминальный тип Б – 6 (10%), базальноподобный – 8 (13,34%), HER2 выявлен в 6 (10%), неклассифицированный – 2 (3,33%). В результате работы составлен иммуногистохимический портрет каждого подтипа.
Определение доминирующих молекулярных подтипов РМЖ у исследуемой когорты пациентов
С помощью компьютерных программ был проведен анализ данных ИГХ исследования: было получено 5 кластерных групп, каждая из которых имела свой индивидуальный ИГХ профиль или «портрет». Проведенный анализ показал, что доминирующим подтипом РМЖ является люминальный подтип А, на втором месте оказался базальноподобный тип, третье разделили люминальный тип Б и HER2, на последнем месте оказался неклассифицированный. Анализ так же показал, что молекулярные подтипы имели прямую связь с гистологической степенью злокачественности (р=0,0001).
Важнейшим критерием, характеризующим правильность диагностики и лечения, является показатель выживаемости. В работе проведён расчёт показателей болезнь-специфической 15-летней выживаемости (69 больных), для расчета показателей которой использован метод Каплан-Мейера. При данном анализе учитывали смертность только от рака молочной железы. Полученные нами результаты свидетельствуют, что пациенты, относящиеся к группе с фенотипом рака: HER2+/ER– и базальноподобный, имеют наихудший прогноз.
Экспрессия белка -catenin в РМЖ
Для оценки экспрессии и локализации белка -catenin было произведено ИГХ окрашивание ТМА стекол и выполнен анализ оценки экспрессии белка в мембране, цитоплазме и ядре клеток нормальной ткани молочной железы, неинвазивного и инвазивного РМЖ, метастазах в лимфатические узлы. Анализ показал, что пропорция опухолей, экспрессирующих белок -catenin в цитоплазме и ядре в опухолях базальноподобной подгруппы РМЖ (рис.2) имеет высокую статистическую значимость, по сравнению с другими подгруппами.
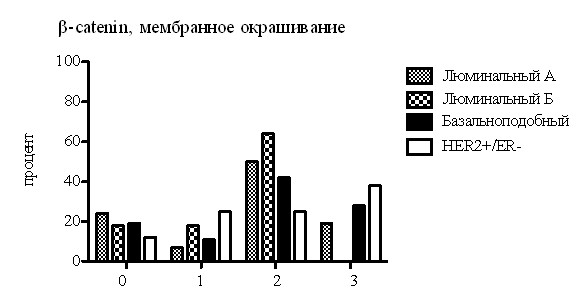

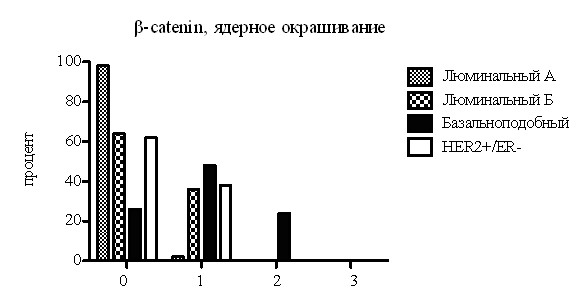
Рис. 2. Изменение распределения белка -catenin в клетке в зависимости от принадлежности пациента к одной из молекулярных подгрупп РМЖ. По вертикали - процент пациентов, имеющих экспрессию. По горизонтали - оценка экспрессии протеина -catenin по системе 0 (нет экспрессии), 1 (слабая экспрессия), 2 (умеренная экспрессия), 3 (выраженная экспрессия).
Ядерная экспрессия белка -catenin так же обратно пропорционально коррелировала с ER (р<0,0001) и PR (р<0,0001) и прямо пропорционально с СK5/6 (р=0,0001) и EGFR (р=0,0001). Цитоплазматическая экспрессия белка напрямую коррелировала со степенью злокачественности РМЖ. Анализ экспрессии белка -catenin в молекулярных подгруппах неинвазивного РМЖ выявил отсутствие превалирования мембранной экспрессии в какой-либо подгруппе и показал явную цитоплазматическую и ядерную экспрессию в подгруппе базальноподобного РМЖ.
Экспрессия CD44 и CD24 в РМЖ
ИГХ анализ экспрессии CD44 и CD24 был проведен для определения популяции стволовых клеток, имеющих CD44+/CD24– фенотип.
Проведенный полуколичественный анализ экспрессии маркеров CD44 и CD24 показал (рис.3), что CD44+/CD24– фенотип ассоциируется прежде всего с РМЖ базальноподобной подгруппы (р=0.0001). Важным на наш взгляд оказалось то, что окраска серийных срезов показала, что клетки, имеющие цитоплазматическую (р=0,0009) и ядерную (р<0,0001) локализации белка -catenin, имеют CD44+/CD24– фенотип и относятся к базальноподобному РМЖ. Клетки с преимущественно мембранной локализацией белка -catenin имеют CD44–/CD24+ фенотип и относятся к люминальному подтипу А.
Популяция опухолевых клеток РМЖ, имеющая CD44+/CD24– фенотип прямо пропорционально коррелировала с экспрессией CK5/6 (р=0,012) и EGFR (р=0,0046) и обратно пропорционально коррелировала с экспрессией ER (р=0,0022) и PR (р=0,0015). Не было выявлено корреляционной связи CD44+/CD24– с возрастом пациенток, размером опухоли и степенью злокачественности РМЖ. В неинвазивных РМЖ мы не выявили никакой корреляционной связи между экспрессией CD44+/CD24– и цитоплазматической или ядерной экспрессией белка -catenin (р=0,50 и р=0,57 соответственно).

Рис.3. Распределение CD44+/CD24- популяции клеток в зависимости от принадлежности пациента к одной из молекулярных подгрупп РМЖ. По вертикали - процент пациентов, имеющих экспрессию. По горизонтали - оценка экспрессии CD44+/CD24- по системе: 0 (нет экспрессии), 1 (слабая экспрессия), 2 (умеренная экспрессия), 3 (выраженная экспрессия), 4 (резко выраженная экспрессия).
Экспрессия белка B-Crystallin
Экспрессию B-Crystallin оценивали в нормальной ткани молочной железы, неинфильтрирующих и инфильтрирующих формах РМЖ с учетом выделенных ранее подгрупп. В нормальном эпителии молочной железы B-crystallin экспрессировался в 96% случаев в миоэпителиальном слое и в 1% случаев в эпителиальном. В 70% случаев неинвазивного и только в 14% случаев инвазивного РМЖ этот протеин экспресировался также в миоэпителиальном слое. В группе неинвазивных раков B-Crystallin экспресировался в 60% случаев в базальноподобной подгруппе РМЖ и только в 5% случаев люминального подтипа А (p=0,001). В группе инвазивных раков B-Crystallin экспресcировался в 81% случаев в базальноподобной подгруппе РМЖ и в 5% в люминальном подтипе А (p<0,001). Данные статистического анализа показали прямую корреляционную связь экспрессии протеина B-Crystallin со степенью злокачественности (p=0,01) РМЖ. Полученные данные подтвердили тот факт, что экспрессия протеина B-Сrystallin наиболее выражена в инвазивных РМЖ подгруппы базальноподобных. Показано, что экспрессия этого протеина в раках in situ наиболее выражена в подгруппе базальноподобных. Полученные результаты позволяют считать, что B–Сrystallin может быть использован как прогностический маркер уже на ранних стадиях РМЖ, особенно у пациентов имеющих тройной негативный фенотип.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Роль врача-патологоанатома в постановке точного диагноза РМЖ остается ведущей. Более того, в эру индивидуализированной медицины и персонализированной терапии РМЖ диагностическое заключение патоморфолога определяет тактику, как хирурга, так и онколога. Современная высокопроизводительная технология анализа на тканевом уровне – технология ТМА позволяет российскому патологу получить информацию о нарушениях, лежащих в основе процессов развития и прогрессии опухоли. В представленной работе критически оценены современные данные о возможности применения ТМА метода в сочетании с ИГХ методом для более точной диагностики РМЖ. Разработаны практические рекомендации по улучшению качества изготовления ТМА блоков и срезов. Приведены экономические расчеты, показывающие преимущество использования данного метода. На основании применения данной технологии исследована экспрессия молекулярно-биологических маркеров ER, PR, HER2, СК5/6, EGFR в РМЖ и проведена классификация всех исследованных РМЖ на молекулярные подтипы. В данной работе впервые сделана попытка изучить панель МБМ (-catenin, CD44,CD24, B-crystallin) и их связь с молекулярными подтипами РМЖ. Особое внимание в работе уделено особенности экспрессии МБМ в базальноподобных раках. Полученные в ходе работы результаты показывают, что молекулярная подгруппа базальноподобного рака обогащена клетками с фенотипом CD44+/CD24–. Эти данные согласуются с данными литературы (Honeth G. и соавт., 2008) и могут свидетельствовать о происхождении раков этой группы из клеток ранних предшественников. Полученные данные свидетельствуют так же о том, что РМЖ, относящиеся к базальноподобной подгруппе явно демонстрируют активацию Wnt/-catenin сигнального пути. Цитоплазматическая и ядерная аккумуляция белка -catenin в наших исследованиях наблюдалась более часто как в инвазивных, так и в неинвазивных раках, относящихся к подгруппе базальноподобных раков по сравнению со всеми другими молекулярными подгруппами. Более того, цитоплазматическая и ядерная аккумуляция белка -catenin показала прямую корреляционную связь с экспрессией других МБМ: ER–, PR–, EGFR+, CK5/6+. В инвазивных раках мололочной железы экспрессия белка -catenin коррелировала с наличием клеток, имеющих CD44+/CD24– фенотип. Полученные нами данные согласуются с данными литературы (Woodward W.A. и соавт., 2005) о том, что активация Wnt/-catenin сигнального пути является одним из ведущих механизмов в поддержании популяции стволовых опухолевых клеток в РМЖ. Данные по экспрессии белка B-crystallin могут служить подтверждением того, что его повышенная экспрессия ведет к апоптотической резистентности и, как следствие, вносит немаловажный вклад в агрессивность раков базальноподобной подгруппы.
Полученные в ходе работы результаты позволяют считать, что иммуногистохимическое определение МБМ с применением ТМА срезов может стать основополагающим в прогнозировании течения РМЖ и эффективности противораковой терапии. Только комплексный и экономически доступный подход может дать возможность по-новому решать проблему индивидуального лечения больных с РМЖ.
ВЫВОДЫ
- Активное внедрение в практику метода тканевых матриц в сочетании с методом иммуногистохимического исследования повышает качество диагностики рака молочной железы и улучшает качество лечения. Приведенные в работе экономические расчеты показывают возможность внедрения технологии тканевых матриц в современной морфологической диагностике рака молочной железы.
- Предложенный стандартный протокол для обработки материала позволяет устранить существующие недостатки технологии тканевых матриц и уменьшить потерю тканевых образцов во время резки парафинового блока или обработки микропрепарата.
- На основе иммуногистохимического анализа рецепторов эстрогена (ER) и прогестерона (PR), Human Epidermal Growth Factor Receptor 2 (HER2), маркера базальных/миоэпителиальных клеток – цитокератинов 5/6 (СК 5/6), Epidermal Growth Factor Receptor (EGFR) выделены несколько подтипов РМЖ: люминальный тип А, люминальный тип Б, базальноподобный тип, тип HER2+/ER–, неклассифицированный. Необходимость такой градации диктуется современным развитием молекулярной биологии и является необходимой при подборе индивидуальной терапии у пациентов с раком молочной железы. Повышение точности диагностики и понимание генеза тройных негативных (базальноподобных) раков молочной железы опухолей может быть достигнуто путем изучения экспрессии молекулярно-биологических маркеров: -сatenin, B-crystallin, СD44, СD24.
- Иерархический кластерный анализ удобен для использования при исследовании множественных биомаркеров и позволяет определить подтипы рака молочной железы при исследовании большой когорты пациентов.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Для оценки экспрессии множественных молекулярно-биологических маркеров в РМЖ необходимо использовать ИГХ в сочетании с ТМА технологией.
- Для ИГХ определения молекулярных подтипов РМЖ необходимо учитывать экспрессию пяти молекулярно-биологических маркеров: ER, PR, HER2, EGFR, CK5/6.
- При выявлении базальноподобного или тройного негативного рака целесообразно выполнение ИГХ теста с дополнительными МБМ: -Catenin, B-crystallin, СD44, СD24.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Криволапов Ю.А., Храмцов А.И. Применение тканевых матриц в иммуногистохимии // Архив патологии. – 2005. –T.67, №2. – C. 48-50.
- Храмцов А.И. Исянов Н.Н., Хоржевский В.А. Веб-кольцо патолого-анатомических сайтов в Интернете: компьютерно-опосредованная коммуникационная среда патоморфологов. // Архив патологии. – 2009. – T. 71, №1. – С. 40-42.
- Храмцов А.И., Храмцова Г.Ф. Применение тканевых матриц в исследовании молекулярных профилей рака молочной железы. 100-летие Российского общества патологоанатомов: Материалы Всероссийской конференции с международным участием (09-10 октября 2009 г.). – СПб, 2009. – C. 330-331.
- Храмцов А.И., Храмцова Г.Ф., Хмельницкая Н.М. Технология тканевых матриц в современном диагностическом и научном исследовании. // Вопросы онкологии. – 2010. – Т.56, №2. – C. 240-244.
- Herschkowitz J.I., Simin K., Weigman V.J., Mikaelian I., Usary J., Hu Z., Rasmussen K.E., Jones L.P., Assefnia S., Chandrasekharan S., Backlund M.G., Yin Y., Khramtsov A.I., Bastein R., Quackenbush J., Glazer R.I., Brown P.H., Green J.E., Kopelovich L., Furth P.A., Palazzo J.P., Olopade O.I., Bernard P.S., Churchill G.A., Van Dyke T., Perou C.M. Identification of conserved gene expression features between murine mammary carcinoma models and human breast tumors. // Genome Biology. – 2007. – Vol.8 (5). – P.76.
- Prosperi J.R., Valancius-Mangel V., Khramtsov A.I., Olopade O.I., Goss K.H. Modulation of the Wnt/-catenin pathway is associated with the basal-like breast cancer phenotype. // Cancer Research. – 2009. – Vol. 69 (2 Supplement). – P. 4066.
- Lubin G.P., Khramtsov A., Khramtsova G., Walmy Sveen E., Perou C.M., Huo D., Olopade O.I. B-Crystallin expression across different stages and subtypes of breast cancer analyzed using tissue microarrays // Cancer Research. – 2010. Vol. 70 (8 Supplement). – P. 1176.
- Adeniji K.A., Huo D., Khramtsov A., Zhang C., Olopade O.I. Molecular profiles of breast cancer in Ilorin, Nigeria. // Journal of Clinical Oncology (Meeting Abstracts). – 2010. – Vol. 28. – P.1602.
Автор считает своим долгом выразить признательность вдохновителям работы к.м.н. Храмцовой Г.Ф., д.м.н., профессору Горделадзе А.С., д.м.н., профессору Смирнову О.А.; научному руководителю д.м.н., профессору Хмельницкой Н.М.; всем учреждениям, предоставившим возможность провести данное исследование и персонально - доктору, профессору Olufunmilayo I. Olopade, доктору, профессору Goss K.H., доктору, профессору Perou C.M., к.м.н. Чибисову В.Н. и д.м.н., профессору Криволапову Ю.А., к.б.н. Аникеевой Н.В.
Список сокращений*
ВОЗ – Всемирная Организация Здравоохранения
ИГХ – иммуногистохимическое исследование
МБМ – молекулярно-биологические маркеры
РМЖ – рак молочной железы
ТМА – тканевые матрицы
ТНРМЖ – тройной негативный РМЖ
ASCO – Американское общество клинической онкологии
CAP – Коллегия американских патологов
CD24-гликопротеин (белок клеточной адгезии)
CD44- гликопротеин (межклеточные взаимодействия, клеточная адгезия)
EGFR (Epidermal Growth Factor Receptor, HER1) – рецептор эпидермального фактора роста
ER – рецепторы эстрогена альфа (Estrogen receptor)
HER2 (Human Epidermal Growth Factor Receptor 2) – рецептор эпидермального фактора роста 2
Vimentin – виментин (белок промежуточных филаментов мезодермального происхождения)
B-crystallin – B-кристаллин (протеин из семейства белков стресса)
-Catenin – -катенин (белок входящий в комплекс клеточной адгезии)
РR – рецепторы прогестерона (Progesterone receptor)
СК-5/6 – цитокератины 5/6 (белки промежуточных филаментов цитоскелета эпителиальных клеток)
*Для избежания неправильной трактовки и ошибок в интерпретации, названия протеинов, антител, инструментов и фирм производителей приведены как в русском, так и в их оригинальном англоязычном варианте.

