Комбинированная терапия очаговой алопеции
На правах рукописи
Гостроверхова
Ирина Петровна
Комбинированная терапия очаговой алопеции
14.01.10 кожные и венерические болезни
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2012
Работа выполнена в ГБОУ ВПО Первый МГМУ им. И.М. Сеченова
Научный руководитель:
Доктор медицинских наук, профессор Олисова Ольга Юрьевна
Официальные оппоненты:
Доктор медицинских наук, профессор Потекаев Николай Николаевич
Доктор медицинских наук Пинсон Игорь Яковлевич
Ведущая организация:
ФГБОУ ВПО Российский университет Дружбы Народов, г. Москва.
Защита диссертации состоится «____» _____________2012 г. в «___» часов на заседании Диссертационного совета Д 208.040.10 при ГБОУ ВПО Первый МГМУ им. И.М. Сеченова по адресу: 119991, г. Москва, ул. М. Трубецкая, д. 8, стр.2.
С диссертацией можно ознакомиться в библиотеке ГБОУ ВПО Первый МГМУ им. И.М. Сеченова по адресу: 117998, г. Москва, Нахимовский проспект, д. 49.
Автореферат разослан «_____» _______________2012 г.
Ученый секретарь Диссертационного совета
Доктор медицинских наук, профессор Эрдес Светлана Ильинична
Актуальность исследования. Частота встречаемости очаговой алопеции (ОА) среди больных дерматологического профиля составляет от 2 - 5% до 8 – 12% (Адаскевич В.П. и соавт., 2000; Кубанова А.А. и соавт., 2002; Мордовцев В.Н., Мордовцева В.В., 2002; McDonagh A., Messenger A., 2003; Trоber B.E. et al., 2005).
ОА остается заболеванием с неясной этиологией и недостаточно изученным патогенезом. Безусловно, ОА является мультифакторным заболеванием и имеет полиэтиологическую природу. Все большее число исследователей считают ОА тканеспецифическим аутоиммунным заболеванием с генетической предрасположенностью (Верхогляд И.В., 2010; Нефедова Е.Д., 2011; Bolduc Ch., 2006).
В последнее время актуальным направлением в изучении патогенеза ОА является определение факторов нейро-иммуно-эндокринной регуляции волосяного фолликула (ВФ). Изучается влияние дисбаланса про- и противовоспалительных цитокинов, в том числе трансформирующего фактора роста (ТGF-b) на развитие и течение ОА (Диденко И.В., 2006; Верхогляд И.В., 2010; Barahmani N. Et al., 2005; Arakawa S., 2007). Считается, что на степень тяжести ОА также влияет выраженность дисбаланса указанных цитокинов (Костина С.В., 2009; Barahmani N. et al., 2005). Известно, что патологические изменения при ОА затрагивают не только ВФ, но соединительно-тканные структуры дермы, в первую очередь кровеносные микрососуды (Мяделец О.Д., Адаскевич В.П., 2006; Потекаев Н.Н., Терещенко Г.П., Гаджигороева А.Г., 2009). Также, согласно исследованиям последних лет, перифолликулярный ангиогенез зависит от экспрессии фактора роста эндотелия сосудов (VEGF), который является одним из важнейших медиаторов роста ВФ, стимулируя пролиферацию клеток матрикса и эндотелиоцитов сосудистой сети, тем самым, поддерживая ВФ в фазе анагена (Шарова А.А., 2009). Важную роль в патогенезе ОА играют ИЛ-10 и трансформирующий фактор роста (ТGF-b), участвуя в поддержании иммунной привилегированности в перифолликулярной зоне, изолируя от антигенов, образующихся при меланогенезе или других, связанных с фазой анагена, процессах (Wollina U., Lange D. et al., 1996). Таким образом, вопрос о роли цитокинов в патогенезе ОА остается открытым.
Несмотря на большое количество существующих методов лечения ОА, по-прежнему, лечение ОА представляет большие трудности для практического здравоохранения. В настоящее время в терапии ОА используются системные и местные препараты: неспецифические раздражающие средства, контактные аллергены, средства стимулирующие рост волос, иммуносупрессоры, различные физиотерапевтические методы терапии, а также всевозможные адъювантные методы терапии. Достаточно изученные иммуносупрессивные средства, включающие глюкокортикостероиды (ГКС), циклоспорин, ПУВА и контактные ирританты, большинство авторов относят к основной патогенетической группе наиболее мощных терапевтических воздействий при ОА (Авербах Е.В., 1985; Суворова К.Н., Гаджигороева А.Г., 1998; Гамаюнов Б.Н., 2011; Tosti A. et al., 2006). Однако, течение болезни зачастую непредсказуемо и существующие методы лечения не всегда способствуют восстановлению волос, не гарантируют от возникновения рецидивов.
Таким образом, до сих пор сохраняются вопросы относительно этиологии и патогенеза ОА. Рост тяжелых торпидных форм, недостаточная эффективность существующих методов лечения, частое рецидивирование, в результате формирующаяся социальная и психологическая дезадаптация больных ОА, диктует необходимость поиска новых и усовершенствование уже имеющихся в арсенале дерматологов способов терапии, с направленным воздействием на основные патогенетические звенья.
В связи с вышеизложенным целью исследования являлось изучение уровня продукции сывороточных цитокинов и разработка патогенетически обоснованного комбинированного метода терапии больных ОА с использованием ПУВА и глюкокортикостероидов.
В соответствии с целью исследования нам предстояло решить следующие задачи:
- Определить уровни продукции сывороточных про- и противовоспалительных цитокинов при различных формах ОА до и после проведения комбинированной терапии.
- Изучить уровни ТGF-b и VEGF в сыворотке крови больных ОА в процессе комбинированной терапии и их влияние на развитие заболевания.
- Оценить динамику дерматоскопической картины ОА в процессе комбинированной терапии на основании совокупности дерматоскопических признаков очагов поражения.
- Дать оценку клинической эффективности комбинированной терапии с использованием ПУВА и инъекций ГКС у больных с различными формами ОА и оценить отдаленные результаты лечения.
Научная новизна исследования. Проведенные иммунологические исследования позволили выявить иммунные нарушения в виде повышения уровня ИЛ-1, ФНО-, ИЛ-2 и снижения ИЛ-10 в сыворотке крови больных ОА.
Впервые при изучении динамики цитокинового профиля больных ОА, установлено, что под влиянием проведенного комбинированного лечения с использованием ПУВА-терапии и ГКС происходит нормализация баланса сывороточных цитокинов (р<0,05).
Впервые при изучении сывороточных уровней фактора роста сосудистого эндотелия (VEGF) и трансформирующего фактора роста (ТGF-b) у больных ОА установлено, что их исходное содержание было достоверно ниже чем в контрольной группе. При этом уровень ТGF-b не имел зависимости от стадии и продолжительности заболевания. Тогда как при проведении корреляционного анализа обнаружена прямая корреляционная зависимость между исходным уровнем VEGF и продолжительностью рецидива (=0,541; p<0,05) и степенью тяжести ОА (=0,395; p<0,05), т.е. чем продолжительнее рецидив ОА, тем выше исходная концентрация VEGF, а также чем легче степень тяжести ОА, тем ниже сывороточная концентрации VEGF. У больных с IV степенью тяжести отмечаются более стойкие нарушения фолликулярного ангиогенеза по сравнению с более легкими формами ОА.
Впервые показано, что в процессе комбинированной терапии с использованием ПУВА и ГКС у больных ОА отмечалась положительная динамика дерматоскопической картины в виде уменьшения количества желтых и черных точек и пеладных волос в форме «восклицательного знака» и увеличения числа псевдовеллюсных волос, что являлось дополнительным критерием эффективности проводимой терапии.
Впервые разработана и научно обоснована методика комбинированной терапии с использованием ПУВА и ГКС, показана её высокая эффективность у больных с различной степенью тяжести ОА (клиническая ремиссия – у 72%, значительное улучшение – у 22 % больных).
Практическая значимость работы.
На основании оценки клинических, иммунологических, дерматоскопических показателей внедрена в практическое здравоохранение новая методика комбинированного лечения с использованием ПУВА-терапии и ГКС, позволившая добиться клинической ремиссии у 72% пациентов и значительного улучшения – у 22%, в том числе и при III и IV степени тяжести ОА. Разработанный метод комбинированной терапии ОА позволил увеличить в два раза продолжительность ремиссии, а также значительно улучшить качество жизни больных ОА.
Динамика дерматоскопической картины ОА может применяться как дополнительный критерий объективной оценки эффективности комбинированной терапии.
Основные положения, выносимые на защиту:
- У больных ОА отмечается дисбаланс сывороточных про- и противовоспалительных цитокинов, проявляющийся повышенным уровнем ИЛ-1, ФНО-, ИЛ-2 и снижением ИЛ-10.
- Сывороточные концентрации ТGF-b и VEGF у больных ОА достоверно снижены по отношению к контрольной группе. При этом уровеньVEGF зависит от степени тяжести и продолжительности рецидива ОА.
- Динамика дерматоскопических признаков, количественное соотношение которых определяет стадию процесса, является критерием оценки эффективности проводимой комбинированной терапии ОА.
- Разработанный комбинированный метод с использованием ПУВА-терапии и глюкокортикостероидов позволяет добиться высокого терапевтического эффекта и увеличить в два раза продолжительность ремиссии у больных ОА.
Реализация полученных результатов исследования.
Полученные результаты комбинированной терапии с использованием ПУВА-терапии и глюкокортикостероидов внедрены в практику работы клиники кожных и венерических болезней, а также в учебный процесс кафедры кожных и венерических болезней Первого МГМУ им. И.М. Сеченова.
Апробация диссертации. Материалы диссертации доложены и обсуждены на научно-практической конференции 2-го Форума медицины и красоты, г. Москва, 24 ноября 2009г.; II Всероссийской научно-практической конференции ФМБА «Современные аспекты дерматовенерологии», г. Москва, 2-3 декабря 2010г. Апробация диссертационной работы состоялась на научно-практической конференции кафедры кожных и венерических болезней лечебного факультета ГБОУ ВПО «Первый МГМУ им. И. М. Сеченова» (22 ноября 2011 года).
Личный вклад автора. Вклад автора является определяющим и заключается в непосредственном участии на всех этапах исследования. Автором проведено углубленное клинико-анамнестическое обследование больных разной степени тяжести ОА, выполнен весь объем инструментальных исследований, организовано ведение пациентов по индивидуально разработанному плану, сформирована база данных. Интерпретированы данные лабораторных исследований, проведена статистическая обработка и анализ полученных результатов, сформулированы выводы и даны практические рекомендации.
Публикации. Результаты диссертационной работы отражены в 6 печатных работах, 2 из них опубликованы в научных журналах, рекомендованных ВАК Минобрнауки РФ.
Объем и структура работы. Диссертация изложена на 135 страницах печатного текста и состоит из введения, обзора литературы, описания материалов и методов исследования, двух глав собственных результатов исследования, заключения, практических рекомендаций, выводов. Иллюстрирована 20 таблицами, 14 рисунками и 19 фотографиями. Список литературы включает 90 отечественных и 150 иностранных источников.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Материалом настоящей диссертационной работы служили данные динамического клинико-лабораторного обследования 50 больных очаговой алопецией (ОА), получавших лечение с 2009 по 2011 гг. в клинике кожных и венерических болезней УКБ №2 Первого МГМУ им. И.М. Сеченова.
Всем пациентам проводилось обследование по единой программе, которая включала углубленное изучение анамнестических данных, клинического течения заболевания и дерматологического статуса; проведение комплекса исследований, включающих гематологические, биохимические, иммунологические, дерматоскопические методы и изучение показателей качества жизни.
Обследовано 50 больных с различными формами ОА в возрасте от 16 до 66 лет, из них 31 (62%) мужчина и 19 (38%) женщин, что составило 1,6 : 1 в половом соотношении. Среди наблюдаемых нами больных подавляющее большинство (66%) было в активном трудоспособном возрасте (20 – 45 лет).
Продолжительность заболевания варьировала от 1 месяца до 11 лет. У 15 (30%) больных продолжительность ОА не превышала 6 месяцев, 15 (30%) страдали ОА от 6 месяцев до 1 года, 9 (18%) больных - от 1 до 3 лет, 3 (6%) больных – от 3 до 5 лет и 8 (16%) больных – свыше 5 лет.
При клинико-лабораторном обследовании и консультации смежных специалистов у 34 (68%) больных были выявлены сопутствующие заболевания, из них у 16 (47%) больных выявлялись очаги хронической инфекции, среди которых преобладали хронический бронхит, хронический тонзиллит, хронический пиелонефрит, хронический аднексит), у 14 (41,2%) - заболевания щитовидной железы; у 14 (41,2%) - вегетососудистая дистония, у 12 (35,3%) больных - заболевания желудочно-кишечного тракта (хронический гастрит, язвенная болезнь желудка и двенадцатиперстной кишки, хронический холецистит, жировой гепатоз), 8 (23,6%) больных с детства страдали атопическим дерматитом, у 3 (8,8%) больных мы диагностировали витилиго. Кроме того, у 14 (41,2%) больных отмечалось несколько сопутствующих заболеваний. Достоверного влияния сопутствующих заболеваний на течение ОА не выявлено (p>0,05). Однако, установлена тенденция влияния сопутствующих заболеваний щитовидной железы на тяжесть клинических проявлений ОА ( = 0,2108, p < 0,05).
Проанализировав анамнестические данные по выявлению возможных причин заболевания, было установлено несколько групп вероятных причин. У 17 (34%) пациентов началу заболевания предшествовала психо-эмоциональное напряжение, в сроки от 2 недель до 3 - 4 месяцев до дебюта ОА. 4 (8%) пациента отметили выпадение волос после перенесенного острого респираторного заболевания (ОРЗ). У 3 (6%) больных отмечались травмы головы с сотрясением головного мозга в анамнезе. 3 (6%) пациента связывали начало ОА с обострениями имеющихся у них хронических заболеваний. 23 (46 %) больных дебют заболевания ни с чем не связывали.
В результате изучения дерматологического статуса больные были распределены на 4 группы согласно классификации тяжести ОА (Щуцкий И.В., 1988). Из 50 больных 10 (20%) (7 муж., 3 жен.) имели I ст. тяжести ОА, у них наблюдалось несколько (до 3-х) четко очерченных участков выпадения волос на волосистой части головы, бороде, округлых или неправильных очертаний от 0,5 до 5 см2; 20 (40%) (14 муж., 6 жен.) - II ст. тяжести, у которых преобладали аналогичные очаги облысения более крупных размеров, от 5 до 10 см2, по общей площади занимающие до 50% волосистой части головы, а также в области бороды, бровей, ресниц, конечностей; 13 (26%) (5 муж., 8 жен.) - III ст. тяжести, у них очаги облысения сливались между собой, занимая до 75% поверхности волосистой части головы, также локализовались на бороде и бровях, ресницы заметно разрежались; 7 (14%) (5 муж., 2 жен.) - IV ст. тяжести, у которых очагов алопеции, как таковых, мы не наблюдали, клиническая картина была представлена практически полным отсутствием волос (более 75%) на волосистой части головы (рис.1).
Рис. 1. Распределение больных по тяжести течения ОА
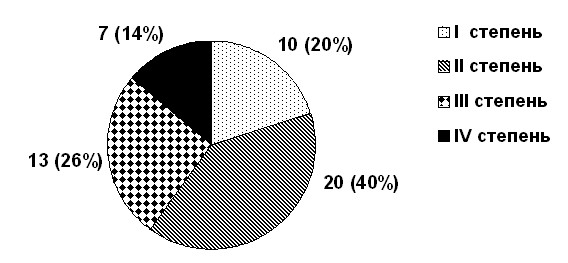
Прогрессирующая стадия ОА диагностирована у 37 (74%) больных, стационарная – у 10 (20%). У 3 больных с IV степенью тяжести стадию заболевания установить не удалось.
Дистрофические изменения ногтевых пластинок отмечались у 8 (16 %) больных, из них IV ст. тяжести ОА отмечалась у 4 больных, III - у 3-х больных, II ст. тяжести - у 1 пациента со стремительно прогрессирующим выпадением волос. Преобладало поражение ногтей в виде точечных углублений (по типу симптома «наперстка»), продольной и поперечной исчерченности, расслоения ногтя от свободного края, истончения ногтей.
Среди наблюдаемых больных у 3 (6%) ОА носила семейный характер, из них у 2 подобным заболеванием страдал один из родителей и у одного – родная сестра.
При иммунологическом обследовании определяли уровень продукции цитокинов (ИЛ-1 (pg/ml), ИЛ-2 (pg/ml), ИЛ-10 (pg/ml), ФНО- (pg/ml), TGF-b1 (ng/ml), VEGF (pg/ml) в сыворотке крови 35 больных ОА методом твердофазного иммуноферментного анализа с использованием коммерческих наборов фирм «Суtotech» (Бельгия), «eBioscience», «R&D Systems» (США). Забор крови у больных ОА производился двукратно по стандартным методикам до и после курса лечения. Для сравнения полученных результатов тот же комплекс исследований проведен у 21 практически здоровых лиц, не страдающих патологией волос и другими дерматологическими, инфекционными и хроническими заболеваниями в стадии обострения.
Для исследования качества жизни наших пациентов до и после лечения мы использовали русифицированную версию анкеты-опросника «Дерматологический индекс качества жизни» (ДИКЖ), (Dermatology Life Quality Index) – Finlay, 1994, который состоит из 10 вопросов, охватывающих различные аспекты жизни больного.
Дерматоскопическое исследование проводилось при помощи дерматоскопа DELTA 20 (Германия) и SLR- фотоадаптера для фотокамеры Canon EOS 500D c разрешением 15 Mps. Диаметр контактной платы дерматоскопа составляет 23 мм. Для работы с фотоснимками использовались программы «ACDSee 4.0 for Windows».
Комбинированная терапия больных ОА
Пациентам ОА, в зависимости от тяжести течения заболевания, были предложены 2 схемы комбинированной терапии.
В 1-ю группу вошли 43 больных, среди которых было 10 (23,3%) пациентов с I ст. тяжести ОА, 20 (46,5%) - со II ст. тяжести и 13 (30,2%) - с III ст. тяжести получавших комбинированную терапию, включающую локальную ПУВА-терапию и внутриочаговые введения ГКС.
2-ю группу составили 7 больных с IV ст. тяжести ОА, которые получали комбинированную терапию, включающую общую ПУВА-терапию с пероральным применением оксаралена и внутримышечные инъекции ГКС.
В нашем исследовании мы использовали парентеральный комбинированный глюкокортикостероидный препарат дипроспан. При выборе препарата мы руководствовались его эффективностью и безопасностью по сравнению с другими системными стероидами.
Пациентам 1-ой группы дипроспан в очаги облысения вводили методом внутрикожных инъекций из расчета 0,1 - 0,2 мл на 1 - 2 см2 очага поражения, с интервалом в 7 – 10 дней. Курс лечения составлял в среднем 6 – 10 процедур.
Локальная ПУВА-терапия проводилась с использованием кабин для локального ультрафиолетового облучения PUVA-180 и PUVA-200 (Waldman, Германия), по методике 3-4-х разового облучения в неделю с начальной дозы 0,5 Дж/см2, осторожно увеличивая дозу УФА на 0,5 Дж/см2. В качестве фотосенсибилизатора использовали 0,3% раствор аммифурина (Россия). Количество сеансов ПУВА-терапии составляло – 21±6, с суммарной дозой УФА от 22 Дж/см2 до 42 Дж/см2. Продолжительность курса составляла от 1,5 до 3 месяцев.
Пациентам 2-ой группы дипроспан вводили внутримышечно с интервалом в 10 – 14 дней. Также больные данной группы получали необходимую корригирующую терапию.
Общая ПУВА-терапия проводилась с использованием кабин для общего ультрафиолетового облучения «Waldmann UV7001K» (Германия), по методике 3-4-х разового облучения в неделю. Начинали общую ПУВА-терапию с дозы УФА 0,5 Дж/см2 с последующим увеличением дозы на 0,5-1 Дж/см2 в зависимости от типа кожи и переносимости лечения. В качестве фотосенсибилизатора использовали оксорален (США). Количество сеансов общей ПУВА-терапии составило – 25±5 с суммарной дозой УФА от 31,5 Дж/см2 до 46 Дж/см2. Продолжительность курса составляла от 2,5 до 3 месяцев.
Эффективность лечения проводили, фиксируя следующие параметры:
- Клинические критерии: состояние клинической ремиссии, значительное улучшение, улучшение, без эффекта. Под состоянием клинической ремиссии понимали активный рост терминальных волос в очагах поражения, т.е. полное зарастание очагов волосами и отсутствие зоны «расшатанных» волос. Значительное улучшение – стойкая положительная динамика, характеризующаяся косметически приемлемым восстановлением роста волос не менее чем на 2/3, исчезновением зоны «расшатанных» волос. Улучшение – медленная динамика процесса, характеризующаяся уменьшением очага(-ов) облысения при отсутствии зоны «расшатанных» волос и наличии псевдовеллюсных волос.
- Дерматоскопические маркеры: уменьшение количества желтых, черных точек, волос в форме «восклицательного» знака и рост псевдовеллюсных волос.
- Оценка качества жизни больного ОА.
Данные комплексных исследований сопоставляли с клиническими проявлениями ОА. Клиническая оценка эффективности лечения объективизировалась результатами дерматоскопических, иммунологических исследований.
Для статистической обработки полученных данных использовались методы параметрической и непараметрической статистики. Для проведения корреляционного анализа пользовались коэффициентом ранговой корреляции Спирмена. Достоверность различий между данными рассчитывалась с помощью коэффициента Стьюдента (t) для параметрических величин. В качестве достоверного критерия различий рассматривался p<0,05. Характер корреляционных связей представляли по рассчитываемому коэффициенту корреляции (направление связи + прямая, – обратная), сила связи (от 0 до 1): 1,0–– 0,7 связь сильная; 0,7–– 0,3 связь средняя; 0,3 – 0; связь слабая; 0 –– связь отсутствует. Все расчеты проводились с использованием пакета прикладных программ «SТАТISТICА 6.0» [StatSoft Inc., 2001], "Microsoft Office Excel 2003".
Результаты исследования
Определение уровня выработки про- и противовоспалительных цитокинов (ИЛ-1, ФНО, ИЛ-2, ИЛ-10) у больных ОА до и после комбинированной терапии.
В нашем исследовании у больных 1-ой и 2-й группы до начала терапии мы выявили статистически достоверное увеличение уровня ИЛ-1 и ФНО на фоне понижения ИЛ-10. При этом ИЛ-2 у больных 1-й группы был сопоставим с контрольными значениями (8,7±1,4 pg/ml) (табл.1).
Таблица 1. Сравнительная оценка сывороточных цитокинов у больных ОА до и после комбинированной терапии
| Цитокины | Контроль (N=21) | Группы больных ОА | до/после лечения | |
| 1-я (N=29) | 2-я (N=6) | |||
| ИЛ-10 pg/ml | 9,2 ±1,2 | 5,2 ±0,1 10,9 ±2,0** | 4,8 ±0,6 7,8 ±1,5*** | До лечения После |
| ИЛ-2 pg/ml | 7,8 ±3,1 | 8,7 ±1,4 8,2 ±2,7 | 12,2±0,3 7,9 ±1,7** | До лечения После |
| ИЛ-1 pg/ml | 25,0 ±1,6 | 70,9 ±1,5 23,9 ±1,4** | 81,3 ±3,7 21,5 ±2,6*** | До лечения После |
| ФНО- pg/ml | 18,6 ±2,4 | 59,9 ±2,5 19,3 ±2,9** | 58,1 ±2,8 15,2 ±1,5*** | До лечения После |
* - достоверное отличие от контроля (р<0,05)
** - достоверное отличие по сравнению с исходным уровнем (р<0,05)
После лечения у больных 1-й группы отмечалось повышение ИЛ-10 в 2 раза относительно исходного уровня (10,9±2,0 и 5,2±0,1 pg/ml), при этом его средние концентрации стали несколько превышать контрольные значения. Средние концентрации противовоспалительных цитокинов ИЛ-1 и ФНО- достоверно уменьшались, в 3 и 3,7 раза соответственно, по сравнению с исходными показателями, и стали сопоставимы с контрольными значениями (23,9 ±1,4 и 19,3 ±2,9 pg/ml). Статистически значимой динамики уровня ИЛ-2 мы не наблюдали. У больных 2-й группы с тяжелым течением ОА отмечалось максимальное снижение противовоспалительных цитокинов ИЛ-2, ИЛ-1 и ФНО- при сравнении с исходными значениями, при этом уровни ИЛ-1 и ФНО- снизились почти в 4 и стали несколько ниже контрольных значений (21,5±2,6 и 15,2±1,5 pg/ml). ИЛ-2 стал сопоставим с контрольными значениями (7,9±1,7 pg/ml). Средний уровень ИЛ-10 увеличился в 1,6 раза, но оставался ниже референтных значений (7,8 ±1,5 pg/ml) (табл.1).
При изучении соотношения цитокинов, которые объективно показывают дисбаланс про- и противовоспалительных цитокинов у больных ОА до начала терапии, в обеих группах отмечалась девиация цитокинового профиля, однако наиболее выражена она у пациентов 2-й группы: ИЛ-2 в 2,5 раза преобладал над ИЛ-10, ИЛ-1 в 17 раз над ИЛ-10, а ФНО - в 12 раз (табл. 2).
После лечения у пациентов 1-й и 2-й группы соотношение про- и противовоспалительных цитокинов стали сопоставимы с референтными значениями (табл. 2).
Таблица 2. Показатели соотношения про- и противовоспалительных цитокинов у больных ОА до и после терапии
| Группы больных ОА До/после терапии | Отношение про- к противовоспалительным цитокинам | ||
| ИЛ 2/ИЛ10 | ИЛ-1/ИЛ10 | ФНО/ИЛ10 | |
| 1-я (N=29) До После | 1,7 ±1,2 0,7 ±0,2 | 13,6 ±1,5 2,2 ±0,7 | 11,5 ± 2,3 1,8 ±0,5 |
| 2-я (N=6) До После | 2,5 ±0,8 0,6 ±0,08 | 17,0± 2,9 1,7 ±0,3 | 12,1 ±1,7 1,2 ±0,09 |
| Контроль | 0,8 ±0,2 | 2,7 ±0,5 | 2,0 ±0,6 |
Таким образом, нами установлено, что девиация цитокинового профиля по Tх-1 пути клеточного иммунитета, выражающаяся в повышении уровня ИЛ-1, ФНО и ИЛ-2, свойственна всем больным ОА, при этом наиболее выраженной она оказалась у больных 2-й группы с тяжелым течением.
Под влиянием комбинированной терапии происходила коррекция иммунного статуса в виде снижения продукции провоспалительных цитокинов. Обобщая результаты исследования, можно сделать вывод, что применение комбинированного метода с использованием ПУВА-терапии и ГКС оказывало иммуносупрессивное действие и способствовало исправлению дефектов клеточного звена иммунитета, как у больных 1-й группы с легким и средне-тяжелым течением, так и у больных 2-й группы с тяжелым течением ОА.
Следующим этапом нашей работы было определение выработки трансформирующего фактора роста (TGF-b) и фактора роста сосудистого эндотелия (VEGF) у больных с разной степенью тяжести ОА до и после лечения.
До начала терапии мы обнаружили достоверное снижение ТGF-b по сравнению с контрольными значениями у всех больных. При этом у больных со II и III ст. тяжести его значения были сопоставимы (34,4±2,2 и 34,1±1,9), а наибольшая разница с контролем отмечалась у больных с IV ст. тяжести ОА (33,5±1,7). Уровень VEGF также был достоверно ниже контрольных значений у всех больных, однако, максимально низкие концентрации отмечались у больных с I ст. тяжести ОА (237,0±41,9). Корреляционный анализ связи между уровнем VEGF и степенью тяжести ОА выявил корреляционную прямую зависимость между этими параметрами (=0,395; p<0,05), установив, что чем легче степень тяжести ОА тем ниже сывороточные концентрации VEGF (табл. 3).
Таблица 3. Показатели факторов роста в сыворотке крови больных ОА в зависимости от тяжести процесса до лечения
| Факторы роста (X±m) | Степень тяжести ОА | ||||
| I (N=6) | II (N=14) | III (N=9) | IV (N=6) | Контроль (N=21) | |
| TGF-b ng/ml | 36,0* ±3,1 | 34,4* ±2,2 | 34,1* ±1,9 | 33,5* ±1,7 | 45,3 ± 2,4 |
| VEGF pg/ml | 237,0* ±41,9** | 280,4* ±22,1 | 302,1* ±42,2 | 309,7* ± 34,4 | 363,2±4 8,3 |
* - достоверное отличие от контроля (р<0,05)
** - достоверное отличие по сравнению с другой группой (р<0,05)
Исследование сывороточных концентраций TGF-b и VEGF в зависимости от продолжительности рецидива ОА показало их достоверное понижение относительно контрольных значений. При этом наибольшая разница TGF-b с контролем отмечалась в группе с продолжительностью рецидива от 3 до 6 месяцев (32,5±2,7). А показатели VEGF максимально были снижены в группах с давностью ОА до 3 и от 3 до 6 месяцев. Использование коэффициента корреляции Спирмена позволило выявить прямую зависимость между уровнем VEGF и продолжительностью рецидива (=0,541; p<0,05), т.е. чем продолжительнее рецидив ОА, тем выше концентрация VEGF (табл.4).
Таблица 4. Показатели факторов роста в сыворотке крови больных ОА в зависимости от продолжительности рецидива ОА
| Факторы роста (X±m) | Продолжительность рецидива ОА (месяцы) | |||
| <3 (N=5) | 3 - 6 (N=13) | > 6 (N=11) | Контроль (N=21) | |
| TGF-b ng/ml | 37,2 * ±5,3 | 32,5* ±2,7 | 36,1* ±1,9 | 45,3 ±2,4 |
| VEGF pg/ml | 244,9* ± 44,3 | 269,5* ± 30,7 | 339,2±41,7** | 363,2 ±48,3 |
* - достоверное отличие от контроля (р<0,05)
** - достоверное отличие по сравнению с другой группой (р<0,05)
После проведения комбинированной терапии у всех больных уровни TGF-b и VEGF увеличились относительно исходных значений, приближая их к контрольным значениям. Однако у больных IV ст. тяжести ОА содержание VEGF составило 316,3±34,1 pg/ml и не отличалось достоверно от исходного содержания (309,7±34,4 pg/ml), оставаясь достоверно ниже контрольных значений, что может свидетельствовать о более стойком нарушении сосудистого компонента в патогенезе ОА у больных с IV ст. тяжести (табл. 5).
Таблица 5. Сравнительная оценка факторов роста у больных с разной степень тяжести ОА до и после проведения комбинированной терапии
| Степень тяжести ОА / До/После лечения | Факторы роста (X±m) | |
| TGF-b ng/ml | VEGF pg/ml | |
| I До (N=6) После | 36,0 ± 3,1 52,1 ± 4,6*** | 237,0 ± 41,9 350,7 ± 32,2** |
| II До (N=14) После | 34,4* ± 2,2 49,2 ± 3,2** | 280,4 ± 22,1 344,5 ± 25,7** |
| III До (N=9) После | 34,1 ± 1,9 44,0 ± 3,6** | 302,1 ± 42,2 345,6 ± 40,6** |
| IV До (N=6) После | 33,5 ± 1,7 40,3 ± 1,5*** | 309,7 ± 34,4 316,3 ± 34,1* |
| Контроль (N=21) | 45,3 ± 2, 4 | 363,2 ± 48,3 |
* - достоверное отличие от контроля (р<0,05)
** - достоверное отличие по сравнению с исходным уровнем (р<0,05)
Таким образом, у больных ОА отмечается достоверное снижение уровня TGF-b. Проведенный корреляционный анализ выявил, что чем продолжительнее рецидив ОА, тем выше уровень VEGF в сыворотке крови больных. А также чем легче степень тяжести ОА тем ниже сывороточные концентрации VEGF. Данная связь может свидетельствовать о нарушении ангиогенеза волосяных фолликулов у больных на ранних стадиях развития ОА, что не противоречит данным литературы, что патологические изменения затрагивают не только волосяные фолликулы, но и соединительнотканные структуры дермы, в первую очередь, кровеносные микрососуды (Цветкова Г.М. и соавт.,1999; Whiting D.A., 2003).
Результаты дерматоскопического исследования.
Поскольку в настоящее время неинвазивные методы исследования в дерматологической практике занимают все более ведущие позиции, всем нашим пациентам мы провели дерматоскопическое исследование очагов алопеции и кожи вокруг до и в процессе лечения. Исследование включало определение основных дерматоскопических признаков ОА ( желтые и черные точки, волосы в форме «восклицательного знака», псевдовеллюсные (миниатюризованные) волосы, количество которых визуально подсчитывали в нескольких зонах и определяли среднее значение для каждого пациента.
Таблица 6. Дерматоскопическая картина очагов у больных разных групп до начала терапии
| Признаки ОА | Группы лечения | |
| №1 (N=43) | №2 (N=7) | |
| Желтые точки | 23,1±6,9 | 1,3±0,6 |
| Черные точки | 3,4±0,7 | 2,1±0,3 |
| Волосы в форме «восклицательного» знака | 5,1±0,1 | 1,7±0,4 |
| Миниатюризованные волосы | 1,2±0,2 | 1,1±0,2 |
У больных 1 группы, состоящих из пациентов I, II, III ст. тяжести ОА, число желтых точек было наибольшим (23,1±6,9 и 22,0±6,1). Подобная дерматоскопическая картина может свидетельствовать о наличии сохранного фолликулярного аппарата с сальными железами, продолжающими продуцировать секрет. У больных 2 группы, состоящей из пациентов IV ст. тяжести ОА, данный признак достоверно снижался почти в 18 раз (1,3±0,6). Анализируя последующие признаки, мы наблюдали аналогичную закономерность, преобладание количества признаков (черных точек, волос в форме «восклицательного знака» и миниатюризованных волос) у больных 1 группы в отличие от больных 2-й группы. В данном случае дерматоскопическая картина совпадала с клинической, так как у большинства больных с IV ст. тяжести ОА кожа в очагах поражения истончена, фолликулярный рисунок слабо выражен, часто отмечалось просвечивание расширенных сосудов (табл.6).
В прогрессирующей стадии ОА число желтых точек в 1,5 раза больше чем в стационарной стадии процесса (22,4±4,3 и 15,1±4,0). Количество черных точек и волосы в форме «восклицательного» знака, также статистически значимо преобладали в прогрессирующую стадию (3,7±0,5 и 5,3±0,7, против 1,9±0,4 и 2,2±0,6), тогда как миниатюризованные волосы достоверно не отличались (1,1±0,2 и 1,3±0,6). Таким образом, дерматоскопические признаки: желтые и черные точки, волосы в форме «восклицательного» знака достоверно увеличены при прогрессировании ОА, что не противоречит данным литературы (табл.7).
Таблица 7. Дерматоскопическая картина очагов у больных в зависимости от стадии ОА
| Признаки ОА | Стадии ОА | Р | |
| Прогрессирующая (N=37) | Стационарная (N=10) | ||
| Желтые точки | 22,4±4,3 | 15,1±4,0 | <0,05 |
| Черные точки | 3,7±0,5 | 1,9±0,4 | <0,05 |
| Волосы в форме «восклицательного» знака | 5,3±0,7 | 2,2±0,6 | <0,05 |
| Миниатюризованные волосы | 1,1±0,2 | 1,3±0,6 | >0,05 |
Дерматоскопическое исследование, проводимое на 3-й недели терапии, показало, что у пациентов 1-й группы, которым проводилась локальная ПУВА-терапия и внутриочаговые введения ГКС отмечалось уменьшение числа желтых точек в 1,4 раза по сравнению с исходными показателями, черных точек – в 1,3 раза, а волосы в форме «восклицательного» знака уменьшились в 2,3 раза. При этом миниатюризованные волосы, наоборот, увеличились в 10,3 раза. Во 2-й группе, где проводилось общая ПУВА-терапия и внутримышечные инъекции ГКС, число желтых и черных точек уменьшилось в 1,1 раза, волосы в форме «восклицательного» знака уменьшились в 1,5 раза и число миниатюризованных волос возросло в 7,2 раза по сравнению с исходными показателями (табл. 8).
Таблица 8. Дерматоскопическая картина очагов у больных разных групп в процессе лечения
| Признаки ОА | Группы лечения | |
| №1 (N=43) | №2 (N=7) | |
| Желтые точки | 16,2±6,1 (1,4) | 1,2±0,2 (1,1) |
| Черные точки | 2,6±0,6 (1,3) | 1,9±0,5 (1,1) |
| Волосы в форме «восклицательного» знака | 2,2±0,7 (2,3) | 1,1±0,2 (1,5) |
| Миниатюризованные волосы | 12,4±3,6 (10,3) | 7,9±2,2 (7,2) |
Таким образом, улучшение дерматоскопической картины ОА наступило у всех больных, но более выраженным оно было у больных 1-й группы.
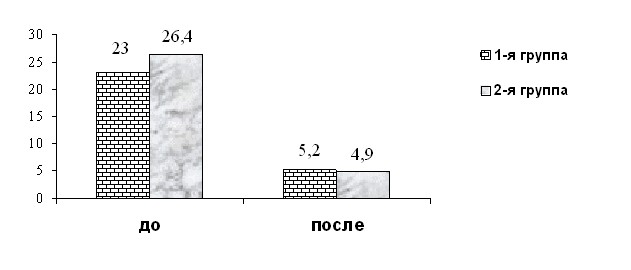
Результаты ДИКЖ у наблюдаемых пациентов до лечения значительно разнились. Средние показатели ДИКЖ у больных 1-й группы составили 23,0±2,1 балла; у больных 2-й - 26,4±2,5. После проведенной терапии отмечалось снижение ДИКЖ (повышение качества жизни) в обеих группах: в 1-й (I, II и III ст. тяжести) - более чем в 4 раза, а во 2-й группе (IV ст. тяжести) – более чем в 5 раз. Причем, проводя корреляционный анализ методом Спирмена между тяжестью течения ОА и показателями ДИКЖ, т.е. угнетением качества жизни пациента, выявлена прямая корреляционная связь (=0,3708, p<0,05).
Таким образом, комбинированная терапия с использованием ПУВА и ГКС существенно повысила качество жизни наших больных (рис.2).
Рис. 2. Среднегрупповые показатели ДИКЖ у больных ОА до и после лечения
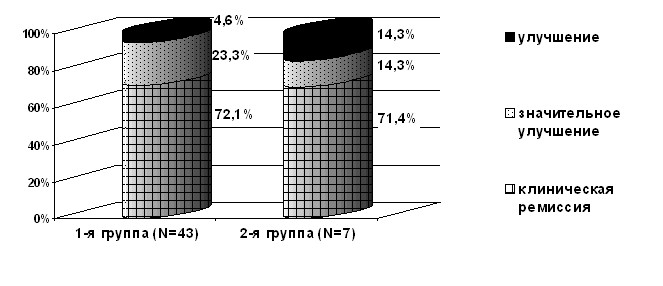
В результате комбинированной терапии у всех больных отмечался выраженный положительный эффект: клиническая ремиссия была достигнута у 36 (72%) больных, значительное улучшение – у 11 (22%) и улучшение – у 3 (6%) больных. Клинической ремиссия отмечалась у 31 (72,1%) больных 1-й группы и у 5 (71,4%) больных – 2-й группы. Значительное улучшение наблюдалось у 10 (23,3%) больных 1-й группы и у 1 (14,3%) больного - 2-й группы. Улучшение в 1-й группе достигнуто у 2 (4,6%) и во 2-й группе у одного (14,3%) пациента (рис. 3).
Рис. 3. Оценка эффективности комбинированной терапии у больных ОА разных групп
Проводимая терапия, вне зависимости от схемы, в целом переносилась нашими пациентами хорошо. Ухудшения и/или осложнений при проведении лечения не было отмечено. Среди побочных эффектов можно отметить появление эритемы у 3 (7%) больных 1-й группы, которую мы расценивали как фототоксическую реакцию, которая свидетельствовала о правильном подборе дозы облучения. Во 2-й группе у 1 пациента (14,3%) отмечалось умеренное повышение печеночных ферментов в крови, которое пришло в норму при назначении гепатопротекторов.
Отдаленные результаты терапии прослежены у 29 пациентов в течение 1,5 лет, у 15 – в течение 1 года и у 6 - в течение 6 месяцев. Из них рецидив заболевания наступил у 13 (26%) больных и у 4 (8%) пациентов мы наблюдали 2 рецидива ОА за время диспансерного наблюдения.
У больных 1-й группы наличие одного рецидива отмечалось у 11 (25,6%) пациентов, 2 рецидива произошло у 3 (7%) пациентов, у остальных 29 (67,4%) сохранялось состояние клинической ремиссии. У больных 2-й группы состояние клинической ремиссии отмечалось у 4 (57,1%) больных, 1 рецидив отмечался у 2 (28,6%) больных, 2 рецидива – у одного (14,3%) больного.
При оценке продолжительности ремиссии мы наблюдали, что у пациентов 1-й группы (23,3% - I ст., 46,5% - II cт., 30,2% - III ст. тяжести ОА), которым была проведена локальная ПУВА-терапия и внутриочаговые введения ГКС, ремиссия достоверно увеличилась в 2,3 раза (11,2±2,3 мес.) по сравнению с предыдущими ремиссиями (4,9±1,8 мес.). У пациентов 2-й группы, после проведения общей ПУВА-терапии и внутримышечных инъекций ГКС, ремиссия увеличилась в 1,6 раза (4,1±0,8) и стала 6,7±1,2 мес. Следовательно, комбинированная терапия увеличила среднегрупповой межрецидивный период у всех больных.
Таким образом, результаты комбинированной терапии, позволившей добиться клинической ремиссии у 72% больных, включая III и IV ст. тяжести ОА, подтверждаются положительной динамикой объективных показателей ДИКЖ до и после окончания терапии у всех больных в виде значительного улучшения качества жизни, а также увеличением продолжительности ремиссии почти в 2 раза. В процессе комбинированной терапии наблюдается положительная динамика дерматоскопической картины очагов алопеции в виде уменьшения патологических признаков (желтые, черные точки и волосы в виде «восклицательного» знака) и увеличения роста псевдовеллюсных и пигментированных волос.
ВЫВОДЫ
- У больных ОА повышаются уровни сывороточных провоспалительных цитокинов (ИЛ-2, ИЛ-1, ФНО-) на фоне сниженного противовоспалительного ИЛ-10. Под влиянием комбинированного лечения с использованием ПУВА-терапии и ГКС в сыворотке крови больных происходит коррекция баланса указанных цитокинов, что позволяет нам сделать вывод, что проведенное лечение обладает иммуносупрессивным действием и способствует исправлению дефектов клеточного звена иммунитета.
- Изучение роли трансформирующего фактора роста (ТGF-b) и фактора роста сосудистого эндотелия (VEGF) в патогенезе ОА показало достоверное снижение их уровней в сыворотке крови больных ОА. При проведении корреляционного анализа обнаружена прямая корреляционная связь между исходным уровнем VEGF и продолжительностью рецидива (=0,541; p<0,05) и степенью тяжести ОА (=0,395; p<0,05), т.е чем продолжительнее рецидив ОА, тем выше исходная концентрация VEGF, а также чем легче степень тяжести ОА, тем ниже уровень продукции VEGF.
- Комбинированная терапия способствует положительной динамике дерматоскопических признаков, количественное соотношение которых определяют трихоскопическую характеристику стадии процесса. В процессе комбинированной терапии отмечается уменьшение патологических признаков (желтые, черные точки и волосы в виде «восклицательного» знака) и увеличения роста псевдовеллюсных и пигментированных волос.
- Разработана методика комбинированного лечения больных с различными формами ОА. Схема комбинированного лечения ОА с использованием ПУВА-терапии и введения глюкокортикостероидов является эффективной, безопасной и патогенетически обоснованной, позволяющей добиться клинической ремиссии и значительного улучшения у 72% и 22% больных соответственно. На основании катамнестических данных показано, что комбинированная терапия в два раза увеличивает длительность ремиссии.
Практические рекомендации
- Проведение иммуносупрессивной терапии показано больным ОА с девиацией цитокинового профиля, а также при снижении уровней ТGF-b и VEGF в сыворотке крови больных.
- Больным I, II, III степени тяжести ОА показано проведение комбинированной терапии, включающей курс локальной ПУВА-терапии и внутриочаговые введения ГКС.
- Больным IV степени тяжести ОА целесообразно проводить терапию, состоящую из курса общей ПУВА-терапии и системного применения ГКС.
- Противопоказаниями к проведению комбинированной терапии у больных ОА являются противопоказания к назначению ГКС и УФА облучения.
- Целесообразно проведение дерматоскопического исследования для оценки тяжести течения и в качестве дополнительного критерия эффективности в процессе терапии больных ОА.
Список научных работ опубликованных по теме диссертации
- Олисова О.Ю., Верхогляд И.В., Гостроверхова И.П. Современные представления об этиологии, патогенезе и лечении очаговой алопеции. // Российский журнал кожных и венерических болезней». – 2010. - №1. – С. 48 – 52.
- Олисова О.Ю., Верхогляд И.В., Гостроверхова И.П. Лечение гнездной алопеции (Обзор). // Пластическая хирургия и косметология. – 2010. - №3. – С. 451 – 457.
- Олисова О.Ю., Смирнов К.В., Гостроверхова И.П. Сочетание ПУВА-терапии и внутриочагового введения дипроспана в лечении очаговой алопеции. // Сборник статей научно-практической конференции дерматологов Центрального федерального округа РФ «Актуальные вопросы дерматовенерологии и дерматоонкологии». – Москва, 27 – 28 мая 2010 г. – С. 78 – 80.
- Олисова О.Ю., Смирнов К.В., Гостроверхова И.П. К вопросу этиологии и патогенеза очаговой алопеции. // Тезисы докладов II-ой Всероссийской научно-практической конференции «Современные аспекты дерматовенерологии». – Москва, 2 – 3 декабря 2010 г. – С. 49 – 50.
- Гостроверхова И.П., Олисова О.Ю., Кушлинский Н.Е. Роль факторов роста в патогенезе очаговой алопеции. // Сборник статей научно-практической конференции дерматологов Центрального федерального округа РФ «Актуальные вопросы дерматовенерологии и дерматоонкологии». – Москва, 26 – 27 мая 2011 г. – С. 113 – 116.
- Гостроверхова И.П., Олисова О.Ю., Смирнов К.В. Комбинированная терапия очаговой алопеции. // Экспериментальная и клиническая дерматокосметология. – 2011. – № 6. – С. 12 – 16.
Список сокращений и условных обозначений
ОА – очаговая алопеция
ВФ – волосяной фолликул
ГКС - глюкокортикостероиды
ИЛ – интерлейкин
ng/ml – нанограммов/миллилитр
pg/ml – пикограммов/миллилитр
ПУВА – сочетанное применение фотосенсибилизаторов группы псораленов с длинноволновым ультрафиолетовым излучением (УФА)
рис. – рисунок
табл. – таблица
ТGF-b – трансформирующий фактор роста бетта
ФНО-– фактор некроза опухоли альфа
ФХТ - фотохимиотерапия
VEGF – фактор роста эндотелия сосудов

