Клинико-экспертные критерии для минилапар о томной холецистэктомии у бол ь ных с желчнокаменной болезнью
На правах рукописи
АНГИЛОВ ВАСИЛий Александрович
Клинико-экспертные критерии
для минилапаротомной холецистэктомии
у больных с желчнокаменной болезнью
14.01.17 – хирургия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Ставрополь, 2010
Работа выполнена в ГОУ ВПО «Ставропольская государственная медицинская академия министерства здравоохранения и социального развития»
| Научный руководитель: | доктор медицинских наук Греясов Виктор Иванович |
| Официальные оппоненты: | доктор медицинских наук, профессор Оноприев Александр Владимирович |
| доктор медицинских наук, профессор Вафин Альберт Закирович | |
| Ведущая организация: | Воронежская государственная медицинская академия им. Н.Н. Бурденко |
Защита состоится « _25__»__февраля________ 2010 года в _____часов на заседании диссертационного совета Д 208.098.01 при ГОУ ВПО «Ставропольская государственная медицинская академия» Министерства здравоохранения и социального развития (355017, Ставрополь, ул. Мира, 310).
С диссертацией можно ознакомиться в библиотеке Ставропольской государственной медицинской академии.
Автореферат разослан «_____»______________2010 г.
Ученый секретарь
диссертационного совета
Д 208.098.01
доктор медицинских наук,
профессор А.С. Калмыкова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. Желчнокаменная болезнь – одно из самых распространенных заболеваний, требующих хирургического вмешательства (В.С.Савельев, 1991; Н.Н. Малиновский, 1994; Кубышкин В.А. и соавт, 1997; Ю.И. Галлингер и соавт. 1999; С.Т. Шаповальянц и соавт. 1999).
Основным методом лечения желчнокаменной болезни является операция холецистэктомия, которая до настоящего времени является «золотым стандартом» в лечении больных с этой патологией. За последние десятилетия методы хирургического лечения желчнокаменной болезни претерпели существенные изменения. С начала 80-х годов начали активно развиваться операции из малых доступов.
Преимущества различных вариантов малоинвазивных холецистэктомий, заключающихся в существенном улучшении течения ближайшего послеоперационного периода, сокращении сроков госпитализации больных, снижении частоты развития возможных осложнений лапароскопической холецистэктомии и малоинвазивных холецистэктомий, получили достаточное освещение в литературе (Ю.И. Галлингер, 1992; А.С. Балалыкин, 1995). Несмотря на широкое применение малоинвазивных технологий в хирургии до сих пор нет четкого теоретического обоснования выбора рациональных доступов и хирургических приемов, топографо-анатомических аспектов вмешательств. Необходимость улучшения качества оперативного лечения больных с желчнокаменной болезнью диктует совершенствование оценочных критериев сложности операций, а также применение оптимальных приемов при выполнении операций, базирующихся на индивидуальных особенностях области вмешательства - желчного пузыря - у больных различного телосложения.
Для оценки состояния желчного пузыря и желчевыделительной системы УЗИ остается главным базовым диагностическим методом, помогающим определить с высокой вероятностью точность расположения дна желчного пузыря, проектирование места желчного пузыря на переднюю брюшную стенку и расположение печени. Наиболее широко об этом написано А.Ю. Созон-Ярошевичем (1954.) в монографии «Анатомо-клинические обоснования хирургических доступов к внутренним органам».
Таким образом, следует отметить, что дальнейшее усовершенствование эндохирургии и повышение безопасности малоинвазивных холецистэктомий невозможно без новых рациональных подходов к улучшению сравнительных клинических и топографо-анатомических данных.
Цель исследования
Улучшение результатов мини-лапаротомной холецистэктомии у больных с желчнокаменной болезнью путем выбора оптимального хирургического доступа.
Задачи исследования:
1. Изучить топографо-анатомические данные для выбора рационального доступа к желчному пузырю, его шейке, протоку, используя данные сонографии.
2. Разработать на основании полученных данных математическую модель операционного доступа.
3. Используя математическую модель и данные дооперационного УЗ-сканирования, произвести оценку выполнимости минихолецистэктомии с различными типами телосложения из стандартного доступа.
4. Изучить влияние предложенного клинико-экспертного подхода при отборе пациентов на частоту возникновения осложнений.
Научная новизна исследования
Впервые разработан алгоритм отбора больных с желчнокаменной болезнью для минихолецистэктомии с индивидуальным выбором методики оперативного лечения в зависимости от типа телосложения.
В качестве эффективного оценочного критерия, позволяющего на дооперационном этапе прогнозировать выполнимость холецистэктомии из мини-доступа, использованы данные сонографии. Впервые выявлена закономерность проецирования важнейших анатомических структур (шейки и дна пузыря) на переднюю брюшную стенку в зависимости от типа телосложения.
Разработана и апробирована в реальных клинических условиях математическая модель хирургического доступа. На основании данных математического моделирования создано компьютерное приложение, которое позволяет до проведения разреза на коже не только оценить возможность выполнения МХЭ в каждом конкретном случае, но и подобрать наиболее рациональный хирургический доступ.
Преимущество предложенной методики убедительно доказывает улучшение основных клинических показателей: достоверно снизилось в 1,9 раза количество общих койко-дней; послеоперационных койко-дней - в 2,2 раза, уменьшилась общая продолжительность оперативного вмешательства с 2,1 до 1,2 часа, частота конверсий - с 12,3% до 3,2%, понизился общий уровень летальности.
Практическая значимость
Результаты проведенного исследования имеют важное значение для хирургии и практического здравоохранения в целом.
Изучены особенности клинического течения послеоперационного периода после МХЭ, динамика изменения важнейших клинических показателей, данных УЗ-сканирования. Выявленные закономерности проецирования важнейших анатомических структур гепатобилиарной зоны у пациентов с различным типом телосложения на переднюю брюшную стенку позволяют существенно улучшить ближайшие и отдаленные результаты лечения больных с этой патологией, снизить количество конверсий в 4 раза.
Врачам-хирургам практического здравоохранения предложен принципиально новый метод, включающий современные медицинские технологии, основывающийся на данных математического моделирования, который позволяет существенно повысить качество и результаты лечения больных с желчнокаменной болезнью: уменьшить сроки пребывания в стационаре, частоту конверсий, неблагоприятных исходов заболевания.
Личный вклад автора в исследование. Диссертантом лично осуществлен поиск литературы по изучаемой проблеме и составлен подробный обзор литературы, охватывающий хирургические аспекты желчнокаменной болезни. Лично автором проведен сбор и анализ жалоб, анамнеза жизни, клиническое наблюдение и обследование больных. Подавляющее число оперативных вмешательств, описанных в исследовании проведено также лично автором работы. Автором лично проведен анализ полученных результатов на основе статистической обработки, им сделаны обоснованные выводы и практические рекомендации, которые логично вытекают из существа данных и полностью соответствуют содержанию работы.
Основные положения, выносимые на защиту:
- Проведенными исследованиями установлено, что у пациентов с различным типом телосложения имеются индивидуальные особенности проекции важнейших анатомических структур (шейки и дна желчного пузыря) на переднюю брюшную стенку.
- Возможность применения методов математического моделирования для дооперационного прогнозирования выполнимости операции из мини-доступа.
- Применение рационального клинико-экспертного подхода при отборе пациентов для проведения МХЭ позволяет снизить частоту послеоперационных осложнений и летальности у больных с ЖКБ.
Внедрение результатов исследования
Научно обоснованный подход, основанный на данных дооперационного обследования и особенностях конституции пациентов, внедрен в практику работы хирургического отделения № 1 Ессентукской городской больницы, хирургического отделения ГУЗ СККЦ СВМП.
Полученные данные используются на лекциях и практических занятиях с врачами-интернами, клиническими ординаторами и курсантами кафедр хирургических болезней и эндохирургии факультета последипломного и дополнительного образования, хирургических болезней №1 с курсом поликлинической хирургии, общей хирургии, хирургических болезней педиатрического и стоматологического факультетов с курсом урологии Ставропольской государственной медицинской академии.
Публикации и апробация работы
Материалы диссертационного исследования доложены и обсуждены на международном хирургическом конгрессе «Новые технологии в хирургии» (г. Ростов-на-Дону, 2005); второй межобластной конференции хирургов «Минимально инвазивная хирургия на современно этапе» (Саратов, 2006); на третьем международном хирургическом конгрессе «Научные исследования в реализации программы «Здоровье населения России» (Москва, 2008); втором съезде хирургов Южного федерального округа (Пятигорск, 2009); совместном заседании кафедр хирургического профиля Ставропольской государственной медицинской академии (г. Ставрополь, 2009).
Материалы диссертационного исследования опубликованы в 6 печатных работах, в том числе 1 работа опубликована в журнале, рекомендованном ВАК Министерства образования и науки РФ.
Диссертационное исследование выполнено на кафедре хирургических болезней и эндохирургии факультета последипломного и дополнительного образования Ставропольской государственной медицинской академии, на базе хирургического отделения № 1 Ессентукской городской больницы в соответствии с планом НИР Ставропольской государственной медицинской академии в рамках государственной отраслевой программы № 31 «Хирургия».
Номер государственной регистрации 012000953816.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования. Клинические данные основаны на материале, полученном при обследовании больных c желчно-каменной болезнью (ЖКБ) в возрасте от 19 до 66 лет, находившихся на стационарном лечении в хирургическом отделении № 1 Ессентукской городской больницы с 2000 по 2006 год.
Контрольную группу составил 281 пациент с ЖКБ, оперированный с применением комплекса «Миниассистент» согласно стандартизированным методикам без учета анатомо-топографических особенностей. При этом у подавляющего большинства пациентов это приводило к неизбежным конверсиям, увеличивало риск интраоперационных и послеоперационных осложнений.
Основная группа представлена 324 пациентами, которым на этапе предоперационного обследования проводилась анатомо-топографическая оценка выполнимости МХЭ у каждого конкретного пациента. Для этого было разработано специальное приспособление, с помощью которого производилось измерение параметров оперативного доступа (патент на изобретение № ?). Полученные сведения и данные УЗ-диагностики сделали возможным создание математической модели, позволяющей на дооперационном этапе прогнозировать возможность проведения оперативного вмешательства из мини-доступа.
Клинический контроль включал изучение первичной медицинской документации и сбор анамнеза, наблюдение за общим состоянием, включающее физикальный и лабораторный контроль.
Физикальный контроль общего состояния пациентов предполагал наблюдение за пульсом, артериальным давлением, частотой дыхательных движений, перитонеальными симптомами, кишечными шумами и динамикой восстановления перистальтики кишечника, состоянием послеоперационной раны.
Лабораторный контроль включал динамическое наблюдение за основными лабораторными показателями по нижеописанным методикам.
Для определения уровня лейкоцитоза морфологической характеристики лейкоцитов производился их подсчет в 1 мкм периферической крови с помощью камеры Горяева в световом микроскопе по общепринятой методике (Н.М. Николаев, 1954).
Лейкоцитарная формула оценивалась по морфологическим особенностям клеток при микроскопии мазков крови, окрашенных краской Лейшмана в иммерсионной системе (процент из 100 подсчитанных лейкоцитов). Обращалось особое внимание, помимо сдвига формулы влево и токсической зернистости, на процентное содержание лимфоцитов (степень выраженности лимфоцитопении).
Рентгенологическое исследование пациентам контрольной и основной групп проводилось на рентген-установках фирмы Philips (Голландия). Ультразвуковое исследование брюшной полости и забрюшинного пространства – на аппарате Aloka SSD-1100 (Япония).
Эндоскопическое исследование проводилось при помощи гибких фиброгастроскопов фирмы «Olympus» с торцевой оптикой, при этом выполнялась стандартная фиброгастродуоденоскопия (ФГДС) с тщательным осмотром стенок желудочно-кишечного тракта и выявлением дефекта слизистой. При необходимости проведения РХПГ применялись гибкие фибродуоденоскопы той же фирмы с боковым расположением оптики. После осмотра зоны БДС производились канюляция холедоха и тугое контрастное наполнение с визуальным контролем на рентген-телевизионной установке, после чего выполнялась серия рентгеновских снимков. При необходимости исследование дополнялось ЭПСТ.
Для выполнения минилапаротомии применялся комплект хирургического инструмента «Миниассистент» по методике, предложенной проф. М.И.Прудковым (1995). Бригада хирургов из двух человек в правом подреберье по среднеключичной линии выполняла послойный трансректальный разрез длиной 3-5 см. Дно пузыря захватывали окончатым зажимом, после чего устанавливали от 4 до 6 зеркал с изменяющейся геометрией, раздвигая подпеченочное пространство и освобождая желчный пузырь и гепато-дуоденальную связку. Одно из зеркал со смонтированным световодом подсоединялось к осветителю лапароскопической стойки, что обеспечивало дополнительное освещение операционного поля. В результате вокруг желчного пузыря формировалось свободное пространство, имеющее вид усеченного конуса, вершиной которого являлся разрез, а широким основанием – зона предстоящего вмешательства (рис.1). Зажим снимали с дна желчного пузыря и, после разделения имеющихся сращений и спаек, перемещали дно латерально, чтобы оно не закрывало операционное поле. Пузырь захватывали за область гартмановского кармана и подтягивали вверх, натягивая шейку желчного пузыря.
Холецистэктомия осуществлялась от «шейки» или комбинированным способом. Техника холецистэктомии не отличается от стандартной, однако использование специально изогнутых инструментов значительно облегчает манипуляции, позволяя выполнять их под контролем зрения. Перевязка пузырного протока и артерии производится отдельно. Кровотечение из ложа обычно останавливается коагуляцией, иногда ложе ушивается.
Для определения типа телосложения по В.Н. Шевкуненко (1935) измеряли рост и длину туловища пациентов, определяли индекс Кетле (Индекс = длина туловища в см / рост в см х 100). Индекс Кетле меньше 28,5 характерен для долихоморфного типа телосложения, 28,5-31,5 – мезоморфного и больше 31,5 – брахиморфного.
Также производили измерение длины нижней конечности относительно длины туловища, составляющей у брахиморфного типа менее 55%, у мезоморфного - от 55 до 56,9%, у долихоморфного - более 57%
Индекс массы тела определяли по формуле: рост в см/массу тела в кг x 100.
Для оценки выполнимости МХЭ применялась методика, предложенная Созон-Ярошевичем в 1954 году, в нашей модификации. В практической деятельности применимы следующие критерии:
I. Угол операционного действия. Данный критерий находится в прямой зависимости от длины разреза и глубины раны. В условиях применения комплекса «Миниассистент» необходимой длины разреза возможно достичь путем равномерной тракции ранорасширителей при помощи ретракционного кольца, входящего в комплект. Ограничивающим фактором в данном случае будет степень ригидности передней брюшной стенки: чем больше толщина передней брюшной стенки, тем сложнее осуществить ретракцию, соответственно, это приводит к компенсаторному увеличению длины разреза (рис.1).

Рис. 1. Угол операционного действия.
II. Ось операционного действия – линия, соединяющая глаз хирурга с наиболее глубокой точкой операционной раны или наиболее важным объектом вмешательства (рис. 2).

Рис. 2. Ось операционного действия.
В нашем случае наиболее важными параметрами оси оперативного действия, характеризующими выполнимость холецистэктомии из мини-доступа, являются:
1. Глубина оси – расстояние от передней брюшной стенки до шейки желчного пузыря. В условиях малого доступа максимально возможная глубина оси ограничена продольной длиной применяемого инструмента. Кроме того, сложность выполнения МХЭ напрямую зависит от толщины передней брюшной стенки.
2. Угол наклонения оси операционного действия - угол, образованный действием и поверхностью тела больного в пределах операционной раны. Значение этого угла состоит в том, что им определяется угол зрения, под которым хирург вынужден рассматривать объект операции. Наилучшие условия создаются, если угол равен 900, и хирург смотрит на объект операции прямо - in face. При уменьшении угла операционного действия до 250 и меньше оперировать достаточно сложно. Угол наклонения оси операционного действия выражает косвенным образом, насколько операционный разрез соответствует расположению органа, на котором производится вмешательство (рис. 3).

Рис. 3. Угол наклонения оси операционного действия.
Мы производили измерение угла наклонения оси операционного действия с помощью данного инструмента (рис. 4).


Рис. 4. Прибор для измерения угла наклонения оси операционного доступа (фото).
Методика обследования состоит в том, что короткую браншу прибора устанавливают у верхнего края операционного разреза строго перпендикулярно, длинную располагают в области шейки желчного пузыря. Угол наклонения оси определяют по транспортиру.
На основании наших измерений можно заключить, что чем больше ось операционной раны и меньше угол наклонения оси операционного действия, тем трудней и опасней будут производиться манипуляции инструментами в глубине операционной раны.
Статистический анализ производился с помощью пакета статистических компьютерных программ «Biostat» (1998), «Statistica 6,0» с использованием специальных руководств по медицинской и биологической статистике. Обобщенная информация относительно количественных признаков приведена в виде средней и ее стандартной ошибки либо стандартного отклонения (или двух стандартных отклонений), что указано в соответствующем разделе. Обобщенная информация о качественных признаках приведена в виде процентов. С целью множественного сравнения полученных средних величин использовали однофакторный дисперсионный анализ и дисперсионный анализ повторных измерений. Множественные попарные сравнения производились с помощью критерия Нъюмена-Кейлса при 5% уровне значимости различий. Сравнение распределений качественных признаков проводилось с использованием критерия Z оценки разности долей, точного критерия Фишера для четырехпольной таблицы при общем числе наблюдений менее 100, критерия 2 для многопольной таблицы, либо при общем числе наблюдений выше 100.
Результаты исследования
В основной группе пациентов мужчин - 108 (33,3%), женщин - 216 (66,7%), в контрольной группе мужчин – 93 (33,1%), женщин - 188 (66,9%). Большинство пациентов основной - 226 (69,7%) и контрольной - 209 (74,4%) групп находилось в трудоспособном возрасте. При этом средний возраст пациентов основной группы составил 43,3±2,4, контрольной группы – 49,4± 3,4 года.
Существенных различий по возрастному и половому составу в сравниваемых группах не было (критерий 2=0,001; р=0,970).
Основной патологией, приведшей к необходимости проведения МХЭ в обеих группах, был острый флегмонозный холецистит (ОФХ) в 168 (51,8%) и в 145 (51,6%) случаях; далее - в порядке убывания: хронический калькулезный холецистит (ХКХ) - у 48 (14,9%) и у 39 (13,9%); острый гангренозный холецистит (ОГХ) - у 32 (9,9%) и у 28 (10%) пациентов в основной и контрольной группах соответственно. Соотношение частоты встречаемости нозологических форм у мужчин и женщин - 1:2 (рис. 5).

Рис. 5. Распределение больных обеих групп по нозологическим формам.
Увеличение количества больных с острой хирургической патологией обусловлено расширением показаний к проведению МХЭ, связанных с ужесточением отбора пациентов и оптимизацией алгоритма предоперационной диагностики. Кроме того, в эту группу вошли пациенты, у которых риск проведения лапароскопической холецистэктомии (ЛХЭ) был достаточно высоким.
В последние годы отмечается увеличение количества больных старше 60 лет, имеющих высокий риск оперативного вмешательства из-за наличия сопутствующей патологии (рис. 6). Ограничение показаний для ЛХЭ из-за выраженных сердечно-легочных нарушений (СЛН) (56,1% - в основной и 45,8% - в контрольной), ожирения 1-2 степеней (28,6% и 31,9%), ХВН (11,2% и 12,6%) привело к увеличению данной категории пациентов и расширению показаний к МХЭ, которая будет являться в данном случае операцией выбора. Статистический анализ (критерий 2) не выявил существенных внутригрупповых различий.

Рис. 6. Характер сопутствующей патологии у больных старше 60 лет.
При поступлении всем пациентам проводилось УЗ-сканирование, которое позволяло оценить состояние желчного пузыря и околопузырных тканей. Нами выделены следующие УЗ-варианты:
1 вариант - хронический калькулезный холецистит, диагностированный в 14,9% случаях. Желчный пузырь уменьшен или нормальных размеров, стенка однородная, уплотнена, с неровным контуром, в просвете визуализируются конкременты (рис. 7).


Рис. 7. Сонограмма желчного пузыря.
2 вариант - острый холецистит без признаков деструкции стенки, обнаруженный у 10,2% пациентов, и бессимптомная водянка желчного пузыря - 6,9%. Обтурационный ОХ на раннем этапе развития характеризовался увеличением поперечного размера желчного пузыря - более 30 мм; значительно реже обнаруживали увеличение длинника пузыря - более 100 мм. Стенки однородные, не более 3 - 4 мм толщиной, могут быть уплотнены. В просвете - неоднородное содержимое, камни, взвесь. При обтурации - конкремент расположен в шейке, не смещается при изменении положения тела больного. При переходе воспаления на стенки пузыря наблюдается изменение эхоструктуры (рис. 8).
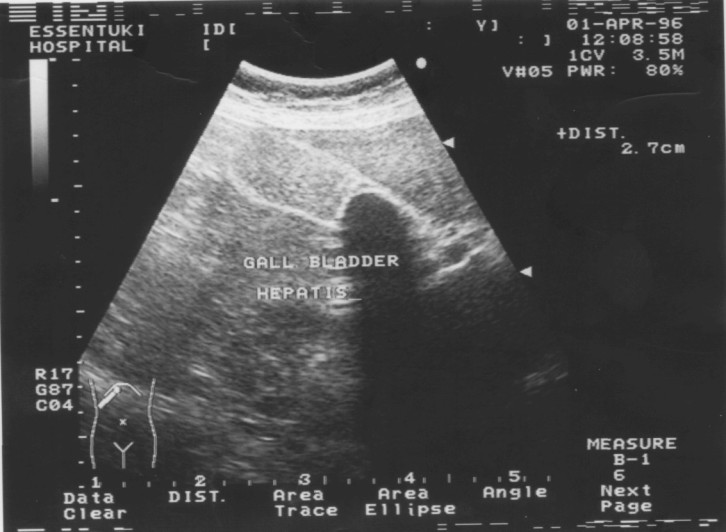

Рис. 8. Сонограмма острого холецистита без признаков деструкции.
3 вариант - острый холецистит с признаками деструкции стенки, но без перивезикальных осложнений - 61,7%. При флегмонозном холецистите отмечается утолщение стенки желчного пузыря - более 4 мм, ее неоднородность и слоистость. Двухконтурность стенки пузыря свидетельствует о наличии деструкции стенки в 100% случаев (рис. 9).


Рис. 9. Сонограмма острого деструктивного холецистита.
У 9,9% пациентов острый гангренозный холецистит осложнился формированием перивезикального инфильтрата. Перивезикальные осложнения визуализируются в виде гиперэхогенных тканей вокруг желчного пузыря при наличии воспалительного инфильтрата и анэхогенных зон, свидетельствующих о скоплении жидкости при абсцедировании. Неоднородная картина эхогенности стенки пузыря (комбинация двух и более степеней эхоплотности) была отмечена у всех пациентов. Как правило, у больных ОХ на разных участках стенки желчного пузыря отмечались неодинаковая толщина и степень эхогенности– «слоистость», что указывало на деструктивные изменения в стенке пузыря (рис. 10).


Рис. 10. Сонограмма острого гангренозного холецистита с перивезикальным инфильтратом
4 вариант – склероатрофический желчный пузырь, обнаруженный у 6,3% пациентов. При этом отмечаются уменьшение продольно-поперечных размеров, увеличение эхоплотности и толщины стенок. Практически в 100 % случаев наблюдается гипертензия в общем желчном протоке (рис. 11).

Рис. 11. Сонограмма склероатрофического желчного пузыря.
У пациентов основной группы при отборе для МХЭ производилась антропометрическая оценка. Для этого измеряли длину туловища, массу тела, вычисляли индекс Кетле. На основании полученных данных у 56 (17,3%) тип телосложения определен как долихоморфный, у 182 (56,2%) - как мезоморфный, у 86 (26,5%) - как брахиморфный. Долихоморфный тип характеризуется высоким ростом, относительно коротким туловищем, длинной узкой шеей, длинной и узкой грудной клеткой, длинными нижними конечностями, малым углом наклонения таза вперед. Средний рост составил 186,5±4,3 см. Индекс Кетле - 17,9±1,4; соотношение длины конечности к длине туловища - более 58%. Это обусловливает специфичность расположения дна и шейки желчного пузыря относительно срединной линии и нижнего края реберной дуги.
Согласно данным дооперационного УЗ-сканирования установлено, что в результате увеличения относительной длины туловища у пациентов данной подгруппы наблюдаются следующие варианты расположения дна и шейки желчного пузыря.
В первом варианте, наблюдаемом в 14% случаев, дно расположено на уровне XI-го грудного позвонка, шейка - в проекции X грудного позвонка, на 3-4 см латеральнее срединной линии (рис. 12).
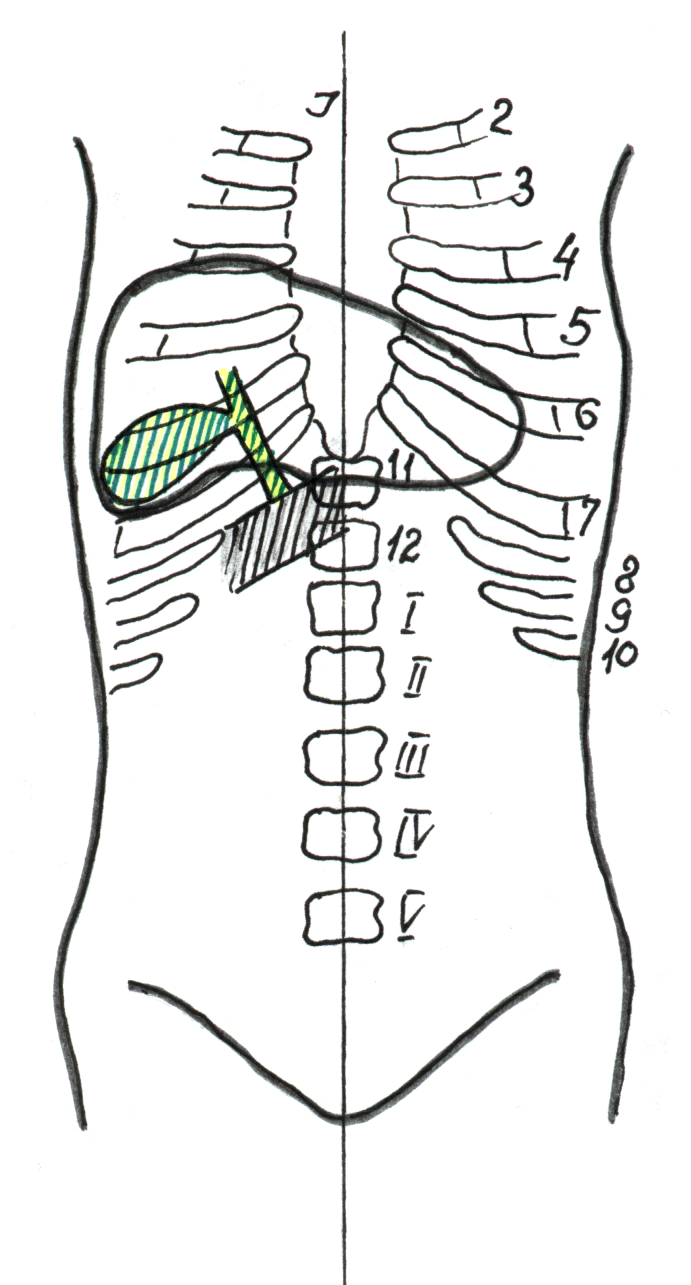
Рис. 12. Топическая схема при I варианте (объяснение в тексте).
При втором варианте дно смещено книзу и расположено на уровне II поясничного позвонка, шейка - в проекции XII грудного позвонка, практически на срединной линии - в 16 % случаев (рис.13).

Рис. 13. Топическая схема при II варианте (объяснение в тексте).
Для брахиморфного типа характерны средний или низкий рост, длинное туловище, высокие плечи, короткая и широкая грудная клетка, короткие ноги, большой угол наклонения таза вперед. Средний рост составил 164,5±6,3 см. Индекс Кетле - 17,9±1,4; соотношение длины конечности к длине туловища - менее 50%.
Особенности конституции обусловливают увеличение поперечного размера и уменьшение продольного. В связи с этим у 63% пациентов с брахиморфным типом телосложения наблюдается смещение шейки желчного пузыря относительно срединной линии латерально до 9-12 см (рис. 14).

Рис. 14. Топическая схема при брахиморфном типе.
Дно при увеличенном пузыре может располагаться вровень с шейкой либо при малых размерах смещаться книзу, как правило, не ниже уровня I поясничного позвонка. У 16 % шейка также смещается книзу от уровня реберной дуги, вплоть до уровня пупочного кольца, располагаясь на уровне II-III поясничного позвонка (рис. 15).
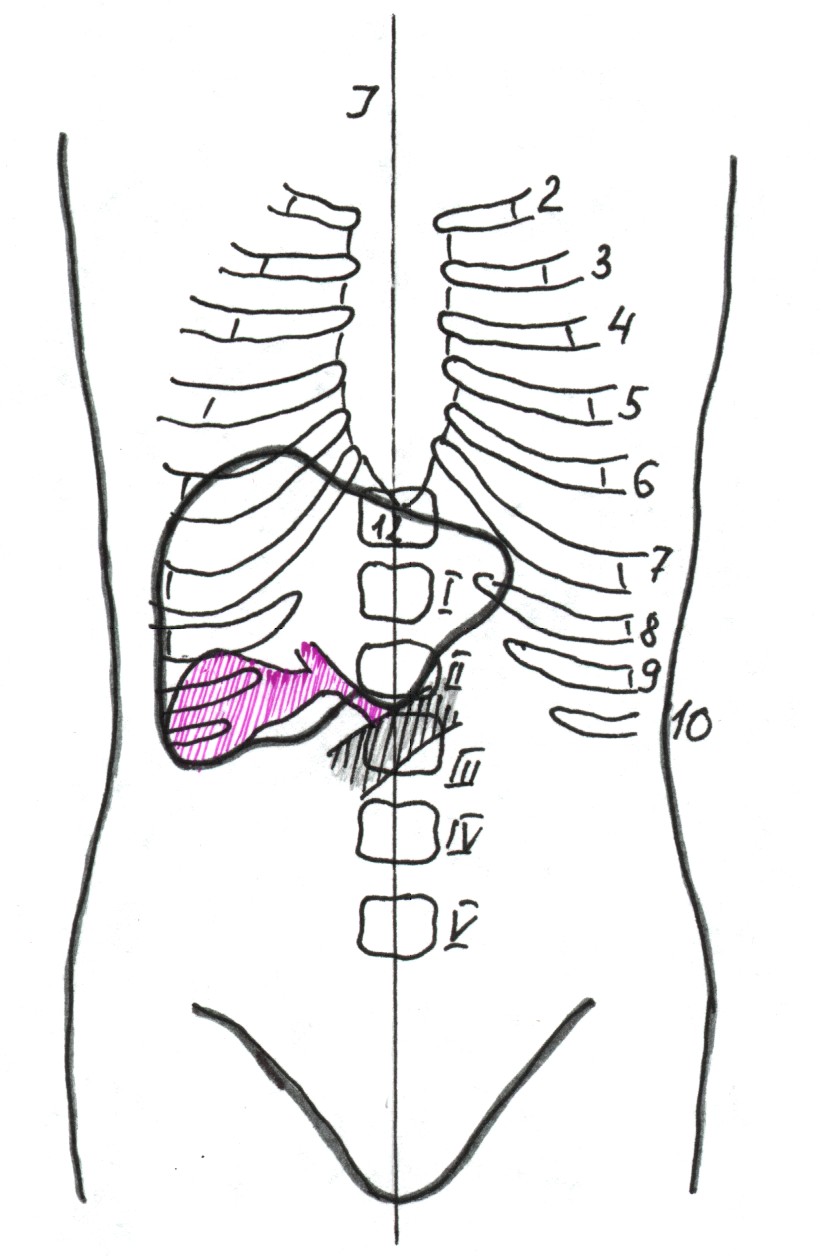
Рис. 15. Топическая схема при долихоморфном типе.
У пациентов мезоморфного типа отмечаются невысокий рост, пропорциональное соотношение длины туловища и конечностей, грудной клетки, шеи и нижних конечностей. У 21% дно расположено на уровне II поясничного позвонка, шейка - в проекции XII грудного или I поясничного позвонка на 4 см латеральнее срединной линии.
На основании УЗ-данных и антропометрических измерений нами предложен принципиально новый, прогрессивный подход к дооперационной оценке выполнимости оперативного вмешательства на основании математического моделирования у пациентов с различным типом телосложения.
Зададим условия для математической модели:
Пусть A - точка операции, а А' - проекция этой точки на поверхность тела пациента. Пусть B - искомая точка центра разреза. A'B - искомое расстояние = x. A’D – расстояние от верхнего края разреза до края реберной дуги или срединной линии. Если d = DC - диаметр разреза, то заложим в модель следующие условия:
1) расстояние АС - от крайней точки разреза до точки операции - должно быть не более 15 см.
2) угол ACB - не менее 50 градусов. Тогда из прямоугольного треугольника AA'C вычисляем A'C = ACcos(угол C).
Т.к. A'C = x + (d/2), то x = ACcos(угол С) - (d/2). Совокупность точек B - это геометрическое место точек, которые могут быть предельными точками центра разреза. Тогда круг с центром в A' и радиусом A'B является геометрическим местом всех возможных точек центра разреза (рис. 16).

Рис. 16. Математическая модель доступа.
Следовательно, чем больше будет А’A и A’D, тем больше будет угол наклонения оси операционного действия. В нашем варианте данное условие звучит так: чем больше расстояние от геометрического центра предполагаемого разреза до проекции шейки желчного пузыря на кожу и глубина операционной раны, тем меньше угол наклонения оси операционного действия, а значит, рискованнее и опаснее оперативное вмешательство из мини-доступа.
Для облегчения работы с математической моделью было разработано Windows- совместимое компьютерное приложение. При введении данных, полученных при УЗ- и антропометрических исследованиях на дооперационном этапе, программа позволяет прогнозировать выполнимость холецистэктомии из мини-доступа (свид. № 2009611300).
Проведенные нами исследования показали, что у пациентов с долихоморфным типом верхний край доступа должен располагаться на 1-2 см выше стандартной проекции и на 4-6 см - латеральнее срединной линии. У больных с брахиморфным типом оптимальной точкой доступа будет нижний край VIII-IX ребер по срединно-ключичной линии относительно срединной линии. В продольном направлении смещение может достигать уровня пупочного кольца.
Также при дооперационном прогнозировании необходимо учитывать толщину передней брюшной стенки. У пациентов с мезоморфным типом при стандартных условиях при увеличении толщины передней брюшной стенки на 1 см угол наклонения оси операционного действия изменяется на 20. У брахиморфного типа при первом варианте и стандартном доступе расстояние от поверхности кожи до шейки пузыря может достигать при ожирении III-IV степени 23-24 см, а это изменит угол наклонения оси на 19-200, при втором варианте - на 230.
Таким образом, созданная нами математическая модель позволяет достаточно точно до проведения разреза прогнозировать успешность выполнения холецистэктомии из мини-доступа.
Предложенный стандартизированный мини-доступ легитимен лишь у пациентов с мезоморфным типом и с нормальной толщиной передней брюшной стенки. При крайних вариантах расположения дна и шейки желчного пузыря, наблюдаемых при долихоморфном и брахиморфном типах, необходима коррекция проекции доступа согласно анатомическим ориентирам: срединной линии и нижнему краю реберной дуги. Значительно осложняет, а в ряде случаев делает невозможным проведение МХЭ, увеличение толщины передней брюшной стенки. По нашим данным, ожирение III-IV степеней является относительным противопоказанием к проведению операции из мини-доступа, так как решающим доводом в пользу миниинвазивного вмешательства будет проекция шейки желчного пузыря на переднюю брюшную стенку, делая ее невозможной при высоких вариантах расположения шейки на уровне X-XI грудных позвонков.
Сравнительная оценка эффективности проводимой терапии у пациентов основной и контрольной групп
Сравнительный анализ лечения больных основной и контрольной групп проводился с использованием клинических и лабораторных показателей. Проведенный статистический анализ позволяет говорить о том, что по основным параметрам достоверных различий в сравниваемых группах не было.
Ограниченность видимости зоны оперативного действия привела к увеличению количества осложнений. Кровотечение из раны, обнаруженное во время операции, выявлено у 3 (1,1%) больных контрольной группы. Причиной его явилось повреждение мышц в результате вынужденного расширения разреза книзу в результате выбора неправильной точки проекции разреза относительно шейки пузыря у тучных пациентов. Образование межмышечной и подкожной гематом в результате избыточной тракции ранорасширителями привело к развитию инфильтратов послеоперационных ран у 4 (1,4%) оперированных. Ограниченность видимости и операционного пространства, особенно при ожирении, стала причиной нарушения целостности пузыря и выпадения конкрементов в свободную брюшную полость у 5 (1,8%), образования абсцессов ложа желчного пузыря - у 2 (0,7%). Несостоятельность культи желчного протока и соскальзывание лигатуры с пузырной артерии в раннем послеоперационном периоде вызвали развитие желчного перитонита у 2 (0,7%) пациентов и кровотечение из культи пузырной артерии - у 2 (0,7%).
Динамика важнейших лабораторных показателей в обеих сравниваемых группах существенно не различалась, в целом отражая единую тенденцию. При поступлении у пациентов с хроническим воспалением уровень билирубина в сыворотке крови составляет от 11 до 17 мкмоль/л, в 1-е сутки отмечается незначительный подъем до верхней границы нормы, с последующей нормализацией на уровне средних показателей при выписке. Показатели АЛТ и АСТ не выходят за пределы нормы в течение всего срока пребывания в стационаре. В лейкоцитарной формуле наблюдается статистически незначимый сдвиг влево в 1-е сутки после оперативного вмешательства, который полностью нормализуется при выписке. У пациентов с острым воспалением наблюдается умеренно выраженный лейкоцитоз до 12*109/л, который несколько повышается в 1-е сутки после вмешательства, к концу лечения отмечается стойкое снижение до верхней границы нормы. Уровень билирубина при поступлении находится на уровне 22-24 мкмоль/л, несколько увеличиваясь в первые сутки после операции и постепенно снижаясь до верхних допустимых границ к моменту выписки больного из стационара. В лейкоцитарной формуле наблюдается лейкоцитарный сдвиг влево, увеличивается количество юных незрелых форм. В послеоперационном периоде отмечается их компенсаторное увеличение с последующим постепенным снижением. У части пациентов с гнойно-деструктивными формами при поступлении наблюдается выраженный лейкоцитоз до 16-18*109/л, в то же время у больных пожилого возраста может отмечаться снижение уровня лейкоцитов до 4,2*109/л или даже лейкопения. Уровень билирубина при поступлении достаточно высок.
Применение миниинвазивных методик в лечении пациентов с ЖКБ в целом благоприятно отражается на общем самочувствии и течении раннего послеоперационного периода в отличие от больных, перенесших открытую лапаротомию. Однако у пациентов контрольной группы из-за увеличения длины разреза во время операции или в результате избыточной тракции краев раны достоверно чаще развиваются гнойно-воспалительные изменения. Края раны отечные, припухлые, в подкожной клетчатке наблюдается скопление серозно-геморрагического экссудата, больные жалуются на раневую боль. Если происходит нагноение раны, то повышается температура тела до 37,8-38,3, что вынуждает открывать рану, производить эвакуацию гноя и проводить ее лечение как открытой гнойной раны. Безусловно, заживление раны вторичным натяжением приводит к формированию грубого послеоперационного рубца, удлинению периода реконвалесценции. В то же время у пациентов основной группы отмечается положительная динамика с первых суток послеоперационного периода. При неосложненном течении возможен перевод больных в палату сразу же после операции. На перевязке послеоперационный рубец розового цвета, может быть умеренная отечность, которая проходит ко 2-3 суткам послеоперационного периода. На 6-7-е сутки формируется линейный послеоперационный рубец, производится удаление шовных лигатур.
Средняя продолжительность пребывания больного в стационаре составила 6,3 койко-дня. Около 1 койко-дня занимала предоперационная диагностика и дооперационная анатомо-топографическая оценка выполнимости МХЭ. При неосложненном течении послеоперационного периода на вторые его сутки производилась ранняя активизация пациентов. При отсутствии отделяемого по страховочному дренажу производили его удаление. На 6-7 сутки больные выписывались из стационара. Минимальное количество составило 5, максимальное - 14 койко-дней. Увеличение продолжительности пребывания больного в стационаре было вызвано развитием осложнений.
Из 324 пациентов осложнения возникли у 10 (3,1%). По характеру мы условно разделили их на: интраоперационные - 0,6%, ранние послеоперационные - 1,5% и поздние послеоперационные - 0,9% случаев. Интраоперационные осложнения развились у 2 (0,6%) больных. В 1 случае причиной кровотечения из операционной раны, которое остановлено путем электрокаутеризации сосудов, стали мелкие сосуды брюшины, во 2 случае попытка удаления гангренозного желчного пузыря сопровождалась повышенной рыхлостью тканей, что привело к нарушению целостности стенки и выпадению конкрементов в свободную брюшную полость.
Ранние послеоперационные осложнения диагностированы у 5 (1,5%) пациентов. Недостаточная обработка ложа удаленного желчного пузыря привела к необходимости релапаротомии в раннем послеоперационном периоде у 1 (0,3%) больного. Причиной этого явилось внутрипеченочное расположение желчного пузыря в сочетании с гангренозно-измененной стенкой. Попытка тампонады ложа не оказала достаточного эффекта. В послеоперационном периоде сохранялось геморрагическое отделяемое из дренажа, происходило изменение показателей гемодинамики и красной крови. При релапаротомии выявлено геморрагическое подтекание из ложа, которое было остановлено при сочетании электрокоагуляции с тампонадой препаратом «Тахокомб». Во втором случае выделение крови по страховочному дренажу произошло в первые сутки послеоперационного периода. Причиной этого послужил недостаточный гемостаз ветвей пузырной артерии, обусловленный наличием плотного перивезикулярного инфильтрата у тучного пациента. Верифицированные во время операции ходы Люшки стали причиной желчеистечения и развития инфильтрата подпеченочного пространства в 1 случае. После УЗ-верификации произведена чрескожная тонкоигольная пункция под непосредственным УЗ-контролем, установлен дренаж в подпеченочное пространство, осуществлялось промывание подпеченочного пространства раствором бетадина. На 7 сутки отмечена положительная динамика процесса, дренаж удален. У 2 (0,6%) пациентов развитие ранних послеоперационных осложнений не было связано непосредственно с зоной вмешательства. Так, у 1 пациента в послеоперационном периоде появились рвота «кофейной гущей» и мелена. После экстренной гастроскопии было установлено, что причиной кровотечения явилась острая язва малой кривизны желудка, не диагностированная до операции. При помощи инфильтрационного эндоскопического гемостаза 70% раствором этилового спирта удалось произвести полную остановку кровотечения. В 1 случае течение послеоперационного периода осложнилось развитием госпитальной пневмонии. Применение антибактериальной терапии привело к нивелированию процессов воспаления к 10 суткам.
Поздние послеоперационные осложнения выявлены у 3 (0,9%) больных. У 1 пациентки в течение последующих 3 лет сформировалась грыжа послеоперационного рубца. Причиной ее стала местная реакция на шовный материал, который вызвал нагноение послеоперационной раны у больной с сопутствующим сахарным диабетом. Последующее лечение включало в себя герниопластику с использованием полипропиленовой сетки, дальнейшее наблюдение за больной не выявило рецидива грыжи. Наиболее опасным и сложным нам представляется вмешательство на желчевыводящих протоках в условиях плотного инфильтрата в области шейки желчного пузыря. При этом у 1 пациента это стало причиной стриктуры холедоха, которая в последующем вызвала механическую желтуху. И в 1 случае - интраоперационное повреждение холедоха, запоздало диагностированное у пациента со склероатрофическим желчным пузырем, которое стало причиной развития желчного перитонита. После повторной релапаротомии, ревизии и санации брюшной полости произведено ушивание дефекта холедоха на Т-образном дренаже. В послеоперационном периоде проводилась дезинтоксикационная и антибактериальная терапия, после чего больной на 14 сутки в удовлетворительном состоянии был выписан из отделения. В дальнейшем были произведены фистулография и удаление Т-образного дренажа, при этом проходимость желчного протока была сохранена, подтекания контраста в брюшную полость обнаружено не было.
В целом по группе в 2 (0,6%) случаях потребовалось повторное оперативное вмешательство по жизненным показаниям, в 1 (0,3%) осуществлено лечение с применением малоинвазивных методик (пункций под УЗ-контролем), в 1 (0,3%) случае осуществлена герниопластика с использованием сетчатого эндопротеза.
Средняя продолжительность оперативного вмешательства составила 1,2 часа. Наибольшая продолжительность отмечена при наличии плотного инфильтрата в области шейки желчного пузыря (1,5 часа). При отсутствии технических трудностей продолжительность оперативного вмешательства составила 38 минут.
Переход на открытый доступ был осуществлен у 10 (3,2%) пациентов. В подавляющем большинстве - в 7 (2,2%) случаях - причинами конверсии явились отсутствие возможности дифференциации элементов гепато-дуоденальной связки и высокой риск их повреждения. У 2 (0,6%) причиной конверсии стало развившееся кровотечение из культи пузырной артерии, которое не удалось остановить из мини-доступа. Нами отмечено, что у тучных пациентов с наличием сопутствующего деструктивного изменения желчного пузыря и формированием перивезикального инфильтрата в виду высокой рыхлости тканей риск соскальзывания лигатуры очень высок. Попытка захвата тканей в глубине раны может привести к ятрогенному повреждению гепатикохоледоха, крупных сосудистых структур, поэтому при возникновении подобного рода осложнений необходимо пережать печеночно-двенадцатиперстную связку и перейти к открытому вмешательству.
Благодаря предложенному анатомо-топографическому подходу, который применялся при дооперационном отборе пациентов для МХЭ, в основной группе не умер ни один пациент.
ВЫВОДЫ:
- Холецистэктомия из мини-доступа является прекрасной альтернативой традиционной открытой. В ряде случаев позволяет завершить лапароскопическую операцию в качестве средства конверсии.
- В отличие от лапароскопической техники не требуется первичной специализации по эндоскопии; инструментарий для проведения минихолецистэктомии обладает гораздо меньшей стоимостью; хирурги, владеющие традиционной техникой выполнения холецистэктомии, быстрее обучаются данной методике.
- Проведенные антропометрические измерения свидетельствуют о том, что у пациентов с различным типом телосложения наблюдается вариативность проекций шейки и дна желчного пузыря на переднюю брюшную стенку. При долихоморфном типе шейка смещается вверх и медиально, при брахиморфном - книзу и латерально.
- Применение предложенного клинико-экспертного отбора пациентов для минихолецистэктомии позволяет на дооперационном этапе оценить выполнимость операции, выбрать наиболее рациональный доступ.
- Внедрение и применение в клинической практике клинико-экспертного подхода уменьшило частоту конверсий с 12,3% до 3,2%.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ:
- На этапе дооперационного обследования необходимо оценивать выполнимость вмешательства из мини-доступа, руководствуясь данными, полученными при антропоморфометрии и УЗ-сканировании.
- При выполнении минихолецистэктомии у пациентов с различными типами телосложения необходима дооперационная коррекция мини-доступа: при долихоморфном типе разрез должен располагаться как можно выше к нижнему краю реберной дуги и максимально ближе к срединной линии; при брахиморфном типе разрез необходимо смещать относительно реберной дуги ниже на 6-8 см, при низком расположении шейки пузыря - до уровня пупочного кольца, относительно срединной линии коррекция возможна до уровня срединноключичной линии.
- Для расчета оптимальной проекции мини-доступа на передней брюшной стенке необходимо применение средств математического и компьютерного моделирования.
- Учитывая простоту освоения методики и относительную более низкую стоимость аппаратуры для мини-доступа в сравнении с лапароскопической, можно рекомендовать минихолецистэктомию в качестве альтернативы традиционной холецистэктомии, особенно в районных больницах.
СПИСОК ОПУБЛИКОВАННЫХ РАБОТ ПО ТЕМЕ ДИССЕРТАЦИИ:
- Ангилов, В.А., Использование анатомо-топографических особенностей проекции желчного пузыря на переднюю брюшную стенку при выполнении холецистэкомии из мини-доступа /В.А. Ангилов, В.И. Греясов, Б.Б.Хациев, Г.А.Денисенко// Вестник новых медицинских технологий – 2009 – Т. ХVI, № 3. - С. 96.
- Ангилов, В.А. Клиникодиагностиечкие показания для минидоступа у больных с желчнокаменной болезнью/ В.А. Ангилов, В.И. Греясов, С.П. Щепкин //Материалы Второй поволжской межобластной конференции хирургов «Минимально инвазивная хирургия на современном этапе». – Ростов-на-Дону; 2006. – С. 6.
- Ангилов, В.А. Опыт применения мини-доступа у больных с желчнокаменной болезнью / В.А. Ангилов, В.И. Греясов, С.П. Щепкин, //Труды Международного хирургического конгресса «Новые технологии в хирургии»». – Ростов-на-Дону; 2005. - С. 455.
- Греясов, В.И., Конверсия на мини-холецистэктомию у больных с желчнокаменной болезнью, которым выполняли лапароскопическую холецистэктомию/ В.А. Ангилов, С.П. Щепкин, В.А. Ангилов, В.М. Чугуевский // Материалы 3-го международного хирургического конгресса. – Москва. 2008. - С. 122-123.
- Греясов, В.И., Одноэтапное хирургическое лечение холедохолитиаза из мини-доступа/ В.А. Ангилов, С.П. Щепкин, В.М. Чугуевский, В.А. Ангилов// Материалы второго съезда хирургов Южного Федерального округа. – Пятигорск. 2009.- С. 14.
- Св.-во гос. рег. прогр. для ЭВМ 2009611300, Российская Федерация./Ангилов В.А., Денисенко Г.А., Хациев Б.Б., Даржания А.Ю; правообладатель Ангилов В.А. № 2009610142; дата поступл.19.01.2009; дата регистр.13.03.2009.
СПИСОК СОКРАЩЕНИЙ:
ЖКБ – желчнокаменная болезнь
МХЭ – минихолецистэктомия
ЛХЭ – лапароскопическая холецистэктомия
ОГХ - острый гангренозный холецистит
ООХ - острый обтурационный холецистит без деструкции стенок
ОФХ - острый флегмонозный холецистит
СЖП - склероатрофический желчный пузырь
ХКХ - хронический калькулезный холецистит
РХПГ – ретроградная холангиопанкреатикография
БДС – большой дуоденальный сосочек
ЭПСТ – эндоскопическая папиллосфинктеротомия
АЛТ - аланинаминотрасфераза
АСТ - аспартатаминотрансфераза

