Антитела к с-концевому фрагменту ат 1 рецептора ангиотензина ii – новый класс кардиотропных препаратов
На правах рукописи
Чепурина Наталья Геннадьевна
АНТИТЕЛА К С-КОНЦЕВОМУ ФРАГМЕНТУ АТ1 РЕЦЕПТОРА АНГИОТЕНЗИНА II – НОВЫЙ КЛАСС КАРДИОТРОПНЫХ ПРЕПАРАТОВ
14.03.06 – фармакология, клиническая фармакология
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Волгоград – 2011
Работа выполнена в ГБОУ ВПО «Волгоградский государственный медицинский университет Министерства здравоохранения и социального развития Российской Федерации»
Научный консультант:
академик РАМН, Заслуженный деятель
науки Российской Федерации,
доктор медицинских наук, профессор Петров Владимир Иванович
Официальные оппоненты:
академик РАМН,
доктор медицинских наук,
профессор Дыгай Александр Михайлович
доктор медицинских наук,
профессор Хохлов Александр Леонидович
заслуженный врач РФ,
доктор медицинских наук,
профессор Недогода Сергей Владимирович
Ведущая организация: ГБОУ ВПО «Ростовский государственный медицинский университет Министерства здравоохранения и социального развития Российской Федерации»
Защита диссертации состоится "___" декабря 2011г. в ____ часов на заседании Диссертационного Совета Д 208.008.02 при Волгоградском государственном медицинском университете по адресу: г. Волгоград, пл. Павших борцов, 1.
С диссертацией можно ознакомиться в библиотеке Волгоградского государственного медицинского университета
Автореферат разослан “_____”_____________ 2011 г.
Ученый секретарь
Диссертационного Совета,
доктор медицинских наук, профессор Бабаева А.Р.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы.
Сердечно-сосудистые заболевания (ССЗ) являются лидирующей причиной смертности во всем мире, приводя ежегодно к 17 млн. смертей, и по прогнозам экспертов к 2020 г. эта цифра может достичь 25 млн. (Ezzati M., Hoorn S.V., Rodgers A., 2003; WHO, 2008; Национальные клинические рекомендации, 2009).
Эволюция прогрессирования ССЗ представляет собой непрерывный континуум изменений, начинающийся с появления факторов риска, приводящих к формированию изменений в органах-мишенях, и, в конечном итоге – развитию заболеваний сердца, головного мозга, почек, сопровождающихся нарушением их функции (Кобалава Ж.Д., Шаварова Е.К., 2008). Хроническая сердечная недостаточность (ХСН) является одним из самых распространенных, прогрессирующих и неблагоприятных заболеваний сердечно-сосудистой системы: по данным исследования ЭПОХА-О-ХСН этой патологией страдает 5,5% населения РФ, при этом 3,4 млн. человек имеют III-IV функциональный класс (ФК) ХСН (Агеев Ф.Т., Даниелян М.О., Мареев В.Ю., 2004). Основными причинами развития ХСН в РФ являются артериальная гипертензия (АГ) – 88% случаев, и ишемическая болезнь сердца (ИБС) – 59% случаев (Фомин И.В., 2007; Рекомендации ВНОК и ОССН, 2009).
Одним из ключевых факторов в патогенезе ХСН и прогрессировании других ССЗ, таких, как АГ, ИБС, является гиперактивация ренин-ангиотензин-альдостероновой системы (РААС) (Бойцов С.А., 2006; Максимов М.Л., Стародубцев А.К., Остроумова О.Д., 2010). Компоненты РААС и, в частности, ангиотензин II (АТII), играют ключевую роль в ремоделировании миокарда, сосудистой стенки и почек и вовлечены во все этапы кардио-ренального континуума (Кобалава Ж.Д., Шаварова Е.К., 2008). Подавление активности и/или блокада компонентов этой системы приводит к снижению частоты развития осложнений ССЗ и смертности от них (Pitt B., 2009). Очевидно, что медикаментозная блокада РААС позволяет приостановить прогрессирование континуума на всех стадиях (Кобалава Ж.Д., Шаварова Е.К., 2008). Однако, несмотря на накопленную обширную доказательную базу по применению ингибиторов ангиотензин-превращающего фермента (ИАПФ) и антагонистов рецептора ангиотензина II (АРА), до настоящего времени нет однозначного мнения по поводу оптимального подхода к подавлению активности РААС (Гиляревский С.Р., 2009). При этом больных с ХСН становится все больше и далеко не у всех можно добиться принципиального улучшения прогноза (Шляхто Е.В., Ситникова М.Ю., 2009). Этот факт говорит о необходимости усовершенствования лекарственной терапии, направленной в том числе на улучшение качества жизни больных и их социальную поддержку.
ССЗ также является ведущей причиной заболеваемости и смертности у больных с хронической почечной недостаточностью (ХПН), получающих заместительную почечную терапию (ЗПТ) независимо от возраста и пола (Foley R.N., 2003; Kessler M., Zannad F., Lehert P., 2007; Sarnak M.J., 2003). Основной причиной смерти в диализной популяции больных является ХСН (Белялов Ф.И., 2005), при этом темпы роста числа пациентов, получающих программный гемодиализ (ПГД), в РФ превышают среднемировые показатели (Томилина Н.А., Бигбов Б.Т. 2005). Нарушенная функция почек является независимым фактором риска ХСН (Vanholder R., Massy Z., Argiles A., 2005). Почечная дисфункция прогрессивно утяжеляет течение ХСН и усложняет лечение таких больных (Shlipak M. G., Massie B.M., 2004).
Больные с V стадией ХБП часто исключаются из исследований, посвященных терапии ССЗ, в связи с высоким риском развития осложнений. Этим объясняется отсутствие крупных проспективных исследований, в которых бы изучались особенности лечения ХСН у данной категории пациентов (Kessler M., Zannad F., Lehert P., 2007). Некоторые основные препараты, используемые в терапии ХСН в общей популяции больных (ИАПФ, АРА), оказывают побочные эффекты, ограничивающие их применение у больных на ПГД (Arora N., Dellsperger K.C., 2007).
В этой связи, перспективна разработка нового класса препаратов, блокирующих активность РААС и не обладающих побочными эффектами, которые бы ограничили их применение у пациентов в различных клинических ситуациях. Таким классом могут стать антитела к С-концевому фрагменту АТ1 рецептора АТII, опосредующие ключевые эффекты одного из важнейших нейрогормонов, значимых для патогенеза ХСН (Эпштейн О.И., 2008).
Цель исследования:
Оптимизация фармакотерапии артериальной гипертензии и хронической сердечной недостаточности с помощью инновационного отечественного препарата, содержащего антитела к С-концевому фрагменту АТ1 рецептора ангиотензина II, предварительно изучив и обосновав его клиническую эффективность и механизм действия в эксперименте и клинике.
Основные задачи исследования:
В эксперименте:
- изучить в сравнительном аспекте влияние кардостена и антагониста рецепторов ангиотензина II лозартана на скорость развития гипотензивного эффекта и его выраженность, оценить стабильность антигипертензивного действия и динамику артериального давления (АД) после отмены препарата у крыс со спонтанной артериальной гипертонией;
- изучить влияние кардостена на кардиогемодинамику в опытах на крысах со спонтанной артериальной гипертонией и у крыс с экспериментальной сердечной недостаточностью;
- изучить кардиопротективное действие кардостена при сердечной недостаточности с использованием экспериментальной изадриновой модели;
- изучить влияние кардостена на специфическое связывание и функциональную активность рецепторов ангиотензина II миокарда крыс в норме и при экспериментальной патологии (АГ и сердечной недостаточности);
- изучить возможный механизм кардиоваскулярного действия кардостена в эксперименте;
В клинике:
- изучить влияние кардостена на клиническое состояние пациентов, фракцию выброса левого желудочка, толерантность к физической нагрузке и качество жизни при длительной комбинированной терапии ХСН;
- изучить клиническую эффективность кардостена в комплексной терапии хронической сердечной недостаточности у пациентов с хронической болезнью почек, находящихся на программном гемодиализе;
- изучить безопасность длительной терапии кардостеном в составе комплексной терапии ХСН.
Научная новизна:
В ходе исследования:
- впервые изучено антигипертензивное действие кардостена в сравнении с лозартаном и с применением плацебо-контроля на крысах со спонтанной гипертонией (SHR);
- впервые изучены в эксперименте кардиотропные эффекты кардостена в сравнении с лозартаном при экспериментальной хронической сердечной недостаточности на крысах линии Wistar и показан его отчетливый кардиопротективный эффект, а также влияние на основные показатели кардио- и гемодинамики;
- впервые показана половая специфичность в кардиопротективном действии кардостена;
- впервые осуществлено изучение возможного механизма действия кардостена в эксперименте;
- впервые проведена сравнительная оценка клинической эффективности применения кардостена с у пациентов с ХСН, ФК I-III. Выполнено комплексное исследование влияния кардостена на клиническое состояние пациентов, толерантность к физической нагрузке, гемодинамические показатели, качество жизни при длительной терапии ХСН;
- впервые показано, что кардостен не уступает по основным клиническим эффектам антагонисту рецепторов ангиотензина II валсартану при длительном применении у пациентов с ХСН;
- впервые применен кардостен у больных с сочетанием мягкой или умеренной ДХСН и V стадии ХБП в составе комбинированной терапии. Проведено всестороннее исследование его влияния на клиническое состояние пациентов, качество жизни, толерантность к физической нагрузке, гемодинамические показатели, диастолическую функцию ЛЖ;
- впервые показано, что дополнительная блокада РААС с помощью кардостена повышает эффективность лечения больных с ХСН и V стадией ХБП, улучшая клиническое состояние, качество жизни, толерантность к физической нагрузке и ДФЛЖ;
- впервые эффекты кардостена сравнили с таковыми у валсартана, представителя группы препаратов первой линии, используемых в терапии ХСН в общей популяции больных и у больных с V стадией ХБП;
- впервые изучена безопасность применения кардостена при его длительном применении в составе комплексной терапии ХСН, в том числе на фоне тяжелого поражения почек и показана его метаболическая нейтральность.
Научно-практическая значимость и внедрение результатов исследования в практику:
- решение поставленных задач позволило комплексно и последовательно оценить эффективность и безопасность представителя нового класса кардиотропных препаратов кардостена в эксперименте и в условиях реальной клинической практики, что открывает новые возможности фармакотерапии АГ и ХСН, в том числе и у пациентов, находящихся на ПГД;
- установлено, что длительная терапия кардостеном приводит к улучшению клинического течения ХСН, повышает толерантность к физической нагрузке, улучшает гемодинамические показатели и систолическую и диастолическую функцию ЛЖ, оказывает положительное влияние на качество жизни пациентов с ХСН;
- в ходе проведения клинических исследований установлено, что кардостен по основным клиническим эффектам не уступает валсартану и может служить альтернативой этой группе препаратов в условиях реальной клинической практики;
- добавление кардостена к стандартной схеме лечения ХСН позволит оптимизировать комплексную фармакотерапию этой патологии;
- показано существенное значение дополнительной блокады РААС с помощью кардостена для более эффективного лечения ХСН на фоне V стадии ХБП;
- помимо высокой клинической эффективности кардостен был безопасен, не оказывал влияния на обмен веществ при длительном применении и при этом хорошо переносился больными ХСН, в том числе и на фоне тяжелой почечной патологии.
Результаты, полученные в исследовании, легли в основу многоцентровых клинических исследований «ПЕРЕКРЕСТОК» и «АНТРАЦИТ» для получения доказательной базы и регистрации кардостена как нового отечественного кардиологического препарата (Регистрационное удостоверение Федеральной службы по надзору в сфере здравоохранения и социального развития № ЛС-001322 от 21.06.2010).
Результаты исследования используются в работе клиник г. Волгограда: НУЗ ОКБ на ст. Волгоград-1 ОАО «РЖД», ГУЗ «Волгоградский областной уронефрологический центр», ГУЗ «Волгоградский областной клинический кардиологический центр», ГУЗ ВОКБ № 3, а также включены в материалы лекций и практических занятий на кафедре клинической фармакологии и интенсивной терапии с курсами клинической фармакологии ФУВ и клинической аллергологии ФУВ, кафедре семейной медицины ФУВ, кафедре кардиологии и функциональной диагностики ФУВ, кафедре урологии, нефрологии и трансплантации Волгоградского государственного медицинского университета, представлены на семинарах для практических врачей.
Положения, выносимые на защиту.
- Кардостен оказывает достоверное мягкое и стабильное антигипертензивное действие, уступающее лозартану по эффективности снижения АД на экспериментальной модели АГ.
- Кардостен оказывает выраженное влияние на толерантность к физической нагрузке, повышает производительность сердца и инотропные резервы миокарда при экспериментальной сердечной недостаточности, превосходя препарат сравнения лозартан.
- Длительная (24-недельная) терапия кардостеном достоверно улучшает клиническое состояние пациентов, толерантность к физической нагрузке, гемодинамические показатели, качество жизни при длительной терапии ХСН (ФК I-III).
- После перевода пациентов с комбинированной терапии кардостеном и валсартаном на терапию одним из этих препаратов, а также при переводе с терапии валсартаном на терапию кардостеном и наоборот, сохраняется стабильный клинический эффект.
- По влиянию на клиническое течение ХСН, толерантность к физической нагрузке, гемодинамическим параметрам, морфофункциональным параметрам ЛЖ, качеству жизни при длительной терапии ХСН с I-III ФК кардостен в дозе 0,003г 3 раза в день сопоставим с антагонистом рецептора ангиотензина II валсартаном, назначенным в дозе 80 мг в день внутрь.
- Шестимесячная комбинированная терапия кардостеном в дозе 0,006г 3 раза в день у больных с легкой или умеренной ДХСН на фоне V стадии ХБП сопровождается достоверным улучшением клинического состояния, толерантности к физической нагрузке, оптимизации гемодинамических показателей и качества жизни, способствует регрессии диастолической дисфункции ЛЖ.
- По влиянию на основные показатели диастолической функции ЛЖ, течение ХСН, толерантность к физической нагрузке, качество жизни больных с ХСН и V стадией ХБП кардостен в дозе 0,006г 3 раза в день внутрь сопоставим с валсартаном, назначенным в дозе 80 мг в день внутрь.
- Кардостен в дозе 0,006г 3 раза в день оказывает значимый гипотензивный эффект у больных с V стадией ХБП и нефрогенной артериальной гипертензией (АГ) I-II степени, находящихся на ПГД. Гипотензивные эффекты кардостена и валсартана в вышеуказанных дозах сопоставимы.
- При применении у больных с ХСН, в том числе с V стадией ХБП, находящихся на ПГД, кардостен в составе комбинированной шестимесячной терапии обладает высоким профилем безопасности, хорошей субъективной переносимостью и не влияет на гематологические и биохимические показатели.
Апробация работы. По результатам диссертации опубликовано 28 печатных работ, из них 12 в изданиях, рекомендованных ВАК РФ. Фрагменты исследования были представлены в докладах на III Съезде фармакологов России «Фармакология практическому здравоохранению» (Санкт-Петербург, 2007г.), на Российско-индийской выставке-семинаре «От генериков к инновационным препаратам» (Волгоград, 2011г.), на научных конференциях ВолгГМУ (2009-2011 гг.), а также в материалах на XIII, XIV, XV Российских национальных конгрессах «Человек и лекарство» (Москва, 2006г., 2007г. и 2008г.), на V Международной конференции «Клинические исследования лекарственных средств» (Москва, 2005г.), на научно-практической конференции «Современные принципы и технологии разработки лекарственных средств» (Москва, 2006г.).
Объем и структура работы. Материалы диссертации изложены на 333 страницах машинописного текста и включают введение, обзор литературы, материалы и методы, пять глав собственных исследований, обсуждение результатов, выводы, практические рекомендации, список литературы, список публикации по теме диссертации и приложения. Список литературы представлен 123 отечественными и 301 зарубежным источниками. Работа включает 89 таблиц и иллюстрирована 39 рисунками и 2 схемами.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Работа выполнена на базе кафедры клинической фармакологии и интенсивной терапии Волгоградского государственного медицинского университета (ректор и заведующий кафедрой – академик РАМН, д.м.н., профессор В.И.Петров), в соответствии с перспективным планом научно-исследовательских работ, и состояла из эксперименальных исследований, сравнительных рандомизированных клинических исследований и клинического фармакокинетического исследования. Проведение настоящих исследований одобрил Региональный независимый этический комитет (протокол № 14 заседания РНЭК от 14 декабря 2006 г.), поправок к исходному протоколу РНЭК не было. Условия проведения экспериментальных исследований соответствовали правилам лабораторной практики (GLP) и Приказу МЗ РФ №267 от 19.06.2003г. «Об утверждении правил лабораторной практики». В клинических исследованиях все испытуемые подписывали Форму информированного согласия до момента включения в исследование. Исследования проводились в соответствии с этическими принципами согласно Хельсинкской Декларации, Европейским предписаниям по GCP и Правилам проведения качественных клинических испытаний в Российской Федерации.
Экспериментальная часть работы по сравнительному изучению антигипертензивного действия кардостена и лозартана на крысах со спонтанной гипертонией и кардиопротективного действия кардостена и лозартана на экспериментальной модели хронической сердечной недостаточности выполнена в НИИ фармакологии при ВолгГМУ.
В исследовании антигипертензивного действия кардостена были использованы спонтанно-гипертензивные крысы самцы (SHR) в возрасте 5-6 месяцев, массой 280-300 г со средним АД 185-200 мм рт. ст. (n=30). Животные были разделены на 3 равные группы: 1-ой группе вводился кардостен (ООО «НПФ «Материа Медика Холдинг»), в дозе 0,25 мл/100 г веса крысы; 2-ой группе – лозартан (козаар, «Merk Sharp & Dohme») в дозе 1 мг/100 г в том же объеме; 3-ей группе (контрольной) вводили дистиллированную воду в дозе 0,25 мл/100 г веса крысы. Курс лечения составил 21 день. В течение всего курса лечения и еще 5 дней после приема последней дозы препаратов 3 раза в день проводилось измерение артериального давления (АД) фотоплетизмографическим методом с хвоста крысы с помощью датчика (плетизморецептора).
В исследовании по изучению кардиопротективного действия кардостена в сравнении с лозартаном при ХСН использовано 80 крыс линии Wistar обоего пола (40 самок и 40 самцов), в возрасте 4-5 месяцев, массой 220-250 г. Исследование толерантности к физической нагрузке проводилось с помощью теста принудительного плавания с отягощением а также осуществлялась запись ЭКГ и реограммы, т.е. определялись производительность (насосная функция) сердца и его электрофизиологические параметры.
Для проведения анализа реограммы использовались следующие комплексные показатели гемодинамики:
- Ударный объем крови по Кубичеку (УОК, мл)
- Ударный индекс (УИ, мл/м2)
- Минутный объем крови (МОК, л/мин)
- Время изгнания минутного объема крови (ВИМОК, с)
- Общее периферическое сосудистое сопротивление (ОПСС, динсмс-5)
- Объемная скорость выброса крови (ОСВ, мл/с) и линейная скорость движения крови (ЛСДК, см/с)
- Реографический индекс (РИ, Ом)
- Коэффициент Блюмбергера (КБ, %)
- Внутрисистолический показатель (ВСП, %)
- Реографический диастолический индекс (РДИ, у. е.)
- Максимальная скорость быстрого наполнения (Vмакс, Ом/с)
Для моделирования хронической сердечной недостаточности всем крысам подкожно вводился изопротеренола гидрохлорид (изадрин, «Sigma» Германия) в дозе 80 мг/кг дважды с интервалом 24 часа (Руководство по экспериментальному изучению новых фармакологических веществ, 2005). Через 7 дней после введения второй дозы изадрина все крысы повторно подвергались принудительному плаванию с отягощением, и проводилась запись ЭКГ во II стандартном отведении и реограммы с целью определения их физической работоспособности и производительности сердца.
Критериями эффективности моделирования хронической сердечной недостаточности явились:
- cнижение физической работоспособности в сравнении с первоначальной (более чем на 20%);
- по реографическим данным – снижение минутного объема крови (более чем на 20%);
- по данным ЭКГ – учащение сердечного ритма, увеличение зубца Q, повышение интервала ST и изменение зубца Т в сравнении с исходными показателями.
По результатам плавания из животных были сформированы 3 группы (по 10 самцов и 10 самок):
- 1 группе животных внутрижелудочно вводили кардостен (ООО «НПФ «Материа Медика Холдинг») в дозе 0,25 мл/100 г в течение 28 дней, начиная с 7 дня после 2-й дозы введения изадрина.
- 2 группе животных внутрижелудочно вводили лозартан (козаар, «Merk Sharp & Dohme») в дозе 10 мг/кг в том же объеме – 0,25 мл/100 г, в течение 28 дней, начиная с 7 дня после введения 2-й дозы изадрина.
- 3 группе животных (контроль) внутрижелудочно вводили дистиллированную воду в дозе 0,25 мл/100 г в течение 28 дней, начиная с 7 дня после введения 2-й дозы изадрина.
Через 2 и 4 недели курсового лечения животных исследуемыми веществами было повторно проведено тестирование: принудительное плавание, записана ЭКГ и реограмма, т.е. определена толерантность к физической нагрузке, производительность сердца, электрофизиологические параметры.
Через 28 дней лечения для оценки функционального состояния и резервов миокарда проводились пробы: нагрузка объемом, проба на адренореактивность, максимальная изометрическая нагрузка.
Функциональные возможности миокарда оценивались по следующим тестам:
- нагрузка объемом – внутривенное введение физиологического раствора из расчета 0,3 мл/100г массы животного в течение двух секунд;
- проба на адренореактивность – внутривенное введение адреналина в разведении 10-7 из расчета 0,1 мл/100 г массы животного;
- максимальная изометрическая нагрузка – пережатие восходящей части дуги аорты в течение 30 сек.
Статистическую обработку результатов обоих экспериментов проводили с помощью пакета программ Microsoft Exсel. Результаты исследования представлены как среднее арифметическое и ошибка среднего (М±m). Вычисление достоверности различий между группами производилось с использованием t- критерия Стьюдента. Различия между группами считались достоверными при p<0,05.
Экспериментальное изучение возможных механизмов действия кардостена проводилось на базе кафедры молекулярной фармакологии и радиологии РГМУ, г. Москва.
В этой части работы также была использована изадриновая модель сердечной недостаточности у крыс. Для этого крысам-самцам массой 250-300 г подкожно вводили изопротеренол в дозе 80 мг/кг дважды с интервалом 24 часа. Сроки развития сердечной недостаточности по гипертрофически-дилатационному типу – 5-7 дней после введения 2-й дозы изадрина (изопротеренола).
Белые беспородные крысы-самцы массой 250-300 г были рандомизированы на 2 группы по 8 особей в каждой: первая группа (I) – крысы с экспериментальной сердечной недостаточностью, получающие плацебо (дистиллированная вода 0,25 мл/100 г); вторую группу (II) составили животные с экспериментальной сердечной недостаточностью, получающие кардостен в дозе 0,25 мл/100 г массы животного, начиная со следующего дня после второго введения изопротеренола. Исследуемый препарат вводили внутрижелудочно через зонд. Через 2 недели после начала экспериментов через 24 ч после последнего введения исследуемых препаратов часть животных декапитировали и брали образцы миокарда для исследования показателей NO-обмена. Изолированные кардиомиоциты из левого желудочка сердца крыс выделяли по методике Tytgat J., 1994). Радиолигандный анализ связывания 125I-Ангиотензина II (А II) плазматическими мембранами миокарда проводили по описанной ранее в научной литературе методике (Lopez J., Lorell B., Ingelfinger J., 1994). Внутриклеточную концентрацию ионов кальция в кардиомиоцитах определяли с помощью флуоресцентного зонда FURA-2. Флуоресценцию (500 нм) регистрировали на спектрофлуориметре MPF-3 «Hitachi» при длинах возбуждающего света 340 нм и 380 нм, соответствующих максимуму поглощения связанной с ионами и свободной формы зонда FURA-2. Внутриклеточную концентрацию кальция рассчитывали на основании измерений при двух длинах волн возбуждения (F340 и F380). Активность NO-синтетазы (NOS) определяли радиолигандным методом, описанным Bredt и Snyder (1990) (Bredt D.S, Snyder S.H., 1990). Для статистической обработки был использован критерий Стьюдента.
В основу клинической части настоящей работы положены исследования, проведенные на клинических базах ГБОУ ВПО ВолгГМУ Росздрава: НУЗ ОКБ на ст. Волгоград-1 ОАО «РЖД» (клиническая база кафедры клинической фармакологии и интенсивной терапии с курсами клинической фармакологии ФУВ и клинической аллергологии ФУВ); ГУЗ «ВОККЦ» (клиническая база кафедры кардиологии и функциональной диагностики ФУВ); ГУЗ ВОКБ № 3 (клиническая база кафедры семейной медицины); ГУЗ «ВОУНЦ» (клиническая база кафедры урологии, нефрологии и трансплантации).
Для оценки эффективности и безопасности кардостена при длительной комплексной терапии ХСН было проведено мультицентровое открытое сравнительное рандомизированное клиническое исследование в параллельных группах с последующим сравнением в перекрестных группах, с дополнительной открытой группой сравнения, получающей комбинацию исследуемых препаратов, и последующей открытой рандомизацией в ней.
Критериями включения пациентов в исследование были:
- взрослые пациенты обоего пола в возрасте старше 18 лет с ХСН;
- симптоматическая ХСН, соответствующая II-IV ФК (по классификации NYHA, 1964);
- ФВ ЛЖ 45%, определена эхокардиографически не ранее, чем за три месяца до первого визита;
- подписанное Информированное Согласие пациента.
Основными критериями исключения пациентов из исследования были:
- систолическое АД (САД) выше 160 мм рт.ст. и/или диастолическое АД (ДАД) выше 100 мм рт.ст.; САД < 90 мм рт.ст. в покое;
- неспособность выполнения теста 6-минутной ходьбы;
- нарушения ритма и проводимости сердца: предсердно-желудочковая блокада II-III степени без имплантированного кардиостимулятора; синдром слабости синусового узла без имплантированного кардиостимулятора; синдром Вольфа-Паркинсона-Уайта (WPW – Wolff-Parkinson-White); полная блокада левой ножки пучка Гиса; пробежки желудочковой тахикардии, трепетание или фибрилляция желудочков, диагностированные в течение 3 месяцев перед рандомизацией; в анамнезе – эпизод внезапной аритмической смерти;
- ЧСС в покое 100 < ЧСС < 50 уд./мин;
- имплантированный кардиовертер-дефибриллятор (ICD);
- острый коронарный синдром в течение 3 месяцев до рандомизации;
- планируемая операция реваскуляризации коронарных артерий;
- баллонная ангиопластика или шунтирование, выполненные в течение 3 месяцев до рандомизации;
- заболевание клапанов сердца, являющееся показанием для хирургического лечения;
- гипертрофическая, дилатационная или рестриктивная кардиомиопатия;
- натрий сыворотки < 135 и > 145 ммоль/л; калий сыворотки <3,5 и > 5,5 ммоль/л;
- нарушение функции почек, определяемое значением креатинина крови 200 ммоль/л;
- изменения состава периферической крови: анемия (Hb ниже 100 г/л); лейкопения (< 3000109/л); тромбоцитопения (< 80 000109/л);
- нарушение функции печени, определяемое значением AлAT или AсAT более, чем в три раза верхнего предела нормы;
- в анамнезе ангионевротический отек на блокаторы РААС.
К стандартной терапии* ХСН пациенты получали: группа I – кардостен, 0,003г3 р./сут., сублингвально + валсартан, 80 мг/сут., однократно; группа II – антитела к С-концевому фрагменту АТ1-рецептора ангиотензина II (кардостен, ООО «НПФ «Материа Медика Холдинг»), 0,003г3 р/сут., сублингвально; группа III – валсартан (диован, «Novartis»), 80 мг/сут. однократно. Длительность лечения составила 6 месяцев. Затем пациенты группы I были разделены на подгруппы IА и IБ и в течение следующих 6 месяцев получали терапию кардостеном или валсартаном, соответственно. В группах II и III на втором этапе исследования был произведен перекрест. Максимальный период наблюдения для пациента – 13 месяцев. Контрольные визиты: скрининг, 1 (рандомизация), 2 (3 месяца), 3 (6 месяцев, рандомизация в группе I), 4 (9 месяцев), 5 (12 месяцев), 6 (13 месяцев, для пациентов, получавших кардостен на втором этапе исследования).
Основные изучаемые параметры:
1. Общеклиническое обследование пациента на каждом визите: оценка общего состояния, одышки, выраженности застойных явлений, переносимости физических нагрузок, измерение веса больного, определение ЧСС и АД.
2. Шкала оценки клинического состояния по В.Ю. Марееву (ШОКС) (Рекомендации ВНОК и ОССН 2006, 2009).
_____________________________________________________________________________
* ингибитор АПФ, который больной получал до исследования и имеет возможность применять в дальнейшем; -адреноблокаторы – предпочтительно метопролол, бисопролол, карведилол (если больной его уже принимал ранее); антагонисты рецепторов альдостерона; диуретики (тиазидные, петлевые), сердечные гликозиды и др. (Рекомендации ВНОК и ОССН 2006, 2009)
3. Оценка толерантности к физической нагрузке с помощью теста 6-минутной ходьбы. По пройденной дистанции определяли ФК ХСН (классификация NYHA, 1964; Рекомендации ВНОК и ОССН 2006, 2009).
4. Морфофункциональные параметры сердца оценивались с помощью эхокардиографии (ЭхоКГ), которая проводилась по общепринятой методике на аппарате ACUSON 128XP10 (США). Оцениваемые параметры: конечный диастолический объем левого желудочка (КДО ЛЖ), конечный систолический объем левого желудочка (КСО ЛЖ), фракция выброса ЛЖ (ФВ ЛЖ), ударный объем (УО), минутный объем (МО), сердечный индекс (СИ), масса миокарда левого желудочка (ММЛЖ), индекс массы миокарда левого желудочка (ИММЛЖ).
5. Качество жизни больных с ХСН оценивалось с помощью специализированного Миннесотского опросника «Жизнь с сердечной недостаточностью» MLHFQ, Канзасского опросника качества жизни, Госпитальной шкалы тревоги и депрессии (HADS), Визуально-аналоговой шкалы (ВАШ).
6. Контроль лабораторных показателей (гематологических, биохимических).
7. Нежелательные побочные реакции.
Для оценки влияния кардостена на течение диастолической ХСН (ДХСН), АГ, процессы ремоделирования сердца, качество жизни пациентов с V стадией ХБП, а также сопоставления эффектов кардостена и валсартана на вышеперечисленные показатели было проведено одноцентровое открытое сравнительное рандомизированное клиническое исследование в параллельных группах с последующим сравнением в перекрестных группах, с дополнительной открытой группой сравнения, получающей комбинацию исследуемых препаратов, и последующей открытой рандомизацией в ней.
Критериями включения в исследование были:
- Взрослые пациенты обоего пола в возрасте от 16 до 65 лет с V стадией ХБП (рекомендации Национального почечного фонда США, 2001), находящиеся на ПГД;
- ДХСН I-II ФК, подтвержденная эхокардиографически;
- нефрогенная АГ I-II степени: САД в пределах 140-179 мм.рт.ст. и/или ДАД в пределах 90-109 мм рт. ст.;
- стандартная терапия ХСН и АГ до включения в исследование и в течение всего исследования, обязательно включавшая ИАПФ.
Критерии исключения были идентичными с таковыми в предыдущем исследовании.
К стандартной терапии ХСН пациенты получали: группа I – антитела к С-концевому фрагменту АТ1-рецептора ангиотензина II (кардостен, ООО «НПФ «Материа Медика Холдинг»), 0,006г3 р/сут., сублингвально; группа II – валсартан (диован, «Novartis»), 80 мг/сут. однократно; группа III – кардостен, 0,006г3 р./сут., сублингвально + валсартан, 80 мг/сут., однократно. Длительность лечения составила 6 месяцев. Затем пациенты группы III были разделены на подгруппы IА и IБ и в течение следующих 6 месяцев получали терапию кардостеном или валсартаном, соответственно. В группах I и II на втором этапе исследования был произведен перекрест. Общий период наблюдения для пациента – 12 месяцев. Контрольные визиты: скрининг, 1 (рандомизация), 2 (3 месяца), 3 (6 месяцев, рандомизация в группе I), 4 (9 месяцев), 5 (12 месяцев).
Основные изучаемые параметры:
- Оценка клинического состояния пациента, физикального статуса, измерение веса, ЧСС, АД, заполнение шкалы оценки клинического состояния по Ю.В. Марееву (ШОКС), тест 6-минутной ходьбы с определением ФК ХСН (Рекомендации ВНОК и ОССН 2006, 2009).
- СКФ, рассчитанная по формуле MDRD.
- Морфофункциональные параметры сердца оценивались с помощью допплерЭхоКГ на аппарате «Aloka SSD-5000». Оцениваемые параметры: КДО ЛЖ, КСО ЛЖ, ФВ ЛЖ, УО, МО, СИ, ММЛЖ, ИММЛЖ, а также параметры оценки диастолической дисфункции ЛЖ (ДДЛЖ): Е/А, время изоволюметрического расслабления (ВИВР), время замедления кровотока раннего диастолического наполнения (DТ) и индекс КСО ЛЖ (ИКСО ЛЖ).
- Суточное мониторирование АД (СМАД) проводилось с использованием портативного аппарата «SpaceLabs 90207» (США). Измерения выполнялись в недиализные дни. Исследовались следующие показатели: средние значения САД, ДАД, среднего АД (СрАД), ЧСС за сутки, день и ночь; индекс времени (ИВ) гипертензии за день, ночь, сутки.
- Качество жизни больных с ХСН оценивалось с помощью специализированного Миннесотского опросника MLHFQ, Канзасского опросника качества жизни, HADS и ВАШ.
6. Контроль лабораторных показателей (гематологических, биохимических).
7. Нежелательные побочные реакции.
Статистическая и математическая обработка результатов клинических исследований проводилась на персональном компьютере с помощью пакета прикладных программ «Statistica 6.0». Результаты обработаны с применением непараметрического критерия Манна-Уитни, критерия знаков, парного критерия Уилкоксона. Данные представлены в виде М±m. Различия считали достоверными при уровне значимости р<0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
При изучении сравнительной гипотензивной активности кардостена и лозартана у крыс линии SHR после введения лозартана снижение АД отмечалось с первого дня, достигнув максимума на 3-5 день (со 189±3,9 до 143,3±3,9 мм рт.ст.), т.е. на 25%, а затем на фоне постоянного введения препарата отмечалось незначительное повышение АД до 155-160 мм рт.ст. и оно находилось на этом уровне до конца курсового лечения (рис. 1). На фоне лечения лозартаном максимальное снижение АД наблюдалось в утренние (до 141,1±8,3 мм рт.ст.) и вечерние часы (до 139,2±3,7 мм рт.ст.) на 4-6 день, а в дневные часы отмечалось незначительное повышение АД (до 147,1±5,8 мм рт.ст.). В последующем, начиная с 9-х суток, устанавливается на стабильном уровне на 22-25% ниже исходного. В группе животных, получавших кардостен, гипотензивный эффект после первого введения был незначительным (АД снизилось со 192,4±3,2 до 178,5±7,5 мм рт.ст.), т.е. эффекта первой дозы не наблюдалось. Гипотензивный эффект достигал максимального уровня на 9-е сутки лечения (с 192,4±3,2 до 174,6±4,4 мм рт.ст.). В дальнейшем АД несколько повысилось к 16-м суткам наблюдения, с последующим снижением в среднем на 5% (рис. 1). Наиболее отчетливое снижение АД отмечалось на 7-11 день в утренние (до 168,4±6,1 мм рт.ст.) и вечерние часы (до 169,1±7,8 мм рт.ст.), в обед повышалось до 180 мм рт.ст. При введении кардостена отмечалось снижение АД у 8 животных из 10, и лишь у 2 крыс снижение АД было неотчетливым. У крыс контрольной группы снижение АД практически не наблюдалось и оно колебалось в пределах 185-195 мм рт.ст. (рис. 1). После отмены препаратов у животных, получавших ранее лозартан, в первый день отмечался подъем АД со 155 до 210 мм рт.ст. и в последующие дни постепенно возвращалось к исходному уровню до начала лечения. У крыс, получавших кардостен, на первые сутки после отмены АД повысилось со 184 до 210 мм рт.ст., на вторые сутки - еще до 216 мм рт.ст., с постепенным небольшим снижением до исходного уровня (198 мм рт.ст.).
Выполненное исследование на модели спонтанной гипертензии свидетельствует о том, что кардостен оказывает мягкое, но стабильное достоверное снижение АД в среднем на 10% практически у всех наблюдаемых животных. По антигипертензивной активности он значительно уступает блокатору АТ1-рецепторов АТ II лозартану. Лозартан обладает выраженным антигипертензивным действием в эксперименте. Значительное снижение АД отмечается уже в первый день и в первые часы после перорального введения лозартана спонтанно-гипертензивным крысам. Гипотензивный эффект его нарастает до 4-6 дня, а в последующем, начиная с 9-го дня, устанавливается на стабильном уровне на 22-25% ниже исходного. После прекращения введения лозартана крысам линии SHR наблюдается быстрое повышение АД уже на вторые сутки. Это позволяет сделать вывод о том, что при его отмене существует опасность синдрома рикошета. Полученные результаты согласуется с литературными данными (Красникова Т.Л., 1996; Кобалава Ж.Д., Шварова Е.К., 2008; Гиляревский С.Р., 2009). После прекращения приема кардостена, также как и лозартана, отмечается быстрое повышение АД выше исходного. Эти данные позволяют рекомендовать постепенное прекращение лечения кардостеном, с целью избегания синдрома отмены.
На основании полученных результатов можно предполагать, что кардостен, оказывая антигипертензивное действие на «жесткой» модели АГ, может оказаться достаточно эффективным средством у больных с начальными формами этой патологии. Терапевтическая активность исследуемого препарата предполагает возможность его использования в самых разнообразных случаях, в том числе и при предгипертензивных состояниях, когда повышение АД носит пограничный характер и связано с эмоциональным напряжением и временными неблагоприятными ситуациями.
При сравнительном изучении кардиопротективного действия кардостена и лозартана на экспериментальной модели ХСН у крыс самцов с ХСН, получавших лозартан, толерантность к физической нагрузке увеличилась на 10% по сравнению с показателями после введения изадрина лишь через 28 дней лечения. У крыс, получавших кардостен, также отмечается повышение физической работоспособности только через 24 дня лечения на 8%. У крыс самцов контрольной группы через 14 дней лечения отмечается снижение толерантности к физической нагрузке еще на 5%, а через 28 дней лечения отмечается незначительное повышение физической работоспособности (на 5,5%) (таб. 1). У крыс самок с ХСН, получавших лозартан, через 14 дней лечения отмечается повышение физической работоспособности на 17%, а через 28 дней лечения – на 34,5% по сравнению с показателями после повторного введения изадрина. У крыс самок, получавших кардостен, повышение толерантности к физической нагрузке через 14 и 28 дней составило 20% и 27,8%, соответственно. У крыс самок контрольной группы через 14 дней «лечения» изменений не отмечается, а через 28 дней отмечается повышение физической работоспособности только на 9,6% по сравнению с показателями после введения изадрина (таб. 1).
Таблица 1. Толерантность к физической нагрузке (плавательная проба (сек.)) у крыс инии Wistar с хронической сердечной недостаточностью, получавших в течение 28 дней кардостен и лозартан, М±m.
| Исследуемые вещества | Продолжительность плавания (сек.) | |||
| Исходные данные | Через 7 дней после введения 2-й дозы изадрина | Через 14 дней лечения препаратами | Через 28 дней лечения препаратами | |
| Крысы самцы | ||||
| Кардостен | 158,1±9,02 | 118,9±3,03 | 122,1±3,8 | 128,2±3,78* |
| Контроль | 162,3±8,37 | 119,9±4,86 | 114,0±4,67 | 126,5±7,9 |
| Лозартан | 156,9±4,4 | 117,5±4,1 | 120,8±4,6 | 129,8±3,9* |
| Крысы самки | ||||
| Кардостен | 157,9±5,4 | 94,8±3,9 | 113,7±3,6* | 121,2±3,6* |
| Контроль | 150,2±13,1 | 93,3±2,58 | 93,2±3,6 | 102,0±5,4 |
| Козаар | 149,0±9,43 | 90,8±5,08 | 106,8±4,27* | 122,4±3,6* |
Примечание: * – p<0,05, достоверность различий по сравнению с показателями через 7 дней после введения 2-ой дозы изадрина.
Таким образом, нами обнаружены интересные данные о том, что исследуемые вещества не одинаково влияют на толерантность к физической нагрузке у крыс самцов и самок с ХСН, требующие, возможно, уточнения в дальнейших исследованиях.
Что касается влияния кардостена и лозартана на электрофизиологические показатели миокарда у животных с ХСН, то крыс самцов, получавших лозартан или кардостен, через 28 дней «лечения» отмечалось более выраженное снижение частоты сердечных сокращений, чем у животных контрольной группы. Однако, у крыс самок, получавших лозартан, отмечалось снижение ЧСС более выраженное, чем у крыс, получавших кардостен и воду. Снижение ЧСС у крыс, получавших кардостен, и животных контрольной группы было сопоставимо (таб. 2).
Таблица 11. Частота сердечных сокращений у крыс линии Wistar с хронической сердечной недостаточностью, получавших в течение 28 дней кардостен и козаар, М±m.
| Исследуемые вещества | Исходные данные | Через 7 дней после введения изадрина | Через 14 дней лечения | Через 28 дней лечения |
| Крысы самцы | ||||
| Кардостен | 392,658±15,46 | 434,563±11,9 | 427,912±15,2 | 400,202±15,7* |
| Контроль | 411,12±13,3 | 440,157±13,7 | 433,811±12,3 | 421,554±13,3* |
| Козаар | 394,766±12,9 | 433,264±10,1 | 418,3117±15,5 | 396,503±11,7* |
| Крысы самки | ||||
| Кардостен | 351,783±17,1 | 418,21±16,2 | 388,11±15,4 | 384,66±14,9* |
| Контроль | 372,55±11,9 | 425,08±9,9 | 401,13±9,8 | 394,83±10,9* |
| Козаар | 355,68±13,6 | 397,66±11,4 | 381,43±15,6 | 374,31±14,2 |
Примечание: * – p<0,05, достоверность различий по сравнению с показателями через 7 дней после введения 2-й дозы изадрина
У крыс самцов после лечения лозартаном отмечалось постепенное уменьшение длительности и амплитуды зубца Р и продолжительности интервала РQ, комплекса QRS и QRST, уменьшение амплитуды зубца T, что свидетельствует о положительной динамике электрофизиологических свойств сердца. У крыс самцов, получавших кардостен, отмечалось уменьшение продолжительности интервала РQ и амплитуды зубца T. У крыс самцов контрольной группы положительной динамики на ЭКГ практически не наблюдалось. У крыс самок с ХСН, получавших лозартан и кардостен, к 28 дню лечения отмечалось уменьшение продолжительности комплекса QRS, QRST и без изменений у животных контрольной группы. У всех крыс самок наблюдалось уменьшение длительности зубца P, уменьшение амплитуды зубца Q в сравнении с амплитудой зубца R. Амплитуда зубца T к 14 дню лечения снижалась у всех самок и к 28 дню повышалась у крыс контрольной группы.
По данным реографии через 14 дней лечения наблюдалось повышение ударного и минутного объема крови у крыс самцов с ХСН, получавших лозартан, на 30% и 24%, соответственно, по сравнению с показателями, которые отмечались через 7 дней после повторного введения изадрина. У самцов, получавших кардостен, и животных контрольной группы изменений УО и МО не наблюдалось. У крыс самок, получавших лозартан, через 14 дней лечения повышение ударного и минутного объема крови составило 32% и 28,5%, соответственно, по сравнению с показателями, которые отмечались через 7 дней после повторного введения изадрина. У самок, получавших кардостен, и животных контрольной группы повышение УО и МО было сопоставимо. Через 28 дней лечения исследуемыми веществами наблюдается повышение УО и МО у всех крыс, но у крыс контрольной группы меньше, чем у животных, получавших лозартан и кардостен. У крыс обоего пола, получавших лозартан, повышение ударного и минутного выброса крови в среднем составило 66,3 % и 55,8 % соответственно по сравнению с показателями, которые отмечались через 7 дней после повторного введения изадрина. У крыс самцов, получавших кардостен, повышение ударного и минутного выброса составило 19% и 10%, соответственно, а у самцов контрольной группы на 8% и 5%, соответственно. Также у самок, получавших лозартан и кардостен, отмечается достоверное повышение сократительной активности желудочков (на 11,1% и 8,1%, соответственно) и уменьшение общего периферического сосудистого сопротивления (на 41,4% и 31,8%, соответственно).
Таким образом, на основании полученных данных можно заключить, что кардостен повышает сократимость миокарда у крыс с хронической сердечной недостаточностью, но по кардиопротективному действию уступает лозартану, хотя описанные изменения в группе животных, получавших кардостен, носили достоверный характер. В ряде случаев достоверность изменений показателей гемодинамики у животных, получавших лозартан, достигалась уже к 14 дню лечения, а по его окончанию отмечалась более высокая производительность сердца, чем у крыс, получавших кардостен и животных контрольной группы.
При изучении влияния исследуемых препаратов на функциональные резервы сердца крыс самцов было показано, что на нагрузку объемом был получен достоверный ответ в группе животных, получающих лозартан (повышение внутрижелудочкового давления на 20,8%, скорости сокращения и скорости расслабления миокарда (на 37,6% и 37,7%, соответственно). У самок в обоих группах, получавших кардостен или лозартан, в ответ на нагрузку объемом происходило повышение скорости сокращения и скорости расслабления миокарда: кардостен – на 24,7% и 30,3%, соответственно, и лозартан – на 19,6% и 25,7%, соответственно. Повышение внутрижелудочкового давления у крыс, получавших кардостен и лозартан, было практически одинаковым – на 8,8% и 9,7%.
При пробе на адренореактивность у всех крыс самцов сопоставимо увеличивалось внутрижелудочковое давление. У всех животных отмечалось значительное увеличение скорости сокращения и несколько меньше скорости расслабления. У крыс, получавших кардостен, повышение скорости сокращения миокарда (на 118,5%) было выше, чем у животных, получавших лозартан и воду. Повышение внутрижелудочкового давления у самцов, получавших лозартан и кардостен, было практически одинаковым, но выше, чем у животных контрольной группы. У крыс, получавших лозартан, скорость расслабления миокарда была выше, чем у животных, получавших кардостен и воду.
При максимальной изометрической нагрузке (пережатии восходящей дуги аорты) у крыс самцов с ХСН наиболее значительное повышение внутрижелудочкового давления отмечалось у животных, получавших лозартан (на 150,6%). У самцов, получавших кардостен и воду, повышение внутрижелудочкового давления было сопоставимо – на 110,9% и 97,2%, соответственно. У крыс самок, получавших лозартан, внутрижелудочковое давление повысилось на 191,7%. У животных, получавших кардостен, отмечалось повышение внутрижелудочкового давления на 122,3 %, а у крыс контрольной группы – на 100,1%. При максимальной изометрической нагрузке у всех животных ЧСС менялась нестабильно.
Выполненное сравнительное исследование по изучению кардиопротективного действия кардостена в сравнении с лозартаном на модели ХСН показало, что кардостен обладает кардиопротективным действием, но уступает лозартану по степени его выраженности. Тем не менее, учитывая значимые изменения гемодинамики, сократительных резервов миокарда ЛЖ, выраженные нарушения ритма, возникающие при воспроизведении изадриновой модели ХСН, и имеющиеся положительное влияние кардостена на миокард в этих условиях в течение ограниченного периода времени, можно прогнозировать реализацию этих эффектов в клинике.
Для изучения возможных механизмов действия кардостена нами было более детально исследовано распределение рецепторов АТII с применением ингибиторного анализа, основанного на использовании селективных лигандов АТ1- и АТ2- подтипов рецепторов ирбесартана и PD-123319, соответственно. Типичные кривые вытеснения связанного с АТ2-рецепторами 125I-AII в двух группах животных представлены на рис. 1. Видно, что число мест связывания PD-123319 отличаются не значительно.
Рис. 1. Кривые вытеснения связанного с мембранами кардиомиоцитов крыс 125I-AII в присутствии PD-123319: (1) - плацебо; (2) – кардостен.

Установленное (рис. 2) существенное различие в числе мест связывания ирбесартана (АТ1-подтип рецепторов), по-видимому, объясняется компенсаторным ответом на блокаду АТ1-рецепторов кардостеном.
Были рассчитаны значения константы ингибирования (Ki) и коэффициента Хилла (nH), приведенные в табл. 3. Анализ полученных результатов позволил высказать предположение об изменении вклада АТ1-рецепторов в специфическом связывании 125I-AII плазматическими мембранами кардиомиоцитов крыс с экспериментальной сердечной недостаточностью на фоне введения кардостена.
Рис. 2. Кривые вытеснения связанного с мембранами кардиомиоцитов крыс 125I-AII в присутствии ирбесартана: (1) - плацебо; (2) – кардостен.

Таблица 3. Параметры конкурентного ингибиторного анализа связывания 125I-ангиотензина II плазмамембранной фракцией кардиомиоцитов, получавших плацебо (1 группа) или кардостен (2 группа) (M±mt).
| Группа животных Соединение | 1 группа, n=8 | 2 группа, n=8 | ||
| Ki,нмоль/л | nH | Ki,нмоль/л | nH | |
| Aнгиотензин II | 5,1 | 1,9±0,4 | 6,3 | 2,0±0,5 |
| PD-123319 | 2,7 | 1,1±0,3 | 3,2 | 0,9±0,3 |
| Ирбесартан | 26 | 0,9±0,2 | 22 | 0,8±0,3 |
Обозначения: Ki - константа ингибирования; nH – коэффициент Хилла.
Рис. 3. Распределение АТ1- и АТ2-подтипов рецепторов AТII плазматическими мембранами кардиомиоцитов крыс при экспериментальной модели сердечной недостаточности и сочетании этой модели с введением кардостена.
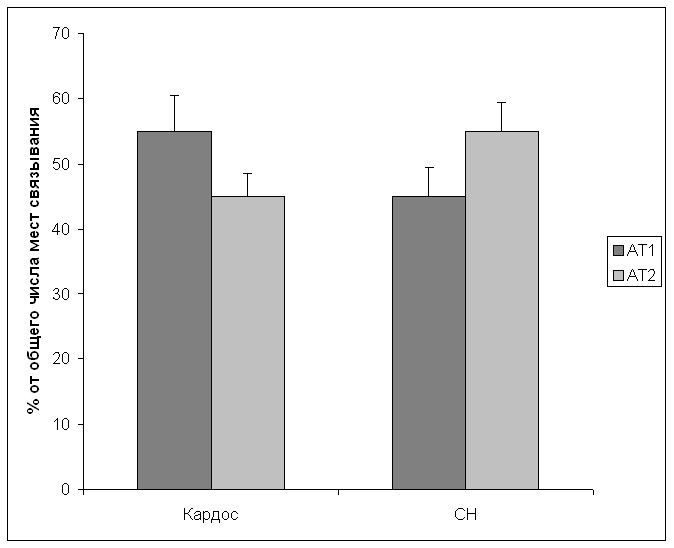
Дальнейшие исследования подтвердили наше предположение. Как видно из данных, представленных на рис. 3, введение кардостена приводит к изменению соотношения АТ1/АТ2 рецепторов в кардиомиоцитах при экспериментальной сердечной недостаточности. Наблюдается достоверное увеличение экспрессии АТ1-рецепторов, при этом уровень АТ2-подтипа рецепторов статистически значимо не меняется. В результате отмеченных изменений увеличение вклада АТ2-подтипа рецепторов, отмечающееся при экспериментальном моделировании сердечной недостаточности, имеет не столь выраженный характер.
Таким образом, выявлены достоверные изменения рецепторного профиля для АТII на фоне введения кардостена, патофизиологическое значение которых были исследованы в следующей серии экспериментов.
Оценка функциональной активности АТ1-подтипа рецепторов АТII включала изучение кальциевого ответа кардиомиоцитов с помощью флуоресцентного индикатора свободных ионов Са2+ в цитоплазме клеток в норме и при экспериментальной патологии.
В интактных кардиомиоцитах базальная концентрация свободных ионов кальция в саркоплазме колеблется на уровне 125-145 нМ, в поддержании этих значений [Са2+]цит основная роль принадлежит Na+/Ca2+-обмену. Сравнение показателей базального (диастолического) уровня [Са2+]цит в кардиомиоцитах в группе животных, получавших кардостен (2 группа), и контрольной группы (1 группа) не выявило достоверного различия: 192±13 и 212±19 нМ (n=8), соответственно.
В следующей серии экспериментов оценивали влияние 2-х недельного введения кардостена на индуцированный уровень [Са2+]цит в кардиомиоцитах. Подъем [Са2+]цит вызывали с помощью двух различных подходов: увеличением внеклеточной концентрации ионов К+ (I) или внесением в суспензию клеток кофеина (II).
I. При повышении внеклеточного содержания ионов калия от 20 до 80 мМ наступает частичная деполяризация мембран кардиомиоцитов, сопровождающаяся открытием потенциалзависимых Са2+-каналов сарколеммы и входом кальция в клетку. Повышение уровня Са2+ начинается через 5-10 секунд после добавления KCl (конечная концентрация 40 мМ) и быстро возрастает в течение 1-2 мин до значения 510±20 нМ. В последующие 2-2,5 мин [Са2+]цит уменьшается до первоначального уровня.
Верапамил, начиная с концентрации 0,5 мкМ, дозозависимо ингибировал повышение [Са2+]цит. Рассчитанное значение IC50 составило 2,8±0,3 мкМ. Действие верапамила определяется его способностью блокировать L-тип Са2+-каналов, имеющих участок связывания для 1,4-дигидропиридинов. На данной экспериментальной модели не выявлено отличие в Са2+-ответах кардиомиоцитов, полученных из миокарда крыс 1 и 2 групп.
II. Помимо входа Са2+ из внеклеточного пространства важным источником поступления ионов кальция в миоплазму являются цистерны саркоплазматического ретикулума (СПР). В физиологических условиях выброс Са2+ из СПР индуцируется инозитолтрифосфатом (IP3) и повышением концентрации в цитозоле самих ионов Са2+ - так называемый механизм кальций-индуцируемого высвобождения кальция. В экспериментальных условиях выход Са2+ из СПР стимулируют кофеин, рианодин. Эти же соединения препятствуют накоплению Са2+ в СПР, что приводит к их опустошению. Добавление к суспензии клеток кофеина (10 мМ) вызывает быстрый подъем [Са2+]цит, который в среднем на 20% ниже максимального уровня Са2+, регистрируемого при К+-деполяризации. Видно, что кинетика изменения [Са2+]цит также имеет свои характерные особенности. При примерно равной скорости повышения [Са2+]цит дальнейшее уменьшение уровня кальция при действии кофеина заметно пролонгировано по времени. Это объясняется тем, что в присутствии кофеина нарушается захват и депонирование Са2+ в СПР, основная нагрузка по удалению кальция из цитозоля переходит к системе Na+/Са2+-обмена. Совместное действие кофеина и ингибитора Na+/Са2+- переноса амилорида (40 мкМ) приводит к еще более выраженному замедлению снижения [Са2+]цит.
На кофеиновой модели в кардиомиоцитах крыс контрольной группы (1) отмечено уменьшение скорости выведения Са2+, наподобие амилорид-обработанных клеток. Динамика изменения [Са2+]цит в кардиомиоцитах 2 группы достоверно отличалась: наблюдали более быстрое снижение индуцированного подъема [Са2+]цит, кроме того, снижение уровня кальция достигает более низких значений (161±20 нМ против 205±25 нМ в контрольной группе) (рис. 4).
Рис. 4. Динамика изменения [Са2+]цит в кардиомиоцитах контрольной группы (1) и на фоне введения кардостена (2).
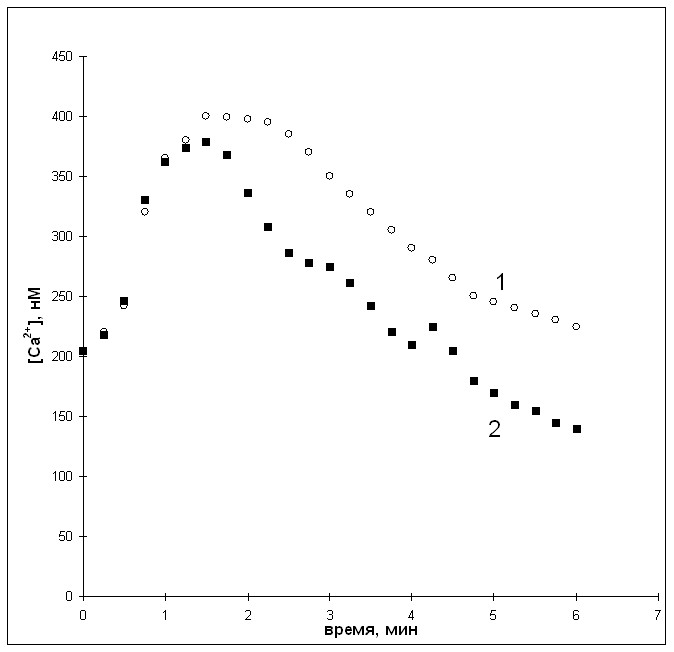
На основании данных, полученных нами с использованием различных экспериментальных моделей, можно заключить, что кардиотропное действие кардостена связано с его нормализующим влиянием на Са2+-обмен в кардиомиоцитах, выраженное в ускоренном снижении индуцированного подъема [Са2+]цит.
В задачи следующего раздела нашей работы входила оценка функциональной активности АТ2-подтипа рецепторов АТII. Для этого было проведено сравнительное исследование влияния кардостена на показатели NO-обмена в миокарде при экспериментальной сердечной недостаточности, включающее изучение активности индуцибельной (iNOS) и конститутивной форм NO-синтетазы (eNOS), определение уровня конечных стабильных метаболитов NO в миокарде.
Влияние 2-х недельного введения кардостена на активность iNOS, eNOS, суммарный уровень метаболитов оксида азота NOx в миокарде экспериментальных животных представлены в табл. 4. Выявлены статистически значимые отличия в двух случаях: кардостен снижал активность iNOS и суммарный уровень метаболитов оксида азота NOx. Достоверного влияния препарата на активность eNOS не отмечено.
Таблица 4. Показатели NO-обмена в миокарде крыс (M±mt).
| Условия эксперимента | Активность iNOS, пмоль L-цитруллина/мин/мг белка | Активность eNOS, пмоль L-цитруллина/мин/мг белка | NOx, нмоль/мг белка |
| I группа – контрольная | 1,19±0,29 | 0,39±0,03 | 13,7±1,6 |
| II группа - введение «Кардоса» | 0,67±0,14* | 0,41±0,04 | 9,0±0,9* |
* - достоверное отличие (р<0,05) от контрольных значений.
Основываясь на полученных результатах, можно заключить, что длительная ишемия, обусловленная введением высоких доз -адреномиметика изопротеренола, вызывает повреждение клеток, что приводит к нарушению барьерной функции плазматической мембраны миоцитов, повышению проницаемости для различных ионов, в частности, к увеличению содержания Ca2+ в цитоплазме. Накопление Са2+ имеет, по меньшей мере, три опасных последствия. Во-первых, провоцируется ишемическая контрактура, сопровождающаяся дальнейшим уменьшением и без того уже недостаточного кровотока по коронарным сосудам. Во-вторых, избыток митохондриального кальция провоцирует дефицит АТФ. Один из защитных механизмов, препятствующих накоплению кальция в цитоплазме, заключается в захвате избыточных ионов митохондриями, при этом во внутримитохондриальном пространстве аккумулируются положительно заряженные ионы. Чтобы уравновесить эти изменения в заряде, митохондрии должны активно выкачивать протоны с использованием АТФ. Это еще один метаболически опасный цикл реакций, приводимый в движение избыточным содержанием Са2+. В-третьих, при увеличении уровня кальция наблюдается активация некоторых фосфолипаз (так называемых Са2+-зависимых фосфолипаз, к которым относятся фосфолипазы А2 и С), способствуя тем самым разрушению клеточных мембран и приводя к накоплению токсических лизофосфолипидов. И, наконец, избыток Са2+ предрасполагает к Са2+-обусловленным аритмиям, таким как некоторые виды ишемической или реперфузионной желудочковой тахикардии (Ripley T. L., 2005). Повышение концентрации свободного цитозольного кальция может служить одной из причин развития апоптоза кардиомиоцитов. В этой связи определенные перспективы могут быть связаны с дальнейшим клиническим исследованием кардостена.
К точкам приложения действия кардостена на патогенез развития экспериментальной сердечной недостаточности можно отнести: изменение рецепторного профиля кардиомиоцитов к ангиотензину II, а также влияние на кальциевый гомеостаз кардиомиоцитов и NO-обмен в миокарде.
Усиленное образование оксида азота – один из компенсаторных адаптивных процессов, позволяющих поддерживать тонус гладкой мускулатуры и коронарный кровоток в условиях кардиотоксического действия изопротеренола. Синтез NO, регулирующий сосудистый тонус, определяется эндотелиальным ферментом (eNOS) – конститутивной изоформой NO-синтетазы. В то же время избыточная продукция активных форм кислорода, к которым относится оксид азота, может быть ответственна за нарастание апоптотической гибели кардимиоцитов и декомпенсацию сердечной деятельности (Watanabe T., Barker T. A., Berk B. C., 2005).
Учитывая то, что максимальное влияние кардостена проявилось при наибольших отклонениях показателей NO-обмена, вызванных экспериментальной патологией, это может указывать на регулирующий (модулирующий) характер воздействия кардостена на состояние NO-обмена в миокарде. Выявленные изменения NO-обмена на фоне приема кардостена могут рассматриваться как фармакологическое действие, направленное на восстановление баланса между компенсаторными и повреждающими механизмами, индуцированными NO в миокарде при экспериментальной патологии.
Следующим этапом исследования стало изучение в сравнительном аспекте клинической эффективности и безопасности кардостена в комплексной терапии хронической сердечной недостаточности в условиях реальной клинической практики в сравнении с валсартаном (диован, «Novartis») при их последовательном, перекрестном и комбинированном применении.
Программу, определенную протоколом исследования, прошли 54 пациента, разделенных на три примерно равные группы. При сравнении трех групп по демографическим, конституциональным критериям, тяжести ХСН, проводимой медикаментозной терапии мы не получили статистически достоверных различий. Следует отметить, что уровень САД во всех группах на момент начала исследования был сопоставим и находился в диапазоне нормальных значений.
Результаты этого клинического исследования показали, что кардостен по своей клинической эффективности не уступает валсартану при добавлении их к стандартной, базисной терапии ХСН. Дополнительная блокада РААС положительно сказалась на клиническом состоянии пациентов, на переносимости ими физических нагрузок. Длительная шестимесячная терапия как кардостеном, так и валсартаном, больных с ХСН сопровождалась достоверным уменьшением степени выраженности симптомов сердечной недостаточности (на 14,0% и 12,4%, соответственно), при этом кардостен несколько превосходил по степени выраженности эффекта препарат сравнения и их комбинацию (снижение показателя в группе, получавшей кардостен и валсартан составило 11,2% за 6 месяцев лечения). После перевода с комбинированной терапии кардостеном и валсартаном на терапию одним из этих препаратов, а также замены кардостена валсартаном и наоборот, существенного изменения клинического течения заболевания не происходило, хотя сохранялась тенденция к дальнейшему снижению этого показателя до конца исследования практически во всех группах. И только в подгруппе пациентов, получавших валсартан, к окончанию второго этапа наблюдения продолжающееся некоторое уменьшение степени выраженности симптомов ХСН стало достоверным (на 5,6% от исходных показателей второго этапа лечения).
Применение кардостена, валсартана и их комбинации в комплексной терапии ХСН способствовало значительному повышению толерантности к физической нагрузке, о чем свидетельствуют результаты теста шестиминутной ходьбы. Максимально выраженные изменения также произошли уже через 3 месяца наблюдения (в группе кардостена – на 12,6%, в группе валсартана – на 7,4% и в группе валсартан+кардостен – на 10,1%), но и после перевода пациентов с комбинированной терапии кардостеном и валсартаном на терапию одним из них или замену кардостена на валсартан и наоборот, пройденная дистанция существенно не изменилась во всех группах.
Изменения гемодинамических показателей в виде САД и ДАД были наиболее ярко выражены в группе пациентов, получавших комбинированную терапию кардостеном и валсартаном, что может объясняться однонаправленным и значимым влиянием валсартана на уровень АД и умеренным гипотензивным эффектом у кардостена. Теми не менее, с учетом того, что в исследование были включены пациенты с уровнем АД, находящимся в диапазоне нормальных значений, ни гипотонии первой дозы, ни устойчивой гипотензии в процессе лечения комбинацией кардостена и валсартана у пациентов этой группы не наблюдалось. Это может объясняться именно модулирующим влиянием кардостена на эту регуляторную систему (Эпштейн О.И., 2003; Эпштейн О.И., Береговой Н.А., Ратушняк А.С., 2001). По влиянию на ЧСС все схемы терапии оказались равнозначными – при исходно нормальных значениях ЧСС достоверных изменений в группах в процессе лечения выявлено не было.
У пациентов со сниженной фракцией выброса ЛЖ значимым влиянием на конечный диастолический объем (КДО) и конечный систолический объем (КСО) ЛЖ обладал кардостен, о чем свидетельствует достоверное снижение этих показателей уже в течение первых 6 месяцев лечения (на 12,8% и 21,1%, соответственно). Далее эти изменения выражались лишь в виде тенденции. Влияние валсартана было более значимым на КСО (снижение показателя на 14,7%), чем на КДО (- 5,8%), но этот эффект был достоверен как к окончанию первого, так и к окончанию второго этапа исследования. Комбинация кардостена и валсартана не приводила к достоверным изменениям этих показателей. При этом кардостен с высокой степенью достоверности и наиболее выражено увеличивал ФВ ЛЖ уже в течение первого полугодия наблюдения (на 21,0%). Значимо этот показатель увеличивался и в группе кардостен+валсартан (на 9,9%). Однако далее, при изменении схемы терапии во всех группах, значительными эти изменения не были ни в одной из них.
Анализ данных Миннесотского опросника свидетельствовал о значимом улучшении качества жизни пациентов, получавших монотерапию кардостеном или валсартаном (-9,1% и -13,2%, соответственно). Это проявилось в достоверном снижении среднего количества набранных баллов уже через 6 месяцев после начала исследования, причем быстрее эти изменения наступили в группе кардостена. В дальнейшем после проведения перекреста в этих группах достигнутый результат лишь поддерживался на протяжении еще 6 месяцев наблюдения, что свидетельствует о стабильности достигнутого ранее эффекта.
По данным Канзасского опросника качество жизни пациентов улучшалось у пациентов всех групп и проявлялось также достоверным снижением среднего количества набранных баллов с максимально выраженным результатом в группе пациентов, получавших кардостен в течение первых 6 месяцев лечения (на 11,4%). Статистически значимое улучшение показателей наблюдалось и в дальнейшем в подгруппах, получавших кардостен или валсартан после комбинированной терапии этими препаратами (на 7,0% и 8,3%, соответственно, относительно исходных показателей второго этапа лечения).
Прогрессивное улучшение клинического состояния пациентов, получавших кардостен или валсартан, нашло отражение и в их психологическом статусе. Это проявилось в достоверном снижении депрессивных и тревожных проявлений по HADS в этих группах (на 13,9% в обеих группах), причем наиболее существенно за первые полгода исследования. Причем положительные сдвиги в этих группах были сопоставимы. После проведения в них перекреста количество баллов, набранных пациентами по госпитальной шкале тревоги и депрессии, продолжало недостоверно снижаться, достигнув минимума в конце исследования.
Улучшилось качество жизни пациентов и по данным ВАШ. Во всех группах наблюдения положительные сопоставимые результаты были достигнуты, как и в предыдущих случаях, уже в первом полугодии: в группе кардостена – на 18,7%, в группе валсартана – на 22,0% и в группе кардостен+валсартан – на 12,1%. Однонаправленные изменения продолжились и во втором полугодии, несмотря на перевод больных с комбинированной терапии кардостеном и валсартаном на терапию одним из этих препаратов и проведение перекреста в двух других группах.
Немаловажным является и тот факт, что полученные результаты позволяют говорить об устойчивости всех достигнутых положительных эффектов при длительной терапии ХСН на протяжении 1 месяца после отмены кардостена, что, несомненно, является дополнительным важным свойством препарата.
Отсутствие развития нежелательных эффектов как в ходе исследования, так и после его завершения, в группе пациентов, получавших этот препарат, свидетельствует о высоком профиле безопасности кардостена.
Таким образом, проведенное сравнительное исследование позволяет судить об оптимизации терапии ХСН как кардостеном, так и валсартаном. В то же время комбинированная терапия кардостеном и валсартаном не имеет преимуществ перед монотерапией этими препаратами. Объяснением этого может являться то, что кардостен и валсартан реализуют свои фармакодинамические эффекты через один и тот же вид рецепторов, но через разные механизмы воздействия на него. Подтверждением этого является тот факт, что при переводе пациентов с комбинации кардостен+валсартан на монотерапию этими препаратами сохраняется стабильность клинических и гемодинамических показателей.
Программу, определенную протоколом клинического сравнительного исследования кардостена и валсартана у больных с диастолической ХСН, находящихся на программном гемодиализе, прошли 30 пациентов, разделенных на три равные группы. При сравнении трех групп по демографическим, конституциональным критериям, тяжести ХСН и ХБП, длительности и качеству ПГД, проводимой медикаментозной терапии после рандомизации мы не получили статистически достоверных различий.
Также группы были сопоставимы по группы были сопоставимы по основным морфо-функциональным параметрам миокарда, пройденной дистанции в ходе выполнения теста шестиминутной ходьбы, показателям СМАД, количеству баллов, набранных при анализе опросников качества жизни, уровню исходных гематологических и биохимических параметров анализа крови.
Достоверное снижение суммы набранных баллов по ШОКС наблюдалось уже в конце третьего месяца исследования, составив по сравнению с исходными данными 51,5% в группе I, 47,2% в группе II и 44,1% в группе III. В конце первого полугодия снижение составило 60,6%, 66,7% и 73,5%, соответственно, в группах I, II и III. После смены схемы терапии изменения суммы баллов, набранных по ШОКС, не наблюдалось ни в одной из групп и подгрупп. В группе I ФК ХСН на момент рандомизации в среднем был равен 1,3±0,2. I ФК ХСН диагностировали у 70% больных, II ФК ХСН – у 30% больных. Исходно в группе II ФК ХСН в среднем составил 1,4±0,2. I и II ФК ХСН диагностирован и у 60% и 40% больных соответственно. В группе III ФК ХСН на момент рандомизации в среднем равнялся 1,3±0,2, на долю I и II ФК ХСН приходилось 70% и 30% соответственно. Достоверное снижение среднего ФК ХСН, определявшееся во всех группах уже через три месяца после начала исследования, составило за первое полугодие 38,5%, 35,7% и 53,8% в группах I, II и III, соответственно. К окончанию первого шестимесячного этапа наблюдения в группе I доля больных с I ФК ХСН возросла до 80%, в группе II – до 90% за счет уменьшения числа больных с II ФК. У 20% больных в группе I и 10% в группе II каких-либо признаков ХСН по ШОКС не было отмечено. В группе III доля больных с I ФК ХСН уменьшилась до 60%, еще у 40% пациентов признаков ХСН не обнаружено. На втором этапе исследования среднее значение ФК ХСН и соотношение пациентов с I ФК ХСН и без признаков ХСН осталось прежним во всех группах и подгруппах.
Продемонстрировано положительное влияние кардостена, валсартана и их комбинации на повышение толерантности к физической нагрузке. За первые шесть месяцев исследования прирост количества пройденных метров составил 13,1%, 13,6% и 14,1% в группах I, II и III соответственно. В дальнейшем мы не обнаружили статистически значимых изменений результатов теста ни в одной из групп.
Для оценки эффективности проводимой терапии у больных с ХСН особое внимание уделялось анализу изменений морфо-функциональных показателей сердца. Нами не обнаружено достоверных изменений систолической, инотропной функции, относительной толщины стенок, объемов ЛЖ. Напротив, среднее значение ИММЛЖ уже через три месяца после начала лечения статистически значимо снизилось во всех группах. Между визитами 1 и 3 величина ИММЛЖ упала на 16,8%, 14,9% и 19%, соответственно в группах I, II и III. После изменения схемы терапии ИММЛЖ продолжил уменьшаться, снизившись к концу исследования по сравнению со значениями, полученными во время визита 3 на 9,8% в группе I, 8,4% в группе II, 7,6% в подгруппе IIIА и 7,1% в подгруппе IIIБ.
Нами показано существенное положительное влияние кардостена, валсартана и их комбинации на параметры диастолического наполнения ЛЖ. Уже через три месяца отмечено увеличение соотношения Е/А во всех группах, оказавшееся достоверным только в группе I (27,3%) и III (16,7%). Через шесть месяцев статистически значимый прирост величины Е/А наблюдался в тех же группах, составив 36,4% и 33,3%, соответственно, в группе I и III. К визиту 5 по сравнению со значениями, полученными на визите 3, величина Е/А достоверно повысилась только в группе и подгруппе, получавшей кардостен: на 14,3% в группе II и 13,3% в подгруппе IIIБ.
В конце шестого месяца исследования по сравнению с исходными величинами среднее значение DT снизилось на 40%, 31,7% и 40,1%, соответственно, в группах I, II и III. В конце исследования DT было меньше, чем шесть месяцев назад, во всех группах и подгруппах, но достоверными изменения оказались только в группе II (9,2%) и подгруппе IIIБ (9,5%).
Снижение ВИВР ЛЖ между визитами 1 и 2 было достоверно и составило в группе I 30,5%, в группе II 29,4% и в группе III 36%. За шесть месяцев ВИВР ЛЖ уменьшилось на 43,9%, 37,2% и 42,3% соответственно в группах I, II и III. В течение трех месяцев после изменения схемы терапии существенных изменений данного показателя не произошло ни в одной из групп и подгрупп. За второе полугодие ВИВР ЛЖ достоверно снизилось только в группе и подгруппе, получавшей кардостен: в группе II на 9,6% и в подгруппе IIIБ на 9,1%.
Другим признаком улучшения ДФЛЖ в нашем исследовании послужило снижение ИКСО ЛП. Значимое снижение ИКСО ЛП продолжалось на протяжении первого полугодия, составив ко второму визиту 5,8% в группе I, 5,3% в группе II и 7,1% в группе III, к визиту 3 – 7,8%, 6,6% и 8,2%, соответственно, в группах I, II и III. Дальнейшие изменения ИКСО ЛП были столь же однонаправленными, но носили недостоверный характер.
Все оцениваемые параметры, полученные при СМАД на момент рандомизации в трех группах, были сопоставимы. За шесть месяцев исследования дневное САД снизилось на 6,2% в группе I, 8,7% в группе II и 9% в группе III. Снижение ночного САД за первые полгода исследования составило 5,1%, 5,2% и 6,0%, соответственно, в группах I, II и III. За аналогичный промежуток времени суточное САД снизилось на 5,1% в группе I, 7,9% в группе II и 8,3% в группе III. Изменения перечисленных показателей во второй половине исследования оказались недостоверными во всех группах и подгруппах.
Достоверное снижение дневного ДАД по сравнению с исходными значениями в конце первого полугодия составило: в группе I 4,7%, в группе II 8,9% и в группе III 10,5%. Убыль ночного ДАД к визиту 3 оказалась равной 8,5%, 8,6% и 10,4%, соответственно, в группах I, II и III. К концу шестого месяца во всех группах наблюдалось статистически значимое снижение и показателей суточного ДАД относительно исходных значений: в группе I на 5,5%, в группе II на 8,7% и в группе III на 10,4%. После изменения схемы терапии средние значения дневного, ночного и суточного ДАД продолжили недостоверно снижаться во всех группах и подгруппах.
В течение первого полугодия дневное СрАД снизилось на 5,3%, 8,8% и на 9,8%, соответственно, в группах I, II и III. Максимальное снижение ночного СрАД также отмечено в первой половине исследования: на 7,0% в группе I, 7,8% в группе II и 8,5% в группе III. Наконец, суточное СрАД за первые полгода исследования снизилось на 6,1%, на 8,3% и на 9,5%, соответственно, в группах I, II и III. Как и в предыдущих случаях изменения дневного, ночного и суточного СрАД во второй половине исследования оказались недостоверными ни в одной из групп и подгрупп.
За первые шесть месяцев исследования гипертонический индекс времени (ИВ) дневного САД уменьшился на 8,8% в группе I, на 13,2% в группе II и на 16,6% в группе III. Среднее значение гипертонического ИВ ночного САД к визиту 3 снизилось на 6,2% в группе I, на 12,4% в группе II и на 13,1% в группе III. Убыль гипертонического ИВ суточного САД за аналогичный промежуток времени составила: 6,7%, 12,5% и 14,4%, соответственно, в группах I, II и III. Между визитами 3 и 5 статистически значимых изменений гипертонического ИВ дневного, ночного и суточного САД не произошло.
Аналогичной была динамика и гипертонического ИВ ДАД. По истечении шести месяцев мы отметили снижение среднего значения гипертонического ИВ дневного ДАД по сравнению с исходными значения на 10,8%, 12% и 12,1%, соответственно, в группах I, II и III. Среднее значение гипертонического ИВ ночного ДАД снизилось к визиту 3 на 6,2% в группе I, на 13,7% в группе II и на 14,4% в группе III. Гипертонический ИВ суточного ДАД за тот же период времени снизился на 8,5%, 12,6% и 14%, соответственно, в группах I, II и III. После изменения схемы терапии во всех группах и подгруппах статистически значимых изменений указанных параметров не отмечалось.
Мы не обнаружили достоверных изменений ЧСС, пульсового АД, вариабельности и суточного индекса САД и ДАД за все время исследования.
Проведенный нами анализ опросников качества жизни выявил значительные положительные сдвиги во всех группах. Так, согласно данным Миннесотского опросника уже через три месяца во всех группах наблюдалось достоверное снижение суммы набранных баллов: на 18,2% в группе I, 18,7% в группе II и 22,3% в группе III. В дальнейшем продолжилось прогрессивное снижение данного показателя, составив к концу шестого месяца 23,8%, 24% и 26,6%, соответственно, в группах I, II и III. Среднее значение суммы баллов, набранных по Канзасскому опроснику, через три месяца оно снизилось на 12,4%, на 12% и на 17,9%, соответственно. В конце первого полугодия среднее значение набранных баллов уменьшилось до 21,7% в группе I, 21,9% в группе II и 26,6% в группе III. Прогрессивное улучшение клинического состояния пациентов нашло отражение и на психологическом статусе пациентов. Уменьшились тревожные и депрессивные проявления по HADS: на 19,3% в группе I, 21% в группе II и 23,6% в группе III через три месяца от начала лечения и, соответственно, на 26,9%, 25,4% и 29,9% через шесть месяцев терапии. Наконец, улучшилось качество жизни пациентов при анализе индекса здоровья, определенного по ВАШ. Через 3 месяца от начала лечения величина индекса здоровья выросла на 22%, 23,1% и 23,6%, соответственно, в группах I, II и III. А еще через 3 месяца увеличилась по сравнению с исходным уровнем на 32% в группе I, 36,5% в группе II и 38,2% в группе III. Во втором полугодии исследования во всех группах и подгруппах продолжилась положительная динамика показателей, полученных при анализе вышеуказанных опросников и шкал. Однако подобные изменения имели недостоверный характер.
Безопасность препарата кардостен определялась путем анализа жалоб больного, оценки динамики клинического состояния пациента, регистрации нежелательных и серьезных нежелательных побочных реакций за период исследования, контроля лабораторных показателей.
В группах и подгруппах пациентов, принимающих кардостен, мы не наблюдали нежелательных реакций, в том числе серьезных. Препарат не вызвал ухудшения течения ХСН на протяжении всего периода исследования. Побочные явления и/или аллергические реакции не были зарегистрированы ни у одного из пациентов, принимавших кардостен. Кардостен не оказывал статистически достоверного влияния на основные показатели общего, биохимического анализов крови, фосфорно-кальциевого, электролитного, липидного обмена, качество ПГД.
Таким образом, проведенное сравнительное исследование позволяет судить об оптимизации терапии ДХСН как кардостеном, так и валсартаном, у лиц с V стадией ХБП. Убедительно доказано существенное значение дополнительной блокады РААС с помощью кардостена и валсартана для более эффективного лечения ХСН у данной категории больных. Длительная комбинированная терапия как кардостеном, так и валсартаном, больных с ДХСН на ПГД сопровождалась достоверным улучшением клинического состояния пациентов, которое проявлялось снижением количества баллов, набранных по ШОКС, среднего значения ФК ХСН. После перевода с комбинированной терапии кардостеном и валсартаном на терапию одним из этих препаратов, а также замены кардостена валсартаном и наоборот существенного изменения клинического течения заболевания и ФК ХСН не происходило. Применение кардостена, валсартана и их комбинации в составе комплексной терапии ДХСН у пациентов с V стадией ХБП способствовало значительному повышению толерантности к физической нагрузке. Пройденная дистанция продолжала расти, несмотря на перевод пациентов с комбинированной терапии кардостеном и валсартаном на терапию одним их этих средств или замену кардостена на валсартан и наоборот.
У больных с ДХСН и V стадией ХБП ни кардостен, ни валсартан, ни их комбинация не оказывали существенного влияния на хронотропную, инотропную и систолическую функцию ЛЖ, но значительно улучшали показатели его диастолической функции. Оба препарата, как в отдельности, так и в комбинации, способствовали улучшению активного расслабления миокарда в раннюю диастолу ЛЖ и снижению скорости поступления крови в позднюю диастолу ЛЖ и систолу ЛП. В течение первого полугодия статистически достоверное улучшение ДФЛЖ и регрессия ГЛЖ происходили параллельно во всех группах. Однако после визита 4, когда схема терапии во всех группах была изменена, значительным оказалось лишь снижение ИММЛЖ, в то время как ДФЛЖ достоверно улучшилась только в группе и подгруппе, получавших кардостен. Данный факт, возможно, свидетельствует об отдельном существовании ДДЛЖ и ГЛЖ у пациентов с ХСН и V стадией ХБП, что согласуется с данными других авторов (Gagliardi G.M., Rossi S., Manes M.T., 2004; Manes M.T., Gagliardi M., Misuraca G., 2005; Miyazato J., Horio T., Takiuchi S., 2005). Снижение ИММЛЖ, происходившее в течение первого полугодия во всех группах и, как и снижение АД, бывшее достоверным, продолжилось и во втором полугодии. Однако если регрессия ГЛЖ во второй половине исследования продолжала оставаться статистически значимой, то изменения АД за этот же промежуток времени оказались несущественными. Кроме того, несмотря на более выраженный гипотензивный эффект валсартана, по сравнению с кардостеном, убыль ИММЛЖ во всех группах была сопоставима, а в первом полугодии оказалась даже более существенной у пациентов, которые получали кардостен, чем у пациентов, находившихся на терапии валсартаном. Полученные нами результаты согласуются с данными Matsumoto N. и Kanno Y. с соавт., которые в своих работах также отмечали обратное развитие гипертрофии ЛЖ (ГЛЖ) не зависимо от гипотензивного эффекта на фоне агентов, моделирующих активность РААС (Kanno Y., Kaneko K., Kaneko M., 2004; Matsumoto N., Ishimitsu T., Okamura A., 2006). Об отсутствии прямой корреляции между величиной ИММЛЖ и уровнем АД сообщают и другие авторы (Covic A., Goldsmith D.J.A., Georgescu G., 1996). Вероятно, на развитии ГЛЖ у больных с V стадией ХБП, помимо уровня АД, влияет ряд других факторов. С другой стороны наши выводы противоречат выводам, полученным Paoletti E. с соавт., которые считали снижение САД на фоне модуляторов РААС, важнейшим фактором регрессии ГЛЖ у больных с ХСН и V стадией ХБП (Paoletti E., Cannella G., 2002). Следует отметить, что действие ряда факторов (уровень Ht, основных показателей фосфорно-кальциевого обмена, УФ, доза РЧЭП, альфакальцидола), влияющих на степень ГЛЖ и величину АД, в нашем исследовании было минимизировано.
Обратное развитие ГЛЖ быстрее происходило у пациентов с КГЛЖ, чем у больных с прогностически более неблагоприятной ЭГЛЖ. Указанные изменения наблюдались на протяжении всего исследования во всех группах и не прекратились после перевода с комбинированной терапии кардостеном и валсартаном на терапию одним из этих препаратов, а также замены кардостена на валсартан и наоборот. В итоге у всех пациентов, участвовавших в исследовании, геометрия ЛЖ к концу двенадцатого месяца терапии нормализовалась.
Кардостен, валсартан и их комбинация оказали выраженный гипотензивный эффект, достоверно снизили значение гипертонического ИВ САД и ДАД. Нами отмечено более выраженное снижение среднего значения АД и гипертонических ИВ АД в группах, получавших валсартан и комбинацию кардостена и валсартана, по сравнению с соответствующим снижением в группе, находившейся на терапии кардостеном. После изменения схемы лечения (перевода с комбинированной терапии кардостеном и валсартаном на терапию одним из этих препаратов и замены кардостена валсартаном и наоборот) ни в одной из групп не отмечено роста АД и гипертонических ИВ АД.
Анализ Миннесотского и Канзасского опросников, свидетельствовал об улучшении качества жизни пациентов всех групп, проявлявшемся снижением среднего количества набранных баллов. Причем степень подобного снижения была сопоставима во всех группах, независимо от того, назначался ли кардостен, валсартан или их комбинация. Статистически значимое улучшение показателей, определяемых по Миннесотскому и Канзасскому опросникам, наблюдалось только в течение первого полугодия исследования. Однако и после визита 3 изменение терапии в группах не только не привело к ослаблению положительного эффекта, но и способствовало дальнейшему снижению количества набранных баллов. Правда, на этот раз снижение оказалось недостоверным. Прогрессивное улучшение клинического состояния пациентов группы кардостена нашло отражение и в психологическом статусе пациентов. Также во всех группах достоверно снизились депрессивные и тревожные проявления по HADS, причем наиболее существенно за первые полгода исследования. Причем положительные сдвиги в группах были сопоставимы. После изменения схемы терапии во всех группах и подгруппах количество баллов, набранных пациентами по госпитальной шкале тревоги и депрессии, продолжало снижаться, достигнув минимума в конце исследования. Улучшилось качество жизни пациентов при анализе индекса здоровья, определенного по ВАШ. Как и в предыдущих случаях, положительные изменения в группах были сопоставимы и продолжились во втором полугодии, несмотря на перевод больных с комбинированной терапии кардостеном и валсартаном на терапию одним из этих препаратов и замену кардостена валсартаном и наоборот. Возможно, качество жизни пациентов с ДХСН и V стадией ХБП, получающих ПГД, в большей степени определяется состоянием ДФЛЖ и степенью регрессии ГЛЖ, чем величиной АД.
Нами продемонстрирована метаболическая нейтральность кардостена и валсартана и их комбинации. Особенно примечательным на наш взгляд является отсутствие влияния кардостена на состояние азотистого, электролитного обмена, качество проводимой заместительной почечной терапии, что чрезвычайно важно у лиц с тяжелой почечной патологией. За все время наблюдения на фоне терапии кардостеном не отмечено нежелательных явлений, в том числе анафилактических реакций при использовании синтетических полисульфонных мембран. Нами также не отмечено ни одного случая госпитализации в стационар пациентов, участвовавших в исследовании, в связи с декомпенсацией ХСН в течение всего периода исследования.
ВЫВОДЫ
- Кардостен в дозе 0,25мл/100г (курс 21 день) оказывает мягкое и стабильное гипотензивное действие у крыс линии SHR, но по антигипертензивной активности уступает лозартану (10% vs 22%). Лозартан в дозе 0,25 мл/100 г и кардостен в дозе 0,25мл/100г при курсовом введении в течение 21 дня, снижая АД, не нарушают дневные ритмы колебания артериального давления. После отмены препаратов существует опасность синдрома рикошета.
- Кардостен в дозе 0,25мл/100г (курс 21 день) по своему кардиопротективному действию уступает лозартану в той же дозе, но превосходит его по выраженному влиянию на толерантность к физической нагрузке (на 27,8%, p<0,05), повышает ударный выброс на 32,1%, (p<0,05) и минутный объем крови на 22,9% (p<0,05%), незначительно повышает инотропные резервы сердца в эксперименте.
- Экспериментальная сердечная недостаточность сопровождается достоверными изменениями рецепторного профиля для АТII, что отражается в достоверном уменьшении соотношения АТ1/АТ2-рецепторов. Изменение Ca2+-обмена при экспериментальной сердечной недостаточности увеличивает базальный внутриклеточный уровень Са2+, а также уменьшает амплитуду и продолжительность Ca2+-ответа кардиомиоцитов.
- В условиях экспериментальной патологии наблюдается повышение функциональной активности АТ2-подтипа рецепторов АТII и связанное с этим увеличение образования NO. Выявленные изменения NO-обмена могут быть причиной дисбаланса между компенсаторными и повреждающими механизмами, индуцированными NO.
- 2-х недельное введение кардостена в дозе 0,25мл/100г массы животного способствует восстановлению соотношения АТ1/АТ2-рецепторов в кардиомиоцитах, нарушенное при экспериментальной сердечной недостаточности. Кардиотропное действие кардостена связано с его нормализующим влиянием на Са2+-обмен в кардиомиоцитах, выраженное в быстром снижении индуцированного подъема [Са2+]цит. Максимальное влияние кардостена проявилось при наибольших отклонениях показателей NO-обмена, вызванных экспериментальной патологией, что может указывать на регулирующий (модулирующий) характер воздействия кардостена на состояние NO-обмена в миокарде.
- Кардостен в дозе 0,003г3 р/сут не уступает по эффективности валсартану в суточной дозе 80 мг при лечении пациентов с ХСН на протяжении 6 месяцев. Перевод пациентов с кардостена на валсартан и с валсартана на кардостен не сопровождается достоверным изменением показателей, которые имели место через 6 месяцев монотерапии. После перевода пациентов с комбинированной терапии кардостеном и валсартаном на терапию одним из этих препаратов также сохраняется стабильный клинический эффект. Комбинированная терапия кардостен (0,003г3 р/сут) + валсартан (80 мг/сут.) у пациентов с ХСН не имеет преимуществ перед монотерапией этими препаратами. Пролонгирование терапии пациентов с ХСН до 12 месяцев способствует более выраженной положительной динамике большинства функциональных и морфометрических показателей по сравнению со всеми группами наблюдения за 6 месяцев терапии.
- Применение кардостена, валсартана и их комбинации было безопасным у пациентов с ХСН разных функциональных классов, в том числе на фоне V стадии ХБП: в процессе лечения не наблюдалось возникновения нежелательных явлений, негативных изменений лабораторных показателей, а также показателей ЭКГ и физикальных данных. Кардостен в дозе 0,006г 3р/сут. При длительном применении в составе комбинированной терапии обладает высоким профилем безопасности, хорошей субъективной переносимостью, метаболической нейтральностью. Применение кардостена в составе шестимесячной комбинированной терапии в дозе 0,006г 3р/сут., у больных с легкой или умеренной ДХСН на фоне V стадии ХБП сопровождается достоверным улучшением клинического состояния пациентов, качества жизни, повышением толерантности к физической нагрузке, увеличением ФВ ЛЖ. Добавление кардостена в вышеуказанной дозе к комплексной терапии у больных с легкой или умеренной ДХСН на фоне уремии, значительно улучшает диастолическое наполнение ЛЖ. По влиянию на течение ХСН, толерантность к физической нагрузке, качество жизни больных с ХСН и V стадией ХБП кардостен в дозе 0,006г 3р/сут. сопоставим с валсартаном, назначенным в дозе 80 мг/сут. внутрь. Кардостен быстрее и эффективнее валсартана улучшает все изученные показатели ДФЛЖ.
- Применение кардостена в вышеуказанной дозе в составе шестимесячной комбинированной терапии нефрогенной АГ I-II степени у больных с V стадией ХБП, находящихся на ПГД, приводит к достоверному снижению дневного САД на 6,2%, ночного и суточного САД – на 5,1%, дневного, ночного и суточного ДАД, соответственно, на 4,7%, 8,5% и 5,5% от исходного уровня. Дневное СрАД уменьшилось на 5,3%, ночное СрАД – на 7,0%, суточное СрАД – на 6,1%, гипертонический ИВ дневного, ночного и суточного САД и ДАД соответственно на 8,8%, 6,2%, 6,7%, 10,8%, 6,2% и 8,5% (все данные р<0,05) по сравнению с исходным уровнем. Гипотензивные эффекты кардостена и валсартана в вышеуказанных дозах сопоставимы.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- В целях оптимизации лечения больных с ХСН I-III ФК в схему длительной базисной фармакотерапии целесообразно включать кардостен в дозе 0,003 г 3 р/сут.
- В целях повышения эффективности лечения больных с легкой и умеренной ДХСН и V стадией ХБП в схему длительной комбинированной терапии целесообразно включать кардостен в дозе 0,006 г 3 р/сут.
- Кардостен может быть эффективной и безопасной альтернативой другим известным модуляторам РААС (ИАПФ, АРА) в терапии ХСН, в том числе легкой и умеренной ДХСН у больных с тяжелой почечной патологией.
- Кардостен может оказаться достаточно эффективным средством у больных с начальными формами гипертонической болезни.
СПИСОК ОПУБЛИКОВАННЫХ РАБОТ ПО ТЕМЕ ДИССЕРТАЦИИ
Статьи в изданиях, рекомендованных ВАК РФ
- Системная гемодинамика и плазменный уровень эндотелина и предсердного натрийуретического пептида у больных гипертонической болезнью на фоне монотерапии лозартаном / В.И. Петров, С.В. Недогода, Н.Г. Чепурина, С.Н. Чумаков, М.В. Дегтяренко // Вестник Волгоградской медицинской академии. – 1997. – Вып. 3 (52). – С. 94-96.
- Сравнительное изучение антигипертензивного действия кардоса и лозартана / И.Н. Тюренков, А.В. Названова, Н.Г. Чепурина // Вестник Волгоградского государственного медицинского университета. – 2006. –№3 (19). – С. 67-69.
- Влияние сверхмалых доз антител к С-концевому фрагменту АТ1-рецептора ангиотензина II (Кардоса) на течение хронической сердечной недостаточности: результаты первого клинического исследования / В.И. Петров, В.В. Иваненко, Н.А. Давыдова, Н.Г. Чепурина, О.И. Эпштейн, С.А. Сергеева, М.В. Качанова, Ю.М. Лопатин // Сердечная недостаточность. – 2007. - Том 8, № 4 (42). – С. 175-177.
- Применение кардоса в комплексной терапии хронической сердечной недостаточности у пациентов, находящихся на гемодиализе / В.И. Петров, М.А. Кретов, Н.Г. Чепурина, Б.Е. Толкачев // Вестник Волгоградского государственного медицинского университета. – 2007. – №4 (24). – С. 30-34.
- Сравнительное изучение кардиопротективного действия кардоса и лозартана при экспериментальной хронической сердечной недостаточности у крыс / И.Н. Тюренков, С.А. Сергеева, А.В. Мартюшев-Поклад, И.А. Хейфец, Ю.Л. Дугина, А.В. Названова, Н.Г. Чепурина, О.И. Эпштейн // Бюллетень экспериментальной биологии и медицины. – 2007. – № 4. – С. 411-413.
- Перспективы применения сверхмалых доз антител к С-концевому фрагменту АТ1-рецептора ангиотензина II в клинической практике / Н.Г. Чепурина // Дальневосточный медицинский журнал. – 2008. – № 3. – С. 115-117.
- Лечение артериальной гипертензии с использованием сверхмалых доз антител к С-концевому фрагменту АТ1 рецептора ангиотензина II / В.И. Петров, С.В. Недогода, О.И. Эпштейн, Т.А. Чаляби, У.А. Брель, Н.Г. Чепурина, Г.В. Мазина, М.В. Качанова, Л.В. Сабанов, С.А. Тарасов, А.Э. Колосова, С.А. Сергеева // Артериальная гипертензия. – 2008. - Т. 14, № 3. – С. 236-238.
- Новый класс сердечно-сосудистых средств – ингибиторы С-концевого фрагмента рецептора ангиотензина II / Н.Г. Чепурина // Вестник Волгоградского государственного медицинского университета. - № 4 (28), 2008. – С. 7-10.
- Механизм действия препарата «Кардос» при моделировании сердечной недостаточности у крыс / В.И. Петров, Н.Л. Шимановский, Н.Г. Чепурина // Казанский медицинский журнал. – 2010. – Том XCI, № 4. – С. 472-476.
- Применение сверхмалых доз антител к С-концевому фрагменту АТ1 рецептора ангиотензина II (кардос) в терапии артериальной гипертензии. Экспериментально-клиническая фармакология сверхмалых доз антител к эндогенным регуляторам функций / В.И. Петров, С.В. Недогода, О.И. Эпштейн, Т.А. Чаляби, У.А. Брель, Г.В. Мазина, Н.Г Чепурина, М.В. Качанова, Л.В. Сабанов, С.А. Тарасов, Ю.А. Заболотнева, А.Э. Колосова, С.А. Сергеева // Бюллетень экспериментальной биологии и медицины. Приложение, 2009. М.: Изд. РАМН. – С. 80-83.
- Оценка влияния кардоса на клиническое течение хронической сердечной недостаточности у больных с V стадией хронической болезни почек, находящихся на программном гемодиализе / Н.Г. Чепурина, М.А. Кретов // Саратовский научно-медицинский журнал. – 2011. – № 2. – С. 422-426.
- Использование в терапии сердечно-сосудистых заболеваний лекарственных препаратов, содержащих сверхмалые дозы антител к С-концевому фрагменту АТ1-рецептора ангиотензина II человека / Н.Г. Чепурина // Вестник Волгоградского государственного медицинского университета – 2011. – №1. – С. 38-39.
Другие работы, опубликованные по теме диссертации.
- Влияние сверхмалых доз антител к АТ1-рецептору ангиотензина II (Кардос) на ремоделирование сердца у больных с хронической сердечной недостаточностью / Н.А. Давыдова, В.В. Иваненко, Н.В. Рязанцева, Н.Г. Чепурина, Ю.Л. Дугина, С.А.Сергеева, О.И. Эпштейн, В.И. Петров, Ю.М.Лопатин // Клинические исследования лекарственных средств : материалы Международной конференции. – Москва, 2005. – С. 63.
- Оценка гипотонии первой дозы сверхмалых доз антител к АТ1-рецептору ангиотензина II (Кардос) у больных с хронической сердечной недостаточностью / Н.А. Давыдова, В.В. Иваненко, И.Н. Тюренков, Н.Г. Чепурина, С.А. Сергеева, О.И. Эпштейн, В.И. Петров, Ю.М.Лопатин // Клинические исследования лекарственных средств : материалы Международной конференции. – Москва, 2005. – С. 65.
- Фармакодинамика препарата на основе сверхмалых доз антител к С-концевому фрагменту АТ1-рецептора ангиотензина II (Кардоса) у больных артериальной гипертензией 1-2 степени / Е.А. Зернюкова, П.А. Бакумов, Н.Г. Чепурина, О.В. Магницкая // Клинические исследования лекарственных средств : материалы Международной конференции. – Москва, 2005. – С. 80.
- Сравнительное изучение антигипертензивного действия кардоса и лозартана на крысах со спонтанной гипертонией / Н.Г. Чепурина // Современные принципы и технологии разработки лекарственных средств : материалы научно-практической конференции. Москва, 2006. – С.54-55.
- Сравнительное изучение антигипертензивного действия кардоса и лозартана на крысах со спонтанной гипертонией (SHR) / И.Н. Тюренков, А.В. Названова, Н.Г. Чепурина // ХIII Российский национальный конгресс «Человек и лекарство» : сб. материалов конгресса : (тезисы докл.), М., 2006. – С. 596-597.
- Кардос в лечении больных с хронической сердечной недостаточностью / В.И. Петров, Н.А. Давыдова, В.В. Иваненко, А.В. Мартюшев-Поклад, Ю.Л. Дугина, Н.Г. Чепурина, С.А. Сергеева, О.И. Эпштейн, Ю.М. Лопатин // ХIII Российский национальный конгресс «Человек и лекарство» : сб. материалов конгресса : (тезисы докл.), М., 2006. – С. 247.
- Оценка фармакодинамики кардоса (препарата на основе сверхмалых доз антител к С-концевому фрагменту АТ1-рецептора ангиотензина II) в острой фармакологической пробе у здоровых добровольцев / В.И. Петров, П.А. Бакумов, Е.А. Зернюкова, Н.Г. Чепурина, О.В. Магницкая // ХIV Российский национальный конгресс «Человек и лекарство» : сб. материалов конгресса : (тезисы докл.), М., 2007. – С. 117.
- Сравнительное изучение влияния кардоса и лозартана на толерантность к физической нагрузке при экспериментальной хронической сердечной недостаточности / А.В. Названова, И.Н. Тюренков, Н.Г. Чепурина, И.А. Хейфец, Ю.Л. Дугина, С.А. Сергеева, О.И. Эпштейн // ХIV Российский национальный конгресс «Человек и лекарство» : сб. материалов конгресса : (тезисы докл.), М., 2007. – С. 853.
- Сравнительное изучение кардиопротективного действия кардоса и лозартана при экспериментальной хронической сердечной недостаточности / И.Н. Тюренков, А.В. Названова, И.А. Хейфец, Н.Г. Чепурина, Ю.Л. Дугина, А.В. Мартюшев-Поклад, С.А. Сергеева, О.И. Эпштейн // ХIV Российский национальный конгресс «Человек и лекарство» : сб. материалов конгресса : (тезисы докл.), М., 2007. – С. 888-889.
- Новый отечественный препарат на основе сверхмалых доз антител «Кардос»: эффективность использования у больных артериальной гипертензией 1-2 степени / Н.Г. Чепурина, А.А. Колебошина // Фармакология практическому здравоохранению : III Съезд фармакологов России : сб. материалов Съезда : (тезисы докл.), М. 2007. – С. 2-2006 – 2-2007.
- Влияние сверхмалых доз антител к С-концевому фрагменту АТ1-рецептора ангиотензина II на диастолическую функцию левого желудочка у пациентов с хронической сердечной недостаточностью и хронической болезнью почек 5 стадии, находящихся на программном гемодиализе / В.И. Петров, М.А. Кретов, Н.Г. Чепурина // ХV Российский национальный конгресс «Человек и лекарство» : сб. материалов конгресса : (тезисы докл.), М., 2008. – С. 264.
- Лечение артериальной гипертензии с использованием сверхмалых доз антител к С-концевому фрагменту АТ1-рецептора ангиотензина II (кардос) / В.И. Петров, О.И. Эпштейн, С.В. Недогода, С.А. Сергеева, М.В. Качанова, Л.В. Сабанов, Т.А. Чаляби, У.А. Брель, Г.В. Мазина, А.Э. Колосова, Н.Г. Чепурина // ХV Российский национальный конгресс «Человек и лекарство» : сб. материалов конгресса : (тезисы докл.), М., 2008. – С. 264.
- Оценка эффективности монотерапии кардосом у пациентов с артериальной гипертензией / А.А. Колебошина, Н.Г. Чепурина // ХV Российский национальный конгресс «Человек и лекарство» : сб. материалов конгресса : (тезисы докл.), М., 2008. – С. 166.
- Кардос – новый препарат для оптимизации фармакотерапии хронической сердечной недостаточности (аспекты механизма действия) / Н.Г. Чепурина // Инновационные достижения фундаментальных и прикладных медицинских исследований в развитии здравоохранения Волгоградской области : 56-я региональная научно-практическая конференция ВолГМУ : Сборник научных трудов – Волгоград, 2009. – С. 295-297.
- Оценка влияния кардоса на клиническое течение хронической сердечной недостаточности у больных с V стадией хронической болезни почек, находящихся на программном гемодиализе / М.А. Кретов, Н.Г. Чепурина // Инновационные достижения фундаментальных и прикладных медицинских исследований в развитии здравоохранения Волгоградской области : 57-я региональная научно-практическая конференция ВолГМУ : Сборник научных трудов – Волгоград, 2010. – С. 241-245.
- Treatment of arterial hypertension with very-small doses of antibodies to C-end fragment of AT1 reseptors of angiotensin II / S. Nedogoda, V. Petrov, J. Epstein, T. Chaliabi, U. Brel, G. Masina, A. Sabanov, S. Tarasov, A. Kolosova, N. Chepurina // The World Congress of Cardiology Abstracts, Buenos Aires, Argentina, May 18-21, 2008: Poster Presentation. Circulation. Journal of the American Heart Association. – P. 147.
Чепурина Наталья Геннадьевна
Антитела к С-концевому фрагменту АТ1 рецептора ангиотензина II – новый класс кардиотропных препаратов
Автореферат
диссертации на соискание учёной степени
доктора медицинских наук

