Предупреждение послеоперационного делирия у гериатрических пациентов
На правах рукописи
РУДОМЕТКИН
Сергей Григорьевич
ПРЕДУПРЕЖДЕНИЕ ПОСЛЕОПЕРАЦИОННОГО ДЕЛИРИЯ
У ГЕРИАТРИЧЕСКИХ ПАЦИЕНТОВ
14.01.20 - анестезиология и реаниматология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
г. Санкт-Петербург
2013
Работа выполнена на кафедре анестезиологии, реаниматологии и трансфузиологии ФПК ППС Государственного бюджетного образовательного учреждения высшего профессионального образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
Научный руководитель:
доктор медицинских наук профессор Заболотских Игорь Борисович
Официальные оппоненты:
Кондратьев Анатолий Николаевич доктор медицинских наук, профессор, заслуженный врач РФ; Федеральное бюджетное государственное учреждение «Российский научно-исследовательский нейрохирургический институт имени профессора А.Л. Поленова» МЗ РФ, отделение анестезиологии-реанимации, руководитель
Корячкин Виктор Анатольевич доктор медицинских наук, профессор, Федеральное бюджетное государственное учреждение «Российский НИИ травматологии и ортопедии. Р.Р. Вредена» МЗ РФ, отделения анестезиологии и реанимации, руководитель
Ведущая организация:
Государственное бюджетное образовательное учреждение высшего профессионального образования «Северо-Западный государственный медицинский университет имени И.И. Мечникова» МЗ РФ
Защита состоится 10 декабря 2013 г. в 13-00 часов на заседании совета по защите диссертаций на соискание ученой степени кандидата наук, на соискание ученой степени доктора наук Д 215.002.07 при Федеральном государственном бюджетном военном образовательном учреждении высшего профессионального образования «Военно-медицинская академия имени С.М. Кирова» Министерства обороны Российской Федерации (194044, Санкт-Петербург, ул. Академика Лебедева, 6)
С диссертацией можно ознакомиться в фундаментальной библиотеке ФГБВОУ ВПО «Военно-медицинская академия им. С.М. Кирова» МО РФ
Автореферат разослан «……» ……………….. 2013 г.
Ученый секретарь диссертационного совета
доктор медицинских наук профессор
Богомолов Борис Николаевич
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы исследования
Послеоперационные когнитивные расстройства, и в частности делирий, являются темой особого внимания в гериатрической хирургии (Deiner S.et al., 2009). Частота данного осложнения у пожилых больных в зависимости от типа хирургического вмешательства варьирует от 6 до 83% (Попугаев К.А. и др., 2012; Huang L.W. et al., 2012; Rudolph J.L. et al., 2011; Fong T.G. et al., 2009; Chang Y.L. et al., 2008). У пожилых пациентов перенесших операции на органах брюшной полости частота ПД может достигать 73% (Ganai S. et al., 2007).
Доказано, что делирий связан с увеличением смертности как в раннем, так и позднем послеоперационных периодах, способен вызывать долгосрочные последствия, которые могут приводить к социальной дезадаптации пациента (Соленкова А.В. и др., 2012; Давыдов В.В., Неймарк М.И., 2005). Кроме того, он связан с существенным увеличением экономических затрат и сроков пребывания пациента в стационаре ( Fong T.G. et al., 2009; Inouye S.K., 1999). Исходя из этого, растет необходимость изучения клинических факторов риска послеоперационного делирия с целью выявления лиц, нуждающихся в мероприятиях по его профилактике (Van Rompaey B. et al., 2009).
Доказана многофакторность развития данного осложнения, но однозначные причины развития делирия до конца не ясны. Отсутствуют и единые подходы в профилактике диагностике и лечении данного состояния (Щеголев А.В. и др., 2011).
Известные факторы риска можно разделить на «преморбидные», «остро развивающиеся» и «ятрогенные» (Попугаев К.А. и др., 2012; Delvin J.W. et al., 2007; Pandharipande P. et al., 2003). К первым относятся такие предикторы, как функциональная зависимость (неспособность к самообслуживанию, самостоятельному передвижению), деменция, выраженная сопутствующая патология - эти факторы трудно поддаются коррекции или лечению. «Остро развивающиеся» и «ятрогенные» факторы связаны с острыми состояниями или окружающей средой (анемия, гипоксемия, гипо/гиперкалиемия, наличие катетеров и зондов, применение лекарственных препаратов и др.) и часто могут быть модифицированы на разных этапах периоперационного периода (Page V., Ely E.W., 2011; Van Rompaey B. et al., 2009; Inouye S.K. et al., 1996).
У пациентов пожилого возраста отмечают следующие факторы риска: исходные расстройства центральной нервной системы, сахарный диабет, интраоперационная трансфузия крови более 800 мл, уровень гемоглобина менее 100 г/л (Gao R. et al., 2008). Так же риск развития делирия у пожилых зависит от степени хирургического стресса (Robinson T.N. et al., 2008), наличия в анамнезе инсультов или транзиторно-ишемических атак, симптомов психологической депрессии (Rudolph J.L. et al., 2009), нарушений электролитного баланса (особенно натрия и калия), типа оперативного вмешательства (Marcantonio E.R. et al., 1994).
Авторы, проводившие исследования пожилых пациентов в абдоминальной хирургии, среди факторов риска развития ПД отмечают исходные когнитивные нарушения, гипоксемию тканей мозга, низкую концентрацию общего белка и альбумина (Morimoto Y. et al., 2009).
Несмотря на большое внимание, которое уделяется проблеме послеоперационных когнитивных расстройств в различных областях хирургии, на данный момент существует достаточно мало сведений о предикторах делирия при оперативных вмешательств на органах брюшной полости, отсутствуют структуированные клинические протоколы его профилактики и лечения. При этом, задачами первостепенной важности в предупреждении делирия являются раннее выявление возможной причины или вероятных факторов риска и незамедлительная их коррекция (Попугаев К.А. и др., 2012; Page V., Ely E.W., 2011).
Учитывая тот факт, что послеоперационный делирий является одной из основных причин увеличения заболеваемости и летальности среди пожилых пациентов в абдоминальной хирургии, давно созрела необходимость создания действенных и простых в клиническом использовании мер по его предупреждению.
Степень разработанности темы исследования
Основой стратегии предупреждения послеоперационного делирия является раннее выявление пациентов с высоким риском его развития и последующая целенаправленная профилактика направленная на модифицируемые факторы риска данного осложнения (Popeo D.M., 2011).
Создано достаточно большое количество прогностических шкал, применяющихся в различных отраслях медицины. В качестве критериев большинство шкал применяют давно известные и вновь выявленные факторы риска ПД.
Хорошо себя зарекомендовала шкала прогнозирования развития делирия у пожилых пациентов (PMRDOP) (MILLER М.О., 2008). Клиническое применение данной шкалы позволило снизить частоту делирия на 33% среди пожилых пациентов группы риска (Inouye S.K. et al., 1999). Основным недостатком данной шкалы является то, что она разработана для терапевтических пациентов, не переносивших оперативное вмешательство, что делает её не применимой в хирургических стационарах.
Китайский исследователь Shi Cheng-mei с соавторами (2010) предложили свою шкалу прогнозирования для пациентов после некардилогических операций. По сообщению авторов, пациенты высокого риска, оцененные по данной шкале, имеют частоту ПД до 95%.
Большой вклад в предупреждение исследуемого нами осложнения, у пациентов после сосудистых операций внёс Hinrich Bhner, который в 2003 году с соавторами разработали прогностическую модель риска развития делирия. В качестве критериев риска ими применялись предикторы полученные путём многофакторной регрессии. Рассчитанные прогностические коэффициенты использовались в качестве баллов при оценке риска. При проведении ROC-анализа, данная модель показала специфичность 78,4% и чувствительность 81,0%, что, несомненно, говорит о её хорошем прогностическом качестве.
В кардиохирургии также была разработана шкала прогноза развития послеоперационного делирия (Rudolph J. L. et al., 2009). Все факторы риска в данном исследовании так же были определены путём многофакторного регрессионного анализа. При значениях MMSE < 23 пациенту присваивается 2 балла; при MMSE от 23 до 27, при наличии ТИА, HAM-D > 4, низком альбумине присваивается по 1 баллу. Суммарная частота делирия для сумм балов 0, 1, 2 и 3 составила 19%, 47%, 63% и 86%, соответственно.
Не удалось найти прогностических шкал ПД в абдоминальной хирургии. В единственном исследовании Morimoto Y c соавторами (2009), сообщается о высоком риске развития делирия после абдоминальных операций при навличии следующих критериев: региональная церебральная сатурация (rSO2) < 60%, < 16 баллов по шкале предоперационной деменции Кana-Нiroi test (KHT) и возраст более 76 лет. Но эти данные не предоставлены в виде прогностической модели, так же не проводилась статистическая проверка прогностической ценности.
В плане профилактики делирия, большое внимание уделяется улучшению качества окружающей пациента среды. Различными авторами рекомендуется создание максимального комфорта для пациента во время его пребывания в ОРИТ, ранняя физическая активизация, мероприятия, по повышению ориентации пациента, коррекции нарушений зрения и слуха, сна, сокращение сроков катетеризации мочевого пузыря, профилактика ятрогенных осложнений, наряду с поддержанием надлежащего нутритивного статуса (Inouye S.K., Bogardus S.T. 1999; Inouye S.K. et al., 2000; Rubin F.H. 2006; Щёголев А.В. 2011). Большое значение имеет контакт с родственниками и близкими. Медицинские манипуляции должны выполняться строго по показаниям, максимально в дневное время с учётом возможного урона для психики пациента (Царенко С.В., Добрушина О.Р. 2008).
Другие мероприятия направлены на предотвращение ПД при помощи профилактических препаратов, в частности, тех препаратов, которые используются при лечении делирия в частности галоперидола и атипичных нейролептиков (Kalisvaart K.J. et al., 2005; Schrader S.L. et al., 2008; Kaneko T. 2009; Larsen K.A., Kelly S.E., et al., 2010). Данная профилактическая стратегия может значительно уменьшить уровень делирия, но множественные побочные эффекты препаратов, включая увеличенный риск смерти, и неопределённость с дозированием лекарственных средств, весьма ограничивают их применение (Chahine L.M, Acar D., Chemali Z., 2010).
Одним из перспективных направлений в профилактике ПД, является применение препаратов с нейропротективной (церебропротективной) и нейротрофической активностью Влияние на биохимические процессы, лежащие в основе реализации интеллектуально-мнестических функций, является главной принципиальной особенностью их действия, что обеспечивает регуляцию познавательных процессов обучения, памяти – основы высшей нервной деятельности человека. Механизмы реализации ноотропов близки к естественным и отражают их нейрометаболическое действие. Кроме того, они обладают сосудистым действием, обусловленным улучшением микроциркуляции и реологических свойств крови (Jelic V., Winblad B., 2003; Desmond D.W., 2004; Яворская В.А. и др., 2006).
Воздействие на отдельные факторы риска вряд ли приведет к успеху в профилактике ПД. Только одновременное воздействие на все модифицируемые предикторы позволяет снизить частоту послеоперационного делирия (Popeo D.M. 2011).
Обращает на себя внимание отсутствие чётких, структурированных алгоритмов профилактики послеоперационного делирия у пожилых пациентов в различных областях хирургии, и в частности после обширных абдоминальных операций. Выполненная в данном исследовании, работа направлена на исключение данного пробела и создание действенных, простых в клиническом применении, мер по профилактике делирия, основанных на воздействие на модифицируемые факторы риска у пациентов старше 65 лет в хирургической гастроэнтерологии.
Цель исследования - снизить частоту развития послеоперационного делирия у пожилых пациентов, подвергшихся обширным абдоминальным операциям за счет его профилактики на основе изучения факторов риска его развития.
Задачи исследования:
1. Определить факторы риска развития делирия после анестезии при обширных абдоминальных операциях у пожилых пациентов.
2. Разработать шкалу прогнозирования развития послеоперационного делирия у пожилых пациентов после обширных абдоминальных операций.
3. Разработать и апробировать алгоритм профилактики делирия при обширных абдоминальных операциях у пожилых пациентов.
Научная новизна исследования
В выполненной работе впервые:
- определены конкретные критерии риска развития послеоперационного делирия среди клинико-лабораторных показателей: в частности установлено, что развитие ПД достоверно связано с предоперационными уровнями общего белка менее 68 г/л, альбумина менее 28 г/л, гемоглобина менее 100 г/л, интраоперационной концентрацией калия в крови ниже 3,4 ммоль/л, послеоперационными уровнями гемоглобина ниже 113 г/л, гематокрита ниже 31 %, общего белка ниже 61 г/л, альбумина ниже 24 г/л;
- подтверждена профилактическая польза применения кетамина при вводной анестезии и уточнена его индукционная доза;
- впервые выявлена взаимосвязь между развитием ПД и предоперационным уровнем АСТ выше 26 Ед/л.;
- расширены представления о сочетаниях факторов риска развития послеоперационного делирия – выявлено, что ПД развивается при сочетании от двух до пяти факторов, доминирующим фактором в сочетаниях является ХСН II ст. и выше по NYHA.
Теоретическая и практическая значимость работы
Впервые установлены комбинации факторов, свидетельствующих о высоком риске развития послеоперационного делирия у пациентов пожилого возраста в зависимости от этапа периоперационного периода.
Разработана прогностическая шкала, позволяющая выявить степень риска развития послеоперационного делирия у конкретного пациента на этапе рутинного предоперационного обследования.
Предложен алгоритм профилактики послеоперационного делирия, основанный на тщательной коррекции всех расстройств гомеостаза на всех этапах периоперационного периода и интраоперационном применении кетамина в дозе 1,12-2,0 мг/кг на этапе индукции анестезии. Использование предложенного алгоритма в практической деятельности ОАРИТ позволяет значительно снизить частоту развития послеоперационного делирия у пожилых пациентов, подвергшихся обширным абдоминальным операциям.
Методология и методы исследования
Проведено исследование, в котором собраны и проанализированы периоперационные данные анамнеза, лабораторных и физикальных исследований пациентов старше 65 лет. Все пациенты подверглись обширным оперативным вмешательствам на органах брюшной полости в МУЗ ГБ№2 «КМЛДО» г. Краснодара в период с 2009 по 2012 год. Физическое состояние пациентов соответствовало 2-4 классу по ASA (Морган-мл. Дж.Э., Михаил М.С., 2004). Средний возраст больных, включенных в исследование - 71,5 лет (от 65 до 84 лет).
Исследование выполнено в два этапа:
- на первом этапе проведено ретроспективное исследование (n=170), в котором производился сбор данных для последующего статистического анализа. На основании полученных (рассчитанных) факторов риска были разработаны шкала прогноза и алгоритм профилактики послеоперационного делирия;
- на втором этапе проведено проспективное исследование (n=132), в котором был применён разработанный алгоритм профилактики и проанализирована частота исследуемого осложнения.
Длительность операций составляла от 4 до 10,5 часов. Операции выполнялись в условиях сочетанной анестезии (СА) (сочетание ингаляционной и эпидуральной анестезии), тотальной внутривенной анестезии (ТВА) на основе применения бензодиазепинов и кетамина и комбинированной анестезии на основе севофлюрана или изофлюрана в сочетании с фентанилом.
Критериями исключения из исследования явились злоупотребление алкоголем, наркотическими веществами, психические заболевания, экстренный характер оперативного вмешательства, перевод пациента в другой стационар, летальный исход в раннем послеоперационном периоде.
В контрольную (ретроспективную) группу вошли 170 больных из них 55,5% - мужчины (n = 94), 44,5% - женщины (n=76). С целью апробации разработанных шкалы прогноза и алгоритма профилактики послеоперационного делирия, выполнено проспективное исследование у 132 пациентов (53,7% - мужчины, (n=71), 46,3% - женщины, (n=61) с аналогичными критериями исключения, длительностью, видами анестезий и операций (основная группа).
Исследуемые больные контрольной и основной групп были сопоставимы по основной патологии и сопутствующим заболеваниям, что подтверждается отсутствием достоверных различий по критерию 2. Основная патология представлена преимущественно онкологическими заболеваниями органов желудочно-кишечного тракта, в структуре сопутствующей патологии доминирующее место занимают заболевания сердечно-сосудистой системы.
Положения, выносимые на защиту:
1. Развитие делирия у пожилых пациентов после обширных абдоминальных операций связано с наличием выявленных предикторов, имеющих четкие критерии риска.
2. Послеоперационный делирий у пожилых пациентов имеет многофактор-ную этиологию и развивается при сочетании от двух до пяти факторов риска.
3. Разработанная шкала позволяет прогнозировать развитие делирия у пожилых пациентов после анестезии при длительных абдоминальных операциях.
4. Выявленная причинно-следственная связь между развитием после-операционного делирия и рассчитанными предикторами позволяет сформировать стратегию его профилактики.
5. Применение разработанного алгоритма профилактики послеоперационного делирия у пожилых пациентов, подвергшихся обширным абдоминальным операциям, достоверно снижает его частоту.
Степень достоверности и апробация результатов
Объём клинического материала включает 302 наблюдения пациентов старше 65 лет, подвергшихся обширным операциям на органах брюшной полости). Результаты исследования обработаны статистически с помощью компьютерных программ STATISTICA - 6 (StatSoft. Inc., США) и MedCalk (MedCalc Software, Бельгия). Первичные материалы исследования (карты течения анестезии 302 больных; журналы общего и биохимического исследования крови 302 больных; карты лабораторного исследования газового состава крови 302 больных; листы назначения и карты динамического наблюдения 967 шт., пациентов находившихся на стационарном лечении в МБУЗ ГБ №2 «КМЛДО» (г. Краснодар) в период с 2009 по 2012 г., компьютерная база данных клинического исследования, таблицы статистического анализа данных, полученных в исследовании; оригиналы, копии и рефераты изученных литературных источников – 344 шт.; оттиски опубликованных работ – 8 шт.) проверены комиссией по достоверности ГБОУ ВПО КубГМУ Минздрава России на основании приказа ректора № 518 от 11.09.2012 г., которая установила соответствие представленных материалов необходимым научным требованиям.
Диссертационная работа была рассмотрена на заседании этического комитета ГБОУ ВПО КубГМУ Минздрава России, протокол №16 от 07.12.2012г.
Работа является самостоятельно выполненным исследованием, текст диссертации проверен системой «Антиплагиат» (ЗАО «Форексис») на наличие заимствований.
По материалам диссертации опубликовано 10 печатных работ, из них 4 статьи в журналах, включенных Высшей Аттестационной Комиссией в перечень ведущих рецензируемых научных журналов и изданий.
Основные положения диссертации докладывались на I Всероссийской конференции молодых ученных «Инновации в анестезиологии и реаниматологии» (Москва, 2011), на VIII и IX Всероссийских научно-методических конференциях «Стандарты и индивидуальные подходы в анестезиологии, реаниматологии и интенсивной терапии» (Геленджик, 2011, 2012), XIII съезде Федерации анестезиологов и реаниматологов (Санкт-Петербург, 2012), XIV Всероссийской конференции «Жизнеобеспечение при критических состояниях» (Москва, 2012).
Результаты внедрены в работу отделений анестезиологии и реанимации №3 и №5 ГБУЗ ККБ №2 МЗ КК г. Краснодар, отделения анестезиологии и реанимации №1 ГБУРО «РОКБ» г. Ростов-на-Дону, отделения анестезиологии и реанимации МБУЗ ГБ №7 г. Ростов-на-Дону, отделения анестезиологии и реанимации №1 для взрослых МБУЗ ГБ №1 им. Н.А. Семашко г. Ростов-на-Дону, а также на кафедре анестезиологии, реаниматологии и трансфузиологии ФПК и ППС Кубанского государственного медицинского университета.
Объем и структура работы
Диссертация изложена на 162 страницах компьютерного текста (Times New Roman 14) и состоит из введения, обзора литературы, материалов и методов исследования, 3 глав собственных результатов, заключения, выводов, практических рекомендаций. Работа иллюстрирована 24 рисунками и содержит 18 таблиц, 2 приложения. Библиографический указатель содержит 60 отечественный и 283 зарубежных источников.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Общая характеристика больных
Проведено исследование, в котором собраны и проанализированы периоперационные данные анамнеза, лабораторных и физикальных исследований пациентов старше 65 лет. Все пациенты подверглись обширным оперативным вмешательствам на органах брюшной полости в МУЗ ГБ№2 «КМЛДО» г. Краснодара в период с 2009 по 2012 год. Физическое состояние пациентов соответствовало 2-4 классу по ASA. Средний возраст больных, включенных в исследование - 71,5 лет (от 65 до 84 лет).
Исследование выполнено в два этапа:
- на первом этапе проведено ретроспективное исследование (n=170), в котором производился сбор данных для последующего статистического анализа. На основании полученных (рассчитанных) факторов риска были разработаны шкала прогноза и алгоритм профилактики послеоперационного делирия;
- на втором этапе проведено проспективное исследование (n=132), в котором был применён разработанный алгоритм профилактики и проанализирована частота исследуемого осложнения.
Длительность операций составляла от 4,0 до 10,5 ч. Операции выполнялись в условиях сочетанной анестезии (СА) (сочетание ингаляционной и эпидуральной анестезии), тотальной внутривенной анестезии (ТВА) на основе применения бензодиазепинов и кетамина и комбинированной анестезии на основе севофлюрана или изофлюрана в сочетании с фентанилом.
Критериями исключения из исследования явились злоупотребление алкоголем, наркотическими веществами, психические заболевания, экстренный характер оперативного вмешательства, перевод пациента в другой стационар, летальный исход в ранний послеоперационный период.
В контрольную (ретроспективную) группу вошли 170 больных из них 55,5% - мужчины (n = 94), 44,5% - женщины (n=76). С целью апробации разработанных шкалы прогноза и алгоритма профилактики послеоперационного делирия, выполнено проспективное исследование у 132 пациентов (53,7% - мужчины, (n=71), 46,3% - женщины, (n=61) с аналогичными критериями исключения, длительностью, видами анестезий и операций (основная группа).
Пациенты в обеих группах сопоставимы по основной и сопутствующей патологии, что подтверждается отсутствием достоверных различий по критерию 2.
Для оценки предоперационного статуса больных, параметров течения анестезии и послеоперационного периода использованы традиционные клинико-лабораторные показатели. Регистрация параметров производилась на следующих этапах периоперационного периода: I этап – исходные данные (за 3-5 суток перед операцией), II – непосредственно перед индукцией, III – в течении анестезии IV – в первые пять суток послеоперационного периода.
Исходно регистрировались следующие показатели:
- данные анамнеза и физикальных исследований: наличие сопутствующей патологии, постоянный приём медикаментов, наличие в анамнезе операций и анестезий, функциональная зависимость;
- антропометрические данные: возраст, пол, рост, вес.
После оперативного вмешательства:
- вид анестезии, длительность анестезии, область оперативного вмешательства.
На всех этапах периоперационного периода:
- параметры волемического статуса: центральное венозное давление, темп инфузии, интраоперационный послеоперационный гидробаланс, вид и количество использованных растворов;
- параметры гемодинамики: артериальное давление, частота сердечных сокращений, случаи гипер- или гипотонии; эпизоды нарушения сердечного ритма;
- лабораторные показатели: общий анализ крови (количество лейкоцитов, эритроцитов, тромбоцитов, гемоглобин, гематокрит), биохимический анализ крови (билирубин, мочевина, креатинин, трансаминазы, общий белок, альбумин, глюкоза, электролиты, амилаза), анализ кислотно-щелочного состояния крови (рН, рСО2, рО2, FiO2, ВЕ), электролиты крови (K+, Na+,Ca 2+,Cl-);
- средние дозы применявшихся препаратов (фентанил, кетамин, сибазон, дормикум, пропофол, наропин, севоран, изофлюран, атропин, дофамин, мезатон, норадреналин, адреналин, антибиотики и др.).
В послеоперационном периоде ежедневно в течение пяти дней после операции производилась оценка пациентов по шкале CAM-ICU с целью диагностирования делирия.
Частота регистрации показателей определялось целесообразностью для исследовательской работы и ограничивалось диагностическими возможностями лечебного учреждения.
Создание благоприятного предоперационного фона обеспечивалось стандартной премедикацией, включавшей двукратный прием (на ночь и утром за 1,5-2 ч до операции) таблетированных форм бензодиазепинов (0,14-0,20 мг/кг диазепама). Второй этап премедикации включал внутримышечное введение за 40-60 минут до поступления в операционную бензодиазепинов (0,14 мг/кг диазепама) и холинолитиков (0,01 мг/кг атропина) и антигистаминных препаратов (0,3 мг/кг димедрола).
Индукция анестезии осуществлялась в следующей последовательности: мидазолам в дозе 0,07 (0,3-0,1) мг/кг, кетамин в дозе 1,5 (1,0-1,8) мг/кг либо пропофол 1,5 мг/кг, фентанил в дозе 2,6 (2,4-3,4) мкг/кг, прекураризация недеполяризующим миорелаксантом – веро-пипекуроний - 0,017 (0,015-0,020) мг/кг, деполяризующий релаксант - листенон (1,5 (1,4-1,8 мг/кг)). Так же для миоплегии при индукции использовался тракриум в дозе - 0,5 (0,3-0,6) мг/кг.
Для поддержания тотальной внутривенной анестезии проводили инфузию кетамина 1,5 (1,4-1,9) мг/(кгч), фентанила 5,2 (4,0 -7,5) мкг/(кгч), дробное введение мидазолама 0,05 (0,04-0,11) мг/(кгч), на травматичных этапах операции для купирования артериальной гипертензии и/или тахикардии дополнительно вводились болюсы фентанила 100-200 мкг и дроперидола 2,5-5,0 мг; для поддержания сочетанной анестезии проводили инфузию кетамина 1,4 (1,3-1,8) мг/(кгч) или ингаляцию изофлюрана 0,6 (0,4-1,0) МАК, либо севофлюрана 0,7 (0,5-1,3) МАК, дробное введение мидазолама 0,6 (0,04-0,09) мг/(кгч), в эпидуральное пространство методом постоянной инфузии вводили 0,2 % ропивокаин - 6-12 мл/ч; ингаляционная анестезия поддерживалась инсуфляцией изофлюрана 0,9 (0,8-1,1) МАК, либо севофлюрана 0,8 (0,7-1,2) МАК, анальгезия в обоих вариантах поддерживалась дробным введением фентанила в общей дозе 3,1 (2,4 – 4,3) мкг/(кгч) и 3,4 (3,1-4,5) мкг/(кгч) соответственно. Объем инфузии варьировал от 11,3 до 18,9 мл/кг/ч, соотношение коллоиды/кристаллоиды – 1:3 или 1:4.
ИВЛ проводили респираторами Blease Focus (Blease, Великобритания) или Saturn Evo (Medec, Бельгия) воздушно-кислородной смесью (FiO2 не менее 0,5) в режиме нормовентиляции, начальный минутный объем вентиляции рассчитывали по формуле Т.М. Дарбиняна, величину дыхательного объема определяли из расчета ДО = 6 мл/кг идеальной массы тела пациента (Hans G.A., 2009). Коррекцию параметров вентиляции производили по данным капнографии и данным газового состава артериальной крови для обеспечения нормовентиляции с целевым уровнем paСО2 – 40 мм рт. ст.
Мониторный контроль состояния больного во время операции соответствовал минимальным требованиям стандарта, принятого в Гарвардской медицинской школе (Eichorn J.H., 1989; Winter A., Spens A.A., 1990).
Всем пациентам в постнаркозном периоде проводился комплекс интенсивной терапии: фармакотерапия, при необходимости протекция функции внешнего дыхания, мероприятия по общему уходу, лечение гипотермии.
Фармакотерапия включала:
- инфузионную терапию коллоидными и кристаллоидными растворами из расчета 28,5-62,3 мл/кг/сутки;
- коррекцию нарушений водно-электролитного, кислотно-основного состояния, углеводного и белкового обмена, анемии, нарушений гемостаза;
- при необходимости, кардиотоники и вазопрессоры;
- тромбопрофилактику низкомолекулярными или нефракционированным гепаринами;
- профилактическую антибактериальную терапию;
- препараты, снижающие секрецию в желудочно-кишечном тракте – фамотидин и октреотид (по показаниям);
- обезболивающие препараты опиаты и НПВС, парацетамол;
- седативные препараты (по показаниям).
Обезболивание у пациентов после тотальной внутривенной и комбинированной анестезии осуществлялось наркотическими анальгетиками:
- фентанил в виде постоянной инфузии 1-2 мкг/кг/мин ;
- дробное внутримышечное или внутривенное введение морфина 5-10 мг или промедола 10-40 мг по требованию или в плановом порядке (каждые 4-6 ч.).
Коррекция гипотермии осуществлялась пассивными методами путем укрывания и активно – предварительным согреванием инфузионных растворов до 37 C., тепловыми воздушными пушками
После сочетанной анестезии обезболивание осуществлялось 0,2% раствором ропивакаина (иногда в комбинации с фентанилом 0,3-0,5 мкг/кг/час) в эпидуральное пространство в виде постоянной инфузии со скоростью 4-15 мл/час. Общие и регионарные методы послеоперационного обезболивания при отсутствии противопоказаний комбинировались с использованием нестероидных противовоспалительных препаратов:
- кеторолак 30 мг внутримышечно 2-4 раза в сутки;
- парацетамол 1000 мг внутривенно 2-4 раза в сутки.
В некоторых случаях вводились ингибиторы протеаз (препараты апротинина: контрикал 100 000 Ед/сут в виде постоянной инфузии).
Для проведения анализа полученных результатов составлен план (рис. 1). База данных создана на основе историй болезни, карт течения анестезии, листов назначения и динамического наблюдения пациентов. Регистрируемые в рамках исследования показатели вносились в файл базы данных программы MS Excel XP (Microsoft Corp., США). Статистические расчеты проводились с помощью программ Statistica 6.1 (StatSoft Inc., США) и MedCalk (MedCalc Software, Belgium).
Начальное определение взаимосвязи зарегистрированных показателей и развитием делирия проводилось с использованием корреляционного анализа (ранговая корреляции Спирмена). Статистически значимой корреляция считалась при р<0,05 (Гланц С., 1999; Петри А., Сэбин К., 2003).
Для корректного математического расчета качественные факторы риска (гипотония, анемия, применение вазоактивных препаратов, гипотермия, гипертермия и др.) были преобразованы в числовые коды.
Изучая корреляционные связи между различными переменными, можно говорить о том, что изменение одной величины однонаправлено или разнонаправлено сопровождает изменения другой величины, но не доказывает причинно-следственной взаимосвязи ( Гланц С., 1999; Петри А., Сэбин К., 2003). На данном этапе анализа были исключены факторы, которые заведомо не оказывают влияние на развитие послеоперационного делирия.

Рис. 1. План исследования
Второй этап статистического анализа выполнялся при помощи программы Statistica 6.1. и включал многофакторный регрессионный анализ, который дает возможность прогнозировать одну зависимую переменную (развитие послеоперационного делирия) по другим независимым переменным (прогностическим факторам) с выявлением их прогностического коэффициента (b).
После выявления факторов риска методом многофакторной регрессии, была определена чувствительность и специфичность каждого предиктора путём построения ROC-кривой при помощи программы MedCalc (MedCalc Software, Бельгия). Для определения численного значения прогностической значимости каждого фактора использовался показатель AUC (Area Under Curve) (Леонов В.П. 2009).
Точка оптимальной чувствительности и специфичности на ROC-кривой принималась за критерий риска развития послеоперационного делирия (Гринхальх Т., 2004; Банержи А., 2007; Леонов В.П. 2009).
Критерии риска предоперационных факторов были включены в разрабатываемую прогностическую шкалу развития послеоперационного делирия. Прогностическая ценность модели шкалы была также проверена путём построения ROC-кривой. Была определена её чувствительность, специфичность и область под кривой. Точка оптимальной чувствительности и специфичности взята за критерий высокого риска развития ПД (Леонов В.П. 2009).
Затем осуществлена апробация прогностической шкалы для случайной выборки пожилых пациентов (n=132), перенесших длительные операции на органах брюшной полости. В зависимости от полученных результатов по разработанной шкале, пациенты основной группы были разделены на подгруппы высокого и низкого риска развития ПД.
Пациенты низкого риска подвергались стандартным методикам предоперационной подготовки, вид анестезии определялся согласно опыту и предпочтениям анестезиолога, проводившего пособие. Коррекция нарушений гомеостаза (анемии, гипопротеинемии и пр.) производилась исходя из стандартных, принятых в нашей клинике и повсеместно подходов:
- предоперационное парентеральное питание в данной группе назначалось только при невозможности проведения энтерального питания или в случае тяжёлой недостаточности питания (общий белок ниже 45 г/л, альбумин ниже 20 г/л) Инфузия альбумна в предоперационном периоде не проводилась;
- трансфузия эритроцитарной массы проводилась при значениях гемоглобина ниже 90 г/л;
- индукция анестезии проводилась на основе различных препаратов, исходя из предпочтений анестезиолога и показаний к применению. В качестве индукционного анестетика применялись пропофол, бензодиазепины, кетамин;
- коррекция гипотонии проводилась при снижении АДср ниже 70 мм рт.ст.;
- препараты калия применялись при концентрации калия в крови ниже 3,5 ммоль/л.;
- в послеоперационном периоде коррекция анемии также проводилась при значениях гемоглобина ниже 90 г/л.
- при невозможности проведения энтерального проводилось полное парентеральное питание. Трансфузия альбумина проводилась при снижении его концентрации в крови ниже 20 г/л.
Ведение пациентов высокого риска в периоперационном периоде осуществлялось с учетом выявленных факторов риска и профилактических разработанных мер:
- предоперационное парентеральное питание у таких пациентов назначалось при значении общего белка ниже 68 г/л, трансфузия альбумина проводилась при его концентрации ниже 28 г/л.
- трансфузия эритроцитарной массы в предоперационном периоде проводилась при значениях гемоглобина ниже 100 г/л.
- индукция анестезии проводилась на основе кетамина в дозе 1,5-2 мг/кг, при отсутствии противопоказаний к его применению.
- коррекция гипотонии проводилась при снижении АДср на 20% от исходного значения.
- препараты калия применялись при концентрации калия в крови ниже 3,4 ммоль/л.
- в послеоперационном периоде коррекция анемии проводилась при значениях гемоглобина ниже 113 г/л.
- проводилось полное парентеральное питание после операции. Трансфузия альбумина при снижении его концентрации в крови ниже 24 г/л.
Впоследствии проанализирована частота развития делирия в группах высокого и низкого риска развития послеоперационного делирия.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Факторы риска развития послеоперационного делирия
На первом этапе статистического анализа в контрольной группе произведён расчет коэффициентов корреляции при помощи ранговой корреляции Спирмена для всех зарегистрированных параметров (Гланц С., 1999; Петри А., Сэбин К., 2003). В предоперационном периоде выявлены 13 факторов, имеющих достоверные связи с развитием ПД, в интраоперационном периоде 7 факторов, в послеоперационном периоде 9 факторов риска.
Затем проведен многофакторный регрессионный анализ коррелируемых факторов для каждого этапа периоперационного периода, с целью выявления истинных предикторов развития ПД. Значимость и направленность факторов определяли по полученным статистически значимым коэффициентам регрессии (b-коэффициент) (Гланц С., 1999; Петри А., Сэбин К., 2003).
В результате регрессионного анализа всего выявлено 15 периоперационых факторов риска, имеющих причинно-следственную связь с развитием ПД у пожилых пациентов после обширных абдоминальных операций.
В предоперационном периоде такими факторами являются: заболевания органов чувств (катаракта, глаукома, пресбиопия высокой степени, миопия высокой степени, гиперметропия высокой степени, нейросенсорная тугоухость, глухота), наличие у пациента диагноза дисциркуляторная энцефалопатия ДЭП независимо от степени, уровень гемоглобина, исходный уровень аспартатаминотрансферазы (АСТ), концентрация общего белка и альбумина, ХСН II-III степени по NYHA (Табл. 1).
Наиболее значимым качественным фактором риска в данном периоде, является наличие хронической сердечной недостаточности (ХСН), причем риск возникновения ПД имел прямую зависимость от её степени. Связь между ПД и ХСН 1 степени по NYHA установить не удалось. Чуть менее значимыми фактором (b=0,215) являются исходные заболевания органов чувств (тугоухость, сниженное зрение) и наличие диагноза дисциркуляторная энцефалопатия (ДЭП) (b=0,219).
Из лабораторных показателей прогностическую значимость имели исходная концентрация гемоглобина (b=-0,206), общего белка (b=-0,279) и альбумина (b=-0,187). Также из лабораторных факторов риска выделялся повышенный уровень аспартатаминотрансферазы (АСТ) (b=0,272).
Таблица 1
Результаты многофакторного регрессионного анализа
предоперационных факторов
| b | Стандартная ошибка b | Достоверность b | |
| Заболевания органов чувств | 0,215 | 0,075 | 0,005 |
| Гемоглобин | -0,206 | 0,082 | 0,015 |
| АСТ | 0,272 | 0,082 | 0,000 |
| Общий белок | -0,279 | 0,082 | 0,000 |
| Альбумин | -0,187 | 0,074 | 0,000 |
| ДЭП | 0,219 | 0,084 | 0,019 |
| ХСН II ст. по NYHA ХСН III ст. по NYHA | 0,167 0,283 | 0,076 0,081 | 0,019 0,000 |
b - коэффициент регрессии.
Важно оценить окончательные значения скорректированного R2 и критерия F. В настоящем исследовании R2=0,782. Это достаточно хорошее значение, показывающее, что построенная регрессия объясняет 78,2% случаев послеоперационного делирия (Гланц С., 1999; Петри А., Сэбин К., 2003). Критериий F – 70,3 с достоверностью р=0,000000 также свидетельствует о том, что построенная регрессия высоко значима (Гланц С., 1999; Петри А., Сэбин К., 2003).
В интраоперационном периоде установлена связь с 4 параметрами: интраоперационной гипотонией (снижение АДср на 20% и более), индукционной дозой кетамина, средней дозой дофамина, концентрацией калия в крови (табл. 2).
Таблица 2
Результаты регрессионного анализа интраоперационных факторов
| b | Стандартная ошибка b | Достоверность b | |
| Индукционная доза кетамина | -0,357 | 0,076 | 0,000 |
| Интраоперационная гипотония | 0,379 | 0,070 | 0,002 |
| Концентрация К+ | -0,216 | 0,086 | 0,014 |
| Средняя доза дофамина | -0,218 | 0,084 | 0,012 |
b - коэффициент регрессии.
Из интраоперационных факторов, наиболее значимым является гипотония (b=0,379), так же весьма значима индукционная доза кетамина (b=-0,357). Несколько меньшую прогностическую значимость имеет средняя доза вазоактивных препаратов (дофамин, норадреналин, мезатон) (b=-0,218). Из лабораторных показателей получена весьма выраженная обратная связь ПД с концентрацией калия крови (b=0,216) (табл. 3.2).
В данной модели R2=0,75. Это достаточно хорошее значение, показывающее, что построенная регрессия объясняет 75% случаев послеоперационного делирия в нашей выборке (Гланц С., 1999; Петри А., Сэбин К., 2003).
После регрессионного анализа выделены четыре значимых послеоперационных факторов риска развития делирия (табл. 3). Была выявлена выраженная обратная связь между абсолютными показателями значений гемоглобина и развитием ПД. Так же выявлена обратная зависимость с уровнем гематокрита (b=-0,205). Наиболее значимую обратную зависимость показали уровень общего белка (b=-0,374) и альбумина (b=-0,291).
Таблица 3
Результаты регрессионного анализа послеоперационных факторов
| b | Стандартная ошибка b | Достоверность b | |
| Гемоглобин | -0,263 | 0,066 | 0,116 |
| Гематокрит | -0,205 | 0,065 | 0,002 |
| О. белок | -0,374 | 0,013 | 0,000 |
| Альбумин | -0,291 | 0,021 | 0,000 |
b - коэффициент регрессии
Выявлена прогностически значимая обратная связь со средней дозой дофамина. Этот результат противоречит мнению большинства авторов, которые связывают развитие делирия с высокими интраоперационными дозами инотропных препаратов (Rudolph J.L. et al., 2007; Hudetz J. et al., 2009). Но при анализе средних доз дофамина в контрольной группе, установлено, что дозы дофамина в группе с развившимся делирием были достоверно выше, чем в группе без делирия, что уже согласуется с большинством источников. Обращает на себя внимание тот факт, что в группе с развившимся делирием инотропная поддержка применялась только в 25% случаев гипотоний, и была эффективна (АДср >70 мм рт.ст.) в 57%. В группе без делирия дофамин и другие вазоактивные препараты, применялись в 90% случаев гипотонии, а эффективность инотропной поддержки составила 83%. Таким образом, обратная зависимость с дозой дофамина связана с недостаточно эффективной инотропной поддержкой или её отсутствием в группе больных с делирием. Учитывая выше изложенное, высокие средние дозы дофамина, как фактор, были объединены с фактором интраоперационной гипотонии в один предиктор развития ПД, который встречался у 60% пациентов с развившимся делирием.
Как основной релаксант пипекуроний применялся в 81 анестезии, в остальных случаях использовались релаксанты средней продолжительности действия, чаще всего тракриум. В группе с делирием частота использования веро-пипекурония составляла 68%, средняя доза составила 0,026 мг/кг*ч. В группе без делирия, веро-пипекуроний применялся в 48% случаев, и средняя доза составила 0,019 мг/кг*ч.
Не было установлено зависимости между развившимся ПД и видом анестезии. В общей группе, в большинстве случаев в качестве анестетика использовались ингаляционные препараты: севофлюран в 73%, изофлюран в 19%. Как основной анестетик кетамин использовался в 8% случаев, но как препарат для индукции в анестезию в 82 % случаев. В группе с развившимся делирием индукция кетамином осуществлялась в 21 случае (60%), средняя доза составила 0,9 мг/кг, в группе без делирия кетамин для индукции применялся в 129 случаях (95%) и средняя доза при индукции составила 1,6 мг/кг. Ни один из видов послеоперационного обезболивания также не имел с развитием делирия.
Нам не удалось получить значимых корреляционных связей между ПД и полом пациентов. В других источниках также не удалось обнаружить единого мнения касательно этого. Нет четкого объяснения того, почему мужчины должны иметь повышенный риск ПД, возможно, это связано с тем, что мужчины имеют повышенный риск сердечно-сосудистых заболеваний, которые являются достоверно известным фактором риска развития ПД.
Несколько исследований показали, что физический статус 3 и более класса по ASA увеличивает вероятность развития ПД (British Geriatrics Society., 2012), однако другие авторы не выявили такой зависимости (Bhner H. et al., 2003). Нам также не удалось найти выраженной корреляционной связи между исходным статусом ASA и развитием делирия в послеоперационном периоде.
Также не было установлено зависимости между делирием и видом анестезии. Среди других источников нет однозначных выводов, подтверждающих эту зависимость. Некоторые устанавливают связь ПД с регионарными методами, другие эту зависимость опровергают (Rasmussen L.S. et al., 2003; Edelstein D.M. et al., 2004; Kunimatsu T. et al., 2004; Yildizeli B. et al., 2005).
Из ожидаемых факторов риска, не удалось установить причинно-следственной связи ПД и объёмом интраоперационной кровопотери, которая отмечается большим количеством авторов (Lepous C. et al., 2006; Gao R. et al., 2008; Krenk L. et al., 2012). Мы связываем этот факт со своевременной интраоперационной коррекцией анемии в исследуемой группе.
Многофакторная регрессия позволила нам выявить факторы, достоверно имеющие причинно-следственную связь с развитием послеоперационного делирия, но не определила чёткие критерии риска количественных факторов. С этой целью была определена чувствительность и специфичность каждого предиктора путём ROC-анализа, критериями риска являлись точки оптимальной чувствительности и специфичности на ROC-кривых (Леонов В.П., 2009).
Все 14 факторов периоперационного периода продемонстрировали прогностическую значимость (табл. 4).
Таблица 4
Результаты ROC-анализа периоперационых факторов риска развития ПД
| Факторы риска | Sensitivity | Specificity | AUC | Критерий риска |
| Нарушения сенсорики | 76,6 | 88,5 | 0,79 | Наличие |
| ХСН II и более по NYHA | 100 | 86,3 | 0,93 | ХСН II и по NYHA |
| ДЭП | 82,2 | 96,3 | 0,88 | Наличие |
| Предоперационный АСТ | 76,8 | 85,4 | 0,77 | > 26 Ед/л |
| Предоперационныйый общий белок | 76,1 | 71,1 | 0,69 | < 68 г/л |
| Предоперационный альбумин | 78,5 | 87,3 | 0,79 | < 28 г/л |
| Предоперационный Hb | 80,1 | 90,7 | 0,85 | < 100 г/л |
| Индукционная доза кетамина | 83,5 | 80,2 | 0,85 | < 1,12 мг/кг |
| Интраоперационная гипотония | 75,2 | 81,1 | 0,72 | Наличие |
| Интраоперационный К+ | 73,4 | 97,2 | 0,78 | < 3,4 ммоль/л |
| Послеоперационный Hb | 86,7 | 75,8 | 0,86 | 113 г/л |
| Послеоперационный Ht | 76,7 | 83,3 | 0,83 | 31% |
| Послеоперационный общий белок | 96,7 | 95,0 | 0,98 | 61 г/л |
| Послеоперационный альбумин | 76,7 | 95,8 | 0,76 | 24 г/л |
Следует отметить, что во всех случаях делирия наблюдалось сочетание от двух до пяти факторов риска. Комбинация из двух факторов наблюдалась у 7 пациентов (20%), из трёх – у 12 (35%), из четырёх - у 9 (25%), из пяти - у 7 (20%).
Доминирующим фактором в сочетаниях является ХСН II ст. и выше. Общая доля данного фактора в сочетаниях составляет 77%, низкие показатели общего белка и альбумина - 63%, гемоглобина ниже 100 г/л – 51%, АСТ > 25 ед/л – 43%, заболеваний органов чувств и ДЭП – 37%.
Шкала прогнозирования развития послеоперационного делирия у пожилых пациентов после обширных абдоминальных операций.
Для создания прогностической шкалы использовались только предоперационные факторы риска: исходные нарушения сенсорики (заболевания органов чувств), ХСН > II и более по NYHA, наличие диагноза ДЭП, уровень гемоглобина < 100 г/л, АСТ > 26 Ед/л, общий белок < 68 г/л, альбумин < 28 г/л.
При наличии фактора риска пациенту присваивался один балл, с последующим суммированием. Окончательный вид прогностической шкалы представлен в таблице 5.
Таблица 5
Шкала риска развития послеоперационного делирия у пожилых пациентов после обширных абдоминальных операций
| Предоперационные факторы риска | При наличии признака присваивается 1 балл, после чего баллы суммируются. Максимальное количество баллов - 7 | |
| Заболевания органов чувств | Да/Нет | |
| ХСН>II ст. по NYHA | Да/Нет | |
| ДЭП | Да/Нет | |
| АСТ > 28 Ед/л. | Да/Нет | |
| Общий белок < 68 г/л | Да/Нет | |
| Альбумин < 28 г/л | Да/Нет | |
| Гемоглобин < 100 г/л | Да/Нет | |
| Риск развития ПД высокий при сумме баллов 3 | ||
Каждый пациент контрольной группы был оценен по разработанной шкале. С целью проверки прогностической значимости и выявления критерия высокого риска развития послеоперационного делирия, полученные результаты были подвергнуты ROC-анализу с построением кривой, судя по которой модель показала отличное качество (чувствительность 80,6, специфичность 98,5, AUC 0,95). Как критерий высокого риска определена сумма баллов > 3.
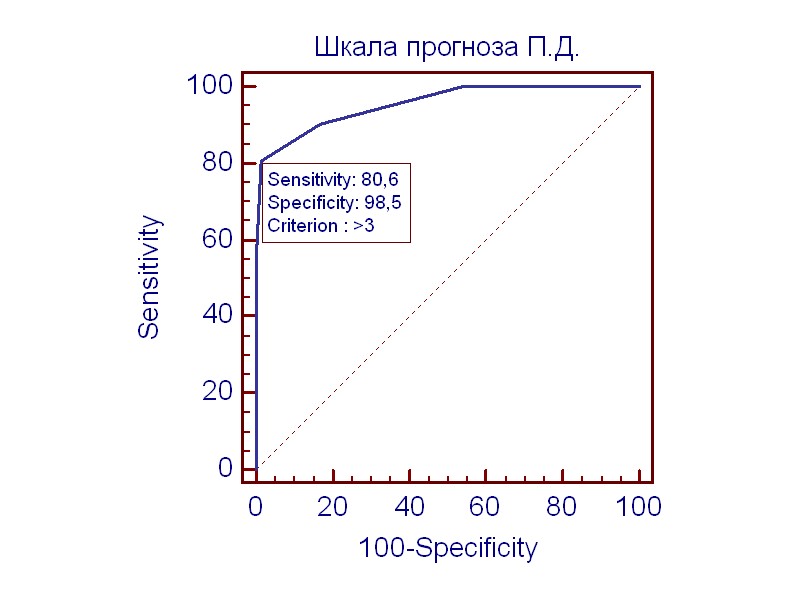
Рис. 2. Массив данных по прогнозированию послеоперационного делирия, связь развития делирия с разработанной шкалой прогноза.
Алгоритм профилактики послеоперационного делирия у пожилых пациентов после обширных абдоминальных операций и его апробация
Алгоритм профилактики развития ПД основан на воздействии на модифицируемые факторы риска и затрагивает все этапы периоперационного периода (рис. 3).
Апробация алгоритма производилась на основной группе пациентов (n=132). Всем пациентам исходно производилось оценивание риска развития ПД, по разработанной прогностической шкале (табл. 5). Пациенты, имеющие низкий риск развития послеоперационного делирия (n=103), подверглись стандартному периоперационному ведению, принятому в клинике.
К пациентам высокого риска (n=29), был применён разработанный алгоритм профилактики ПД (рис. 3).
В контрольной группе послеоперационный делирий наблюдался у 20,5% пациентов (n=35) и развивался в 1-4 сутки после оперативного вмешательства. Средняя длительность составила 3±2,5 суток. В первые сутки ПД был зарегистрирован у 22,8% больных (n=8), во вторые - у 42,8% (n=15), в третьи - у 28,5% (n=10) и в четвёртые - у 5,7% (n=2). У 19 пациентов (14%) зарегистрирована гиперактивная форма ПД, у 12-ти (54%) – смешанная, у 4-х (32%) – гипоактивная.
В контрольной группе частота ПД у пациентов высокого риска (n=42) составила 59%, у больных низкого риска (n=128) - 10,2%.
В основной группе частота делирия составила 9,8%. ПД развивался во 2-4 сутки после оперативного вмешательства. Средняя длительность составила 2±1,5 суток. Случаев развития делирия в первые сутки не наблюдалось. Во вторые сутки ПД развился у 38,4% (n=5), в третьи - у 41,1% (n=6) и в четвёртые – у 15,3 % (n=2). У 3-х пациентов (23%) зарегистрирована гиперактивная форма ПД, у 7-ми (54%) – смешанная, у 3-х (23%) – гипоактивная.
В основной группе пациентов (n=132) низкий риск развития ПД был определён у 103 пациентов, частота делирия составила 9,7%. У больных высокого риска (n=29) данной группы частота ПД была 10,3%. Применение предложенного алгоритма профилактики позволило снизить частоту делирия в основной группе в два раза, а в подгруппе высокого риска более чем в пять раз (табл. 6).
Таблица 6
Частота развития послеоперационного делирия
в основной и контрольной группах
| Частота ПД | Контрольная группа | Основная группа |
| У больных с высоким риском ПД | 59% (n=42) | 10,3%* (n=29) |
| У больных с низким риском ПД | 10,2% (n=128) | 9,7% (n=103) |
| Всего в группах | 20,5% (n=170) | 9,8%* (n=132) |
*- p<0,05 по критерию 2 в сравнении с контрольной группой
Рис. 3. Алгоритм профилактики послеоперационного делирия у пожилых пациентов с высоким риском при обширных абдоминальных операциях.
Достоверное снижение частоты развития послеоперационного делирия в основной группе свидетельствует об эффективности разработанной профилактической стратегии. При этом, в подгруппе пациентов высокого риска делирий развивался в 6 раз реже при применении профилактических мероприятий. Отсутствие выраженного снижения частоты ПД у пациентов низкого риска объясняется, в первую очередь, преобладанием немодифицируемых или «слабомодифицируемых» факторов риска.
ВЫВОДЫ
1. Выявлено, что для пациентов пожилого возраста, нуждающихся в обширных абдоминальных хирургических вмешательствах, характерно наличие факторов риска развития послеоперационного делирия, отражающих состояние гомеостаза и основных жизненно важных биохимических констант, имеющих четкую зависимость от этапа периоперационного периода, которые могут быть легко диагностированы на основе рутинного предоперационного обследования пациента.
2. Продемонстрировано, что применение кетамина для индукции анестезии у пациентов пожилого возраста в дозе не ниже 1,12 мг/кг существенно снижает риск развития послеоперационного делирия.
3. Доказано, что развитие послеоперационного делирия у пожилых пациентов имеет многофакторную этиологию, и развивается при сочетании двух и более факторов риска. В предоперационный период самым частым является сочетание ХСН II ст. по NYHA и выше с уровнем альбумина ниже 30 г/л (37%), в интраоперационный период - сочетание гипотонии и концентрации калия в плазме крови менее 3,4 ммоль/л (41%), в послеоперационный период - сочетание общий белок ниже 61 г/л с уровнем альбумина ниже 24 (31%).
4. Доказано, что прогностическая шкала риска развития послеоперационного делирия у пациентов пожилого возраста, включающая основные факторы риска, характерные для предоперационного периода характеризуется высокой чувствительностью (80,6) и специфичностью (98,5, AUC 0,95).
5. Продемонстрировано, что применение алгоритма профилактики послеоперационного делирия у пожилых пациентов, основанного на тщательной предоперационной коррекции гомеостаза и интраоперационном использовании кетамина в дозе 1,5-2,0 мг/кг, позволило значительно снизить частоту развития данного осложнения у исследуемых пожилых пациентов с 20,5% до 9,8%, а среди больных с высоким риском развития послеоперационного делирия с 59% до 10,3%.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. У всех пациентов пожилого возраста, нуждающихся в обширных хирургических вмешательствах, необходимо проводить оценку факторов риска развития послеоперационного делирия с использованием предложенной прогностической шкалы, применение которой доступно в стационаре любого уровня независимо от материально-технического оснащения.
2. Оценка по прогностической шкале риска развития послеоперационного делирия менее трёх баллов свидетельствует о низком риске возникновения данного осложнения, что позволяет использовать схему стандартного периоперационного ведения пациента.
3. Оценка по прогностической шкале риска развития послеоперационного делирия от трёх до семи баллов свидетельствует о высоком риске возникновения данного осложнения, что является показанием для использования предложенного алгоритма профилактики данного осложнения.
4. С целью профилактики послеоперационного делирия у пациентов пожилого возраста в пред- и послеоперационном периодах показана тщательная коррекция гипопротеинемии, гипоальбуминемии и анемии при снижении концентрации гемоглобина ниже 100-113 г/л.
5. Основным методом профилактики послеоперационного делирия у пожилых пациентов в интраоперационный период является индукция анестезии путем внутривенного болюсного введения кетамина в дозе 1,12-2 мг/кг и коррекция интраоперационной гипотонии при снижении среднего артериального давления более чем на 20% от исходных показателей.
Список работ, опубликованных по теме диссертации
1. Рудометкин, С.Г. Риск развития послеоперационного делирия в зависимости от вида анестезии в абдоминальной хирургии / С.Г. Рудометкин, Н.В. Трембач // I Всероссийская конференция молодых ученых «Инновации в анестезиологии и реаниматологии»: матер. конф. – М., 2011. - С. 170.
2. Рудомёткин, С.Г. Риск развития послеоперационного делирия в зависимости от исходного физиологического и когнитивного статусов в абдоминальной хирургии / С.Г. Рудометкин, Н.В. Трембач, М.К. Карипиди // I Всероссийская конференция молодых ученых «Инновации в анестезиологии и реаниматологии»: матер. конф. – М., 2011. - С. 171.
3. Рудометкин, С.Г. Влияние толерантности к транзиторной гипоксии и гиперкапнии на развитие послеоперационного делирия в гериатрии / С.Г. Рудометкин, Н.В. Трембач // Вестник интенсивной терапии. – 2011. - №5. – С 56 –57.
4. Рудомёткин, С.Г. Модифицируемые интраоперационные факторы риска послеоперационного делирия у пожилых пациентов, подвергшихся обширным абдоминальным операциям / С.Г. Рудометкин, Н.В. Трембач, И.Б. Заболотских // XIII съезд Федерации анестезиологов и реаниматологов: матер. съезда – СПб., 2012. – С.132.
5. Заболотских, И.Б. Предоперационные факторы риска развития делирия у пожилых пациентов после обширных абдоминальных операций / И.Б. Заболотских, С.Г. Рудомёткин, Н.В. Трембач // Вестник анестезиологии и реаниматологии. – 2012. - Том 9. - №4. – С. 3-8.
6. Заболотских, И.Б. Предоперационные и интраоперационные факторы риска развития делирия у пожилых пациентов после обширных абдоминальных операций / И.Б. Заболотских, С.Г. Рудомёткин, Н.В. Трембач // Кубанский научный медицинский вестник. – Краснодар. - 2012. - №3 (132). – С. 121-128.
7. Рудометкин, С.Г. Интраоперационные факторы риска развития делирия у пожилых пациентов, перенесших обширные абдоминальные операции / С.Г. Рудометкин // Вестник интенсивной терапии. – 2012. - №5. - С 104-107.
8. Рудометкин, С.Г. Шкала риска развития делирия у пожилых пациентов перенесших обширные абдоминальные операции / С.Г. Рудометкин, Н.В. Трембач // 14 Всероссийская конференция с международным участием «Жизнеобеспечение при критических состояниях»: матер. конф. – М., 2012. – С119.
9. Рудомёткин, С.Г. Прогнозирование послеоперационного делирия у пожилых пациентов, подвергающихся обширным оперативным вмешательствам на органах брюшной полости / С.Г. Рудометкин, Н.В. Трембач, И.Б. Заболотских // Кубанский научный медицинский вестник. – Краснодар. - 2012. - №4 (134). – С. 91-95.
10. Заболотских, И.Б. Профилактика делирия у пожилых пациентов после обширных абдоминальных операций / И.Б. Заболотских, С.Г. Рудометкин, Н.В. Трембач // Вестник анестезиологии и реаниматологии. – 2013. - Том 10. - № 1. – С.7-12.
СПИСОК СОКРАЩЕНИЙ
| АД | артериальное давление |
| АДд | диастолическое артериальное давление |
| АДс | систолическое артериальное давление |
| АДср | среднее артериальное давление |
| АСТ | аспартатаминотрансфераза |
| ДЭП | дисциркуляторная энцефалопатия |
| ИВЛ | искусственная вентиляция легких |
| КАИ КАС | комбинированная анестезия на основе изофлюрана комбинированная анестезия на основе севофлюрана |
| ПД | послеоперационный делирий |
| СА | сочетанная анестезия |
| ТВА | тотальная внутривенная анестезия |
| ТИА | транзиторная ишемическая атака |
| ХСН | хроническая сердечная недостаточность |
| ASA | American Society of Anesthesiologists |
| АUC | Area under the ROC curve |
| MMSE | Mini Mental State Examination |
| ROC | Receiver operator characteristic |

