Влияние препаратов-проводников с лимфотропной активностью на фармакокинетические и фармакодинамические параметры цефотаксима
На правах рукописи
Юров Дмитрий Евгеньевич
Влияние препаратов-проводников с лимфотропной активностью
на фармакокинетические и фармакодинамические
параметры цефотаксима
14.03.06 – фармакология, клиническая фармакология
АВТОРЕФЕРАТ
Диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2011
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Российский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Научный руководитель:
| доктор медицинских наук, профессор | Козлов Иван Генрихович |
| Научный консультант: | |
| кандидат медицинских наук, доцент | Кукушкин Герман Владимирович |
Официальные оппоненты:
| член-корр. РАМН, профессор | Шимановский Николай Львович |
| доктор медицинских наук, профессор | Муляр Александр Георгиевич |
Ведущая организация:
Учреждение Российской академии медицинских наук Научно-исследовательский институт фармакологии имени В.В. Закусова РАМН
Защита состоится «21» марта 2011 года в 14:00 часов на заседании диссертационного совета Д 208.072.01 при ГОУ ВПО РГМУ Росздрава по адресу: 117997, г. Москва, ул. Островитянова, д.1.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО РГМУ Росздрава по адресу: 117997, г. Москва, ул. Островитянова, д.1.
Автореферат разослан «17» февраля 2011 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Потешкина Н.Г.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы исследования
Разработка и внедрение средств и методов направленного транспорта лекарственных препаратов является одной из важнейших стратегических задач современной фармакологии [Kshirsagar N.A., 2000; Gholam A. et al., 2005]. Их применение позволяет увеличивать биодоступность лекарственных веществ, минимизировать потери при распределении в тканях, повышать концентрацию в очаге повреждения и увеличивать время полувыведения. В целом, использование средств и способов направленной доставки препаратов повышает эффективность проводимой терапии, улучшает ее переносимость, безопасность и комплаентность [Леонова М.В., 2009; Muranishi S., 2000; Wertheimer A., 2005].
В качестве одного из перспективных фармакотерапевтических направлений рассматривается целевая доставка лекарственных средств в лимфатическую систему, которая является ключевым звеном гуморального транспорта и участвует практически во всех патологических процессах, независимо от их этиологии и патогенеза [Левин Ю.М., 2008]. Кроме того, играя важную роль в регуляции иммунного ответа и элиминации чужеродных веществ, лимфатическая система одновременно служит одним из основных путей распространения в организме опухолевых клеток, бактерий и вирусов [Левин Ю.М., 1987; Аничков Н.М. и др., 1989; Charman W., 1992; Jain R.,2002; Cao Y.,2005]. Поэтому направленный транспорт лекарственных веществ в лимфатическую систему позволяет не только оказывать эффективное терапевтическое воздействие на патологический процесс непосредственно в лимфатических сосудах и лимфоузлах, но и доставлять их к очагу повреждения [Буянов В.М., 1991; Бородин Ю.И., 2010].
В связи с этим, в последние годы ведется активный поиск способов, обеспечивающих накопление лекарственных средств (особенно противоопухолевых, антибактериальных и противовирусных) в лимфатической системе [Панченков Р.Т. и др., 1982; Левин Ю.М., 1982, 2003; Бондарь Г.В., 2009; Yumei X., 2009]. С этой целью в клинической практике используются прямое введение лекарственных препаратов в лимфатические сосуды (эндолимфатический способ введения) и метод непрямого лимфотропного введения [Чернеховская Н.Е. и др., 2000]. Для создания лимфотропности лекарственных средств применяют локальное эндотрахеальное и эндобронхиальное введение в подслизистые оболочки, системы направленной доставки на основе нанотехнологий, эндолимфатические проводники, способствующие транспорту низкомолекулярных веществ из интерстиция в лимфатические капилляры. Установлено, что свойствами препаратов-проводников обладают, например, лекарственные средства с протеазной активностью – гиалуронидаза, химотрипсин. Показано, что они усиливают движение жидкости и белков в тканях, ускоряя тем самым лимфатический дренаж, что, по-видимому, и обеспечивает транспорт низкомолекулярных ксенобиотиков (в том числе лекарственных веществ) преимущественно в лимфатическую систему [Левин Ю.М., 1982; Свиридкина Л.П. и др., 2007; D.E. Golan et al., 2007].
Как прямой, так и непрямой способы введения лекарственных препаратов в лимфатическую систему имеют свою терапевтическую нишу. Многие авторы указывают на перспективность именно второго подхода, т.к. он сочетает в себе удобство применения, безопасность и высокую эффективность [Левин Ю.М., 1998; Свиридкина Л.П. и др., 2001; Долидзе Д.Д. и др., 2001; Джугостран В.Я. и др., 2005].
Широкое применение нанотехнологических систем доставки ограничивают высокая стоимость, трудоемкость получения и недостаточно хорошо изученные побочные эффекты, а эндотрахеальное и эндобронхиальное введение в подслизистые оболочки требует наличия эндоскопического оборудования и специальной подготовки медицинского персонала. В связи с этим весьма актуальным является поиск препаратов – эндолимфатических проводников для подкожного и внутримышечного введения, что расширило бы возможности непрямой лимфотропной терапии и привело к повышению эффективности лечения целого ряда заболеваний.
Цель исследования: изучить влияние препаратов-проводников, обладающих лимфотропной активностью на фармакодинамические и фармакокинетические параметры цефотаксима.
Для достижения данной цели были поставлены следующие задачи.
Задачи исследования:
- Исследовать влияние гиалуронидазы, гиалуронидазы+азоксимера и гепарина натрия на скорость лимфатического дренажа в брыжейке мышей.
- Разработать метод визуализации накопления лекарственных препаратов в клетках лимфатической системы.
- Провести изучение влияния препаратов-проводников на накопление лекарственного препарата в лимфатической системе.
- Провести сравнительную оценку концентраций цефотаксима в крови, тканях печени и стенки кишечника мышей через 1,5 и 24 часа после его совместного введения с препаратами-проводниками, обладающими лимфотропной активностью.
- Провести сравнительную оценку выживаемости мышей с моделированным гнойно-воспалительным процессом органов брюшной полости после однократного внутримышечного введения цефотаксима и его совместного введения с препаратами-проводниками.
Научная новизна исследования
- Впервые проведена сравнительная оценка концентраций антибиотика цефотаксима в плазме крови и тканях печени мышей после его совместного применения с препаратами-проводниками (гиалуронидазой, гиалуронидазой+азоксимером, гепарином натрия), обладающими лимфотропной активностью. Установлено, что предварительное введение препаратов-проводников не только приводит к созданию в плазме крови более высоких концентраций антибиотика, чем в случае его моновведения, но и обеспечивает поддержание более высоких уровней цефотаксима на протяжении суток. Кроме того, показано, что при моновведении цефотаксима его печеночные концентрации превышают плазменные, тогда как при совместном введении с препаратами-проводниками отмечена обратная направленность.
- Впервые разработан метод визуализации накопления лекарственных препаратов в клетках лимфатической системы, сутью которого является определение процента флуоресцирующих лимфоцитов лимфоузлов при накоплении в них антибиотика доксициклина. С его помощью впервые изучено влияние гиалуронидазы, гиалуронидазы+азоксимера и гепарина натрия на накопление антибиотика в клетках лимфоузлов мышей. Показано, что все изученные препараты-проводники увеличивают накопление доксициклина в клетках лимфоузлов экспериментальных животных.
- Показано, что совместное использование препаратов-проводников с лимфотропной активностью и цефотаксима увеличивает выживаемость лабораторных животных с моделированным гнойно-воспалительным процессом органов брюшной полости.
- Впервые проведена сравнительная оценка концентраций антибиотика цефотаксима стенки кишечника мышей после его совместного применения с препаратами-проводниками (гиалуронидазой, гиалуронидазой+азоксимером, гепарином натрия), обладающими лимфотропной активностью. Установлено, что предварительное введение препаратов-проводников создает в ткани стенки кишечника более высокие концентрации антибиотика, чем в случае его моновведения, а также обеспечивает поддержание более высоких уровней цефотаксима на протяжении суток.
Практическая значимость работы
Полученные в ходе исследования данные позволяют обосновать целесообразность изучения клинического использования лимфотропной терапии, включающей применение препаратов-проводников, у пациентов с гнойно-воспалительными заболеваниями органов брюшной полости с целью повышения эффективности проводимой антибактериальной терапии.
Разработанный метод визуализации накопления лекарственных препаратов в клетках лимфатической системы может быть использован для изучения поступления лекарственных веществ в лимфатическую систему.
Результаты проведенного исследования углубляют имеющиеся представления о возможностях метода непрямой лимфотропной терапии.
Основные положения, выносимые на защиту
- Препараты-проводники с лимфотропной активностью (гиалуронидаза, гиалуронидаза+азоксимер и гепарин натрия) оказывают влияние на фармакокинетику антибиотика ЦФ, вызывая увеличение его концентрации в плазме крови и некоторых тканях, а также пролонгируют время циркуляции в организме.
- Изученные препараты-проводники обладают способностью ускорять лимфатический дренаж и увеличивают поступление антибиотика в лимфатическую систему.
- Применение лимфотропной антибиотикотерапии ЦФ, повышает эффективность проводимой терапии, увеличивая выживаемость животных с моделированным гнойно-воспалительным процессом органов брюшной полости.
Апробация работы
По результатам исследований опубликовано 8 работ. Основные положения диссертации были представлены на III съезде лимфологов России (Москва, 2008), XVI Российском национальном конгрессе «Человек и лекарство» (Москва, 2009), Конференции «44 года основания и становления общеклинической лимфологии и эндоэкологической реабилитации» (Москва, 2009).
Апробация диссертации состоялась на расширенном заседании кафедры фармакологии ГОУ ВПО Российский государственный медицинский университет Росздрава.
Внедрение результатов исследования
Полученные в исследовании результаты используются в учебном процессе и экспериментальных исследованиях на кафедре фармакологии ГОУ ВПО РГМУ Росздрава, в отделе молекулярной и экспериментальной гематологии, онкологии и иммунологии ФНКЦ ДГОИ Росздрава.
Структура и объем диссертации
Диссертация изложена на 101 странице, состоит из введения, обзора литературы, главы «Материалы и методы исследования», главы «Результаты собственных исследований», обсуждения, выводов и списка литературы, включающего 116 отечественных и 91 зарубежных источников. Диссертация иллюстрирована 2 таблицами и 19 рисунками.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
В качестве экспериментальных животных были выбраны белые лабораторные беспородные мыши и мыши линии CBA – Luc, которые содержались в стандартных условиях вивария. Все эксперименты проведены в острых опытах с соблюдением правил работы на животных согласно основным отечественным и международным нормативным документам (Приказ №755 от 12.08.1977 МЗ СССР «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных», Правила проведения качественных клинических испытаний в РФ (1998), положения Хельсинкской декларации 2000 г.).
Определение скорости лимфатического дренажа. В исследование были включены белые беспородные лабораторные мыши массой 20-25 г. Изучали влияние лекарственных препаратов ГЛРД, ГЛРД+Аз и ГепН на скорость лимфатического дренажа в брыжейке мышей. Дозу всех изученных препаратов рассчитывали исходя из разовой дозы, рекомендуемой для человека, применяя межвидовой коэффициент пересчета для мышей.
Проведено 3 серии экспериментов на 51 животных. Во время эксперимента мыши находились под нембуталовым наркозом (5 мг/100 г массы внутримышечно). За 15 мин. до начала определения скорости лимфатического дренажа животным основных групп в заднюю лапу вводили один из изучаемых лекарственных препаратов, а животным контрольных групп – 0,3 мл физиологического раствора. В течение эксперимента животное находилось на специальном подогреваемом столике, а ткани брыжейки орошались теплым (37С) физиологическим раствором.
Скорость лимфатического дренажа тканей определяли по времени (мин.), за которое происходило полное удаление из ткани брыжейки предварительно введенного в нее лимфотропного маркера – 0,002 мл 2% раствора красителя Evans blau («Merck»), который инъецировали с помощью прецизионного шприца на расстоянии 2-3 мм от места прокола в толщу корневого участка брыжейки. После введения красителя появлялась хорошо визуализируемая метка в виде синего пятна с четкими границами. В дальнейшем визуально производили оценку динамики рассасывания пятна краски из брыжеечной ткани и фиксировали время его полного исчезновения.
Оценка накопления доксициклина (ДЦ) в лимфоцитах лимфатических узлов мышей. В опыт включались мыши линии СВА (самцы массой 30 г). Животным вводили подкожно в верхнюю треть наружной поверхности задней лапы препарат-проводник в объеме 0,15 мл. Контрольным животным вводится равный объем ФСБ. Через 60–90 сек. через ту же иглу вводили ДЦ в дозе 0,25 мг. Еще через 30 мин. животное выводили из эксперимента, выделяли и гомогенизировали лимфоузлы, клеточную взвесь фильтровали через капроновый фильтр и дважды отмывали ФСБ. Все процедуры проводили при 4С. Осадок клеток ресуспензировали в ФСБ до концентрации 106 в 1 мл, отбирали аликвоту объемом 100 мкл и быстро смешивали с 900 мкл охлажденного до –20С этанола. Инкубировали 60 мин. Клетки осаждали центрифугированием, добавляли 0,5 мл ФСБ и проводили анализ с помощью метода проточной цитофлуориметрии при длине волны 488 нм.
Определение концентрации цефотаксима (ЦФ) в плазме крови мышей, тканях печени и стенке кишечника. Исследование проведено на 72 мышах, которые были подразделены на восемь подгрупп. В двух подгруппах животным под кожу задней лапы вводили ЦФ в дозе 3 мг. Мышам остальных шести подгрупп такую же дозу антибиотика вводили через 3 мин. после предварительной инъекции ГЛРД, ГЛРД+Аз, ГепН. Животных первых четырех подгрупп выводили из эксперимента путем декапитации через 1,5 ч, следующих четырех подгрупп – через 24 ч после введения препаратов, предварительно наркотизировав. Кровь собирали в пробирку с гепарином натрия. Органы извлекали непосредственно после выведения животных из эксперимента.
После подготовки проб плазмы крови и тканей органов проводили хроматографическое определение концентрации ЦФ на жидкостном хроматографе «Agilent 1100 Series» с ультрафиолетовым детектором (длина волны 264 нм) на колонке «Zorbax Eclipse XBD-C8» c использованием подвижной фазы состава: 500 mM уксуснокислый натрий (CH3COONa) – 900 мл, ацетонитрил – 100 мл, рН 3,75. Скорость подвижной фазы составляла 1,0 мл/мин. Концентрации в пробе определялись по площади пика на основании калибровочной кривой. В качестве стандарта использовался образец коммерческого цефотаксима в виде натриевой соли производства ООО «Деко». Все используемые реактивы соответствовали классу чистоты не ниже ХЧ (химически чистых).
Оценка выживаемости мышей с моделированным гнойно-воспалительным процессом органов брюшной полости при совместном применении ЦФ с препаратами-проводниками (ГЛРД, ГЛРД+Аз и ГепН). Исследование проводилось на 150 половозрелых мышах линии CBA – Luc, самцах, массой 28–30 г.
Гнойно-воспалительный процесс органов брюшной полости моделировался путем внутрибрюшинного введения микробной взвеси Staphylococcus aureus N: 25923 (J49) ATCC (NSDA, США), 1 единица оптической плотности которого соответствовала 8,5·108 мт/мл. Перед проведением эксперимента была определена LD100, вызывающая гибель мышей на 5–7 сутки, равная 109 мт/мл. Животным вводилась семичасовая культура микроорганизмов, находящихся в логарифмической фазе роста. Для определения фазы и скорости роста штамма S. aureus лиофилизированный стафилококк массой 30 мг помещали в стерильный бульон («Brain Heart Infusion» для культуральных работ, Panreac) объемом 50 мл и культивировали при 37С. Затем через каждые два часа производили измерение оптической плотности раствора с использованием фотоэлектрического колориметра КФК-2МП при длине волны 540 нм. Количество микробных тел в бактериальной суспензии определяли с помощью стандартов мутности по McFarland. Далее выполняли двукратное центрифугирование при 3000 об/мин. в течение 10 мин. в растворе Хэнкса. После этого надосадочную жидкость удаляли из пробирки пастеровской пипеткой. К осадку добавляли 4 мл раствора Хэнкса, ресуспензировали и измеряли оптическую плотность раствора. Производили подсчет общего количества микробных тел с учетом оптической плотности и путем многократного разведения приготавливали раствор объемом 1 мл, содержащий 109 мт, который внутрибрюшинно вводили экспериментальным животным.
Для оценки выживаемости из взятых в эксперимент мышей было сформировано 5 групп – по 30 животных в каждой. Всем животным внутрибрюшинно вводилось 109 мт/мл (LD100) микробной взвеси S. aureus и в течение 7 дней оценивалась их продолжительность жизни без лечения и на фоне проводимой терапии. Первая группа – контрольная, не получала лечения. Животным из второй группы через 60 мин. после введения микробной взвеси, в верхнюю треть бедра подкожно инъецировали 0,3 мл 0,9% раствора хлорида натрия, а спустя 3 мин. через ту же иглу ЦФ объемом 0,3 мл в дозе 5,9 мг. Мышам из третьей – пятой групп через 1 ч после введения микробной взвеси в качестве препарата-проводника в верхнюю треть бедра подкожно инъецировали соответственно по 0,3 мл раствора ГЛРД, ГЛРД+Аз, ГепН и через ту же иглу спустя 3 мин. вводили 0,3 мл ЦФ. Дозу всех изучаемых препаратов рассчитывали исходя из разовой дозы, рекомендуемой для человека, используя межвидовой коэффициент пересчета. В качестве растворителя для исследуемых препаратов использовали 0,9% раствор хлорида натрия.
Статистическая обработка результатов
Результаты экспериментальных исследований обработаны статистически с применением критерия Стьюдента для малых выборок. Результаты считали достоверными при уровне вероятности p<0,05.
Для анализа выживаемости экспериментальных животных использовали метод множительных оценок Kaplan – Meier и одновариантный анализ с использованием log-rank теста для выявления существенных различий между сравниваемыми группами мышей.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ ИССЛЕДОВАНИЙ
1. Влияние ГЛРД, ГЛРД+Аз и ГепН на скорость удаления лимфотропного красителя из брыжейки мышей (рис.1).
Время удаления лимфотропного красителя из брыжейки мышей в контрольной группе составило 43,3±0,5 мин., тогда как после введения ГЛРД оно равнялось 29,9±0,7 мин. (p<0,001), ГЛРД+Аз – 32,3±1,4 мин. (p<0,001) и ГепН – 28,5±0,6 мин. (p<0,001).
Таким образом, все исследуемые препараты вызывали уменьшение времени исчезновения лимфотропного красителя синий Эванса из брыжейки мышей (в среднем на 29,8%), что может свидетельствовать об их лимфостимулирующем действии.
Рисунок 1. Влияние ГЛРД, ГЛРД+Аз и ГепН на скорость удаления лимфотропного красителя из брыжейки животного
 Примечание: *p<0,001.
Примечание: *p<0,001.
2. Накопление лекарственных препаратов в лимфоцитах лимфатических узлов мышей на фоне применения препаратов-проводников.
Само по себе лимфостимулирующее действие, оказываемое препаратами-проводниками, не всегда свидетельствует об их способности усиливать проникновение лекарственных средств вообще, и антибиотиков в частности, в лимфатическую систему. В связи с этим был разработан метод визуализации накопления лекарственных препаратов в клетках лимфатической системы, позволяющий регистрировать действие изучаемых препаратов-проводников на поступление лекарственных препаратов в лимфатическую систему.
В качестве исследуемого препарата был выбран доксициклин (ДЦ), что связано с его способностью проникать в лимфоциты и флуоресцировать в диапазоне длин волн регистрируемых с помощью проточной цитофлуориметрии.
Накопление ДЦ в лимфоцитах близлежащего к месту введения пахового лимфатического узла оценивалось по протоколу разработанного метода после предварительного введения препаратов-проводников: ГЛРД, ГЛРД+Аз, ГепН (рис. 2).
Рисунок 2. Схема метода

Использование всех трех исследуемых препаратов приводит к увеличению накопления антибиотика в лимфоузлах по сравнению с моновведением ДЦ (28,78±2,9% флуоресцирующих клеток) (рис. 3). Максимальный процент окрашенных клеток наблюдался при введении ДЦ на фоне ГЛРД+Аз и был на 40% выше, чем в случае введения моновведения ДЦ.
Рисунок 3. Накопление доксициклина в лимфоцитах паховых лимфоузлов мышей при различных способах его введения
 Примечание: *p<0,05.
Примечание: *p<0,05.
3. Влияние предварительного введения ГЛРД, ГЛРД+Аз и ГепН на концентрацию антибиотика ЦФ в плазме крови.
Анализ результатов исследования средней концентрация ЦФ в плазме крови через 1,5 ч показал, что при его моновведении она составила 0,126±0,021 мкг/мл. Предварительное введение ГЛРД, ГЛРД+Аз и ГепН увеличение до 0,334±0,042 мкг/мл (р<0,01), 0,206±0,025 мкг/мл (р<0,05) и 0,294± 0,033 мкг/мл (р<0,01) соответственно (рис. 4).
Рисунок 4. Концентрации ЦФ в плазме крови мышей при различных способах его введения через 1,5 ч

Примечание: *p<0,05; **p<0,01.
Через 24 ч концентрация ЦФ в крови при моновведении снизилась на 82% по сравнению с таковой определенной через 1,5 ч, составив 0,016± 0,004 мкг/мл.
На фоне предварительного введения препаратов-проводников во всех трех случаях концентрация антибиотика также снижалась к концу первых суток, однако была достоверно выше, чем при моновведении ЦФ. Так в случае предварительного использования ГепН концентрация ЦФ составила 0,034±0,006 мкг/мл, (р<0,05), ГЛРД – 0,068±0,013 мкг/мл, (р<0,01), а ГЛРД+Аз – 0,111±0,011 мкг/мл (р<0,01), что почти в 7 раз выше, чем при использовании только одного ЦФ (рис. 5).
Рисунок 5. Концентрации ЦФ в крови мышей при различных способах его введения через 24 ч

Примечание: *p<0,05; **p<0,01.
Таким образом, через 1,5 ч у животных опытных групп регистрировалась более высокая плазменная концентрация ЦФ, чем у мышей контрольной группы. Наибольший уровень антибиотика в крови отмечался при его введении на фоне введения ГЛРД.
При использовании всех трех препаратов-проводников снижение концентрации ЦФ в плазме крови в сравнении с таковым после его моновведения было достоверно меньшим, что обеспечивало поддержание более высокого уровня антибиотика в кровотоке на протяжении суток. Наибольшая концентрация антибиотика ЦФ к 24 ч отмечалась в случае его использования с ГЛРД+Аз.
4. Влияние предварительного введения ГЛРД, ГЛРД+Аз и ГепН на концентрацию антибиотика ЦФ в печени.
Анализ результатов исследования уровня ЦФ в ткани печени через 1,5 ч показал, что при моновведении его средняя концентрация составила 0,275±0,021 мкг/г (в 2 раза выше, чем в плазме крови).
При предварительном введении ГЛРД, ГЛРД+Аз и ГепН концентрации антибиотика в печени составили соответственно 0,263±0,038, 0,255±0,043 и 264±0,045 мкг/г и достоверно не отличались от уровня ЦФ, применявшегося без предварительного введения проводника (рис.6).
Через 24 ч концентрации ЦФ в ткани печени после предварительного введения ГЛРД, ГЛРД+Аз и ГепН уменьшились и статистически не отличались от уровня антибиотика в случае его моновведения (0,033±0,009 мкг/г) и составили соответственно 0,040±0,011, 0,044±0,008 мкг/г и 0,036±0,007 мкг/г (рис. 7).
Рисунок 6. Концентрации ЦФ в печени мышей при различных способах его введения через 1,5 ч

Таким образом, определение уровня ЦФ в ткани печени через 1,5 ч не выявило статистически значимых различий в концентрациях антибиотика как в условиях его моновведения, так и в случае использования с любым из трех исследуемых препаратов-проводников. При этом концентрация ЦФ в печеночной ткани в случае моновведения и при использовании ГЛРД+Аз была в 2 и 1,2 раза (соответственно) выше, чем в плазме крови. Напротив, при введении ЦФ с ГЛРД или ГепН концентрации в печени были ниже по сравнению с таковыми в плазме крови.
Через 24 ч достоверных отличий между концентрациями в печеночной ткани ЦФ, как при моновведении, так и на фоне препаратов-проводников, не отмечается (рис. 7). В тоже время обращает на себя внимание тот факт, что концентрация ЦФ при моновведении в плазме крови на протяжении суток прогрессивно снижалась, при этом через 24 ч в печени она была в 2 раза выше, чем в тот же момент в плазме крови.
Рисунок 7. Концентрации ЦФ в печени мышей при различных способах его введения через 24 ч

При использовании в качестве препарата-проводника ГЛРД уровень ЦФ определенный в плазме крови был в 1,7 раза выше по сравнению с таковым в печени (как и в случае исследования концентраций антибиотика через 1,5 ч), а при применении ЦФ после введения ГепН его концентрация в печеночной ткани и плазме крови выравнивалась.
Если препаратом-проводником была ГЛРД+Аз, то концентрация ЦФ, определенная через 1,5 ч была выше в печени по сравнению с плазмой крови, тогда как к 24 ч (см. рис. 5, 7) происходила инверсия соотношения «печень – кровь» и уровень антибиотика становился в 2,5 раза выше в крови по сравнению с таковым в печени.
Таким образом, на основании сравнения концентрации ЦФ в печени и крови через 1,5 и 24 ч при различных способах его введения можно сделать вывод о зависимости фармакокинетики ЦФ от используемого препарата-проводника. Несмотря на различие во временной динамике общей тенденцией в действии всех трех исследуемых препаратов-проводников является создание более низкого по сравнению с плазмой крови уровня ЦФ в печени. Тогда как в случае моновведения антибиотика, его печеночная концентрация оказалась выше плазменной.
5. Влияние введения ЦФ и его совместного введения с ГЛРД, ГЛРД+Аз и ГепН на выживаемость мышей с моделированным гнойно-воспалительным процессом органов брюшной полости.
Результаты предыдущих исследований показали, что препараты-проводники (ГЛРД, ГЛРД+Аз и ГепН) увеличивают концентрацию ЦФ в плазме крови и пролонгируют время его циркуляции. Однако оставалось неясным, как изменение фармакокинетических параметров сказывается на фармакологической эффективности антибиотика. Для решения этого вопроса была использована модель гнойно-воспалительного процесса органов брюшной полости. Мышам линии CBA Luc внутрибрюшинно вводили 109 мт/мл (LD100) S. aureus и в течение 7 дней оценивали продолжительность жизни животных без лечения и на фоне проводимой терапии.
На рисунке 8 изображены кривые Kaplan – Meier, демонстрирующие динамику выживаемости животных в контрольной и экспериментальных группах. Как видно из представленных графиков, в контрольной группе к 7-му дню наблюдения все мыши погибли. Напротив, во всех экспериментальных группах часть животных выжила.
Статистическая обработка результатов показала, что процентное распределение выживших мышей, получавших лечение ЦФ, составило 39% (95% ДИ 1,119–2,214; p=0,0007). При использовании антибиотика на фоне препаратов-проводников ГЛРД и ГЛРД+Аз выживаемость животных достоверно увеличивается. Так в течение 7 дней наблюдения выживало 75% и 72% мышей, получавших ГЛРД+ЦФ (95% ДИ 0,12–0,64; p=0,0029) и ГЛРД+Аз + ЦФ (95% ДИ 0,17–0,9; p=0,0266) соответственно. При использовании в качестве препарата-проводника ГепН выживаемость составила 43% и статистически не отличалась от таковой при использовании одного ЦФ.
Рисунок 8. Выживаемость инфицированных животных при моновведении ЦФ (A) и в комбинации с ГЛРД (B), ГЛРД+Аз (C) и ГепН (D)
 |  |
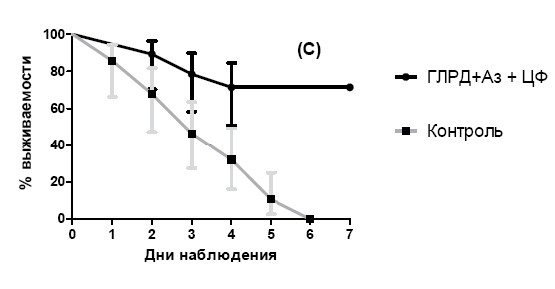 |  |
Таким образом, однократное введение антибиотика ЦФ как в виде монотерапии, так и на фоне введения препаратов-проводников обеспечивает выживаемость части мышей с моделированным гнойно-воспалительным процессом органов брюшной полости, по сравнению с контрольной группой, где погибает 100% животных. Причем лучшие результаты достигаются в группах с предварительным введением ГЛРД или ГЛРД+Аз, где выживаемость составляет более 70%.
6. Влияние предварительного введения ГЛРД, ГЛРД+Аз и ГепН на концентрацию антибиотика ЦФ в стенке кишечника.
Полученные результаты, показавшие увеличение выживаемости животных с моделированным гнойно-воспалительным процессом органов брюшной полости при использовании ЦФ на фоне применения препаратов-проводников, побудили к определению концентрации антибиотика в очаге поражения – тканях стенки кишечника.
Анализ результатов исследования концентрации ЦФ в ткани стенки кишки через 1,5 ч показал, что при моновведении его средний уровень составил 0,412±0,072 мкг/г.
Предварительное введение ГЛРД, ГЛРД+Аз и ГепН приводило к статистически значимому увеличению концентраций антибиотика в стенке кишки, по сравнению с уровнем ЦФ в той же ткани, определявшемся при использовании режима монотерапии: соответственно 1,5±0,109 (p<0,01), 0,615±0,071 (p<0,05) и 0,841±0,077 мкг/г (p<0,01) (рис. 9).
Рисунок 9. Концентрации ЦФ в стенке кишечника мышей через 1,5 ч при различных способах его введения
 Примечание: *p<0,05; **p<0,01.
Примечание: *p<0,05; **p<0,01.
Через 24 ч (рис. 10) концентрации ЦФ в стенке кишечника после предварительного применения всех трех препаратов-проводников – ГЛРД, ГЛРД+Аз и ГепН – были достоверно выше, чем при введении только одного антибиотика (0,154±0,03 мкг/г) и составили соответственно 0,472±0,084 мкг/г (p<0,01), 0,354±0,074 мкг/г (p<0,01) и 0,351±0,079 мкг/г (p<0,01).
Таким образом, определение уровня ЦФ в стенке кишечника через 1,5 ч выявило статистически значимые различия в концентрациях антибиотика, создаваемых при его моновведении и в случае использования ГЛРД, ГЛРД+Аз и ГепН в качестве препаратов-проводников.
Рисунок 10. Концентрации цефотаксима в ткани стенки кишечника мышей через 24 ч при различных способах его введения
 Примечание: **p<0,01.
Примечание: **p<0,01.
При этом концентрации ЦФ в стенке кишечника при любом из изучаемых способов введения антибиотика в разы превышала плазменные, например, при использовании в качестве препарата-проводника ГЛРД концентрация ЦФ была почти в 5 раз выше, чем в плазме крови.
Через 24 ч в стенке кишечника наблюдается уменьшение концентрации ЦФ вне зависимости от способов его введения, однако различия между концентрациями ЦФ, получаемыми с помощью моновведения антибиотика и его применением на фоне предварительного введения ГЛРД, ГЛРД+Аз и ГепН сохраняются: они достоверно выше в случае использования препаратов-проводников. При этом уровень ЦФ в тканях стенки кишки превышает плазменный, особенно при применении предварительного введения ГЛРД и ГЛРД+Аз, по сравнению с концентрациями ЦФ, определенными через 1,5 ч.
Таким образом, при сравнении концентрации ЦФ в стенке кишечника и плазме крови через 1,5 и 24 ч при различных способах его введения прослеживается зависимость фармакокинетики ЦФ от используемого препарата-проводника. Заметное уменьшение концентрации ЦФ в плазме крови через 24 ч при моновведении, ее увеличение при предварительном применении ГЛРД или ГЛРД+Аз, а также минимальное изменение при использовании ГепН коррелируют с уровнем ЦФ, определяемым в стенке кишечника.
ВЫВОДЫ
- Установлено, что все используемые в исследовании препараты-проводники (гиалуронидаза, гиалуронидаза+азоксимер, гепарин натрия) обладают сравнимым лимфостимулирующим действием, которое выражается в увеличении скорости лимфатического дренажа.
- Разработан метод визуализации накопления лекарственных препаратов в клетках лимфатической системы. С его помощью показано, что предварительное введение всех трех изученных препаратов-проводников увеличивает накопление модельного антибиотика доксициклина в лимфатической системе.
- При использовании цефотаксима в комбинации с препаратами-проводниками в плазме крови определяются более высокие концентрации антибиотика, которые снижаются более медленно в течение 24 ч, по сравнению с аналогичным показателем при моновведении цефотаксима. Общей тенденцией в действии препаратов-проводников является создание более низкого по сравнению с плазмой крови уровня ЦФ в печени. Тогда как в случае моновведения антибиотика, его печеночная концентрация регистрируется выше плазменной.
- Введение цефотаксима в комбинации с гиалуронидазой, гиалуронидазой+азоксимером увеличивает более чем на 70% выживаемость экспериментальных животных с моделированным гнойно-воспалительным процессом органов брюшной полости, по сравнению с моновведением антибиотика, что может быть объяснено более высокой концентрацией цефотаксима в тканях стенки кишечника.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
При выборе способа введения антибактериальных средств у пациентов с гнойно-воспалительными процессами органов брюшной полости необходимо учитывать имеющиеся сведения о преимуществах метода непрямого лимфотропного применения антибиотиков.
Для изучения в экспериментальных условиях влияния препаратов-проводников на поступление лекарственных веществ в лимфатическую систему целесообразно использовать метод визуализации накопления лекарственных препаратов в клетках лимфатической системы.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
| 1. | Кукушкин Г.В., Козлов И.Г., Юров Д.Е., Свиридкина Л.П., Топорова С.Г. Влияние курса трансторакального электрофореза террилитина на показатели липидного обмена у больных с ИБС и ХОБЛ. // Материалы III Междунар. конгр. «Эндоэкологическая Медицина». – Республика Кипр, 2007. – С. 73. |
| 2. | Свиридкина Л.П., Кукушкин Г.В., Юров Д.Е., Топорова С.Г., Баркинхоева Ф.А., Козлов И.Г. Влияние лимфостимулирующего препарата террилитина на показатели иммунного статуса. // Российский иммунологический журнал. – 2008. – Т. 2 (11) № 2–3. – С. 197–198. |
| 3. | Свиридкина Л.П., Бархинхоева Ф.А., Юров Д.Е., Кукушкин Г.В., Топорова С.Г., Козлов И.Г. Оптимизация фармакокинетики лекарственных средств путем использования эндолимфатических препаратов-проводников. // Вестник уральской медицинской академической науки. – 2008. – №1 (19). – С. 67–69. |
| 4. | Попова С.А., Свиридкина Л.П., Топорова С.Г., Кукушкин Г.В., Юров Д.Е. Нарушения дренажной функции лимфатической системы при экзогенной интоксикации у мышей разного возраста и их коррекция антиоксидантами. // Альманах «Геронтология и гериатрия». – 2009. – Выпуск 8. – С. 66–71. |
| 5. | Юров Д.Е., Кукушкин Г.В., Баркинхоева Ф.А., Свиридкина Л.П., Шкопоров А.Н., Козлов И.Г. Повышение эффективности антибактериальной терапии при экспериментальном перитоните. – Материалы XVI российского национального конгресса «Человек и лекарство». – 2009. – С. 779. |
| 6. | Топорова С.Г., Свиридкина Л.П., Баркинхоева Ф.А., Кукушкин Г.В., Юров Д.Е. Влияние лидазы на фармакокинетику цефотаксима. – Материалы XVI российского национального конгресса «Человек и лекарство». – 2009. – С. 750. |
| 7. | Баркинхоева Ф.А., Свиридкина Л.П., Топорова С.Г., Кукушкин Г.В., Юров Д.Е. Влияние ряда лекарственных препаратов с различным действием на лимфатический дренаж и фармакокинетику цефотаксима. // Научно-практический журнал «Лимфология», г. Андижан. – 2009. – № 1–2 – С. 24–25. (Материалы Выездной научной сессии, посвященной 80- летию основоположника клинической лимфологии Узбекистана, профессора С.У. Джумабаева). |
| 8. | Юров Д.Е., Кукушкин Г.В., Павлова С.И., Свиридкина Л.П., Козлов И.Г. Новый метод для оценки эффективности препаратов – эндолимфатических проводников. // Вестник уральской медицинской академической науки. – 2009. – № 2/1 (24). – С. 237–238. |
СПИСОК СОРАЩЕНИЙ
| ГепН | – гепарин натрия |
| ГЛРД | – гиалуронидаза |
| ГЛРД+Аз | – гиалуронидаза+азоксимер |
| ДИ | – доверительный интервал |
| ДЦ | – доксициклин |
| ЕД | – единица действия |
| МЕ | – международная единица |
| мт | – микробное тело |
| УЕ | – условная единица |
| ФСБ | – фосфатно-солевой буфер |
| ЦФ | – цефотаксим |
| LD100 | – доза смертельная абсолютная |

