Роль метаболических нарушений в развитии тоннельных невропатий верхней конечности у больных сахарным диабетом (
На правах рукописи
АФОНИНА
Жанна Алексеевна
Роль метаболических нарушений в развитии тоннельных невропатий
верхней конечности у больных сахарным диабетом
(14.00.13 – нервные болезни, 14.00.03 – эндокринология)
АВТОРЕФЕРАТ
диссертация на соискание ученой степени
кандидата медицинских наук
Москва 2009
Работа выполнена в ГОУ ДПО Российская Медицинская Академия
Последипломного Образования
Научные руководители:
кандидат медицинских наук, доцент Игорь Алексеевич Строков
доктор медицинских наук, профессор Александр Сергеевич Аметов
Официальные оппоненты:
доктор медицинских наук, профессор Сергей Сергеевич Никитин
доктор медицинских наук, профессор Ирина Владимировна Гурьева
Ведущая организация: Московский Областной Научно-
Исследовательский Клинический Институт
им. М.Ф. Владимирского
Защита состоится «___»______________________________2009 года в _____ часов на заседании Диссертационного Совета Д.208.040.07 при Московской Медицинской Академии им. И.М. Сеченова (119992, Москва, ул. Трубецкая д. 8, стр.2)
С диссертацией можно ознакомиться в библиотеке Московской Медицинской Академии им. И.М. Сеченова (117998 Москва, Нахимовский проспект, д.49)
Автореферат разослан «___»____________________________2009 года.
Ученый секретарь
Диссертационного Совета
доктор медицинских наук,
профессор Игорь Владимирович Дамулин
]
ВВЕДЕНИЕ
Актуальность проблемы. Одним из самых распространенных осложнений сахарного диабета (СД) является дистальная симметричная сенсорно-моторная диабетическая полиневропатия (ДПН). Клинически ДПН проявляется спонтанными сенсорными феноменами и неврологическим дефицитом в дистальных отделах преимущественно ног. Вместе с тем у ряда больных СД жалобы на болевые ощущения и двигательные нарушения в руках являются ведущими, ограничивающими их бытовую и профессиональную деятельность. В исследованиях P.J.Dyck [1999], отмечено, что в популяции пациентов с СД и ДПН билатеральные сенсорные симптомы в руках часто вызваны тоннельными невропатиями (ТН). Наиболее частыми ТН рук у больных СД являются карпальная тоннельная невропатия (КТН) и кубитальная тоннельная невропатия (КБТН).
Данные о распространенности ТН рук у больных СД противоречивы. Некоторые авторы считают, что они встречаются у 1-2 % больных СД, в то время, как другие приводят цифры в 30-40 % [J.W. Albers et al., 1996, P.J. Dyck, 1999]. В отечественной литературе к настоящему времени имеются единичные публикации о сенсорном синдроме в руках у пациентов с СД, и практически нет исследований ТН рук в популяции больных СД 1 и 2 типов. Трудности диагностики ТН у пациентов с СД обусловлены возможностью сочетания ДПН и локального поражения нервов, и в этом случае сенсорную симптоматику связывают прежде всего с ДПН. Отсутствие лечебного воздействия на локальную компрессию периферических нервов значительно снижает качество жизни больных. В зарубежной литературе описано несколько алгоритмов дифференциальной электромиографической (ЭМГ) диагностики ДПН и ТН, однако в случае выраженных электрофизиологических нарушений, при ДПН, не всегда можно подтвердить наличие ТН [D.C. Preston, B.E. Shapiro, 1998, E.E. Ubogu, M. Benatar, 2006]. Основная дискуссия в литературе развернулась по вопросу о возможностях ЭМГ диагностики ТН рук при наличии или отсутствии полиневропатии.
Таким образом, проблема диагностики ТН в популяции больных СД изучена недостаточно. Слабо освещены вопросы ранней диагностики ТН и дифференциальной ЭМГ диагностики ТН при наличии у больных ДПН. Мало исследований факторов, влияющих на развитие и выраженность ТН у больных СД, требуются исследования по изучению эффективности различных консервативных лечебных мероприятий. Одним из возможных направлений лечения может стать использование патогенетической терапии, например антиоксидантов.
Цель исследования: изучить клинические и нейрофизиологические особенности тоннельных невропатий верхних конечностей у пациентов сахарным диабетом и оценить эффективность различных методов их терапии.
Задачи исследования:
- Изучить клинические особенности болевого синдрома верхних конечностей у пациентов с СД 1 и 2 типов.
- Определить распространенность тоннельных невропатий верхних конечностей у больных СД 1 и 2 типов.
- Изучить зависимость характера и выраженности болевого синдрома, позитивной и негативной симптоматики при тоннельных невропатиях от выраженности и длительности нарушений углеводного обмена.
- Разработать алгоритм дифференциальной ЭМГ диагностики полиневропатии и ТН в руках у больных сахарным диабетом.
- Оценить эффективность различных консервативных методов терапии при тоннельных невропатиях у больных сахарным диабетом 1 и 2 типов.
Научная новизна:
- Впервые проведено исследование причин развития и особенностей болевого синдрома верхних конечностей у больных Российской популяции с СД 1 и 2 типов;
- Впервые выявлена распространенность отдельных форм ТН верхних конечностей у больных Российской популяции с СД 1 и 2 типов;
- Впервые показано, что функциональное состояние нервов играет ведущую роль в формировании тоннельных невропатий у больных СД;
- Впервые показана эффективность различных методов консервативной терапии при тоннельных невропатиях рук у больных СД.
Основные положения выносимые на защиту:
- Болевой синдром и сенсорная симптоматика в руках у больных СД обусловлены преимущественно ТН (карпальной, кубитальной, пронаторной, канала Гийона) и их сочетанием с артропатиями.
- Факторами риска развития ТН в руках являются наличие и длительность СД, а также наличие диабетической полиневропатии.
- Степень выраженности клинических проявлений и ЭМГ изменений при тоннельных невропатиях рук зависит от длительности сахарного диабета.
- Диагностика ТН рук у больных СД должна основываться на оценке спонтанных сенсорных феноменов, неврологического дефицита, результатах провокационных тестов и ЭМГ обследования.
- ЭМГ диагностика ТН рук у больных СД должна включать оценку амплитуды двигательного и сенсорного ответов, дистальной латенции, скорости проведения возбуждения, соотношения дистальных латенций срединного и локтевого нервов.
- Наиболее эффективно лечение ТН рук у больных СД внутривенным введением антиоксидантов (альфа-липоевая кислота), меньший эффект имеет локальное введение в область компрессии нерва коротко действующих кортикостероидных препаратов (дексаметазон).
Практическая значимость:
- Разработан алгоритм дифференциальной диагностики ТН и ДПН, включающий изучение ЭМГ показателей, а также оценку клинических сенсорных симптомов.
- Модифицирована классификация степеней поражения ТН у больных СД с учетом клинических и нейрофизиологических данных;
- Показана эффективность различных методов консервативной терапии тоннельных невропатий у больных СД.
Апробация. Диссертационная работа была апробирована и рекомендована к защите на заседании кафедры нервных болезней ГОУ ВПО Московской Медицинской Академии им. Сеченова.
Личный вклад соискателя. Автор является основным исполнителем исследования на всех этапах работы.
Публикации. По теме диссертации опубликовано 10 печатных работ, в том числе в изданиях, рекомендуемых ВАК.
Структура и объем диссертации. Диссертация изложена на 135 страницах машинописного текста и состоит из введения, обзора литературы, 3 глав, заключения, выводов, практических рекомендаций, списка литературы. Библиографический указатель включает 195 источников (62 отечественных и 132 зарубежных). Текст диссертации включает 14 таблиц и 17 диаграмм.
СОДЕРЖАНИЕ РАБОТЫ
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Характеристика пациентов. Обследовано 250 пациентов с СД (группа А), 172 женщины (68,8%) и 78 мужчин (31,2%), в возрасте от 18 до 75 лет; средний возраст – 54,6±11,6 лет (М± – здесь и далее). В состав группы вошли 68 человек (27,2%) с СД 1 типа и 182 человека (72,8%) с СД 2 типа. Длительность СД составила 12,2±8,1 лет, от 1 до 41 года. Уровень гликозилированного гемоглобина (HbA1c) – 8,1±1,7 % (4,8% –12%).
Группу В составили 106 человек с болевым синдромом в руках из пациентов группы А, которым проводились клиническое и ЭМГ обследование. В группу вошли 79 женщин (74,5%) и 27 мужчин (25,5%), в возрасте от 19 до 75 лет; средний возраст – 54,9±12,5 лет. Длительность СД составила 12,5±8,4 лет, от 1 до 41 года. Уровень HbA1c – 8,8±1,5 % (5,9% – 12%). Длительность клинических проявлений ТН 4,4±4,2 лет (0,5 – 20 лет). Пациентов с СД 1 типа – 28 (26,4%), с СД 2 типа – 78 (73,6%) больных.
Группа С из 88 пациентов с ТН отобрана из больных группы B. В группу вошло 69 женщин (78,4%) и 19 мужчин (21,6%), в возрасте от 19 до 73 лет; средний возраст – 53,8±11,8 лет. Длительность СД составила – 12,4±8,8 лет, от 1 до 41 года. Уровень HbA1c - 8,8±1,6 % (5,9%–12%). Длительность проявлений ТН – 4,4±3,7 лет, от полугода до 15 лет. В группу включено 23 пациента (26,1%) с СД 1 типа и 65 пациентов (73,9%) с СД 2 типа.
Для определения алгоритма диагностики ТН, сочетающихся с ДПН, было набрано 60 пациентов (группа D). В группу вошли 44 женщины (73,3%) и 16 мужчин (26,7%). Средний возраст в группе – 54,5±12,2 лет (23 – 72 года). Длительность СД – 11,2±7,1 лет (от года до 25 лет). Уровень HbA1c составил – 8,9±1,5 % (5,9 – 12%). С СД 1 типа – 12 пациентов (20%), с СД 2 типа – 48 пациентов (80%).
Таблица 1. Характеристика пациентов
| Группы | N | Возраст | Пол М/Ж | Тип СД I/II | Длительность СД | Уровень HbA1c |
| A | 250 | 54,6 ± 11,6 | 78/172 | 68/182 | 12,2 ± 8,1 | 8,1 ± 1,7 |
| B | 106 | 54,9 ± 12,5 | 27/79 | 28/78 | 12,5 ± 8,4 | 8,8 ± 1,5 |
| C | 88 | 53,8 ± 11,8 | 19/69 | 23/65 | 12,4 ± 8,8 | 8,8 ± 1,6 |
| D | 60 | 54,5 ± 12,5 | 16/44 | 12/48 | 11,2 ± 7,1 | 8,9 ± 1,5 |
| E | 100 | 55,6 ± 8,7 | 25/75 | – | – | – |
| F | 15 | 54,7 ± 4,8 | 4/11 | – | – | – |
Контрольная группа Е состояла из 100 пациентов с болевым синдромом в руках, не страдающих СД и заболеваниями, способными вызвать полиневропатию, и исследована для сравнительной оценки распространенности и выраженности ТН. В группу вошли 75 женщин (75%) и 25 мужчин (25%). Средний возраст составил 55,6±8,7 лет (44 – 68 лет).
Контрольная группа F для оценки ЭМГ показателей состояла из 15 здоровых испытуемых. Женщин в группе было 11 (73,3%), мужчин – 4 (26,7%) человека. Средний возраст составил 54,7±4,8 лет (46 – 63 года). Основная и группа F были сопоставимы по возрасту, полу и росту. Группы A, B, C и D были сопоставимы по возрасту, полу, росту и длительности СД.
Клиническое исследование. При исследовании локального статуса оценивали интенсивность и частоту в руках спонтанных сенсорных симптомов, болей, а также отмечали неловкость и слабость в кистях. У пациентов группы С оценивали распространенность, время возникновения и связь с возможными провоцирующими факторами позитивной невропатической симптоматики и ее выраженность по 3-х балльной системе: Из стимулозависимых болей оценивали кисточковую аллодинию, динамическую гипералгезию на укол иглой и статическую гипералгезию на тупое надавливание. При анализе тестов Тинеля и Фалена, тестов пальцевой компрессии и экстензии отмечали время возникновения парестезий.
Учитывая сложную структуру заболевания у ряда больных (двусторонний процесс, поражение двух нервов на одной руке или одного нерва на разных уровнях, наличие ДПН), оценка данных клинического обследования проводилась отдельно для каждой руки, а оценка ЭМГ данных – для каждого из пораженных нервов. При множественном поражении тяжесть нарушения определялась тем нервом, который страдал в большей степени. ТН у пациентов основной группы были подразделены на четыре степени тяжести:
- Жалобы на периодические боли или парестезии, возможны легкие нарушения чувствительности на пальцах рук. При ЭМГ – снижение скорости проведения возбуждения (СРВ) по сенсорным волокнам ниже тоннеля, возможно увеличение дистальной латенции и снижение амплитуды ПД.
- Жалобы на периодические или постоянные болевые ощущения в дистальных отделах рук, нарушения чувствительности в зоне иннервации пораженного нерва. ЭМГ: снижение СРВ по сенсорным волокнам, умеренное снижение СРВ по моторным волокнам локтевого нерва через область локтевого сгиба, небольшое увеличение резидуальной латенции моторных волокон срединного нерва, возможно легкое снижение амплитуд М-ответов.
- Наличие в неврологическом статусе стойких нарушений чувствительности, а также признаки гипотрофии мышц с легким или умеренным снижением мышечной силы. ЭМГ: снижение СРВ по двигательным волокнам и амплитуды М-ответа.
- Наличие в неврологическом статусе выраженной атрофии мышц со снижением мышечной силы. При ЭМГ обследовании – значительное снижение амплитуды М-ответа, вплоть до его отсутствия.
Всем пациентам, входящим в основную группу, проводилось биохимическое исследование крови с определением уровня гликированного гемоглобина, а также стандартное неврологическое обследование по общепринятой методике. На руках проводилась оценка изменения сухожильных рефлексов, мышечной силы, поверхностной чувствительности. Болевую чувствительность определяли с помощью укола тупой иглой, температурную чувствительность – инструментом «Тиотерм», тактильную чувствительность – с помощью 10 граммового монофиломента, вибрационную чувствительность – с помощью градуированного 128 Гц камертона. Суставно-мышечное чувство оценивали в терминальных фалангах пальцев рук. Для оценки рефлексов, мышечной силы и чувствительности использовали разработанные 4-х балльные шкалы.
Электрофизиологическое исследование. Исследование состояния периферических нервов проводили методом стимуляционной ЭМГ на приборе «Электронейромиограф – 01» фирмы «МБН» (Россия). Стимуляция проводилась по стандартной методике, при температуре конечности не менее 31С. Применяли стимулирующие импульсы прямоугольной формы, с частотой 1 имп/сек (для моторных нервов) и 3 имп/сек (для сенсорных нервов), длительностью 0,2 мс, при супрамаксимальной силе тока. Оценивали показатели моторных и сенсорных волокон срединного и локтевого нервов: дистальная латенция (ДЛ), резидуальная латенция (РЛ) моторных волокон, амплитуда М- и S-ответов и СРВ.
Исследование эффективности терапии ТН проведено в 3 группах пациентов, сопоставимых по полу, возрасту, росту, степени компенсации СД и выраженности клинических проявлений. В первой группе из 16 пациентов использован метод лечебных блокад с короткодействующим кортикостероидным препаратом (4 мг дексаметазона). Блокады проводились через два-три дня, 4 – 5 раз. У всех пациентов отмечалось незначительное повышение глюкозы в крови, которое регрессировало в течение 10–24 часов. Во второй группе из 16 пациентов применяли аппликации с димексидом. Пациенты в течение 14 дней накладывали марлевые компрессы со смесью димексида и 2% новокаина (1:1) в течение 40 – 60 минут на область тоннеля. Третьей группе из 18 пациентов проводилось внутривенное капельное введение 600 мг –липоевой кислоты в течение 10 дней. В каждой группе оценивали динамику субъективных ощущений, нарушений чувствительности, двигательной и рефлекторной сфер, а также изменений ЭМГ на фоне лечения.
Статистическая обработка. Для статистической обработки данных использована программа Statistica 7 SP2, продукт компании StatSoft, а также программа Биостатистика для Windows и DOS IBM-PC. Определяли средние величины М и среднее квадратичное отклонение. Для сравнения средних величин несвязанных совокупностей использовался критерий Стьюдента. Сравнение количественных переменных связанных совокупностей, подчиняющихся нормальному распределению, проводилось с использованием парного критерия Стьюдента, в случае, когда выборка не подчинялась нормальному распределению, применялся Т-критерий Вилкоксона. Для сравнения порядковых признаков и количественных величин, не подчиняющихся нормальному распределению, в двух не связанных совокупностях был применен тест Манна – Уитни. Для оценки эффективности разных методов терапии в отдельных группах использован непараметрический критерий Крускала-Уоллиса для множественных сравнений. В случае обнаружения различий между выборками применялся критерий Данна для установления этих различий. Для выявления связи в зависимости от типа переменных использовались: метод прямой корреляционной связи – коэффициент корреляции Пирсона (r); коэффициент ранговой корреляции Спирмена (R).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
Из 250 пациентов с СД неприятные сенсорные ощущения в руках (боль, жжение, парестезии, онемение, зуд) различной степени выраженности выявлены у 106 пациентов (42, 4%), причем у 6 человек (5,7%) жалобы в руках доминировали в клинической картине. У 22 пациентов (20,8%) сенсорный феномен в руках был обусловлен различными ТН (КТН, КБТН, пронаторной ТН, ТН канала Гийона); у 8 пациентов (7,6%) жалобы были обусловлены сенсорно-моторной ДПН; у 7 человек (6,6%) были выявлены только признаки артропатий; у 3 пациентов (2,8%) отмечались признаки корешкового синдрома, подтвержденного ЭМГ и МРТ исследованиями; у 31 пациента (29,3%) сенсорный феномен в руках был обусловлен сочетанием ТН и ДПН; у 25 человек (23,6%) выявлено сочетание ТН и артропатий; у 7 пациентов (6,6%) отмечалось сочетание ТН, ДПН и артропатий; у 3 пациентов (2,8 %) ТН сочетались с ДПН и шейной радикулопатией. Таким образом, из 106 человек с болями и двигательными нарушениями в дистальных отделах рук – 88 пациентов (83%) имели ТН верхних конечностей, причем у 41 пациента (38,7%) отмечалось сочетание ТН и ДПН.
Оценка распространенности ТН. Из 88 обследованных КТН выявлена у 57 человек (64,8%), в 44 наблюдениях (77,2 %) с двух сторон. КБТН установлена у 48 пациентов (54,6%), в 37 случаях (75,5%) с двух сторон. ТН канала Гийона диагностирована у 6 пациентов (6,8%) из них у 5 двусторонняя. Пронаторная ТН выявлена у 7 пациентов (8%), причем у 6 больных она была двусторонней. Сочетание КТН и КБТН наблюдалось у 24 пациентов (27,3%), КТН и пронаторной ТН - у 4 больных (4,6%), КБТН и канала Гийона – у 4 больных (4,6%), карпальной ТН и невропатии канала Гийона – у одного больного. Сочетание карпальной ТН, пронаторной ТН и ТН канала Гийона отмечено у двух пациентов (2,3 %). Из 88 больных двухсторонняя ТН отмечалась у 68 человек (77,3%), односторонняя ТН – у 20 пациентов (22,7 %). Отмечена достоверная разница распределения ТН между мужчинами и женщинами: КТН чаще встречалась у женщин, в то время как КБТН – у мужчин. Выявлено, что у больных СД ТН рук встречаются достоверно чаще (83%), чем в общей популяции (62%). Распространенность ТН рук составила 35,2 % (КТН – 22,8 %, КБТН – 19,2 %), что совпадает с данными литературы [P.J. Dyck, 1999].
Диаграмма 1. Распределение ТН по тяжести у пациентов основной и
контрольной групп
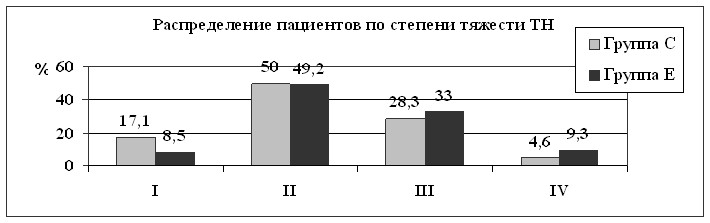 При сравнении поражения нервов в основной и контрольной группах выявлено, что КТН у больных с СД наблюдался реже (p<0,05), в то время как КБТН отмечалась чаще (p<0,05), чем в контрольной группе, что может свидетельствовать о более частом вовлечении у пациентов с СД в патологический процесс n. ulnaris на локте при его кратковременном сдавлении. Наблюдалось более частое тоннельное поражение нервов в начальной стадии (I степень) у больных с СД (17,8%), (диаграмма 1) по сравнению с контрольной группой (8,5%), что может указывать на большую уязвимость нервов и подверженность их изменениям при кратковременном сдавлении.
При сравнении поражения нервов в основной и контрольной группах выявлено, что КТН у больных с СД наблюдался реже (p<0,05), в то время как КБТН отмечалась чаще (p<0,05), чем в контрольной группе, что может свидетельствовать о более частом вовлечении у пациентов с СД в патологический процесс n. ulnaris на локте при его кратковременном сдавлении. Наблюдалось более частое тоннельное поражение нервов в начальной стадии (I степень) у больных с СД (17,8%), (диаграмма 1) по сравнению с контрольной группой (8,5%), что может указывать на большую уязвимость нервов и подверженность их изменениям при кратковременном сдавлении.
В структуру позитивной невропатической симптоматики пациентов с ТН вошли спонтанные болевые и не болевые сенсорные феномены (табл. 2). Двигательные нарушения в виде неловкости движений отмечены у 41 пациента (46,6 %), слабость у 16 пациентов (18,2 %). Оценка интенсивности жалоб осуществлялась отдельно для каждой пораженной руки. Оценка болевого синдрома проводилась в соответствии со шкалой диагностики невропатической боли ДН4 [D.Bouhassira et al., 2005]. Характеристика выраженности субъективных ощущений представлена на диаграммах 2 и 3.
Таблица 2. Позитивная невропатическая симптоматика пациентов с ТН.
| Сенсорные симптомы (чел/%) | Болевой синдром (чел/%) |
| Онемение – 77/87,5 | Ноющие боли – 32/36,4 |
| Покалывание – 60/68,1 | Жжение – 18/20,5 |
| Стреляющие, дергающие боли – 5/5,7 | |
| Тупые давящие боли в глубине тканей – 8/9,1 | |
| Болезненное ощущение холода – 11/12,5 |
Диаграмма 2. Характеристика интенсивности субъективных ощущений у 88 пациентов основной группы (n = 176)
(n) – количество рук
Диаграмма 3. Характеристика интенсивности болевого синдрома у 88 пациентов основной группы, (n = 176)
 (n) – количество рук
(n) – количество рук
Болевой синдром выявлен у 38 пациентов с ТН (43,1 %); боль невропатического характера отмечена у 9 пациентов с ТН верхних конечностей (23,7 %), боль ноцицептивного характера выявлена у 6 больных СД (15,8 %), сочетание невропатической и ноцицептивной боли отмечено у 23 пациентов (60,5 %). Было отмечено, что у пациентов с СД чаще возникает жжение и зуд и у ряда больных стреляющая и пульсирующая боль, что менее характерно для пациентов общей популяции, которые чаще характеризовали боль в руках как колющую и тупую.
Данные неврологического осмотра. По данным объективного неврологического обследования (таблица 3) чаще всего страдала вибрационная чувствительность, которая была снижена до 3 баллов в 9 случаях (4,0%), до 4 баллов – в 20 случаях (11,4%), до 5 баллов – в 43 случаях (24,4%), до 6 баллов – в 52 случаях (29,6%), до 7 баллов – в 30 случаях (16,0%), нормальная чувствительность отмечалась в 22 случаях (12,5%). Температурная гипестезия стояла на втором месте по распространенности – 110 случаев (62,5 %). Чуть реже встречалось нарушение болевой – 91 случай (51,7 %) и тактильной чувствительности – 76 случаев (43,2 %).
Таблица 3. Данные неврологического обследования
| Чувствительность, рефлексы | Норма(%) | Умеренное снижение (%) | Резкое снижение (%) | Отсутствует (%) |
| Тактильная | 56,8 | 39,2 | 4 | 0 |
| Температурная | 37,5 | 52,4 | 10,2 | 0 |
| Болевая | 48,3 | 44,3 | 7,4 | 0 |
| Суставно - мышечная | 97,2 | 2,8 | 0 | 0 |
| Карпорадиальный рефлекс | 29 | 46 | 20,5 | 4,6 |
| Рефлекс с бицепса | 73,9 | 21,6 | 3,4 | 1,14 |
| Рефлекс с трицепса | 78,4 | 18,75 | 2,8 | 0 |
Динамическая гипералгезия на укол иглой выявлялась в 12 случаях, статическая гипералгезия отмечалась в 4 случаях, и оценивалась как слабая боль. Нарушение суставно-мышечного чувства обнаружено у 3 пациентов (2,8%). Парез дистальных мышц рук отмечался в 39 руках (у 20 пациентов). В 27 случаях (14 пациентов) наблюдалась слабость отведения большого пальца при КТН и слабость отведения мизинца при КБТН; в 8 случаях (4 пациента) снижение мышечной силы затрагивало мышцы сгибающие пальцы; в 4 случаях (2 пациента) страдали мышцы сгибатели кисти. Степень снижения мышечной силы коррелировала с выраженностью гипотрофии мышц. Около трети больных жаловались на вегетативные нарушения в дистальных отделах рук (гипергидроз, изменение окраски кожи и др.).
При оценке зависимости интенсивности субъективных ощущений, нарушений чувствительной и рефлекторной сферы от типа СД, длительности заболевания, возраста и уровня гликемии были установлены следующие корреляции: обратная линейная связь между длительностью жалоб в руках и степенью сохранности вибрационной (R=–0,37; p<0,05) и температурной чувствительности (R=–0,31; p< 0,05). Обнаружена обратная зависимость между уровнем гликемии и степенью сохранности карпорадиальных рефлексов (R=–0,27; p<0,05). При сопоставлении интенсивности онемения и покалывания найдена положительная связь (R=0,41; p<0,05), что может указывать на единство патофизиологических механизмов возникновения этих феноменов. Установлена обратная линейная зависимость между интенсивностью онемения и степенью сохранности тактильной чувствительности (R=–0,31; p<0,05), а также обратная связь между частотой онемения и степенью сохранности тактильной чувствительности (R=–0,34; p< 0,05).
Анализ клинических данных показал, что характер и выраженность болевого синдрома не связаны с длительностью и типом СД, уровнем HbA1c, возрастом, полом и длительностью жалоб больных. При оценке зависимости выраженности ТН от тех же показателей, выявлена положительная связь между длительностью СД и степенью тяжести ТН (R=0,21; p<0,05), что согласуется с данными литературы [P.J. Dyck, P.K. Thomas, 1999]. Относительно отсутствия связи между уровнем HbA1c и выраженностью субъективных ощущений необходимо отметить, что показатель HbA1c показывает средний уровень гликемии за три месяца.
Проведен анализ возникновения ТН рук в разных возрастных группах. При этом возраст манифестации заболевания считался с момента появления у пациента характерных жалоб в руках. Показано, что ТН верхних конечностей наиболее часто возникают в возрастных группах от 41 до 50 лет (29,5 %) и от 51 до 60 лет (34,4 %), реже – после 60 лет (14,8 %), от 30 до 40 лет (13,1 %) и до 30 лет (8,2 %). Таким образом, ТН рук развились в период от 41 до 60 лет у 63,9 % больных СД.
Диагностические тесты были положительны в 96,3% случаев. Наиболее диагностически значимыми для КТН оказались тесты пальцевой компрессии – 85% и Тинеля – 77,5%, менее значимы – тест Фалена (57,5%) и экстензионный (48,75%). Для диагностики КБТН наиболее значимым оказался флексионный тест – 82,5 % и тест Тинеля – 78,4 %.
При ЭМГ обнаружено достоверное снижение ЭМГ показателей у пациентов с СД за исключением СРВ на плече по моторному срединному нерву и РЛ моторного локтевого нерва. Установлена обратная связь между величиной амплитуды М-ответа и выраженностью слабости в дистальных отделах рук (R=-0,38; p<0,05), что свидетельствует о прогрессировании слабости в руках на фоне снижения амплитуды М-ответа срединного нерва, характеризующей число сохранных нервных волокон. Обнаружена прямая связь между показателями РЛ и выраженностью слабости (R= 0,34; p<0,05), что свидетельствует о снижении мышечной силы в кистях на фоне увеличения РЛ, характеризующей СРВ в дистальных отделах нерва. РЛ срединного нерва коррелировала с выраженность онемения (R=0,33; p<0,05) и покалывания (R=0,34;p<0,05). Имелись обратные зависимости между интенсивностью жжения и СРВ на ладони (R=–0,31; p<0,05), а также между длительностью жалоб в руках и показателем СРВ на ладони по сенсорным волокнам срединного нерва (R=-0,47; p< 0,05).
Алгоритм дифференциальной диагностики ЭМГ и ТН.
Для дифференциации ТН и ДПН использованы ЭМГ алгоритмы, которые описали Johnson E.W. (1993) и Preston D.C., Shapiro B.E. (1998), а также собственные разработки. Выделено 4 группы пациентов в зависимости от наличия или отсутствия ДПН и ТН. У 19 пациентов (31,7 %) ЭМГ признаков ДПН в руках не было, но выявлялись ТН. Алгоритм ЭМГ диагностики ТН рук у этих больных был стандартным. При наличии ДПН без изменения М-ответов, ТН выявлялись в одном или двух нервах у 30 % больных (18 человек). В этом случае в алгоритм диагностики включали анализ срединно-локтевого соотношения: в группе пациентов без ДПН (20 человек) среднее срединно-локтевое соотношение ДЛ составило 1,31 ± 0,19 мс; в группе пациентов с ДПН (22 человека) соотношение ДЛ составило 1,44 ± 0,24 мс;в группе пациентов с сочетанием КТН и ДПН (41 человек) соотношение ДЛ составило 1,7 ± 0,29 мс. Наиболее увеличен средний показатель срединно-локтевого соотношения ДЛ у пациентов с сочетанием КТН и ДПН, что можно учитывать при ЭМГ диагностике ТН.
Диаграмма 4. РОС кривая срединно-локтевого соотношения ДЛ
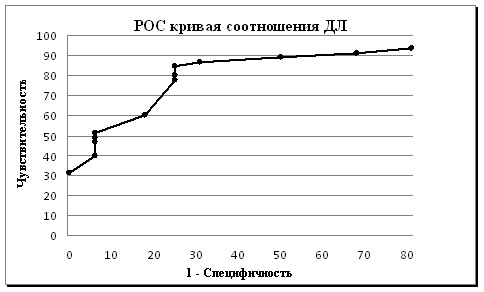
На графике (диаграмма 4) показано 13 значений срединно-локтевого соотношения ДЛ. Чем больше площадь под кривой, тем она более значима для диагностики. Наиболее высокое значение чувствительности (84,4 %) и специфичности (75 %) характерно для показателя соотношения ДЛ = 1,45 мс. Однако, оптимальное значение срединно-локтевого соотношения ДЛ можно выявить с помощью коэффициента отношения правдоподобия LR (LR= чувств./1-специфичн.), который является критерием полезности для диагностики сочетания КТН и ДПН. Наибольшее значение LR = 8,176 выявлено при соотношении ДЛ = 1,6 мс (чувст.= 51,1 %, специфичн. = 93,75 %). Показатель срединно-локтевого соотношения ДЛ выше 1,6 мс более чем в 8 раз вероятен у пациентов с сочетанием ТН и ДПН, чем у пациентов без их сочетания.
При ДПН нервов рук со снижением М-ответов и наличием ТН (23 больных – 38,4 %) в алгоритм диагностики можно включать исследование коротких сегментов нервов в области локальной компрессии. Таким образом, алгоритм диагностики ТН рук у больных СД и ДПН должен включать: 1.Клиническую оценку сенсорных симптомов при воздействии на зону предполагаемой компрессии; 2. ЭМГ оценку амплитуд М-ответов и ПД, ДЛ, СРВ нервов, изучение срединно-локтевого соотношения ДЛ.
Лечение ТН.
Оценку эффективности разных методов консервативной терапии ТН провели в трех группах пациентов, сопоставимых по возрасту, росту, полу, типу и длительности СД (табл. 4).
Таблица 4. Характеристика лечебных групп
| Группы | Всего чел./ рук | Средний Возраст | Пол М/Ж | Гликемический контроль (чел.) | КТС (чел./ рук) | Куб.ТС (чел./ рук) | ||
| удвл. | отн. удвл. | неудвл. | ||||||
| I | 16/29 | 53,1±11,7 (27 – 75) | 3/13 | 1 | 4 | 11 | 11/20 | 8/15 |
| II | 16/29 | 50,3±13,5 (19 – 64) | 2/14 | 2 | 4 | 10 | 12/22 | 9/17 |
| III | 18/36 | 48,8±14,6 (19 – 67) | 5/13 | 2 | 7 | 7 | 12/24 | 13/24 |
Эффективность лечения оценивали клинически и по ЭМГ до и после окончания курса терапии. Клинически результаты лечения были представлены: 1 – значительным улучшением, что сопровождалось купированием или существенным уменьшением субъективных ощущений; восстановлением чувствительности или сужением зоны чувствительных нарушений; уменьшением степени выраженности диагностических тестов; 2 – незначительным улучшением при уменьшении выраженности и частоты болевого синдрома без положительной динамики объективных показателей чувствительной и двигательной сфер; 3 – отсутствием эффекта; 4 – отрицательной динамикой. Разработана 4-х балльная шкала оценки динамики субъективных ощущений, неврологического дефицита, провокационных проб и ЭМГ показателей. Для каждого пациента подсчитана сумма баллов 4-х составляющих. Эффективность лечения оценивали по динамике суммы баллов после лечения: >4 баллов – значительное улучшение, что сопровождалось купированием или существенным уменьшением субъективных ощущений; восстановлением чувствительности или сужением зоны чувствительных нарушений; уменьшением степени выраженности диагностических тестов; улучшением ЭМГ показателей; от 1 до 4 баллов – незначительным улучшением, что предусматривало уменьшение выраженности и частоты болевого синдрома без положительной динамики объективных показателей чувствительной и двигательной сфер, возможно улучшение отдельных ЭМГ показателей; 0 баллов – отсутствие эффекта; Отрицательной динамика считалась при усилении субъективных ощущений, ухудшении данных неврологического обследования и ЭМГ показателей.
Общая эффективность лечения представлена в табл. 5 и на диаграмме 5.
Таблица 5. Эффективность разных методов терапии в группах
| Эффективность абс.число больных/рук (%) | Группа I (n=16/29) | Группа II (n=16/29) | Группа III (n=18/36) |
| Значительные улучшения | 2/4 (13,8) | 5/9 (31) | 8/16 (44,4) |
| Незначительные улучшения | 11/20 (69) | 10/18 (62,1) | 8/16 (44,4) |
| Отсутствие динамики | 3/5 (17,2) | 1/2 (6,9) | 2/4 (11,1) |
| Отрицательная динамика | 0 | 0 | 0 |
Ни в одной группе не отмечалось отрицательной динамики ТН на фоне лечения. В группе I после терапии аппликациями димексида у 2 больных с двусторонней КТН наблюдались значительные улучшения. У 11 больных отмечено уменьшение боли и парестезий в руках, при неврологическом обследовании улучшений не выявлено. У 3 пациентов не наблюдалось изменений в ощущениях и при неврологическом обследовании. В группе II после лечебных блокад значительные улучшения выявлены у 5 пациентов. Уменьшение неврологической симптоматики зафиксировано у 11 больных. Отсутствие эффекта отмечалось у одной пациентки. В группе III после в/в капельного введения -липоевой кислоты у 8 пациентов наряду с уменьшением боли наблюдалось уменьшение неврологического дефицита. У 8 пациентов динамика ограничивалась уменьшением неврологической симптоматики. У 2 больных из не наблюдали эффекта от терапии.
Диаграмма 5. Эффективность разных методов терапии в группах
 При оценке динамики выраженности онемения в руках выявлено, что на фоне лечения с помощью аппликаций димексида выраженность онемения в кистях и пальцах рук уменьшилась, но не исчезла ни у одного пациента; на фоне лечебных блокад онемение прошло у одного пациента(6,25%), в то время как в группе III полный регресс онемения наблюдался у 9 больных (50%). Во всех группах отмечалось достоверное снижение интенсивности онемения, причем была выявлена большая респонсивность ощущения онемения к -липоевой кислоты по сравнению с аппликациями димексида и блокадами с дексазоном.
При оценке динамики выраженности онемения в руках выявлено, что на фоне лечения с помощью аппликаций димексида выраженность онемения в кистях и пальцах рук уменьшилась, но не исчезла ни у одного пациента; на фоне лечебных блокад онемение прошло у одного пациента(6,25%), в то время как в группе III полный регресс онемения наблюдался у 9 больных (50%). Во всех группах отмечалось достоверное снижение интенсивности онемения, причем была выявлена большая респонсивность ощущения онемения к -липоевой кислоты по сравнению с аппликациями димексида и блокадами с дексазоном.
При оценке динамики выраженности парестезий в руках положительные изменения выявлены во всех группах (p<0,05). На фоне лечения аппликациями димексида ощущение покалывания в пальцах рук исчезло у одного пациента (7,7 %); в группе II покалывание прошло у 4 пациентов (33,3 %); а при лечении тиоктовой кислотой покалывание в пальцах полностью регрессировало у 6 больных (46,2%).
Выраженность боли достоверно уменьшалось во всех группах (p<0,05). При лечении аппликациями димексида наблюдался значимый регресс ноцицептивных болей, которые полностью исчезли у 3 человек (30 %), однако динамика невропатической боли не была достоверной. После блокад с дексазоном отмечена достоверная положительная динамика невропатической боли, которая полностью регрессировала у 6 пациентов (54,5 %), у 2 пациентов уменьшились суставные боли. При лечении тиоктовой кислотой невропатическая боль в руках достоверно регрессировала, динамики выраженности суставной боли не отмечалось.
При оценке динамики изменения ощущения неловкости в пальцах рук достоверные улучшения выявлены во всех группах (p<0,05). Ощущение неловкости в пальцах рук на фоне лечения аппликациями димексида уменьшилось у двух пациентов, но не исчезло, в то время как на фоне лечебных блокад и тиоктовой кислоты оно полностью регрессировало у 4 больных (40 %) каждой группы. При оценке ощущения слабости достоверных положительных изменений не было выявлено ни в одной группе. Однако, тенденция к снижению слабости отмечена на фоне лечебных блокад и -липоевой кислоты.
Таким образом, положительная динамика изменений субъективных ощущений была выявлена во всех исследуемых группах. Можно отметить большую эффективность воздействия -липоевой кислоты на интенсивность и частоту возникновения онемения и жжения по сравнению с двумя другими методами и на ее преимущество в отношении неловкости в пальцах рук и покалывания в сравнении с аппликациями димексида.
Динамика изменений неврологических показателей: Достоверной динамики изменений сухожильных рефлексов не выявлено ни в одной группе. Тенденция к увеличению сухожильных рефлексов была отмечена на фоне лечения -липоевой кислотой и в меньшей степени – на фоне лечебных блокад. Достоверной положительной динамики изменений тактильной, болевой, вибрационной, температурной и суставно-мышечной чувствительности не было выявлено ни в одной группе, однако, тенденция к улучшению чувствительности отмечалась в группе III.
Динамика изменений электрофизиологических показателей:
ЭМГ проводилась до лечения и в течение одного месяца после терапии. При исследовании моторного срединного нерва во всех группах отмечено достоверное снижение ДЛ. В группе I достоверных улучшений показателей амплитуды М-ответа, СРВ на предплечье и РЛ не наблюдалось. В группе II на фоне лечебных блокад отмечалось достоверное увеличение амплитуды М-ответа, в то время как изменения показателей СРВ на предплечье и РЛ не достигали достоверного уровня. В группе III были выявлены значимые изменения показателей амплитуды М-ответа и РЛ, и не обнаружено достоверной динамики СРВ на предплечье. При исследовании сенсорных срединных нервов во всех группах отмечено достоверное повышение СРВ на ладони, в группах I и II выявлено достоверное снижение дистальной латентности. Значимого повышения амплитуды S-ответа не отмечалось ни в одной группе (табл. 6).
Таблица 6. Динамика изменений ЭМГ показателей сенсорных
волокон n. medianus в трех группах (М±)
| Группы | ДЛ (мс) | А ПД (мкВ) | СРВ на ладони (м/с) | |
| I n=20 | до лечения | 3,7 ± 0,4 | 13,0 ± 6,3 | 37,2 ± 5,7 |
| после | 3,6 ± 0,5 | 13,3 ± 5,7 | 39,0 ± 5,2 | |
| достоверность различий | p> 0,05 | p> 0,05 | p< 0,05 | |
| II n=22 | до лечения | 4,2 ± 0,8 | 8,5 ± 3,7 | 34,9 ± 6,1 |
| после | 4,0 ± 0,7 | 8,8 ± 3,5 | 37,0 ± 6,1 | |
| достоверность различий | p< 0,05 | p> 0,05 | p< 0,05 | |
| III n=24 | до лечения | 3,89 ± 0,98 | 11,5 ± 8,2 | 39,1 ± 6,0 |
| после | 3,68 ± 0,88 | 11,8 ± 8,2 | 41,9 ± 5,7 | |
| достоверность различий | p< 0,05 | p> 0,05 | p< 0,05 | |
При исследовании моторных локтевых нервов у пациентов на фоне терапии аппликациями димексида не наблюдалось улучшения ни одного показателя. В группах II и III было отмечено достоверное снижение ДЛ моторного локтевого нерва и повышение СРВ через кубитальный тоннель. Достоверного увеличения амплитуды М-ответа не зафиксировано ни в одной группе, как и изменений СРВ на плече. Достоверное увеличение СПВ на предплечье было выявлено у пациентов группы II после лечебных блокад. В двух других группах значимых улучшений не зафиксировано.
При изучении динамики ЭМГ показателей КТН и КБТН выявлены достоверные различия после проведенной терапии тремя методами. В случае КТН наиболее респонсивным оказался показатель ДЛ срединного нерва, который стал достоверно ниже после проведенной терапии во всех группах, но наиболее значимо – на фоне -липоевой кислоты. Наиболее резистентными оказались показатели СРВ моторных волокон, изменения которых не достигали уровня достоверности ни в одной из групп, однако, на фоне тиоктовой кислоты, достоверным было снижение РЛ, отражающей СПВ по дистальным участкам нерва. Динамика амплитуды М-ответа была достоверно значимой в группах II и III, а изменения РЛ достоверно изменились на фоне лечения -липоевой кислотой. ДЛ сенсорных волокон срединного нерва достоверно уменьшилась во всех группах, на фоне аппликаций димексида – в меньшей степени. Амплитуда S-ответа не подверглась значимому изменению ни в одной группе, в то время как положительная динамика показателей СРВ на ладони была достоверной во всех группах. Результаты исследования указывают на большую эффективность воздействия -липоевой кислоты на функцию проводимости срединного нерва при КТН, особенно при вовлечении в патологический процесс моторных волокон. При КБТН на фоне лечебных блокад и воздействия -липоевой кислотой наблюдались достоверные улучшения показателей ДЛ и СРВ. Полученные результаты доказывают большую эффективность воздействия блокад дексаметазона и -липоевой кислоты на функцию проводимости локтевого нерва при КБТН по сравнению с аппликациями димексида.
ВЫВОДЫ
- Распространенность сенсорных ощущений в руках (боль, жжение, онемение, парестезии, зуд) у больных 1 и 2 типов сахарного диабета составляет 42,2 %. Распространенность сенсорных ощущений не зависит от типа сахарного диабета.
- Спонтанный сенсорный феномен в руках у больных сахарным диабетом обусловлен наличием тоннельных невропатий (20,8 % случаев), реже диабетической полиневропатией (7,5 % случаев), артропатиями (6,6 % случаев) и шейной радикулопатией (2,8 % случаев). В 62,3 % случаев имеется сочетание тоннельных невропатий с диабетической полиневропатией, артропатиями и шейной радикулопатией.
- У больных сахарным диабетом наиболее часто наблюдались карпальный (64,5 % случаев) и кубитальный синдромы (54,6 % случаев), реже – пронаторный (6,8 % случаев) и канала Гийона (6,8 % случаев) синдромы. Сочетание нескольких тоннельных синдромов отмечено в 32,1 % случаев. Двухсторонние тоннельные невропатии выявлены у 77,3 % больных, односторонние – в 22,7 % случаев.
- Боли в руках у больных сахарным диабетом и тоннельными невропатиями верхних конечностей выявлялись в 43,1 % случаев. Боль имела невропатический характер в 23,7 % случаев, ноцицептивный – в 15,8 % случаев, сочетанный характер – в 60,5 % случаев.
- Диагностика тоннельных синдромов рук у больных сахарным диабетом должна основываться на оценке спонтанных сенсорных феноменов, неврологического дефицита, результатах провокационных тестов и электромиографического обследования.
- Электромиографическая диагностика тоннельных синдромов рук у больных сахарным диабетом должна включать оценку амплитуды двигательного и сенсорного ответов, дистальной латенции, скорости проведения возбуждения и при диагностике карпального синдрома – дополнительно оценки соотношения дистальных латенций срединного и локтевого нервов.
- Факторами риска развития тоннельных синдромов в руках являются наличие и длительность сахарного диабета, развитие диабетической полиневропатии.
- Степень выраженности клинических проявлений и электрофизиологический изменений при тоннельных синдромах рук у больных сахарным диабетом зависит от его длительности.
- Наиболее эффективно лечение тоннельных синдромов рук у больных сахарным диабетом внутривенным введением антиоксидантов (-липоевая кислота), несколько меньший эффект имеет локальное введение в область компрессии нерва коротко действующих кортикостероидных препаратов (дексаметазон).
- В формировании тоннельных синдромов рук у больных сахарным диабетом большое значение имеет исходное функциональное состояние периферических нервов.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- При диагностике ТН у больных СД помимо неврологического и электрофизиологического обследования необходимо оценивать спонтанные сенсорные феномены и результаты провокационных тестов.
- ЭМГ диагностика карпальной ТН должна включать оценку амплитуды М-и S-ответов, скорости проведения сенсорных и моторных волокон, а также соотношения дистальных латенций срединного и локтевого нервов.
- В популяции больных СД для лечения ТН целесообразно использовать -липоевую кислоту в сочетании с блокадами короткодействующего кортикостероида.
СПИСОК ОПУБЛИКОВАННЫХ РАБОТ ПО ТЕМЕ ДИССЕРТАЦИИ
- Афонина Ж.А., Аметов А.С., Строков И.А. Боли в руках при диабетической полиневропатии// Патогенез. – 2005. – Т. 3. – № 2. – С. 8.
- Аметов А.С., Афонина Ж.А., Строков И.А. Лечение карпального и кубитального тоннельных синдромов у больных сахарным диабетом// Материалы I Национального конгресса терапевтов. Москва. – 2006. – С. 8-9.
- Афонина Ж.А. Алгоритм дифференциальной электромиографической диагностики диабетической полинейропатии и тоннельных синдромов верхних конечностей// Материалы I Национального конгресса терапевтов. Москва. – 2006. – С. 12.
- Афонина Ж.А., Строков И.А. Тоннельные синдромы в руках у больных сахарным диабетом// Вестник эндокринологии. Казахстан. – 2007. – № 4. – С. 6-13.
- Строков И.А., Строков К.И., Афонина Ж.А. Патогенетическая терапия диабетической полиневропати// Лечащий врач. – 2008. - № 3. – С. 10-14.
- Строков И.А., Афонина Ж.А., Строков К.И., Албекова Ж.С. Бенфотиамин в лечении диабетической полиневропатии// Медицина. Казахстан. – 2008. - № 6 – С. 50-55.
- Строков И.А., Афонина Ж.А., Строков К.И., Аметов А.С. Лечение диабетической полиневропатии// Consilium Medicum. Москва. – 2008. – Т. 10. - № 7. – С. 113-118.
- Афонина Ж.А., Строков И.А., Аметов А.С., Войчик Э.А. Лечение тоннельных невропатий рук у больных сахарным диабетом// Русский медицинский журнал. – 2008. – Т. 16 – № 12. – С. 1621-1625.
- Строков И.А., Афонина Ж.А., Строков К.И., Дадаева Е.Е. Возможности применения актовегина у больных диабетической полиневропатией// Consilium Medicum. Москва. – 2008. – Т. 10. - № 9. – С. 44-47.
- Строков И.А., Афонина Ж.А., Строков К.И., Албекова Ж.С. Патогенетическое лечение диабетической полиневропатии бенфотиамином// Вестник эндокринологии. Казахстан. – 2008. – № 3. – С. 3-8.

