Цитокины в прогнозировании послеоперационных осложнений при искусственном и вспомогательном кровообращении
На правах рукописи
СУСКОВ СЕРГЕЙ ИГОРЕВИЧ
ЦИТОКИНЫ В ПРОГНОЗИРОВАНИИ ПОСЛЕОПЕРАЦИОННЫХ осложнений ПРИ ИСКУССТВЕННОМ И ВСПОМОГАТЕЛЬНОМ КРОВООБРАЩЕНИИ
14.01.24 – трансплантология и искусственные органы
14.03.09 – клиническая иммунология, аллергология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва – 2010
Работа выполнена в ФГУ «Федеральном научном центре трансплантологии и искусственных органов имени академика В.И.Шумакова» Минздравсоцразвития РФ
Научные руководители:
Член-корреспондент РАМН,
доктор медицинских наук, профессор Шумаков Дмитрий Валерьевич
Заслуженный деятель науки РФ,
доктор биологических наук, профессор Зарецкая Юлия Михайловна
Официальные оппоненты:
Заслуженный деятель науки РФ,
доктор медицинских наук, профессор Онищенко Нина Андреевна
доктор биологических наук Мирошниченко Ирина Вадимовна
Ведущее учреждение:
Российский научный центр хирургии им. академика Б.В.Петровского
Защита диссертации состоится “ ”………………….2010г. в………часов на заседании диссертационного совета Д.208.055.01 при ФГУ «ФНЦ трансплантологии и искусственных органов им. академика В.И.Шумакова» МЗ и СР РФ, по адресу: 123182, Москва, ул. Щукинская д.1.
С диссертацией можно ознакомиться в библиотеке ФГУ «ФНЦ трансплантологии и искусственных органов им. академика В.И.Шумакова» МЗ и СР РФ
Автореферат диссертации разослан «________» _________________ 2010года
Ученый секретарь Диссертационного совета Д.208.055.01
доктор медицинских наук, профессор Шевченко Ольга Павловна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы:
Внедрение искусственного и вспомогательного кровообращения в хирургическую практику сделало возможным выполнение сложных операций на сердце, включая двухэтапную трансплантацию сердца, и позволило расширить возрастные границы хирургического лечения, в том числе среди больных с сочетанной патологией сердца. [Шумаков В.И., Толпекин В.Е., 2000, 2003; Шумаков Д.В., 2009; Nishimura, 2000; Park et al., 2000; Pennington D.C. et al., 2001; Caruso R., 2010].
В то же время, для дальнейшего улучшения клинических результатов применения систем механической поддержки кровообращения, наряду с созданием новых и совершенствованием используемых систем вспомогательного кровообращения, возникает необходимость решения ряда медико-биологических задач, связанных с дизрегуляцией адаптационно-защитных реакций, приводящих к развитию воспалительного ответа, иммунному и метаболическому дисбалансу и снижению противоинфекционной резистентности. Наличие входных ворот для инфекции через магистрали систем искусственного и вспомогательного кровообращения повышает риск бактериальной агрессии с развитием тяжелых инфекционно-воспалительных процессов и органных дисфункций [Шумаков В.И. и соавт., 2006; Белобородова Н.В., 2008; Гусев Е.Ю. и соавт., 2008; Сускова В.С. и соавт., 2009; Попцов В.Н., 2009; Smedira N.G. et al., 2001; Hotchkiss S.S., 2003 и др.], что выдвигает разработку новых информативных методов прогнозирования послеоперационных осложнений в разряд актуальных задач.
В последние годы появились новые данные о роли цитокинопосредованных механизмов в развитии хирургической инфекции и полиорганной недостаточности. Показано, что в результате повреждения и/или инфицирования тканей в организме развивается сложный многокомпонентный каскад последовательных реакций, неотъемлемым звеном которых являются цитокины иммунной системы – функциональные молекулы межклеточных взаимодействий в иммунном ответе [Черных Е.Р. и соавт., 2005; Кетлинский С.А. и соавт., 2008; Hancook J.T. et al., 2001; Blan K.S. et al., 2007; Cinel I. et al., 2009].
Цитокины играют ключевую роль как в развитии защитного воспалительного ответа, так и в регуляции избыточных проявлений системного воспаления. Нарушение цитокинового баланса приводит либо к развитию бактериально-токсического шока и органных дисфункций, что является причиной ранней летальности больных с гнойно-септическими осложнениями, либо к развитию глубокой иммунодепрессии и анергии, что ведет к формированию поздней полиорганной недостаточности. [Косякова Н.И. и соавт., 2005; Козлов В.К., 2006; Casey L.С., 2000; Annane D. et al., 2003; Axelsson J. et al., 2010].
В настоящее время определение сывороточных уровней цитокинов используется для оценки тяжести течения патологического процесса; эффективности проводимой терапии; прогнозирования развития тяжелых послеоперационных инфекционно-воспалительных осложнений. [Демьянов А.В. и соавт., 2003; Бережная Н.И. 2007,; Bone R.S., 1997; Balk R.A., 2002; He Z., Zhao C. et al., 2005; Guani-Guerra E. еt al., 2010].
Однако, применение цитокинов иммунной системы в качестве маркеров воспаления и прогнозирования осложненного послеоперационного течения в отечественной клинической практике остается ограниченным [Останин А.А. и соавт., 2004; Шевченко О.П., 2009; Железнякова Г.Ф. и соавт., 2009]. Остаются недостаточно изученными особенности продукции цитокинов и прогностическое их значение у больных с исходным иммунодефицитным состоянием при операциях в условиях искусственного и вспомогательного кровообращения.
Сдерживающим фактором использования цитокиновых параметров для прогнозирования послеоперационных осложнений является также отсутствие четкого алгоритма иммунологического мониторинга, включающего наряду с определением фенотипического состава клеток, оценку регуляторных межклеточных взаимодействий, осуществляемых цитокинами. Отсутствие таких данных предопределило цель настоящего исследования.
Цель исследования:
Изучить значимость цитокинов иммунной системы для прогнозирования развития и тяжести течения послеоперационных осложнений у больных при искусственном и вспомогательном кровообращении и повысить информативность алгоритма иммунологического мониторинга на основе включения цитокиновых параметров.
Задачи исследования:
- Изучить особенности цитокинового статуса у больных с нарастающей сердечной недостаточностью при подготовке к операциям в условиях искусственного кровообращения.
- Исследовать основные закономерности и выявить особенности динамики цитокинов в процессе и в ранние сроки после искусственного кровообращения.
- Оценить уровни цитокинов и их взаимосвязь с клеточными параметрами при вспомогательном кровообращении для определения тактики иммунологического мониторинга.
- Выявить сопряженность между цитокинами иммунной системы и клиническим статусом кардиохирургических больных для обоснования использования их в прогнозировании послеоперационных осложнений.
- Усовершенствовать алгоритм иммунологического мониторинга путем включения цитокиновых параметров для повышения его информативности при прогнозировании развития послеоперационных осложнений.
Научная новизна:
Впервые показано, что цитокиновый дисбаланс, отражающий тяжелую форму нарушения иммунной системы, является новым самостоятельным функциональным типом вторичного иммунодефицита, способствующим развитию тяжелых инфекционно-воспалительных процессов и органных дисфункций.
Впервые установлено, что нарушение баланса продукции цитокинов является ранним признаком иммунодефицитных состояний у больных с нарастающей сердечной недостаточностью и предпосылкой для развития иммунозависимых осложнений при хирургическом лечении.
Показана возможность использования цитокиновых параметров для раннего выявления тяжелой иммунодепрессии и контроля за ее разрешением на разных этапах после операций в условиях искусственного и вспомогательного кровообращения.
Впервые определены типы основных вариантов цитокиновых реакций, соответствующих: 1 – благоприятному прогнозу, 2 – нарастанию органных дисфункций и риску инфекционных осложнений, 3 – нарастанию дыхательной недостаточности, 4 – неблагоприятному прогнозу после искусственного кровообращения, которые зависят от тяжести дооперационного иммунодефицита, степени выраженности сердечной недостаточности и типа органных дисфункций.
Выявлена сопряженность между параметрами клинического статуса и цитокинами иммунной системы и обоснована возможность их использования для прогнозирования и индивидуального контроля за развитием послеоперационных осложнений и тяжестью их течения.
Разработан алгоритм иммунологического мониторинга на этапах хирургического лечения в условиях искусственного и вспомогательного кровообращения путем применения сочетанной оценки цитокиновых параметров и фенотипического состава клеток иммунной системы позволивший повысить его прогностическую информативность.
Научно-практическая значимость работы:
Выявленные закономерности и варианты динамики цитокинов у кардиохирургических больных до и после операций в условиях искусственного и вспомогательного кровообращения необходимо учитывать при выборе тактики иммунологического обследования для контроля за развитием послеоперационных осложнений.
Отобраны варианты комбинаций цитокинов на основе их корреляционных взаимосвязей для использования в качестве прогностических параметров развития и тяжести течения послеоперационных осложнений у кардиохирургических больных.
Обязательными компонентами иммунологического мониторинга, наряду с клеточными (апоптоз, иммунорегуляторные субпопуляции лимфоцитов) и фагоцитарными (моноциты, оксидазная активность нейтрофилов) показателями иммунитета, должны быть цитокиновые параметры (IL-2, IL-4, IFN-, IL-6, TNF-), отражающие взаимосвязь между отдельными звеньями иммунной системы.
Определены информативные цитокиновые показатели (IL-6, IL-8, TNF-) и прогностически значимые периоды для проведения иммунологического мониторинга (ранний период адаптации, лихорадка неясной этиологии, 30 сутки левожелудочкового обхода – критический срок развития эндокардита систем МПК, замена деталей системы) при вспомогательном кровообращении.
Внедрение результатов в практику:
Основные положения диссертационной работы внедрены в клиническую практику и повседневно используются в отделениях: анестезиологии, реанимации и интенсивной терапии; хирургии сердца и вспомогательного кровообращения; коронарной хирургии и трансплантации сердца и реконструктивной хирургии приобретенных пороков сердца ФГУ «ФНЦТИО им. академика В.И. Шумакова» Минздравсоцразвития России.
Апробация диссертации состоялась 01 июля 2010г. на заседании объединенной научной конференции клинических, экспериментальных отделений и лабораторий ФГУ «ФНЦТИО им. академика В.И. Шумакова» Минздравсоцразвития РФ.
Материалы и основные положения диссертации доложены:
На XXXI Congress ESAO, (Warshaw, Poland, 2004г.); на IX и Х Всероссийском научном форуме с международным участием «Дни иммунологии в С.-Петербурге», (2005, 2006гг.); на 11-th European Congress on Extra-Corporeal Circulation Technology, (Italy 2005г.); на 7-th Symposium of World artificial organ, immynology and Transplantation society (Waits), (Russia., St-Petersburg, 2005г.); на XII, XIII, XIV и XV Всероссийских съездах сердечно-сосудистых хирургов, (Москва, 2006-2009гг.); на VI Съезде иммунологов-аллергологов, Российском национальном конгрессе аллергологов и III Конференции по иммунотерапии (Москва, 2006г.); на Конференции «Клиническая трансплантация органов» РНЦХ РАМН, (Москва, 2007г.); на Объедененных иммунологических форумах, (Москва, 2007 и 2008гг.); на IV Всероссийском съезде трансплантологов им. академика В.И.Шумакова, (Москва, 2008г.); на Национальной конференции «Аллергология и клиническая иммунология – междисциплинарные проблемы», (Москва, 2009г.); на VII Съезде аллергологов-иммунологов СНГ, (С.-Петербург, 2009г.); на Всесоюзной конференции «Инфекции в трансплантологии», (Москва, 2009г.).
Публикации. По теме диссертации опубликовано 16 научных работ в центральной печати, в том числе 4 статьи в журналах, рецензируемых ВАК.
Диссертационная работа выполнена в рамках зарегистрированной НИОКР (2661/12 от 19.12.07г. регистрационный № 0120.0800392) темы: «Диагностика и коррекция иммунных нарушений у больных при органной и клеточной трансплантации и операциях на сердце в условиях искусственного и вспомогательного кровообращения».
Проведенные исследования являются частью разрабатываемой новой стратегии терапии гнойно-септических осложнений у кардиохирургических и трансплантологических больных.
Объём и структура диссертации. Диссертация состоит из введения, обзора литературы, характеристики больных и методов исследования, 4 глав результатов собственных исследований, заключения, выводов, практических рекомендаций и библиографического указателя, включающего 199 источников, из них 96 отечественных и 103 зарубежных авторов. Работа представлена на 110 страницах машинописного текста, иллюстрирована таблицами и рисунками.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЙ
Общая характеристика клинических наблюдений
Поскольку искусственное и вспомогательное кровообращение применяется, главным образом, при операциях на сердце, в настоящее исследование включен анализ результатов обследования 130 кардиохирургических больных, поступивших на плановое хирургическое лечение в период с 2005-2010гг. (Таб.1.). Эти больные составили основную группу клинических наблюдений. 20 здоровых доноров крови составили контрольную группу, параметры иммунной системы которых были приняты в качестве нормативных показателей.
Таблица 1.
Общая характеристика кардиохирургических больных, составивших
основную группу наблюдений
| Показатели | ИБС M±m (min-max) | ППС M±m (min-max) | ИБС + ППС M±m (min-max) | Всего M±m (min-max) | |
| Количество больных, n | 75 | 40 | 15 | 130 | |
| Пол, n (%): | муж. жен. | 58 (77,3) 17 (22,7) | 17 (42,5) 23 (57,5) | 10 (66,6) 5 (33,4) | 85 45 |
| Возраст, лет | 54 ± 5,7 * (43-73) | 56,3 ± 7,8 * (47-80) | 57,6 ± 6,8 * (48-78) | 56,1 ± 6,7 * (43-78) | |
| - Степень сердечной недостаточности - Функциональный класс стенокардии (по NYHA) | НК 2А–2Б * ФК III–IV * | НК 2А–2Б * ФК III–IV * | НК 2А –2Б * ФК III–IV * | НК 2А–2Б * ФК III–IV * | |
| Операция в условиях ИК, кол-во | Реваскуляция миокарда (АКШ) n=75 | Протезирование клапанов (ПК) n=40 | Сочетанная ПК+АКШ операция, n=15 | 130 | |
| Длительность ИК, мин. | 130 ± 9 * (78-182) | 123 ± 12 * (67-162) | 144 ± 15 * (87-200) | 132 ± 13 * (67-200) | |
| Осложнения (СПОН, СПОД, СВР) - начало клинических проявлений п/о, сут. - степень выраженности, сумм. балл SOFA | 2,1 ± 0,3 * 11,7 ± 2,1 * | 2,4 ± 0,3 * 10,5 ± 0,8 * | 2,0 ± 0,8 * 12,0 ±1,8 * | 2,2 ± 0,4 * 12,0 ±1,6 * | |
Примечание: * - P > 0,05 - между больными с ИБС, ППС и сочетанными ИБС + ППС. ППС – приобретенные пороки сердца
Как видно из таблицы 1., больные с разной патологией сердца достоверно по возрасту, степени сердечной недостаточности и функциональному классу стенокардии при обследовании до операции, а также по длительности ИК и развитию осложнений (системной воспалительной реакции, органных дисфункций и полиорганной недостаточности) в раннем послеоперационном периоде не различались (p>0,05). У мужчин преобладали операции по реваскуляции миокарда и сочетанной патологиии сердца, тогда как у женщин – операции по реконструкции клапанов сердца. В соответствии с поставленными задачами были определены следующие этапы исследования, включающие изучение:
1 - общих закономерностей и особенностей динамики цитокинов при искусственном и/или вспомогательном кровообращении;
2 - сопряженности динамики цитокинового статуса с клинико-иммунологической тяжестью послеоперационного течения;
3 - информативности использования цитокинов в иммунологическом мониторинге для прогнозирования послеоперационных осложнений.
Иммунологическое обследование проводили по схеме: до, в процессе, на 1 и 3 сутки после искусственного кровообращения, а также в процессе левожелудочкового обхода. Показатели иммунного статуса сравнивались с контрольной группой. В ходе иммунологического обследования было проведено 530 развернутых иммунологических анализов с использованием современных стандартизированных методов.
Оценку клеточного звена иммунитета проводили иммунофенотипированием лимфоцитов (CD3+, CD3+CD4+, CD3+CD8+, CD16+CD56+) с помощью дифференцировочных и активационных МКАТ, меченных FITC и фикоэритрином методом проточной цитофлуорометрии (Becton Coulter, Франция) [Пинегин Б.В., Ярилин В.А., 2001].
Состояние гуморального звена иммунитета оценивали по содержанию В-лимфоцитов (CD19+); концентрации иммуноглобулинов основных классов G, A, M в сыворотке крови методом радиальной иммунодиффузии в геле [Manchini G, 1965]; подклассов IgG 1-4 в сыворотке крови ИФА методом («Вектор-Бест» РФ); уровню низкомолекулярных ЦИК (6% ПЭГ).
Фагоцитарную активность нейтрофилов крови определяли по фагоцитозу убитой взвеси Staph. Aureus, подсчитывая фагоцитарный индекс и фагоцитарное число. Оксидазную и бактерицидную функцию нейтрофилов оценивали в НСТ-тесте спектрофотометрически и методом люминолзависимой хемилюминесценции [Хаитов Р.М., Пинегин Б.В., 1995].
Цитокиновый статус (IL-1, TNF-, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL-12, INF-) оценивали методом флуорометрии на 2-лучевом лазерном автоматизированном анализаторе (Bio-Plex Protein Assay System, Bio-Rad, USA) с использованием коммерческих тест-систем 11-Plex [Останин А.А. 2004] и методом ИФА («Цитокин», С-Пб.). Цитокины IL-1Ra и G-CSF определяли методом ИФА («Цитокин», С-Пб.).
Оценка тяжести клинического состояния больных.
Cистемный воспалительный ответ оценивали по числу лейкоцитов, уровню С-реактивного белка методом турбометрии в капилляре, по полуколичественному тесту на прокальцитонин («BRAHMS PCT-Q», Германия) [Aouifi A. et al., 1999]. Рассчитывали лейкоцитарную формулу и лейкоцитарный индекс интоксикации (ЛИИ) [Кальф-Калиф Я.Я., 1941].
Диагноз сепсиса и септического шока выставляли по критериям согласительной конференции American College of Chest physicians и Society of Critical Care Medicine (1992).
Диагностика органной недостаточности проводилась совместно с Отделением анестезиологии, реанимации и интенсивной терапии (Зав. д.м.н. В.Н.Попцов) по бальной шкале SOFA (The Sequential Organ Filure Assessment) [Vincent J.L., 1998], включающей оценку коффициента оксигенации HiO2/FiO2, количества тромбоцитов, общего билирубина, креатинина, уровня артериального давления и дозы катехоламинов. Нарушение сознания оценивали по шкале Глазго. Суммарный балл выше 10 свидетельствовал о наличии СПОН, менее 10 баллов – СПОД.
Статистическая обработка результатов проводилась с использованием прикладных программ Statisticа 6 (StatSoft, USA). При нормальном распределения количественных признаков подсчитывали средние значения (М), ошибки средней (m). При оценке качественных признаков подсчитывались их относительные доли (%). В качестве статистических тестов при нормальном распределении количественных признаков с равными выборочными дисперсиями использовали t-критерий Стьюдента. Отличия считали значимыми при p<0,05. Для оценки связи количественных признаков использовались методы линейной регрессии и корреляции (коэффициент корреляции Пирсена), для сопоставления пропорций – точный критерий Фишера.
Результаты собственных исследований и их обсуждение
I. Основные закономерности и особенности цитокинового статуса у кардиохирургических больных до и после операций в условиях искусственного и вспомогательного кровообращения.
На первом этапе исследований проведено изучение основных закономерностей и особенностей цитокинового статуса у кардиохирургических больных до и после операций в условиях искусственного и вспомогательного кровообращения.
Известно, что несостоятельность иммунной системы является основным фактором развития и прогрессирования послеоперационных осложнений. При этом тяжелые дисфункции иммунной системы наблюдаются чаще, чем несостоятельность других органов и систем, и сопровождаются глубокой иммунодепрессией, которая является не только ранним и надежным признаком развития опасных для жизни состояний, таких как сепсис и полиорганная недостаточность, но и во многом обеспечивает их возникновение и последующее нарастание. Это подтверждает необходимость выявления иммунных нарушений и оценки степени их тяжести уже в дооперационном периоде.
- Оценка тяжести иммунных нарушений и цитокинового дисбаланса у больных с нарастающей сердечной недостаточностью при подготовке к операции проведена у 38 больных с ИБС и приобретенными пороками сердца (ППС) с прогрессирующей сердечной недостаточностью, находящихся на медикаментозной поддержке. Степень выраженности тяжелых дисфункций иммунной системы оценивали по: 1) определению субпопуляционного дисбаланса Т-лимфоцитов; 2) количеству апоптотических лимфоцитов (CD95+кл.), экспрессирующих маркер апоптоза; 3) бактерицидной и оксидазной активности нейтрофилов и моноцитов, в том числе антигенпрезентирующей их функции; 4) лимфопении и сдвигу лейкоцитарной формулы, информативных для выявления тяжелых иммунодефицитов (таб.2.).
Как видно, независимо от диагноза, у обследованных больных с высокой частотой выявлялся повышенный уровень апоптотических лимфоцитов (CD95+кл.), экспрессирующих маркер апоптоза (у 78% больных – в 3-5 раз выше N) и повышенная продукция активных форм кислорода в НСТ-тесте (у 86% больных). При этом, у больных с ИБС более выражен апоптоз, тогда как у больных с ППС повышена оксидазная активность нейтрофилов (p<0,05). Эти параметры относятся к высокоинформативным
Таблица 2.
Дисфункции иммунной системы у кардиохирургических больных с сердечной недостаточностью при подготовке к операции (n=38)
| Показатель | Доноры (n=20) | ИБС (n=20) | ППС (n=18) | %% больных | |||||
| Me | Min-max | Me | Min-max | <N | N | >N | |||
| Лейкоциты 109 | 4000-9000 | 5200 | 4000-7800 | 6790 | 3050-7200 | 14 | 72 | 14 | |
| Лимфоциты | % | 25-40 | 31 | 28-45 | 29 | 18-37 | 36 | 64 | 0 |
| 109 | 1700-2500 | 1639 | 656-3000 | 1560 | 670-2700 | 29 | 67 | 7 | |
| Нейтрофилы п/я %% | 1-8 | 9* | 4-16 | 10* | 5-13 | 0 | 50 | 50 | |
| Т-лф.(CD3) % | 60-75 | 71 | 53-86 | 59 | 60-81 | 14 | 57 | 29 | |
| ИРИ (CD4/CD8) | 1,5-2,0 | 3,0* | 0,8-3,5 | 2,9* | 1,1-4,0 | 29 | 29 | 42 | |
| Моноциты % | 1-7 | 3 | 1-7 | 3 | 1-3 | 0 | 86 | 14 | |
| Акт. HLA-DR % | 8-15 | 14 | 6-21 | 10,5 | 7-26 | 14 | 57 | 29 | |
| Рец. к IL-2 (CD25) % | 1-5 | 2 | 1-5 | 1,8 | 1-4 | 22 | 78 | 0 | |
| Апоптоз (CD95+кл.) % | 0-10 | 41* | 22-69 | 26 * ** | 22-52 | 0 | 22 | 78 | |
| НСТ-тест (у.е.) | сп. | 80-99 | 67 | 80-200 | 157* ** | 98-206 | 0 | 14 | 86 |
| инд. | 130-256 | 296* | 126-334 | 317* ** | 146-452 | 0 | 14 | 86 | |
Примечания: *- p<0,05 достоверность различий по сравнению с группой доноров, **- p<0,05 достоверность различий между группами больных с ИБС и ППС. %% больных – частота со сниженными (), сохраненными (N) и повышенными () параметрами.
показателям для выявления иммунодепрессивных состояний, особенно при наличии сдвига формулы влево, лимфопении и апоптоза. Субпопуляционный дисбаланс Т-лимфоцитов отмечался у более половины всех обследованных больных и был связан с дисбалансом иммунорегуляции за счет снижения/повышения как CD4+кл., так и CD8+ЦТЛ. Нарушение активации моноцитов (HLA-DR+кл.) и Т-хелперов (СD4+25+кл.) отмечалось реже (у 14% и 22% больных соответственно).
Исследование цитокинового статуса у больных с нарастающей сердечной недостаточностью в дооперационном периоде включало оценку сывороточных уровней цитокинов иммунной системы с преимущественным провоспалительным (IL-1, IL-6, IL-8, TNF-) и противовоспалительным (IL-10, IL-1Ra) действием, а также уровней G-CSF и регуляторных цитокинов (IL-2, IL-4, IFN-).
Индивидуальный анализ спектра и сывороточных концентраций цитокинов (рис.1.) выявил преобладание повышенных уровней провоспалительного IL-1 (26%), хемоаттрактанта IL-8 (38%) и костномозгового колониестимулирующего фактора G-CSF (54%) у больных с наличием локальных очагов воспаления и/или при обострении хронических заболеваний. Колебания уровней IFN-, IL-6, регулирующих функциональные свойства моноцитов, приближались к средним уровням, тогда как уровни TNF- у 89% больных не превышали N. Повышение IL-2 у 84% больных было характерно для преобладания Th1 иммунного ответа.





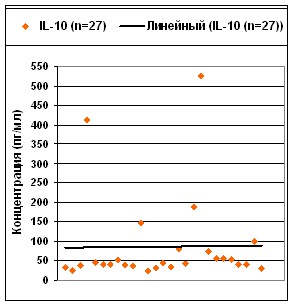
Рис. 1. Индивидуальное распределение спектра и сывороточных концентраций цитокинов у кардиологических больных до операции.
Компенсаторное нарастание IL-1Ra, блокирующего рецепторы IL-1 на клетках-мишенях и, тем самым, способствующего сдерживанию развития воспалительной реакции, наблюдалось у 46% обследованных больных.
Проведенный корреляционный анализ (рис. 2.) в дооперационном периоде выявил достоверные положительные взаимосвязи между регуляторными, про- и противовоспалительными цитокинами, отражающими функциональное состояние отдельных звеньев иммунной системы.
Так, сопряженные повышения IL-1Ra и IL-4 (r=0,28), IL-6 (r=0,48) и IL-10 (r=0,3) отражает состояние Тreg.- регуляторного звена; IL-4 и TNF- (r=0,42) отражает взаимосвязь Th1(клеточного) и Th2 (гуморального) иммунного ответа; IL-6 и IL-10 (r=0,62) свидетельствует о нарастании сердечной недостаточности, TNF- в сочетании с G-CSF (r=0,4) может служить механизмом повышения процесса апоптоза В-лимфоцитов и нейтрофилов; высокие корреляционные связи между IFN- и компонентом комплемента C3a (r=0,8) свидетельствуют о развитии воспалительного процесса. В то же время соотношение между IL-1 и IL-1Ra выражалось отрицательным коэффициентом корреляции (r = -0,11), что приводило к снижению продукции IL-1 и сдерживанию развития воспалительного процесса в результате негативной эндогенной регуляции IL-1Ra.

Рис. 2. Корреляционные взаимосвязи (r) между цитокинами до операции.
(Достоверные положительные корреляции обозначены стрелками)
Нарушение корреляционных взаимосвязей цитокинов в процессе иммунного ответа приводит к формированию нового функционального типа вторичного иммунодефицита, проявляющегося развитием цитокинового дисбаланса и повышению риска развития послеоперационных осложнений.
Таким образом, полученные результаты выявили на фоне тяжелых клеточных дисфункций наличие у большинства обследованных больных вторичного функционального иммунодефицита и высокого риска развития органных дисфункций воспалительного типа, пусковым моментом которых в раннем послеоперационном периоде служит операционная травма и кардиопульмональный обход.
- Цитокиновый статус у кардиохирургических больных с прогрессирующей сердечной недосточностью на ранних сроках после искусственного кровообращения.
Изучение состояния цитокинового статуса в раннем периоде после операций в условиях искусственного кровообращения было продолжено у обследованных до операции 38 кардиохирургических больных по следующей схеме: до ИК, после ИК, 12 часов, 1 сутки и 2-3 суток после операции, а также у 10 больных в процессе ИК по схеме: 5 мин. ИК, 40 мин. ИК, конец ИК, далее по общей схеме. Время ИК варьировало от 111 мин. до 195 мин.; ишемия миокарда составила 68-87 мин.
В таблице 3. представлен характер общих закономерностей динамики цитокиновых параметров (IL-1, IL-1Ra, IL-6, IL-8, G-CSF, TNF-, IL-10) в процессе искусственного кровообращения и в раннем периоде после ИК, отражающий развитие защитной воспалительной реакции и механизмов, сдерживающих гиперактивацию воспалительного ответа.
Как видно, дооперационные уровни цитокинов не превышали контрольных значений за исключением исходно повышенных показателей концентрации IL-10.
Через 5 мин. ИК быстро нарастали концентрации IL-1 и IL-8, отражающие начало защитной воспалительной реакции в ответ на ИК, с одновременной быстрой продукцией IL-1RA – общебиологической адаптивно-компенсаторной реакцией сдерживания гиперактивации
Таблица 3.
Динамика цитокинов иммунной системы у кардиохирургических больных до и после искусственного кровообращения (n=38)
| ИК сроки | IL-1 (пг/мл) | IL-1Ra (пг/мл) | IL-6 (пг/мл) | IL-8 (пг/мл) | G-CSF (пг/мл) | IL-10 (пг/мл) | TNF- (пг/мл) |
| До ИК | 68±12 | 84±18 | 31±3 | 39±15 | 21±7 | 201±17* | 17±3 |
| 5ИК | 110±21* | 356±45* | 18±5 | 84±17* | 33±8 | 182±8,4* | 22±4 |
| 40 п/ИК | 150±8* | 520±150* | 128±129* | 143±28* | 479±127* | 94±10 | 19±7 |
| Конец ИК | 160±30* | 392±60* | 129±22* | 154±33* | 717±346* | 75±4,5 | 20±3 |
| 12ч. п/ИК | 180±53* | 235±95* | 121±22* | 149±32* | 437±151 | 70±5 | 18±1,4 |
| 1с. п/ИК | 80±25* | 518±106* | 95±6* | 95±23* | 312±147* | 65±4 | 32±3,5 |
| 2-3с. п/ИК | 75±17 | 406±26* | 237±18* | 71±21 | 56±16 | 61±3,7 | 20±4 |
| Контр. гр. | 57±15 | 260±60 | 32±4 | 57±12 | 48±15 | 61±13 | 28±7 |
Примечание: * - p < 0,05 – по сравнению с контрольной группой
воспалительного процесса, и сохраняющимся уровнем IL-10 - Тreg –регуляции. В процессе искусственного кровообращения пики нарастания IL-1, IL-8 и G-CSF приходились на период – «конец ИК – 12час. после ИК», с последующим снижением к 1-3 суткам после ИК.
В процессе искусственного кровообращения и через 1-3 сутки после ИК уровни TNF- и IL-10 не превышали контрольных значений.
Динамика IL-6 и IL-1Ra – антагониста рецептора к IL-1, имела двухфазный характер: первый подъем продукции IL-6 наблюдался во время ИК и 12 час. после ИК (период нарастания миокардиальной недостаточности после пережатия аорты) со снижением к 1 суткам и вторым подъемом ко 2-3 суткам (периоду развития ранних послеоперационных осложнений и органных дисфунций). Первое повышение IL-1Ra соответствовало периоду подключения ИК, второе повышение отмечалось через 2-3 суток – период повышения риска развития послеоперационных осложнений.
Индивидуальный анализ цитокиновых параметров в процессе искусственного кровообращения показал увеличение числа больных с повышенными концентрациями исследуемых цитокинов, что позволило выявить особенности и установить основные типы вариантов динамики цитокинового статуса при применении ИК.
Первый тип варианта динамики цитокинового статуса характерен для неосложненного послеоперационного течения при операциях в условиях ИК.

Рис.3. Вариант 1. Благоприятный прогноз. n=15 (40%)
При этом дооперационные показатели цитокинов варьируют в пределах нормативных значений за исключением IL-8. Повышение продукции цитокинов в процессе ИК сдерживается условиями его проведения (гипотермия и др.). К 12ч. после ИК отмечается подъем уровней всех цитокинов (адаптационно-компенсаторная реакция) с нормализацией к 3 суткам (благоприятный прогноз) (рис.3.).

Рис.4. Вариант 2. Нарастание риска органных дисфункций. n=9 (22%)
При втором варианте отмечаются исходно высокие уровни провоспалительных цитокинов, в том числе G-CSF, стимулирующего дополнительный выброс нейтрофилов из костного мозга, которые свидетельствуют о наличии хронического воспалительного процесса (бакэндокардит и др.). Уже с 5 мин. после начала ИК резко возрастает уровень IL-1Ra и IL-10, сохраняющиеся до конца ИК, при одновременном снижении продукции IL-1. Резкий подъем IL-1Ra расценивается как сдерживающий механизм воспалительной реакции на ИК. К концу 1 сут. все показатели цитокинов возвращаются к норме (Нарастание риска органных дисфункций) (рис.4.).
При третьем варианте динамики цитокинового статуса в конце ИК определяются высокие уровни IL-1Ra, IL-8, G-CSF, а также IL-10, что свидетельствует о нарастании иммуносупрессии в организме. К 12 час. их уровни снижаются (кроме IL-1Ra), тогда как возрастает уровень IL-6, отражающий нарушения, связанные с гипоксией миокарда в процессе ИК.

Рис.5. Вариант 3. Нарастание дыхательной недостаточности. n=10 (28%)
Новый подъем IL-8 и G-CSF на постоянно высоком фоне IL-1Ra может служить прогнозом нарастающей дыхательной недостаточности (рис.5.).
При четвертом варианте динамики цитокинового статуса высокий уровень IL-1Ra определяется на протяжении раннего послеоперационного периода (в первые 3 суток). Повышение уровней IL-6 и IL-8 к 3 сут. и

Рис.6. Вариант 4. Неблагоприятный прогноз. n=4 (10%)
особенно к 4-6 суткам может использоваться для прогноза развития тяжелых инфекционных осложнений и полиорганной недостаточности. Такой вариант наиболее типичен у больных с интраоперационными осложнениями (Неблагоприятный прогноз) (рис.6.).
Таким образом, изучение общих закономерностей динамики как усредненных показателей, так и индивидуального анализа наиболее исследованных в клинике цитокинов иммунной системы, обозначаемых как цитокиновый статус, в раннем периоде после операции в условиях искусственного кровообращения позволило выявить наиболее важные информативные параметры (IL-1Ra, IL-6, IL-8, G-CSF) для прогнозирования генерализации воспалительного ответа и развития органных дисфункций.
- Влияние вспомогательного кровообращения на уровни цитокинов и их сопряженность с клеточными параметрами иммунной системы.
Динамика цитокиновых параметров при вспомогательном кровообращении изучена на этапе механической поддержки кровообращения методом внутриаортальной баллонной контрпульсации и левожелудочкового обхода (ЛЖО) с помощью насоса «Biopump».
Динамика цитокиновых параметров у кардиохирургических больных с нарастающей сердечной недостаточностью при внутриаортальной баллонной контрпульсации.
Показанием к применению внутриаортальной баллонной контрпульсации (ВАБК) явилась неэффективность фармакологической поддержки и прогрессирующая сердечная недостаточность с выраженным синдромом низкого сердечного выброса до или после операции. Динамика цитокиновых параметров при подключении внутриаортальной баллонной контрпульсации исследована у 42 кардиохирургических больных.
Характер реагирования иммунной системы и течение послеоперационного периода при искусственном кровообращении и ВАБК имели общие закономерности и зависили не столько от их длительности, сколько от исходного состояния адаптационно-приспособительных реакций и антиген-специфического иммунного ответа. Динамика продукции цитокинов при ВАБК коррелировала с дисфункцией миокарда и системной воспалительной реакцией.
При эффективном подключении ВАБК уменьшался Т-клеточный иммунодефицит в результате повышения уровня Т-хелперов – ключевой иммунорегуляторной субпопуляции в формировании антиген-специфического иммунного ответа. ВАБК не нарушал адекватного реагирования иммунной системы: снижение гипоксии органов и систем при ВАБК приводило к восстановлению функций иммунокомпетентных клеток, снижению апопотоза.
При быстро нарастающей сердечной недостаточности и недостаточности кровообращения, снижении транспорта кислорода и темпа диуреза требовалось подключение левожелудочкового обхода.
Динамика цитокиновых параметров в процессе вспомогательного кровообращения с использованием левожелудочкового обхода.
Иммунологический мониторинг в процессе левожелудочкового обхода у 15 больных при подготовке к двухэтапной пересадке сердца осуществляли в соответствии с выделенными критическими периодами развития системной воспалительной реакции и полиорганной дисфункции, а также активации инфекции (рис.7).

Рис.7. Динамика цитокиновых параметров в процессе левожелудочкового обхода с помощью насоса «Biopump»
I – период адаптации, II – развитие «эндокардита системы», III – эпизоды лихорадки и обострения инфекций, IV – замена деталей и удаление системы
На протяжении левожелудочкового обхода отмечался дисбаланс провоспалительных цитокинов. Характер отклонений TNF-, IL-6 и IL-8 в разные периоды мониторинга имел свои особенности, сопряженные с иммунологическим и клиническим статусом. Так, в 1-2 сутки (рис.7.(I)) после подключения ЛЖО отмечалось повышение уровня IL-6, и IL-8, соответствующее активации нейтрофилов с повышением адгезивных их свойств, а также HLA-DR+кл., В-лимфоцитов, ЦИК, характерное для адаптационной реакции.
Нарушением периода реадаптации после ЛЖО можно считать быстрое развитие 2-й фазы СВР, которая проявлялась резким падением количественных показателей клеточного иммунитета (так называемый «иммунный паралич») уже на 4-е сутки после ЛЖО с нарастанием сывороточных уровней TNF- и IL-6, и сохраняющейся неустойчивой гемодинамикой. Резкий подъем IL-6 уже на 5 сутки после ЛЖО, сохраняющийся в последующие 7-10 дней, характерен для развития ранней ПОН как результат генерализации СВР, связанной с активацией инфекции, чаще представленной Гр-флорой без бактериемии.
Эти нарушения являлись сигналом к назначению иммунокоррегирующей терапии, направленной на сдерживание выработки провоспалительных цитокинов, и нормализации, в первую очередь, клеточного иммунитета.
Повышение количества В-лф., IgM, HLA-DR+кл., адгезии нейтрофилов с нарастанием сывороточного уровня IL-8 и TNF- совпадало с появлением на 13-19 сутки ЛЖО лихорадки неясной этиологии, что было расценено как обострение очагов хронической инфекции (в первую очередь – трахеобронхиты, хронические пневмонии и др.) и требовало детального клинико-иммунологического обследования.
К концу 1-го месяца (рис.7.(II)) подключения ЛЖО возрастала опасность, так называемого, «эндокардита систем МПК» в результате распространения инфекции по поверхностям магистралей и деталей системы. В этот период помимо усиления антибактериальной терапии необходимо проведение бактериологического и иммунологического мониторинга и иммунокоррекции.
Замена магистралей или нарушения работы деталей системы МПК и возникающие при этом нарушения гемодинамики сопровождались высокими сывороточными уровнями TNF- и IL-6 (рис.7.(III)), клиническими проявлениями инфекции и органной дисфункции. При удалении ЛЖО показатели цитокинов нормализуются (рис.7.(IV)).
Таким образом, показано, что цитокины с провоспалительным действием (IL-6, IL-8, TNF-) при вспомогательном кровообращении являются ключевыми параметрами прогнозирования тяжести осложнений не только в ранние сроки после подключения, но и на протяжении всего периода левожелудочкового обхода насосом «Биопамп».
Выявлена сопряженность динамики цитокиновых параметров с нарастанием продукции HLA-DR АГ моноцитами (таб.4), отражающая функциональную активность моноцитарно-макрофагального звена в ответ на инфекцию с формированием очага воспаления и органных дисфункций (1 фаза СВР). Снижение этих параметров и нарастание уровня «противовоспалительных» цитокинов приводило к иммунодепрессии и клеточной анергии (2 фаза СВР).
Такие иммунологические показатели, как уровень ЦИК, апоптоза лимфоцитов (CD95+кл.), молекул адгезии (CD11b) могут свидетельствовать об активации бактериальной инфекции. При ПОН была выявлена сопряженность Т-клеточной иммунодепрессии с повышением сывороточных уровней IL-6, TNF-, а также инактивацией моноцитов и снижением Тh-рецепции к IL-2. Эти параметры были использованы при иммунологическом обследовании в критические периоды активации инфекции и развития ПОН при вспомогательном кровообращении.
Таким образом, результаты проведенных исследований позволили установить закономерности иммунного реагирования при ВАБК и ЛЖО, отобрать информативные параметры для оценки риска развития и тяжести послеоперационных осложнений, определить оптимальные сроки проведения
Таблица 4.
Иммунологические параметры фазы СВР, активации инфекции и развития ПОН
| Тип патологии | Иммунологические параметры |
| Системная воспалительная реакция | IL-1, IL-6, IL-8, TNF- Оксидазная активность нейтрофилов Продукция HLA DR АГ моноцитами |
| Активация инфекции | Тh-2, IgМ, В-лимфоциты, CD 11b+кл., >TNF->IL-6 |
| Развитие ПОН | Т-клеточная иммуносупрессия, инактивация моноцитов, снижение рецепции к IL-2, повышение IL-6, TNF- |
иммунологического мониторинга и направленность иммуномодулирующей терапии.
II. Оценка цитокинового статуса у кардиохирургических больных с клиническими проявлениями полиорганной недостаточностии и септических осложнений.
На втором этапе исследована сопряженность между цитокинами иммунной системы и параметрами клинического статуса и обоснована возможность использования цитокинов для прогнозирования послеоперационных осложнений.
- Клинико-иммунологический статус у кардиохирургических больных с осложненным послеоперационным периодом.
Изучение состояния клинического статуса у 35 кардиохирургических больных с использованием шкалы SOFA (рис.2.1.А) выявило нарушение функций практически всех основных органных систем, особенно иммунной системы, уже на 1-3 сутки после операции. Эти нарушения указывали на выраженность проявлений СПОН и сопутствующих ему общей воспалительной реакцией, более выраженной при развитии полиорганной недостаточности, чем у больных с органными дисфункциями (рис.2.1.В).
Суммарный балл по шкале SOFA в группе больных с СПОН был выше (p<0,05), чем в группе СПОД (11,8±0,5 и 7,7±0,3 баллов соответственно).
* - <0,05 при межгрупповом сравнении, ^ - p<0,05 по сравнению с донорами
Рис. 8. Выраженность полиорганных нарушений (А) и количественные показатели СВР (В) у кардиохирургических больных с осложненным ранним послеоперационным периодом
Для оценки системного воспаления бактериальной этиологии использовался высокоспецифичный маркер - прокальцитонин (ПКТ). В группе больных со СПОД только в 5% случаев тест на ПКТ был положительным и не превышал 10 нг/мл. У 28% больных группы содержание ПКТ в сыворотке крови было выше 0,5 нг/мл, у 7% - превышал 10 нг/мл, что инфекционных осложнений в раннем послеоперационном периоде.
- Оценка цитокинового статуса и прогностического значения цитокиновых параметров у кардиохирургических больных с осложненным послеоперационным периодом.
Сравнительный анализ содержания цитокинов разных групп у здоровых доноров и кардиохирургических больных с осложненным послеоперационным течением до и после комплексного лечения представлен в табл. 5 и 6.
Таблица 5.
Сывороточные уровни про- и противовоспалительных цитокинов у кардиохирургических больных с осложненным послеоперационным периодом до и после комплексной терапии (n=25)
| Осложнения | Провоспалительные цитокины | Противо-воспалительные цитокины | ||||||
| IL-6 (пг/мл) | IL-8 (пг/мл) | TNF- (пг/мл) | IL-1Ra (пг/мл) | |||||
| До | После | До | После | До | После | До | После | |
| СПОН (n=10) | 60 ^ 51-73 | 55 ^ 10-188 | 38 ^ 34-47 | 697 * ^ 81-2153 | 1,3 ^ 0-2,3 | 4,5 * ^ 0,4-11 | 310 ^ 240-420 | 168 * 150-330 |
| СПОН + сепсис (n=8) | 75 ^ 62-87 | 63 ^ 15-160 | 108^ 64-139 | 1343 * ^ 89-4366 | 1,6 1,1-2 | 5,6 * 0,9-6,1 | 427 ^ 350-570 | 220 * 145-260 |
| СПОН + сепсис + септ. шок (n=7) | 110 ^ 87-134 | 310 * ^ 163-859 | 118 76-154 | 1250 * 128-2194 | 2,8 2,4-3,5 | 4,3 1,5-9,6 | 1340 ^ 870-1900 | 876 * ^ 485-1150 |
| Доноры (n=20) | 3,3 (2,8-4,5) | 1,8 (1,4-2,2) | 18 (16-21) | 150 (100-250) | ||||
* - <0,05 при межгрупповом сравнении, ^ - p<0,05 по сравнению с донорами
Комплексная оценка сывороточных уровней 13 основных цитокинов традиционным иммуноферментным анализом (IL-1Rа и G-CSF) и Bio-Plex-технологией, показала, что в отличие от здоровых доноров у больных со СПОН, тяжелым сепсисом и септическим шоком отмечался достоверно более высокий уровень противовоспалительных цитокинов IL-1Rа и IL-10 (p<0,05).
Кроме того, у больных регистрировалось значительное увеличение концентрации мультифункционального цитокина IL-6, который, как известно, на начальных этапах септического процесса вместе с IL-1 индуцирует острофазный ответ, но в последующем в большей степени проявляет свои противовоспалительные и иммуносупрессорные свойства.
При этом не обнаружено повышение содержания провоспалительных; цитокинов (IL-l, TNF-, IL-12). Более того, отмечалось их снижение (средний уровень этих цитокинов находился на нижней границе чувствительности метода).
Таблица 6.
Сывороточные уровни регуляторных цитокинов у кардиохирургических больных с осложненным послеоперационным периодом до и после комплексной терапии (n=25)
| Осложнения | Th1- цитокины | Th2- цитокины | ||||||
| IL-2 (пг/мл) | IFN- (пг/мл) | IL-4 (пг/мл) | IL-10 (пг/мл) | |||||
| До | После | До | После | До | После | До | После | |
| СПОН (n=10) | 0,5 ^ 0-0,7 | 6 * ^ 0-15 | 15 ^ 13-17 | 15 ^ 0-30 | 5,5 ^ 4-6,5 | 6 ^ 0-26 | 8 ^ 7-8,7 | 2,6 * ^ 1-3,5 |
| СПОН + сепсис (n=8) | 0 | 0 | 4,8 ^ 4-5,2 | 2,6 * ^ 0-9,4 | 0 | 0 | 8,5 ^ 7,6-9 | 4,5 * 1-15 |
| СПОН + сепсис + септ. шок (n=7) | 0,4 ^ 0-0,8 | 2,1 * ^ 0-11 | 10,2 ^ 8-12 | 10,5 ^ 4-13 | 0,5 ^ 0-1,6 | 4,4 * ^ 0-12 | 45 ^ 32-57 | 77 * ^ 8-326 |
| Доноры (n=20) | 1,4 (1-16) | 23 (13-27) | 1,3 (1,1-1,5) | 4,3 (3,8-5,1) | ||||
Примечание: «0» - результаты ниже чувствительности BioPlex технологии. * - <0,05 при межгрупповом сравнении, ^ - p<0,05 по сравнению с донорами
При анализе сывороточных уровней регуляторных Th1 и Th2 – цитокинов (IFN-, IL-2 и IL-4, IL-5 соответственно) также выявлено их снижение, т.е. выявленные дисфункции Т-клеточного звена при сепсисе являются общими как для Тh1- так и Тh2-лимфоцитов, а скорее обусловлены пребыванием их в состоянии анергии.
Содержание в сыворотке крови хемокина IL-8 у больных также достоверно превышало контрольные уровни (p<0,05). Отмечалась сопряженность повышенных уровней противовоспалительных цитокинов (IL-1Ra, IL-6 и IL-10) и хемокина (IL-8) с тяжестью послеоперационных осложнений (СПОН, тяжелый сепсис, септический шок) (SOFA – 11,8±0,5, 13,0±1, 17,5±2,1 баллов соответственно).
При септическом шоке до лечения были резко повышены не только уровни пртивовоспалительных цитокинов, но и TNF- с одновременным повышением уровня CD95+кл., экспрессирующих маркер апоптоза. Отмечалось также нарастание уровня IL-1 и регуляторного IL-2, что свидетельствовало о цитокиновом дисбалансе с преобладанием иммунодепрессии (коэффициент иммунодепрессии IL-1Ra/TNF- > 10).
Комплексная оценка уровней 13 основных цитокинов с использованием ИФА и новой современной и Bio-Plex технологии показала, что развивитие глубокой иммунодепрессии на фоне снижения функций жизненно важных органов и систем может служить прогнозом развития септических осложнений и подтверждает необходимость включения заместительной иммунокоррекции в комплексное лечение кардиохирургических больных после искусственного и вспомогательного кровообращения.
Результаты оценки цитокинового статуса у больных после комплексной терапии (таб. 5 и 6) показали восстановление баланса про- и противовоспалительных цитокинов (коэффициент иммунодепрессии IL-1Ra/TNF- < 10). Активация функции нейтрофилов с повышением их антигенпрезентирующей способности может запускать активацию Тh1, приводя к балансу Th1/Тh2. При этом отмечается достоверное повышение (p<0,05) уровней хемокина IL-8 и провоспалительных цитокинов IL-6, IL-1, TNF-, снижающих иммунодепрессию, обусловленную противовоспалительными цитокинами, что расценивалось как благоприятный прогноз. Восстановление цитокинового баланса сопровождалось разрешением синдрома полиорганной недостаточности (сумма балов по SOFA снижалась с 11,8±0,5 до 6,8±1,9 баллов; p <0,05). У больных с септическим шоком прогноз оставался неблагоприятным.
Таким образом, полученные данные показали, что цитокиновый дисбаланс является одним из ключевых показателей развития и исхода послеоперационных осложнений и подтверждает необходимость разработки нового алгоритма иммунологического мониторинга и повышения его информативности путем включения цитокиновых параметров.
III. Оценка информативности алгоритма комплексного иммунологического мониторинга у кардиохирургических больных при искусствнном и вспомогательном кровообращении.
При проведении комплексного иммунологического мониторинга были выявлены отклонения количественных и функциональных параметров в разных звеньях иммунной системы, которые могут использоваться для прогнозирования развития и тяжести течения послеоперационных осложнений (рис.9.).
Так, уже в процессе и на раннем этапе после искусственного и вспомогательного кровообращения оправданным являлось определение состояния врожденного и приобретенного иммунитета по соотношению нейтрофилов и мононуклеаров для оценки истощения адаптационных резервов и антимикробного потенциала.

Рис. 9. Схема алгоритма комплексного иммунологического мониторинга
I – Клеточный иммунитет. II – Гуморальный иммунитет, III – Система фагоцитов, IV – Про- и противовоспалительные цитокины, V – Регуляторные цитокины, VI – Дополнительные обследования.
Резкая лимфопения в 1-е сутки (<1200109/л) и снижение уровня активированных моноцитов (CD14+DR+ < 30%) была сопряжена с развитием инфекционных осложнений на 3-6 сутки после операции. Перед развитием полиорганной недостаточности наблюдалось снижение иммунорегуляторного индекса (CD4+/CD8+ < 1, при N – 2,8-3,0). Снижение CD4+Т-хелперов менее 30% приводило к резкому дисбалансу Th1/Th2 иммунного ответа, сопровождающемуся снижением продукции регуляторных цитокинов IL-2 и IFN-. Преобладание противовоспалительных цитокинов IL-1Ra, IL-6, IL-10 усиливало суммарную супрессию иммунного ответа и приводило к цитокиновому дисбалансу, развитию септических осложнений и полиорганной недостаточности. Повышение CD25+кл., экспрессирующих рецептор к IL-2, и пролиферативного ответа лимфоцитов свидетельствовало о нарастании воспалительной реакции, тогда как их снижение было сопряжено с развитием иммунодепрессии и анергии.
Повышение информативности комплексного многокомпонентного исследования иммунной системы с использованием разработанного алгоритма иммунологического мониторинга позволило в одном и том же образце периферической крови одномоментно получить данные о: 1 – выраженности адаптационных и компенсаторных реакций и степени интоксикации; 2 – типе и степени вторичной иммунной недостаточности клеточного, гуморального звена и системы фагоцитов; 3 – степени активации параметров разных звеньев иммунитета и антигенпрезентирующих клеток; 4 – состоянии цитотоксического звена иммунитета; 5 – состоятельности антимикробного потенциала; 6 – готовности клеток иммунной системы к апоптозу; 7 – степени оксидазной активности нейтрофилов; 8 – состоянии системы цитокинов; 9 – клеточной анергии и депрессии иммунного ответа, а также 10 – индивидуальной чувствительности иммунокомпетентных клеток к действию иммуномодуляторов в тестах in vitro.
Таким образом, оценка результатов иммунологического мониторинга подтверждает высокую информативность разработанного алгоритма, включающего регуляторные, про- и противовоспалительные цитокины, который позволяет оценить дисфункции иммунной системы, выявляемые как на уровне межклеточных взаимодействий, так и на уровне взаимосвязей между звеньями иммунной системы.
ВЫВОДЫ:
- Исследование цитокинового статуса у больных с нарастающей сердечной недостаточностью в дооперационном периоде позволило выявить наличие функционального типа иммунодефицита, проявляющегося: дисбалансом цитокинов с про-, противовоспалительным и регуляторным действием, преобладанием повышенных уровней IL-1, IL-8, G-CSF и IL-2 у 26%, 28%, 54%, и 80% больных соответственно, а также компенсаторным нарастанием IL-1Ra – эндогенного регулятора воспаления.
- В процессе искусственного кровообращения и в раннем послеоперационном периоде выявлены основные варианты цитокиновых реакций, определяющих тип органных дисфункций, характер и выраженность которых, зависит от тяжести дооперационного иммунодефицита и исходной степени сердечной недостаточности. Подтверждена двухфазная динамика развития системной воспалительной реакции после искусственного кровообращения: повышение уровней провоспалительных цитокинов в первой фазе и сменой их на противовоспалительные цитокины с развитием иммунодепрессии и клеточной анергии во второй фазе, а также ключевая роль IL-1Ra в сдерживании гиперактивации системной воспалительной реакции на протяжении искусственного кровообращения и в раннем послеоперационном периоде.
- Наиболее информативными цитокиновыми параметрами в условиях вспомогательного кровообращения являются IL-6, IL-8, TNF-, которые в сочетании с клеточными показателями иммунной системы позволили выявить прогностически значимые периоды для проведения иммунологического мониторинга, контроля за выраженностью компенсаторных реакций и прогнозирования послеоперационных осложнений.
- Выявленная сопряженность между цитокинами иммунной системы (IL-1Ra, IL-6, IL-8, IL-10, TNF-) и параметрами клинического статуса кардиохирургических больных является основанием для использования цитокиновых параметров в прогнозировании послеоперационных осложнений и тяжести их течения.
- Усовершенствован алгоритм иммунологического мониторинга путем применения сочетанной оценки фенотипического состава клеточных (апоптоз, иммунорегуляторные субпопуляции лимфоцитов), фагоцитарных (моноциты, оксидазная активность нейтрофилов) показателей иммунитета и цитокиновых параметров (IL-1Ra, IL-2, IL-4, IL-6, IL-8, IFN-, TNF-), отражающих взаимосвязь между отдельными звеньями иммунной системы.
- Проведение комплексного иммунологического мониторинга с использованием усовершенствованного алгоритма позволило повысить его информативность в прогнозировании послеоперационных осложнений при искусственном и вспомогательном кровообращении.
Практические рекомендации
- Начинать иммунологический мониторинг у больных с нарастающей сердечной недостаточностью следует уже на этапе предоперационной подготовки для раннего выявления цитокинового дисбаланса, предопределяющего развитие послеоперационных осложнений.
- У кардиохирургических больных, оперированных в условиях искусственного и вспомогательного кровообращения, прогнозирование тяжести и контроль за разрешением послеоперационных осложнений рекомендуется проводить с использованием разработанного алгоритма иммунологического мониторинга, включающего сочетанную оценку цитокинового дисбаланса и нарушений параметров клеточного звена иммунитета, характеризующих апоптоз и иммунорегуляцию.
- Выявление цитокинового дисбаланса, наряду с тяжелыми клеточными дисфункциями иммунной системы, является показанием к проведению иммунокорригирующей терапии, основанной на индивидуальном подборе иммуномодуляторов.
Список работ, опубликованных по теме диссертации:
- Сускова В.С., Шальнев Б.И., Шумаков Д.В., Сусков С.И. и др. Иммунологический мониторинг для прогнозирования и лечения инфекционных осложненй при вспомогательном и искусственном кровообращении // Ж. «Мед. иммунология», 2000, Т.2, №2, С.198-199.
- Хитрик Н.М., Тельнюк Я.И., Сусков С.И. и др. Критерии прогнозирования инфекционных осложнений у кардиохирургических больных // Ж. «Мед. иммунология», 2002, Т.4, №2, стр.164.
- Tolpekin V.E., Suskova V.S., Shumakov D.V., Suskov S.I. et al. Intraaortic contrpulsation balloon pump (IABP) in elderly patients. (clinic-immunological aspects), XXXI Congress ESAO, Warshaw, Poland, 2004, p.97.
- Сускова В.С., Ермакова Л.П. Сусков С.И. и соавт. Обоснование показаний к иммунокоррекции у больных ИБС старшего возраста при баллонной контрпульсации, 2005 // III Всероссийский съезд по трансплантологии и искусственным органам, Вестник трансплантологии и искусственных органов, 2005, №3, стр.48.
- Shumakov V.I., Suskova V.S., Tolpekin V.Е., Suskov S.I. et al. Immunocorrection during intraaortic contrpulsation balloon pump (IABP) application in elderly patients with ischemic heart disease // 2005, Italy, 11 th European Congress on extra-corporeal circulation technology, p.57.
- Ермакова Л.П., Сускова В.C, Шумаков Д.В., Сусков С.И. и др. Влияние превентивной баллонной контрпульсации на развитие СВР и протвоинфекционный потенциал у кардиохирургических больных // XI Всероссийский съезд сердечно-сосудистых хирургов, Бюл. НЦССХ, 2006, Т.3, стр.273.
- Шумаков В.И., Сускова В.С., Емец В.И., Ермакова Л.П., Сусков С.И. и др. Тактика иммунодиагностики и иммунокоррекции на разных этапах лечения больных при операциях на сердце // Вестник трансплантологии и искусственных органов, 2006, №4, С.55-61.
- Matveev Yu. G., Suskova V.S., Suskov S.I. et al. Cardiopulmonary bypass with leukocyte filter: reduction in the systemic inflammatory response syndrome // 7-th Symposium of World artificial organ, immunology and Transplantation society (Waits). Russia., St.-Petersburg, 2006, p.59-60.
- Shumakov V.I., Suskova V.S., Tolpekin V.Е., Suskov S.I. et al. Clinico-Immunological Aspects of Intraaortic Contrpulsation (IABP) Application Elderly Patients With Ischemic Heart Disease // 7-th Symposium of World artificial organ, immunology and Transplantation society (Waits). Russia., St.-Petersburg, 2006, p.95-96.
- Козлова М.Н., Попцов В.Н., Сускова В.С., Лютов А.Г., Шумаков Д.В., Сусков С.И. и др. Клинико-иммунологическое обоснование применения внутривенного иммуноглобулина G-Габриглобин у больных с синдромом полиорганной недостаточности после операций с искусственным кровообращением.//Вестник трансплантологии и искусственных органов.-2008. - № 6 (44).- С. 34-39.
- Сускова В.С., Емец В.И., Ермакова Л.П., Сусков С.И., Козлова М.Н. Оценка индивидуальной чувствительности иммуномодуляторов у кардиохирургических больных при осложненном послеоперационном периоде // Объедененный иммунологический форум., 2008, Российский иммунологический журнал, 2008, Т.2(11), №№2-3, стр.319.
- Сускова В.С., Быстрых О.А., Емец В.И., Сусков С.И., Ермакова Л.П., Козлова М.Н. Сопряженность развития послеоперационных осложнений с иммунной недостаточностью у кардиохирургических больных // Национальная конференция «Аллергология и клиническая иммунология – междисциплинарные проблемы», Москва, 2008, Российский аллергологический журнал. Прилож-е 1, Материалы конференции, М., 2008, №1, С.287-288.
- Сускова В.С., Емец В.И., Ермакова Л.П., Козлова М.Н., Сусков С.И., Попцов В.Н., Шумаков Д.В., Семеновский М.Л., Казаков Э.Н. Ранняя диагностика иммунных нарушений и их коррекция в лечении полиорганной недостаточности и септических осложнений после операций с искусственным и вспомогательным кровобращением // Вестник трансплантологии и искусственных органов, 2009, Т.9, №7, С.57-64.
- Сусков С.И., Ермакова Л.П., Козлова М.Н., Сускова В.С., Шумаков Д.В., Попцов В.Н. Фагоцитарно-цитокиновый мониторинг в раннем периоде после ОТТС для контроля за развитием септических осложнений // Вестник трансплантологии и искусственных органов, 2009, Т.11, прилож-е, С.105-106.
- Сускова В.С., Шемакин С.Ю., Сусков С.И., Ермакова Л.П., Кормер А.Я., Шумаков Д.В., Пестрецова Т.В. Состояние иммунной системы при вспомогательном кровообращении с помощью системы искусственных желудочков сердца «EXCOR» в период ожидания трансплантации сердца // Вестник трансплантологии и искусственных органов, 2010, Т.12, С.181-182.
- Сусков С.И., Шумаков Д.В., Сускова В.С., Ермакова Л.П., Попцов В.Н., Кормер А.Я., Шемакин С.Ю., Пестрецова Т.В. Оптимизация клинико-иммунологического мониторинга для прогнозирования послеоперационных осложнений при трансплантации сердца // Вестник трансплантологии и искусственных органов, 2010, Т.12, С.183-184.
СПИСОК ОСНОВНЫХ СОКРАЩЕНИЙ И УСЛОВНЫХ ОБОЗНАЧЕНИЙ
АГ – антиген
АКШ – аорто-коронарное шунтирование
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
АФП – абсолютный фагоцитарный показатель
БВО – бивентрикулярный обход
ВАБК – внутриаортальная баллонная контрпульсация
ВИД – вторичный иммунодефицит
ВК – вспомогательное кровообращение
ГСО – гнойно-септические осложнения
ДКМП – дилятационная кардиомиопатия
ИБС – ишемическая болезнь сердца
ИК – искусственное кровообращение
ИРИ – иммунорегуляторный индекс
ИС – индекс стимуляции
ИФА – иммуноферментный анализ
ЛЖО – левожелудочковый обход
ЛЗХЛ – люминолзависимая хемилюминесценция
МКАТ – моноклональные антитела
МПК – механическая поддержка кровообращения
НК – нарушение кровообращения
НСТ – нитрозолий синий тест
ОАР – отделение анестезиологии и реанимации
ОД – органные дисфункции
ОТТС – ортотопическая трансплантация сердца
ПОН – полиорганная недостаточность
ПКК – пркальцитонин
ППС – приобретенные пороки сердца
ПЭГ – полиэтиленгликоль
ЦИК – циркулирующие иммунные комплексы

