Экстракорпоральная гемокоррекция в комплексном лечении печеночной недостаточности
На правах рукописи
АЛЕКСАНДРОВА
ИРИНА ВЛАДИМИРОВНА
ЭКСТРАКОРПОРАЛЬНАЯ ГЕМОКОРРЕКЦИЯ
В КОМПЛЕКСНОМ ЛЕЧЕНИИ ПЕЧЕНОЧНОЙ НЕДОСТАТОЧНОСТИ
14.00.37 – Анестезиология и реаниматология
14.00.27 – хирургия
Автореферат диссертации
на соискание ученой степени
доктора медицинских наук
Москва – 2009
Работа выполнена в Научно-исследовательском институте скорой помощи им.Н.В.Склифосовского Департамента здравоохранения Москвы
Научные консультанты: Доктор медицинских наук, профессор
Евгений Александрович Евдокимов
Член-корреспондент РАМН,
доктор медицинских наук, профессор
Александр Сергеевич Ермолов
Официальные оппоненты: Член-корреспондент РАМН,
доктор медицинских наук, профессор
Борис Романович Гельфанд
Доктор медицинских наук, профессор
Михаил Борисович Ярустовский
Доктор медицинских наук, профессор
Александр Михайлович Фомин
Ведущая организация – Российский научный центр хирургии им.Б.В.Петровского РАМН
Защита состоится «____»___________2009г. в ____ часов на заседании Диссертационного Совета Д 850.010.01 при Научно-исследовательском институте скорой помощи им.Н.В.Склифосовского по адресу: 129010, г.Москва, Большая Сухаревская площадь, д.3
С диссертацией можно ознакомиться в научной библиотеке НИИ скорой помощи им.Н.В.Склифосовского.
Автореферат разослан «__________________» 2009 г.
Ученый секретарь Диссертационного Совета,
доктор медицинских наук, профессор А.А.Гуляев
Сокращения, используемые в диссертации
АД – артериальное давление
АД сред. – среднее артериальное давление
АлД – альбуминовый диализ
АЛТ – аланиновая аминотрансфераза
АСТ – аспарагиновая аминотрансфераза
ГГТП – гаммаглютаматтранспептидаза
ГРС – гепаторенальный синдром
ИВЛ – искусственная вентиляция легких
Ig – иммуноглобулин
ЛДГ - лактатдегидрогеназа
ЛО – лист ожидания трансплантации печени
МАРС – молекулярная адсорбирующая рециркулирующая система
ОПечН – острая печеночная недостаточность
ОТП – операция трансплантации печени
ПА – плазмаферез
ПБЦ – первичный билиарный цирроз
ПВВГФ – продленная вено-венозная гемофильтрация
ПН – печеночная недостаточность
ПСХ – первичный склерозирующий холангит
РИ – резистивный индекс
РФП – радиофармпрепарат
СПОН – синдром полиорганной недостаточности
ФПН – фульминантная печеночная недостаточность
ЦИК – циркулирующие иммунные комплексы
ЦП – цирроз печени
ЩФ – щелочная фосфатаза
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Проблема лечения печеночной недостаточности сохраняет свою актуальность и в наши дни, являясь одной из важных и сложных проблем медицины. Отмечается тенденция к значительному росту заболеваемости, в частности острыми вирусными гепатитами и алкогольной болезнью печени (Хазанов А.И.,2003; Майер К.П.,2004; Ивашкин В.Т. и Маевская М.В.,2007). Существующая в настоящее время стандартная медикаментозная терапия (СМТ) направлена на возможность спонтанной регенерации при острых поражениях печени, а также на лечение осложнений и профилактику дальнейшего прогрессирования заболевания у пациентов с хронической печеночной недостаточностью (Хазанов А.И. 1998,2006; Иваников И.О., 2003; Радченко В.Г.,2005; Майер К.П.,2004). Печень является единственным органом организма, не только по обилию функций, но и, в первую очередь, обладающим уникальной возможностью регенерации и функциональной реабилитации. (Starzl T., Bell R., Beart R. et al. 1975, Цирульникова О.М., 2004).
Несмотря на определенные успехи современной интенсивной терапии, летальность пациентов при острой печеночной недостаточности, или острой декомпенсации хронической печеночной недостаточности, остается неприемлемо высокой и не снижается ниже 60%, даже в специализированных гепатологических центрах (Kamath P.S.,et al.,2001; Kim W.R., Braun R.S., 2002; D, Amigo G., et al., 2006). По данным Всемирной организации здравоохранения (ВОЗ) среди причин смерти, печеночная недостаточность стабильно занимает шестое место (Kamath P.S.,2001; Cardenas A., et al., 2005; D, Amigo G., et al., 2006).
Причиной высокой летальности являются осложнения, присоединяющиеся по мере прогрессирования основного заболевания и приводящие к развитию полиорганной недостаточности, в терминальной стадии хронического диффузного заболевания печени. Декомпенсация хронических заболеваний печени часто ассоциируется с полиорганной дисфункцией, включающей гемодинамическую нестабильность, развитие почечной и церебральной дисфункции, что приводит к высокому риску летального исхода (Буеверов А.О., Маевская М.В.,2005; Bulterwarth R.F.,2000;
Strkureja W.,et al.,2005; D, Amigo G., et al., 2006; Kamath P.S., Kim W.R.,2007).
У пациентов с фульминантной печеночной недостаточностью и терминальной стадией хронических заболеваний печени стандартная медикаментозная терапия оказывается неэффективной (O, Gready J.G.,1989 Gotthardt D.,2007). Надежды и успехи современной гепатологии во многом связаны со значительным прогрессом современной медицины, и, в первую очередь, с возможностью выполнения операции трансплантации печени, безнадежным ранее пациентам. Однако и этот метод лечения, из-за недостатка донорских органов, или длительного времени ожидания операции, не может обеспечить всех нуждающихся пациентов.
Нарушение синтетической, метаболической и детоксицирующей функции печени при ее поражении приводит к накоплению различных токсических субстанций, таких как аммиак, медиаторы оксидативного стресса, желчные кислоты, оксид азота, лактат, продукты метаболизма арахидоновой кислоты, эндогенные бензодиазепины, индолы, меркаптаны, воспалительные цитокины. В результате развиваются системные поражения – нарушения циркуляции, приводящие к гипертоническому типу кровообращения, коагуляционные и иммунологические расстройства. В дополнение имеет место вторичное поражение печени вследствие избытка воспалительных медиаторов и метаболитов оксидативного стресса, что приводит к клинической манифестации полиорганной дисфункции с последующим присоединением септических осложнений. Этот сложный патогенез порождает различные теоретические и патофизиологические подходы к восстановлению функции печени при печеночной недостаточности (Mitzner S., Stange J., 1996; Kramer L., Gendo A., 1997; Matsubara S., Okabe K., 1990; Kapatanoglu L., Brei A.N., 2000; Evenepoel P.W., et al., 2005).
Удаление из циркуляторного русла патологических метаболитов, воспалительных факторов и вазоактивных субстанций возможно только при использовании экстракорпоральной гемокоррекции. (Jalan R., Williams R.,2002; Stange J., et al., 2002; Davenport A., 2003; Evenepoel P.W., et al.,2005).
Создание и использование, искусственных систем поддержки функции печени, является основной идеей современной интенсивной терапии пациентов с печеночной недостаточностью, позволившей снизить летальность с 85% до 60%. (Kim W.R., Brown R.S., 2002; Wilmer A., et al., 2002; Isoniemi H., et al., 2005;Laleman W., et al., 2006; Ronco C., 2007)
За последние 20 лет опубликовано немало исследований использования методов экстракорпоральной гемокоррекции в лечении печеночной недостаточности как острой, так и хронической. Сведения литературы противоречивы, в основном основаны на анализе результатов лечения малочисленных и разнородных групп пациентов. Работы, оценивающие комплексное применение различных методов экстракорпоральной детоксикации в доступной литературе отсутствуют, традиционно большинство гепатологических клиник в нашей стране, придерживается консервативной тактики ведения пациентов. Существуют разногласия в определении лечебной тактики при тяжелых поражениях печени, особенно при фульминантном варианте течения заболевания. До сих пор нет единого мнения об эффективности плазмафереза и продленной гемофильтрации при тяжелых поражениях печени.
Таким образом, неуклонный рост числа пациентов с печеночной недостаточностью, неоднозначность подходов в вопросах лечебной тактики и неудовлетворительные результаты лечения определяют необходимость дальнейшей разработки клинических аспектов данной патологии. Появление современных гемопроцессоров и аппаратов искусственной поддержки основных функций печени, достижения трансфузиологии и реаниматологии, новые технологии в хирургии печени позволяют изучать проблему лечения печеночной недостаточности с новых позиций и на современном уровне.
Создание в 2000 году в НИИ скорой помощи им. Н.В.Склифосовского Центра трансплантации печени предоставило уникальную возможность использования современных методов экстракорпоральной гемокоррекции в комплексном лечении печеночной недостаточности как на этапе ведения пациентов в период ожидания трансплантации печени, так и в случае осложненного течения послеоперационного периода.
Цель исследования
Улучшение результатов лечения печеночной недостаточности путем включения в комплексную терапию экстракорпоральных методов гемокоррекции.
Задачи исследования
- Провести оценку эффективности лучевых методов в диагностике ранних признаков синдрома портальной гипертензии при печеночной недостаточности.
- Определить изменения иммунного статуса в зависимости от степени тяжести печеночной недостаточности.
- Оценить эффективность плазмафереза в коррекции иммунологических и гипокоагуляционных нарушений в комплексном лечении печеночной недостаточности.
- Провести оценку эффективности использования продленной вено-венозной гемофильтрации в лечении гепаторенального синдрома.
- Оценить эффективность альбуминового диализа при острой и хронической печеночной недостаточности.
- Провести оценку использования альбуминового диализа в лечении дисфункции печеночного трансплантата в разные сроки посттрансплантационного периода.
- Определить тактику использования методов экстракорпоральной гемокоррекции в лечении острой и хронической печеночной недостаточности.
Научная новизна.
Впервые в отечественной практике обосновано, доказано и внедрено в клиническую практику раннее применение экстракорпоральной гемокоррекции в комплексной терапии острой и фульминантной печеночной недостаточности, в том числе, при развитии дисфункции печеночного трансплантата у реципиентов, перенесших операцию трансплантации печени, а также при декомпенсации хронических диффузных заболеваний печени, что позволило предупредить развитие полиорганной недостаточности и значительно улучшить результаты комплексного лечения больных.
Показано, что комплексное использование плазмафереза, методов заместительной почечной терапии и альбуминового диализа повышает шансы на выживаемость, ранее считавшихся бесперспективными пациентов, продлевая время, необходимое для поиска донорского органа для трансплантации.
Выявлено выраженное корригирующее влияние плазмафереза на изменения в системе гемостаза и иммунитета при тяжелой печеночной недостаточности, за счет быстрого и эффективного удаления из циркуляции плазменных активаторов гемостаза, продуктов распада фибриногена, а также избытка циркулирующих иммунных комплексов всех классов и функционально неполноценных иммуноглобулинов, преимущественно классов А и G. Помимо известного детоксикационного эффекта плазмафереза, показана его высокая эффективность в купировании цитолитического и холестатического синдромов.
Показана высокая эффективность использования продленной вено-венозной гемофильтрации в улучшении центральной и внутрипочечной гемодинамики, коррекции гипонатриемии и водного баланса при лечении резистентного асцита и гепаторенального синдрома.
Определены показания и оптимальные параметры проведения альбуминового диализа при острой, декомпенсации хронической печеночной недостаточности и дисфункции печеночного трансплантата. Выявлено, что высокоэффективное удаление из плазмы водорастворимых и альбуминсвязанных токсинов, способствует уменьшению выраженности синдромов цитолиза и воспаления, улучшению синтетической функции печени, регрессу энцефалопатии и купированию органной дисфункции.
Показано, что раннее проведение альбуминового диализа у пациентов с острой печеночной недостаточностью и первичной дисфункцией печеночного трансплантата позволяет избежать развития фульминантного течения заболевания и полиорганной недостаточности, существенно улучшая исходы лечения.
Патогенетически обосновано использование экстракорпоральной гемокоррекции, включающей плазмаферез с целью коррекции иммунных и гипокоагуляционных нарушений, продленную вено-венозную гемофильтрацию при развитии гепаторенального синдрома и альбуминовый диализ, в качестве искусственной поддержки основных функций печени, позволяющей значительно улучшить клиническое состояние пациентов и увеличить выживаемость в период ожидания донорского органа для выполнения операции трансплантации печени.
Предложен алгоритм использования методов экстракорпоральной гемокоррекции в лечении острой и хронической печеночной недостаточности.
Практическая значимость работы
- Предложены объективно обусловленные принципы интенсивной терапии печеночной недостаточности различной степени тяжести, включающие раннюю лучевую диагностику повреждения печени и почек, нарушения гемодинамики, изменения иммунологических параметров, а также показания для включения в комплексную терапию методов экстракорпоральной гемокоррекции.
- Включение в комплексную терапию плазмафереза позволяет уменьшать выраженность синдромов цитолиза и внутрипеченочного холестаза, улучшает иммунный статус и временно стабилизирует гемокоагуляционные нарушения.
- Использование продленной вено-венозной гемофильтрации способствует восстановлению функции почек и нормализует водно-электролитные нарушения у пациентов с хроническими диффузными заболеваниями печени, осложненными развитием резистентного асцита и гепаторенального синдрома II типа.
- Раннее проведение альбуминового диализа у пациентов с острой печеночной недостаточностью и первичной дисфункцией печеночного трансплантата позволяет избежать развития фульминантного течения заболевания и полиорганной недостаточности, существенно улучшая исходы лечения.
- Использование альбуминового диализа в качестве поддерживающей терапии у пациентов с декомпенсацией хронической печеночной недостаточности и при развитии поздней дисфункции трансплантата печени приводит к значительному уменьшению выраженности синдромов цитолиза и холестаза, регрессу энцефалопатии, восстановлению гемодинамики, позволяя выиграть время для спонтанной регенерации печени или поиска донорского органа для трансплантации.
- Применение предложенной тактики и схемы оптимальных методов экстракорпоральной гемокоррекции, таких как, плазмаферез, продленная вено-венозная гемофильтрация и альбуминовый диализ, в комплексной терапии печеночной недостаточности, в том числе, у реципиентов, находящихся в листе ожидания трансплантации печени позволяет значительно улучшить клиническое состояние пациентов и увеличить выживаемость.
Основные положения, выносимые на защиту
- Развитие печеночной недостаточности сопровождается формированием синдрома портальной гипертензии, ранние признаки которого отмечаются при остром поражении печени на 1-й неделе заболевания и выявляются методами лучевой диагностики: радионуклидной сцинтиграфией печени и ультразвуковой допплерографией.
- В иммунном статусе пациентов с циррозом печени класса А клеточное звено соответствует значениям физиологической нормы, имеются нарушения факторов естественной резистентности, связанные с дисбиотическими нарушениями, а также изменения гуморального звена, обусловленные нарушением метаболической функции печени. По мере развития заболевания и переходу пациентов из класса В в класс С, к нарушениям гуморальной составляющей, присоединяется недостаточность клеточного звена иммунной системы за счет увеличения доли цитотоксических Т-лимфоцитов, развития лимфопении и снижения иммунорегуляторного индекса.
- Плазмаферез обладает выраженным иммунокорригирующим действием на параметры гуморального звена иммунитета при циррозе печени как класса В, так и класса С, за счет значительной и стойкой элиминации из плазмы циркулирующих иммунных комплексов всех классов и избытка иммуноглобулинов, преимущественно классов А и G.
- Плазмаферез способствует поддержанию баланса в свертывающей и противосвертывающей системах и уменьшает риск гипокоагуляционного кровотечения, за счет быстрого и эффективного удаления из циркуляции продуктов распада фибрина и плазменных активаторов гемостаза, с последующей коррекцией, с использованием свежезамороженной донорской плазмы, являющейся источником факторов свертывания.
- Продленная вено-венозная гемофильтрация при печеночной недостаточности, осложненной резистентным асцитом и гепаторенальным синдромом, помимо снижения уровня мочевины и креатинина, приводит к повышению среднего артериального давления, снижению центрального венозного давления и вазодилятации почечных артерий, корригирует гипонатриемию и водный баланс, увеличивает скорость клубочковой фильтрации и восстанавливает диурез.
- Альбуминовый диализ позволяет уменьшать выраженность синдрома цитолиза и воспалительной активности, нормализует неврологический статус при печеночной недостаточности, вследствие детоксикационного эффекта процедуры, совмещающей элиминацию водорастворимых токсинов за счет гемофильтрации и токсинов связанных с альбумином, благодаря адсорбции на колонках с углем и анионобменной смолой.
- Увеличение активности сывороточной холинэстеразы и уровня протромбина, стабильный уровень сывороточного альбумина, указывают на значимое улучшение синтетической функции печени при включении в комплексную терапию печеночной недостаточности альбуминового диализа.
- Комплексное использование плазмафереза, продленной гемофильтрации и альбуминового диализа позволяет полностью восстанавливать функцию печени при острой печеночной недостаточности, функциональный статус органа до декомпенсации при хронических диффузных заболеваниях печени, стабилизирует и поддерживает состояние пациента в период ожидания донорского органа для трансплантации, способствует восстановлению функции трансплантата.
Внедрение результатов работы
Основные положения проведенных исследований внедрены в клиническую практику отделения лечения острых эндотоксикозов, реанимационных отделений и Центра трансплантации печени Научно-исследовательского института скорой помощи им.Н.В.Склифосовского, а также используются в практической работе медицинских учреждений г.Москвы (Информационное письмо №3, М,-2004, «Возможности ортотопической трансплантации печени при лечении больных с терминальными поражениями печени»).
Результаты диссертационной работы используются в лекционном и учебном материале, на семинарских и практических занятиях учебно-клинического отдела НИИ СП им.Н.В.Склифосовского (Методические материалы «Печеночная энцефалопатия», М.2004.22с.), кафедры трансплантации и искусственных органов ГОУ ВПО МГМСУ (Московского государственного медико-стоматологического университета) Росздрава и кафедры неотложной и общей хирургии РМАПО.
Апробация работы
Основные материалы исследования доложены и обсуждены на:
- Московском городском семинаре «Диагностика, клиника и лечение острой печеночной недостаточности». Москва 1998г,
- I и II Съезде токсикологов России, Москва, 1998 и 2004,
- 4, 5 и 6 международных конференциях «Актуальные аспекты экстракорпорального очищения крови в интенсивной терапии», Москва, 2004, 2006 и 2008 год,
- «Неотложная медицина в мегаполисе», Москва, 2004, 2005, 2006, 2007 г.,
- XLIII Конгрессе Европейской ассоциации диализа и трансплантации в Глазго (Великобритания, 2005г.).
- Конференции «Актуальные вопросы анестезиологии и реаниматологии», Москва 2005 год,
- Московском городском семинаре «Актуальные вопросы донорства и трансплантации органов», Москва 2003 и 2007г.
- Российском съезде реаниматологов и анестезиологов, Москва, 2006г,
- шестой Московской ассамблее «Здоровье столицы», Москва 2007г.
- IV Всероссийском съезде трансплантологов, Москва 2008г.
Публикации
По теме диссертации опубликовано 57 печатных работ, в виде статей и тезисов в журналах, сборниках трудов конференций, съездов, симпозиумов, в том числе 9 статей в ведущих научных журналах, рекомендованных ВАК РФ для диссертации на соискание ученой степени доктора медицинских наук, а также 4 публикации в зарубежной печати.
Объем и структура диссертации
Диссертационная работа изложена на 230 страницах машинописного текста и состоит из списка сокращений, введения, обзора литературы, шести глав собственных исследований, заключения, выводов, практических рекомендаций, библиографического указателя. Библиографический указатель включает 290 источников, их них 239- иностранные авторы. Работа иллюстрирована 24 рисунками и 54 таблицами.
СОДЕРЖАНИЕ РАБОТЫ
Общая характеристика больных и методов исследования
В работе проведен анализ комплексного клинико-лабораторного обследования и лечения 336 пациентов с острой и хронической печеночной недостаточностью, находившихся на лечении в отделении и реанимации острых эндотоксикозов Научно-исследовательского института скорой помощи имени Н.В.Склифосовского за период с 2003 по 2007 год.
Из 336 пациентов было 180 мужчин (54%) и 156 женщин (46%). Возраст пациентов колебался от 15 до 65 лет. Средний возраст составил 36,4±16,7 лет.
Таблица 1.
Распределение больных по полу и возрасту в зависимости от этиологии печеночной недостаточности
| Этиология ПН | Кол-во больных | муж | жен | Средний возраст |
| Алкогольный ЦП | 93 | 65 | 28 | 49,42±10,19 |
| Вирусный ЦП | 94 | 63 | 31 | 46,85±10.94 |
| Аутоиммунный ЦП | 18 | 2 | 16 | 39,29±12,9 |
| ПБЦ | 23 | 23 | 47,5±6,7 | |
| ПСХ | 16 | 10 | 6 | 35,45±10,76 |
| Криптогенный ЦП | 17 | 3 | 14 | 42,27±15,13 |
| Б-нь Вильсона | 15 | 5 | 10 | 27,42±6,54 |
| ОПН/ФПН | 46 | 24 | 22 | 36,1±16,5 |
| Дисфункция трансплантата | 14 | 8 | 6 | 41,8±14,5 |
| Всего | 336 | 180 | 156 | 36,4±16,7 |
Все обследованные пациенты, как с острой, так и с декомпенсацией хронической печеночной недостаточности, относились к трудоспособному возрасту и являлись потенциальными кандидатами для постановки в лист ожидания трансплантации печени.
276 пациентов с циррозом печени различной этиологии составили группу декомпенсированной хронической печеночной недостаточности. Наиболее частой причиной развития цирроза печени явилось вирусное поражение выявленное у 94 пациентов; из них основное место занимал вирус гепатита С – 54 пациента, вирусом гепатита В было инфицировано 22 пациента и комбинация HBV+HDV у 18 пациентов. Мужчины составили 67% (n=63), женщины 33% (n=31).
93 пациента старшей возрастной группы, имели алкогольный цирроз печени. В этой группе было 69,9% мужчин (n=65) и 30% женщин (n=28). Аутоиммунный цирроз печени имел место у 18 пациентов – у 2 мужчин и 16 женщин, преимущественно молодого возраста. Первичный билиарный цирроз печени и первичный склерозирующий холангит, относящиеся к аутоиммунным поражениям печени, диагностирован у 23 и 16 пациентов соответственно. Группу ПБЦ составили женщины среднего возраста 47,5±6,7 лет, из 16 пациентов с ПСХ было 10 мужчин (62,5%) и 6 женщин (37,5%) среднего возраста 35,45±10,76 лет. Не удалось установить этиологию цирроза печени у 17 пациентов, 3-х мужчин и 14 женщин, они составили группу пациентов с криптогенным ЦП. Самый молодой возраст (27,42±6,54 лет) у 15 пациентов: 5 мужчин и 10 женщин с болезнью Вильсона-Коновалова.
Для определения степени тяжести цирроза печени использовали шкалу прогностических критериев Чайлд-Пью (Child-Pugh)
Таблица 2
Степень тяжести цирроза печени по классификации Child-Pugh в зависимости от этиологии
| Этиология ЦП | Кол-во б-х | Класс А | Класс В | Класс С |
| Алкогольный | 93 | 9 | 40 | 44 |
| Вирусный | 94 | 13 | 38 | 43 |
| Криптогенный | 17 | 0 | 6 | 11 |
| Аутоиммунный | 18 | 5 | 6 | 7 |
| ПБЦ | 23 | 5 | 11 | 7 |
| ПСХ | 16 | 1 | 5 | 10 |
| Б-нь Вильсона | 15 | 5 | 4 | 6 |
| Всего | 276 | 38 | 110 | 128 |
| В % | 100% | 14 % | 40 % | 46 % |
| Баллы | 5,54±0,5 | 8,02±0,87 | 11,71±1,33 |
38 пациентов имели степень тяжести соответствующую классу А, 110 – классу В и 128 - классу С. Таким образом 86% исследуемых пациентов имели длительно протекающее субкомпенсированное или декомпенсированное диффузное заболевание печени и рассматривались как потенциальные реципиенты на операцию трансплантации печени.
Степень тяжести по шкале MELD составляла в среднем 21,4±6,1 балла, органная недостаточность по шкале SOFA – 7,58±2,79 балла.
Вторую группу составили 60 пациентов с острой печеночной недостаточностью и дисфункцией печеночного трансплантата. Острая печеночная недостаточность, различной этиологии, в том числе с фульминантным течением, отмечалась у 46 пациентов: 24-х мужчин и 22-х женщин. Средний возраст мужчин составил 40 (15-62) лет, женщин – 31,8 (19-60) лет.
Наиболее частой причиной развития острой печеночной недостаточности явился острый алкогольный гепатит - 37% случаев (n=17). На втором месте, по частоте встречаемости, острое лекарственное поражение печени – 24% (n=11).
Острые отравления у 11 пациентов (24%), 8 из 11 с отравлением грибами и 3 с отравлением хлорированными углеводами. Дебют болезни Вильсона-Коновалова, в виде развития фульминантной печеночной недостаточности, у 2-х пациенток, им была выполнена ОТП по экстренным показаниям. Одна пациентка с фульминантным течением острого вирусного гепатита В, один пациент после массивной резекции печени, у одного пациента ОПечН возникла вследствие сепсиса, у одного – массивного гемолиза эритроцитов и этиология острой печеночной недостаточности у 1 пациентки осталась неизвестной.
Степень органной дисфункции по шкале SOFA составляла в среднем 8,5±3,6 балла.
Острая печеночная недостаточность, вследствие дисфункции трансплантата после перенесенной ОТП у 14 пациентов: 8 мужчин и 6 женщин, средний возраст которых был 41,8 лет (от 19 до 64), при этом средний возраст мужчин –35,8 лет, женщин – 47,7 лет. Первичная дисфункция трансплантата имела место у 6 пациентов, хроническая дисфункция – у 8. Степень тяжести по шкале MELD – 18,2±2,6 балла, по шкале SOFA – 7,64±5,3 балла.
На момент завершения работы в Центре трансплантации печени НИИ СП им.Н.В.Склифосовского было выполнено 78 операций трансплантации печени; 59 реципиентов из 78 проходили обследование перед постановкой в лист ожидания ТП и получали поддерживающую терапию в отделении лечения острых эндотоксикозов.
Из 78 выполненных операций трансплантации печени, 4 ретрансплантации в связи с развитием тяжелой печеночной недостаточности вследствие дисфункции трансплантата, выполненные через 4, 6, 10 и 12 месяцев после первой операции.
Методы исследования
Диагноз острой или хронической печеночной недостаточности, а также оценка тяжести состояния и эффективности проводимой терапии в динамике основывались на основании комплексного анализа клинических, лабораторных и инструментальных данных обследования.
Пациенты обследованы по единому плану, который, предусматривал всестороннее клиническое, лабораторное и инструментальное обследование при поступлении в стационар, до и после проведения методов экстракорпоральной гемокоррекции.
Клиническое обследование включало возраст пациента, жалобы, анамнез заболевания, срок госпитализации, сопутствующие заболевания, осложнения и физикальные данные: наличие желтухи, гипотонии, олигурии, признаков портальной гипертензии, печеночной энцефалопатии, желудочно-кишечного кровотечения.
Определение степени тяжести ЦП проводилось в соответствии с классификацией по Child-Pugh, и шкале MELD - математической модели конечной стадии заболеваний печени, включающей оценку билиарной системы, функции почек и свертывающей системы крови. Степень тяжести органной дисфункции оценивали по шкале SOFA. Степень энцефалопатии - по критериям West Haven.
Лабораторная диагностика включала данные клинического исследования клеточного состава периферической крови и биохимическое исследование сыворотки крови отражающее функциональное состояние печени и почек: концентрация общего белка и фракций, общего билирубина, конъюгированной и неконъюгированной фракций, мочевины, креатинина, активности сывороточных цитолитических (аланиновая трансаминаза, аспарагиновая трансаминаза), холестатических (щелочная фосфотаза, -глутамилтранспептидаза), протеолитических (общая амилаза) ферментов, холинэстеразы, аммиака и желчных кислот, электролитного состава и КЩС, уровень С-реактивного белка. Все клинические и биохимические методы исследования выполнялись в клинико-диагностических лабораториях НИИ СП им Н.В. Склифосовского по унифицированным методикам.
Исследование свертывающей системы крови проводилось на коагулометре «St 4, Stago La Roche» (Франция). Оценка иммунной системы включала определение количественного и функционального состояния клеточного, гуморального и фагоцитарного звеньев.
Основным инструментальным методом верификации диагноза и динамического контроля течения заболевания и эффективности проводимой терапии, являлась лучевая диагностика, включающая рентгенографическое, ультразвуковое и радионуклидное исследования.
В плановом порядке, а при возникновении желудочно-кишечного кровотечения – экстренно, выполняли эзофагогастродуоденоскопию. 16 пациентам выполнено склерозирование и 5 лигирование варикозно-расширенных вен пищевода.
Лечение печеночной недостаточности определялось этиологией, активностью воспалительного или некротического процесса, осложнениями и сопутствующими заболеваниями. Печеночно-клеточная недостаточность, угроза кровотечения из варикозно расширенных вен пищевода и желудка, а также отечно-асцитический синдром служили показанием к проведению комплексной терапии, включающей методы экстракорпоральной гемокоррекции.
Консервативная терапия проводилась с момента поступления пациента в стационар и продолжалась на фоне применения методов экстракорпоральной гемокоррекции.
При сохраненной мочевыделительной функции почек с целью выведения из организма низкомолекулярных и водорастворимых токсических метаболитов и для коррекции водно-электролитных нарушений, гипопротеинемии, факторов плазменного гемостаза проводили инфузионно-трансфузионную терапию и форсированный диурез по общепринятой методике.
При установке катетера в центральную вену, для проведения инфузионно-трансфузионной терапии и для обеспечения сосудистого доступа, при экстракорпоральной гемокоррекции, а также для уменьшения образования токсинов и аммиака в толстой кишке назначались антибиотики. Препаратами выбора являлись цефалоспорины III поколения, ципрофлоксацин, ванкомицин. Антибиотикотерапия всегда проводилась при потенциальном риске развития у пациента гнойно-септических осложнений (резистентный асцит, гидроторакс, состоявшееся кровотечение из варикозно-расширенных вен пищевода).
Для снижения содержания в кишечнике аммиака и других токсических веществ белкового происхождения, а также с целью усиления перистальтики кишечника и ускоренного выведения из организма токсических веществ назначали раствор лактулозы (дюфалак, нормазе) внутрь по 30-50 мл ежедневно.
При выраженных клинических проявлениях печеночной энцефалопатии наряду с препаратами лактулозы вводимыми per rectum (300 мл на 700 мл воды), использовали внутривенное введение препарата Гепа-Мерц, с последующим переходом на пероральное применение..
Для связывания в желудочно-кишечном тракте эндотоксинов и с целью коррекции явлений дисбиоза кишечника, при повышении титров антител к условно патогенной флоре, пациентам проводилось лечение энтеросорбентами, с последующим назначением эубиотиков. Для восстановления и сохранения структуры гепатоцитов и клеточных мембран, нормализации внутриклеточного метаболизма применяли антиоксидантную и мембраностабилизирующую терапию с использованием -токоферола, витаминов группы В, С, гептрала, эссенциальных фосфолипидов.
С целью профилактики развития эрозивного поражения слизистой верхних отделов желудочно-кишечного тракта использовали блокаторы протонной помпы (омез, омепразол), антацидные препараты.
Лечение отечно-асцитического синдрома включало ограничение потребления натрия и жидкости, диуретическую терапию, сочетающую спиронолактон и салуретики, неэффективность которых требовала проведения абдоминального парацентеза с одновременной инфузией 10% раствора альбумина.
Лечение кровотечения из варикозно-расширенных вен пищевода основывалось на двух основных принципах - медикаментозном снижении давления в портальной системе (-блокаторы, нитраты, вазопрессин, соматостатин или его аналог октреатид) и проведении облитерации варикозных узлов. При остром кровотечении использовали прямую тампонаду кровоточащих сосудов путем постановки зонда Блекмора.
Коррекция гемостаза осуществлялась введением свежезамороженной плазмы, трансфузией отмытых эритроцитов, криопреципитата, раствором аминокапроновой кислоты.
У всех пациентов осуществлялась коррекция нарушений белкового обмена, гипопротеинемии и аминокислотного дисбаланса. Использовали сбалансированные аминокислотные растворы с преобладанием аминокислот с разветвленной цепью (Аминоплазмаль-Гепа, Гепасол А, Аминостерил-Гепа).
Пациентам с выраженным холестатическим синдромом, в комплексную терапию включали холеретические препараты (урсофальк, урсосан).
Для коррекции анемии в комплексную терапию включали препарат железа Венофер в комплексе с эритропоэтином и витамином В12. При неэффективности стандартной медикаментозной терапии, в комплексное лечение включали методы экстракорпоральной гемокоррекции.
Комплексная терапия пациентов с печеночной недостаточностью включала следующие методы экстракорпоральной гемокоррекции: плазмаферез (ПА), продленную вено-венозную гемофильтрацию (ПВВГФ) и альбуминовый диализ (АлД) с использованием MARS. Для осуществления адекватного кровотока во время проведения экстракорпоральной гемокоррекции использовался двухпросветный рентгеноконтрастный катетер 11 Fr, установленный по методу Сельдингера в центральной вене (внутренней яремной, подключичной или бедренной).
Плазмаферез проводили по двум методикам: фильтрационным или дискретным способом. При проведении фильтрационного ПА, для сепарации крови на плазму и форменные элементы, применяли аппарат «Prisma» фирмы Gambro (Швеция) с использованием комплекта «TPE-2000» или плазмафильтр «Plasmaflux P 2S» фирмы Fresenius (Германия). При дискретном фракционировании, кровь пациента (400-500 мл) собирали в специальные полиэтиленовые мешки с антикоагулянтом, затем кровь фракционировали на центрифуге фирмы « Jouan». После ее разделения форменные элементы смешивали с физиологическим раствором хлорида натрия и внутривенно возвращали больному. Во время ПА, для предотвращения экстракорпорального свертывания крови, применяли непрерывное введение гепарина в дозе 30-50 ед/кг час. В ряде случаев, учитывая выраженные нарушения гемокоагуляции, у пациентов с печеночной недостаточностью, антикоагулянты не использовали.
Показанием для проведения плазмафереза у больных с диффузными заболеваниями печени считали нарастание гипербилирубинемии и холестатического синдрома (повышение уровня билирубина и его фракций, ферментов холестаза), синдрома цитолиза (повышение активности трансаминаз), нарушение в свертывающей системе крови с развитием гипокоагуляционного синдрома, нарушения иммунологических показателей (гипериммуноглобулинемию, повышение циркулирующих иммунных комплексов, особенно средних и малых).
Длительность процедуры плазмафереза составляла два часа, скорость кровотока - 90-120 мл/мин. Скорость удаления плазмы и введения замещающего раствора- 800-120 мл\час. Объем эксфузированной плазмы, в зависимости от веса пациента, и исходного уровня общего белка, составлял за одну процедуру от 1000 до 2000 мл, в среднем 1027±210 мл (от 0,5 до 1,5 объема циркулирующей плазмы, что составляло 30-40 мл на кг веса).
Пациентам с фульминантным течением печеночной недостаточности ПА проводили с интервалом в 12-24 часа, при циррозе печени, в зависимости от темпа прироста общего билирубина и уровня ферментов холестаза, ПА повторяли через 48-72 часа.
Продленную вено-венозную гемофильтрацию (ПВВГФ) и гемодиафильтрацию (ПВВГДФ) выполняли на гемопроцессоре «Prizma» (Gambro, Швеция) с использованием комплектов «Prisma-M 100 Pre». Использовали цитратную антикоагуляцию (Anticoagulant Citrate dextrose A-ACD-A) со скоростью 3-8 мл/час, с контролем уровня ионизированного кальция и дополнительным введением 5-20 мл 10% раствора глюконата кальция в сутки, либо антикоагулянты не применяли.
В качестве замещающего раствора использовались стандартные стерильные бикарбонатные полиионные электролитные растворы Prismasol 2 или Prismasol 4 фирмы Gambro. Процедуры проводили в следующем режиме: 3-5 сессий ПВВГФ с интервалом в 1,5-3 дня, в зависимости от нарастания веса больного, темпа диуреза и азотемии. Продолжительность лечения составляла
- 12-24 часа.
- Скорость кровотока- 100-180 мл/мин, поток замещающего раствора-1000-2500 мл\час,
скорость ультрафильтрации 100-300 мл/час, дефицит ультрафильтрата за процедуру составлял 1500-2000 мл.
Альбуминовый диализ (АлД) с использованием Молекулярной Адсорбирующей Рециркулирующей Системы (МАРС).
Молекулярная адсорбирующая рециркулирующая система - экстракорпоральная система для поддержания функции печени, посредством адсорбции и диализа, с использованием в качестве диализата 20% донорского альбумина. Перфузия крови осуществляется внутри капилляров гемофильтра с полисульфоновой непроницаемой для молекул альбумина (величина пор мембраны пропускает мелкие и средние молекулы до 50 кД) высокопоточной мембраной (MARS FLUX 1 s, Gambro, Sweden). Контур МАРС содержит 600,0 мл 20% донорского альбумина (в нашем исследовании фирм Bayer и Baxter) и включает второй фильтр с полисульфоновой низкопоточной мембраной (diaFLUX 1 s, Gambro, Sweden) и два адсорбирующих картриджа: первый
картридж содержит 102 г активированного древесного угля без покрытия (diaMARS AC 250, Gambro, Sweden), второй картридж содержит 240 г анионобменной смолы (diaMARS IE 250, Gambro, Sweden). Адсорбирующие картриджи никогда не оказываются в прямом контакте с кровью пациента и служат для регенерации донорского альбумина. Диализный контур соединяется с аппаратом гемодиализа.
По градиенту концентрации происходит диффузия токсических субстанций через полупроницаемую мембрану из крови в наружный альбуминовый контур, принимающий на себя токсины. Через мембрану проходят субстанции с малой и средней молекулярной массой до 50 кДа.
Далее, за счет постоянной рециркуляции через обычный гемофильтр, и 2 картриджа, осуществляется регенерация связывающей способности насыщенного токсинами донорского альбумина.
Процедура альбуминового диализа проводилась с использованием монитора MARS в комплексе с гемопроцессором Prismа и АИП Integra фирмы «Gambro». Скорость кровотока и скорость альбуминового диализа во время процедуры составляла 100-120 мл\мин. Скорость бикарбонатного диализа 300 мл\мин (Integra) и 2000 мл/час (Prismа). Продолжительность одной сессии составляла 8 часов. Использовалась цитратная антикоагуляция со скоростью 2-6 мл/час.
Результаты, полученные при исследовании, обработаны вариационно-статистическим методом по t-критерию Стъюдента. Рассчитывали среднюю арифметическую (Х), среднее квадратичное отклонение (SD), значение t-критерия и уровень значимости различий (р). Учитывая небольшое число наблюдений в группах, использовали непараметрические методы Манна-Уитни и Колмогорова-Смирнова. Различия считали статистически достоверными, если уровень значимости был р<0,05.
Статистическая обработка результатов исследования выполнена на персональном компъютере с использованием программы Statistica 6.0.
Результаты собственных исследований.
При поступлении в стационар 298 пациентов из 336 (89%), за исключением 38 пациентов с циррозом печени класса А находились в тяжелом или крайне тяжелом состоянии, о чем свидетельствовали высокие значения баллов по шкале органной дисфункции SOFA и индекса MELD. Все пациенты с циррозом печени имели сформировавшийся синдром портальной гипертензии. 40% пациентов класса В и 75% класса С имели асцит. Гепаторенальный синдром был диагностирован у 23% больных, 42% пациентов класса С и 8% класса В имели признаки нарушения гемодинамики почек, выявленные при УЗ допплерографии; у 6% при поступлении определялся гидроторакс. Варикозное расширение вен пищевода отмечалось у 73%.
При радионуклидном исследовании определялся повышенный захват радиоколлоида левой долей печени до 38%, селезенкой до 70 % и костным мозгом до 40%, количественные показатели увеличивались по мере прогрессирования заболевания, достигая 60-70% для селезенки и 30-40% для костного мозга у пациентов класса С.
Достоверное преобладание радиоколлоида в селезенке и костном мозге пациентов с циррозом печени классов В и С, в отличие от пациентов с острым поражением печени свидетельствовал о сформировавшимся синдроме портальной гипертензии, нарастающем по мере прогрессирования процесса. Увеличение индекса печеночно-почечной артериальной перфузии у пациентов с ЦП указывало на тяжелую степень синдрома портальной гипертензии и соответствовало клиническим проявлениям в виде варикозного расширения вен пищевода 2-3 степени, наличию резистентного к диуретической терапии асцита, а также формированию гепаторенального синдрома.
Комплексное исследование показателей иммунной системы проведено у 128 пациентов с печеночной недостаточностью, из них 20 пациентов имели ОПечН и 108 пациентов - ЦП.
Показатели иммунограммы, отражающие состояние клеточного звена иммунитета у пациентов с циррозом печени класса А по шкале Child-Pugh, соответствовали значениям физиологической нормы. У больных класса В наблюдалось снижение иммунорегуляторного индекса за счет увеличения доли цитотоксических Т-лимфоцитов. Прогрессирование процесса и нарастание симптомов интоксикации у пациентов класса С приводило к недостаточности клеточного звена иммунитета за счет развития лимфопении и снижения иммунорегуляторного индекса.
В иммунном статусе больных с циррозом печени класса А были выявлены нарушения факторов естественной резистентности, связанные с дисбиотическими нарушениями, а также изменения гуморального звена иммунитета, обусловленные нарушением метаболической функции печени. Со временем, по мере развития заболевания, и переходу пациентов из класса В в класс С, к нарушениям гуморальной составляющей, присоединяется недостаточность клеточного звена иммунной системы.
Плазмаферез был выполнен 105 пациентам с печеночной недостаточностью, проведена 321 процедура, что в среднем составило 5,1±0,8 на пациента при острой печеночной недостаточности и 3,25±0,5 при декомпенсации хронической печеночной недостаточности.
Перед проведением плазмафереза проводилась активная инфузионная терапия с целью коррекции гипопротеинемии и гипоальбуминемии, стабилизации гемодинамических показателей и онкотического давления, а так же профилактики развития кровотечений, включающая 10% и 20% растворы альбумина, свежезамороженной плазмы и кристаллоидные растворы. Общий объем инфузионной терапии составлял 800-1500 мл.
Учитывая выраженное нарушение белково-синтетической функции печени, проявляющееся снижением уровня общего белка, альбуминов, диспротеинемии, дефицитом факторов гемостаза, замещение осуществляли растворами свежезамороженной донорской плазмы и 20% раствором альбумина в соотношении 3:1 или 1:1, соответственно, из расчета 30-40 мл на кг массы тела.
Осложнения процедур плазмафереза отмечались крайне редко, аллергические реакции в виде крапивницы отмечались при проведении 21 процедуры из 307, что составило 6,8%. Гипотония, при проведении 23 процедур, что составило 7,5%.
Все осложнения были купированы медикаментозно и не требовали прекращения процедур плазмафереза.
При оценке эффективности плазмафереза как в группе хронической так и в группе острой печеночной недостаточности, уровень общего белка и сывороточного альбумина достоверно не менялся в процессе процедуры. Отмечалось достоверное снижение уровня общего билирубина в среднем на 25,8±12,9% от исходной величины за процедуру. Снижение общего билирубина происходило за счет достоверного уменьшения двух фракций. Уровень неконъюгированного билирубина снижался в среднем на 33,2±14% от исходного уровня. Конъюгированная фракция билирубина уменьшалась в среднем на 16,8±9,6% за процедуру. У пациентов с острой печеночной недостаточностью уменьшение содержания билирубина отмечалось сразу после окончания плазмафереза, в течение 16-24 часов показатели повышались вновь на 20-25 % и оставались достоверно выше исходных, что требовало ежедневного проведения процедуры. Данная динамика имела место после каждой процедуры плазмафереза при фульминантном течении печеночной недостаточности и указывала на прогрессирование некробиотического процесса; каждый следующий сеанс оказывался менее эффективным, чем предыдущая процедура. У таких пациентов после проведения ПА на фоне улучшения гемореологических и коагуляционных параметров в комплексную терапию включали другие методы экстракорпоральной гемокоррекции, например альбуминовый диализ.
У пациентов с ЦП класса В содержание общего билирубина имело стойкую тенденцию к снижению от процедуры к процедуре, уменьшаясь в среднем на 27-35% и достигая нормальных значений к 10-14 суткам терапии, эффект достигался проведением 2-3 сеансов плазмафереза. При циррозе печени класса снижение уровня билирубина происходило более медленно, и на 2-3-и сутки после проведенного лечения содержание билирубина вновь возрастало на 15-20%. Быстрый рост сывороточного уровня содержания билирубина и нарастание явлений холестаза на фоне проведения плазмафереза расценивалось нами как критерий неблагоприятного прогноза.
Отмечалось достоверное снижение активности цитолитических ферментов в плазме, при этом у пациентов класса В и класса С активность АСТ и АЛТ снижалась на 25-32%, в то время как в группе пациентов с острой печеночной недостаточностью на 40%. У пациентов с ЦП, острым лекарственным и острым алкогольным гепатитом, при синдроме внутрипеченочного холестаза, после сеансов ПА достоверно уменьшался уровень ферментов холестаза: ЩФ в среднем на 23±5,6%, ГГТП – на 28±7,3%. Уровень ЛДГ у пациентов с хронической печеночной недостаточностью имел тенденцию к нормализации, в отличие от пациентов с острой печеночной недостаточностью, у которых ЛДГ при проведении плазмафереза достоверно снижалась на 44% от исходного уровня.
Проведение плазмафереза приводило к достоверному снижению концентрации иммуноглобулинов класса А у пациентов класса В и С с 6,2±0,5 г/л до 5,3±0,4 г/л и 4,7±0,3 до 3,6±0,2 соответственно; иммуноглобулинов класса G с 15,1±0,5 г/л до 12,5±0,3 г\л в классе В и с 17,6±0,8 до 14,8±0,7 г/л в классе С. Иммуноглобулины класса М, превышающие физиологическую норму, имели тенденцию к нормализации – с 3,3±0,1г/л до 2,9±0,2г/л у пациентов класса В и с 2,8±0,2 до 2,4±0,1 г/л у пациентов класса С. Достоверно уменьшалось содержание циркулирующих иммунных комплексов всех классов: сумма ЦИК с 455,0±141 до 346±111 (р=0,0001) у пациентов класса В и с 642±28,3 до 475±25,8 у пациентов класса С, малые иммунные комплексы снижались на 26% у пациентов класса В и на 34%, у пациентов класса С; средние – на 30% в классе В и на 24%, в классе С. Наиболее эффективно элиминировали большие циркулирующие иммунные комплексы.
При проведении ПА, у пациентов с фульминантным течением острой печеночной недостаточности, достоверно снижался показатель протромбинового времени по МНО в среднем на 45%, с 6,4±1,7 до 3,67±1,2, достоверно повышался уровень фибриногена с 1,26±0,5г/л до 2,0±0,4 г\л, нормализовалось АПТВ, достоверно снижаясь на 64%.
Значение протромбинового индекса по Квику, значительно сниженное по отношению к физиологической норме (на 78,5%) в среднем до 17,2±3.4%, достоверно возрастало в среднем до 28,4±5,3%, что составляло 64%.
На фоне проведения плазмафереза достоверно улучшались показатели противосвертывающей системы, так уровень протеина С возрастал с 37,5±18,6% до 73,7±12,4%, антитромбина III с 51,5±4,2% до 65,8±1,76%, фибринолитическая активность возрастала с 45,7±10,8 до 21,6±8,4 мин, что в среднем составляло 52%.
Таблица 3
Влияние плазмафереза на показатели гемостаза у пациентов с острой и хронической печеночной недостаточностью
| Показатели | Норма | Группы пациентов | До ПА | После ПА |
| Тромбоциты х109/л | 180-320 | ХПН | 173±65 | 177±93 |
| ОПН | 180,7±55 | 146,8±49 | ||
| Протромбиновое время по МНО | <1,4 | ХПН | 3,1±0,85 | 2,9±0,91 |
| ОПН | 6,4±1,7 | 3,67±1,2* | ||
| Фибриноген г/л | 1,8-3,5 | ХПН | 1,1±0,62 | 1,3±0,87 |
| ОПН | 1,26±0,5 | 2,0±0,4* | ||
| АПТВ сек | 26-36 | ХПН | 72,6±14,4 | 49,2±8,7* |
| ОПН | 156±20,4 | 55,6±10,4* | ||
| Протромбиновое время по Квику % | >70 | ХПН | 49,9±7,4 | 60,1±4,3* |
| ОПН | 17,2±3,4 | 28,4±5,3* | ||
| Протеин С % | 70-140 | ХПН | 70,6±16,14 | 85,8±25,8 |
| ОПН | 37,5±18,6 | 73,7±12,4* | ||
| Антитромбин 3 % | 80-120 | ХПН | 77,8±5.1 | 85,4±6.7 |
| ОПН | 51,5±4,2 | 65,8±1,76 | ||
| Фибринолитическая активность мин. | 4-10 | ХПН | 23,2±4,8 | 14,9±2,6* |
| ОПН | 45,7±10,8 | 21,6±8,4* |
Примечание: * - различия достоверны (р<0,05).
Улучшение клинической симптоматики сопровождалось снижением склонности к кровоточивости слизистых оболочек, образованию подкожных гематом и петехий, у 2-х пациентов исчезли явления геморрагического цистита.
У пациентов с хронической печеночной недостаточностью (циррозом печени) плазмаферез так же оказывал корригирующее влияние на факторы свертывающей системы. Так на фоне проведения плазмафереза отмечена тенденция к снижению показателя протромбинового времени и достоверное увеличение показателя протромбинового индекса на 20% за одну процедуру. Однако такая динамика сохранялась в течение 3-х первых сеансов плазмафереза, достигнув определенного уровня, на 35-40% превышающий исходный до начала лечения, уровень и МНО и ПТИ стабилизировался и не менял своего значения в ходе дальнейшего использования плазмафереза. Уровень фибриногена имел тенденцию к увеличению с 1,1±0,62 до 1,3±0,87 г/л, что указывало на значительное угнетение синтетической функции печени, в отличие от пациентов с острой печеночной недостаточностью, у которых уровень фибриногена на фоне лечения увеличивался на 66%. Плазмаферез способствовал достоверному снижению АПТВ в среднем с 72,6±14,4 до 49,2±8,7 сек, что составляло 32%, в то время как при острой патологии печени мы наблюдали уменьшение на 64%, при этом ни в одной из групп АПТВ не достигал значений нормы.
При оценке влияния плазмафереза на показатели противосвертывающей системы нами отмечено, что уровень протеина С у пациентов с циррозом печени находится на нижней границе нормальных значений и остается стабильным в ходе всех процедур. При острой печеночной недостаточности содержание протеина С в два раза ниже нормы, а в ходе лечения плазмаферезом его уровень достоверно увеличивается на 90%, достигая нормальных значений. Антитромбин III оставался стабильным у пациентов с циррозом печени, составляя в среднем 77,8±5,1 % до плазмафереза и 85,4± 6,7% после. Фибринолитическая активность достоверно улучшалась у пациентов с циррозом печени на фоне проведения плазмафереза в среднем на 35%: с 23,2±4,8 мин. до 14,9±2,6 мин.
С целью лечения гепаторенального синдрома у пациентов, находящихся в листе ожидания трансплантации печени, мы использовали метод продленной вено-венозной гемофильтрации. Преимуществом продленной гемофильтрации перед стандартным диализом является возможность стабилизации гемодинамических параметров и постоянный контроль жидкостного баланса, а также элиминация вазоактивных субстанций и провоспалительных цитокинов.
Показанием к включению ПВВГФ в комплексную терапию являлась олигоанурия, нарушение жидкостного баланса, увеличение сывороточного уровня мочевины и креатинина, гипонатриемия.
Пациентам с ГРС II типа и резистентным к диуретической терапии асцитом, проведение ПВВГФ сочетали с выполнением парацентеза с последующей дробной эксфузией асцитической жидкости (до 3-5 литров в сутки, в течение 4-5 дней), и с ежедневными внутривенными инфузиями 20% раствора альбумина из расчета 8-10 г на каждый литр удаленной асцитической жидкости.
Таблица 4
Влияние ПВВГФ на биохимические показатели пациентов с печеночной недостаточностью.
| Показатели | До ПВВГФ | После ПВВГФ |
| Мочевина ммоль/л | 21,5±8,03 | 14,6±6,1* |
| Креатинин мкмоль/л | 204,4±98,7 | 147±80,8* |
| Натрий ммоль/л | 131,7±5,3 | 134,8±5,4* |
| Калий ммоль/л | 5,6±1,9 | 4,9±1,4 |
Проведение ПВВГФ приводило к достоверному снижению уровня мочевины и креатинина, отмечалось достоверное повышение содержания сывороточного натрия со 131,7±5,3 до 134,8±5,4 ммоль/л, после третьего сеанса содержание сывороточного натрия повышалось до 140,6±3,8 мэкв/л.
Отмечено улучшение системной гемодинамики на фоне проведения ПВВГФ: среднее артериальное давление в ходе проведения процедуры достоверно повышалось с 64±14,2 до 92±16,3 мм рт.ст. (р=0,000), уменьшалась тахикардия со 112±15,6 до 89±13,7 уд/мин (р=0,001), достоверно снижалось ЦВД с 20,1±1,6 до 12,3±0,9 мм водного столба. Из 23 процедур проводившихся с инотропной поддержкой катехоламинами, в 43% случаев дозы вводимых препаратов удалось снизить в течение ПВВГФ, а в последующем отменить совсем. У 8 пациентов с ФПН в связи с развитием стойкой гипотонии, потребовавшей значительного увеличения дозы инотропных препаратов, процедуру пришлось прекратить.
По данным ультразвукового допплерографического исследования в процессе проведения сеанса ПВВГФ у пациентов с ГРС отмечено достоверное улучшение гемодинамики почек, о чем говорит изменение резистивного индекса на уровне дуговых ветвей почечных артерий в среднем на 14% за одну процедуру и до 20% после проведения 3-х продленных вено-венозных гемофильтраций.
Таблица 5
Изменение ультразвуковых параметров на фоне проведения ПВВГФ
| Показатели | До ПВВГФ | После ПВВГФ |
| РИПА | 0,76±0,04 | 0,66±0,06 * |
| Размер почек мм | ||
| Длина | 117,5±1,5 | 109±1,5 * |
| Ширина | 53±0,6 | 48±0,5 * |
Примечание: * - различия достоверны (p<0,05).
После сеансов ПВВГФ по данным УЗИ отмечено уменьшение разобщения листков плевры в среднем с 2,4±0,5 см до 1,2±0,3 см, и уменьшение разобщения листков брюшины в среднем с 5,4±1,2 см до 3,5±0,7 см.
После проведения ПВВГФ у пациентов с ГРС 2 типа и резистентным асцитом на фоне нормализации водного баланса и снижения гипергидратации увеличивалась скорость клубочковой фильтрации почек с достоверным увеличением диуреза с 37±5,6 до 84,5±7,6 мл/час (р=0,03), что давало возможность уменьшить дозу диуретических препаратов.
Проведение ПВВГФ у пациентов с ПН и ГРС помимо основных эффектов, таких как нормализация уровня мочевины и креатинина, коррекция электролитных нарушений и водного баланса, способствует элиминации патогенных субстанций и вазоактивных медиаторов, синтез которых повышен, а утилизация значительно снижена при дисфункции печени. Именно эти эффекты процедуры приводят к стабилизации гемодинамики, улучшению почечного кровотока, вследствие вазодилятации почечных артерий, и нормализуют почечную дисфункцию, приводя к увеличению скорости клубочковой фильтрации и восстановлению диуреза.
Использование в комплексной терапии печеночной недостаточности таких методов экстракорпоральной гемокоррекции как плазмаферез и продленная вено-венозная гемофильтрация, позволяет стабилизировать клиническое состояние пациентов, прежде всего, за счет нормализации параметров гемостаза, иммунокоррекции и уменьшения почечной дисфункции.
В патогенезе развития печеночной, а в дальнейшем, полиорганной недостаточности, на сегодняшний день, ведущая роль принадлежит связанным с белками, и в первую очередь с альбумином, метаболическим субстанциям.
Единственным методом, позволяющим селективно элиминировать их из плазмы, в настоящее время, является альбуминовый диализ.
136 сессий альбуминового диализа были включены в комплексную терапию 57 пациентов с печеночной недостаточностью различной этиологии и степени тяжести.
Таблица 6
Сравнительная характеристика пациентов, получавших МАРС-терапию.
| Параметры | ФПечН | ОПечН | ОАГ | ЦП | ДТр |
| Количество больных | 10 | 10 | 6 | 17 | 14 |
| Возраст (год) | 36,5±11,4 | 31,7±10,9 | 42±9,65 | 41,5±12,1 | 41,5±9,75 |
| Пол, М/Ж | 9 / 1 | 7 / 3 | 6 / 0 | 10 / 7 | 8 / 6 |
| Количество сессий | 27 | 23 | 19 | 37 | 30 |
| Среднее кол-во сессий на 1 б-го | 2,7 | 2,3 | 3,2 | 2,2 | 2,1 |
| Исход лечения: | |||||
| ОТП | 2 | 0 | 0 | 2 | 4 |
| Выписаны | 1 | 10 | 6 | 2 | 2 |
| Летальность (%) | 7 (70%) | 0 | 0 | 13 (76,5%) | 7 (50%) |
| Выживаемость | 30% | 100% | 100% | 23,5% | 50% |
Группы достоверно не отличались по полу, возрасту и степени тяжести полиорганной дисфункции по шкале SOFA, а также степени тяжести цирроза печени по шкале Child-Pugh и индексу MELD.
Маркером альбуминсвязанных токсинов в нашем исследовании, служил общий билирубин сыворотки крови и его фракции.
Таблица 7
Уровень билирубина до и после альбуминового диализа
| ФПечН | ОПечН | ОАГ | ЦП | ДТр | |
| До АлД | 347±216 | 305±166 | 318±154 | 392±168 | 762±214 |
| После АлД | 270±161* | 278±160* | 254±122* | 299±135* | 562±177* |
| % снижения | 30,5±12 | 23±20,1 | 25,5±11 | 29,8±13,5 | 24,8±15,2 |
* - достоверность различий между началом и концом сессии, р<0,05
Уровень общего билирубина во всех группах до начала терапии был выше 300 мкмоль/л, достигая максимального значения у пациентов с дисфункцией печеночного трансплантата - 762 мкмоль/л. При фульминантном течении печеночной недостаточности и декомпенсации цирроза печени выявлен наиболее высокий процент снижения билирубина за одну процедуру - 30%. У пациентов с острой печеночной недостаточностью, включая дисфункцию трансплантата, отмечено снижение билирубина на 23-25%. Достоверных различий в снижении уровня билирубина между группами не было.
Снижение уровня общего билирубина происходило за счет снижения в ходе сессий конъюгированной фракции на 35±14,8% при фульминантной, и на 26-28% в группах с острой печеночной недостаточностью и циррозом печени. У пациентов с острым алкогольным гепатитом конъюгированная фракция билирубина уменьшалась на 22,3±12,3 % за сессию. Достоверных различий в снижении билирубина между группами не выявлено. Неконъюгированная фракция билирубина достоверно снижалась на 22-30% в ходе лечения во всех группах, за исключением пациентов с дисфункцией печеночного трансплантата, у которых отмечалась тенденция к снижению в среднем на 13,6±12,6%.
У пациентов всех групп, до начала терапии, отмечалось повышение активности сывороточных трансаминаз, что указывало на выраженность воспалительного процесса в печени, а у пациентов с фульминантным течением печеночной недостаточности, о некротических процессах в органе. Сывороточный уровень АСТ у пациентов этой группы составлял в среднем 1409±156,1 Е/л, АЛТ - 1799±147 Е/л.
Выраженный синдром цитолиза гепатоцитов отмечен также в группе пациентов с острой печеночной недостаточностью и дисфункцией трансплантата. Активность трансаминаз у пациентов с острым алкогольным гепатитом и декомпенсацией цирроза печени превышал нормальные значения в 2,4-3,6 раза. Проведение альбуминового диализа достоверно и стабильно уменьшало активность трансаминаз во всех группах, от сессии к сессии.
Таблица 8
Динамика АСТ в ходе проведения альбуминового диализа
| ФПечН | ОПечН | ОАГ | ЦП | ДТр | |
| До АлД | 1409±156,1 | 416±70,7 | 145,3±72 | 174±157 | 276±195 |
| После АлД | 977±112,9* | 191±60,6* | 97,8±44* | 125±104* | 160±80* |
* - достоверность различий между началом и концом сессии, р<0,05
Таблица 9
Динамика АЛТ в ходе проведения АлД
| ФПечН | ОПечН | ОАГ | ЦП | ДТр | |
| До АлД | 1799±147 | 531±463 | 96,7±55 | 142±130 | 186±89 |
| После АлД | 1480±119* | 410±302* | 61,4±24* | 106±95* | 137±60* |
* - достоверность различий между началом и концом сессии, р<0,05
О выраженности воспалительного процесса в печени свидетельствовало также значительное повышение содержания С-реактивного белка в сыворотке крови пациентов с печеночной недостаточностью.
В двух группах с наиболее высокой степенью тяжести пациентов фульминантной печеночной недостаточностью и декомпенсацией цирроза печени содержание СРБ превышало нормальное значения более чем в 10 раз, достигая средних значений 85,7±12,6 мг/л и 92,3±12,3 мг/л, соответственно.
Средние значения СРБ у пациентов с острым поражением печени колебались в значительных пределах, составляя в среднем 65±60 мг/л и 78,2±40 мг/л, что было вызвано токсическим воздействием лекарственных препаратов, грибного токсина и алкоголя. В процессе лечения альбуминовым диализом отмечалось достоверное снижение концентрации СРБ у пациентов с острой печеночной недостаточностью и циррозом печени, выраженная тенденция к уменьшению в группе острого алкогольного гепатита. У пациентов с дисфункцией трансплантата величина СРБ практически не изменялась: 71,6±26 мг/л до и 61,5±27,6 мг/л после, оставаясь высокой и после окончания сессии. Значительный и достоверный рост содержания С-реактивного белка в ходе проведения АлД отмечен у пациентов с фульминантной печеночной недостаточностью. Учитывая высокую летальность пациентов этой группы, можно сделать заключение, что, несмотря на высокую эффективность в элиминации провоспалительных токсинов и метаболитов, альбуминовый диализ не в состоянии прервать массивный и молниеносный воспалительный каскад и некроз гепатоцитов.
Таблица 10
Влияние альбуминового диализа на уровень СРБ (норма 0-8 мг/л)
| ФПечН | ОПечН | ОАГ | ЦП | ДТр | |
| До АлД | 34,8 ±4,6 | 65±60 | 78,2±40 | 92,3±12,3 | 71,6±26 |
| После АлД | 85,7±12,6* | 42,5±43* | 59,5±32 | 60,5±12,1* | 61,5±27,6 |
* - достоверность различий между началом и концом сессии, р<0,05
Тем не менее, значительное уменьшение выраженности синдрома цитолиза и воспалительной активности у пациентов, получавших альбуминовый диализ, связано с детоксикационным эффектом процедуры, совмещающей положительные стороны гемофильтрации по элиминации из крови провоспалительных факторов как за счет конвекции, так и за счет сорбционных свойств мембраны гемофильтра; а также за счет удаления токсинов связанных с альбумином, благодаря адсорбции на колонках с углем и анионобменной смолой.
Исследование ферментов холестаза, показало, что у пациентов с острой и фульминантной печеночной недостаточностью не развивается синдром холестаза, в этих группах превалирует синдром цитолиза гепатоцитов.
У пациентов с циррозом печени среднее значение ЩФ незначительно превышало норму. Острый алкогольный гепатит сопровождался выраженным и стойким внутрипеченочным холестазом, среднее значение ЩФ достоверно превышало норму и составляло 1030±711 Е/л. Максимальных значений в нашем исследовании достигал уровень ЩФ у пациентов с хронической дисфункцией печеночного трансплантата, сопровождавшийся развитием холангиогепатита. Средний уровень ЩФ в данной группе составлял 4150±2155 ед/л.
Проведение альбуминового диализа достоверно снижало содержание ЩФ в группе пациентов с дисфункцией трансплантата и острым алкогольным гепатитом. Однако эффект от лечения носил временный характер, в течение 5-7 суток, затем отмечалась тенденция к возрастанию до преддиализного уровня, что требовало проведения повторной процедуры через 7-10 суток. У пациентов с циррозом печени, напротив, отмечалось достоверное снижение ЩФ до нормальных значений, уже после первой сессии альбуминового диализа.
Несмотря на тенденцию к снижению повышенного уровня ГГТ на фоне проведения альбуминового диализа, достоверные результаты мы получили только у пациентов с острым алкогольным гепатитом и дисфункцией трансплантата, именно в этих группах отмечались наиболее высокие значения показателя и наиболее выраженные клинические проявления синдрома холестаза.
Гепаторенальный синдром 1-го типа чаще развивался у пациентов с острым алкогольным гепатитом, среднее значение сывороточной мочевины в этой группе достигало 19,1±9,4 ммоль/л, а среднее значение креатинина 250±105 мкмоль/л.
Таблица 11
Динамика уровня мочевины при альбуминовом диализе
(1,8-7,2 ммоль/л)
| ФПечН | ОПечН | ОАГ | ЦП | ДТр | |
| До АлД | 9,7±5,9 | 12,2±7,6 | 19,1±9,4 | 17,1±7,2 | 12,4±9,2 |
| После АлД | 8,7±5,3 | 9,1±6,0 | 16±8,2 | 15,3±9,6 | 9,6±7,2 |
* - достоверность различий между началом и концом сессии, р<0,05
Гепаторенальный синдром 2-го типа, осложняющий течение хронических диффузных заболеваний печени, являлся причиной почечной дисфункции у пациентов с циррозом печени. Среднее значение мочевины сыворотки составляло17,1±7,2 ммоль/л, креатинина 165,3±70 мкмоль/л.
При проведении альбуминового диализа отмечалась выраженная тенденция к снижению уровня сывороточной мочевины и креатинина в ходе каждой сессии во всех группах, не зависимо от этиологии печеночной недостаточности.
Достоверное снижение уровня креатинина до и после сессий отмечено у пациентов с острой печеночной недостаточностью и острым алкогольным гепатитом.
Эффективность альбуминового диализа в удалении водорастворимых токсинов, маркерами которых служат креатинин и мочевина,а также в коррекции нарушений водного обмена обусловлена диализно - фильтрационной составляющей метода.
Средние значения основных параметров, отражающих синтетическую функцию печени, были снижены во всех группах. У пациентов с фульминантной печеночной недостаточностью и дисфункцией трансплантата содержание сывороточного альбумина составляло в среднем 33,2±6,9 - 34,2±3,7 г/л. Достаточно высокий уровень альбумина у пациентов с острой печеночной недостаточностью и циррозом печени, в нашем исследовании, составляющий 32,5±6,1 г/л, являлся следствием медикаментозной подготовки пациентов к проведению альбуминового диализа. В процессе альбуминового диализа и после его окончания уровень альбумина существенно не менялся, более того, отмечалась тенденция к увеличению его концентрации в сыворотке крови. Только у пациентов с фульминантным течением ПН выявлена тенденция к снижению уровня альбумина к концу сессии.
Наиболее выраженное нарушение синтетической функции печени по уровню активности сывороточной холинэстеразы отмечалось в группе пациентов с ЦП и у пациентов с острым алкогольным гепатитом. Среднее значение холинэстеразы у пациентов с фульминантым гепатитом и дисфункцией трансплантата было одинаковым и составляло 3,8±0,95 Е/л. Менее всего синтетическая функция печени страдала у пациентов с острой печеночной недостаточностью, среднее значение холинэстеразы - 4,1±2,2 Е/л и приближалось к нижней границе нормальных значений. Альбуминовый диализ способствовал увеличению синтеза ХЭ у пациентов всех групп. При этом достоверные результаты получены у пациентов с острой печеночной недостаточностью и острым алкогольным гепатитом.
Таблица 12
Динамика уровня холинэстеразы при альбуминовом диализе
(норма 5,4-13,2 Е/л).
| ФПечН | ОПечН | ОАГ | ЦП | ДТр | |
| До АлД | 3,8 ±0,85 | 4,1±2,2 | 3,0±1,6 | 2,4±0,7 | 3,8±0,95 |
| После АлД | 3,99±0,72 | 4,9±1,8* | 3,5±1,4* | 2,5±0,6 | 3,6±0,43 |
* - достоверность различий между началом и концом сессии, р<0,05
Значительное снижение синтеза протромбина также отмечалось у большинства пациентов всех групп, за исключением пациентов с дисфункцией трансплантата и острым гепатитом, у которых ПТИ соответствовал нижней границе нормальных значений (68,8±18,8%). Наиболее выраженные нарушения синтеза протромбина выявлены у пациентов с фульминантным течением печеночной недостаточности, в которой среднее значение ПТИ снижалось до 35,3 ±10,2%, что клинически проявлялось кровотечениями из слизистой носа, ротовой полости, подкожными кровоизлияниями, диффузным геморрагическим пропитыванием вещества головного мозга.
Таблица 13
Динамика уровня протромбина при альбуминовом диализе
(норма более 70%)
| ФПечН | ОПечН | ОАГ | ЦП | ДТр | |
| До АлД | 35,3 ±10,2 | 67,75±24,4 | 56,8±18 | 42,8±14,8 | 68,8±18,8 |
| После АлД | 45,2±24,4 | 73,97±21,3 | 54,8±17 | 52,6±18,7* | 68,7±18,8 |
* - достоверность различий между началом и концом сессии, р<0,05
Среднее значение протромбинового индекса у пациентов с циррозом печени составляло 42,8±14,8%, геморрагический синдром проявлялся в основном кровотечениями из слизистой носа и десен.
На фоне лечения альбуминовым диализом во всех группах больных отмечена тенденция к увеличению уровня протромбинового индекса. При этом достоверное различие в уровне ПТИ до и после сессии АлД мы получили только в группе пациентов с циррозом печени.
Таблица 14
Влияние альбуминового диализа на уровень энцефалопатии
(баллы по шкале West-Haven)
| ФПечН | ОПечН | ОАГ | ЦП | ДТр | |
| До АлД | 3,3 ±0,82 | 1,9±1,02 | 2,1±0,53 | 2,78±0,93 | 2,25±0,4 |
| После АлД | 2,25±1,04* | 0,6±0,22* | 0,9±0,32* | 1,67±0,97* | 1,47±0,9* |
* - достоверность различий между началом и концом сессии, р<0,05
Наиболее тяжелые неврологические нарушения выявлены у пациентов с фульминантным течением печеночной недостаточности. Глубина энцефалопатии в среднем составляла 3,3±0,82 балла по шкале West-Haven, что клинически проявлялось состоянием глубокого сопора или комы. Появление признаков улучшения сознания отмечалось к 4-6 часу процедуры. Продолжительность эффекта после окончания сессии, не превышала 8-10 часов, полного купирования энцефалопатии у пациентов, данной группы, мы не отмечали.
У пациентов с циррозом печени выход из состояния сопора, отмечался к 6-8 часу альбуминового диализа, а проведение второй сессии АлД полностью купировало основные проявления энцефалопатии, стабильность и длительность полученного эффекта поддерживалась стандартной медикаментозной терапией.
Переход от 2 к 1-0 стадии энцефалопатии отмечался в группах пациентов с острой печеночной недостаточностью и хронической дисфункцией трансплантата.
Выход из состояния комы мы наблюдали у 10 из 54-х пациентов (18,5%).
Проанализировав результаты собственных наблюдений, мы определили показания к включению альбуминового диализа в комплексную терапию печеночной недостаточности.
- Неэффективность проводимой стандартной медикаментозной терапии.
- Прогрессирующее нарастание гипербилирубинемии (общий билирубин сыворотки крови > 350 ммоль/л).
- Печеночная энцефалопатия > 2 баллов по шкале West-Haven.
- Синдром цитолиза гепатоцитов (АСТ>200 Е/л, АЛТ>250 Е/л).
- Синдром внутрипеченочного холестаза (ЩФ>400 Ед/л, ГГТ>350 Е/л).
- Снижение синтетической функции печени (уровень сывороточной
ХЭ < 4 ммоль/мин*л, ПТИ < 50%).
- Выраженный некробиотический синдром (СРБ>50 мг/л, ЛДГ>500 Е/л).
- Гепаторенальный синдром (сывороточный натрий<128 мкмоль/л,
мочевина > 12 моль/л, креатинин>170 мкмоль/л)
На основании собственных данных и данных литературы мы предлагаем следующий алгоритм экстракорпоральной гемокоррекции при печеночной недостаточности представленный на рисунках 1 и 2.
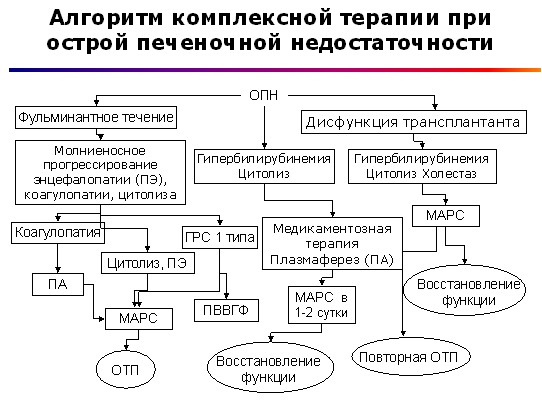
Рис. 1.
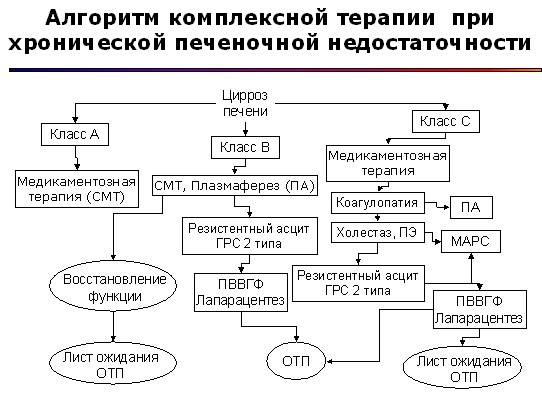
Рис. 2.
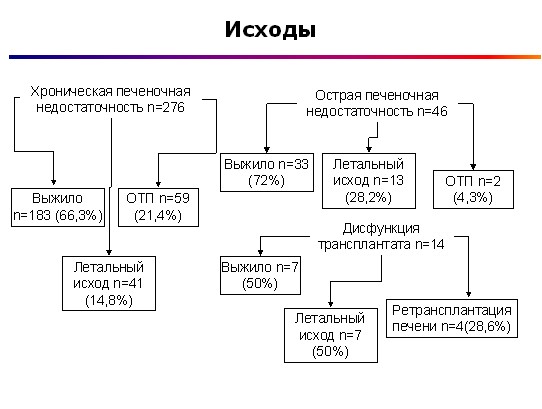
Соблюдение этого алгоритма лечения на ранних этапах развития печеночной недостаточности позволило добиться полного восстановления функции печени у пациентов с острой печеночной недостаточностью, увеличить время выживаемости при фульминантной ПН и декомпенсации цирроза печени (7суточная выживаемость – 50%) в течение которого может быть решен вопрос о выполнении операции трансплантации печени.
ВЫВОДЫ
- Ультразвуковая допплерография при острой печеночной недостаточности уже на 1-й неделе заболевания выявляет признаки портальной гипертензии: снижение объемного кровотока по воротной вене, увеличение размеров селезенки с дилятацией внутриселезеночного венозного рисунка. По данным радионуклидных методов ранним признаком портальной гипертензии является преобладание радиоколлоида в селезенке (12-30% захвата) и визуализация костного мозга (3-7% захвата).
- У пациентов с циррозом печени класса А по Child-Pugh состояние клеточного звена иммунитета соответствует значениям физиологической нормы, изменения гуморального звена, обусловлены нарушением метаболической функции печени. По мере прогрессирования заболевания и переходу пациентов из класса В, в класс С, к нарушениям гуморальной составляющей, присоединяется недостаточность клеточного звена иммунной системы.
- Дезинтоксикационный эффект плазмафереза при печеночной недостаточности связан с нормализацией пигментного обмена печени, уменьшением синдромов цитолиза гепатоцитов и внутрипеченочного холестаза, обладает выраженным иммунокорригирующим действием на параметры гуморального звена иммунитета, за счет элиминации из плазмы циркулирующих иммунных комплексов и избытка функционально неполноценных иммуноглобулинов. Плазмаферез позволяет быстро и эффективно осуществлять коррекцию нарушений свертывающей и противосвертывающей системы крови, уменьшая риск геморрагических осложнений.
- Продленная вено-венозная гемофильтрация у пациентов с печеночной недостаточностью и гепаторенальным синдромом, улучшает центральную и внутрипочечную гемодинамику, нормализует водно-электролитный баланс, снижает уровень азотистых шлаков, увеличивает скорость клубочковой фильтрации, что способствует коррекции гепаторенального синдрома.
- Альбуминовый диализ с использованием МАРС является патогенетически обоснованной системой поддержки печени, способной высокоэффективно удалять из плазмы водорастворимые и альбуминсвязанные токсины, способствуя уменьшению выраженности синдромов цитолиза и воспаления, улучшению синтетической функции печени, что приводит к регрессу энцефалопатии и купированию органной дисфункции.
- Использование альбуминового диализа в комплексной терапии первичной дисфункции трансплантата с 1-2-х суток послеоперационного периода способствует восстановлению функции трансплантата и препятствует развитию полиорганной недостаточности. При хронической дисфункции трансплантата позволяет стабилизировать функцию, либо подготовить пациента к операции ретрансплантации печени.
- Предложенный алгоритм комплексного применения методов экстракорпоральной гемокоррекции у пациентов с печеночной недостаточностью способствует восстановлению или временной стабилизации основных функций печени, коррекции органных нарушений, увеличивая время выживания пациентов в период ожидания донорского органа для трансплантации, что, в конечном итоге, приводит к снижению летальности.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- При поступлении в стационар пациента с печеночной недостаточностью диагностика и лечение должны проводиться с учетом этиологии, степени тяжести поражения печени, сроков заболевания.
- Пациентов с острой печеночной недостаточностью необходимо госпитализировать в отделение реанимации и интенсивной терапии в связи с возможным развитием фульминантного течения заболевания.
- Реанимационные и лечебные мероприятия при фульминантном течении печеночной недостаточности необходимо проводить одновременно с диагностическим процессом.
- Для уточнения степени тяжести печеночной недостаточности необходимо в первые сутки пребывания пациента в стационаре, выполнить биохимическое исследование крови, включающее определение уровня общего билирубина и его фракций, активности ферментов цитолиза – аланиновой и аспарагиновой трансаминаз, ферментов холестаза – щелочной фосфатазы и гаммаглютамилтранспептиды, синтетической функции печени – уровень общего белка, альбумина, холинэстеразы, маркеров функции почек - мочевины, креатинина, сывороточное содержание калия и натрия. Определить уровень тромбоцитов и параметры гемостаза.
- Инструментальная диагностика должна включать ультразвуковое исследование органов брюшной полости и плевральных полостей. Для выявления морфофункциональных изменений и портальной гипертензии выполняется ультразвуковая допплерография сосудов портальной системы и почек, радионуклидная сцинтиграфия печени и почек.
- При наличии синдрома портальной гипертензии для оценки степени выраженности варикозного расширения вен пищевода выполняется ЭГДС.
- При подозрении на фульминантное течение острой печеночной недостаточности необходимо решать вопрос о постановке в лист ожидания и выполнении трансплантации печени по экстренным показаниям, как можно раньше, до развития признаков органной недостаточности.
- Основой лечебной тактики при печеночной недостаточности является консервативная (стандартная) базовая терапия с использованием по показаниям методов экстракорпоральной гемокоррекции.
- Основным показанием к проведению методов экстракорпоральной гемокоррекции является отсутствие эффекта от проводимой консервативной терапии и необходимость поддержки пациента в период ожидания донорского органа для выполнения операции трансплантации печени.
- Показанием к проведению плазмафереза у пациентов с печеночной недостаточностью является:
- гипербилирубинемия (общий билирубин >160 мкмоль/л),
- синдром цитолиза (повышение активности трансаминаз > 5 норм)
- синдром холестаза (повышение ЩФ, ГГТП > 1,5-3 норм)
- синдром гипокоагуляции (снижение уровня ПТИ < 60%)
- значительное повышение уровня ЦИК (СуммаЦИК > 500 у.е./мл)
- гипериммуноглобулинемия (повышение концентрации Ig A, Ig G)
- гиперхолестеринемия (повышение уровня холестерина > 10 ммоль/л)
- выраженный кожный зуд
- синдром интоксикации
- Противопоказанием к проведению плазмафереза является выраженная гипопротеинемия, активное кровотечение, терминальное состояние пациента.
- Пациентам с печеночной недостаточностью, перед проведением процедур плазмафереза проводится инфузионная терапия с целью коррекции гипопротеинемии и гипоальбуминемии, стабилизации гемодинамических показателей и онкотического давления, включающая раствор свежезамороженной плазмы, 10% и 20% растворы альбумина, кристаллоидные растворы. Общий объем инфузионной терапии не должен превышать 800-1500 мл.
- Учитывая выраженное нарушение белково-синтетической функции печени, проявляющееся снижением уровня общего белка, альбуминов, диспротеинемии, дефицитом факторов гемостаза, замещение удаленной плазмы необходимо осуществлять растворами свежезамороженной донорской плазмы и 20% раствором альбумина в соотношении 3:1 или 1:1, соответственно, из расчета 30-40 мл на кг массы тела.
- При наличии у пациента с хронической печеночной недостаточностью резистентного к диуретической терапии асцита, сопровождающегося формированием гепаторенального синдрома, подтвержденного гипонатриемией, гиперазотемией, гипергидратацией и олигурией, показано проведение продленной вено-венозной гемофильтрации.
- Показанием к проведению ПВВГФ является:
- повышение уровня сывороточной мочевины >12 ммоль/л
- повышение уровня сывороточного креатинина > 170 мкмоль/л
- снижение уровня сывороточного натрия <125 мкмоль/л
- снижение суточного диуреза <900 мл
- гипергидратация, отечный синдром
- высокообъемный и резистентный к диуретической терапии асцит
- Перед выполнением ПВВГФ выполняется парацентез - дренирование и катетеризация стерильным катетером брюшной полости, под контролем ультразвукового исследования. Асцитическая жидкость эвакуируется дробно, не более 5 литров в сутки. Во время проведения пункции удалется от 1,5 до 3 литров асцитической жидкости. Затем, в течение 3-6 суток, асцитическую жидкость эвакуируют дробно, не более 3-5 литров в сутки, собирая ее в стерильный пластиковый пакет. Обязательным условием является ежедневное введение 10-20% раствора альбумина из расчета 6-8 грамм на 1 литр удаленной жидкости.
- У пациентов с острой печеночной недостаточностью показанием к проведению альбуминового диализа является синдром цитолиза гепатоцитов, выраженнная гипербилирубинемия, прогрессирующая энцефалопатия и развитие почечной недостаточности.
- При развитии фульминантного течения острой печеночной недостаточности показанием к проведению альбуминового диализа служит прогрессирование печеночно-клеточной недостаточности: уровень сывороточного билирубина выше 300 мкмоль/л, выраженный синдром цитолиза с увеличением активности трансаминаз в 55 раз от нормы, быстрое прогрессирование энцефалопатии, вплоть до развития сопора и комы (3-4 балла по шкале Вест Хавен), почечная недостаточность с олигурией и гиперазотемией, синдром интоксикации, а также необходимость в поддержании основных функций печени на время поиска донорского органа для трансплантации.
- Развитие первичной дисфункции трансплантата с повышением активности сывороточных трансаминаз до 3000-5000 Е/л требует проведения альбуминового диализа в первые часы постановки диагноза.
- Восстановление исходного уровня билирубина в течение суток после проведения альбуминового диализа у пациентов с декомпенсацией хронического заболевания печени (цирроз печени) является показателем тяжелой и необратимой печеночно-клеточной недостаточности с неблагоприятным исходом.
Список работ, опубликованных по теме диссертации.
- Musselius S., Lebedeva Y., Alexandrova I., Vasina N. Application of haemodialysis with cell therapy in acute hepatorenal failure.- // Nephrology, Dialysis, Transplantation, 1998, v.13, № 6, p.205.
- Musselius S., Lebedeva U., Alexandrova I.- Application of haemodialyses combined with cell therapy in acute hepatorenal failure.// XXXV Congress of the European Renal Association European Dialysis and Transplant Association.-Rimini,Italy.- 1998.-A-205.
- Лебедева Ю.Н., Александрова И.В., Шиманко И.И. Эффективность использования гепатоцитов в экстракорпоральной системе «вспомогательная печень» у больных с острой печеночной недостаточностью.- //Материалы городского семинара «Диагностика, клиника и лечение острой печеночной недостаточности». - Труды НИИ СП.-М.1998г.-, c.26-30.
- Лебедева Ю.Н., Мусселиус С.Г., Александрова И.В., Васина Н.В., Митин А.С. Экстракорпоральное применение гепатоцитов при печеночной недостаточности.- // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 1999.- №1.- том IX.- приложение № 6.- Материалы Четвертой Российской конференции «Гепатология сегодня».- с.67.
- Александрова И.В., Васина Н.В., Лебедева Ю.Н. Экстракорпоральная детоксикация в лечении печеночной недостаточности вследствие приема парацетамола. //Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 2000.- №5.- том.- приложение №.- Материалы Шестой Российской гастроэнтерологической недели. № 273.- с.74.
- Александрова И.В., Мусселиус С.Г., Лебедева Ю.Н.,.Рык А.А., Васина Н.В. Лечение острой печеночно-почечной недостаточности при острых отравлениях.- // Материалы конференции «Особенности эндотоксикоза при острых отравлениях». М. 2001. С. 24-27.
- Александрова И.В., Мусселиус С.Г., Лебедева Ю.Н., Васина Н.В. Современные аспекты активной детоксикации у больных с печеночной недостаточностью.- Труды III Международной ассамблеи «Новые медицинские технологии». М. 2001. С.68-69.
- Александрова И.В., Мусселиус С.Г., Васина Н.В. Плазмаферез в лечении первичного билиарного цирроза печени.- // 9 Конференция Московского общества гемафереза. М. 2001. С.6.
- Маевская М.В., Ведерникова А.В., Ивашкин В.Т., Новрузбеков М.С., Андрейцева О.И, Александрова И.В., Чжао А.В. Болезнь Вильсона (клиническое наблюдение). // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 2002. №5.Том XII.- с. 20-22.
- Александрова И.В., Мусселиус С.Г., Лебедева Ю.Н.-Экстракорпоральная детоксикация в лечении больных с первичным билиарным циррозом печени.// Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 2002.- №1.- том XII.- приложение № 16.- Материалы Седьмой Российской гастроэнерологической недели. № 54.- с.19.
- Боровкова Н.В., Александрова И.В., Мусселиус С.Г., Лебедева Ю.Н. Особенности иммунного статуса пациентов, обследованных по программе трансплантации печени. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 2002.- №1.- том XII.- приложение № 16.- Материалы Седьмой Российской гастроэнерологической недели. № 56.- с.19.
- Андрейцева О.И., Чугунов А.О., Журавель С. В., Александрова И.В., Чжао А.В. Особенности формирования листа ожидания трансплантации печени..-.// Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 2002.- №1.- том XII.- приложение № 16.- Материалы Седьмой Российской гастроэнерологической недели. № 130.- с.43.
- Чжао А.В., Андрейцева О.И., Новрузбеков М.С., Александрова И.В., Лебедева Ю.Н., Журавель С.В. Лечение реинфекции вирусом гепатита С после трансплантации печени (клиническое наблюдение). // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 2002.- №16.-Материалы Восьмой Российской гастроэнерологической недели. № 130.- с.21.
- Чжао А.В., Луцик К.Н., Андрейцева О.И., Александрова И.В., Лебедева Ю.Н. Возможности лечения ламивудином и специфической иммунопрофилактики инфекции вирусом гепатита В до и после трансплантации печени. –// Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 2002.- №16.-Материалы Восьмой Российской гастроэнерологической недели.
- Андрейцева О.И., Гуляев В.А., Журавель С.В., Джаграев К.Р., Александрова И.В., Кузнецова Н.К., Чугунов А.О., Адамовский Н.Г., Киселев В.В., Чжао А.В. Принципы отбора больных для трансплантации печени.- // Клинические перспективы Гастроэнтерологии, гепатологии //, №4, 2002, с.12-20.
- Александрова И.В., Первакова Э.И., Васина Н.В., Булава Г.В. Клинико-лабораторные аспекты применения плазмафереза (ПА) в сочетании с продленной вено-венозной гемофильтрацией (ПВВГФ) в комплексной терапии фульминантной печеночной недостаточности.. // Сб. трудов XI Конференции Московского общества гемафереза.- М.- 2003.- С 75.
- Александрова И.В., Зимина Л.Н., Васина Н.В., Донова Л.В., Рябов Е.Б., Первакова Э.И. Клинико-диагностические особенности поражения печени, обусловленные приемом тайских таблеток для снижения веса. // Материалы 2-го Съезда токсикологов России.- М.- 2003.- с. 305-306.
- Ишмухаметов А.И., Чжао А.В., Мусселиус С.Г., Кудряшова Н.В., Синякова О.Г., Александрова И.В., Андрейцева О.И. Значение радиоизотопного метода для оценки функции печени и почек при трансплантации печени. //Медицинская радиология и радиационная безопасность.- 2003.-№2.-с.42-47.
- Александрова И.В., Первакова Э.И., Васина Н.В., Донова Л.В. Продленная вено-венозная гемофильтрация (ПВВГФ) в комплексной терапии гепаторенального синдрома. // Материалы IX Российской Гастроэнтерологической Недели М, 2003. Рос. журн. гастроэнтерол., гепатол., колопроктологии.- 2003.-№5.-Прилож.№21.- С. 81.
- Александрова И.В., Васина Н.В., Галкина Г.С., Рябов Е.Б., Первакова Э.И. Возможности коррекции анемии у больных циррозом печени различного генеза. // Материалы XXXI научной сессии ЦНИИ Гастроэнтерологии. М,- 2003. Экспериментальная и клиническая гастроэнтерология.- 2003.-№ 5.- С. 120.
- Зимина Л.Н., Галанкина И.Е., Ведешкина А.Н., Александрова И.В., Первакова Э.И., Журавель С.В., Чжао А.В., Андрейцева О.И. Морфология печени при печеночной недостаточности после приема тайских таблеток. // Материалы симпозиума «Патогенез и патологическая анатомия критических, терминальных и постреанимационных состояний».- М.- 2003.- С. 49-53.
- Александрова И.В., Галкина Г.С., Рябов Е.Б., Первакова Э.И., Андрейцева О.И., Чжао А.В. Лист ожидания трансплантации печени – обследование и ведение пациентов. // Материалы научно-практической конференции «Актуальные вопросы донорства и трансплантации органов» НИИ СП.-М.-2003.-с.28-34.
- Баев А.А., Павлов Ч.С., Маевская М.В., Александрова И.В., Ивашкин В.Т. Последние достижения в диагностике наследственного гемохроматоза. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 2003г.- №6.- С. 4-10.
- Александрова И.В., Первакова Э.И., Донова Л.В. Неинвазивые методы диагностики гепаторенального синдрома. // Материалы X Российской Гастроэнтерологической Недели.- М., 2004. Российск. журн. гастроэнтерол., гепатол., колопроктологии.- 2004.-№5.- С. 157.
- Александрова И.В., Первакова Э.И, Галкина Г.С., Чжао А.В., Рябов Е.Б., Артамонов В.В. Эфферентная терапия печеночной недостаточности. // Сб. материалов IV Международной конференции «Актуальные аспекты экстракорпорального очищения крови в интенсивной терапии» Пятая неделя нефрологии в Москве «Актуальные проблемы острой почечной недостаточности».- М.- 2004.- С. 116-117.
- Ермолов А.С., Александрова И.В., Первакова Э.И., Рей С.И., Рык А.А., Гептнер Р.А., Васина Н.В. МARS-терапия у больных фульминантной печеночной недостаточностью. // Сб. материалов IV Международной конференции «Актуальные аспекты экстракорпорального очищения крови в интенсивной терапии». Пятая неделя нефрологии в Москве «Актуальные проблемы острой почечной недостаточности» М.- 2004.- С. 117.
- Александрова И.В, Первакова Э.И., Васина Н.В., Булава Г.В., Никулина В.П. Место пробиотиков и бактериофагов комплексной терапии больных с циррозом печени различного генеза. Тезисы статей IV съезда НОГР, М.,-2004. Экспериментальная и клиническая гастроэнтерология, 2004.-№ 1.- С. 71.
- Александрова И.В., Первакова Э.И., Васина Н.В., Рей С.И., Галкина Г.С., Алексеев И.Н., Донова Л.В. Изменение гемодинамики, электролитного и азотистого обмена у больных циррозом печени с резистентным асцитом при включении в терапию продленной вено-венозной гемофильтрации. // Сб. тезисов докладов III Российского конгресса по патофизиологии.- М.- 2004.- С.118
- Ермолов А.С., Александрова И.В., Первакова Э.И., Васина Н.В., Федотов А.Г. MARS-терапия у больного с гемигепатэктомией. // Материалы четвертой международной конференции «Актуальные аспекты экстракорпорального очищения крови в интенсивной терапии».- М.- 2004.- С.121.
- Донова Л.В., Александрова И.В., Первакова Э.И. Ультрасонография в диагностике гепаторенального синдрома. // Визуализация в клинике.-2004.-№24-25,с.39-41.
31. Alexandrova I.V., Pervacova E.I., Rey S.I. MARS therapy in acute liver failure. 6 International symposium on albumin dialysis in liver disease.-Rostock.-2004.-p.149.
- Кудряшова Н.Е., Александрова И.В., Синякова О.Г., Первакова Э.И., Ходарева Е.Н. Оценка функционального состояния печени радионуклидным методом. Материалы X Российской конференции «Гепатология сегодня», М, 2005. Рос. журн. гастроэнтерол., гепатол., колопроктологии.-2005.-№1.-Прил. №24.- С. 102.
- Александрова И.В., Первакова Э.И., Васина Н.В., Рей С.И. Перспективы применения альбуминового диализа у больных с терминальной стадией печеночной недостаточности. // Материалы X Российской конференции «Гепатология сегодня». М, 2005г. Рос. журн. гастроэнтерол., гепатол., колопроктологии.-2005.-№1.-Прил. №24.- С. 42.
- Александрова И.В., Первакова Э.И., Васина Н.В., Рей С.И. МARS-терапия как метод заместительной терапии у больных фульминантной печеночной недостаточностью. //Сборник научных работ конференции, посвященной 30-летию кафедры анестезиологии и реаниматологии МГМСУ. «Актуальные вопросы анестезиологии и реаниматологии.» М, 2005 г. С.6-7.
- Павлов Ч.С., Баев А.А., Лавров А.В., Александрова И.В., Ивашкин В.Т Значение мутаций гена гемохроматоза в развитии синдрома перегрузки железом. // Клинические перспективы гастроэнтерологии, гепатологии.-2005.-№3.-С.17-24.
- Федосьина Е.А., Александрова И.В., Павлов Ч.С., Маевская М.В., Ивашкин В.Т. Случай своевременной диагностики и успешного лечения спонтанного бактериального перитонита. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 2005.- №1. Том XV. Приложение №24. Материалы десятой Российской конференции «Гепатология сегодня». № 140.- с.39.
- Александрова И.В, Первакова Э.И, Васина Н.В, Рей С.И. Комплексная экстракорпоральная коррекция печеночной недостаточности. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 2006.- №1.- том XVI.- приложение № 27.- Материалы одиннадцатой Российской гастроэнерологической недели. № 2.- с.4.
- Андрейцева О.И., Новрузбеков М.С., Надинская М.Ю., Чжао А.В., Александрова И.В. Трансплантация печени при первичном билиарном циррозе. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 2006.- №1.- том XVI.- приложение № 27.- Материалы одиннадцатой Российской гастроэнерологической недели. № 6.- с.5.
- Федосьина Е.А., Павлов Ч.С., Маевская М.В., Александрова И.В., Шептулин А.А., Ивашкин В.Т. Нерешенные вопросы лечения резистентного асцита у больных циррозом печени различной этиологии. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 2006.- №1.- том XVI.- приложение № 27.- Материалы одиннадцатой Российской гастроэнерологической недели. № 41.- с.15.
- Федосьина Е.А., Павлов Ч.С., Маевская М.В., Александрова И.В., Шептулин А.А., Ивашкин В.Т. Частота спонтанного бактериального перитонита у больных циррозом печени различной этиологии. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 2006.- №1.- том XVI.- приложение № 27. Материалы одиннадцатой Российской гастроэнерологической недели. № 43.- с.15.
- Федосьина Е.А., Павлов Ч.С., Маевская М.В., Александрова И.В., Шептулин А.А., Ивашкин В.Т. Новые подходы к диагностике спонтанного бактериального перитонита у больных циррозом печени. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 2006.- №1.- том XVI.- приложение № 27.- Материалы одиннадцатой Российской гастроэнерологической недели. № 42.- с.15.
- Кудряшова Н.Е., Александрова И.В., Синякова О.Г., Первакова Э.И. Сцинтиграфия при первичном билиарном циррозе. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 2006.- №1.- том XVI.- приложение № 27. Материалы одиннадцатой Российской гастроэнерологической недели. № 174.- с.50.
- Alexandrova I., Pervakova E., Donova L., Rey S. Influence of CVVHDF on hemodynamics, electrolytic and nitrogen metabolism changes in patients with hepatorenal syndrome. // XLIII Congress of the European Renal Association European Dialysis and Transplant Association.-2006.-Glasgow.UK- SP.681.
45. Донова Л.В., Александрова И.В., Первакова Э.И., Андрейцева О.И., Чжао А.В. Комплексная эхография в диагностике осложнений циррозов печени. Материалы IX Симпозиума с международным участием «Новые диагностические технологии в лучевой диагностике».- М.-2006г.-С.86-87.
46. Александрова И.В., Первакова Э.И., Васина Н.В., Рей С.И. Комплексная экстракорпоральная коррекция печеночной недостаточности.// Материалы пятой международной конференции «Актуальные аспекты экстракорпорального очищения крови в интенсивной терапии».- М.- 2006.- С.34.
47. Александрова И.В., Первакова Э.И., Рей С.И., Булава Г.В., Боровкова Н.В., Васина Н.В. Влияние MARS-терапии на иммунный статус пациентов с диффузными заболеваниями печени. // Материалы пятой международной конференции «Актуальные аспекты экстракорпорального очищения крови в интенсивной терапии».- М.- 2006.- С.35.
48. Гепаторенальный синдром и трансплантация печени. Гуляев В.А., Александрова И.В., Киселев В.В., Погребниченко И.В., Журавель С.В., Дорофеева Е.Н., Новрузбеков М.С., Чжао А.В.// Анналы хирургической гепатологии.-2006.-Том 11.-№4.-С.82-90.
49. Донова Л.В., Чжао А.В., Александрова И.В., Андрейцева О.И., Журавель С.В., Новрузбеков М.С. Значение ультразвуковой допплерографии в оценке функции почек при ортотопической трансплантации печени. // Рос. журн. гастроэнтерол., гепатол., колопроктол.-2007.-№ 4.- С.40-43.
50. Первакова Э.И., Александрова И.В., Булава Г.В., Боровкова Н.В. Влияние MARS-терапии на динамику иммунологических показателей у больных с диффузными заболеваниями печени. // Тез. докл. 7-го съезда науч. о-ва гастроэнтерологов России, г. Москва, 20-23 марта 2007 г.- (Эксперим. и клин. гастроэнтерология.-2007.- Прил. № 1).-С. 192-193.- Сообщ. В 34.
51. Александрова И.В., Первакова Э.И., Рей С.И., Марченкова Л.В. Динамика холестатического синдрома и иммунологических показателей у больных с циррозом печени при включении в комплексную терапию плазмафереза. [материалы Тринадцатой Рос. гастроэнтерол. недели, г.Москва, 22-24 окт. 2007 г.] // Рос. журн. гастроэнтерол., гепатол., колопроктол.-2007.-№ 5.-Прил. № 30.-С.72.- № 261.
52. Александрова И.В., Первакова Э.И., Булава Г.В., Боровкова Н.В. Нарушения иммунного статуса и методы коррекции у пациентов с диффузными заболеваниями печени //Гепатология сегодня: материалы Двенадцатой Рос. конф., г. Москва, 19-21 марта 2007 г. // Рос. журн. гастроэнтерол., гепатол., колопроктол.-2007.-№ 1.-Прил. № 29.-С.72.-№258.
53. Чжао А.В., Александрова И.В., Андрейцева О.И., Журавель С.В., Джаграев К.Р.,. Гуляев В.А. и др. Опыт трансплантации печени в НИИ СП им. Н.В. Склифосовского. / [Гепатология сегодня: материалы Двенадцатой Рос. конф., г. Москва, 19-21 марта 2007 г.] // Рос. журн. гастроэнтерол., гепатол., колопроктол.-2007.-№ 1.-Прил. № 29.-С.5.-№7.
54. Журавель С.В., Дорофеева Е.Н., Кузнецова Н.К., Киселев В.В., Донова Л.В., Александрова И.В., Чжао А.В. Трансплантация печени у больных с гепаторенальным синдромом..//Материалы городской н-п-к-«Актуальные вопросы трансплантации органов».- М.-2008.-с.81-83.
55. Александрова И.В., Первакова Э.И., Донова Л.В., Артамонов В.В. Продленная вено-венозная гемофильтрация в лечении гепаторенального синдрома у пациентов с хроническими диффузными заболеваниями печени. // Российский журнал гастроэнтерологии, гепатологии и колопроктологии.-2008г.-Том XVIII.-№4.- С 38-42.
56. Хубутия А.Ш., Александрова И.В., Артамонов В.В., Первакова Э.И., Рей С.И., Рябов Е.Б. Альбуминовый диализ в лечении пациентов с дисфункцией печеночного трансплантата. // IV Всероссийский съезд трансплантологов. М.-2008.-с.213-214.
57. Ермолов А.С., Александрова И.В., Чжао А.В., Артамонов В.В., Рей С.И. МАРС-терапия в лечении дисфункции печеночного трансплантата. // Анестезиология и реаниматология.- 2008.-№ 6.- с.67-70.

