Ранняя стадия поражения почек у больных гипертонической болезнью: клиническое значение, принципы профилактики
На правах рукописи
НАНЧИКЕЕВА
МАЙРА ЛАТЫПОВНА
РАННЯЯ СТАДИЯ ПОРАЖЕНИЯ ПОЧЕК
У БОЛЬНЫХ ГИПЕРТОНИЧЕСКОЙ БОЛЕЗНЬЮ: КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ,
ПРИНЦИПЫ ПРОФИЛАКТИКИ
14.01.04-внутренние болезни
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Москва -2010
Работа выполнена в ГОУ ВПО Московская медицинская академия им. И.М. Сеченова и во Владимирском областном государственном учреждение здравоохранения «Областная клиническая больница».
Научный консультант:
доктор медицинских наук, профессор Козловская Лидия Владимировна
Официальные оппоненты:
академик РАМН, доктор медицинских наук,
профессор Моисеев Валентин Сергеевич
доктор медицинских наук,
профессор Ермоленко Валентин Михайлович
доктор медицинских наук,
профессор Арутюнов Григорий Павлович
Ведущее учреждение:
ГОУ ВПО Московский государственный медико-стоматологический университет
Защита состоится «_____»____________2010 г. в _____час.
на заседании диссертационного совета Д 208.040.05 при ГОУ ВПО
Московская медицинская академия им. И.М.Сеченова (119991, г. Москва,
ул. Трубецкая, д.8, стр.2)
С диссертацией можно ознакомиться в ГЦНМБ ГОУ ВПО Московская
медицинская академия им. И.М.Сеченова (117998, г. Москва,
Нахимовский проспект, д.49)
Автореферат разослан «_____»__________2010 года
Ученый секретарь диссертационного совета
доктор медицинских наук,
профессор Волчкова Елена Васильевна
ОБЩАЯ ХАРАКТРИСТИКА РАБОТЫ
Актуальность темы
Гипертоническая болезнь (ГБ) - широко распространенное заболевание, частота которого составляет около 40% взрослого населения России. По данным сводных статистик ГБ занимает одно из ведущих мест в спектре причин терминальной почечной недостаточности у больных на диализе [Белоусов Ю.Б., 1997; Stevens L.A., 2004; Бикбов Б.Т., Томилина Н.А., 2004], что делает проблему изучения патологии почек, связанную с артериальной, гипертензией чрезвычайно актуальной.
Согласно современным представлениям центральным звеном развития гипертонической нефропатии (ГНП) является неиммунное поражение почечных сосудов. Высокая гипертензия через гемодинамические факторы (напряжение сдвига и круговой стресс) активирует/повреждает почечные эндотелиоциты, вызывая их дисфункцию. Дисфункция эндотелия внутрипочечных сосудов в сочетании с метаболическими нарушениями, оксидативным стрессом, нейро-гуморальной активацией потенцируют ишемию ткани почки и фиброангиогенез, которые реализуются через патологическую активацию локально почечного ангиотензина ІІ и опосредованную им гиперпродукцию трансформирующего фактора роста- 1 (TGF-1), ингибитора активатора плазминогена-I (РАI-I). Связанная с фиброангиогенезом структурно-функциональная перестройка - дезадаптивное ремоделирование микрососудистого русла почки, запустевание внутриклубочковых и перитубулярных капилляров с усилением ишемии составляют патофизиологическую основу гипертонической сосудистой нефропатии (ГНП).
С другой стороны почки, поврежденные гипертонией, сами могут продуцировать факторы, усиливающие повреждение системного сосудистого русла, и создавать условия для вовлечения других органов-мишеней ГБ -сердца, центральных и периферических сосудов и связанных с этим осложнений (ССО) [Bro S., 2003; Foley R.N. et al., 2006]. Тесная связь сердечно-сосудистых заболеваний и поражения почек через артериальную гипертензию послужила предпосылкой для создания понятия рено-кардио-васкулярного континуума на основе общности механизмов органного повреждения при ГБ, в первую очередь эндотелиальной дисфункции.
В свете указанной концепции уточнение гемодинамических и молекулярно-клеточных путей развития ранней стадии ГНП приобретает первостепенное значение для определения более эффективных мер патогенетического воздействия на течение болезни в целом. Но именно ранняя стадия поражения почек при ГБ остается недостаточно изученной: окончательно не определены критерии ранней стадии ГНП, не оценена информативность методов ее диагностики и мониторирования, не разработаны меры профилактики этой формы сосудистой нефропатии. Между тем реальный путь первичной профилактики ГНП может состоять в установлении и устранении спектра модифицируемых факторов риска (ФР) ГНП, а также применении средств, нивелирующих нежелательные эффекты ангиотензина-II - основной мишени нефропротективной стратегии на современном этапе.
Цель исследования
Охарактеризовать раннюю стадию поражения почек при гипертонической болезни - гипертоническую нефропатию (ГНП), определить методы ее диагностики, обосновать пути эффективной нефропротекции для предупреждения поражения почек и других органов-мишеней.
Задачи исследования
1. Изучить спектр факторов риска гипертонической болезни популяционных (метаболических) и эндогенных - асимметричного диметиларгинина (АДМА) и гомоцистеина, определить среди них диагностически значимые для развития поражения почек. Оценить частоту и сроки возникновения ГНП среди больных ГБ с разной длительностью заболевания в зависимости от степени АГ.
2. Определить клинические критерии ранней стадии ГНП на основании изучения микроальбуминурии (МАУ), скорости клубочковой фильтрации (СКФ), а также состояния внутрипочечной гемодинамики при использовании ультразвукового метода дуплексного сканирования с цветовым допплеровским картированием внутрипочечных сосудов.
3. Уточнить вклад эндотелиальной дисфункции и сопряженных с ней пристеночных процессов коагуляции, протеолиза/фибринолиза и фиброангиогенеза в механизмы ремоделирования внутрипочечных сосудов по уровню экскреции с мочой ингибитора активатора плазминогена-I (PAI-I), трансформирующего фактора роста-бета1 (TGF-1), сосудистого эндотелиального фактора роста (VEGF), коллагена ІV типа.
4. Подтвердить значение МАУ, как универсального маркера системной эндотелиальной дисфункции в пробе с эндотелий-зависимой вазодилатацией (ЭЗВД). Изучить рено-кардио-васкулярные взаимоотношения у больных с ранней стадией ГНП на основании определения ремоделирования сердца и сосудов ультразвуковыми методами.
5. Оценить влияние коррекции метаболических ФР и фармакологической блокады неблагоприятных эффектов ангиотензина II на развитие ГНП, поражение сердца и сосудов у больных ГБ.
Научная новизна
Впервые дана комплексная оценка ранней стадии поражения почек у больных гипертонической болезнью - гипертонической нефропатии, как динамически развивающегося процесса, к начальным признакам которого относится МАУ. Показано, что МАУ при ГБ является интегральным маркером не только локально-почечной, но и системной дисфункции эндотелия, формирующейся и у молодых людей с непродолжительным стажем болезни при участии комплекса факторов риска, включая увеличение массы тела, нарушение обмена мочевой кислоты, гипергомоцистеинемию и гиперпродукцию АДМА.
Впервые у больных с ранней стадией ГНП выявлена корреляция МАУ со спектром экскретируемых мочевых биомаркеров (медиаторов) – PAI-I, TGF-1, VEGF, коллагена IV типа, отражающих ключевые механизмы формирования эндотелиальной дисфункции и усиления процессов фиброангиогенеза в почке, ведущих к ремоделированию внутрипочечных сосудов и ишемии почечной ткани.
На основании проведенного корреляционного анализа установлено, что к клиническим эквивалентам дезадаптивного ремоделирования внутрипочечных сосудов – более позднего этапа развития ранней стадии ГНП, относятся увеличение показателя RI, оцененного допплерометрически, увеличение экскреции с мочой коллагена IV типа и тенденция к снижению СКФ через фазу гиперфильтрации.
Обнаружена тесная взаимосвязь маркеров ГНП – МАУ и RI, со степенью снижения эндотелий-зависимой вазодилатации, выраженностью ремоделирования миокарда левого желудочка и гипертрофии общих сонных артерий.
Наличие рено-кардио-васкулярных взаимосвязей указывает на возможность использования выявленных критериев ГНП для оценки сердечно-сосудистого риска и обосновывает целесообразность применения средств, ингибирующих неблагоприятные эффекты ангиотензина II центрального регулятора процессов фиброангиогенеза в почке, для профилактики развития ХПН и предупреждения кардио-васкулярных осложнений.
Практическая значимость
На основании полученных результатов уточнены факторы риска развития поражения почек у больных ГБ. Разработаны диагностически значимые критерии ранней стадии ГНП – МАУ, повышение RI междолевых почечных артерий и изменение суммарной фильтрационной функции почек –начальная гиперфильтрация с постепенным развитием гипофильтрации.
Показана информативность изучения мочевых биомаркеров – PAI-I, TGF-1,VEGF и коллагена IV типа, в мониторировании ранней стадии ГНП.
Уточнена возможность использования маркеров ранней стадии ГНП-МАУ и RI, для оценки формирования рено-кардио-васкулярного континуума у пациентов ГБ.
Обоснована целесообразность применения ингибиторов АПФ у больных ГБ для предупреждения развития ГНП и профилактики сердечно-сосудистых осложнений.
Положения, выносимые на защиту
1. Ранняя стадия поражения почек у больных ГБ эндотелиальной дисфункции и процессов фиброангиогенеза в почке – ГНП, это динамически развивающийся процесс, на начальном этапе которого выявляется микроальбуминурия (МАУ). Частота и выраженность МАУ коррелируют с тяжестью АГ, популяционными ФР - увеличением индекса массы тела, нарушением обмена мочевой кислоты (урикемией, урикозурией), гиперпродукцией гомоцистеина и неадекватным синтезом асимметричного диметиларгинина (АДМА), на последующих этапах – с повышением внутрипочечного сосудистого сопротивления, регистрируемого допплерометрическим методом, постепенным снижением СКФ через фазу гиперфильтрации длительно без гиперкреатининемии.
2. Имеется прямая корреляция между величиной МАУ и уровнем экскреции с мочой молекулярных медиаторов PAI-1, TGF-1, VEGF и коллагена IV типа, отражающих эндотелиальную дисфункцию и связанные с ней механизмы фиброангиогенеза – патофизиологической основы ремоделирования микрососудистого русла почки при ГНП. Дополнительно выявляемая тесная связь между уровнем экскреции с мочой коллагена IV типа и степенью увеличения внутрипочечного сосудистого сопротивления (RI) в совокупности со снижением СКФ указывает на более поздний этап развития ранней стадии ГНП.
3. Маркеры ГНП - МАУ и RI, являются универсальными показателями системной эндотелиальной дисфункции и ремоделирования сосудистого русла органов-мишеней ГБ в рамках рено-кардио-васкулярного континуума, о чем свидетельствует их тесная взаимосвязь у больных ГБ со степенью снижения эндотелий-зависимой вазодилатации (показателем ЭЗВД), выраженностью гипертрофии миокарда и величиной комплекса интима-медиа ОСА. Информативность и доступность для исследования обусловливают возможность использование МАУ и RI для оценки кардио-васкулярного риска и связанных с ним осложнений при ГБ.
4. Поддержание целевого уровня АД у больных ГБ, в том числе у молодых с непродолжительным стажем болезни, с помощью лекарственных средств, нивелирующих неблагоприятные эффекты ангиотензина II на процессы фиброангиогенеза в почке, наряду с мероприятиями по модификации факторов риска, оказывает нефро- и кардиопротективное действие, ведет к профилактике ГНП с развитием ХПН и сердечно-сосудистых осложнений.
Апробация работы
Апробация диссертации проведена 16 сентября 2009г. на совместном заседании кафедры терапии профболезней медико-профилактического факультета, отдела нефрологии НИЦ, кафедры нефрологии и гемодиализа ФППОВ ГОУ ВПО ММА им. И.М.Сеченова и кафедры внутренних болезней факультета фундаментальной медицины МГУ им. М.В. Ломоносова. Материалы исследования доложены и обсуждены на XI-м и XVI-м Всероссийском Национальном Конгрессе «Человек и лекарство» (Москва, апрель 2004 и май 2009г.), на XIII-м Европейском Конгрессе по артериальной гипертензии (Милан, 2003г.): на VI съезде Научного общества нефрологов России (Москва, ноябрь 2005г.), на V съезде Российской ассоциации специалистов ультразвуковой диагностике в медицине (Москва, сентябрь 2007г.), на V конференции Российского диализного общества (Москва, сентябрь 2007г.), Российском национальном конгрессе кардиологов (Москва, октябрь 2009г.).
Внедрение результатов исследования
Основные положения диссертации внедрены в работу отделений терапии, нефрологии и кардиологии Владимирской областной клинической больницы (ВОГУЗ ОКБ). Полученные практические и теоретические выводы применяются в учебном процессе кафедр терапии и профболезней медико-профилактического факультета ММА им. И.М. Сеченова, терапии, хирургии и лучевой диагностики ФППОВ Ивановской Государственной медицинской академии.
Публикации
По материалам диссертации опубликовано 30 научных работ, в том числе, отдельные результаты исследования включены в раздел «Поражение почек при эссенциальной артериальной гипертензии» национального руководства Нефрология» под редакцией Н.А.Мухина (Москва, 2009г.).
Объем и структура диссертации
Диссертация изложена на 183 страницах печатного текста и состоят из введения, обзора литературы, глав «Материалы и методы исследования», «Результаты собственного исследования и их обсуждение», заключения, выводов, практических рекомендаций и списка литературы, который содержит источник, из которых отечественных - 30, и зарубежных - 234. Диссертация иллюстрирована 44 рисунками, 18 таблицами, 3 схемами.
База проведения исследования
Основной базой проведения исследования были областная клиническая больница г. Владимира (главный врач Остапущенко О.С.) и кафедра терапия и профболезней медико-профилактического факультета ММА им. И.М.Сеченова (зав. кафедрой - академик РАМН, профессор Н.А.Мухин). Специальные исследования проведены в подразделениях ВОГУЗ ОКБ: отделах ультразвуковой и функциональной диагностики (зав. д.м.н. М.Н.Буланов, Ю.К.Кононович), биохимической лаборатории (зав. Л.Л.Семенова), иммунологической лаборатории (зав. С.Л.Бредун) и в подразделениях ММА им. И.М.Сеченова - на базе отдела нефрологии НИЦ ММА им. И.М.Сеченова (зав. д.м.н. И.Н.Бобкова).
Выражаю глубокою уважение и приношу искреннюю благодарность за поддержку, критические замечания и повседневную помощь в работе над диссертацией своему научному консультанту – д.м.н., профессору Л.В.Козловской. Искренне признательна за оказанное доверие и представленную возможность проходить учебу в докторантуре и готовить к защите научную работу на кафедре терапии и профболезней ММА им. И.М.Сеченова, зав. кафедрой академику РАМН, профессору Н.А.Мухину. Отдельную большую благодарность за участие в методическом осуществлении работы приношу зав. отделом нефрологии НИЦ ММА им. И.М.Сеченова д.м.н. И.Н.Бобковой, асс. кафедры терапии и профболезней к.м.н. В.В.Рамееву, ведущему научному сотруднику отдела нефрологии НИЦ к.м.н. М.Ю. Швецову. Автор признателен всем сотрудникам кафедр терапии и профболезней, нефрологии и гемодиализа и отдела нефрологии НИЦ ММА им. И.М.Сеченова за поддержку в проведении исследования.
СОДЕРЖАНИЕ РАБОТЫ
- Общая характеристика обследованных больных:
Исследовано 259 больных гипертонической болезнью (ГБ): 186 (65%) мужчин и 73 (35%) женщины в возрасте от 17 до 67 лет [46 (30-53) лет, медиана и интерквартильный размах (25-й-75-й процентиль)], наблюдавшихся во Владимирской областной клинической больнице с 1997 по 2007 годы. Группа исследования включала, в том числе 47 молодых людей призывного возраста (от 17 до 28 лет, средний возраст 20,6 (19-22) с хорошо документированным началом заболевания. Контрольную группу составили 57 здоровых лиц, сопоставимых по полу и возрасту с больными из группы исследования: 38 мужчин и 19 женщин от 20 до 63 лет, средний возраст 42 (31-49).
Верификацию диагноза ГБ проводили в соответствии с Российскими рекомендациями по диагностике и лечению артериальной гипертензии ВНОК 2008г. (третий пересмотр). Критериями диагноза считали офисное АД140/90, среднесуточное АД125-130/80 (в соответствии с методическими рекомендациями №96/234, Министерства здравоохранения РФ 1996г.) при суточном мониторировании на аппарате ТМ-2421, Япония. У молодых лиц призывного возраста при постановке диагноза дополнительно учитывали гипертонический тип реакции на нагрузку при велоэргометрии. Особое внимание уделяли исключению вторичного характера гипертензии. В исследование не включали больных с явной ПУ и гиперкреатининемией (более 133 мкмоль/л у мужчин и более 124 мкмоль/л у женщин).
У подавляющего большинства пациентов (76% всех обследованных) длительность ГБ не превышала 10 лет, более, чем у половины из них (75%) – стаж гипертензии был менее 5 лет. Длительное течение заболевания (16 лет) отмечено менее чем у 10% больных. Среди 259 пациентов у большинства (73%) установлены 1 (38%) и 2 (35%) степени ГБ, примерно у 27% - 3-я (более тяжелая) степень гипертонии. Среди 47 лиц призывного возраста у подавляющего большинства – 38(82%) диагностирована 1 степень повышения АД, у остальных была 2-я степень АГ, 3-я степень АГ не зарегистрирована ни в одном случае, длительность заболевания у всех не превышал 3-х лет.
У всех больных ГБ были изучены, у части повторно, тпопуляционные факторы риска, в т.ч. индекс массы тела (ИМТ), липидные фракции, обмен мочевой кислоты, гликемия и, так называемые, «новые» - уровень в сыворотке крови гомоцистеина (у 48) и у АДМА (у 65) больных.
Помимо общеклинического обследования больных проводили специальные исследования (таблица 1). Для характеристики изменений со стороны почек у всех больных исследовали МАУ методом иммуноферментного анализа, величину расчетной скорости клубочковой фильтрации - СКФ по формуле Кокрофта-Гоулта с коррекцией на стандартную площадь поверхности тела (мл/мин/1,73м2), уровень креатинина сыворотки крови - стандартным методом. Стадии ХБП определяли по критериям NKF K/DOKI (2002г).
Таблица 1. Общий объем исследований
| Показатели | Число исследований, в т.ч. повторных (n/n) |
| I. Метаболические факторы риска | |
| Индекс массы тела (ИМТ) | 259/105 |
| Общий холестерин (ОХ), ммоль/л | 259/105 |
| Триглицериды (ТГ), ммоль/л | 240/51 |
| Холестерин липопротеидов высокой плотности (ХЛВП) мм/л | 1608/51 |
| Холестерин липопротеидов низкой плотности (ХЛНП),мм/л | 160/51 |
| Глюкоза, ммоль/л | 248/105 |
| Мочевая кислота (МК) сыворотки крови, ммоль/л | 243/105 |
| Суточная экскреция мочевой кислоты (ЭМК), мг/сут | 218/0 |
| Асимметричный диметиларгинин (АДМА), мкмоль/л | 65/0 |
| Гомоцистеин, мкмоль/л | 48/0 |
| II. Показатели функции почек | |
| СКФ (по Кокрофту-Гоулту, мл/мин/1,73м2) | 212/105 |
| Креатинин крови, мкмоль/л | 212/105 |
| III. Специальные методы исследования | |
| Микроальбуминурия, мг/сут | 259/105 |
| Допплерография внутрипочечных артерий | в том числе 57 здоровых |
| Общие почечные артерии | 224/105 224/105 224/105 |
| Сегментарные артерии (RI, PI)* | |
| Междолевые артерии (RI, PI) | |
| УЗДГ сосудов | |
| комплекс интима-медиа общих сонных артерий (КИМ ОСА), мм | 128/68 71/0 |
| эндотелий-зависимая вазодилатация (ЭЗВД), % | |
| УЗИ сердца | |
| ЭХОКГ (с определением вариантов ремоделирования миокарда левого желудочка) | 208/80 |
| Мочевые тесты | в том числе 12 здоровых |
| нгибитор активатора плазминогена-1 (PAI-1) | 53 |
| трансформирующий фактор роста 1 (TGF-1) | 70 |
| эндотелиальный сосудистый фактор роста (VEGF) | 71 |
| коллаген ІV типа | 36 |
Примечание: *RI-индекс резистентности, PI-пульсационный индекс
Ультразвуковую допплерометрию периферических и внутрипочечных артерий (УЗДГ) проводили на аппарате SSD-5500 (Aloka, Япония). Исследовали интраренальные почечные артерии (сегментарные и междолевые) в проекции трех сегментов обеих почек. Среди изученных допплерометрических параметров - индекса резистентности (RI) и пульсационного индекса (PI) -показатель RI междолевых почечных артерий обладал по нашем данным наибольшей информативностью (чувствительность-0,75, специфичность -0,67 и положительная прогностическая значимость-90%), что позволило в дальнейшей работе использовать именно этот показатель для оценки внутрипочечный гемодинамики, принимая в качестве порогового значение RI 0,65.
Для оценки изменений магистральных и периферических артериальных сосудов рассчитывали усредненную величину комплекса интима-медиа дистальных отделов общих сонных артерий (КИМ ОСА) и изучали зависимую от эндотелия вазодилатацию плечевой артерии (ЭЗВД) в манжеточной пробе (по стандартной методике Сelermajer 1992г).
Эхокардиографическое исследование проводили на аппарате Sequoia-256 (Simens). Согласно классификации Ganau A. на основании величин индекса массы миокарда левого желудочка (ИММЛЖ) и индекса относительной толщины стенки (ИОТС) выделяли следующие геометрические типы ЛЖ: 1) нормальная геометрия (нормальный ИОТС<0,42 и нормальный ИММЛЖ 110г/м2 - у женщин и 125г/м2 - у мужчин); 2) концентрическое ремоделирование (ИОТС0,42 и ИММЛЖN); 3) концентрическая гипертрофия (ИОТС0,42 и ИММЛЖ>N); 4) эксцентрическая гипертрофия (ИОТС<0,42, ИММЛЖ>N).
Отдельным разделом работы было изучение мочевых биомаркеров межклеточных и клеточно-матриксных взаимодействий в почке. Иммуноферментным методом (ELISA) были определены концентрации в моче ингибитора активатора плазминогена (PAI-I) - маркера эндотелиальной дисфункции и состояния протеолиза/фибринолиза в почке (Technozim PAI-1 Antigen, Автрия), трансформирующего фактора роста-1 (TGF-1) - ключевого профиброгенного медиатора(«DRG MTPL» EIA-1864, Германия), сосудистого эндотелиального фактора роста (VEGF) - регулирующего пролиферацию эндотелия и проницаемость сосудистой стенки («BioSource International, Immunoassay Kit, США, Бельгия») и коллагена IV типа - структурного компонента эндотелиальных и эпителиальных базальных мембран и экстрацеллюлярного матрикса («Biotrin Internetional, LTD, Daiichi Fine Chemical Co, LTD, Ирландия, Япония »). Всего проведено 278 исследований этих биомаркеров.
Статистический анализ: Результаты исследования оценивали параметрическими и непараметрическими методами с помощью пакета прикладных программ STATISTICA (версия 7.0). При параметрическом распределении сравнение независимых групп по количественным переменным использовали t-критерия Стьюдента, F-критерий Фишера (однофакторный дисперсионный анализ), при непараметрическом распределении рассчитывали U-критерий Манна-Уитни. Для сравнения 3 и более групп применяли ранговый анализ вариаций - Н-критерий Краскела-Уоллиса, при проведении множественных парных сравнений количественных переменных проводили перерасчет уровня значимости р с поправкой Бонферрони. Для сравнения качественных переменных применяли классический критерий 2 по Пирсону, 2 с поправкой Иейтса (при абсолютных частотах в четырехпольной таблице <10) и точный критерий Фишера (при абсолютных частотах 5). Для сравнения частот бинарного признака в несвязанных группах применяли вычисление отношения шансов. Сравнение зависимых групп при непараметрическом распределении данных выполняли с использованием критерия Вилкоксона (Z) - для количественных признаков и критерия Мак-Немара (2) – для качественных признаков.
Оценку связей между показателями проводили с помощью корреляционного анализа: при нормальном распределении признака рассчитывали коэффициенты корреляции по Пирсону (r), при ненормальном распределении - коэффициент корреляции Спирмена (R).
Для анализа различий групп одновременно по 2 и более признакам, а так же для исследования закономерностей группирования взаимосвязанных переменных в локальные подмножества использовали методы многофакторного анализа: многофакторный дисперсионный анализ, кластерный анализ и анализ главных компонент. Для проведения многофакторного анализа абсолютные лабораторные параметры подвергли нормализации.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
1. Частота и уровень микроальбуминурии у больных ГБ.
Суточная экскреция альбумина с мочой среди 259 исследованных больных ГБ колебалась от 10,3 до 288 мг/сут. В группе пациентов с МАУ (186, 72%) уровень ее составил в среднем 51,73 (27,7-62) мг/сут; у остальных (73, 28%) пациентов ГБ величина альбуминурии не достигала степени МАУ и составила в среднем 22,4 (12,1-28) мг/сут. Распределение больных ГБ по длительности заболевания в группах больных с МАУ и без МАУ было примерно одинаковым (2=7,59, р>0,05), что позволило проводить последующий анализ особенностей поражения почек у них без учета стажа болезни.
1.1. Оценка гипертензионного синдрома и факторов риска в зависимости от наличия или отсутствия МАУ.
Группа пациентов ГБ с МАУ характеризовалась в целом более высокой частотой выраженной АГ, чем группа больных без МАУ (2=27,46, р=0,000001): так 3-я степень повышения АД выявлена у 37% больных с МАУ и лишь у 12 % - без МАУ(таблица 2).
Таблица 2. Характеристика гипертензионного синдрома в группах пациентов ГБ с МАУ и без МАУ.
| Степени АГ (САД/ДАД, мм рт.ст.) | без МАУ (n=73) | c МАУ (n =187) |
| 1 ст АГ (140-159/90-99) | 45 (62%) | 52 (28%) |
| 2 ст АГ (160-179/100-109) | 19 (26%) | 74 ( 35 %) |
| 3 ст АГ (180/110) | 9 (12%) | 61 (37%) |
Кроме того, нами было выявлено статистически значимое увеличение среднего уровня МАУ среди лиц с более выраженной (2-й и 3-й степенями) АГ (H(n=259)=41,99, p=0,00001 и =26,97, p=0,00001, таблица 3).
Таблица 3. Величина МАУ у пациентов в зависимости от степени АГ
| Степени АГ (САД/ДАД, мм рт.ст.) | Медиана (интерквартильный размах) |
| 1 ст АГ(140-159/90-99), n=97 | 32 9 (21-44,8)*.** |
| 2 ст АГ(160-179/100-109) n=93 | 44 (32-63) |
| 3 ст АГ (180/110) n=69 | 56 (35-85) |
Примечания: * различия достоверны (р<0,000004) между 1 и 2 группами пациентов
** различия достоверны (р<0,0000001) между 1 и 3 группами больных.
При анализе выраженности АГ отдельно среди призывников молодого возраста с ГБ отмечена та же тенденция (=5,14, р=0,07): несмотря на то, что у большинства из них (как с МАУ, так и без МАУ) была 1 степень АГ, фактически все случаи выявления более серьезной 2-й степени АГ относились к группе лиц с МАУ.
Возможность выявления МАУ у молодых пациентов с коротким стажем АГ, позволяет предполагать определенное значение наследственной предрасположенности как к самой ГБ, так и к гипертонической нефропатии.
При рассмотрении спектра факторов риска артериальной гипертензии в группах пациентов с МАУ и без МАУ не выявлено статистически значимой связи МАУ с полом пациентов и приверженностью к курению (таблица 4). Также не установлено достоверной связи МАУ с такими традиционными ФР, как нарушение липидного обмена (уровнем общего холестерина, липопротеидов низкой и высокой плотности, триглицеридами) и углеводного обмена (уровнем тощаковой гликемии). В то же время выявлена достоверная тесная корреляция МАУ с возрастом больных, нарушением обмена мочевой кислоты и ИМТ.
Таблица 4. Характеристика факторов риска ГБ в группах пациентов
с МАУ и без МАУ.
| Параметр | с МАУ(n=187) | без МАУ(n=73) | Достоверность различий |
| Пол, м/ж | 123/64 | 48/25 | 2=0,01, р=0,98 |
| Возраст, г | 47 (34-54) | 39,5 (21-49) | U=4761, р=0,0002 |
| Число курящих, n | 69 | 19 | 2=0,23, р=0,62 |
| ОХ, ммоль/л | 6,0 (5,2-6,8) | 5,6 (4,6-6,7) | F=3,29, р=0,07 |
| ЛПВП, ммоль/л | 1,1 (0,8-1,3) | 1,2 (0,95-1,41) | F=2,2, р=0,14 |
| ЛПНП, ммоль/л | 4,0 (3,4-4,9) | 3,8 (2,6-4,9) | F=2,7, р=0,09 |
| ТГ, ммоль/л | 1,7 (1,2-2,3) | 1,5 (1,1-2,05) | F=1,44, р=0,23 |
| Глюкоза, ммоль/л | 4,9 (4,4-5,3) | 4,7 (4,2-5,1) | F=2,43, р=0,12 |
| МК, мкмоль/л | 0,38 (0,31-0,43) | 0,33 (0,28-0,39) | F=8,8, р=0,0033 |
| ЭМК, мг/сут | 620 (510-730) | 470 (380-605) | F=17,7, р=0,00004 |
| ИМТ | 29 (26-33) | 27 (24-31) | F=8,9, р=0,0031 |
Кроме того в группе больных с МАУ по сравнению с группой больных без МАУ нами выявлены в среднем более высокий сывороточный уровень гомоцистеина (U=142, Z=3,31, р=0,047) и тенденция к гиперпродукции АДМА (U= 338, Z=0,82, р=0,37). Установлена тесная корреляционная связь уровня в сыворотке крови гомоцистеина с ИМТ (R=0,38; р<0,05) и гликемией (R=0,41; р<0,05); АДМА - с величиной урикемии (R=0,5; р<0,05) и гликемии (R=-0,34; р<0,05), что подтверждает признаваемую в настоящее время важную роль гомоцистеина и АДМА, в том числе опосредованно - через влияние на традиционные метаболические факторы риска, в развитии гипертонической нефропатии и артериальной гипертензии в целом.
1.2. Функциональное состояние почек в зависимости от наличия или отсутствия МАУ.
Среди обследованных 212 больных ГБ суммарная фильтрационная функция почек была выше у 59 пациентов без МАУ, чем среди 153 пациентов с МАУ, соответственно 108 (94-125) и 96,2 (79-116) мл/мин/1,73 м (U=6382, Z=-3,25, р=0,001). Для уточнения характера изменения СКФ в зависимости от наличия МАУ мы сопоставили частоту выявления нормофильтрации (СКФ от 90 до 130 мл/мин/1,73м2), гиперфильтрации (СКФ>130 мл/мин/1,73м) и гипофильтрации (СКФ<90 мл/мин/1,73м) в группах больных ГБ с МАУ и без МАУ. Частота нормальной и повышенной СКФ в этих группах статистически значимо не различалась, в то время как сниженная СКФ – гипофильтрация, выявлялась достоверно чаще в группе больных с МАУ (таблица 5).
При расчете вероятности (шанса) ухудшения функции почек оказалось, что шанс выявления гипофильтрации у пациентов с наличием МАУ в 2,2 раза выше, чем в группе больных без МАУ (59:94 против 13:46, отношение шансов=2,21). Особенностью этого этапа развития ГНП является отсутствие длительное время гиперкреатининемии (уровень креатинина крови среди больных с гипофильтрацией составил в среднем 99 (87,2-111,5) мкмоль/л.
Таблица 5. Частота нормальной, повышенной и сниженной СКФ в группах пациентов ГБ с МАУ и без МАУ.
| СКФ | с МАУ(n=153) | без МАУ (n=59) | Достоверность различий |
| Гиперфильтрация, СКФ 130 мл/мин/1,73 м, n=49 | 33 (21,5%) | 16 (27%) | 2 = 0,72, p=0,39 |
| Нормофильтрация, 90СКФ<130мл/мин/1,73 м, n=91 | 61 (40%) | 30 (51%) | 2 = 0,74; p=0,15 |
| Гипофильтрация, СКФ<90 мл/мин/1,73 м, n=72 | 59 (38,5%) | 13 (22%) | 2 = 5,19; p=0,023 |
При исследовании СКФ отдельно у 47 молодых пациентов призывного возраста с ГБ гипофильтрация не отмечена ни у одного пациента, гиперфильтрация выявлена у 21 (44,7%), у большинства - 16 (76%) с МАУ. Т.о, к наиболее ранним маркерам вовлечения в патологический процесс почек при ГБ относится МАУ. В дебюте ГБ появление МАУ сопряжено с гиперфильтрацией, развивающейся в результате нарушения механизмов ауторегуляции внутрипочечного кровотока, гиперсекреции локально-почечного ангиотензина ІІ (Brenner В., 1982; Hostetter T.M., 1981, Bidani К., 2004.). По мере развития ГНП происходит постепенное снижение СКФ (на ранней стадии менее 90, но не более 60 мл/мин/1,73м2) без гипекреатининемией. Дополнительное значение для развития гипофильтрации имеют факторы риска – избыточная масса тела, возраст и др.
1.3. Показатели внутрипочечной гемодинамики в зависимости от наличия и отсутствия МАУ.
Среди 224 больных ГБ, внутрипочечный кровоток у которых исследован допплерометрически, показатель RI междолевых почечных артерий в целом был статистически значимо выше, чем среди 57 здоровых лиц [соответственно 0,65 (0,61-0,675) и 0,6 (0,59-0,61), U=2366, Z=7,34, р=0,0000001].
Анализ средней величины RI и частоты высоких значений RI(>0,65) в зависимости от степени тяжести гипертензионного синдрома показал, что оба показателя были выше среди пациентов со 2-й и 3-й степенями АГ, чем среди пациентов с 1 степенью АГ (H(n=224)=17,14, р=0,0002). Так средний показатель RI составил у пациентов с 1 степенью АГ 0,63 (0,6-0,665), 2-й степенью АГ- 0,65 (0,61-0,665), с 3-ей степенью АГ-0,67 (0,64-0,7) (U1-2 =2535,5, Z1-2=-2,25, р=0,015; U1-3=1503; Z1-3=-3,97, р=0,00007, U2-3=2068, Z2-3 =-2,3, р=0,02); частота выявления высоких значений показателя RI (>0,65) в группах - соответственно 38%, 59% и 69% ( =12,01, р=0,0024).
Кроме того нами выявлена статистически значимая связь показателя RI с длительностью гипертензии (H(n=224)=25,17, р=0,00001): по мере увеличения стажа болезни повышались средний уровень и частота высоких показателей RI. Среди пациентов с длительностью заболевания более 5 лет повышенные значения RI(>0,65) выявлялись в 2,3 раза чаще, чем нормальные. В то же время среди пациентов ГБ с коротким стажем болезни (менее 5 лет) частота обнаружения повышенных значений RI была в 1,6 раза ниже, чем частота выявления нормальных значений RI. Однако, у 40% больных этой группы также выявлялась повышение внутрипочечного сосудистого сопротивления (показатель RI>0,65), что свидетельствует о возможности более раннего вовлечения почек как органа-мишени ГБ, требующего активного выявления.
Средний показатель RI был достоверно выше в группе больных ГБ с МАУ (138) - 0,66 (0,63-0,69), чем в группе - без МАУ (49) [0,62 (0,59-0,65), U=1576, Z=5,58, р=0,0000001]. При наличии МАУ вероятность выявления повышенных показателей RI зависела от суммарной фильтрационной функции почек.
Уже среди пациентов с гиперфильтрацией (в т.ч., лиц призывного возраста с коротким стажем артериальной гипертензии и невысоким АД) появляется вероятность (шанс) выявления повышенных показателей внутрипочечного сосудистого сопротивления (RI>0,65), но этот шанс незначителен (1,52, =0,07, р=0,79), при наличии гипофильтрации шанс возрастает в 7 раз (=11,03, р=0,0009), (рисунок 1). 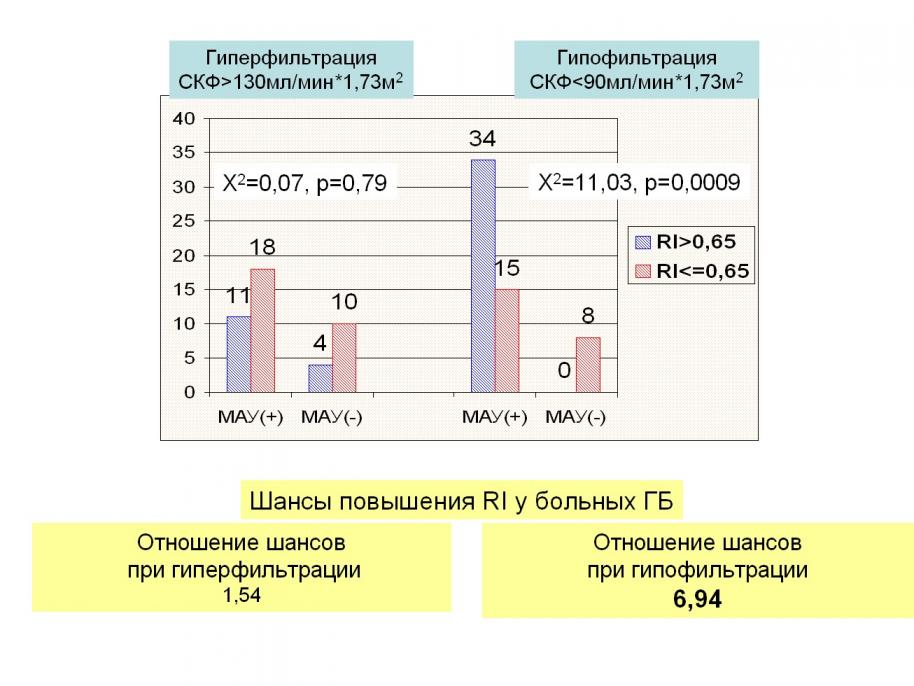 Рисунок 1. Частота выявления высоких показателей RI (>0,65) у пациентов ГБ с МАУ, гипер- и гипофильтрацией.
Рисунок 1. Частота выявления высоких показателей RI (>0,65) у пациентов ГБ с МАУ, гипер- и гипофильтрацией.
Проведенный нами корреляционный анализ выявил наличие двусторонних связей между показателями МАУ и СКФ (r=-0,22, р<0,05), RI и МАУ (r=0,53, р<0,05) RI и СКФ (r=-0,27, р<0,05).
Таким образом, степень повышения внутрипочечного сосудистого сопротивления, оцениваемого по RI междолевых почечных артерий (>0,65) коррелирует с величиной АД, длительностью АГ, величиной МАУ и снижением СКФ и может рассматриваться как показатель дальнейшего развития ранней стадии ГНП. Патофизиологической основой этих изменений считают гипертоническое ремоделирование внутрипочечных сосудов, обеднение микроциркуляторного русла, ведущее к снижению почечного кровотока и ишемии ткани почки. Важную роль в этих процессах играют эндотелиальная дисфункция и связанные с ней механизмы накопления экстрацеллюлярного матрикса (ЭЦМ).
1.4. Определение мочевых биомаркеров эндотелиальной дисфункции, механизмов протеолиза/фибринолиза и фиброангиогенеза в почке у больных ГБ с МАУ и без МАУ.
Показатели всех изученных мочевых биомаркеров (молекулярных медиаторов) – PAI-1,TGF-1 и VEGF, кроме коллагена ІV типа, были достоверно выше у больных ГБ, чем в контрольной группе (таблица 6).
Таблица 6. Величина мочевой экскреции изученных биомаркеров в группах больных ГБ и практически здоровых лиц (медиана и интерквартильный размах).
| Показатель | n | больные ГБ | n | здоровые лица | достоверность различий |
| PAI-1 (мкг/мл) | 53 | 0,176 (0,152-0,194) | 12 | 0,147 (0,140-0,157) | U=104,5, Z=2,68, р=0,007 |
| TGF-1(пг/мл) | 70 | 0,270 (0,225-0,297) | 12 | 0,211 (0,2-0,223) | U=110,5, Z=2,79, р=0,005 |
| VEGF (пг/мл) | 71 | 81,33 (68,5-88,74) | 12 | 52,68 (47,85-61,43) | U=69,5, Z=3,81, р=0,0001 |
| коллаген ІV типа (нг/мл) | 36 | 7,57 (3,21-15,5) | 12 | 5,09 (2,15-6,4) | U=86,5, Z=1,75, р=0,08 |
Средний уровень изученных биомаркеров, в том числе коллагена ІV типа, был достоверно выше у пациентов ГБ с микроальбуминурией (табл. 7).
Таблица 7. Величина мочевой экскреции изученных биомаркеров
среди больных ГБ с МАУ и без МАУ (медиана, интерквартильный размах).
| Показатель | n | Больные ГБ с МАУ | n | Больные ГБ без МАУ | Достоверность различий |
| PAI-1, мкг/мл | 42 | 0,184 (0,165-0,197) | 11 | 0,147 (0,130-0,161) | t=3,26, р=0,002 |
| TGF-1, пг/мл | 53 | 0,29 (0,244-0,306) | 17 | 0,21 (0,193-0,237) | t=3,96, р=0,0002 |
| VEGF, пг/мл | 54 | 83,4 (73,15-90,73) | 17 | 69,7 (64,1-78,42) | U=251, Z=2,81, р=0,005 |
| Коллаген ІV типа, нг/мл | 26 | 10,3 (5,36-17,52) | 10 | 3,07 (2,11-4,91) | U=55, Z=2,65, р=0,008 |
Мы провели изучение характера взаимосвязей между экскретируемыми с мочой медиаторами и клиническими маркерами ГНП (схема 1). Нами выявлены статистически значимые прямые корреляции между выраженностью МАУ и экскрецией с мочой PAI-1 (R=0,53, р=0,00004, мощность критерия W=0,99), TGF-1 (R=0,48; р=0,0002, мощность критерия W=0,99), коллагена ІV типа (R=0,43, р=0,009, мощность коэффициента корреляции W=0,76) и VEGF (R=0,36, р=0,001, мощность коэффициента корреляции 0,88). Отмечена тесная корреляция величины экскреции с мочой коллагена ІV типа не только с МАУ, но и показателем RI (r=0,73, р=0,01), что позволяет рассматривать этот показатель у больных ГБ как дополнительное свидетельство дальнейшей эволюции ГНП – накоплении компонентов ЭЦМ в почечной ткани.
Кроме того, корреляционный анализ выявил статистически значимые связи между экскрецией с мочой PAI-1 и TGF-1 (R=0,37, р=0,0066, мощность критерия 0,79), а так же между TGF-1 и VEGF (R=0,42, р=0,0003, мощность критерия 0,96) и всех этих факторов - с МАУ, что подтверждает развитие локально-почечной дисфункции эндотелия и сопряженных с ней процессов ремоделирования сосудистой стенки на ранней стадии ГНП. С другой стороны мочевые биомаркеры характеризуют эндотелиальную дисфункцию в почке и в целом раннюю стадию ГНП наряду с таким интегральным клиническим маркером как МАУ.
Схема 1. Корреляционный анализ взаимосвязей мочевых биомаркеров, МАУ, показателя RI и величины CКФ (представлены статистические значимые коэффициенты корреляции R, р<0,05).
Нами была обнаружена также тесная прямая связь мочевой экскреции коллагена ІV типа с RI и обратная связь RI с СКФ. Такой характер взаимосвязей может означать, что повышение экскреции коллагена ІV типа у больных ГБ отражает усиление процесса фиброангиогенеза в почке.
Этапность развития ранней стадии ГНП подтверждается результатами проведенного нами многофакторного анализа взаимоотношений всех изученных маркеров ГНП (рисунок 2).

Рисунок 2. Многофакторный анализ взаимоотношений маркеров
гипертонической нефропатии.
По результатам этого анализа были выделены два фактора, объяснивших 75% дисперсии изученных признаков в исследованной группе больных ГБ. Фактор 1 (29% дисперсии), объединяющий МАУ, PAI-1, TGF-1 и VEGF, предположительно можно рассматривать как свидетельство локально-почечной дисфункции эндотелия, который на начальном этапе имеет адаптивный характер, направленный на сохранение механизма ауторегуляции внутрипочечного кровотока. Фактор 2 (46% дисперсии), объединяющий в одну группу показатели МАУ, RI и мочевую экскрецию коллагена ІV типа, по-видимому, отражает следующий этап развития ГНП – дезадаптивное ремоделирование микроциркуляторного русла почки с гипоперфузией и усилением ишемии почечной ткани.
С клинических позиций выявление у больных ГБ совокупности указанных маркеров – микроальбуминурии, высокого индекса резистентности (RI>0,65), тенденции к снижению СКФ (<90 мл/мин/1,73м2), выделения с мочой повышенного количества коллагена ІV типа, является обоснованием определенного диагноза ГНП.
2. Оценка системной дисфункции эндотелия и поражения органов сердечно-сосудистой системы у больных с клиническими маркерами ранней стадии ГНП.
Учитывая современные представления о МАУ как показателе не только локально-почечной, но и системной дисфункции эндотелия нами было проведено исследование зависимой от эндотелия вазодилатации у больных ГБ с клиническими маркерами ранней стадии ГНП - МАУ RI и СКФ.
Проведенный анализ выявил статистически значимую связь выраженности системной дисфункции эндотелия с величиной МАУ (Н (n=71)=15,94, p=0,0003) и показателем RI (H (n=71)=13,96, p=0,0009).
МАУ нарастала от группы больных с сохранной системной функцией эндотелия (ЭЗВД >8%, гр.1) к группам пациентов с умеренной (ЭЗВД 4-8%, гр.2), выраженной (ЭЗВД<4%, гр.3) эндотелиальной дисфункцией, причем с последней разница была достоверной (U1-3= 9,5, Z1-3=-3,52, р=0,0005, U1-2=269, Z1-2=-2,97, U2-3=93, Z2-3=-1,88, с поправкой Бонферрони р1-2 и р2-3 >0,05, рисунок 3, А).
RI был статистически значимо выше в группах пациентов ГБ с умеренной (ЭЗВД 4-8%, гр.2) и выраженной (ЭЗВД<4%, гр.3) системной эндотелиальной дисфункцией, чем в группе больных с сохранной вазомоторной функцией эндотелия (ЭЗВД>8%, гр.1) (U1-2=254,5, Z1-2=-3,07, р=0,002, U1-3=50,5, Z1-3=-3,11, р=0,002, U2-3=127, Z2-3=-2,97, с поправкой Бонферрони р2-3>0,05, рисунок 2, Б).
Ухудшения системной функции эндотелия по мере увеличения МАУ и RI по мере подтверждается и наличием статистически высоко значимой обратной корреляции между этим показателем и величиной МАУ (R1=-0,48, р=0,00002, рис.3, В) и RI (R2=-0,41, р=0,005, рис.3, Г) и позволяет считать эти показатели локально-почечными проявлениями системной эндотелиальной дисфункции.
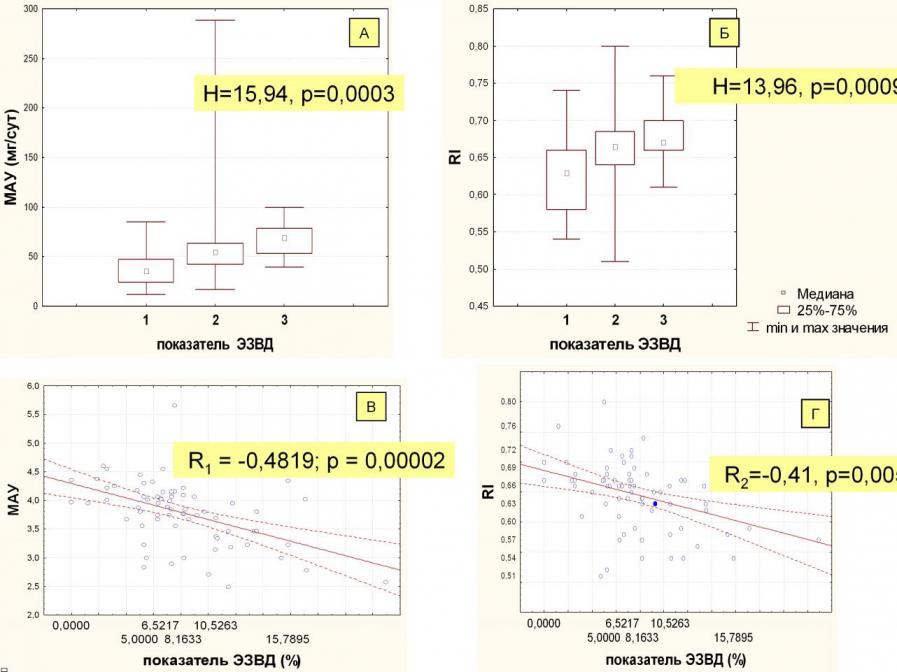
Рисунок 3. Взаимоотношения показателя ЭЗВД с МАУ и RI.
Нами выявлена достоверная корреляция опосредованно через МАУ между показателем ЭЗВД и мочевыми биомаркерами и через RI между ЭЗВД и коллагеном ІV типа (схема 2).

Схема 2. Корреляционные связи между показателем ЭЗВД
и клиническими маркерами ГНП (представлены статистические значимые коэффициенты корреляции R, р<0,05).
Кроме того в исследованной группе из 70 больных ГБ установлена статистически значимая связь между показателем ЭЗВД и ультразвуковыми признаками гипертонического ремоделирования миокарда ЛЖ (H(n=70)=8,71, p=0,013) и общих сонных артерий (Н(n=70)=16,24, p=0,0003): по мере снижения показателя ЭЗВД увеличивалась выраженность концентрического ремоделирования миокарда ЛЖ и толщина КИМ ОСА.
Такой характер корреляций еще раз подтверждает высказанное нами положение о том, что МАУ (и RI) является локально-почечным проявлением генерализованной дисфункции эндотелия, ведущей к перестройке сосудистого русла почки и других органов-мишеней ГБ - сердца и сосудистой стенки с их структурно-функциональным изменением.
Нами выявлена прямая связь между степенью ремоделирования миокарда и выраженностью МАУ (Н (n=180) =13,58, p=0,0011). МАУ нарастала от группы больных с нормальной геометрией ЛЖ (НГЛЖ, гр.1) к группам больных с концентрическим ремоделированием (КРЛЖ, гр.2) и концентрической гипертрофией левого желудочка сердца (ГЛЖ, гр.3), с последней группой больных разница была достоверной (U1-3=629,5, Z 1-3= -3,67, p=0,0002; U1-2=2034,5, Z1-2=-2,08, U2-3=1115, Z2-3=-2,02, с поправкой Бонферрони, p1-2 и p2-3>0,05, рисунок 4, А). Еще более четкая связь (Н(n=166)=14,3, р=0,0008) отмечена нами между степенью ремоделирования левого желудочка сердца и величиной RI междолевых артерий. Средние показатели RI в группах пациентов с КРЛЖ и ГЛЖ были статистически значимо выше, чем в группе больных с нормальной геометрией ЛЖ (U1-2=1612, Z1-2=2,45, p=0,014; U1-3=552,5, Z1-3 =3,51, p=0,0005; U2-3=953,5, Z2-3 = -2,01, с поправкой Бонферрони p2-3>0,05), что позволяет считать показатель RI междолевых почечных артерий чувствительным методом оценки поражения сердца у больных ГНП в рамках рено-кардиального континуума(рисунок 4, Б). По нашим данным при развитии ГНП, проявляющимся повышением RI и постепенным снижением СКФ, увеличивается вероятность формирования ГЛЖ (Н(n=172)=13,3, р=0,0013, соответственно U1-3= 541, Z1-3= 3,77, р=0,0002; U2-3= 913, Z2-3= 2,61, р=0,009; U1-2=2072, Z1-2=1,15, с поправкой Бонферрони р1-2 >0,05, рисунок 4, В).
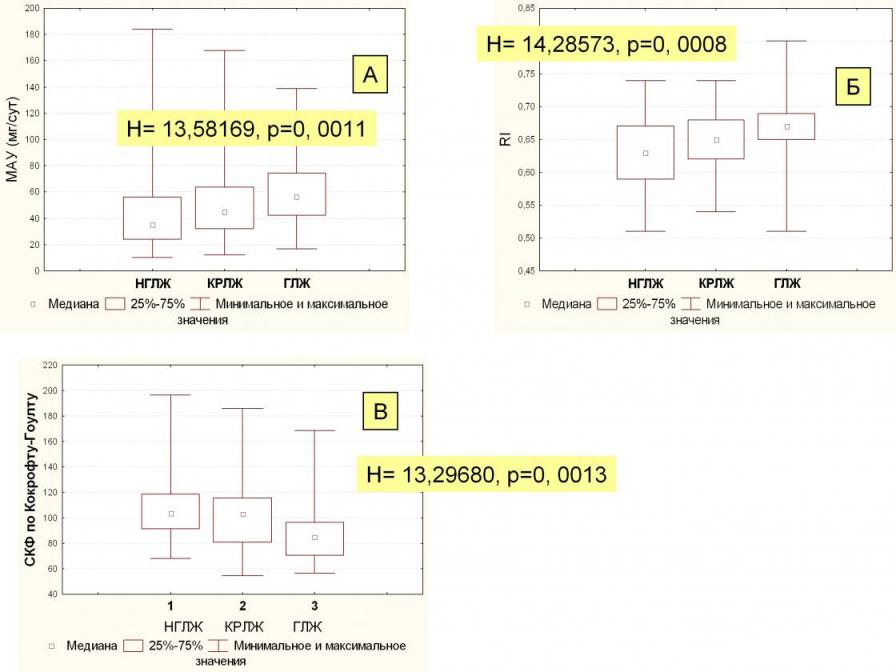
Рисунок 4. Связь МАУ, RI и СКФ с разной степенью ремоделирования
миокарда левого желудочка.
У пациентов с ранней стадией ГНП также выявлены ультразвуковые признаки гипертрофического ремоделирования общих сонных артерий, проявляющиеся статистически значимым увеличением среднего показателя КИМ ОСА среди пациентов ГБ с МАУ (U=584,5, Z=4,4, p=0,00001) и высоким показателем RI (U=968,5, Z=3,53, p=0,00041, рисунок 5, А и Б). В то же время отмечена лишь тенденция (Н(n=97)=0,3, р=0,9) к увеличению КИМ ОСА в группе больных с уровнем СКФ <90 мл/мин/1,73м2 (рисунок 5, В).

Рисунок 5. Связь МАУ(А), RI (Б) и СКФ (В) с величиной комплекса интима-медиа общих сонных артерий.
Нами обнаружены тесные взаимосвязи между изученными компонентами рено-кардио-васкулярного континуума – МАУ, RI, СКФ, ИММЛЖ и КИМ ОСА: прямая связь между МАУ, СКФ, RI, КИМ ОСА и ИММЛЖ, обратная связь между МАУ, СКФ, RI, КИМ ОСА и ИММЛЖ и показателем ЭЗВД (схема 3).
Схема 3. Взаимосвязь показателя ЭЗВД и компонентов рено-кардиоваскулярного континуума у обследованных больных ГБ (представлены статистические значимые коэффициенты корреляции R, р<0,05)
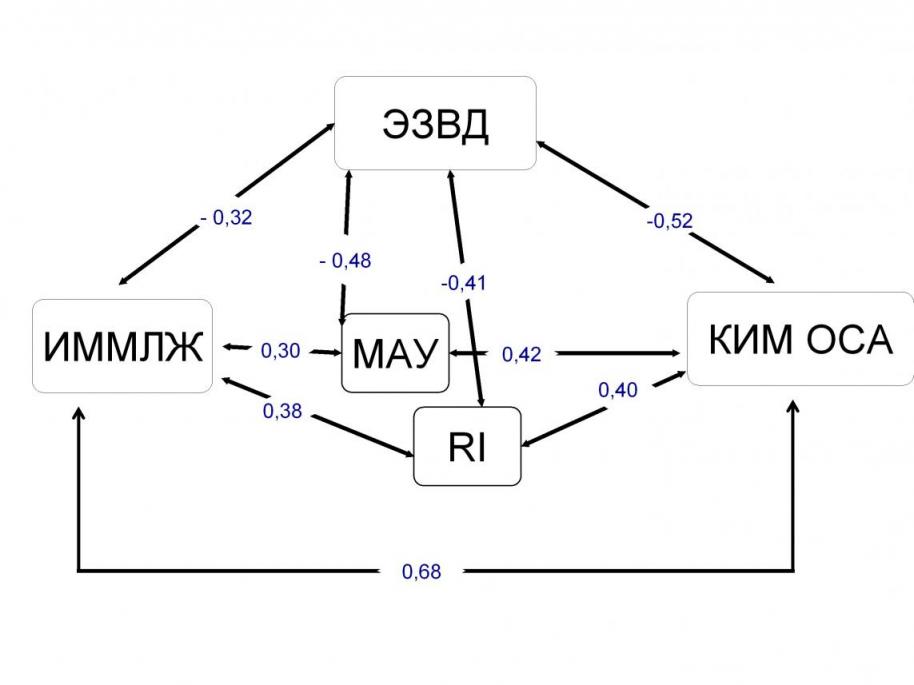
Таким образом, из приведенных данных следует, что больные с ранней стадией ГНП представляют собой группу риска развития не только ренальной дисфункции, но и сердечно-сосудистых заболеваний и их осложнений (ССО). В этом смысле исследование МАУ и других маркеров ГНП важно с точки зрения мониторирования рено-кардио-васкулярного континуума и обоснования активной антигипертензивной терапии.
3. Оценка нефропротективного и кардиопротективного эффектов ингибиторов АПФ у больных ГНП.
Для оценки влияния коррекции ранней стадии ГНП на прогрессирование рено-кардио-васкулярного континуума у больных ГБ мы изучили динамику маркеров ГНП в результате блокады ангиотензина ІІ - многоуровневого регулятора процессов фиброангиогенеза в почке.
С этой целью среди наблюдаемых нами больных была выделена группа (72), которым активно проводились мероприятия по коррекции образа жизни с минимизацией факторов риска. С целью блокады нежелательных эффектов ангиотензина II были назначены ингибиторы АПФ - ренитек или фозиноприл не менее 6 месяцев, при необходимости, главным образом, у больных с третьей степенью АГ (у которых не удавалось достичь целевого уровня АД) с добавлением антагонистов кальция.
Среди 72 больных целевой уровень АД (<130/80 мм рт.ст.) был достигнут у 41 (55%), у остальных 31 (45%) этого добиться не удалось, хотя снижение среднего уровня САД и ДАД к концу 6-месячного периода наблюдения было статистически значимым и в этой группе (таблица 8).
По истечении 6 месяцев приема ингибиторов АПФ у 41 пациента был достигнут целевой уровень АД (<130/80 мм рт.ст.), отмечено достоверное снижение ИМТ, общего холестерина, триглицеридов, мочевой кислоты в сыворотке крови (таблица 8).
Таблица 8. Динамика показателей, характеризующих метаболические нарушения и поражение органов-мишеней у пациентов ГБ, достигших целевого уровня АД (n=41)
| показатель | до лечения | длительность наблюдения 6 месяцев | критерий Вилкоксона (Z, р) |
| САД(мм рт.ст.) | 155 (145-60) | 129 (125-135) | Z=5,05, р=0,0000001 |
| ДАД(мм рт.ст.) | 96 (90-00) | 81 (80-85) | Z=5,44, р=0,0000001 |
| ИМТ(кг/м2) | 27,9 (5,6-9) | 26,8 (24,7-28) | Z=2,71, р=0,006 |
| ОХ(ммоль/л) | 5,98 (5,3-6,9) | 5,27 (4,5-6) | Z=2,88, р=0,004 |
| ТГ(ммоль/л) | 1,76 (1,06-2,4) | 1,17 (0,8-1,5) | Z=2,85, р=0,004 |
| глюкоза(ммоль/л) | 4,76 (4,4-5,3) | 4,6 (4,3-5,1) | Z= 1,37, р=0,17 |
| МК(ммоль/л) | 0,38 (0,31-0,44) | 0,34 (0,28-0,38) | Z= 2,73, р=0,006 |
| МАУ (мг/сут) | 56,8 (39-65,5) | 25,5 (16-31) | Z= 5,48, р=0,0000001 |
| RI | 0,65 (0,62-0,68) | 0,62 (0,59-0,655) | Z=3,2, р=0,001 |
| СКФ(мл/мин/1,73м2) | 107,7(80,9-129,6) | 114,5 (99,5-128) | Z=0,98, р=0,32 |
| креатинин(мколь/л) | 84,8 (70,5-95) | 85,7 (76-93,5) | Z= 0,78, р=0,43 |
Статистически значимое величины альбуминурии с полным исчезновением МАУ у 28 (68%). Среди этих 28 больных с нормоальбуминурией через 6 месяцев лечения ингибиторами АПФ, у 27 отмечались и нормальные величины RI, причем у 10 из них RI нормализовался при исходно повышенном его уровне (критерий Мак-Немара =9,09, р=0,026). У 14 (34%) пациентов с достигнутым и поддерживаемым в течении 6 месяцев целевым АД произошла нормализация СКФ за счет ее повышения при гипофильтрации (у 6), снижения - при гиперфильтрации (у 8) (критерий Мак-Немара 2=5,88, р=0,015), средняя величина СКФ при этом не изменилась
У части больных (из 41) с достигнутым целевым уровнем АД сохранились клинические признаки ГНП: МАУ - у 13 (32%), повышенное внутрипочечное сосудистое сопротивление (RI>0,65) - у 14 (34%) и отклонения СКФ - у 24 % (у 7 повышенная СКФ и у 3 - сниженная фильтрация), что указывает на необходимость более длительной (превышающей 6 месяцев) терапии ингибиторами АПФ у пациентов ГНП для обеспечения эффективной нефропротекции.
В группе из 31 больного с недостигнутым целевым уровнем АД отмечено достоверное снижение уровня мочевой кислоты в сыворотке крови. Значимого изменения остальных метаболических факторов риска по сравнению с исходным уровнем в этой группе не наблюдалось. Более того, к концу 6-месячного срока отмечено достоверное увеличение ИМТ (таблица 9). Средний уровень МАУ в целом по группе через 6 месяцев снизился, однако у 20 (65%) больных он оставался диагностически значимым. Показатели RI и СКФ в среднем по группе изменились незначительно (р>0,05), лишь у 3-х из 18 пациентов с исходно повышенным RI к концу исследования этот показатель нормализовался.
Таблица 9. Динамика показателей, характеризующих метаболические нарушения и поражение органов-мишеней у пациентов ГБ, не достигших целевого уровня АД (n=31)
| показатель | до лечения | длительность наблюдения 6 месяцев | критерий Вилкоксона (Z, р) |
| САД (мм рт.ст.) | 180 (160-200) | 151 (145-160) | Z=4,65, р=0,000005 |
| ДАД (мм рт.ст.) | 109 (100-120) | 89,7 (90-95) | Z=4,62, р=0,000004 |
| ИМТ (кг/м2) | 31,7 (29-34,7) | 32,9 (29-35,8) | Z=1,39, р=0,006 |
| ОХ (ммоль/л) | 6,43 (5,4-7,1) | 5,9 (5,5-6,2) | Z=1,57, р=0,11 |
| ТГ (ммоль/л) | 1,94 (1,02-2,33) | 1,88 (1,1-2,4) | Z=0,24, р=0,8 |
| Глюкоза (ммоль/л) | 4,96 (4,4-5,6) | 5,08 (4,45-5,65) | Z= 0,37, р=0,7 |
| МК(ммоль/л) | 0,40 (0,32-0,48) | 0,35 ([0,3-0,39) | Z= 2,79, р=0,005 |
| МАУ(мг/сут) | 69,6 (38,7-95) | 39,4 (27-49) | Z= 3,95, р=0,00008 |
| RI | 0,667 (0,65-0,7) | 0,66 (0,64-0,68) | Z=1,34, р=0,1 |
| СКФ (мл/мин/1,73м2) | 106,7 (87-125) | 102,5 (80,5-123,5) | Z=0,52, р=0,6 |
| креатинин(мколь/л) | 85,0 (71-99) | 84,6 (75,5-95) | Z= 0,78, р=0,43 |
В течение более длительного срока, в среднем 5 лет, мы наблюдали 33 пациента с ГНП, из них только у 6 удалось поддерживать целевой уровень АД весь срок. У всех этих больных МАУ не выявлялась и RI был в пределах нормы. У остальных 27 больных, у которых целевой уровень АД длительно поддерживать не удавалось - регистрировалось повышенное АД, хотя и ниже исходного, МАУ персистировала и выявлялись высокие показатели RI (таблица 10). Среди 17 больных с исходной гипофильтрацией (СКФ <90 мл/мин/1,73м2) у 6 через 5 лет наблюдения СКФ достигла уровня <60 мл/мин/1,73м2 (стадия III ХБП). У 7 из больных этой группы гипофильтрация (СКФ<90 мл/мин/1,73м2) развилась de novo, т.е. наблюдалось прогрессирование поражения почек.
Таблица 10. Динамика показателей, характеризующих метаболические нарушения и поражение органов-мишеней у пациентов ГНП, не достигших целевого уровня АД при длительном наблюдении (n=27).
| показатель | до лечения | длительность наблюдения 5 лет | критерий Вилкоксона (Z, р) |
| САД (мм рт.ст.) | 169,6 [160;180 ] | 150 [145;160 ] | Z=3,77, р=0,000162 |
| ДАД (мм рт.ст.) | 100,3 [90-110] | 88,11 [85;95] | Z=3,48, Р=0,00051 |
| ИМТ(кг/м2) | 29,8 [26,8;33,5 ] | 30,92 [27,3;34,3 ] | Z=2,0, р=0,045 |
| ОХ (ммоль/л) | 6,52 [5,8;7,5] | 6,5 [5,5;7,4 ] | Z=0,48, Р=0,63 |
| ТГ(ммоль/л) | 2,00 [1,09;2,5 ] | 2,1 [1,1;2,69 ] | Z=0,11, Р=0,9 |
| глюкоза(ммоль/л) | 5,19 [4,7;5,8 ] | 5,11 [4,5;5,6 ] | Z= 1,03, р=0,3 |
| МК(ммоль/л) | 0,37 [0,3;0.44] | 0,37 [0,29;0,46 ] | Z= 0,55, Р=0,58 |
| МАУ(мг/сут) | 68 [38,2;85,5 ] | 55,52 [35;64 ] | Z= 1,24, Р=0,2 |
| RI | 0,67 [0,66;0,7 ] | 0,68 [0,67;0,7] | Z=1,3, Р=0,19 |
| СКФ(мл/мин/1,73м2) | 90 [68,9;111,5 ] | 73,35 [58,8;84 ] | Z=2,44, Р=0,01 |
| креатинин(мколь/л) | 87,2 [69;98,6 ] | 93,4 [86;100 ] | Z= 1,2, Р=0,2 |
Среди 72 больных ГНП, принимающих ингибиторы АПФ в течение 6 месяцев, статистически значимой положительной динамики УЗИ- показателей ремоделирования миокарда ЛЖ и ОСА не выявлено. Однако у 27 с ГНП, у которых удалось к концу 6-месячного наблюдения добиться исчезновения МАУ и показателя RI, признаков прогрессирования гипертрофии миокарда и общих сонных артерий не отмечено. Более того, к концу периода наблюдения у 1 пациента концентрическая гипертрофия миокарда левого желудочка трансформировалась в концентрическое ремоделирование и у 6 - с исходным КРЛЖ наблюдался регресс эхографических признаков ремоделирования миокарда левого желудочка (=5,14, р=0,02). Статистически значимой динамики величины КИМ ОСА выявлено не было.
Через более длительный срок (спустя 5 лет) эхокардиографические параметры были оценены у 33 больных. Среди них у 27 с персистирующей в течение 5 лет ГНП регресса гипертрофического ремоделирования миокарда и ОСА по сравнению с исходным уровнем не выявлено, напротив, отмечена тенденция к увеличению среднего по группе ИММЛЖ - соответственно 108,9 (98-116) г/м2 и 116 (100-130) г/м2 (Z=0,98, р=0,32) и величины КИМ ОСА - соответственно 1,08 (1-1,2) мм и 1,17 (1-1,4) мм (Z=0,9, р=0,37). Более того в этой группе больных ГНП у 9 пациентов отмечено прогрессирование признаков ремоделирования миокарда ЛЖ - формирование КРЛЖ при исходно нормальной геометрией ЛЖ (у 3) и формирование ГЛЖ при исходной КРЛЖ (у 6). Кроме того, среди пациентов с неэффективно леченной ГНП в отсутствии статистически значимой динамики средней по группе величины КИМ ОСА у 6 отмечено увеличение гипертрофии сосудистой стенки.
Таким образом, наличие персистирующей ГНП увеличивает сердечно-сосудистый риск у больных ГБ. У отдельных больных этой группы за 5-летний период развились сердечно-сосудистые осложнения - инфаркт миокарда (1) и мозговой инсульт (2). Поэтому контроль за течением ГНП, начиная уже с ранней стадии – это реальный путь профилактики не только прогрессирования ХБП, но и развития сердечно-сосудистых осложнений в рамках рено-кардио-васкулярного континуума.
ВЫВОДЫ:
1. Поражение почек как органа-мишени ГБ у 40% больных начинает формироваться рано - в течение 5 лет от дебюта заболевания. К факторам риска ГНП относятся выраженность самого гипертензионного синдрома и популяционные факторы риска - увеличение индекса массы тела (F=8,94, р=0,0031), нарушение обмена мочевой кислоты (урикемия F=8,23, р=0,0041, урикозурия F=19,7, р=0,00004), а также гиперпродукция гомоцистеина (U=142, р=0,047) и неадекватный синтез асимметричного диметиларгинина (U=338, р=0,41), при определенной роли наследственного фактора и индивидуальных особенностей образа жизни.
2. Ранняя стадия ГНП - динамический процесс, имеющий на каждом этапе свои клинико-функциональные и биомаркеры. К наиболее ранним маркерам ГНП относится микроальбуминурия (МАУ), развивающаяся вследствие гемодинамически обусловленной дисфункции эндотелиоцитов внутрипочечных сосудов. Последующим этапом формирования ГНП является повышение внутрипочечного сосудистого сопротивления (ВПСС), регистрируемого допплерометрическим методом (RI>0,65) и изменения суммарной фильтрационной функции почек - ранняя гиперфильтрация и последующее начальное снижение скорости клубочковой фильтрации (СКФ<90 и 60мл/мин/1,73м2) длительно без гиперкреатининемии. Существует тесная корреляционная прямая связь величины МАУ с показателем RI, и обратная связь МАУ и RI со степенью снижения СКФ.
3. Выявление МАУ у больных ГБ сопровождается повышенной экскрецией с мочой молекулярных медиаторов- ингибитора активатора плазминогена-1 (PAI-1) трансформирующего фактора роста (TGF-1) и сосудистого эндотелиального фактора роста (VEGF). Отмечена прямая корреляция между величиной МАУ и уровнем экскрецией этих медиаторов (соответственно RPAI-1-МАУ=0,53, р=0,00004, RTGF 1-МАУ=0,48, р=0,0002, RVEGF-МАУ=0,36, p=0,01), между уровнем экскреции PAI-1 и TGF-1 (R=0,37, p=0,007), TGF-1 и VEGF (R=0,42, p=0,0003), что, с одной стороны, подтверждает патогенетическую роль изученных мочевых биомаркеров эндотелиальной дисфункции и фиброангиогенеза в почке при ГНП, с другой - свидетельствует о возможности использования этих мочевых тестов наряду с МАУ для диагностики ранней стадии ГНП.
4. Формирующееся вследствие фиброангиогенеза ремоделирование внутрипочечных сосудов с ишемией ткани почки - патофизиологической основы ГНП, проявляется экскрецией с мочой коллагена IV типа, коррелирующей с величиной МАУ (R=0,43, р=0,009) и степенью увеличения внутрипочечного сосудистого сопротивления – RI (r=0,73, р<0,01). Тесная связь между этими показателями свидетельствует об их значении в совокупности с начинающимся снижением СКФ для оценки дальнейшего (более позднего) этапа развития ранней стадии ГНП.
5. Имеется достоверная связь с маркерами поражения почек- МАУ и RI и степени снижения эндотелий-зависимой вазодилатации [с МАУ (Н=15,94, р=0,0003) и с RI (Н=13,96, р=0,0009)], выраженности ремоделирования миокарда левого желудочка [с МАУ (Н=13,58, р=0,0011) и с RI (Н=14,29, р=0,0008)] и гипертрофии общих сонных артерий [с МАУ (Z=4,4, р=0,00001) и с RI (Z=3,63, р=0,0004)], что обосновывает целесообразность исследования маркеров ГНП для оценки сердечно-сосудистого риска и связанных с ним осложнений при ГБ.
6. Применение у больных ГБ, в том числе у молодых пациентов с непродолжительным стажем болезни, наряду с мероприятиями по модификации факторов риска, также лекарственных средств (ингибиторов АПФ), нивелирующих неблагоприятные действия ангиотензина ІІ на процессы фиброангиогенеза в почке, оказывает нефропротективный и кардиопротективный эффекты, проявляющиеся в исчезновении МАУ, нормализации показателя RI и СКФ, уменьшении степени ремоделирования миокарда ЛЖ и общих сонных артерий.
Практические рекомендации
1. Больные с неконтролируемой артериальной гипертензией (особенно со 2-й и 3-й степенями повышения АД) вне зависимости от длительности заболевания представляют собой группу риска поражения почек. Наиболее ранним маркером ГНП является появление МАУ (альбуминурия более 30 мг/сут).
2. Риск развития ГНП выше у больных с выявлением увеличенного внутрипочечного сосудистого сопротивления. При повышении RI (>0,65) в междолевых почечных артериях больные ГБ требуют особенно тщательного контроля АД с поддержанием целевого уровня 130/80 мм рт.ст.
3. У больных ГБ с персистирующей МАУ и показателем R>0,65 повышается вероятность изменения СКФ от начальной гиперфильтрации (СКФ>130 мл/мин/1,73м2) к снижению СКФ. У больных ГНП о нарушении фильтрационной функции почек может свидетельствовать уже незначительное снижение СКФ (< 90 мл/мин/1,73м2).
4. Более углубленно об этапах развития ранней стадии ГНП можно судить по спектру мочевых биомаркеров эндотелиальной дисфункции и фиброангиогенеза - экскреции с мочой PAI-I, TGF-1, VEGF и коллагена IV типа. Высокий уровень экскреции с мочой коллагена IV типа указывает на усиление процессов дезадаптивного ремоделирования внутрипочечных сосудов – более поздний этап развития ГНП.
5. При выявлении у больных ГБ указанных клинических маркеров ГНП – МАУ, повышенного RI, изменения СКФ заставляет предполагать развитие поражения органов сердечно-сосудистой системы.
6. Применение для поддержания целевого уровня АД средств нивелирующих негативные эффекты ангиотензина II – реальный путь профилактики не только ГНП, но сердечно-сосудистых осложнений у больных ГБ.
Список работ, опубликованных по теме диссертации
- Нанчикеева М.Л., Барабашкина А.В., Гладкая А.А., Буланов М.Н., Остапущенко О.С., Кирюхин А.В. Возможности допплерографии в диагностике поражения почек при гипертонической болезни // Материалы 4-й французско-русской школы-семинара по нефрологии «Артериальная гипертония и почки» 20-22 октября 1999 г. – М. - 1999. – С. 37.
- Конечная Е.Я., Нанчикеева М.Л., Буланов М.Н., Гладкая А.А. Значение показателей внутрипочечной гемодинамики у пациентов с эссенциальной артериальной гипертонией. // Ультразвуковая и функциональная диагностика. - 2001. - №2. - С. 83-89.
- Буланов М.Н., Конечная Е.Я., Нанчикеева М.Л., Гладкая А.А. Показатели внутрипочечной гемодинамики у больных с впервые выявленной артериальной гипертонией. // Эхография. – 2002. - №3, С. 42-46.
- Буланов М.Н., Конечная Е.Я., Нанчикеева М.Л., Боницкая Ю.Ю., Гладкая А.А. Показатели внутрипочечной гемодинамики как маркеры доклинической стадии гипертонической нефропатии. // Ультразвуковая и функциональная диагностика. - №2. – 2002. - С. 18-24.
- Нанчикеева М.Л., Конечная Е.Я., Буланов М.Н., Гладкая А.А., Козловская Л.В. Возможности ранней диагностики поражения почек у больных гипертонической болезнью // Терапевтический архив. – 2004. - №9. – С. 29-34.
- Нанчикеева М.Л., Козловская Л.В, Буланов М.Н., Конечная Е.Я., Гладкая А.А. Значение ультразвуковой диагностики в исследовании кардиоренальных взаимоотношений при гипертонической болезни // Ультразвуковая и функциональная диагностика. - №1. – 2005. - С. 76-82.
- Нанчикеева М.Л. Возможности диагностики ранней (доклинической) стадии гипертонической болезни // Клиническая медицина. Вопросы клиники, диагностики, профилактики и лечения. Межвузовский сборник стран СНГ. / под редакцией Г.Н. Андреева, В.Р. Вебера, Г.Г. Брыжахина, А.И.Корабельникова, А.С. Ибадильдина. // Великий Новгород–Алматы.: НовГУ, 2006. – Т.13. – С. 67-69.
- Нанчикеева М.Л., Остапущенко О.С., Кононович Ю.К. Структурно-функциональная характеристика миокарда левого желудочка у практически здоровых лиц и у больных гипертонической болезнью // Материалы V съезда Российской ассоциации специалистов ультразвуковой диагностики 18-21 сентября 2007 г. – М. 2007. – С. 58.
- Нанчикеева М.Л., Остапущенко О.С., Гладкая А.А. Показатели внутрипочечной гемодинамики и сердечно-сосудистое ремоделирование у больных гипертонической болезнью // Клиническая медицина. Вопросы клиники, диагностики, профилактики и лечения. Межвузовский сборник стран СНГ. / под редакцией Г.Н. Андреева, В.Р. Вебера, А.С. Ибадильдина. // Великий Новгород–Алматы. - НовГУ. - 2007. – Т.14. – С. 103-106.
- Кононович Ю.К., Остапущенко О.С. Нанчикеева М.Л., Структурно-функциональная характеристика миокарда левого желудочка у практически здоровых лиц и у больных гипертонической болезнью // Материалы V съезда Российской ассоциации специалистов ультразвуковой диагностики 18-21 сентября 2007 г. – М. - 2007. – С. 58.
- Нанчикеева М.Л., Козловская Л.В. Поражение органов сердечно-сосудистой системы и метаболические нарушения у пациентов с ранними признаками гипертонической нефропатии // Материалы Российской научно-практической конференции «Актуальные проблемы современной нефрологии» (Москва 17-18 октября 2007 г.) – М.: Печатный Двор. - 2007. – С. 52-54.
- Нанчикеева М.Л. Состояние внутрипочечной гемодинамики у больных гипертонической болезнью // Клиническая медицина. Вопросы клиники, диагностики, профилактики и лечения. Межвузовский сбор-ник стран СНГ. / под редакцией Г.Н. Андреева, В.Р. Вебера, А.С. Ибадильдина. // Великий Новгород–Алматы.: НовГУ, 2007. – Т.15. – С. 100-110.
- Нанчикеева М.Л., Козловская Л.В. Метаболические нарушения и микроальбуминурия у больных гипертонической болезнью // Материалы V конференции Российского диализного общества. - Нефрология и диализ. – 2007. – Т. 9. – № 3. – С. 338-339.
- Нанчикеева М.Л., Козловская Л.В., Фомин В.В., Буланов М.Н. Сосудистая реактивность и микроальбуминурия у больных гипертонической болезнью // Материалы V конференции Российского диализного общества – Нефрология и диализ. – 2007. – Т. 9. – № 3. – С. 339.
- Нанчикеева М.Л., Козловская Л.В., Фомин В.В., Буланов М.Н., Микроальбуминурия и сосудистая реактивность при гипертонической болезни. Тезисы докладов 5 съезда Российской ассоциации специалистов ультрзвуковой диагностики в медицине 18-21 сентября. - 2007.- С. 95-96.
- Нанчикеева М.Л., Гладкая А.А., Остапущенко О.С., Носова С.В., Леонтьева Т.Н. Возможности ультразвуковой диагностики ранних признаков поражения органов мишеней у больных гипертонической болезнью // Материалы ХV Российского национального конгресса «Человек и лекарство» 14-18 апреля 2008 г. – М. - 2008. – С. 240-241.
- Нанчикеева М.Л., Кононович Ю.К., Буланов М.Н., Фомин В.В., Козловская. Л.В. Значение ультразвуковой диагностики для оценки поражения органов-мишеней и определения тактики ведения пациентов с эссенциальной артериальной гипертензией // Ультразвуковая и функциональная диагностика. - 2008. - №3. - С. 84-90.
- Нанчикеева М.Л., Остапущенко О.С., Гладкая К.Г., Носова С.В., Буланов М.Н. Эндотелиальная дисфункция у больных гипертонической болезнью // Сборник тезисов XVI Российского национального конгресса «Человек и лекарство» 6-10 апреля.-2009.-С.193-194.
- Нанчикеева М.Л., Козловская Л.В., Фомин В.В., Рамеев В.В., Буланов М.Н. Эндотелиальная дисфункция и ремоделирование внутрипочечных сосудов как основа формирования гипертонической нефропатии // Ультразвуковая и функциональная диагностика. - 2009. - №5. - С. 84-94.
- Нанчикеева М.Л., Козловская Л.В., Фомин В.В. Клиническое значение исследования ЭЗВД у больных гипертонической болезнью // Врач.-2009.-№10.- С.82-84.
- Батюшин М.М., Кутырина И.М., Моисеев С.В., Нанчикеева М.Л., Терентьев В.П., Фомин В.В. Швецов М.Ю. Поражение почек при эссенциальной артериальной гипертензии // Глава в книге «Нефрология. Национальное руководство» под. редакцией Н.А. Мухина. – М. ГЭОТАР-Медиа. 2009. – С. 434-446.
- Nanchikeeva M.L., Konechnaya E. Ya., Barabashkina A.V., Shuvaeva L.N., Gladkaya A.A., Pavlova N.S., Bulanov M.N. Correlation of intrarenal bloodflow indices with albuminuria pronouncement in hypertensive patients // European Journal of Ultrasound. – 1998.- № 4. – P. 48.
- Nanchikeeva M.L., Boulanov M.N., Gladkaya A.A. Statins (Lescol) and ACE inhibitors (Enap) in treating Hypertensive patiojns- International journal on Immunorehabilitation.- 1999. - №12. - P.81.
- Nanchikeeva M.L., Konechnaya E. Ya., Ostapushenko O.S., Boulanov M.N. Is there any correlations between left ventricular hypertrophy with renal lesions and metabolic syndrome in patients with essential arterial hypertension // Journal of Hypertension. – Volume 21 (Suppl.2). – June 2000. – Р. S67
- Konechnaya E. Ya., Nanchikeeva M.L., Ostapushenko O.S., Boulanov M.N., Semenova L.L., Barabashkina A.V., Lvov A.V., Kirukhin A.V. Essential arterial hypertension: metabolic disturbances and lesion target organs. // Journal of hypertension 18 (Suppl. 2), June 2000. – P. 105.
- Nanchikeeva M.L., Konechnaya E. Ya., Ostapushenko O.S., Boulanov M.N., Gladkaya A.A. Early (preclinical) stage of renal lesions in patients with essential arterial hypertension with metabolic disturbances: diagnostic criteria, clinico-biochemical comparisons, correlation // Journal of hypertension 18 (Suppl. 2). - June 2000. - P. 105.
- Nanchikeeva M.L., Konechnaya E. Ya., Boulanov M.N. Role of disturbance of purine metabolism in beginning and development of arterial hypertension and involving of target organs // Journal of Hypertension. – Volume 22 (Suppl.2). – June 2000. – Р2. 281. – S231.
- Konechnaya E., Nanchikeeva M., Bulanov M., Gladkaya A., Kozlovskaya L. Hypertension nephropathy: criteria of early diagnosis and treatment varieties. // Journal of Hypertension, Volume 21 (suppl.4). - June 2003. - P. 293.
- Konechnaya E., Nanchikeeva M., Bulanov M. Role of Doppler measurement of intrarenal hemodynamics in patients with essential arterial hypertension // Journal of Hypertension. – Volume 21 (Suppl.4). – June 2003. – Р. 83.
- Nanchikeeva M., Konechnaya E., Ostapushchenko O., Gladkaya A., Bulanov M. Kidneys function state in patients with firstly diagnosed arterial hypertension. // Journal of Hypertension. - Volume 21 (suppl.4). - June 2003. - P. 84-85.
- Nanchikeeva M., Konechnaya E., Gladkaya A., Bulanov M. Cardiorenal syndrom in essential essential arterial hypertension patients) Journal of Hypertension. – Volume 22 (Suppl.2). – June 2004. – Р. 62.
Список сокращений.
АГ - артериальная гипертония
АД - артериальное давление
АПФ - ангиотензинпревращающий фермент
БМК - базальная мембрана клубочка
VEGF - сосудистый эндотелиальный фактор роста
ВПГ - внутрипочечная гемодинамика
ВПСС - внутрипочечное сосудистое сопротивление
ГБ - гипертоническая болезнь
ГЛЖ - гипертрофия миокарда левого желудочка
ГНП - гипертоническая нефропатия
ДАД - диастолическое артериальное давление
ИБС - ишемическая болезнь сердца
ИМТ - индекс массы тела, индекс Кетле
ИММЛЖ - индекс массы миокарда левого желудочка
КРЛЖ - концентрическое ремоделирование миокарда левого желудочка
МАУ - микроальбуминурия
МК - мочевая кислота
ОХ - общий холестерин
PAI-1 - ингибитор активатора плазминогена-1
САД - систолическое артериальное давление
СКФ - скорость клубочковой фильтрации
ССО - сердечно-сосудистые осложнения
ТГ - триглицериды
TGF-1 - трансформирующий фактор роста - 1
ФР - фактор риска
ХЛВП - холестерин липопротеидов высокой плотности
ХЛНП - холестерин липопротеидов низкой плотности
ХПН - хроническая почечная недостаточность
ЭМК - экскреция мочевой кислоты

