Клинико-патогенетические особенности сочетания артериальной гипертензии и сахарного диабета 2 типа и фармакологическая коррекция эндотелиальной дисфункции
На правах рукописи
Красюкова Виктория Александровна
КЛИНИКО-ПАТОГЕНЕТИЧЕСКИЕ ОСОБЕННОСТИ СОЧЕТАНИЯ
АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ И САХАРНОГО ДИАБЕТА 2 ТИПА
И ФАРМАКОЛОГИЧЕСКАЯ КОРРЕКЦИЯ
ЭНДОТЕЛИАЛЬНОЙ ДИСФУНКЦИИ
14.01.04 – внутренние болезни
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Воронеж 2010
Работа выполнена в Государственном общеобразовательном учреждении высшего профессионального образования «Воронежская государственная медицинская академия им. Н.Н. Бурденко Министерства здравоохранения и социального развития Российской Федерации» (ГОУ ВПО ВГМА им. Н.Н. Бурденко Минздравсоцразвития России)
Научный руководитель: доктор медицинских наук,
профессор
Чернов Юрий Николаевич
Официальные оппоненты: доктор медицинских наук,
профессор
Кузнецов Сергей Иванович
доктор медицинских наук,
доцент
Великая Ольга Викторовна
Ведущее учреждение: ГОУ ВПО «Смоленская государственная
медицинская академия Росздрава»
Защита состоится « 30 » ноября 2010 г. в 1300 часов на заседании диссертационного совета Д 208.009.02 в ГОУ ВПО ВГМА им. Н.Н. Бурденко Минздравсоцразвития России по адресу: 394036, г. Воронеж, ул. Студенческая, 10.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО ВГМА им. Н.Н. Бурденко Минздравсоцразвития России
Автореферат разослан «____» _______________ 2010 г.

Учёный секретарь
диссертационного совета Будневский А.В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Сахарный диабет (СД) – глобальная медико-социальная проблема, что обусловлено его высокой распространенностью, сохраняющейся тенденцией к росту заболеваемости и хроническим течением (Демидова Т.Ю., 2009). В настоящее время установлено, что в 50-80 % случаев СД 2 типа сочетается с артериальной гипертензией (АГ), способствуя развитию и прогрессированию кардиоваскулярной патологии (Stumvol M., 2005; Дедов И.И., Шестакова М.В., 2006).
В основе развития АГ и СД 2 типа лежит инсулинорезистентность (ИР) и гиперинсулинемия, обуславливающие активацию симпатоадреналовой и ренин-ангиотензин-альдостероновой системы (РААС) с последующим развитием нейрокардиопатии (Соколов Е.И., 2002; Дедов И.И., Шестакова М.В., 2006).
Важным звеном патогенеза сердечно-сосудистой патологии является эндотелиальная дисфункция (ЭД), которая характеризуется нарушением эндотелий зависимой вазодилятации (ЭЗВД) (Аметов А.С., Демидова Т.Ю., Смагина Л.В., 2004; Небиеридзе Д.В., 2004; Кобалава Ж.Д., 2009). Хроническая гиперактивация РААС играет ведущую роль в формировании ЭД (Бувальцев В.И., 2001; Williams B., 2001; Кобалава Ж.Д., 2009). В свою очередь, ЭД предшествует патологии сосудов и повышению жесткости сосудистой стенки, показатели которой ассоциированы со значениями артериального давления (Van Popele N.M. et al., 2001; Мартынов А.И., 2007; Кобалава Ж.Д., 2009).
Эндотелий является терапевтической мишенью лечения сердечно-сосудистых заболеваний (Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т., 2001; Адашева Т.В., Задионченко В.С., Сандомирская А.П., 2002), а необходимость коррекции ЭД рассматривается как важный показатель адекватности антигипертензивной терапии (Бувальцев В.И., 2001; Небиеридзе Д.В., 2006).
Поиск новых подходов к лечению больных АГ в сочетании с СД, предусматривающих направленную коррекцию функционального состояния эндотелия, имеет важное практическое значение. Для решения данной задачи в клинической практике предложено использование ингибиторов ангиотензинпревращающего фермента (иАПФ) (Anderson T.J., 2000; Адашева Т.В., Задионченко В.С., Сандомирская А.П., 2002; Небиеридзе Д.В., 2004) и антагонистов рецепторов ангиотензина II (АРА) (Кобалава Ж.Д., 2009; Brillante D.G., 2009), метаболически нейтральных и специфически влияющих на РААС с коррекцией ЭД (Дедов И.И., Шестакова М.В., 2007). Результаты исследований ELITE II и RESOLVD показали, что применение комбинации иАПФ и АРА в отношении нейрогуморальной регуляции сосудистого тонуса преимущества над монотерапией данными препаратами не имело (McKelvie R.S. et al., 1999; Houghton A.R. et al., 2000; Pitt B. et al., 2000). Создание нового класса лекарственных средств, представляющих собой сверхмалые дозы аффинно-очищенных антител к С-концевому фрагменту АТ1-рецептора ангиотензина II (препарат кардостен, ООО «Материа Медика Холдинг», г. Москва) (Эпштейн О.И., 2008), открывает новые перспективы в коррекции состояния нейрогуморальной системы и ЭД.
Учитывая вышеизложенное, актуальное значение имеет повышение эффективности фармакотерапии ЭД у больных с сочетанием АГ и СД, что предполагает разработку новых эффективных схем терапии и методов контроля проводимого лечения.
Цель работы: повышение эффективности терапии эндотелиальной дисфункции у больных артериальной гипертензией в сочетании с сахарным диабетом 2 типа.
Задачи исследования:
1. Провести сравнительное исследование функционального состояния эндотелия, активности процессов перекисного окисления и антиоксидантной системы крови у больных АГ, СД 2 типа и при сочетании АГ и СД 2 типа.
2. Определить особенности вегетативного статуса и чувствительности -адренорецепторов при АГ, СД 2 типа и при АГ в сочетании с СД 2 типа.
3. Проанализировать эффективность фармакотерапии при назначении иАПФ и сверхмалых доз антител к АТ1-рецепторам (кардостен) с определением показателей вегетативной регуляции и эндотелий зависимой вазодилятации у пациентов, страдающих АГ в сочетании с СД 2 типа.
4. Оценить диагностические возможности пробы с дозированной физической нагрузкой для определения функционального состояния сосудистого эндотелия и выявления индивидуальной реакции на проводимую терапию.
5. Разработать метод контроля эффективности антигипертензивной фармакотерапии у больных, страдающих АГ и СД 2 типа, с использованием велоэргометрической пробы.
Научная новизна
Впервые проведено комплексное исследование, включавшее одновременную оценку состояния функции эндотелия, чувствительности -адренорецепторов, показателей свободнорадикального окисления, вегетативной регуляции у пациентов при сочетании АГ и СД 2 типа, в сравнении с больными АГ и пациентами, страдающими СД 2 типа.
Впервые у больных с сочетанием АГ и СД 2 типа показана высокая эффективность комбинированной терапии с назначением иАПФ и сверхмалых доз антител к С-концевому фрагменту АТ1-рецептора ангиотензина II (препарат кардостен), по сравнению с монотерапией иАПФ, с учетом состояния функции эндотелия, показателей вегетативного баланса и адренореактивности рецепторов.
Впервые для больных АГ и СД разработан способ прогнозирования состояния функции эндотелия в зависимости от динамики показателей вариабельности сердечного ритма и адренореактивности рецепторов при назначении антигипертензивных средств (положительное решение о выдаче патента на изобретение по заявке № 2009134015/14 (047655) от 5.07.2010 г.).
Впервые представлена диагностическая ценность коэффициента физической работоспособности для контроля эффективности назначения антигипертензивных средств у больных АГ с СД (патент № 2257840 от 10.08.2005 г.).
Впервые проведена оценка функционального резерва эндотелия с учетом величины эндотелий зависимой вазодилятации до и после нагрузочной пробы у больных АГ и СД 2 типа с возможностью контроля индивидуальной реакции на проводимую антигипертензивную фармакотерапию.
Практическая значимость
Доказано повышение эффективности терапии ЭД у больных АГ в сочетании с СД 2 типа при комбинированном назначении сверхмалых доз антител к С-концевому фрагменту АТ1-рецептора ангиотензина II (кардостен) и иАПФ, по сравнению с монотерапией иАПФ.
Для прогноза эффективности терапии ЭД у больных АГ разработан способ, включающий оценку показателей вегетативного баланса и адренореактивности рецепторов мембран эритроцитов на фоне проводимой терапии (положительное решение о выдаче патента на изобретение по заявке № 2009134015/14 (047655) от 5.07.2010 г.).
У больных АГ и СД 2 типа предложено проведение пробы с дозированной физической нагрузкой с оценкой динамики эндотелий зависимой вазодилятации до и после нагрузочного теста для выявления функциональных возможностей эндотелия сосудистой стенки и определения индивидуальной реакции на проводимую фармакотерапию.
Показана диагностическая значимость определения коэффициента физической работоспособности при проведении пробы с физической нагрузкой для объективного контроля эффективности антигипертензивной терапии у больных с сочетанием АГ и СД 2 типа (патент № 2257840 от 10.08.2005 г.).
Основные положения, выносимые на защиту
1. Сочетание АГ и СД 2 типа у пациентов сопровождается усилением вегетативной дисрегуляции, десенситизацией адренорецепторов, липопероксидацией и более выраженными проявлениями эндотелиальной дисфункции по сравнению с больными АГ и пациентами, страдающими СД 2 типа.
2. Комбинированное назначение иАПФ и сверхмалых доз антител к С-концевому фрагменту АТ1-рецептора (препарат кардостен) позволяет повысить эффективность фармакокоррекции эндотелиальной дисфункции при снижении активности симпатического звена регуляции.
3. Проба с дозированной физической нагрузкой с оценкой эндотелий зависимой вазодилятации и расчетом коэффициента физической работоспособности имеет диагностическое значение для определения эффективности антигипертензивной терапии.
Апробация работы
Основные положения диссертации доложены и обсуждены на I Всероссийской конференции молодых ученых (Воронеж, 2007), XIV Российском национальном конгрессе ‹‹Человек и лекарство›› (Москва, 2007), XV Российском национальном конгрессе ‹‹Человек и лекарство›› (Москва, 2008), III Всероссийской конференции молодых ученых (Воронеж, 2009), научно-практической конференции с международным участием ‹‹Достижения клинической фармакологии в России›› (Москва, 2009), Российском национальном конгрессе кардиологов ‹‹Кардиология: реалии и перспективы›› (Москва, 2009), XVII Российском национальном конгрессе ‹‹Человек и лекарство›› (Москва, 2010).
Работа апробирована на совместном заседании кафедры клинической фармакологии, факультетской терапии, пропедевтики внутренних болезней, эндокринологии, биохимии, нормальной физиологии, физиотерапии, курортологии и восстановительной медицины ИПМО ВГМА им. Н.Н. Бурденко, кафедры фармакологии фармацевтического факультета ГОУ ВПО «Воронежский государственный университет».
Внедрение результатов исследования в практику
Результаты исследования внедрены в работу терапевтического отделения НУЗ “Дорожная клиническая больница на ст. Воронеж-1” ОАО РЖД и кафедры клинической фармакологии ВГМА им. Н.Н. Бурденко. Материалы исследования включены в учебное пособие ‹‹Организация лекарственного обеспечения в лечебном учреждении››, глава ‹‹Особенности назначения противодиабетических препаратов. Коррекция эндотелиальной дисфункции›› (Воронеж: издательство ‹‹Истоки››, 2010).
Публикации
По материалам диссертации опубликовано 14 печатных работ, из них 3 статьи – в журналах, рекомендованных ВАК РФ. Получен 1 патент на изобретение ‹‹Способ оценки эффективности фармакотерапии при артериальной гипертонии›› (патент № 2257840 от 10.08.2005 г.).
Объем и структура диссертации
Диссертация изложена на 137 страницах машинописного текста и состоит из введения, обзора литературы, описания материалов и методов исследования, клинической характеристики пациентов, собственных результатов и их обсуждений, выводов, практических рекомендаций, списка литературы и приложения. Работа иллюстрирована 19 таблицами, 20 рисунками. Список литературы включает 216 источников, из них 106 отечественных и 110 зарубежных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Работа основана на результатах обследования 123 пациентов, включая больных СД 2 типа, пациентов с АГ, больных с сочетанием АГ и СД 2 типа. В исследовании участвовали 70 мужчин и 53 женщины, находившихся на лечении в НУЗ “Дорожная клиническая больница на ст. Воронеж-1” ОАО РЖД с 2006 по 2010 годы. Пациенты были ознакомлены со структурой исследования, целью, задачами, информированы о проведении диагностических процедур.
Критерии включения в исследование: возраст от 30 до 75 лет; АГ 1-2 стадии; СД 2 типа среднетяжелого течения; базисная антигипертензивная терапия иАПФ.
Критерии исключения из исследования: СД 1 типа; СД 2 типа легкого и тяжелого течения; АГ 3 стадии; симптоматическая АГ; острый коронарный синдром в течение 3 месяцев до рандомизации; AV-блокада I-III степени; феохромоцитома; инсулинома; злокачественные новообразования; беременность; лактация; нарушение функции печени (АлАТ, АсАТ выше нормы в 2 раза) и почек (креатинин 220 мкмоль/л); повышенная чувствительность к применяемому препарату; участие пациентов в других исследованиях.
В соответствии с диагностическими критерями СД (ВОЗ, 1999) и Российскими рекомендациями 3-его пересмотра ‹‹Диагностика и лечение АГ›› (Комитет экспертов Российского медицинского общества по АГ и ВНОК, 2008) пациенты были разделены на три группы: в 1 группу вошли больные СД 2 типа (n=20), во 2 группу – больные АГ (n=25), в 3 группу – больные АГ в сочетании с СД 2 типа (n=78). Контрольную группу составили 14 здоровых лиц. Общая характеристика обследованных лиц приведена в таблице 1.
Таблица 1
Характеристика обследованных лиц
| Показатель | Здоровые (n=14) | 1 группа СД (n=20) | 2 группа АГ (n=25) | 3 группа АГ+СД (n=78) |
| Возраст, лет | 36,3±1,3 | 52,3±2,7 | 49,1±2,4 | 53,7±1,1 |
| мужчины/женщины | 6/8 | 11/9 | 17/8 | 42/36 |
| ИМТ, кг/м2 | 22,3±0,7 | 28,2±1,1 | 27,9±1 | 32,4±0,7 |
| САД мм рт ст | 118,9±3,2 | 119,9±1,87 | 153,3±2,7 | 152,2±1,6 |
| ДАД мм рт ст | 66,1±3,1 | 76±1,2* | 95,5±1,7* | 94,9±0,96 |
| Анамнез АГ, годы | - | - | 8+0,95 | 7,52+0,62 |
| АГ 1 стадии | - | - | 1 (4 %) | 11 (14 %) |
| АГ 2 стадии | - | - | 24 (84 %) | 67 (86%) |
| Анамнез СД 2 типа, годы | - | 4,2±0,9 | - | 4,7+0,6 |
| Полинейропатия | - | 10 (50 %) | - | 41 (56 %) |
| Непролиферативная ангиоретинопатия | - | 6 (30 %) | - | 26 (33 %) |
| Нефропатия | - | 4 (20 %) | - | 12 (15 %) |
| Поражение сосудов нижних конечностей | - | 2 (10 %) | - | 8 (10 %) |
| ИМТ < 25 кг/м2 | - | 4 (20 %) | 7 (28 %) | 6 (8 %) |
| ИМТ = 25-29,9 кг/м2 | - | 9 (45 %) | 10 (40 %) | 21 (27 %) |
| ИМТ = 30-34,9 кг/м2 | - | 6 (30 %) | 6 (24 %) | 33 (42 %) |
| ИМТ = 35-39,9 кг/м2 | - | 1 (5 %) | 2 (8 %) | 11 (14 %) |
| ИМТ > 40 кг/м2 | - | - | - | 7 (9 %) |
p<0,01,*p<0,05 – достоверность отличий от показателей здоровых лиц
С целью изучения влияния фармакотерапии на показатели периферической гемодинамики и состояние регуляторных систем среди обследованных пациентов с сочетанием АГ и СД было выделено две группы: 1 группу (n=26) составили больные, принимавшие иАПФ (эналаприл 10-20 мг/сут), 2 группу (n=27) – пациенты, которые наряду с иАПФ (эналаприл 10-20 мг/сут) получали сверхмалые дозы антител к С-концевому фрагменту АТ1-рецептора ангиотензина II – кардостен (ООО «Материа Медика Холдинг», Россия) – по 2 таблетки 2 раза в день (утром и вечером), сублингвально (до полного растворения в полости рта), вне зависимости от приема пищи. Базисная сахароснижающая терапия у 52 % всех больных включала препараты сульфонилмочевины (диабетон МВ 30-120 мг/сут или манинил 7-20 мг/сут). В 48 % случаев, при ИМТ 30-34,9 кг/м2, схема лечения включала препарат группы бигуанидов (метформин 500-2000 мг/сут).
Лабораторные методы исследования включали определение показателей глюкозы крови натощак и постпрандиальной, гликированного гемоглобина (HbA1c), общего холестерина (ОХС), липопротеидов низкой плотности (ЛПНП) с помощью автоанализатора Hitachi (Япония), С-пептида – с использованием автоматического электрохемилюминисцентного анализатора ELECSYS 2010 F.Hoffman-La-Roshe (Швейцария); уровня адренореактивности рецепторов мембран эритроцитов (-АРМ) (Длусская И.Г., Стрюк Р.И., 2000). Процессы ПОЛ исследовались лабораторным методом с определением диеновых коньюгатов (ДК) (Казаков К.С и соавт., 1985), малонового диальдегида (МДА) (Saton K., 1978), гидроперекисей липидов (ГПЛ) (Гаврилова В.Б., Мишкорудный М.И., 1983). Антиокислительную общую активность плазмы крови (АОА) определяли люминолзависимым биохемилюминесцентным методом по степени торможения образования активных форм кислорода в реакции Фентона с использованием биохемилюминометра ПХЛ-01.
Оценка параметров периферической гемодинамики проводилась на основе метода объемной компрессионной артериальной осциллографии с использованием аппарата АЦПКО (Дегтярев В.А., 1997). Исследование вариабельности сердечного ритма (ВСР) производилось при помощи компьютерного комплекса «Варикард» (ООО «Рамена», Россия) с регистрацией пятиминутной записи ЭКГ. При оценке вегетативного статуса использовались показатель SDNN, Мо, АМо, стресс-индекс (Si) и спектральные показатели TP, LF, HF, VLF, отражавшие распределение колебаний по мощности и частоте (Баевский Р.М., 2002).
Велоэргометрическая проба (ВЭМ-проба) проводилась на велоэргометре ВЕ-2 по ступенчато-возрастающей методике. Двойное произведение (ДП) вычислялось как САДЧСС/100. Коэффициент физической работоспособности (КФР) рассчитывался с учетом величины пороговой мощности нагрузки (W) и общей продолжительности нагрузочной пробы (t) (патент № 2257840).
Измерение артериальной ригидности проводилось на основе контурного анализа пульсовой волны объёма (Парфенов А.С., 2007) при помощи прибора «Ангиоскан» (Россия) с программным обеспечением Powergraph 3,3 с определением индекса жесткости (SI), индекса отражения (RI). Для оценки эндотелий зависимой вазодилятации (ЭЗВД) проводилась 5-ти минутная окклюзионная проба с использованием прибора «Ангиоскан».
Статистическая обработка полученных результатов проводилась с использованием компьютерной программы статистического анализа BioStat [AnalystSoft Inc., версия 2009]. Расчету подлежали описательные статистики, оценка которых показала преобладание асимметричных распределений изученных выборок. Это определило целесообразность применения непараметрических критериев значимости Манна-Уитни с оценкой вероятности нулевой гипотезы (РU) и Уилкоксона при сравнении выборок. Корреляционную зависимость рассчитывали по методу Spearman с помощью программы ‹‹SPSS 9.0››.
Результаты исследования и их обсуждение
При анализе углеводного обмена у больных 1 и 3 группы уровень гликемии натощак и постпрандиальной, концентрация НвА1с превышали рекомендуемые целевые показатели, соответствующие диагностическим критериям компенсации СД (табл. 2). Среднее значение С-пептида, находившееся в пределах нормы (1,1-4,4 нг/мл) во всех группах наблюдения, указывало на достаточный уровень выработки инсулина (табл. 2). Полученные данные о нормальном функционировании секреторного аппарата -клеток поджелудочной железы, хронической гипергликемии и повышенном уровне НвА1с свидетельствовали о наличии у больных СД и пациентов с сочетанием АГ и СД признаков ИР.
Оценка липидного спектра показала повышение уровня атерогенных фракций (табл. 2) с увеличением ОХС у больных СД в 50 % случаев, у пациентов с АГ – в 32 %, у больных АГ в сочетании с СД – в 72 %; повышение ЛПНП – в 84%, 80 % и 96% случаях соответственно. Повышенная концентрация ОХС и ЛПНП у больных с СД позволила объяснить достаточно высокую частоту встречаемости диабетической ретинопатии (в 30-33 % случаев) (табл. 1), в основе которой лежит атеросклеротический процесс и ИР.
Таблица 2
Особенности показателей метаболического обмена в группах (М±m)
| Показатель | Здоровые (n=14) | 1 группа СД (n=20) | 2 группа АГ (n=25) | 3 группа АГ+СД(n=78) |
| Гликемия, ммоль/л - натощак - через 2 часа после еды | 4,98±0,1 6,9±0,08 | 9,6±1,7 8,8±1,4 | 5,1±0,14 7,2±0,3 | 10,8±0,3 12,2±0,5 |
| С-пептид, нг/мл | 2,56±0,06 | 2,89±0,31 | 2,67±0,1 | 3,2±0,21 |
| НвА1с, % | 4,4±0,2 | 7,74±1,1* | 5,34±0,12* | 7,8±0,4* |
| ОХС, ммоль/л | 4,99±0,03 | 5,48±0,37 | 5,45±0,43 | 5,86±0,14 |
| ЛПНП, ммоль/л | 2,94±0,03 | 5,35±0,35 | 4,85±0,35 | 5,71±0,14 |
| МДА, нмоль/л | 1,87±0,1 | 1,89±0,22 | 2,78±0,16 | 2,39±0,23 |
| ДК, мкмоль/мл | 3,71±0,17 | 10,42±2,18* | 6,18±0,85* | 11,7±0,86 |
| ГПЛ, ед/мл | 2,91±0,12 | 2,94±0,25 | 4,76±0,47* | 5,42±0,97 |
| АОА, S | 231,3±3,6 | 378±40,5 | 306,6±2,1 | 317,8±11,5 |
p<0,01; *p<0,05 – достоверность различий с показателями здоровых лиц
При изучении показателей процессов ПОЛ у пациентов с АГ отмечено повышение уровня МДА на 32,7 % (p<0,01), ДК на 40 % (p<0,05), ГПЛ на 38,9 % (p<0,05), по сравнению со здоровыми лицами. Полученные данные свидетельствуют об активации свободнорадикальных реакций в условиях роста гемодинамической нагрузки при увеличении артериального давления (АД). Среди больных СД выявлено более выраженное повышение концентрации ДК на 64,4% (p<0,05), тогда как в 3 группе у больных с сочетанной патологией отмечена наибольшая интенсификация окислительных реакций с повышением ДК на 68,3 % (p<0,01) и ГПЛ на 46,3 % (p<0,01) (табл. 2).
Анализ АОА плазмы крови выявил у больных всех групп наблюдения достоверное снижение уровня антирадикальной защиты крови, что проявлялось повышением показателя АОА (табл. 2). Активация процессов ПОЛ у пациентов 1 и 3 группы объясняется хронической гипергликемией, гиперлипидемией, что в условиях тканевой гипоксии увеличивает образование вторичных продуктов ПОЛ, оказывающих наибольшее повреждающее воздействие на мембраны клеток эндотелия, способствуя развитию ЭД.
Оценка результатов контурного анализа пульсовой волны объёма показала достоверное увеличение индекса жесткости (SI > 9,0 м/с) у 63 % больных СД, у 88 % пациентов с АГ и у 82 % больных при сочетании АГ и СД. При этом в 1 группе SI был повышен на 15 % (p<0,01), во 2 группе – на 23 % (p<0,01), в 3 группе – на 25 % (p<0,01), по сравнению со значением SI здоровых лиц, что свидетельствовало об увеличении ригидности стенки крупных сосудов, особенно выраженном у больных с сочетанием АГ и СД (табл. 3).
Повышение жесткости стенки периферических сосудов со значением индекса отражения пульсовой волны RI > 60 % в 1 группе выявлено в 90 % случаев, во 2 группе – в 77 %, в 3 группе – в 89 %. При этом RI у больных СД был увеличен на 20 % (p<0,06), у пациентов с АГ – на 16 % (p<0,01), у больных АГ и СД – на 18,5 % (p<0,01), по сравнению со здоровыми лицами (табл. 3). Полученные данные указывают на то, что формирующиеся у больных диабетом метаболические изменения могут способствовать снижению эластичности сосудистой стенки.
Таблица 3
Показатели жесткости сосудистой стенки и функции эндотелия (М±m)
| Показатель | Здоровые (n=14) | 1 группа СД (n=20) | 2 группа АГ (n=25) | 3 группа АГ+СД (n=78) |
| SI, м/с | 8,3±0,2 | 9,8±0,5** | 10,8±0,6** | 11,1±0,3** |
| RI, % | 59,1±1,5 | 73,6±4,9* | 70,2±2,9** | 72,6±1,6** |
| ЭЗВД, усл. ед. | 1,89±0,05 | 1,71±0,12 | 1,23±0,07** | 1,38±0,05** |
**p<0,01;*p<0,06 – достоверность различий с показателями здоровых лиц
При анализе результатов окклюзионной пробы была выявлена эндотелиальная дисфункция (ЭД) со снижением показателя ЭЗВД у больных АГ до 1,23±0,07 усл.ед. (p<0,01), у пациентов с сочетанием АГ и СД – до 1,38±0,05 усл.ед. (p<0,01), по сравнению со здоровыми лицами, имевшими показатели ЭЗВД=1,89±0,05 усл.ед. (табл. 3). У пациентов с СД значение ЭЗВД=1,71±0,12 усл.ед. (p<0,06) находилось в пределах нормы, однако, следует отметить, что значение ЭЗВД<1,5 усл.ед. выявлено у 29 % больных СД. При этом, у пациентов с АГ величина ЭЗВД<1,5 усл.ед. отмечена в 75 % случаях, при сочетанной патологии – у 72 % обследованных.
У больных с сочетанием АГ и СД также по мере возрастания САД, ДАД и АДср. выявлена тенденция к увеличению жесткости стенки сосудов и к снижению функции эндотелия. При корреляционном анализе установлена положительная сильная корреляционная связь между SI и АДср. (r=0,71; p<0,05), что указывает на снижение эластичности стенки сосудов и усиление ЭД по мере прогрессирования АГ.
При изучении вегетативной регуляции у обследованных больных выявлено изменение баланса регуляторных систем с преобладанием активности симпатического звена регуляции. Наибольшее уменьшение временного параметра SDNN отмечено у больных СД – на 48,6 % (p<0,01) и пациентов с сочетанием АГ и СД – на 38,7 % (p<0,01), тогда как у больных АГ SDNN был снижен на 22 % (p<0,01) (табл. 4). Значение стресс-индекса (Si) у пациентов с СД было выше контрольных значений в 4,9 раза (p<0,01), у больных АГ в сочетании с СД – в 7,6 раза (p<0,01), у пациентов с АГ – в 2,7 раза (p<0,01) (табл. 4).
Таблица 4
Показатели вегетативной регуляции и адренореактивности рецепторов (М±m)
| Показатель | Здоровые (n=14) | 1 группа СД (n=20) | 2 группа АГ (n=25) | 3 группа СД+АГ (n=78) |
| SDNN, мс | 67,7±11,5 | 34,8±4,5** | 52,9±5,7** | 41,5±4,2** |
| Mo, мс | 929,2±32,4 | 863,9±38 | 874,8±18* | 837,4±19,3* |
| Amo, % | 32,8±3,2 | 61,1±4,3** | 47,2±3,2* | 59,2±2,5** |
| pNN50 % | 44,3±6,8 | 7,1±2,8** | 14,6±3,9** | 10,5±2,7** |
| Si, усл. ед. | 36,3±11,3 | 177,1±41** | 98,4±17,6* | 277,2±51,9** |
| TP, mc2 *1000 | 10,1±3,2 | 1,4±0,3** | 3,6±0,8** | 2,8±0,7** |
| HF, % | 38,9±4,9 | 34,1±5,9 | 34,4±5,3 | 27,9±2,7* |
| LF, % | 38,9±3,5 | 32,3±2,9 | 28,8±3,1* | 30,3±1,8* |
| VLF, % | 22,2±3,1 | 31,1±4,7 | 35,6±4,4 | 36,8±2,5* |
| IC, усл.ед. | 2,06±0,26 | 2,7±0,63 | 5,3±1,33 | 5,7±0,77 |
| -АРМ, усл.ед. | 10,5±0,7 | 37,4±8,6** | 42,9±5,3** | 42,6±2,9** |
*p<0,05; **p<0,01– достоверность различий с показателями здоровых лиц
Анализ спектральных показателей подтвердил вегетативный дисбаланс у пациентов трех групп со снижением общей мощности спектра (TP), особенно в 1 и 3 группе наблюдения (табл. 4). При этом в группе с сочетанием АГ и СД вклад HF-компонента в суммарную мощность спектра снизился в большей степени до 27,9±2,7 % (p<0,05), а процентный вклад VLF-волн, отражающих тенденцию к переходу регуляции с рефлекторного уровня на более низкий гуморально-метаболический, оказался равным 36,8±2,5 % (p<0,01) (табл. 4).
При изучении адренореактивности клеточных мембран эритроцитов (-АРМ) во всех группах наблюдения выявлено снижение чувствительности рецепторного аппарата в ответ на избыточную адренергическую стимуляцию на фоне гиперсимпатикотонии, что проявлялось повышением показателя -АРМ в среднем в 3,5-4 раза (p<0,01), по сравнению со здоровыми лицами (табл. 4).
Оценка данных объемной компрессионной артериальной осциллографии у больных 2 и 3 группы, позволила отметить значения САД и ДАД, не соответствующие целевому уровню АД при АГ и СД (табл. 5). Интегральная величина АДср. у больных АГ была выше на 18 % (p<0,01), ПАД на 30,7 % (p<0,01), у пациентов с сочетанием АГ и СД – на 15,7 % (p<0,01) и 32 % (p<0,01) соответственно, превышая значения здоровых лиц (табл. 5).
Наибольшие изменения сосудистой стенки отмечены у больных АГ в сочетании с СД с уменьшением податливости сосудистой системы (ПСС) на 12 % (p<0,05). На повышенный тонус резистивных сосудов у больных 2 и 3 группы указывает увеличение общего периферического сопротивления сосудов (ОПСС) на 10,8 % (p<0,05) и 7,4 % (p<0,05) соответственно (табл. 5).
Таблица 5
Показатели периферической гемодинамики (М±m)
| Показатель | Здоровые (n=14) | 1 группа СД (n=20) | 2 группа АГ (n=25) | 3 группа СД+АГ (n=78) |
| САД, мм рт ст | 118,9±3,2 | 125,4±2* | 141,5±5,3** | 130,1±2,1** |
| ДАД, мм рт ст | 66,14±3,1 | 68,6±0,33 | 95,5±1,7** | 94,9±0,96** |
| АД ср., мм рт ст | 83,7±1,8 | 90,2±1,8* | 102±4,5** | 99,3±1,7** |
| ПАД, мм рт ст | 46±3,9 | 57,9±1,9* | 66,4±3,3** | 60,7±2,3** |
| ПСС, мл/мм рт ст | 2,16±0,07 | 2,08±0,14 | 1,95±0,07 | 1,9±0,05* |
| ОПСС, дин*см-5*с | 1334±29,4 | 1377,4±15,9 | 1496,9±81,2* | 1440,3±42,3* |
| СПВ, см/сек | 666,3±8,1 | 699,6±25,5 | 669,9±34,5 | 681,1±19,3 |
*p<0,05; **p<0,01 – достоверность различий с показателями здоровых лиц
Изучение влияния терапии на состояние регуляторных систем у пациентов с сочетанием АГ и СД в двух группах наблюдения показало более выраженное воздействие на вегетативный баланс комбинации кардостена и иАПФ, по сравнению с лечением иАПФ. Так, у больных 1 группы, получавших иАПФ, через 2 месяца терапии отмечено повышение SDNN на 10 % (p<0,05), в то время как у пациентов 2 группы, принимавших кардостен и иАПФ, параметр SDNN увеличился на 18%, что указывает на уменьшение избыточной активности симпатического отдела ВНС. Улучшение состояния регуляторных систем через 2 месяца у больных 2 группы подтверждалось снижением стресс-индекса Si на 58,6 % (p<0,01), повышением временного показателя pNN50% на 65 % (p<0,05), тогда как у больных 1 группы изменения Si были незначительными, а значение pNN50% снизилось на 43 % (p<0,05) (табл. 6).
Комплексная терапия кардостеном и иАПФ у больных 2 группы через 2 месяца способствовала изменению волновой структуры спектра с возрастанием HF-компонента на 20,6 % (p<0,06) и снижением доли компонента VLF на 23,8 % (p<0,06), что указывало на достижение уровня вегетативной регуляции с повышением активности парасимпатической нервной системы. При этом у больных 1 группы через 2 месяца терапии иАПФ HF-компонент снизился на 28 % (p<0,01), LF повысился на 9 % и VLF – на 28 % (p<0,01) (табл. 6).
При изучении адренореактивности рецепторов у больных 1 группы, принимавших иАПФ, через 2 месяца лечения значение -АРМ уменьшилось статистически недостоверно на 15,6 %. Напротив, во 2 группе через 2 месяца терапии кардостеном в сочетании с иАПФ отмечено повышение чувствительности -адренорецепторов на 32 % (p<0,05) (табл. 6).
Таблица 6
Динамика показателей вегетативной регуляции и адренореактивности (М±m)
| Показатель | Здоровые (n=14) | 1 группа (n=26) | 2 группа (n=27) | ||
| исходно | 2 месяца | исходно | 2 месяца | ||
| SDNN, мс | 67,7±11,5 | 41,2±8,7** | 46±15* | 44,7±5** | 54,5±7,2 |
| Mo, мс | 929±32 | 805±31,5** | 849±46 | 874±30 | 903,8±27 |
| Amo, % | 32,8±3,2 | 64±4,6** | 51,6±5* | 55,35±3** | 49,4±4,4* |
| pNN50 % | 44,3±6,8 | 15,44±6** | 8,8±5,7* | 8,30±2,8** | 23,9±12* |
| Si, усл. ед. | 36,3±11,3 | 216±37,8** | 214±79* | 153±32,4** | 63,4±10** |
| TP, mc2*1000 | 10,1±3,2 | 3,53±1,6** | 5,4±3,1 | 2,62±0,7** | 2,3±0,5** |
| HF, % | 38,9±4,9 | 28,5±4,9 | 20,5±6 | 27±3,5** | 34±7,2 |
| LF, % | 38,9±3,5 | 27,6±3,4** | 30,3±3,7 | 35±2,3 | 37±5,2 |
| VLF, % | 22,2±3,1 | 35,2±4,8 | 49±5,5* | 38,25±3** | 29,2±7,8 |
| IC, усл.ед. | 2,06±0,3 | 5,9±1,1 | 5,9±1,4 | 6,42±1,4 | 4,3±2,2 |
| -АРМ, усл.ед. | 10,5±0,7 | 30,8±4,8** | 26±9,2 | 38,3±4,4** | 26±5,7* |
*p<0,05;**p<0,01– достоверность различий с показателями здоровых лиц
p<0,06 – достоверность различий с показателями 1 группы
При оценке состояния сердечно-сосудистой системы через 2 месяца терапии у больных 2 группы, получавших кардостен в комбинации с иАПФ, выявлено снижение уровня САД на 6,5 %, ДАД на 32 %, АДср. на 7,7 % (p<0,01) (табл. 7). При этом отмечена тенденция к уменьшению ПАД, положительная динамика параметра СПВ, характеризующего упруго-вязкие свойства магистральных сосудов. Сохранение через 2 месяца низких значений ПСС, наряду с недостоверным снижением ОПСС, указывало на умеренное изменение тонуса периферических сосудов, что объясняется медленным формированием положительной динамики показателей АД на фоне проводимой терапии (табл. 7).
Таблица 7
Динамика параметров периферической гемодинамики (М±m).
| Показатель | Здоровые (n=14) | 1 группа (n=26) | 2 группа (n=27) | ||
| исходно | 2 месяца | исходно | 2 месяца | ||
| САД, мм рт ст | 119±3,2 | 130,2±3,5* | 129±7,4 | 130±2,6* | 121,6±1,9 |
| ДАД, мм рт ст | 66,1±3,1 | 94,8±1,4 | 66,5±4,5 | 94,9±1 | 64,1±2,1 |
| АДср., мм рт ст | 83,7±1,8 | 98,5±3 | 97,8±6 | 100±2,1 | 92,3±1,5 |
| ПАД, мм рт ст | 46±3,9 | 61,7±4 | 63,3±3,2 | 60±2,9 | 57,5±2,8* |
| ПСС, мл/мм рт ст | 2,16±0,1 | 1,84±0,07 | 1,9±0,2 | 1,95±0,1* | 1,9±0,2 |
| ОПСС, дин*см-5*с | 1334±29 | 1427±58,2 | 1407±42 | 1450±60,8 | 1315±78 |
| СПВ, см/сек | 666±8,1 | 663±36,2 | 681±7,3 | 677±26,2 | 645±25,7 |
*p<0,05; p<0,01 – достоверность различий с показателями здоровых лиц
Во 2 группе через 2 месяца терапии выявлено положительное влияние кардостена в сочетании с иАПФ на эластичность крупных сосудов с понижением SI на 16 % (p<0,05) и резистивных сосудов со снижением RI на 12 % (p<0,05) (табл. 8). Напротив, у пациентов 1 группы через 2 месяца монотерапии иАПФ значения жесткости сосудистой стенки существенно не изменились, оставаясь на уровне SI=11,2±0,7 м/с (p<0,01) и RI=69,1±3,7 % (p<0,01) (табл. 8). При этом в 1 группе на фоне лечения отмечено умеренное снижение показателей АД и недостоверное изменение параметров ОПСС, ПСС и СПВ (табл. 7).
Анализ динамики показателей функции эндотелия на фоне терапии комбинацией кардостена и иАПФ у больных 2 группы выявил повышение ЭЗВД на 7,4 % (p<0,01) от исходных значений (табл. 8), при этом нормального уровня ЭЗВД (>1,5 усл.ед.) достигло 19 % пациентов. У больных 1 группы оценка результатов окклюзионной пробы показала, что среднее значение ЭЗВД на фоне лечения иАПФ через 2 месяца значимо не изменилось (табл. 8).
Таблица 8
Динамика показателей жесткости сосудистой стенки
и функции эндотелия (М±m)
| Показатель | Здоровые (n=14) | 1 группа (n=26) | 2 группа (n=27) | ||
| исходно | 2 месяца | исходно | 2 месяца | ||
| SI, м/с | 8,3±0,2 | 11,4±0,4 | 11,2±0,7 | 11,3±0,8 | 9,46±0,7* |
| RI, % | 59,1±1,5 | 70,6±2,6 | 69,1±3,7 | 70,8±4,8 | 62,5±3,6* |
| ЭЗВД, усл ед | 1,8±0,1 | 1,4±0,1 | 1,4±0,1 | 1,25±0,06 | 1,35±0,04 |
p<0,01 – достоверность различий с показателями здоровых лиц
*p<0,05 – достоверность различий с исходными значениями
На основании данных, полученных у больных АГ и СД при анализе ВСР и лабораторного исследования крови при проведении гипотензивной терапии, был разработан способ прогнозирования состояния функции эндотелия. Данный способ имеет клиническое значение, позволяя прогнозировать эффект лечения ЭД уже через 4 недели приема препаратов на основании динамики показателей вегетативного статуса и -АРМ с расчетом коэффициента вегетативного баланса (КВБ) по формуле (1) и коэффициента адренореактивности (КА) по формуле (2):
 (1),
(1),
 (2),
(2),
где SDNNисх, Tpисх, Amoисх, -АРМисх – значения показателей до начала терапии; SDNNi, Tpi, Amoi, -АРМi – показатели через 4 недели лечения.
Анализ клинических наблюдений показал, что если через 4 недели терапии значение КА0,61 усл.ед., а величина КВБ<1,0 усл.ед., что свидетельствует об изменении адренореактивности -адренорецепторов на фоне уменьшения активности СНС, то прогноз состояния функции эндотелия на фоне проводимого лечения благоприятный.
При показателе КА<0,6 усл.ед. наряду с величиной КВБ1,01 усл.ед., что отражает значительное усиление адренореактивности рецепторов при повышении активности СНС, прогноз для терапии ЭД неблагоприятный и требуется коррекция проводимой терапии.
В настоящем исследовании у больных АГ (n=21) и у пациентов с сочетанием АГ и СД (n=27) при выполнении ВЭМ-пробы установлено изменение функциональных возможностей сердечно-сосудистой системы со снижением толерантности к физической нагрузке (ФН). У пациентов, страдавших АГ, при средней пороговой мощности нагрузки W=153,6±4 Вт (р<0,01) САД составило 200,8±3,3 мм рт ст (p<0,05), ДАД – 99,6±1,8 мм рт ст (р<0,01) (табл. 9).
Таблица 9
Результаты велоэргометрической пробы (М±m)
| Показатели | Здоровые (n=19) | АГ (n=21) | СД+АГ (n=27) | |
| Исходно | САД, мм рт ст | 125,5±2,6 | 139,8±2,4 | 121,5±1,5 |
| ДАД, мм рт ст | 84,9±1,8 | 90,2±1,5 | 80±1,4 | |
| ЧСС, уд/мин | 78,6 ±2,9 | 97,4±3 | 72,4±2,6 | |
| АДср, мм рт ст | 98,4±2 | 107,7±1,8 | 94,5±1,6 | |
| ПАД, мм рт ст | 40,6±1,6 | 50,5±2,2 | 43,5±2,2 | |
| ДП, ед | 103,3±8,4 | 111,2±4,8 | 87,9±3,1 | |
| Пороговые значения | W, Вт | 173,8±2,2 | 153,6±4 | 87,5±6,7 |
| t, мин. | 20,9±0,26 | 18,4±0,48 | 10,5±0,8 | |
| При пороговой нагрузке | САД, мм рт ст | 190,5±3,4 | 200,8±3,3* | 165,5±5 |
| ДАД, мм рт ст | 93,2±1,7 | 99,6±1,8 | 87±2,9 | |
| ЧСС, уд/мин | 127,7±2,9 | 115,3±3,2 | 103,8±4,1 | |
| АДср, мм рт ст | 125,5±1,9 | 133,6±1,6 | 113,2±1,6* | |
| ПАД, мм ртст | 97,9±3,3 | 100,7±3,8 | 78,5±7,2 | |
| ДП, ед | 175,8±5,6 | 230,5±7,5 | 167±9,7* | |
| КФР, усл.ед | 1,75±0,02 | 1,55±0,04 | 0,88±0,07 | |
р<0,01;*р<0,05 – достоверность различий с группой здоровых лиц
У больных АГ в сочетании с СД средний пороговый уровень нагрузки до начала лечения был снижен до W=87,5±6,7 Вт (р<0,01), при этом показатель САД повысился до 165,5±5 мм рт ст (р<0,01), ДАД до 87±2,9 мм рт ст (р<0,01) (табл. 9), появились жалобы на физическую усталость, что требовало прекращения нагрузочной пробы. Выявленное в ходе исследования увеличение АД у больных обследованных групп при физической нагрузке средней интенсивности (50-100 Вт) свидетельствовало о повышении сосудистого тонуса. Это обуславливало низкие показатели толерантности к нагрузке у пациентов, по сравнению со здоровыми лицами, выполнявших пороговую нагрузку мощностью W=173,8±2,2 Вт. При этом, время выполнения ВЭМ-пробы (t) у больных АГ составило 18,4±0,48 мин. (р<0,01), у пациентов с сочетанием АГ и СД – 10,5±0,8 мин. (р<0,01), в отличие от здоровых лиц, у которых продолжительность нагрузочного теста была t=20,9±0,26 мин. (табл. 9). Кроме того, установлено, что при выполнении пороговой нагрузки у здоровых лиц происходило увеличение показателя двойного произведения (ДП) в 1,7 раз, тогда как у больных АГ и СД – в 1,9 раза (р<0,05), у пациентов с АГ – в 2,1 раза (р<0,01) (табл. 9), что было связанно с увеличением потребности миокарда в кислороде, несмотря на выполнение больными пороговой нагрузки меньшей мощности.
В настоящем исследовании для оценки эффективности терапии у больных с сочетанием АГ и СД впервые был использован новый диагностический показатель – коэффициент физической работоспособности (КФР), определявшийся по результатам ВЭМ-пробы по формуле (3):
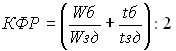 (3)
(3)
где Wб – величина мощности пороговой нагрузки и tб – продолжительность выполнения нагрузочной пробы больного; Wзд – величина максимальной физической нагрузки и tзд – продолжительность выполнения нагрузочной пробы у здоровых лиц.
Наиболее высокие значения КФР=1,75±0,02 усл.ед. при ВЭМ-пробе установлены у здоровых лиц. Снижение толерантности к ФН, обусловленное повышением АД во время ВЭМ-пробы, приводило к уменьшению КФР у больных АГ до 1,55±0,04 усл.ед. (p<0,01). В еще большей степени снижение КФР отмечено у пациентов с сочетанием АГ и СД – до 0,88±0,07 усл.ед. (p<0,01) (табл. 9).
При анализе результатов окклюзионной пробы до и после проведения ВЭМ-исследования у здоровых лиц отмечена положительная динамика с увеличением значения ЭЗВД на 14,9 % (p<0,01) (рис. 1). Напротив, у больных АГ прирост ЭЗВД после нагрузочной пробы составил 7,7 % (р<0,05), у пациентов с сочетанием АГ и СД выявлено снижение величины ЭЗВД на 16 % (р<0,05), что объясняется уменьшением функционального резерва вазодилятации на фоне ЭД (рис. 1).

Рис. 1. Динамика ЭЗВД при выполнении ВЭМ-пробы.
**p<0,01;*р<0,05 – достоверность различий с показателями здоровых лиц
p<0,01– достоверность различий с исходными показателями здоровых лиц
По данным корреляционного анализа выявлены сильные отрицательные связи между индексом жесткости SI и КФР (r= -0,78; p<0,01), между SI и мощностью пороговой нагрузки (r= -0,79; p<0,01), а так же между SI и временем выполнения ВЭМ-пробы (r= -0,79; p<0,01). Это указывает на формирование зависимости между увеличением жесткости стенки крупных сосудов и снижением переносимости ФН у больных АГ в сочетании с СД.
Назначение комбинированной терапии препаратом кардостен и иАПФ у больных с сочетанием АГ и СД оказало положительное влияние на параметры ригидности стенки сосудов и реакцию сосудистого эндотелия, оцениваемую до и после проведения ВЭМ-пробы (табл. 10). Если до начала терапии у пациентов с сочетанием АГ и СД снижение показателя ЭЗВД было на 16 % (р<0,05) после выполнения пороговой нагрузки, то через 2 месяца приема кардостена и иАПФ показатель ЭЗВД уменьшился на 6 % (p<0,05) после ВЭМ-пробы (табл. 10). При этом, следует отметить, что до начала лечения после выполнения пороговой ФН величина ЭЗВД достигла нормальных значений (ЭЗВД>1,5 усл.ед.) только у 11 % больных с сочетанием АГ и СД, через 2 месяца комбинированной терапии – у 25 % пациентов. Полученные результаты отражают повышение адаптационных возможностей сосудистого эндотелия при выполнении ФН после курсовой терапии кардостеном и иАПФ.
Таблица 10
Динамика показателей ЭЗВД и жесткости сосудистой стенки
на фоне ВЭМ-пробы при терапии кардостеном в сочетании с иАПФ (М±m)
| Показатели | Здоровые (n=14) | АГ+СД (n=27) | ||
| исходно | 2 месяца | |||
| До нагрузки | SI, м/с | 8,3±0,22 | 11,3±0,8 | 9,46±0,7* |
| RI, % | 59,1±1,5 | 70,8±4,8 | 62,5±3,6* | |
| ЭЗВД, усл ед | 1,89±0,1 | 1,25±0,06 | 1,35±0,04 | |
| После нагрузки | SI, м/с | 7,72±0,22 | 10,36±0,9 | 9,3±0,41* |
| RI, % | 53±1,37 | 61,2±3,6 | 61,1±3,2 | |
| ЭЗВД, усл ед | 2,22±0,1 | 1,05±0,12 | 1,27±0,06 | |
р<0,01– достоверность различий с группой здоровых лиц
*р<0,05 – достоверность различий с исходными значениями
На основании данных, полученных у больных АГ и пациентов с сочетанием АГ и СД при исследовании ЭЗВД до и после ФН, был предложен расчет нового диагностического критерия – коэффициента резерва вазодилятации, который определяется по по формуле (4):
 (4)
(4)
где ЭЗВДисх – эндотелий зависимая вазодилятация, регистрируемая до начала нагрузочной пробы; ЭЗВДi – эндотелий зависимая вазодилятация, регистрируемая на 10 минуте после проведения ВЭМ-пробы.
Значение КРВ>1 усл.ед. указывают на сохранение функционального резерва сосудистого эндотелия для вазодилятации у обследуемого больного, КРВ<1 усл.ед. характеризует снижение адаптационных возможностей эндотелия.
По результатам исследования значение КРВ1 усл.ед. установлено у 62 % пациентов с АГ, что говорит о сохранении вазодилятирующей функции эндотелия (рис. 2а). У больных с сочетанием АГ и СД расчетный показатель КРВ>1 усл.ед. установлен только у 33 % лиц, что указывает на сохранение функциональных возможностей сосудистого эндотелия после выполнения нагрузочной пробы у ограниченного числа пациентов (рис. 2б). При проведении окклюзионной пробы до и после ВЭМ через 2 месяца терапии кардостеном и иАПФ выявлено повышение функционального резерва эндотелия с достижением показателя КРВ1 усл.ед. у 50 % обследованных лиц с сочетанной патологией (рис. 2в).


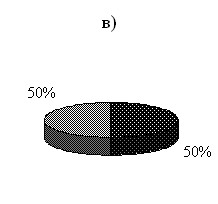
Рис. 2. Распределение больных согласно изменению ЭЗВД после проведения ВЭМ-пробы: а) больные АГ, б) больные АГ+СД до терапии, в) больные АГ+СД через 2 месяца терапии кардостеном в комбинации с иАПФ.
Комбинированная фармакотерапия кардостеном и иАПФ у пациентов с сочетанием АГ и СД также положительно влияла на переносимость ФН, что выражалось в достоверном увеличении мощности пороговой нагрузки на 22 % и КФР на 24 % (табл. 11).
Таблица 11
Результаты ВЭМ-пробы у пациентов с АГ+СД
на фоне терапии кардостеном в комбинации с иАПФ (М±m)
| Показатели | Здоровые (n=14) | АГ+СД (n=27) | ||
| исходно | 2 месяца | |||
| Пороговые значения | W, Вт | 173,8±2,2 | 87,5±6,7 | 112,5±8,5 |
| t, мин | 20,9±0,3 | 10,5±0,8 | 13,5±1 | |
| При пороговой нагрузке | САД, мм рт ст | 190,5±3,4 | 165,5±5 | 160±9,4 |
| ДАД, мм рт ст | 93,2±1,7 | 87±2,9* | 86,7±4,2* | |
| ЧСС, уд/мин | 127,7±2,9 | 103,8±4,1 | 99,2±3,4 | |
| АДср, мм рт ст | 125,5±1,9 | 113,2±1,6* | 111,1±5,7 | |
| ПАД, мм рт ст | 97,9±3,3 | 78,5±7,2 | 73,3±6,4* | |
| ДП, ед | 175,8±5,6 | 167±9,7 | 160±14,4 | |
| КФР, усл.ед | 1,75±0,02 | 0,88±0,07 | 1,13±0,09 | |
р<0,01;*р<0,05 – достоверность различий с группой здоровых лиц
Через 2 месяца терапии кардостеном и иАПФ у пациентов с АГ и СД при выполнении ФН большей интенсивности W=112,5±8,5 Вт (р<0,01) пороговый показатель САД достигал величины 160±9,4 мм рт ст (р<0,01), наряду со снижением ПАД, АДср., ЧСС на высоте ФН, что отражало тенденцию к улучшению физиологических возможностей сосудистой системы после фармакотерапии (табл. 11).
Таким образом, проведенное исследование обосновывает необходимость применения сверхмалых доз антител к АТ1-рецептору к ангиотензину II в комбинации с иАПФ для фармакологической коррекции ЭД и вегетативного баланса у больных с АГ в сочетании с СД 2 типа. Данный подход позволяет повысить клиническую эффективность лечения больных с сочетанной патологией и улучшить функциональное состояние сосудистого эндотелия.
Выводы
1. Сочетанная патология (АГ и СД 2 типа) сопровождается повышением жесткости сосудистой стенки (прирост SI на 25 %, RI на 18 %), снижением эндотелий зависимой вазодилятации на 27 % на фоне увеличения показателей липопероксидации и угнетения антиоксидантной активности крови.
2. Особенностью патогенеза при формировании сочетанной патологии АГ и СД 2 типа является выраженный вегетативный дисбаланс с гиперсимпатикотонией, что проявляется снижением SDNN на 38 %, увеличением стресс-индекса в 5-8 раз и десенситизацией -адренорецепторов.
3. Фармакологическая коррекция при назначении препарата кардостен и иАПФ, в сравнении с монотерапией иАПФ, через 2 месяца лечения способствует достоверному повышению эндотелий зависимой вазодилятации, снижению симпатикотонии с уменьшением стресс-индекса на 58 % и увеличением чувствительности -адренорецепторов на 32 %.
4. Контроль показателей ЭЗВД после пробы с дозированной физической нагрузкой выявил достоверное улучшение функционального состояния эндотелия с повышением вазодилятации в 1,2 раза у 50 % больных АГ и СД через 2 месяца лечения иАПФ в комбинации с кардостеном.
5. Оценка эффективности антигипертензивной терапии у больных АГ и СД 2 типа по данным ВЭМ-пробы, с расчетом нового диагностического критерия (коэффициента физической работоспособности), показала через 2 месяца лечения повышение толерантности к физической нагрузке на 24,4 %.
Практические рекомендации
1. Рекомендуется использовать комбинацию иАПФ и препарата кардостен (2 таблетки 2 раза в день курсом не менее 2-х месяцев) с целью повышения эффективности терапии ЭД у больных АГ в сочетании с СД 2 типа.
2. Для оценки индивидуальной переносимости и прогноза эффективности коррекции функции эндотелия у больных АГ и СД 2 типа обосновано мониторирование показателей вариабельности сердечного ритма и адренореактивности -адренорецепторов с расчетом диагностических критериев (КВБ, КА).
3. Для выявления функциональных возможностей сосудистой стенки и подбора средств индивидуальной фармакокоррекции рекомендуется применение пробы с дозированной физической нагрузкой и определение эндотелий зависимой вазодилятации до и после велоэргометрической пробы.
4. Контроль эффективности антигипертензивной терапии у больных с сочетанием АГ и СД 2 типа рекомендуется осуществлять при проведении пробы с физической нагрузкой с расчетом коэффициента физической работоспособности.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
Список статей, опубликованных в журналах, рекомендованных ВАК:
1. Изменение эластичности сосудистой стенки у больных сахарным диабетом 2 типа / В.А. Красюкова, Е.И. Щербакова, Ю.Н. Чернов, О.А. Мубаракшина // Системный анализ и управление в биомедицинских системах. – 2009. – Т.8, №3. – С.762 – 765.
2. Красюкова В.А. Анализ вегетативной регуляции и эластичности сосудистой стенки у больных сахарным диабетом 2 типа / В.А. Красюкова, Ю.Н. Чернов, Г.А. Батищева // Достижения клинической фармакологии в России: материалы науч.-практ. конференции с международным участием. Клиническая фармакология и терапия. Приложение. – 2009. – №6. – С.150-151.
3. Эндотелиальная дисфункция при сахарном диабете и возможные пути фармакологической коррекции / Ю.Н. Чернов, В.А. Красюкова, Г.А. Батищева, О.А. Мубаракшина // Экспериментальная и клиническая фармакология. – 2010. – Т. 73, №2. – С. 39-43.
Изобретения:
4. Патент № 2257840. Способ оценки эффективности фармакотерапии при артериальной гипертонии / Г.А. Батищева, Ю.Н. Чернов, Н.Ю. Гончарова, И.Б. Ушаков, А.С. Калюжная, Т.Е. Котельникова, Т.В. Микляева, Е.В. Растяпина, В.А. Красюкова; опубл. 10.08.2005.
Список работ, опубликованных в других изданиях:
5. Красюкова В.А. Анализ фармакотерапии пациентов с сахарным диабетом 2 типа и сопутствующими заболеваниями / В.А. Красюкова, Ю.Н. Чернов // Материалы 1 Всероссийской конференции молодых ученых, организованной Воронежской государственной медицинской академией им. Н.Н. Бурденко и Курским государственным медицинским университетом. – Воронеж, 2007. – Т. 1. – С. 41-44.
6. Проблема инсулинорезистентности при лечении больных сахарным диабетом 2 типа /Ю.Н. Чернов, Г.А. Батищева, Е.И. Щербакова, В.А. Красюкова // Материалы 1 Всероссийской конференции молодых ученых, организованной Воронежской государственной медицинской академией им. Н.Н. Бурденко и Курским государственным медицинским университетом. – Воронеж, 2007. – Т. 1. – С. 126-130.
7. Чернов Ю.Н. Анализ фармакотерапии пациентов с сахарным диабетом 2 типа и сопутствующими заболеваниями / Ю.Н. Чернов, В.А. Красюкова // 14 Рос. нац. конгресс ‹‹Человек и лекарство››: тезисы докл. – М., 2007. – С. 243.
8. Красюкова В.А. Окислительный стресс как фактор развития осложнений сахарного диабета 2 типа / В.А. Красюкова, Ю.Н. Чернов, Г.А. Батищева // 15 Рос. нац. конгресс ‹‹Человек и лекарство››: тезисы докл. – М., 2008. – С. 183.
9. Чернов Ю.Н. Эффективность комплексной терапии пациентов, страдающих сахарным диабетом 2 типа / Ю.Н. Чернов, В.И. Золоедов, В.А. Красюкова // Научно-медицинский вестник Центрального Черноземья: научно-практический журнал. – Воронеж, 2008. – № 32.– С. 53-55.
10. Клинико-морфологические особенности сочетания остеопороза и сахарного диабета 2 типа / Е.И. Щербакова, В.А. Красюкова, Ю.Н. Чернов, Г.А. Батищева // Материалы 3 Всероссийской конференции молодых ученых, организованной Воронежской государственной медицинской академией им. Н.Н. Бурденко и Курским государственным медицинским университетом. – Воронеж, 2009. – Т.1. – С. 138-140.
11. Красюкова В.А. Сахарный диабет 2 типа и эластичность стенки сосудов / В.А. Красюкова, Ю.Н. Чернов, О.А. Мубаракшина // Кардиология: реалии и перспективы: материалы Российского национального конгресса кардиологов, 6-8 октября 2009. – М., 2009. – С.193-194.
12. Жесткость сосудистой стенки и развитие ангиопатий у больных сахарным диабетом 2 типа / Е.И. Щербакова, Ю.Н. Чернов, В.А. Красюкова, Н.Г. Фетисова, Е.А. Киселева, Н.В. Разуваева // 17 Рос. нац. конгресс ‹‹Человек и лекарство››: тезисы докл. – М., 2010. – С. 309-310.
13. Эластичность стенки сосудов у пациентов, страдающих сахарным диабетом 2 типа / В.А. Красюкова, Г.А. Батищева, Ю.Н. Чернов, Е.И. Щербакова // Актуальные вопросы организации, оказания первичной, специализированной медицинской помощи в условиях многопрофильного стационара на догоспитальном этапе: материалы 4 науч.-практ. конференции. – Воронеж, 2010. – С. 218-220.
14. Особенности лекарственного обеспечения в лечебном учреждении: методическое пособие для клинических ординаторов / под ред. В.Г. Кукеса, Ю.Н. Чернова. Гл. Особенности назначения противодиабетических препаратов. Коррекция эндотелиальной дисфункции / Ю.Н.Чернов, О.А. Мубаракшина, В.А. Красюкова. – Воронеж: Истоки, 2010. – С. 95-105.
Список сокращений
АГ – артериальная гипертензия
АД – артериальное давление
АОА – антиокислительная общая активность плазмы крови
АРА – антагонисты рецепторов к ангиотензину II
ВСР – вариабельность сердечного ритма
ВЭМ – велоэргометрия
ДАД – диастолическое артериальное давление
ДК – диеновые коньюгаты
ДП – двойное произведение
ГПЛ – гидроперекиси липидов
иАПФ – ингибиторы ангиотензинпревращающего фермента
ИМТ – индекс массы тела
ИР – инсулинорезистентность
КА – коэффициент адренореактивности
КВБ – коэффициент вегетативного баланса
КФР – коэффициент физической работоспособности
МДА – малоновый диальдегид
ОПСС – общее периферическое сосудистое сопротивление
ПАД – пульсовое артериальное давление
ПОЛ – перекисное окисление липидов
ПСС – податливость сосудистой системы
ПССП – пероральные сахароснижающие препараты
ОХС – общий холестерин
САД – систолическое артериальное давление
СД – сахарный диабет
СПВ – скорость распространения пульсовой волны
ФН – физическая нагрузка
ЭЗВД – эндотелий зависимая вазодилятация
ЭД – эндотелиальная дисфункция
-АРМ – бета-адренореактивность клеточных мембран эритроцитов
SI – индекс жесткости
RI – индекс отражения пульсовой волны

