Брахитерапия как метод р адикального лечения рака предстател ь ной железы (
На правах рукописи
ИВАНОВ СЕРГЕЙ АНАТОЛЬЕВИЧ
бРАхИТЕРАпИЯ
КАК мЕТОд РАдИКАЛЬНОГО ЛЕЧЕНИЯ
РАКА пРЕдСТАТЕЛЬНОЙ жЕЛЕзы
(14.01.13. - лучевая диагностика, лучевая терапия
14.01.12. – онкология)
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Москва - 2010
Работа выполнена в ФГУ "Российский научный центр рентгенорадиологии Росмедтехнологий" (директор - член-корреспондент РАМН, профессор Солодкий В.А.).
Научные консультанты:
академик РАМН, профессор В.П. Харченко
доктор медицинских наук, профессор А.Д. Каприн
Официальные оппоненты:
доктор медицинских наук, профессор
Шаплыгин Леонид Васильевич
доктор медицинских наук, профессор
даценко павел Владимирович
доктор медицинских наук, профессор
зайцев Андрей Владимирович
Ведущая организация: ФГУ "Московский научно-исследовательский онкологический институт им. П.А.Герцена Росмедтехнологий"
Защита диссертации состоится « 28 » июня 2010 года в 13 часов на заседании диссертационного совета Д 208.081.01 при ФГУ "Российский научный центр рентгенорадиологии Росмедтехнологий" (117997, Москва, ул. Профсоюзная, д. 86).
С диссертацией можно ознакомиться в научно-медицинской библиотеке ФГУ "Российский научный центр рентгенорадиологии Росмедтехноло-гий" (117997, Москва, ул. Профсоюзная, д. 86).
Автореферат разослан « » мая 2010 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор З.С. Цаллагова
СпИСОК СОКРАЩЕНИЙ
| БТ | - брахитерапия |
| ВОЗ | - Всемирная организация здравоохранения |
| ГРРПЖ | - гормонорезистентный рак предстательной железы |
| гт | - гормональная терапия |
| дгПЖ | - доброкачественная гиперплазия предстательной железы |
| длт | - дистанционная лучевая терапия |
| ДПФТ | - дистанционная протонно-фотонная терапия |
| кт | - компьютерная томография |
| лг | - лютеинизирующий гормон |
| РГЛГ | - релизинг гормон лютеинизирующего гормона |
| лт | - лучевая терапия |
| ЛУ | - лимфатические узлы |
| МАБ | - максимальная андрогенная блокада |
| МРТ | - магнито-резонансная томография |
| пж | - предстательная железа |
| ПСА | - простатспецифический антиген |
| РПЭ | - радикальная простатэктомия |
| РОД | - разовая очаговая доза |
| РПЖ | - рак предстательной железы |
| РФП | - радиофармпрепарат |
| сод | - суммарная очаговая доза |
| ТРПБ | - трансректальная пункционная биопсия |
| ТРУЗИ | - трансректальное ультразвуковое исследование |
| УЗИ | - ультразвуковое исследование |
ОбЩАЯ хАРАКТЕРИСТИКА РАбОТы
Актуальность проблемы. Рак предстательной железы (РПЖ) - одна из важных проблем онкоурологии и вначале XXI века становится одной из самых распространенных болезней среди мужского населения большинства стран мира.
Едва ли можно назвать другую проблему в современной медицине, которая привлекала бы столь пристальное внимание не только клиницистов, но и морфологов, рентгенологов, фармакологов.
В структуре онкологических заболеваний ряда стран РПЖ занимает прочное 2-3 место после рака легких и желудка (Park et al., 2003; Rebillard et al., 2003).
В России РПЖ составляет 2,9% от всех онкологических и 36% от онкоурологических заболеваний. В последние годы тактика лечения пациентов с раком простаты изменилась в пользу более активного отбора больных, подлежащих радикальному хирургическому лечению (Степанов В.Н., 1997; Helson et al., 2002; Lepor, 2004). В то же время, сдержанное отношение многих урологов к радикальной простатэктомии (РПЭ) объясняется технической сложностью операции и сравнительно высокой частотой послеоперационных осложнений, которые обусловлены, прежде всего, анатомическими особенностями железы.
Проведение радикального лечения возможно при локализованной форме РПЖ, которая диагностируется у 30% больных с первично выявленными злокачественными новообразованиями предстательной железы, тогда как 60-80% случаев заболевания приходятся на местно-распространенные и генерализованные формы, основным методом лечения которых является гормонотерапия. Способы проведения этого вида лечения могут быть различными по эффективности и переносимости. К основным методам гормонотерапии относятся билатеральная орхидэктомия, лечение эстрогенами и антиандрогенами, терапия препаратами-аналогами гонадотропина рилизинг-гормона (ГРГ), возможно сочетание различных методов. Назначение неадекватной гормональной терапии может приводить к отсутствию положительного терапевтического эффекта, большим экономическим затратам и потере времени. Более того, такое лечение может вызвать быстрое прогрессирование заболевания. Статистически достоверного преимущества максимальной андрогенной блокады (МАБ) по сравнению с хирургической или медикаментозной кастрацией в общей и безрецидивной выживаемости при распространенном РПЖ не выявлено, МАБ не имеет преимущества в переносимости перед хирургической или медикаментозной кастрацией.
В настоящее время твердо упрочилось представление о значении лучевой терапии как одном из ведущих методов лечения при раке предстательной железы, применяемым как самостоятельно, так и в комплексе с хирургическим методом, гормональной и химиотерапией и т.д. Лучевая терапия является в настоящее время одним из ведущих консервативных специальных методов лечения рака предстательной железы при локализованном и при местно-распространенном процессе. В литературе последних лет утвердилось мнение о том, что лучевая терапия является хорошей альтернативой радикальной простатэктомии (РПЭ) при ранних стадиях (Т1-Т2) рака предстательной желез. При этом в подходах к лучевому лечению у различных авторов имеются различные мнения, касающиеся техники и технологии облучения, объема лучевого воздействия и суммарных очаговых доз.
К настоящему времени определены роль и место бурно развивающегося в последнее десятилетие важнейшего направления лучевой терапии — протонной. Несмотря на очевидные успехи, сфера применения протонной лучевой терапии остается очень ограниченной, составляя всего 7% от всей структуры онкологических заболеваемости (Hara I., Murakami M., 2004).
Брахитерапия 125J Rapid-Strand является современным, высокотехнологичным, эффективным, сравнительно безопасным и легко воспроизводимым методом лечения РПЖ, с низким уровнем осложнений и смертности. Однако, в настоящее время не изучены отдаленные результаты лечения методом брахитерапии, не проведено качественное сравнение с другими видами лечения локализованного и местнораспространенного РПЖ, в связи с чем не определено, может ли брахитерапия рассматриваться в качестве реальной альтернативы дистанционной лучевой терапии и радикальной простатэктомии. Это послужило причиной проведения данного исследования.
Цель исследования:
Улучшить результаты лечения больных раком предстательной железы за счет оптимизации выбора метода радикального лечения.
Задачи исследования:
- Определить факторы прогноза развития рака предстательной железы.
- Изучить частоту развития ранних и поздних осложнений после радикальной простатэктомии, брахитерапии, фотонной и протонно-фотонной лучевой терапии.
- Провести сравнительный анализ результатов лечения при раке предстательной железы методом брахитерапии с результатами лечения хирургическим методом и основными методами лучевой терапии (фотонная и протонно-фотонная лучевая терапия).
- Выявить степень влияния брахитерапии при раке предстательной железы на качество жизни пациентов в сравнении с другими методами радикального лечения.
- Разработать алгоритм выбора метода радикального лечения при локализованном и местнораспространенном раке предстательной железы.
Научная новизна.
- На основании анализа ближайших и отдаленных результатов лечения оценено значение различных современных методов лечения больных локализованным раком предстательной железы.
- Достоверно установлены терапевтические преимущества брахитерапии среди других методов лучевой терапии (фотонной и протонно-фотонной).
- Достоверно установлено преимущество протонно-фотонной терапии по сравнению с фотонной дистанционной лучевой терапией.
- Определены показания к брахитерапии, дистанционной фотонной и протонно-фотонной терапии у больных раком предстательной железы.
- Выявлены преимущества и недостатки брахитерапии при лечении пациентов, страдающих раком предстательной железы.
Практическая значимость.
Оценена значимость для прогноза эффективности лечения методом брахитерапии при раке предстательной железы таких критериев, как клиническая стадия РПЖ, инициальный уровень ПСА, степень дифференцировки по шкале Глисона и процент положительных биоптатов. Для определения вероятности наличия метастатического поражения регионарных лимфоузлов определена целесообразность использование значения инициального ПСА. Выяснено, что для осуществления оптимального выбора метода лечения пациентов целесообразно их деление на группы риска развития опухоли (с учетом стадии опухолевого процесса и значения ПСА). Выявлены определяющие составляющие эффективного выполнении позадилонной простатэктомии (анатомичность доступа, осуществление гемостаза и наложение пузырно-уретрального анастомоза). Установлена необходимость проведения профилактики постлучевого ректита, цистита, простатита при использовании методов фотонной и протонно-фотонной дистанционной лучевой терапии. Установлены преимущества протонно-фотонной терапии над фотонной терапией при проведении радикального лечения по поводу рака предстательной железы. Выявлена большая эффективность брахитерапии по сравнению с другими существующими методами радикального лучевого лечения при локализованном раке предстательной железы.
Основные положения, выносимые на защиту
- Результаты радикального лечения при локализованном и местнораспространенным раком предстательной железы определяются методом проведенного лечения и основными параметрами опухолевого процесса такими, как клиническая стадия РПЖ, инициальный уровень ПСА, степень дифференцировки по шкале Глисона и процент положительных биоптатов.
- Для осуществления оптимального выбора метода лечения целесообразно использование распределение пациентов на группы риска прогрессирования опухолевого процесса.
- Наиболее эффективными методами лечения локализованного рака предстательной железы являются радикальная простатэктомия и брахитерапия.
- Протонно-фотонная радикальная лучевая терапия по сравнению с фотонной радикальной лучевой терапией при сопоставимой эффективности приводит к достоверно меньшему количеству осложнений.
Реализация и апробация результатов исследования
Основные положения диссертации изложены в 16 печатных научных работах, опубликованных в рецензируемых научных журналах, содержащихся в «Перечне ведущих рецензируемых научных журналов и изданий» ВАК РФ. Научные результаты, полученные при выполнении диссертационного исследования, используются при лечении пациентов с диагнозом РПЖ в отделении урологии Российского научного центра рентгенорадиологии Росмедтехнологий, Главного военного клинического госпиталя им. Н.Н. Бурденко МО РФ, а также в системе последипломного медицинского образования кафедры урологии факультета усовершенствования врачей РГМУ им. Н.И. Пирогова, факультета повышения квалификации медицинских работников Российского университета дружбы народов, курса урологии при кафедре хирургии ФППОВ Московской медицинской академии им. М.А. Сеченова.
Основные положения работы доложены и обсуждены на заседании Московского общества урологов, на 1-ом съезде онкоурологов Российской федерации.
Объем и структура работы.
Диссертация состоит из введения, 6 глав, заключения, выводов, указателя литературы. Изложена на 308 страницах машинописи, содержит 56 таблиц и 45 рисунков. Указатель литературы содержит 145 отечественных и 234 зарубежных источников.
Связь с планом научных работ РНЦРР.
Работа выполнена по основному плану научно-исследовательских работ Российского научного центра рентгенорадиологии МЗСР РФ по проблеме: "Разработка новых методов диагностики и лечения онкоурологических заболеваний". Номер Государственной регистрации 01.91.0 001778.
СОдЕРжАНИЕ РАбОТы
Общая характеристика больных и методов исследования
В основе работы лежит изучение результатов лечения 335 больных раком предстательной железы, находившихся на лечении в урологическом отделении Российского научного центра рентгенорадиологии Росмедтехнологий с 1999 по 2007 год.
Возраст пациентов колебался от 49 до 82 лет. Диагноз у всех больных был верифицирован цитологическим или гистологическим методами. Всем пациентам после морфологической верификации в течение 3 месяцев проводилась гормональная терапия в режиме МАБ (хирургическая или медикаментозная кастрация в комбинации с антиандрогенами).
В зависимости от метода радикального лечения больные были разделены на 4 группы. Первую группу (группа I) составили 74 больных, которым была выполнена радикальная простатвезикулэктомия. Во вторую группу (группа II) вошли 76 пациентов, которым в качестве радикального метода лечения была проведена дистанционная мегавольтная фотонная лучевая терапия по радикальной программе. В третью группу (группа III) были включены 62 пациента, которым в качестве основного курса лечения был проведена протонно-фотонная терапия. В четвертую группу (группа IV) были включены 123 пациента, которым после проведения курса неоадъювантной гормональной терапии была проведена внутритканевая лучевая терапия (брахитерапия) (табл. 1).
Таблица 1.
Распределение пациентов Рпж по видам лечения
| Группы | Количество пациентов | |
| абс. | % | |
| I группа (радикальная простатэктомия) | 74 | 22,1 |
| II группа (лучевая фотонная терапия) | 76 | 22,7 |
| III группа (лучевая протонно-фотонная терапия) | 62 | 18,5 |
| IV группа (брахитерапия) | 123 | 36,7 |
| Всего | 335 | 100 |
Распределение больных в зависимости от распространенности опухолевого процесса в соответствии с последней редакцией классификации TNM международного противоракового союза (TNM>
Таблица 2.
Распределение пациентов Рпж в зависимости от стадии
опухолевого процесса
| Распространенность Рпж | Стадия (TNM) | Кол-во больных | |
| абс. | % | ||
| Локализованный | T1N0M0 | 57 | 17,0 |
| T2N0M0 | 182 | 54,3 | |
| Местнораспространенный | T3N0M0 | 96 | 28,7 |
| Всего | Все стадии | 335 | 100 |
Значительных различий в распространенности опухолевого процесса среди больных всех групп не было. Большая часть пациентов при поступлении имели распространенность опухолевого процесса на уровне T2N0M0 (182(54,3%)).
Распределение пациентов всех групп по возрасту представлено в таблице 3.
Таблица 3.
Распределение пациентов Рпж по возрасту в зависимости
от видов лечения
| Возраст больных | Группы | |||||||
| I | II | III | IV | |||||
| абс. | % | абс. | % | абс. | % | абс. | % | |
| 40-49 | 3 | 4,1 | 0 | 0 | 0 | 0 | 1 | 2,4 |
| 50-59 | 29 | 39,2 | 6 | 7,9 | 3 | 4,8 | 4 | 9,5 |
| 60-69 | 30 | 40,5 | 31 | 40,8 | 34 | 54,8 | 18 | 42,9 |
| 70 и старше | 12 | 16,2 | 39 | 51,3 | 25 | 40,3 | 19 | 45,2 |
| Всего | 74 | 100 | 76 | 100 | 62 | 100 | 42 | 100 |
Как следует из данных, приведенных в таблице, наибольшее количество пациентов 208 ( 81,8 %) находились в возрасте 60 лет и старше.
При оценке нарушения общего состояния пациентов по шкале Карнов-ского выявлено, что все группы были сходными по этому показателю и, что большинство пациентов (98,8 %) имели нарушения на уровне 100-80 %, то есть являлись физически активными, способными к самообслуживанию, зачастую продолжающими активную трудовую деятельность (таблица 4.). Эти данные говорят об особой важности для таких больных вопроса сохранения качества жизни во время и после лечения.
Таблица 4.
Распределение пациентов по степени нарушения общего состояния (по шкале Карновского) в зависимости от проведенного лечения
| Степень субъективного состояния | Группы пациентов | Итого | ||||||||
| I | II | III | IV | |||||||
| абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | |
| 100% | 39 | 52,7 | 39 | 51,3 | 34 | 54,8 | 36 | 85,7 | 148 | 58,3 |
| 90% | 32 | 43,2 | 34 | 44,7 | 21 | 33,9 | 5 | 11,9 | 92 | 36,2 |
| 80% | 3 | 4,1 | 2 | 2,6 | 5 | 8,1 | 1 | 2,4 | 11 | 4,3 |
| 70% | 0 | 0,0 | 1 | 1,3 | 2 | 3,2 | 0 | 0,0 | 3 | 1,2 |
| 60% | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
Распределение пациентов в группах в зависимости от морфологического строения опухоли предстательной железы представлено в таблице 5. Пациенты, включенные в исследование имели опухоль, представляющую собой какую-либо разновидность аденокарциномы, чаще всего типичную ацинарную аденокарциному.
Таблица 5.
Распределение пациентов по группам в зависимости от морфологического строения опухоли
| Тип опухоли | Группы пациентов | Итого | ||||||||
| I | II | III | IV | |||||||
| абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | |
| ацинарная аденокарцинома | 69 | 93,2 | 68 | 89,5 | 57 | 91,9 | 38 | 90,5 | 232 | 91,3 |
| эндометриоидный рак | 2 | 2,7 | 3 | 3,9 | 2 | 3,2 | 2 | 4,8 | 9 | 3,5 |
| крибриформный рак | 1 | 1,4 | 0 | 0,0 | 1 | 1,6 | 0 | 0,0 | 2 | 0,8 |
| папиллярный рак | 1 | 1,4 | 2 | 2,6 | 0 | 0,0 | 2 | 4,8 | 5 | 2,0 |
| муцинозный рак | 1 | 1,4 | 3 | 3,9 | 2 | 3,2 | 0 | 0,0 | 6 | 2,4 |
В ходе морфологического исследования биопсийного материала также производилась оценка степени дифференцировки опухолевых клеток. Наиболее часто встречались умеренно-дифференцированные опухоли (70,9 %). Распределение пациентов в зависимости от указанного параметра представлено в таблице 6.
Таблица 6.
Распределение пациентов по группам в зависимости от степени дифференцировки опухоли
| Степень дифференцировки опухоли | Балл по Gleason | Группы пациентов | Итого | ||||||||
| I | II | III | IV | ||||||||
| абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | ||
| высокодифференцированная | менее 4 | 12 | 16,2 | 13 | 17,1 | 8 | 12,9 | 7 | 16,7 | 40 | 15,7 |
| умеренно-диференцированная | от 5 до 7 | 48 | 64,9 | 52 | 68,4 | 47 | 75,8 | 33 | 78,6 | 180 | 70,9 |
| низкодифференцированная | более 7 | 14 | 18,9 | 11 | 14,5 | 7 | 11,3 | 2 | 4,8 | 34 | 13,4 |
По данным ТРУЗИ у 121 (47,6 %) больных РПЖ сочетался с доброкачественной гиперплазией предстательной железы, у 29 (11,4%) — с хроническим простатитом, у 53 (20,9 %) — с ДГПЖ и хроническим простатитом.
С целью уменьшения размеров опухоли предстательной железы, снижения ее митотической активности, уменьшения вероятности манифестации опухолевого процесса всем пациентам в исследуемых группах до применения методов радикального лечения было начато проведение гормональной терапии.
Неоадъювантная гормональная терапия проводилась в среднем в течение 3 месяцев по следующим основным режимам (режимы А и В представляют собой режимы максимальной андрогенной блокады (МАБ):
Режим A - комбинация медикаментозной кастрации (синтетический агонист ЛГРГ гозерелин ("Золадекс") и нестероидного антиандрогена. Золадекс назначался подкожно (в среднюю часть брюшной стенки) по 1 капсуле-депо, содержащую 3,6 мг гозерелина ацетата каждые 28 дней. В качестве антиандрогена применялся флуцином (флутамид), который назначался внутрьпосле еды по 250 мг 3 раза в день с интервалом 6-8 ч (800 -1600 -2200).
Режим B - комбинация хирургической кастрации и нестероидного ан-тиандрогена. На первом этапе выполнялась орхидэктомия, затем назначался флуцином (флутамид) внутрь после еды по 250 мг 3 раза в день с интервалом 6-8ч(800-1600-2200).
Режим C - прием нестероидного антиандрогена флуцином (флутамид) который назначался внутрь после еды по 250 мг 3 раза в день с интервалом 6-8ч(800-1600-2200).
Количественное распределение пациентов в группах в зависимости от режимов проводимой неоадъювантной гормональной терапии приведены в таблице 7.
Таблица 7.
Распределение пациентов по группам в зависимости от режима
неоадъювантной гормональной терапии
| Режим гормональной терапии | Группы | Итого | ||||||||
| I | II | III | IV | |||||||
| абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | |
| А | 54 | 73,0 | 57 | 75,0 | 49 | 79,0 | 37 | 88,1 | 197 | 77,6 |
| В | 15 | 20,3 | 12 | 15,8 | 8 | 12,9 | 3 | 7,1 | 38 | 15,0 |
| С | 5 | 6,8 | 7 | 9,2 | 5 | 8,1 | 2 | 4,8 | 19 | 7,5 |
Назначение того или иного курса гормональной терапии определялось общим состоянием больного, наличием сопутствующих заболеваний, отношением пациента к предлагаемому лечению.
Радикальная простатвезикулэктомия проводилась по общепринятой методике.
методика проведения дистанционной лучевой терапии.
В зависимости от стадии РПЖ нами использовались следующие варианты ДЛТ. При недиссеминированных формах РПЖ лучевое воздействие выполнялось в два этапа. На первом этапе проводилась так называемая локо-региональная ЛТ, когда через 6 полей 0° (размер поля 13-16 см), 90° (размер поля 10-15 см), 150° (размер поля 4-6 см), 180° (размер поля 13-16 см), 210° (размер поля 4-6 см), 270° (размер поля 10-15 см) облучались предстательная железа и зоны регионального метастазирования с границами: верхняя - уровень L5-S1, нижняя - нижний край седалищных бугров. В режиме обычного фракционирования с РОД 2 Гр ежедневно, 5 раз в неделю, СОД доводилась до 44-46 Гр.
На втором этапе осуществлялось облучение только предстательной железы (локальная ЛТ) в статическом режиме с 4 полей как правило под углами 40°-50°, 320°-310°, 260°-250°, 100°-110°. Размеры полей соответствовали размерам предстательной железы. Облучение проводилось в режиме обычного фракционирования с РОД 2 Гр ежедневно, 5 раз в неделю, СОД доводилась до 70 Гр.
Кроме того, всем пациентам данной группы была проведена неоадью-вантная гормонотерапия в режиме МАБ - 64 пациентам (84,2%) и в режиме монотерапии - 12 пациентам (15,8%). Сроки гормональной терапии варьировали от 3 месяцев до 18 месяцев в зависимости от ответа пациента на данную терапию и возможности проведения лучевой терапии.
В своей работе мы использовали классификацию нежелательных последствий лучевого лечения оценивали на основании стандартной шкалы RTOG/EORTC.
Все постлучевые осложнения разделены на ранние, возникающие непосредственно в момент или сразу же после окончания лечения, и поздние, которые появляются через 3 и более месяцев после окончания лучевой терапии.
методика проведения дистанционной протонно-фотонной терапии.
Разработанная методика предназначена для использования у больных раком предстательной железы T1-3N0-1M0 стадий с исходным уровнем PSA не выше 50 нг/мл и индексом Глисона не более 8.
Предлучевая КТ-топометрия проводилась в условиях внутривенного контрастирования мочевого пузыря (за 30 мин до исследования). После введения ректального маркера-эндостата в прямую кишку пациента и фиксации его в положении «лежа на спине» изготавливалась серия КТ-сканов от уровня ануса до нижней границы крестцово-подвздошного сочленения с шагом 4 мм, и с последующей реконструкцией изображения в сагиттальной и фронтальной плоскостях.
Облучаемый объем маркировался, отступая от границ мишени в зоне прямой кишки, на 5 мм, а на остальном протяжении - на 10 мм. Одновременно в сагиттальной плоскости определялся геометрический центр облучаемого объема и его расположение относительно ректального маркера-эндостата. Устанавливались параметры противолежащих боковых фигурных полей облучения, формировавшихся при реализации процедур с помощью индивидуальных коллиматоров из легкоплавких материалов.
Расчет очаговой дозы производили по центральному и 4-5 дополнительным поперечным сканам. Энергия протонного пучка составляла 220-230 Мэв, а для модификации дозного распределения использовали водный поглотитель переменного объема. Негомогенность дозы в мишени при этом, как правило, не превышала 5%.
Для расчета эквивалентных доз использовали линейно-квадратичную модель в модификации H.Withers с соавт. (7), без учета общего времени облучения. Соотношение / для опухоли простаты считали равным 3,5 Гр, независимо от степени ее злокачественности. ОБЭ протонов принимали за 1,1.
Перед каждым сеансом протонного облучения пациента с введенным в прямую кишку маркером-эндостатом фиксировали на процедурном столе с помощью сетки из термопластического материала, а затем выполняли рентгеновскую центрацию терапевтического пучка.
При фотонном облучении предстательной железы или всего объема малого таза (ДГТ или тормозным излучением 6 Мэв) использовались стандартные 4-6-ти-польные технологии подведения дозы ионизирующего излучения.
Фотонное облучение всего объема малого таза проводилось до суммарной очаговой дозы 44 Гр за 22 ежедневных фракции. При последующей локальной протонотерапии суммарная очаговая доза 22,4 Гр подводилась на простату за 8 ежедневных фракций по 2,8 Гр, что (при ОБЭ-1,1 и / - 3,5Гр) соответствует 28,4 Гр-экв., а с учетом фотонной компоненты - 72,4 Гр-экв. Лечение проводилось в режиме расщепленного курса, с 2-х недельным перерывом после СОД 24 Гр. Объем облучаемых тканей у больных благоприятной прогностической группы (T1-2N0M0, с исходным уровнем PSA 10 нг/мл. и индексом Глисона 6) при фотонотерапии ограничивался предстательной железой и семенными пузырьками, а уровень очаговых доз оставался неизменным.
методика проведения брахитерапии.
Брахитерапия проводилась с использованием системы 125I Rapid-Strand фирмы BK Medical. Планирование оптимального расположения радиоактивных источников внутри простаты на основании изображения, полученного с помощью УЗИ, выполнялось с помощью специального программного обеспечения, в которое вводились контуры простаты, прямой кишки и уретры. Результатом планирования являлся план имплантации радиоактивных микроисточников, который обеспечивал подведение необходимой дозы в поражённый участок простаты и в то же время не допускал избыточного облучения уретры и прямой кишки.
Датчик для брахитерапии вводился в прямую кишку и фиксировался с помощью специального устройства для стабилизации и пошагового позиционирования. Позиционирование игл осуществлялось с помощью шаблона, на котором расположены отверстия с шагом 5 мм. Имплантация микроисточников проводилась под эпидуральной анестезией в положении пациента на спине, с запрокинутыми и фиксированными ногами, с помощью закрытого чрезпромежностного доступа и длилось от 40 мин до 2 часов в зависимости от объема предстательной железы и анатомических особенностей пациента. Микроисточники содержали радионуклиды 125I, период полураспада которого составлял 59,4 дня. Длина пробега частиц в ткани составляла 5 мм. Микроисточники были фиксированы на жесткой полимерной нити и в количестве 60-200 штук, имплантировались в ткань предстательной железы через специальные иглы-троакары. Контроль положения игл внутри простаты осуществляется с помощью УЗИ-изображения. Оценка после имплантации осуществляется с помощью УЗИ или рентгеновского изображения (источники содержат в себе рентгеноконтрастную вставку). Контроль клинической эффективности осуществлялся с помощью определения уровня ПСА в динамике.
методика учета и статистической обработки результатов исследований.
Учет главного критерия эффективности лечения в онкологии - выживаемости больных - проводился с помощью интервального метода путем построения таблиц дожития «Life Table», рекомендованных Международным противораковым союзом (UICC) и Всемирной организацией здравоохранения, а также с помощью программы PARADOX по методу Kaplan-Mayer. Для оценки достоверности полученных результатов производилось статистическое исследование с использованием критерия Стьюдента на компьютере ABM РС с использованием программ Microsoft Exel, SPSS 9,0 и StatSoft STATISTICA 6,0. Уровень безошибочного суждения был принят равным 95%, что соответствует требованиям, предъявляемым к статистическим исследованиям биологических систем.
Результаты лечения пациентов методом радикальной простатэктомии.

Средний возраст пациентов данной группы составил 61,5±0,4 года и колебался от 42 до 75 лет. Средняя продолжительность послеоперационного койко-дня равнялась 10,2±0,2 сут. (от 7 до 18 суток). В послеоперационном периоде продолжительность наблюдения за больными была от 9 до 84 месяцев (53,2±1,5 мес.). Клиническая стадия опухоли простаты T1 была диагностирована у 13 человек (17,6%), T2 - у 49 (66,2%) и Т3 - у 12 (16,2%) больных (рисунок 1).
Рис. 1. Распределение больных в зависимости от группы риска.
Мы изучили распределение больных в зависимости от группы риска развития рецидива, таким образом в группу низкого риска (Т1-2,N0, индекс Глиссона<6, ПСА<10 нг/мл) вошли 23 пациента, в группу среднего риска (Т1-3, N0, индекс Глиссона-6-7, ПСА от 10 до 30 нг/мл) 27 пациентов и в группу высокого риска (Т1-4, N0-1, индекс Глиссона > 7, ПСА > 30 нг/мл) 23 пациента.
Среди сопутствующих заболеваний органов мочевой системы у 3 (4,0%) больных выявлены солитарные кисты почек, у 7 (9,4%) больных камни почек и/или мочевого пузыря, дивертикулы мочевого пузыря - у 2 (2,7%) больных. У 11 (14,8%) больного диагностирована сопутствующая кардиологическая патология, у 5 (6,7%) больных - легочная патология, у 6 (8,1%) - сахарный диабет I типа.
Интраоперационной и ранней послеоперационной летальности в наших наблюдении не было. Наиболее частым интраоперационным осложнением позадилонной РПЭ в нашем исследовании было значительное по объему и скорости кровотечение, которое наблюдалось у 7 (8,8%) больных. Основным источником кровотечения являлись вены дорсального венозного комплекса. Средняя степень кровопотери во время операции во всей группе составила 1327±794 мл. Частота развития кровотечения и степень кровопотери достоверно снижались при накоплении опыта выполнения операций. Средняя степень кровопотери во время последних 32 операций уменьшилась на 48,3% (842±404 мл) по сравнению с первыми 20 вмешательствами (1630±679 мл). Общая частота осложнений раннего послеоперационного периода составила 18.4%, во всех случаях осложнения купированы консервативно.
Наиболее тяжелым поздним послеоперационным осложнением является стриктура уретры (везико-уретрального анастомоза), которая наблюдалась у 7 (9,5%) больных. Развитие стриктуры мочеиспускательного канала приводило к повышению риска инконтиненции, недержание мочи развилось у 4 больных со стриктурами. Недержание мочи диагностировано у 12 (16,2%) больных, из них у 10 (80%) отмечено недержание легкой и умеренной степени тяжести и у 2 (20%) - тотальная инконтиненция.
Отдаленные результаты операции.
Общая, опухоль-специфичная выживаемость и смертность.
За время наблюдения в группе хирургического лечения умерли 4 человека: 3 - от генерализации РПЖ, 1 - от причин, не связанных с РПЖ. Общая выживаемость больных за время наблюдения составила 94,5±2,3%, опухоль-специфичная выживаемость - 97,2±2,4%. Общая 5-летняя выживаемость больных, рассчитанная по методу Каплана-Мейера, составила 95±2,1%, 7-летняя - 91±2,6%. 5-летняя опухоль-специфичная выживаемость больных, рассчитанная по методу Каплана-Мейера, составила 95±2,3%, 7 - летняя выживаемость - 93±2,8% (рисунок 2)

Рис. 2. Общая выживаемость пациентов группы хирургического лечения.
Показатель смертности за время наблюдения составил 5,4%, смертности от РПЖ - 4%. От прогрессирования РПЖ умерли 3 больных через 35, 45 и 68 месяцев после РПЭ. Еще 1 больной умер через 55 месяцев после проведенного лечения от острого инфаркта миокарда (рисунок 3).

Рис. 3. Опухоль-специфичная выживаемость в группе
хирургического лечения.
5-летняя выживаемость без признаков клинического прогрессирова-ния, рассчитанная по методу Каплана-Мейера, составила 92±0,03%, 7-летняя - 89±0,04% (рисунок 4).

Рис. 4. Общая безрецидивная выживаемость в группе хирургического
лечения.
Клиническое прогрессирование РПЖ за время наблюдения выявлено у 5 (6,7%) больных: у 2 (2,7%) диагностирован местный рецидив (подтвержден морфологически), у 3 (4,0%) - генерализация РПЖ. Время до развития объективного прогрессирования заболевания составляло 12 - 68 месяцев, средний период - 32,9±16,6 месяцев, медиана безрецидивного течения - 32,5 месяца, интерквартальный размах - 21-36 месяцев. У 4 пациентов развитию клинического прогрессирования РПЖ предшествовал биохимический рецидив заболевания, у 1 больного при диагностике ПСА-рецидива в то же время при биопсии зоны везико-уретрального анастомоза выявлен местный рецидив. Время развития биохимического прогрессирования заболевания составляло 3-68 месяцев, средний период - 21,7±19.5 месяцев, медиана безрецидивного периода -16.5 месяцев. Таким образом, медиана времени до развития клинического прогрессирования болезни почти в 2 раза превышала медиану рецидивного периода до биохимического рецидива у данных больных. Период от регистрации повышения уровня ПСА до выявления местного рецидива или отдаленных метастазов в среднем составлял 16 мес.
Большинство биохимических рецидивов зарегистрировано в течение первых 2 лет после РПЭ, показатель 2-летней безрецидивной выживаемости составляет 74,3±3,6%, 3-летней - 70,2±4%. Было установлено, что в течение первого года наблюдения выявлено 70% всех рецидивов, через 24 месяца -84% и через 36 месяцев - 93%. Таким образом, после 3 лет наблюдения биохимический рецидив РПЖ диагностирован только у 7% больных с развившимся прогрессированием опухолевого процесса.
Длительность периода безрецидивного течения у больных с развившимся прогрессированием процесса составляла 3-68 месяцев, медиана безрецидивной выживаемости - 9 месяцев. У 50% больных прогрессирование заболевания выявлено в течение первых 9 месяцев наблюдения после РПЭ.
В общем, из 74 больных группы хирургического лечения безрецидивное течение за время наблюдения отмечено у 52 (70,3%) больных, рецидивы РПЖ выявлены у 22 (29,7%) пациентов: биохимическое прогрессирование - у 17 (22,9%), клиническое прогрессирование - у 5 (6,8 %).
Предоперационный уровень ПСА являлся независимым фактором прогноза безрецидивной выживаемости больных после РПЭ. При уровне ПСА менее 4 нг/мл рецидива заболевания не выявлено ни у одного больного. У больных с концентрацией ПСА менее 20 нг/мл 5-летняя безрецидивная выживаемость составляет 75%, при уровне ПСА более 20 нг/мл 35%. 5-летняя безрецидивная выживаемость больных с предоперационными признаками локализованного РПЖ оказалась на 36% выше, чем у пациентов с признаками экстракапсулярного процесса.
5-летняя безрецидивная выживаемость больных с патоморфологиче-ски локализованными (по данным послеоперационного гистологического исследования) опухолями составила 85±3,7%, с экстракапсулярной инвазией опухоли - 53±14,3%. Степень дифференцировки опухоли являлась сильным прогностическим признаком для оценки безрецидивной выживаемости больных. Наличие метастазов в тазовых лимфатических узлах наиболее сильно влияло на безрецидивную выживаемость больных после РПЭ. Различия в 5-летней безрецидивной выживаемости больных с метастазами в ЛУ и без них составили 61%. Вероятность развития прогрессирования РПЖ у пациентов с количеством удаленных ЛУ более 15 на 24% меньше, чем у больных с числом удаленных узлов < 15. Метастазы в лимфатических узлах и сумма Глисона оказались прогностическими послеоперационными факторами, достоверно влияющими на безрецидивную выживаемость больных.
Результаты лечения пациентов методом дистанционной фотонной лучевой терапии.
Средний возраст 76 пациентов данной группы составил 70±6 лет и колебался от 55 до 78 лет. В послеоперационном периоде продолжительность наблюдения за больными была от 12 до 90 месяцев (60,2±1,5 мес.). Клиническая стадия опухоли простаты T1 была диагностирована у 12 человек (15%), T2 - у 34 (45%) и Т3 - у 30 (40%) больных.
Мы изучили распределение больных в зависимости от группы риска развития рецидива. В группу низкого риска (Т1-2N0, индекс Глиссона < 6, ПСА < 10 нг/мл) вошли 4 пациента, в группу среднего риска (Т1-3N0, индекс Глиссона-6-7, ПСА от 10 до 30 нг/мл) 44 пациента и в группу высокого риска (Т1-4, N0-1, индекс Глиссона > 7, ПСА > 30 нг/мл) 28 пациентов (рисунок 5).
Среди сопутствующих заболеваний органов мочевой системы у 2 (2,6%) больных выявлены солитарные кисты почек, у 10 (13,15%) больных камни почек и/или мочевого пузыря, дивертикулы мочевого пузыря - у 1 (1,3%) больного. У 25 (33%) больных диагностирована сопутствующая кардиологическая патология, у 9 (11,6%) больных -заболевания легких, у 6 (7,8%) - сахарный диабет I типа.

Рис. 5. Распределение больных в группе фотонной терапии
в зависимости от степени риска.
В проведенном исследовании у 74 (97%) пациентов были отмечены осложнения после курса дистанционного лучевого лечения. Основными видами осложнений явились цистит, ректит, энтероколит и их сочетания.
Изолированные лучевые поражения мочевого пузыря или прямой кишки были у 11 пациентов (14,5%), сочетание осложнений - отмечено у 63 пациентов (83%). Развитие цистита 1 степени было отмечено у 41 пациента (54%), 2 степени у 19 пациентов(25%). Различие по степени ректита и количеству пациентов составило соответственно - 27,6% и 64,5%. В целом можно сделать вывод о более тяжелом течении ректита после ДЛТ по сравнению с циститом. Нами была выявлена слабая корреляция между СОД излучения и вероятностью развития острого цистита и энтероколита и сильная корреляция между объемом облучаемых тканей и развитием энтероколита.
Поздние постлучевые осложнения выявлены у 51 (67,1%) пациента. Хронический постлучевой цистит развился у 21 (27,6%) больных, из них у 18 (85,7%) наблюдались явления 1 степени тяжести, у 3 (14,3%) - 2 степени. Хронический постлучевой ректит диагностирован у 49 (64,4%) больных, из них у 44 (89%) - 1 степени токсичности, у 5 (11%) - 2 степени. У 10 (13.2%) больных выявляли язву прямой кишки. Стриктура уретры развилась у 10 (13.2%) больных, недержание мочи тяжелой степени - у 3 (4 %) пациентов.
Отдаленные результаты фотонной лучевой терапии.
Общая, опухоль-специфичная выживаемость и смертность
За время наблюдения в группе ДЛТ (дистанционной лучевой терапии) умерли 24 человека: 8 - от генерализации РПЖ, 18 - от причин, не связанных с РПЖ. Общая выживаемость больных за время наблюдения составила 43,6±9,7%, опухоль-специфичная выживаемость - 72,1± 10,2%. Общая 5-летняя выживаемость больных, рассчитанная по методу Каплана-Мейера, составила 43,6±9,7% (рисунок 6). 5-летняя опухоль-специфичная выживаемость больных, рассчитанная по методу Каплана-Мейера, составила 72,1± 10,2% (рисунок 7). В данной группе был отмечен крайне высокий уровень смертности от причин не связанных с прогрессированием РПЖ, таким образом, от других причин за время наблюдения умерло 18 человек. Основными причинами смерти стали острый инфаркт миокарда (77,7%), острое нарушение мозгового кровообращения (16,6%), несчастный случай (5,56%). Столь высокие значения данного показателя мы связываем с пожилым возрастом пациентов (статистически значимо большем в сравнении со средним возрастом пациентов первой группы) и большим количеством сопутствующей патологии.

Рис. 6. Общая выживаемость в группе фотонной терапии.
Показатель смертности за время наблюдения составил 31,5%, смертности от РПЖ -10,5%. От прогрессирования РПЖ умерли 8 больных через 8, 9, 10, 15,23, 25 и 50 и 51 месяц после начала ДЛТ.
Рис. 7. Опухоль-специфичная выживаемость
в группе фотонной терапии.
Общая выживаемость больных без признаков клинического прогрес-сирования за время наблюдения составила 81±5,3%, 5-летняя выживаемость без признаков клинического прогрессирования, рассчитанная по методу Каплана-Мейера, составила также 81±5,3% (рис. 8).
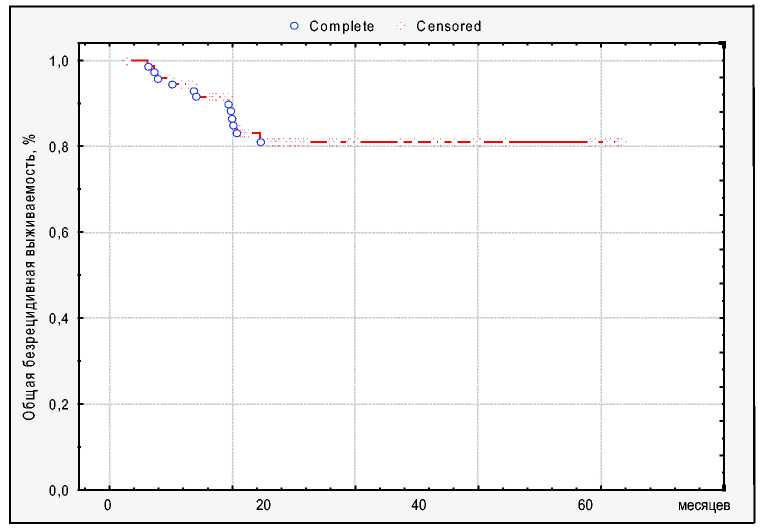
Рис. 8. Общая безрецидивная выживаемость в
группе фотонной терапии.
Клиническое прогрессирование РПЖ за время наблюдения выявлено у 12 (15,7%) больных: у 4 (5,2%) диагностирован местный рецидив (подтвержден морфологически), у 8 (10,5%) - генерализация РПЖ. Время до развития объективного прогрессирования заболевания составляло 4-22 месяцев, средний период - 12,7±5,2 месяцев, медиана безрецидивного течения - 14 месяцев. При сравнении данного показатели со значениями первой группы было выявлено значительно более раннее возникновение рецидива (р< 0,05). У 9 пациентов развитию клинического прогрессирования РПЖ предшествовал биохимический рецидив заболевания. Время развития биохимического прогрессирования заболевания составляло 2-18 месяцев, средний период -8,6±2,7 месяцев, медиана безрецидивного периода - 10 месяцев. Таким образом, медиана времени до развития клинического прогрессирования болезни почти в 1,5 раза превышала медиану рецидивного периода до биохимического рецидива у данных больных. Период от регистрации повышения уровня ПСА до выявления местного рецидива или отдаленных метастазов в среднем составил 3 мес.
В общем, из 76 больных этой группы безрецидивное течение за время наблюдения отмечено у 64 (84,2%) больных, рецидивы РПЖ выявлены у 12 (15,7%) пациентов, биохимическое прогрессирование - у 12 (15,9%).
Инициальный ПСА являлся фактором прогноза безрецидивной выживаемости больных после фотонной лучевой терапии. У больных с концентрацией ПСА менее 20 нг/мл 5-летняя безрецидивная выживаемость составляет 85%, при уровне ПСА более 20 нг/мл 67%. 5-летняя безрецидивная выживаемость больных с предоперационными признаками локализованного РПЖ оказалась на 22% выше, чем у пациентов с признаками экстракапсулярного процесса.
Степень дифференцировки опухоли также являлась сильным прогностическим признаком для оценки безрецидивной выживаемости больных.
Тем не менее, наиболее достоверным фактором прогрессирования опухоли в данном исследовании явились группы риска, которые учитывают следующие показатели ИГ, уровень ПСА, стадию заболевания. У пациентов с первой группой риска рецидивов не было отмечено за все время наблюдения, у пациентов со второй группой 5-летняя выживаемость составила 97,4±2,4%, у пациентов 3 группы - 47,6±9,3%. Все различия полученные при анализе данного показателя явились статистически значимыми.
Результаты лечения пациентов методом дистанционной протонно-фотонной терапии.
Средний возраст всех 62 пациентов данной группы составил 67,3±6,1 лет и колебался от 48 до 74 лет. В послеоперационном периоде продолжительность наблюдения за больными была от 9 до 56 месяцев (30,2±15,2 мес.). Клиническая стадия опухоли простаты T1 была диагностирована у 6 человек (9,6%), T2 - у 31 (50%) и Т3 - у 25 (40,3%) больных.
Мы изучили распределение больных в зависимости от группы риска развития рецидива, таким образом в группу низкого риска (Т1-2, N0, индекс Глиссона<6, ПСА<10 нг/мл) вошли 3 пациента, в группу среднего риска (Т1-3, N0, индекс Глиссона-6-7, ПСА от 10 до 30 нг/мл) 34 пациента и в группу высокого риска (Т1-4, N0-1, индекс Глиссона > 7, ПСА > 30 нг/мл) 25 пациентов (рисунок 9).

Рис. 9. Распределение больных в группе протонно-фотонной
терапии в зависимости от степени риска.
Среди сопутствующих заболеваний органов мочевой системы у 1 (1,6%) больного выявлены солитарные кисты почек, у 10 (16,2%) больных камни почек и/или мочевого пузыря, дивертикулы мочевого пузыря - у 1 (1,6%) больного. У 21 (33,8%) больных диагностирована сопутствующая кардиологическая патология, у 9 (14,5%) больных - легочная, у 6 (9,6%) - сахарный диабет I типа.
В ходе исследования установлено, что у 48 (77,4%) пациентов были отмечены осложнения после курса ДПФТ.
Основными видами осложнений явились цистит, ректит, энтероколит и их возможные сочетания.
Изолированные лучевые поражения мочевого пузыря или прямой кишки были у 40 пациентов (64,5%), сочетание осложнений отмечено у 8 пациентов (12,9%). Развитие цистита 1 степени отмечено у 31 пациента (50%), 2 степени - у 19 пациентов (30,6%), различие по степени ректита и количеству пациентов составило соответственно 27,6% и 64,5%. В целом можно сделать вывод о более тяжелом течении ректита после ПФТ по сравнению с циститом. Нами была выявлена слабая корреляция между СОД излучения и вероятностью развития острого цистита и энтероколита и сильная корреляция между объемом облучаемых тканей и развитием энтероколита.
Поздние постлучевые осложнения выявлены у 28 (45,2%) пациентов. Хронический постлучевой цистит развился у 11 (17,7%) больных, из них у 9 (82%) наблюдались явления 1 степени тяжести, у 2 (18 %) - 2 степени. Хронический постлучевой ректит диагностирован у 17 (27,4%) больных, из них у 15 (88,2%) -1 степени, у 2 (11,7%) - 2 степени. У 7 (11,2%) больных выявляли язву прямой кишки. Стриктура уретры развилась у 2 (3,2%) больных, недержание мочи тяжелой степени - у 3 (4,8 %) пациентов.
Отдаленные результаты протонно-фотонной терапии.
Общая, опухоль-специфичная выживаемость и смертность.
За время наблюдения в группе ДПФТ (дистанционной протонно-фотонной лучевой терапии) умерли 11 человека: 5 - от генерализации РПЖ, 6 - от причин, не связанных с РПЖ. Общая выживаемость больных за время наблюдения составила 65,7±7,6%, опухоль-специфичная выживаемость -75,7±5,6%. Общая 5-летняя выживаемость больных, рассчитанная по методу Каплана-Мейера, составила 65,7%. 5-летняя опухоль-специфичная выживаемость больных, рассчитанная по методу Каплана-Мейера, составила 75,7%. В данной группе не было отмечено такого высокого уровня смертности от причин не связанных с прогрессированием РПЖ, как в группе ДЛТ, что связано с более молодым возрастом пациентов данной группы. Основными причинами смерти, не связанной с РПЖ, стали острый инфаркт миокарда (66,7%), острое нарушение мозгового кровообращения (16,7%), несчастный случай (1,67%).
Показатель смертности за время наблюдения составил 17,7%, смертности от РПЖ - 8,1%. От прогрессирования РПЖ умерли 5 больных через 14, 27, 32,41 и 42 месяца после начала ДПФТ. Общая выживаемость больных без признаков клинического прогрессирования за время наблюдения составила 63,7%, 5-летняя выживаемость без признаков клинического прогрессирования, рассчитанная по методу Каплана-Мейера, составила также 63,7%.
Клиническое прогрессирование РПЖ за время наблюдения выявлено у 13 (20,1%) больных: у 5 (8,1%) диагностирован местный рецидив (подтвержден морфологически), у 8 (12,9%) - генерализация РПЖ. Время до развития объективного прогрессирования заболевания составляло 4-32 месяцев, средний период- 20,1 ± 5,2 месяцев, медиана безрецидивного течения - 21 месяцев. У 9 пациентов развитию клинического прогрессирования РПЖ предшествовал биохимический рецидив заболевания. Время развития биохимического прогрессирования заболевания составляло 2-18 месяцев, средний период - 10,6±2,7 месяцев, медиана безрецидивного периода - 11 месяцев. Таким образом, медиана времени до развития клинического прогрессирования болезни почти в 2 раза превышала медиану рецидивного периода до биохимического рецидива у данных больных. Период от регистрации повышения уровня ПСА до выявления местного рецидива или отдаленных метастазов в среднем составлял 3 мес.
В общем, из 62 больных группы ДПФТ безрецидивное течение за время наблюдения отмечено у 49 (79%) больных, рецидивы РПЖ выявлены у 13 (20,1%) пациентов, биохимическое прогрессирование - у 9 (14,5%).
Инициальный уровень ПСА не всегда являлся точным фактором прогноза безрецидивной выживаемости больных после дистанционной протонно-фотонной терапии. Наиболее достоверные различия были получены при сравнении показателей у пациентов с уровнем ПСА большим или меньшим 20 нг/ мл. У больных с концентрацией ПСА менее 20 нг/мл 5-летняя безрецидивная выживаемость составляет 81%, при уровне ПСА более 20 нг/мл 63,1%.
5-летняя безрецидивная выживаемость больных с признаками локализованного РПЖ оказалась на 22% выше, чем у пациентов с признаками экстракапсулярного процесса. Степень дифференцировки опухоли также являлась сильным прогностическим признаком для оценки безрецидивной выживаемости больных. 5-летняя безрецидивная выживаемость у пациентов с высокодифференцированными (2-4 балла) и низкодифференцированными (7 баллов и 8-10 баллов) опухолями различались в 3 раза.
Тем не менее, наиболее достоверным фактором прогрессирования опухоли в данном исследовании, как и в предыдущей группе, явилась оценка степени риска, которая учитывает следующие показатели ИГ, уровень ПСА, стадию заболевания. У пациентов с первой группой риска рецидивов не было отмечено за все время наблюдения, у пациентов второй группы 5-летняя выживаемость составила 97,4±2,3%, у пациентов 3 группы - 47,6±9,8%. Все различия полученные при анализе данного показателя явились статистически значимыми.
Кроме того, нами были изучены прогностическая значимость различных факторов для определения опухоль-специфичной выживаемости. Для таких показателей как уровень ПСА и стадия опухолевого процесса статистически значимых зависимостей не было выявлено. При изучении различий у пациентов по ИГ было установлено, что опухоль-специфичная выживаемость пациентов с ИГ >8 составила 0%, тогда как при ИГ< 8 этот показатель составил 92,5%. При оценке значимости групп риска было установлено, что опухоль-специфичная выживаемость у пациентов с первой группой риска составила 100%, тогда как с 3 - 0%.
Таким образом, определение группы риска является наиболее эффективным инструментом прогноза как опухоль-специфичной так и безрецидивной выживаемости пациентов с РПЖ при применении протонно-фотонной лучевой терапии.
Результаты лечения пациентов методом брахитерапии.
В исследование включены истории болезней 123 пациентов с диагностированным локализованным и местнораспространенным раком предстательной железы (РПЖ). Возраст больных колебался от 50 до 79 лет (средний возраст 67,3±6,5 года): до 60 лет- 50 человек (40,6%), от 61 до 70 лет- 60 человек (48,8%) и старше 70 лет-13 человек (10,6%).
По прогнозу заболевания пациенты были разделены на 3 группы. В первую группу вошли больные локализованным раком предстательной
железы с благоприятным прогнозом: стадия Т1-Т2в, ПСА менее 10 нг/мл, оценка по шкале Глисона < 7 (56 человек- 45,5%). Вторую группу составили больные (27 человек- 22%) с промежуточным прогнозом: стадия Т1-Т2с, ПСА 10-20 нг/мл или оценка по шкале Глисона > 7нг/мл. Третью группу составили больные с неблагоприятным прогнозом: стадия Т1-Т3, ПСА > 20нг/мл, оценка по шкале Глисона >7 (40 человек- 32,5%). Характеристика больных по распределению на группы представлена на рисунке 10.

Рис. 10. Распределение больных в группе брахитерапии в
зависимости от степени риска прогрессирования
Как видно из представленных данных, брахитерапия проводилась в большинстве случаев пациентам с хорошим и промежуточным прогнозом (79,6% больных).
В сыворотке крови пациентов обследуемой группы уровень ПСА на исходном этапе находился в пределах от 2,1 до 189,0 нг/мл, среднее значение составило 17,51 нг/мл. В ходе исследования у 52 (42,3%) пациентов были отмечены осложнения после курса брахитерапии РПЖ.
Основными видами осложнений явились простатит, цистит, ректит и их сочетания. При анализе частоты осложнений после проведенной брахитерапии РПЖ мы отметили преобладание более легких форм лучевых реакций. Дизурические явления наблюдались у 45,5%, однако данное состояние пациенты отмечали в течении непродолжительного периода, что не дает нам право относить к следствию влияния радиоактивных частиц, а скорее всего связывать его с непосредственным влиянием на простату во время манипуляции.
Наиболее часто возникающие лучевые реакции во время лечения РПЖ, такие как простатит, цистит и ректит, в данной группе встречались с частотой 40,1%, 4% и 10% соответственно, что ниже, чем при использовании ДЛТ и ПФТ.
Отдаленные результаты брахитерапии.
Общая 5-летняя выживаемость больных в группе брахитерапии составила 82±5,7%, 5-летняя опухоль-специфичная выживаемость больных, рассчитанная по методу Каплана-Мейера, составила 96±3,0%. Из 123 больных группы безрецидивное течение за время наблюдения отмечено у 109 (89%) больных. Клиническое прогрессирование РПЖ за время наблюдения выявлено у 14 (11,3%) больных: у 9 (7,3%) диагностирован местный рецидив (подтвержден морфологически), у 5 (4,1%) - генерализация РПЖ. Общая выживаемость больных без признаков клинического прогрессирования за время наблюдения составила 76%±5,4, 5-летняя выживаемость без признаков клинического прогрессирования, рассчитанная по методу Каплана-Мейера, составила также 76±5,4%.
Предоперационный уровень ПСА в данном случае явился фактором прогноза безрецидивной выживаемости больных после брахитерапии. Наиболее достоверные различия были получены при сравнении показателей у пациентов с уровнем ПСА большим или меньшим 20 нг/мл. У больных с концентрацией ПСА менее 20 нг/мл 5-летняя безрецидивная выживаемость составляет 90±2,3%, при уровне ПСА более 20 нг/мл 69±4,3%. Кроме того, вероятность же развития биохимического рецидива у больных третьей группы с ПСА более 20 нг/мл в 2,9 раза превосходит вероятность его развития у пациентов с уровнем ПСА менее 20 нг/мл. Вероятность того, что мужчина с уровнем ПСА более 20 нг/мл умрет от РПЖ в 6,4 раза выше, чем мужчина с нормальным уровнем ПСА.
Локализованные формы рака ПЖ обеспечивают безрецидивную выживаемость не менее чем у 90±2,8%. Безрецидивная 5-летняя выживаемости пациентов со стадией Т3 составила 75±5,6%. Стадия опухоли в данном случае не являлась прогностически значимым фактором.
Степень дифференцировки опухоли являлась сильным прогностическим признаком для оценки безрецидивной и опухоль-специфичной выживаемости больных. 5-летняя безрецидивная выживаемость больных с ИГ менее 6 составила 81,8±3,4%, ИГ 6-7 - 78,4±5,2%, ИГ более 8 - 50,7±6,1%. Опухоль-специфичная выживаемость у пациентов с ИГ<8 в 1,5 раза меньше, чем у пациентов с ИГ >8. Кроме того, риск смерти от РПЖ у пациента с ИГ более 7 в 4,7 раза больше, чем у пациента в ИГ менее 6.
Тем не менее, как и в предыдущих наблюдениях, наиболее достоверным фактором прогрессирования опухоли в данном исследовании явились группы риска. У пациентов с первой группой риска рецидивов не было отмечено за все время наблюдения, у пациентов со второй группой 5-летняя выживаемость составила 89%, у пациентов 3 группы - 62%. Все различия полученные при анализе данного показателя явились статистически значимыми. Опухоль-специфичная выживаемость у пациентов 2 группы риска составила 87±2,5%, у пациентов с 3 группой риска - 70±3,2%. Согласно нашим расчетам, вероятность смерти от РПЖ у пациентов третьей группы в 27 раз выше, чем у пациентов первой группы, а вероятность возникновения рецидива в 4,1 раза выше.
Таблица 8.
Распределение пациентов с различными видами лечения по видам пятилетней выживаемости (для группы брахитерапии 3-летняя выживаемость).
| Выживаемость | Группа 1 (РПЭ) | Группа 2 (ДЛТ) | Группа 3 (ДПФТ) | Группа4 (БТ) |
| общая | 94,5±2,3 | 43,6±9,7 | 65,7±7,6 | 82,1±12,7 |
| опухоль-специфичная | 97,2±2,4 | 72,1±10,2 | 75,7±5,6 | 96,3±9,2 |
| безрецидивная | 70,2±3,7 | 81±5,3 | 63,7±6,3 | 76,4±19,3 |
Таким образом, мы считаем, что определение группы риска является наиболее оптимальным для прогноза как опухоль-специфичной так и безрецидивной выживаемости пациентов с РПЖ при применении брахитерапии.
В нашем исследовании в группе брахитерапии общая выживаемость больных за время наблюдения составила 82,1±12,7%, опухоль-специфичная выживаемость - 96,3±9,2%. Общая 3-летняя выживаемость больных составила 82±5,7%, 5-летняя опухоль-специфичная выживаемость - 96,3±3,0%. Общая выживаемость больных без признаков клинического прогрессирования за время наблюдения составила 76,4±19,3%, 3-летняя выживаемость без признаков клинического прогрессирования составила также 76,4±19,3%.
Сравнительная оценка результатов лечения в группах.
Общая выживаемость больных достоверно различалась при сравнении 1 группы со второй и третьей (р=0,0013 и р=0,02 соответственно), но при сравнении первой и четвертой групп значимых различий не было выявлено. Тогда как общая выживаемость больных в группах ДЛТ и БТ достоверно различалась (р=0,023). При сравнении риска смерти от любых причин между группами БТ и ДЛТ отмечается увеличение относительного риска смерти в группе ДЛТ на 50%. При сравнении рисков между группами БТ и РПЭ отмечается увеличение риска смерти в группе БТ на 10%. При сравнении группы БТ и ПФТ отмечается увеличение риска смерти в группе ПФТ на 23%. В целом, минимальная общая смертность была отмечена в группе РПЭ и БТ, важно отметить, что первая группа является самой молодой, в отличие от группы БТ (средний возраст 67 лет).
Опухоль-специфичная выживаемость при сравнении всех групп также достоверно различалась между 1 и 2,1 и 3 группами (во всех случаях р<0,005). Различия оказались достоверными между группами БТ и ДЛТ (р=0,0028) и между группами БТ и ПФТ (р=0,0026), но между группами ДЛТ и ПФТ статистически достоверных различий в опухоль-специфичной выживаемости не выявлено (р=0,77), также как и между РПЭ и БТ.
Выживаемость больных без признаков клинического прогрессирования процесса достоверно различалась между группой хирургического лечения и всеми группами лучевого лечения (р<0,001). Частота развития метастатического РПЖ достоверно отличалась в группах ДЛТ и ПФТ (р=0,001, точный критерий Фишера, двусторонний тест), в группах БТ и ПФТ (р<0,001). Мы отметили очень высокий процент безрецидивного течения заболевания в группе ДЛТ, при низких остальных показателях выживаемости (общей и опухоль-специфичной), мы считаем данный показатель неадекватным ввиду высокой смертности в данной группе от сопутствующих заболеваний.
Таким образом, лучшие результаты в плане общей, опухоль-специфичной и безрецидивной выживаемости были получены у пациентов после проведения РПЭ. Однако показания к выполнению данного оперативного вмешательства очень ограничены и выбор пациентов по дооперационным показателям определяет наилучший прогноз в данной группе. Показатели выживаемости в группе БТ не отличались значимо от показателей в группе РПЭ, несмотря на больший возраст больных данной группы и больший процент пациентов с неблагоприятным прогнозом (23% vs 40% в группе РПЭ и БТ соответственно).
Учитывая различия между больными 3 групп по основным характеристикам опухолевого процесса мы провели анализ результатов различных вариантов лечения в зависимости от таких факторов прогноза как клиническая стадия РПЖ, степень дифференцировки опухоли, уровень ПСА и группы риска до начала лечения.
При сравнении выживаемости больных без признаков клинического прогрессирования с различным дооперационным уровнем ПСА закономерностей, отличных от анализа предыдущих данных, не было получено. В группе пациентов с дооперационным уровнем ПСА менее 10 нг/мл лучшие значения безрецидивной выживаемости были получены в группах РПЭ и БТ, между собой они не различались (р=0,7). Статистически значимый уровень безрецидивной выживаемости отмечался в группах ДЛТ и ПРФ, между собой показатели не различались. Такие же различия характерны для пациентов с дооперационным уровнем ПСА от 10 до 20 нг/мл и более 20 нг/мл.
При анализе безрецидивной выживаемости в зависимости от исходной стадии опухоли было выявлено, что практически во всех группах (за исключением ПФТ) при Т1 безрецидивная выживаемость приближалась к 100% и не различалась между РПЭ, БТ и ДЛТ. При стадии опухоли Т2 отмечалось снижение показателей безрецидивной выживаемости, при этом значения у пациентов групп РПЭ, БТ и ДЛТ значимо не различались, в среднем приближаясь к 90%. При оценке данного показателя у пациентов со стадией Т3 важно отметить резкое снижение его в группе РПЭ (30%), что в 2 раза ниже, чем в группах ДЛТ и БТ. Данные различия статистически достоверны. Важно отметить, что стадия РПЖ Т3 не является показанием для проведения радикальной простатэктомии. В данном исследовании стадия Т3 у пациентов после РПЭ явилась послеоперационным диагнозом. Таким образом, можно говорить, что наиболее высокий и стабильный процент безрецидивного течения отмечали у пациентов с различными стадиями опухолевого процесса при применении брахитерапии.
Сравнительный анализ безрецидивной выживаемости пациентов с различной степенью дифференцировки опухоли показал снижение данного показателя при уменьшении степени дифференцировки опухоли. У пациентов с ИГ менее 6 отмечалась высокая безрецидивная выживаемость, особенно в группе РПЭ, что статистически отличалось от всех остальных групп. В этой же группе пациентов отмечалась и наименьшая безрецидивная выживаемость при ИГ более 8. При таком значении ИГ безрецидивная выживаемость была низкая, лучшие показатели были у пациентов после ДЛТ и БТ (52% и 50% соответственно), что оказалось статистически значимо выше, чем в остальных двух группах.
Интегральным показателем всех параметров, получаемых до операции, является группа риска развития рецидива заболевания. В нашем исследовании была подтверждена целесообразность выделения данных групп для определения прогноза заболевания. Безрецидивная выживаемость пациентов с низким риском развития рецидива составила 100% вне зависимости от вида лечения. Безрецидивная выживаемость у пациентов со средним риском прогрессирования в группе протонно-фотонной терапии составила 60,7+11,2%, в группе фотонной терапии 72,1±8,0%, в группе брахитерапии - 79,3±7,4% и в группе простатэктомии - 76±7,1%. Как и следовало ожидать, худшие результаты были получены при анализе безрецидивной выживаемости у пациентов с высоким риском развития рецидива. Наиболее высокие значения безрецидивной выживаемости были получены у пациентов после РПЭ и БТ, эти данные значимо отличались от данных выживаемости пациентов после ДЛТ и ПФТ. У пациентов с высоким риском безрецидивная выживаемость в группе протонно-фотонной терапии составила 40,0±9,6 %, в группе фотонной терапии 42,0±8,7 %, в группе хирургического лечения 52,0±6,4 % и в группе брахитерапии 62,1±12,5 %% (небольшое количество таких пациентов в группе брахитерапии не позволяет говорить о достоверности результатов). Достаточно важным мы считаем тот факт, что вне зависимости от вида лечения у пациентов с низким риском развития рецидива безрецидивная выживаемость составила 100%. Это позволяет врачам выбирать метод лечения исходя лишь из возможности развития осложнений и побочных реакций, способности пациента перенести хирургическое вмешательство. Данные полученные в нашем исследовании позволяют врачам в повседневной практике лечения РПЖ опираться на значения группы риска, как наиболее точного прогноза возникновения рецидива у данного больного.
При анализе взаимосвязи между предоперационным уровнем ПСА и безрецидивной выживаемостью больных после РПЭ выявлена статистически достоверная взаимосвязь между концентрацией маркера и вероятностью возникновения рецидива РПЖ. При сравнении медианы предоперационного уровня ПСА у больных с развившимся прогрессированием заболевания и у пациентов без признаков рецидива также выявлены достоверные различия: медиана уровня ПСА - 21 нг/мл и 10,2 нг/мл соответственно (р<0,001). 5-летняя безрецидивная выживаемость в группе больных с уровнем ПСА менее 10 нг/ мл составила 79%, от 10 до 20 нг/мл - 71%, свыше 20 нг/мл - 35%. Достоверных различий безрецидивной выживаемости больных с уровнем ПСА менее 10 нг/мл и уровнем ПСА в диапазоне от 10 до 20 нг/мл не отмечено (р=0,25). Таким образом, предоперационный уровень ПСА при монофакторном анализе являлся независимым фактором прогноза безрецидивной выживаемости больных после РПЭ. При уровне ПСА менее 4 нг/мл рецидива заболевания не выявлено ни у одного больного. Наиболее прогностически значимым являлся уровень маркера, равный 20 нг/мл. Учитывая, что уровень ПСА достоверно не коррелирован с патоморфологическими характеристиками опухоли, исходная концентрация маркера, по-видимому, в большей степени отражает распространенность метастатического процесса (как лимфогенного, так и гематогенного).
При анализе безрецидивной выживаемости у больных с различной клинической стадией выявлены статистически достоверные различия между группами пациентов с локализованными и экстракапсулярными опухолями (р=0,0015, логранговый критерий), а также между больными с клинической стадией T1b и T1c (непальпируемые и невизуализируемые опухоли) и клинической стадией Т2а и Т2Ь (р=0,049). Темп развития рецидива был также выше у больных с клинически экстракапсулярными опухолями, у всех пациентов с клинической стадией ТЗа прогрессирование процесса выявлено в течение первых 2 лет после РПЭ.
Мы провели многофакторный анализ влияния различных признаков на безрецидивную выживаемость больных после различных видов лечения, используя регрессионную модель пропорциональных рисков Кокса. Для построения модели оценки вероятности безрецидивной выживаемости нами были отобраны такие факторы, как клиническая стадия РПЖ, уровень ПСА до начала лечения, степень дифференцировки опухоли по шкале Глисона и группа риска. Модель в целом оказалась прогностически значимой (р<0,001). Статистически достоверным фактором прогноза, влияющим на безрецидивную выживаемость больных, являлась только клиническая стадия (р=0,03) и группа риска развития рецидива, в то время как ни концентрация ПСА, ни степень дифференцировки при многофакторном анализе не оказывали достоверного влияния на показатели безрецидивной выживаемости. Факторами прогноза, оказывающим достоверное влияние в мультивариантном анализе на выживаемость больных без признаков клинического прогрессирования, являлась степень дифференцировки опухоли по шкале Глисона и группа риска. Следует отметить, что и в монофакторном анализе у больных с высоко- и низкодифференцированными опухолями существенно больше различалась выживаемость без признаков клинического прогрессирования, чем общая безрецидивная выживаемость.
Таким образом, подводя итоги анализу наших исследований, следует сказать, что подтверждена целесообразность комплексного подхода в прогнозировании результатов лечения РПЖ. Лучшие результаты лечения, учитывая эффективность при различных стадиях РПЖ, получены при применении радикальной простатэктомии и брахитерапии как в ближайшие, так и в отдаленные сроки.
При оценке результатов лечения по группам установлено, что при локализованном РПЖ по оценке как ближайших, так и отдаленных результатов наиболее предпочтительно хирургическое лечение или брахитерапия. Однако, при более поздних стадиях заболевания наиболее эффективной является брахитерапия, особенно это актуально у пациентов, которым не показано или невозможно проведение оперативного вмешательства. Применение методов дистанционного облучения (ДЛТ и ПФТ) характеризуются приблизительно сходными результатами эффективности лечения, однако, при протонно-фотонной терапии отмечается более низкая частота возникновения постлучевых осложнений, что делает этот метод более предпочтительным для использования.
Брахитерапия является высокотехнологичным современным методом лечения рака предстательной железы с высокой эффективностью. Данный метод характеризуется низким количеством нежелательных постлучевых эффектов. Опухоль-специфичная выживаемость после применения данного метода составляет 96%, что не отличается от такого же показателя у пациентов после радикальной простатэктомии. Однако, данный метод может быть использован у пациентов с невозможностью выполнения оперативного лечения.
На основе вышеперечисленного нами разработан алгоритм выбора метода лечения пациентов, основанный на учете факторов прогноза, объема предстательной железы, общего соматического статуса пациентов (рисунок 11).

Рис. 11. Алгоритм выбора метода радикального лечения при локализованном и местнораспространенном раке предстательной железы
Выводы.
- Клиническая стадия РПЖ, уровень ПСА до операции, степень дифференцировки по шкале Глисона и процент положительных биоптатов являлись в моновариантном анализе предоперационными факторами прогноза, достоверно влияющими на безрецидивную выживаемость больных после операции. В многофакторном регрессионном анализе достоверными факторами прогноза безрецидивной выживаемости являлись только уровень ПСА (р=0,006) и процент позитивных биоптатов (р=0,001).
- Предоперационный уровень ПСА не являлся самостоятельным фактором прогноза, достоверно коррелирующим с основными патоморфологическими характеристиками опухолевого процесса. Статистически достоверная корреляция выявлена только между уровнем ПСА и выявлением метастазов в регионарных лимфатических узлах. Значимым для определении прогноза опухоли является уровень ПСА более 20 нг/мл.
- Степень дифференцировки опухоли по шкале Глисона, наличие опухолевого роста по линии резекции, патоморфологическая стадия опухолевого процесса являются факторами, достоверно влияющими на безрецидивную выживаемость больных после лечения. В мультивариантном анализе достоверными факторами прогноза безрецидивной выживаемости явилась сумма Глисона (р=0,001).
- Степень риска развития рецидива является наиболее точным показателем прогрессирования опухоли. У пациентов с низким риском развития рецидива вне зависимости от вида лечения 5-тилетняя безрецидивная выживаемость составляет 100%.
- Основным интраоперационным осложнениями позадилонной РПЭ явилось кровотечение (8,8%). Основными поздними послеоперационными осложнениями являлись стриктуры везико-уретрального анастомоза (10,2%) и недержание мочи (17%). Основными осложнениями лучевых методов лечения явились постлучевой ректит, цистит, простатит и энтероколит. Наименьшая частота осложнений отмечена у пациентов после брахитерапии (42%), наибольшая частота осложнений у пациентов после дистанционной лучевой фотонной терапии (92%).
- Общая выживаемость больных за время наблюдения в группе дистанционной фотонной терапии составила 43,6%, опухоль-специфичная выживаемость - 72,1%. В группе протонно-фотонной лучевой терапии общая выживаемость больных за время наблюдения составила 65,7%, опухоль-специфичная выживаемость - 75,7%. Общая выживаемость больных без признаков клинического прогрессирования за время наблюдения составила 63,7%.
- Показатели выживаемости пациентов после протонно-фотонной терапии и дистанционной лучевой терапии оказались сопоставимыми и значимо не отличались. Однако, частота постлучевых осложнений после проведении протонно-фотонной терапии значимо ниже, чем после проведения дистанционной лучевой терапии.
- Наиболее эффективным лучевым методом радикального лечения локализованного рака предстательной железы является брахитерапия. 5-летняя общая, опухоль-специфичная выживаемость, безрецидивная выживаемость составили соответственно 82%, 96%, 76%.
- Показатели опухоль-специфичной, общей и безрецидивной выживаемости сопоставимы после радикальной простатэктомии и брахитерапии, несмотря на различные воздействия на предстательную железу и отсутствие той радикальности удаления ткани ПЖ при брахитерапии как при радикальной простатэктомии.
пРАКТИЧЕСКИЕ РЕКОмЕНдАЦИИ
- Для осуществления оптимального выбора метода лечения пациентов целесообразно использование определения групп риска развития опухоли (с учетом стадии опухолевого процесса и значения ПСА) и предложенного алгоритма выбора метода радикального лечения при раке предстательной железы.
- При соответствии опухолевого процесса группам благоприятного и среднего прогноза предпочтение следует отдавать проведению радикальной простатэктомии и брахитерапии. Проведение брахитерапии возможно при отсутствии значительных нарушений мочеиспускания.
- При использовании методов дистанционной лучевой фотонной и протонно-фотонной терапии необходимо проведение профилактики постлучевого ректита, цистита, простатита.
- При проведении дистанционной лучевой терапии с учетом частоты развития ранних и поздних постлучевых осложнений при возможности предпочтение следует отдавать проведению протонно-фотонной терапии.
- При наличии равных условий к проведению лечения с помощью всех существующих методов радикального лечения при раке предстательной железы целесообразно проведение хирургического лечения или брахитерапии.
СпИСОК ОпУбЛИКОВАННых РАбОТ пО ТЕмЕ дИССЕРТАЦИИ
- Каприн А.Д., Котляров П.М., Подшивалов А.В., Иванов С.А. Современные аспекты диагностики рака простаты // Андрология и генитальная хирургия.-2001.-№3.- С. 30-34.
- Харченко В.П., Каприн А.Д., Иванов С.А., Костин А.А. Внутриуретральное стентирование у больных после хирургического и комбинированного лечения рака простаты // Андрология и генитальная хирургия.-2003.- №2.- С. 58-60.
- Титова В.А., Иванов С.А., Клименко А.А. Опыт применения альфа-адреноблокаторов в профилактике и лечении постлучевых циститов // Материалы I съезда онкологов СНГ, Минск.- 2004.- С.32.
- Каприн А.Д., Клименко А.А., Иванов С.А. Лучевое повреждение мочевого пузыря и методы его коррекции // Материалы VI Всероссийской научно-практической конференции «Актуальные вопросы лечения онкоурологических заболеваний», Москва.- 2005.- С. 50.
- Каприн А.Д., Халил Ф., Костин А.А., Иванов С.А. Влияние дистанционной лучевой терапии на уродинамические показатели у больных с локализованным раком предстательной железы // Материалы научно-практической конференции «Диагностика и современные принципы лечения опухолей нижних мочевых путей», Москва.- 2005.- С. 91-93.
- Каприн А.Д., Халил Ф., Костин А.А., Иванов С.А. Эффективность применения альфа-адреноблокаторов в лечении постлучевых нарушений мочеиспускания у больных с локализованным раком предстательной железы // Материалы научно-практической конференции «Диагностика и современные принципы лечения опухолей нижних мочевых путей», Москва.- 2005.- С. 93-94.
7. Каприн А.Д., Костин А.А., Иванов С.А. Профилактика постлучевых стриктур простатического отдела уретры // Материалы Пленума правления РОУ «Достижения в лечении заболеваний верхних мочевых путей и стриктур уретры», Екатеринбург.- 2006.- С. 379-340.
- Хмелевский Е. В., Харченко В. П., Паньшин Г. А., Мельник Ю. Д., Иванов С. А. и др. Методика протонно-фотонной лучевой терапии локализованного рака предстательной железы // Российский онкологический журнал.- 2006.- №6. - C. 12.
- Каприн А.Д., Иванов С.А., Клименко А.А. Рак предстательной железы: новые возможности в диагностике локализованных и местнораспространенных форм заболевания // Андрология и генитальная хирургия.-
2006.-№2.-C.14-19.
- Каприн А.Д., Титова В.А., Иванов С.А., Клименко А.А., Гармаш С.В. Системная и внутрипузырная озонотерапия при циститах после радикальной лучевой терапии и комплексного лечения злокачественных опухолей малого таза // Онкоурология.- 2006.- №4.- C. 35-37.
- Каприн А.Д.,. Найговзина Н.Б., Иванов С.А., Башмаков В.А. Экономическая эффективность скрининга рака предстательной железы // Онкоурология.- 2007.- №4. - C. 36-40.
- Иванов С.А., Каприн А.Д. Улучшение качества мочеиспускания больных локализованным раком предстательной железы в процессе комбинированного лечения // Материалы XI съезда урологов России, Москва.- 2007.- С. 162-163.
- Каприн А.Д., Иванов С.А, Клименко А.А., Цыбульский А.Д. Простатэктомия при раке предстательной железы: первый опыт // II конгресс российского общества онкоурологов, Москва.- 2008.- С. 45.
- Иванов С.А., Каприн А.Д., Паньшин Г.А., Гармаш С.В., Гамидов М.И., Шестаков А.В., Нестеров П.В. Результаты адьювантной лучевой терапии после радикальной простатэктомии у пациентов с локализованным раком предстательной железы // Вопросы онкологии.- 2009.-том 55. -№4. - C. 512-514.
- Иванов С.А., Хмелевский Е.В., Фастовец С.В. Использование простатического специфического антигена как фактора прогноза отдаленных результатов брахитерапии при раке предстательной железы // Онкоурология.- 2009.- №4.- C. 17.
- Иванов С.А., Каприн А.Д., Хмелевский Е.В., Фастовец С.В. Простатический специфический антиген как фактор прогноза отдаленных результатов внутритканевой лучевой терапии при раке предстательной железы// Военно-медицинский журнал.- 2009.- №11.- C. 61.

