Сравнительная оценка нейропротекторного и снотворного действия антиинсомнических препаратов при черепно-мозговой травме
На правах рукописи
ЩЕЛКАНОВА ОКСАНА АЛЕКСАНДРОВНА
СРАВНИТЕЛЬНАЯ ОЦЕНКА НЕЙРОПРОТЕКТОРНОГО
И СНОТВОРНОГО ДЕЙСТВИЯ АНТИИНСОМНИЧЕСКИХ
ПРЕПАРАТОВ ПРИ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЕ
14.03.06 фармакология, клиническая фармакология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Владивосток 2011
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Читинская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации
Научный руководитель:
Доктор медицинских наук Белозерцев Феликс Юрьевич
Официальные оппоненты:
Доктор медицинских наук Кропотов Александр Валентинович - профессор Государственного образовательного учреждения высшего профессионального образования «Владивостокский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации
Доктор медицинских наук Дюйзен Инесса Валерьевна - ведущий научный сотрудник Учреждения Российской академии наук «Институт биологии моря им. А.В. Жирмунского ДВО РАН».
Ведущая организация: ГОУ ВПО «Красноярский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации
Защита состоится «_17» июня 2011 г. в 10 часов
на заседании Диссертационного совета Д 208.007.03 при Владивостокском государственном медицинском университете
по адресу: 690002,г. Владивосток, пр. Острякова, 2
С диссертацией можно ознакомиться в библиотеке Владивостокского государственного медицинского университета,
Автореферат разослан __ мая 2011 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Е.В. Просекова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Изыскание новых нейропротекторных средств с многофакторным действием на различные патологические реакции при черепно-мозговой травме является одной из актуальных проблем современной фармакологии. Исследованиями установлена недостаточная эффективность фармакотерапии в остром периоде черепно-мозговой травмы и высокая частота побочных эффектов применяемых лекарственных средств (Коновалов А.Н., 2006, Верещагин Е.И., 2009, Bramlett Н.M., Dalton Dietrich W, 2006).
По статистическим данным у 35-40% больных с черепно-мозговой травмой при назначении фармакотерапии наблюдается полное восстановление нервно-психического статуса на продолжительный срок. Вместе с тем, у 60-65% больных отмечаются неблагоприятные исходы фармакотерапии острого периода травмы мозга. Бессонница, судорожные симптомы, деменция, апатия, депрессия, тревога, психотические расстройства, сочетаются с периодами вторичного ухудшения неврологического статуса (Потапов А.А., 2009, Мартуза Р. 2002, Rowland L.P., 2001, Парфёнов В.Е., 2002, Астраков С.В., 2007).
Исследователи обращают внимание, что нарушения ночного сна неблагоприятно отражаются на течении острых поражений мозга, а антиинсомнические препараты повышают эффективность их терапии (Левин Я.И., Ковров Г.В., 2003, Горбачева Ф.Е., 2004). Нельзя исключить, что данное положение распространяется на течение и исходы травматической болезни мозга. С момента травмы мозга бессонница, как и перепады настроения, ухудшение памяти, внимания и др. неврологические проявления могут длиться более 3 месяцев (Ким А.А., 2002, Мартуза Р., 2002). Эти наблюдения делают актуальным исследование влияния антиинсомнических препаратов на течение и исходы черепно-мозговой травмы.
Трудности фармакотерапии острого периода связывают с многочисленностью факторов вторичного повреждения мозга, но основными считаются гипоксия, ишемия, судорожные явления. С целью их профилактики и более полного восстановления неврологических и психических функций одновременно применяют большое число нейротропных средств с различной направленностью фармакологического эффекта (Faden A.I., 2002, Коновалов А.Н.,2006, Белозерцев Ф.Ю., 2007.). Вместе с тем высказано мнение, что чем массивнее повреждение мозга, тем меньше должен быть перечень используемых препаратов. Они могут способствовать фиксации патологических состояний и внесения таких изменений в работу ЦНС, которые являются потенциально опасными для больных с травмами мозга (Качков И.А. и др., 1999, Касумов Р.Д., Кондратьев А.Н., 2001, Старченко А.А.,2004. ). Наконец, полипрагмазия ведет к непредсказуемым эффектам фармакологического взаимодействия препаратов (Коррейа М.А., 2007). Поэтому актуальной задачей является поиск антиинсомнических препаратов с многофакторным действием на различные звенья патогенеза черепно-мозговой травмы.
В настоящее время для терапии синдрома бессонницы в посттравматический период рекомендуют назначать нитразепам, зопиклон, золпидем, мелаксен, радедорм и др. Однако их способность оказывать антигипоксическое, антиишемическое, противосудорожное и снотворное действие в остром периоде травмы мозга не изучена в должной степени.
Для решения этой актуальной проблемы проведена сравнительная оценка нейропротекторных свойств и эффективности снотворного действия ряда антиинсомнических препаратов в условиях острого периода травмы мозга.
Работа выполнена в рамках программы Росздрава и плановой темы НИР ЧГМА «Разработка лекарственных средств, оказывающих многофакторное нейропротекторное и ноотропное действие при заболеваниях ЦНС» (№ гос. регистрации 01200 602670).
Цель работы: мониторинг сравнительной эффективности антиинсомнических препаратов с нейропротективными свойствами для терапии острого периода контактной черепно-мозговой травмы.
Задачи работы:
1. Оценить влияние травмы мозга (в эксперименте) на динамику устойчивости центральной нервной системы к глобальной ишемии, гипоксии с гиперкапнией, судорогам и мнестическим нарушениям;
2. Изучить эффективность снотворных средств в различные сроки посттравматического периода;
3. Анализ антиишемической, антигипоксической, противосудорожной активности снотворных препаратов в условиях черепно-мозговой травмы;
4. Оценить действие снотворных средств на мнестические расстройства после травмы мозга;
Научная новизна. В экспериментальных исследованиях применен комплекс методов, позволивший выявить спектр и эффективность действия основных антиинсомнических препаратов на механизмы вторичного повреждения мозга - ишемию, гипоксию, судороги и мнестические расстройства.
Впервые показано:
– золпидем, нитразепам и феназепам проявляют максимальное снотворное действие в 1-ю неделю посттравматического периода с последующим снижением во 2-ю неделю в 1,5-2 раза. Эффективность снотворного действия зопиклона и экстракта хмеля повышается на 2-й неделе. Мелаксен и дифенгидрамин оказывают антиинсомническое действие в 1-ю неделю острого периода черепно-мозговой травмы;
– зопиклон и золпидем обладают выраженной антиишемической активностью, увеличивая длительность и частоту гаспинга при полной ишемии головного мозга. Дифенгидрамин проявляет умеренное антиишемическое действие;
– золпидем и экстракт хмеля в остром периоде черепно-мозговой травмы проявляют высокую антигипоксическую активность при гиперкапнической гипоксии, зопиклон – умеренную. Мелаксен повышает, а нитразепам, феназепам и дифенгидрамин снижают устойчивость животных к гемической гипоксии;
– зопиклон проявляет выраженное противосудорожное действие в 1-ю и 2-ю неделю посттравматического периода, а дифенгидрамин – во 2-ю неделю;
– зопиклон, мелаксен и экстракт хмеля обладают протекторным эффектом в отношении мнестических расстройств, вызванных травмой мозга и судорогами.
Впервые установлено, что в условиях острого периода экспериментальной черепно-мозговой травмы зопиклон, золпидем и экстракт хмеля наряду с антиинсомническим действием оказывают выраженный нейропротекторный эффект.
Практическая значимость. Новые данные о нейропротекторном действии снотворных препаратов вошли в пособие (курс лекций по фармакологии), рекомендованный УМО Министерства здравоохранения и социального развития Российской Федерации в качестве учебного пособия для медицинских вузов РФ. Учебное пособие и материалы диссертационной работы используются в учебном процессе на кафедре фармакологии и кафедре неврологии с курсом нейрохирургии ГОУ ВПО «Читинская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию».
На применение золпидема в остром периоде черепно-мозговой травмы в качестве антиишемического и антигипоксического средства получено положительное решение о выдаче патента РФ (№ 2009118616 от 22.11.2010).
Дано экспериментальное обоснование планирования дальнейших клинических исследований возможности применения золпидема, зопиклона и экстракта хмеля для профилактики вторичных повреждений мозга и профилактической терапии стрессовой и травматической инсомнии в острой стадии черепно-мозговой травмы
Основные положения, выносимые на защиту:
1. В посттравматическом периоде у антиинсомнических препаратов наблюдается неодинаковая эффективность снотворного действия. Их эффекты могут уменьшаться либо возрастать во 2-ю неделю острого периода травмы мозга. Стабильным антиинсомническим действием отличаются зопиклон и экстракт хмеля.
2. В остром периоде черепно-мозговой травмы золпидем, зопиклон и экстракт хмеля обладают более широким спектром нейропротекторной активности, чем мелаксен, нитразепам, феназепам и дифенгидрамин.
3. В посттравматическом периоде зопиклон, золпидем и экстракт хмеля проявляют высокую антигипоксическую активность, золпидем и зопиклон - антиишемическую, зопиклон и дифенгидрамин – противосудорожную, экстракт хмеля, зопиклон и мелаксен – антиамнестическую.
Апробация работы. Отдельные фрагменты работы доложены и обсуждены на Юбилейной конференции с международным участием (Санкт-Петербург, 2009), Всероссийской конференции «Актуальные вопросы современной медицинской науки и здравоохранения» (Екатеринбург, 2009), Всероссийской конференции «Актуальные проблемы теоретической, экспериментальной и клинической медицины и фармации» (Тюмень, 2009), Всероссийской научно-практической конференции «Актуальные вопросы клиники, диагностики и лечения» (Санкт-Петербург, 2009), ХVII Российском национальном конгрессе «Человек и лекарство» (Москва, 2010) и на заседании кафедр нервных болезней с курсом нейрохирургии и фармакологии ГОУ ВПО «Читинская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации.
Публикации. По материалам диссертации опубликованы 10 научных работ: из них 3 статьи – в периодических изданиях, рекомендованных ВАК Минобрнауки РФ. Получено положительное решение о выдаче патента РФ на изобретение:
«Средство, оказывающее антиишемическое, антигипоксическое и антиамнестическое действие в остром периоде черепно-мозговой травмы» № 2009118616 от 22.11.2010
Объем и структура диссертации. Диссертация состоит из введения, обзора литературы, описания материалов и методов и следования, 3 глав с изложением результатов собственных исследований, обсуждения результатов, заключения, выводов, практических рекомендаций и списка использованной литературы, Диссертация изложена на 149 страницах машинописного текста, иллюстрирована 16 рисунками и 25 таблицами. Указатель литературы включает 125 отечественных и 117 зарубежных источников информации.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования. Эксперименты выполнены на 652 белых, беспородных крысах обоего пола массой 130-160 г и 330 белых, беспородных мышах массой 20-30 г., содержавшихся в стандартных условиях вивария с естественным 12-часовым свето-темновым циклом, при температуре воздуха 20-21°С и свободном доступе к воде и полнорационному корму. Содержание животных соответствовало правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 3 51000.3-96 и 51000.4-96) и Приказу МЗ РФ № 267 от 19.06.2003г. «Об утверждении правил лабораторной практики» (GLP) с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях(1997г.). При проведении экспериментов учитывались требования Комиссии по проблеме этики отношения к животным Российского национального комитета по биоэтике при Российской академии наук и этические нормы, изложенные в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985г.). Исследования на животных одобрены локальным этическим комитетом при ГОУ ВПО «Читинская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации (Протокол № 12 от 14.03.2009 г.).
2.1.Методика нанесения черепно-мозговой травмы
Контактную черепно-мозговую травму в эксперименте наносили с использованием модифицированного метода Аллена (Белозерцев Ф.Ю., 2006) под наркозом, вызванном этаминалом натрия (40 мг/кг). Травму головного мозга вызывали падением груза в вертикальной трубке с фиксированной высоты. У животных удаляли кожный покров черепа и на его обнаженную поверхность помещали особый «ударник» диаметром 1 мм. Повреждения костей черепа и сенсомоторной области мозга производили симметрично с обеих сторон.
2.2. Методика оценки снотворного действия препаратов
Исследование специфического снотворного эффекта препаратов проведено по изменениям поведения животных (Гацура В.В, 1974, Воронина Т.А, Неробокова Л.Н., 2005). Эксперименты выполнены на белых мышах и крысах. Для моделирования стрессовой бессонницы животных высаживали в индивидуальные клетки за 10 минут до в/б инъекции препаратов и наносили 3-секундное болевое электрораздражение (сила тока 0,6 мА). После введения препаратов у животных регистрировали латентный период возникновения бокового положения с угнетением рефлекса переворачивания (righting reflex) и продолжительность бокового положения. Дополнительно фиксировали процент животных, у которых развивается боковое положение. Кроме того, у животных определяли второй поведенческий критерий развития сна угнетение рефлекса отдергивания головы. В опытах регистрировали момент торможения рефлекса отдергивания головы и его продолжительность. Оба показателя характеризуют развитие у животных гипнотического состояния.
Влияние препаратов на двигательную и исследовательскую активность экспериментальных животных изучено в камере «Открытое поле» (размеры камеры 60 х 30 см).
Методика оценки толерантности к действию снотворных препаратов
После нанесения контактной черепно-мозговой травмы животных через сутки высаживали в индивидуальные клетки и моделировали стрессовую бессонницу. В течение 12 дней животным вводили антиинсомнические препараты в терапевтической дозировке и регистрировали латентное время возникновения бокового положения с угнетением рефлекса переворачивания, продолжительность угнетения рефлекса переворачивания и рефлекса отдергивания головы.
Методы исследования нейропротекторной активности
антиинсомнических препаратов
Нейропротекторную активность препаратов оценивали по устойчивости мозга к ишемии, гипоксии, электрошоковым судорогам и мнестическим расстройствам.
Методика полной ишемии головного мозга
Для определения антиишемической активности препаратов использовали декапитационную модель полной глобальной ишемии головного мозга (Lowry О.Н. et al.,1964, Gosal D, Torres J.E.,2001, Кулинский В.И. и др.,2000). С этой целью после декапитации определяли продолжительность и частоту агонального дыхания (гаспинга). Учитывая значение температуры для проявления гаспинга, исследования антиишемической активности препаратов проводили в одинаковых температурных условиях (+18).
Методика оценки антигипоксической активности препаратов
Антигипоксическую активность веществ определяли по продолжительности резервного времени у крыс или мышей в условиях нормобарической гермокамеры и гемической гипоксии, вызываемой образованием метгемоглобина. При помещении животных в гермокамеру моделировали нормобарическую, прогрессирующую гипоксию с гиперкапнией, т.е. создавали модель воздействия на травмированных животных двух факторов, повреждающих мозг при контактной травме (Качков И.А. и др.,1999). У крыс массой 140-160 г объем гермокамеры составлял 800 мл, а мышей c массой тела 20-26 г - 200 мл. Резервное время оценивали по продолжительности дыхания и сердечной деятельности у животных (Воронина Т. А, Островская Р.У., 2005).
Гемическую гипоксию моделировали введением нитрита натрия, который вызывает метгемоглобинообразование и резко уменьшает кислородную емкость крови. Антигипоксическую активность веществ определяли по продолжительности резервного времени у мышей после подкожного введения нитрита натрия в дозе 200 мг/кг, который (Воронина Т.А., Островская Р.У, 2005, Евсеева М.А и др., 2008). Резервное время оценивали по продолжительности дыхания и сердечной деятельности у животных. Препараты вводили за 1 час до инъекции нитрита натрия.
Методика исследования противосудорожной активности препаратов
В опытах по оценке противосудорожной активности препаратов использовали крыс массой 130-160 г. Электрошоковые судороги воспроизводили у крыс через глазничные электроды (50 Hz, 150 мА) с помощью электростимулятора. Под влиянием электростимуляции (0,2 сек.) у животных вызывали максимальную тоническую экстензию задних конечностей. В опытах оценивали способность препаратов блокировать развитие максимального электрошока, влиять на время латентного периода и продолжительность тонической экстензии. Защитный индекс препаратов, указывающий на выраженность противосудорожного эффекта, определяли по отношению числа животных, у которых не возникали электрошоковые судороги, к общему числу экспериментальных животных, подвергнутых электрораздражению через корнеальные электроды. В соответствии с международным стандартом критерием наличия противосудорожного действия служит отсутствие электрошоковых судорог не менее, чем у 50% крыс (Воронина Т.А., Неробокова Л.Н., 2005).
Методика исследования мнемотропной активности препаратов
Для оценки мнестических и когнитивных функций у интактных животных и животных, перенесших черепно-мозговую травму, использована методика выработки и отсроченного воспроизведения условной реакции пассивного избегания (УРПИ) в камере с «опасным» и «безопасным» отсеком (Воронина Т.А., Островская Р.У., 2005). Обучение животных УРПИ производили в камере с затемненным и освещенным отсеками, соединенных дверцей.
Методика исследования мнестических расстройств
Амнезию условного рефлекса пассивного избегания вызывали у крыс нанесением максимального электрошока, что моделировало вторичное повреждение мозга судорожной природы. Оценку состояния памяти производили по показателям отсроченного воспроизведения УРПИ через 1 час и 7 суток, что считается оптимальными сроками для оценки состояния кратковременной и долговременной памяти животных (Сапронов Н.С., Федотова Ю.О., 2002). Для этого животных помещали в освещенный, «безопасный» отсек камеры на 200 сек. Определяли латентное время 1-го захода в темный, «опасный» отсек камеры и время пребывания в нем. Тестирование показателей УРПИ проводили трижды. Введение снотворных препаратов производили за час до сеанса обучения или тестирования.
У животных с экспериментальной травмой мозга проведена оценка выраженности снотворного действия и спектра нейропротекторной активности следующих лекарственных средств:
- позитивных модуляторов гамкергической передачи (нитразепам 5-10 мг/кг, феназепам 5-10 мг/кг, золпидем 5-20 мг/кг, зопиклон 2-15 мг/кг);
- прочих снотворных разного химического строения (мелаксен 3-6 мг/кг, дифенгидрамин 25-50 мг/кг, экстракт хмеля 5-15 мл/кг).
Спиртово-водный экстракт хмеля готовили из соотношения сырья и 15 раствора этилового спирта - 1:1.
Статистическая обработка данных проведена с использованием пакета программ «Биостат». Соответствие полученных данных гаусовскому распределению определяли по критерию Фишера. Оценку достоверности различий (контроль-опыт) проводили по критерию (t) Стьюдента и непараметрическому критерию (U) Манна - Уитни.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Динамика изменений устойчивости мозга при черепно-мозговой травме
Первоначально изучена динамика устойчивости мозга в острый период черепно-мозговой травмы к ишемическим, гипоксическим, судорожным факторам вторичного повреждения мозга и состояние мнестических функций у травмированных животных.
В остром посттравматическом периоде наблюдаются значительные колебания резистентности мозга к полной ишемии и гиперкапнической гипоксии (таблица 1). Полученные данные свидетельствуют о повышении устойчивости головного мозга к влиянию ишемического фактора - в 1-е и 15-е сутки посттравматического периода. Об этом свидетельствует увеличение продолжительности гаспинга в первые 24 часа после ЧМТ почти на 42% и его частоты на 15 сутки почти на 41% по сравнению с интактными животными (Р<0,05). Вместе с тем, на 6-е сутки наблюдается достоверное снижение частоты гаспинга.
Известно, что частота разрядов нейронов ствола мозга коррелирует с дыхательными движениями мышц во время агонального дыхания (St-John W.M., 1999). Поэтому дополнительно определяли непрямой интегральный показатель устойчивости мозга, позволяющий косвенно учитывать эффективность утилизации кислорода нервной тканью при активации дыхательной функции в условиях полной ишемии мозга (Белозерцев Ф.Ю., 2006). По сравнению с интактными животными интегральный показатель вырос в 1-е сутки на 66%, в 15-е – на 56% и снизился почти на 21% к 6 суткам Следовательно, в посттравматический период наблюдается неустойчивая динамика резистентности мозга к ишемической гипоксии, обусловленная очевидно взаимодействием пато- и саногенетических механизмов ЦНС
Таблица 1
Динамика устойчивости животных после черепно-мозговой травмы к глобальной ишемии головного мозга и гиперкапнической гипоксии
| Группа животных | Дни после травмы мозга | Длительность гаспинга (сек.) | Частота гаспинга | Резервное время (мин.) |
| Интактные мыши | - | 13,7±0,76 | 9,1±0,54 | 41,5±1,5 |
| Опытная группа 1 (ЧМТ) | 1 | 19,4±0,98* | 10,6±0,8 | 49,5±2,1** |
| Опытная группа 2 (ЧМТ) | 3 | 14,7±0,97 | 10,4±0,8 | 47,8±1,9* |
| Опытная группа 3 (ЧМТ) | 6 | 13,7±1,7 | 7,2±0,64* | 43,2±2,1 |
| Опытная группа 4 (ЧМТ) | 10 | 14,3±0,78 | 11,6±0,85 | 39,8±1,7 |
| Опытная группа 5 (ЧМТ) | 15 | 15,1±1,6 | 12,8±0,67* | 42,1±1,7 |
Примечание. Значимость различий контроль (интактные мыши) – опыт (мыши после черепно-мозговой травмы): * при Р<0,05 и ** при Р<0,01
Во-вторых, в различные сроки после черепно-мозговой травмы иначе менялась динамика выносливости крыс к двум другим факторам ВПМ - гипоксической гипоксии и гиперкапнии. В первые сутки после травматического повреждения мозга продолжительность жизни животных в гермокамере возросла на 19,9%. На 3 сутки она оставалась достоверно выше, чем у интактных животных. Снижение показателя резервного времени при гиперкапнической гипоксии зарегистрировано на 10-е сутки (таблица 1).
Еще значительнее снижалась устойчивость животных к гемической гипоксии, для которой характерно нарушение транспортной функции гемоглобина. Как видно на рис. 1, продолжительность жизни к 10 дню посттравматического периода уменьшалась на 16% (Р <0,05).
Вторичные повреждения перифокальной нервной ткани при черепно-мозговой травме часто являются следствием судорожных реакций. Поэтому в опытах на крысах исследованы сдвиги продолжительности судорог, вызванных электростимуляцией через глазничные электроды, в различные сроки посттравматического периода (таблица 2).

Рис. 1. Характеристика устойчивости животных к гемической гипоксии на 10 сутки после черепно-мозговой травмы (* - Р < 0,05).
В 1-е сутки острого периода ЧМТ у животных регистрируется значимое уменьшение продолжительности тонических экстензий по сравнению с интактными животными (на 27,6%). Повторное определение устойчивости мозга к судорогам на 3-и и 6-е сутки показывает, что она остается на более высоком уровне, чем у интактных крыс. Об этом свидетельствует уменьшение продолжительности тонических экстензий соответственно на 33% и 25% (Р < 0,05).
Вероятно, в первые 6 суток посттравматического периода развивается устойчивая активация эндогенных противосудорожных механизмов, которая достигает максимума на 3 сутки. К 15 дню тестирование выявило увеличение продолжительности тонической экстензии на 25%, указывающее на повышение судорожной готовности ЦНС и большую вероятность развития вторичных судорожных явлений в травмированном мозге (таблица 2).
В серии опытов определена динамика мнестических нарушений после нанесения электрошоковых судорог, моделирующих судорожные явления у травмированных крыс. На 3-й, особенно, 6-й день посттравматического периода угнетение условной реакции пассивного избегания (УРПИ) через 1 час после электрошоковых судорог было более значительным, чем у интактных крыс. Время пребывания в «опасном» отсеке камеры соответственно возросло в два и три раза, а воспроизведение УРПИ снизилось на 18-23% (Р < 0,05).
Тестирование воспроизведения УРПИ через 7 дней после нанесения ЭШ показало полное исчезновение памятного следа условных оборонительных ответов у травмированных животных. Время пребывания в опасном отсеке увеличивалось в 2 раза, если ЭШ наносили не на 3-и, а на 6 сутки после травмы (соответственно 42,9±5,92 и 92,2±4,5 сек, Р < 0,01). Следовательно, с увеличением времени после травмы нарастает степень мнестических расстройств
Таблица 2
Динамика показателей электрошоковых судорог у крыс после
черепно-мозговой травмы
| Группа (п – число животных) | Дни после травмы | Латентный период (сек.) | Длительность тонической экстензии (сек.) |
| Контрольная (интактные крысы) п=15 | - | 1,3±0,8 | 15,1±1,2 |
| Опытная 1 (крысы с ЧМТ) п=10 | 1 | 2,23 ± 0,3 | 10,5 ± 0,6* |
| Опытная 2 (крысы с ЧМТ) п=10 | 3 | 1,9± 0,3 | 9,7± 0,3** |
| Опытная 3 (крысы с ЧМТ) п=10 | 6 | 1,9± 0,6 | 11,6± 0,6* |
| Опытная 4 (крысы с ЧМТ) п=10 | 10 | 0,9± 0,4 | 13,9± 0,9 |
| Опытная 5 (крысы с ЧМТ) п=15 | 15 | 1,1± 0,4 | 18,9± 1,3** |
Примечание. Значимость различий контроль (интактные крысы) – опыт (крысы после черепно-мозговой травмы): * при Р<0,05 и ** при Р<0,01
Исследование антиинсомнического действия препаратов при ЧМТ
Сравнение показателей действия гипнотиков на модели стрессовой и болевой бессонницы выявило их неодинаковую эффективность в 1 и 2 неделю острого периода травмы мозга.
На 2 сутки в малых дозах нитразепам и феназепам угнетали рефлекс переворачивания (righting reflex) и рефлекс отдергивания головы у 83,3% крыс. Вместе с тем, нитразепам вызывает боковое положение у травмированных животных в 4 раза быстрее, а угнетение рефлексов в 2 раза продолжительнее. С увеличением дозировки бензодиазепинов до 10 мг/кг величина показателей снотворного действия у крыс оказалась примерно одинаковой, что указывает на достижение максимального снотворного действия нитразепама в дозе 5 мг/кг, а феназепама – 10 мг/кг.
Применение на 2-е сутки посттравматического периода небензодиазепиновых снотворных, обладающих иным механизмом действия на ГАМКа-рецепторный комплекс нейрональных мембран мозга, показало большое сходство параметров снотворного действия золпидема и нитразепама (рис. 2). При назначении зопиклона угнетение рефлексов возникало медленнее, а продолжительность эффекта была меньше в 2,5 раза (Р < 0,01).
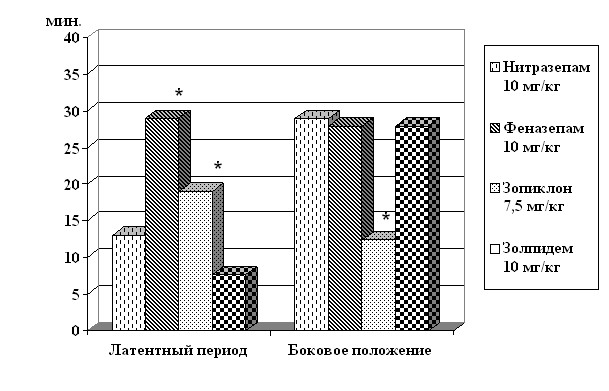 Рис. 2. Влияние гамк-позитивных препаратов на продолжительность сна у крыс с черепно-мозговой травмой (2 сутки)
Рис. 2. Влияние гамк-позитивных препаратов на продолжительность сна у крыс с черепно-мозговой травмой (2 сутки)
По вертикали – время (мин.), по горизонтали – латентный период и продолжительность
бокового положения. Значимость различий опыт 1 (нитразепам) – опыт 2,3,4 * – Р < 0,05
Исследование, проведенное на 4-е сутки посттравматического периода, показало, что частота развития сна отмечается у 100% крыс на фоне действия больших дозировок всех препаратов. Измерение показателей специфического антиинсомнического действия нитразепама, феназепама и золпидема на 4 день посттравматического периода не выявило значительных изменений продолжительности бокового положения и времени угнетения рефлекса отдергивания. Вместе с тем, применение зопиклона повышает скорость наступления сна в 2 раза, а время бокового положения на 24% по сравнению данными, полученными у крыс на 2 сутки после черепно-мозговой травмы.
На 11 сутки после травмы мозга продолжительность гипногенного эффекта нитразепама уменьшалась на 31%, феназепама – на 37% и золпидема – на 51% (Р < 0,01). Вместе с тем, эффективность специфического действия зопиклона не изменялась как по показателям рефлекса переворачивания (righting reflex), так и рефлекса отдергивания головы.
Эти факты указывают на неодинаковые потенциально терапевтические возможности нитразепама, феназепама, золпидема и зопиклона, обладающих различным механизмом вмешательства в работу ГАМКа-рецепторного комплекса гипногенных зон мозга. Действительно, ГАМКа-рецепторные комплексы различных отделов мозга содержат неодинаковые комбинации субъединиц, образующих его BZ1- сайты (Тревор Э.Д., Вэй У.Л., 2007). Поэтому эффективность гипногенного действия препаратов может зависеть как от особенностей строения BZ1- -сайта, так и действия на иные BZ2- BZ5- участки ГАМКа-рецепторов мозга.
В следующей серии опытов проведено сравнение показателей снотворного действия мелаксена, дифенгидрамина и экстракта хмеля у крыс в различные сроки посттравматического периода. В качестве эталонного средства в опытах применяли натрия этаминал, введение которого вызывало в среднем через 12 минут угнетение рефлекса переворачивания (righting reflex) и рефлекса отдергивания головы в течение 13-14 минут. Введение мелаксена (3-6 мг/кг) на 2-й день вызывало появление снотворного действия у 87,5-100% травмированных крыс, дифенгидрамина (25-50 мг/кг) – у 87,5-100% и экстракта хмеля (10-15 мл/кг) – 75-100%. Скорость появления бокового положения в условиях стрессовой бессонницы, вызванной болевым раздражением, составила в среднем 35-39 мин. при введении мелаксена, 48-64 мин. – дифенгидрамина и 11-19 мин. – экстракта хмеля. Продолжительность угнетения рефлекса отдергивания головы и рефлекса переворачивания составила в среднем 17-24 минуты на фоне действия мелаксена, 15-17 минут – дифенгидрамина и 12-17 минут - экстракта хмеля (рис. 3). Дополнительно установлена способность экстракта хмеля (10 мл/кг) потенцировать действие натрия этаминала (30 мг/кг). Сочетанное введение препаратов вызывало быстрый и более продолжительный снотворный эффект. Об этом свидетельствует короткий латентный период и в 3 раза большее время угнетения рефлексов переворачивания и отдергивания головы.
Исследование эффективности снотворных на 4-е сутки после травмы показало, что мелаксен оказывал снотворное действие всего в 28,5% случаев, тогда как дифенгидрамин и экстракт хмеля – у 100% животных. На фоне действия дифенгидрамина и экстракта хмеля величина показателей скорости и продолжительности угнетения рефлексов переворачивания и отдергивания головы не изменялась по сравнению со вторыми сутками посттравматического периода.
На 11-е сутки острого периода ЧМТ при введении мелаксена снотворное действие развивалось в 14% случаев, что указывает на резкое уменьшение его эффективности. Сходная динамика наблюдалась при определении интенсивности снотворного эффекта дифенгидрамина. Вместе с тем, введение экстракта хмеля в дозе 15 мл/кг вызывало проявления сна у травмированных крыс в 86% случаев (таблица 3). Регистрация времени торможения рефлекса переворачивания и рефлекса отдергивания головы свидетельствовала о значительном усилении снотворного действия экстракта хмеля. В большой дозе показатели его антиинсомнического эффекта повышались в среднем на 52-75% по сравнению со 2-и сутками после травмы мозга (таблица 3).
 Рис. 3. Влияние этаминала натрия, мелаксена, дифенгидрамина и экстракта хмеля на рефлекс переворачивания у травмированных крыс (2 сутки)
Рис. 3. Влияние этаминала натрия, мелаксена, дифенгидрамина и экстракта хмеля на рефлекс переворачивания у травмированных крыс (2 сутки)
По вертикали – время (сек.), по горизонтали – латентный период и продолжительность
бокового положения. Значимость различий опыт 1 – опыт 2,3,4: * – Р < 0,05
Таким образом, мелаксен оказывает снотворное действие в первые 2 суток посттравматического периода. В последующем его специфический эффект развивается у 14-28,5% животных. Дифенгидрамин проявляет снотворные свойства в 1 неделю острого периода ЧМТ. Антиинсомнический эффект экстракта хмеля усиливается на 2-й неделе посттравматического периода примерно в 2 раза и становится сопоставимым с действием нитразепама.
Низкую устойчивость антиинсомнического эффекта у мелаксена и дифенгидрамина отмечают многие исследователи (Левин Я.И.,2005). Возможно, исчезновение снотворного действия этих средств на 2 неделе после травмы связано, с перестройкой метаболизма травмированного мозга и особенностями молекулярных механизмов их действия.
Таблица 3
Влияние снотворных препаратов на состояние сон-бодрствование у крыс
на 11 сутки посттравматического периода
| Группа животных и препарат | Доза мг/кг | Латентный период (мин.) | Продолжительность бокового положения (мин.) | Время угнетения рефлекса отдергивания головы | % спящих крыс |
| Опытная 1 ЧМТ Натрия этаминал | 30 | 11,6±1,11* | 14,3±1,7 | 12,7±1,55 | 77% |
| Опытная 2 ЧМТ Мелаксен | 3 | 28 | 5 | 4 | 14,3% |
| Опытная 3 ЧМТ Дифенгидрамин | 50 | 44 | 14 | 12 | 12,5% |
| Опытная 4 ЧМТ Экстракт хмеля | 10 мл/кг | 15±5,56 | 26,7±4,37 | 22,7±4,33 | 43% |
| 15 мл/кг | 18,3±3,74 | 21±4,23 | 19,3±3,56 | 86% |
Примечание. Значимость различий опытная 1 – опытная 2 (3,4,5): * – Р < 0,05.
Сравнение нейропротекторных свойств антиинсомнических
препаратов в посттравматический период
Основные направления нейропротекции видят в предупреждении либо уменьшении прежде всего вторичных ишемических, гипоксических, судорожных и мнестических расстройств. В опытах обнаружено значительное различие антиишемической активности препаратов. Измерение частоты и продолжительности гаспинга при глобальной ишемии мозга показало, что на фоне действия бензодиазепиновых и небензодиазепиновых гипнотиков устойчивость мозга повышается, но в различной степени (таблица 4). Эффективность феназепама была примерно в 2 раза выше, чем нитразепама. Устойчивость мозга к его полной ишемии гораздо эффективнее повышают зопиклон и золпидем. 6-дневное введение их малых доз увеличивало продолжительность гаспинга соответственно на 39% и 27%, больших доз – на 80% и 146% (Р < 0,01). При этом частота агонального дыхания повышается на 107% и 164% (Р < 0,01). Следовательно, наибольшей антиишемической эффективностью обладает золпидем. У зопиклона она ниже примерно в 2 раза и у феназепама – в 4 раза.
6- дневное введение животным снотворной дозировки дифенгидрамина увеличивало продолжительность гаспинга на 63,5% и его частоты – на 105% (Р< 0,05). Вместе с тем, мелаксен и экстракт хмеля незначительно влияли на продолжительность и частоту гаспинга (таблица 4).
Таблица 4
Сравнительная оценка антиишемической активности снотворных препаратов в посттравматический период
| Препарат | Доза мг/кг | Показатели гаспинга | |
| Время (сек.) | Частота дыхательных движений | ||
| Интактные мыши | – | 13,6±0,87 | 9,1±0,45 |
| Мыши с ЧМТ (6 сутки ) | – | 13,7±1,7 | 7,2±0,64* |
| Опытная 1 ЧМТ + нитразепам | 5 | 15,7±1,7 | 11,1± 0,97 |
| 10 | 16.1 ± 1.31 | 12,1± 1,4* | |
| Опытная 2 ЧМТ + феназепам | 5 | 11.8 ± 1.07 | 11 ± 0.98 |
| 10 | 17.7 ± 1.58* | 15.12 ± 1.72 ** | |
| Опытная 3 ЧМТ + зопиклон | 2 | 19±1,5* | 16±1,1** |
| 7,5 | 24,7±2,6** | 15±1,4** | |
| Опытная 4 ЧМТ + золпидем | 10 | 17,43 ± 1.59 | 15,7 ± 1.43** |
| 20 | 33,67 ± 2.1** | 19 ±1.29* | |
| Опытная 5 ЧМТ + мелаксен | 3 | 17.17 ± 1.81 | 10.83 ± 0.91 |
| Опытная 6 ЧМТ + дифенгидрамин | 50 | 22.4 ± 1.81* | 14,8 ± 2.23** |
| Опытная 7 ЧМТ +экстракт хмеля | 10 мл/кг | 16.58 ± 1.71 | 11.33 ± 1.38 |
Примечание. Значимость различий контроль (интактные мыши) – опыт
(мыши после черепно-мозговой травмы): * при Р<0,05, ** при Р<0,01
В серии исследований определена устойчивость к гипоксии у травмированных животных после 10 дневного курса терапии антиинсомническими препаратами. Назначение бензодиазепиновых снотворных не изменяло продолжительности жизни травмированных крыс, помещенных в гермокамеру. Напротив, применение небензодиазепиновых снотворных золпидема и зопиклона значительно повышало устойчивость травмированных животных к гиперкапнической гипоксии. Зопиклон и золпидем в малых дозировках увеличивали длительность резервного времени у крыс соответственно на 32% и 33,8% (Р< 0,05). Назначение препаратов в больших дозах позволило выявить высокую антигипоксическую активность у золпидема. В условиях гермокамеры антигипоксическая эффективность экстракта хмеля (10 мл/кг) была сопоставима с действием большой дозы золпидема (соответственно 64.5± 6,11 и 70,4 ± 8,12 мин.). Очевидно, зопиклон, золпидем и экстракт хмеля повышают устойчивость животных к гиперкапнической гипоксии, которая часто является фактором ВПМ в условиях черепно-мозговой травмы (Качков И.А. и др.,1999).
Вместе с тем, на фоне действия мелаксена и, особенно, дифенгидрамина отмечается тенденция к уменьшению продолжительности резервного времени.
При использовании другой модели гипоксических расстройств в посттравматическом периоде (гемической гипоксии) обнаружена низкая эффективность изученных снотворных препаратов. Если нитразепам и дифенгидрамин углубляли гипоксические нарушения, сокращая резервное время соответственно на 10,5% и 32% по сравнению с контролем, то мелаксен увеличивал время жизни травмированных животных на 33,7% (Р< 0,05).
Таблица 5
Влияние снотворных препаратов на электрошоковые судороги у крыс на 3 сутки посттравматического периода
| Группа и препарат | Доза (мг/кг) | Латентный период тонической экстензии (сек.) | Длительность тонической экстензии (сек.) | Защитный индекс абс. % |
| Интактная | – | 1,3±0,8 | 15,5±0,8 | 0/10 |
| Контрольная (крысы с ЧМТ) | – | 1.86±0.34 | 9.43±0.53 | 0/10 |
| Опытная 1 ЧМТ + нитразепам | 10 | 2,6 ± 0,27 | 6,6± 0,54** | 3/8 37,5% |
| Опытная 2 ЧМТ + феназепам | 10 | 2 ± 0,26 | 8,67± 0,49 | 2/8 25% |
| Опытная 3 ЧМТ + зопиклон | 7,5 | 2,1± 0,3 | 3,5± 0,4** | 8/11* 72,7% |
| Опытная 4 ЧМТ + золпидем | 10 | 0,83±0,37 | 8,8±0,58 | 1/6 16,7% |
| Опытная 1 ЧМТ + дифенгидрамин | 50 | 1,8±0,37 | 12,4±1,34 | 2/7 28,5% |
| Опытная 2 ЧМТ + мелаксен | 3 | 1,57±0,2 | 9,7±0,67 | 2/8 25% |
| Опытная 3 ЧМТ + экстракт хмеля | 10 мл/кг | 2,4±0,37 | 8,92±0,88 | 0/7 0 |
Примечание. Значимость различий интактная группа – контрольная группа и
контрольная группа - опытная группа: * – Р < 0,05, ** – Р < 0,01.
Изучение способности антиинсомнических препаратов предупреждать возникновение судорожных реакций у травмированных животных показало, что большинство препаратов не влияли на параметры реакции максимального электрошока. Судя по данным таблицы 5, в 1 неделю посттравматического периода лишь зопиклон в снотворной дозе предупреждает возникновение реакции тонической экстензии в 72,7% случаев.
Критерием достаточной клинической эффективности препаратов считается 50% уровень подавления реакции тонической экстензии в эксперименте (Воронина Т.А., Неробокова Л.Н., 2005). Остальные изученные гамкергические вещества подавляют реакцию максимального электрошока у 16,7 – 37,5% травмированных крыс. В случае возникновения реакции тонической экстензии нитразепам и зопиклон укорачивали ее длительность соответственно на 30% и 63% (Р< 0,01). Определение противосудорожной активности дифенгидрамина, мелаксена и экстракта хмеля не выявило изменений латентных периодов и продолжительности реакций тонической экстензии у травмированных крыс (таблица 5).
На 7 сутки после травмы гамк-миметик зопиклон с той же эффективностью подавлял возникновение судорожной реакции максимального электрошока. Его введение в 62,5% случаев угнетало возникновение реакции тонической экстензии у травмированных животных, а у остальных крыс на 73% уменьшало ее продолжительность (Р< 0,05). У остальных снотворных препаратов зафиксирован низкий защитный индекс (17-30%), не позволяющий считать их противосудорожный потенциал клинически значимым.
Следовательно, ранние посттравматические судороги эффективно предупреждает зопиклон. Его противосудорожный эффект развивается при использовании снотворных дозировок препарата.
В серии опытов посттравматические судорожные реакции моделировали на 2-й неделе посттравматического периода. Получены доказательства, что нитразепам, феназепам, золпидем, мелаксен и экстракт хмеля после 12-дневного введения препаратов подавляли судорожные ответы в 25-37,5% случаев. У остальных животных наблюдалось укорочение продолжительности реакции тонической экстензии на 55 - 75 % (Р< 0,01). Напротив, назначение дифенгидрамина и зопиклона подавляло реакцию тонической экстензии соответственно у 57,1% и 62,5% травмированных животных. Сопоставление эффективности зопиклона на 3, 7 и 12 сутки свидетельствует, что препарат в одинаковой степени способен подавлять возникновение ранних и поздних посттравматических судорог.
Исследование влияния препаратов на мнестические расстройства у травмированных крыс проведено на 6 сутки. По сравнению с интактными животными у них в 3 раза возрастало время пребывания в опасном отсеке. В еще большей степени нарушалось запоминание и воспроизведение УРПИ в группе травмированных крыс, которым после выработки УРПИ сразу наносили ЭШ. В этом случае продолжительность нахождения в «опасном» отсеке камеры возрастала почти в 9 раз (соответственно 10,5±1,5 и 87,9±9,15 сек., Р < 0,01).
Анализ параметров отсроченного на 1 час воспроизведения УРПИ указал, что нитразепам и дифенгидрамин в снотворных дозировках существенно не изменяли времени нахождения травмированных крыс в «опасном», неосвещенном отсеке камеры. Феназепам и золпидем уменьшали время пребывания крыс в «опасном» отсеке примерно на 46-48% (Р < 0,05). Вместе с тем, на фоне действия малых доз зопиклона, мелаксена и экстракта хмеля время нахождения в неосвещенном, «опасном» отсеке не отличалось от уровня интактных животных. Следовательно, эти препараты у травмированных животных полностью устраняют мнестические расстройства судорожного происхождения через 1 час после обучения (таблица 6).
Тестирование припоминания УРПИ через 7 суток после его выработки показало, что феназепам, нитразепам, золпидем и дифенгидрамин не влияли на частоту воспроизведения УРПИ. С другой стороны на фоне действия зопиклона, мелаксена и экстракта хмеля количество крыс, выполняющих условные ответы, возрастало на 42,8%, 40% и 57% (Р < 0,05).
Несмотря на отсутствие условных оборонительных ответов у остальных травмированных крыс мелаксен, нитразепам, феназепам и зопиклон примерно в одинаковой степени уменьшали время пребывания в «опасном» отсеке камеры.
Таблица 6
Показатели отсроченного воспроизведения энграмм УРПИ после сеанса обучения и нанесения электрошока в посттравматический период
| Группа животных | Доза препарата (мг/кг) | Показатели воспроизведения условной реакции пассивного избегания | |
| Время пребывания в опасном отсеке через 1 час (сек.) | Время пребывания в опасном отсеке через 7 суток (сек.) | ||
| Контрольная ЧМТ + ЭШ | – | 87,9±9,15** | 92,2±8,4** |
| Опытная 1 Нитразепам | 5 | 62,3±9,3 | 43.2±8,49* |
| Опытная 2 Феназепам | 5 | 46±9,68 | 50,25±7,2* |
| Опытная 3 Зопиклон | 2,5 | 6,7±0,88** | 48.7±7.58 * |
| Опытная 4 Золпидем | 5 | 47,8±12,7* | 28,6±2,6** |
| Опытная 5 Дифенгидрамин | 25 | 79,3±16.1 | 90,67±11,9 |
| Опытная 6 Мелаксен | 3 | 0 | 46,6±6.85** |
| Опытная 7 Экстракт хмеля | 10 мл/к | 0 | 36,3 ±7,9** |
Примечание. Значимость различий контроль – опыт: * – Р < 0,05; ** – Р < 0,01.
Более выраженное антиамнестическое действие установлено у экстракта хмеля и золпидема, которые существенно увеличивали время нахождения травмированных животных в «безопасном» отсеке камеры (таблица 6).
Таким образом, мнестические нарушения судорожного происхождения в посттравматический период эффективно устраняют мелаксен, золпидем, зопиклон и экстракт хмеля.
ВЫВОДЫ
1. В посттравматический период повышение устойчивости головного мозга крыс к влиянию ишемического фактора происходит в 1-е и 15-е сутки, к гипоксии – в 1-3-й день, к судорогам – в 1 – 6-е сутки. Снижение резистентности ЦНС к ишемии наблюдается на 6 день посттравматического периода, гипоксии – 10 день, судорогам – 15 день. Мнестические расстройства регистрируются, начиная с 3-их суток посттравматического периода.
2. У бензодиазепинов и производного имидазопиридина золпидема максимальная эффективность антиинсомнического действия установлена на 2 – 4-е сутки посттравматического периода с последующим снижением к 11 дню. Эффективность снотворного действия производного циклопирролона зопиклона и экстракта хмеля повышается на 2 неделе посттравматического периода. Мелаксен и дифенгидрамин вызывают сон у 100% животных в 1-ю неделю посттравматического периода и у 12-14% – во 2-ю неделю.
3.В посттравматический период выраженной антиишемической активностью обладают зопиклон и золпидем. Мелаксен повышает устойчивость травмированных животных к гемической гипоксии, а экстракт хмеля, золпидем и зопиклон-к гиперкапнической гипоксии. Зопиклон, предупреждает возникновение посттравматических судорог более, чем у половины животных в 1-ю и 2-ю неделю острого периода черепно-мозговой травмы.
Дифенгидрамин проявляет высокое противосудорожное действие во 2 неделю после травмы.
4. В условиях экспериментальной черепно-мозговой травмы золпидем оказывает умеренное антиамнестическое действие через 1 час и 7 суток после мнестических расстройств, вызванных травмой мозга и судорогами. Зопиклон, мелаксен и экстракт хмеля обладают более сильным протекторным эффектом.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
Выраженные нейропротекторные свойства золпидема, зопиклона и экстракта хмеля аргументируют целесообразность их дальнейшего изучения для профилактической терапии при травме мозга и профилактики стрессовой и травматической инсомнии.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1.Щелканова О.А., Колодий В.Л., Мудров В.А., Гаффарова Л.В., Казакова Т.А., Золотарев А.Е.,Верхотурова С.В. Сравнение седативных эффектов препаратов хмеля // Забайкальский медицинский вестник. 2009. №1.С.71-74.
2. Белозерцев Ф.Ю., Юнцев С.В., Запольская Ю.А., Колодий В.Л., Щелканова О.А., Белозерцев Ю.А. Сравнение антиишемической активности гамкергических препаратов в условиях локальной ишемии и травмы мозга // Забайкальский медицинский вестник. 2009. №3. С.7-9.
3. Колодий В.Л., Малышев С.В., Данзанов Г.Б., Запольская Ю.А., Сиднева Е.А., Щелканова О.А., Сластина Е.А. Сравнение антигипоксической активности снотворных и противосудорожных препаратов //Материалы 43-й Всероссийской научной конференции с международным участием студентов и молодых ученых «Актуальные проблемы теоретической, экспериментальной, клинической медицины и фармации». Тюмень, 2009. С. 29-30.
4. Колодий В.Л., Селиванова М.М., Запольская Ю.А., Дамбаева Д.Д., Рубцова Т.Ю., Щелканова О.А. Исследование антиишемической активности противосудорожных и снотворных препаратов //Материалы 64-й Всероссийской научно-практической конференции молодых ученых и студентов с международным участием «Актуальные вопросы современной медицинской науки и здравоохранения». Екатеринбург, 2009. С. 469-471.
5. Колодий В.Л., Смольяков Ю.Н., Запольская Ю.А., Щелканова О.А. Влияние гамк-позитивных препаратов на переработку информации в семантической памяти //Тезисы и доклады I Межрегиональной конференции студентов и молодых ученых с международным участием «Консолидация традиционной и академической медицины». Улан-Удэ, 2009. С. 110-112.
6. Белозерцев Ф.Ю., Запольская Ю.А., Щелканова О.А., Юнцев С.В. Антиишемическая активность гамк-позитивных препаратов //Вестник Российской военно-медицинской академии.2009. Т.6, № 25. С. 662.
7. Белозерцев Ф.Ю., Запольская Ю.А., Щелканова О.А., Белозерцев. Ю.А., Юнцев С.В. Динамика устойчивости мозга к факторам вторичного повреждения при черепно-мозговой травме //Вестник Российской военно-медицинской академии. 2009. Т.6, № 25. С. 662-663.
8. Белозерцев Ю.А.,Запольская Ю.А., Щелканова О.А., Белозерцев Ф.Ю. Динамика мнестических расстройств после черепно-мозговой травмы //Сборник материалов XVII Российского национального конгресса «Человек и лекарство». Москва, 2010. С. 557.
9. Щелканова О.А., Белозерцев Ф.Ю. Влияние золпидема, зопиклона и мелатонина на амнезию при черепно-мозговой травме//Сборник материалов XVII Российского национального конгресса «Человек и лекарство». Москва, 2010. С.748-749.
10. Щелканова О.А., Белозерцев Ф.Ю., Белозерцев Ю.А., Юнцев С.В. Анализ снотворного действия нитразепама, золпидема и мелаксена в остром периоде черепно-мозговой травмы //Экспериментальная и клиническая фармакология. 2010. №5. С. 97.

