Оглы реконструктивные операции при органической обструкции верхних мочевыводящих путей
На правах рукописи
ГУЛИЕВ БАХМАН ГИДАЯТ оглы
РЕКОНСТРУКТИВНЫЕ ОПЕРАЦИИ ПРИ ОРГАНИЧЕСКОЙ
ОБСТРУКЦИИ ВЕРХНИХ МОЧЕВЫВОДЯЩИХ ПУТЕЙ
14.00.40 - Урология
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Санкт-Петербург
2008
Работа выполнена на кафедре урологии Государственного образовательного учреждения высшего профессионального образования «Санкт-Петербургская государственная медицинская академия им. И.И.Мечникова» Федерального агентства по здравоохранению и социальному развитию Российской Федерации
Научный консультант:
доктор медицинских наук, профессор Комяков Борис Кириллович
Официальные оппоненты:
доктор медицинских наук, профессор Шпиленя Евгений Семенович
заслуженный деятель науки РФ
доктор медицинских наук, профессор Ткачук Владимир Николаевич
доктор медицинских наук, профессор Мартов Алексей Георгиевич
Ведущая организация: Государственное образовательное учреждение дополнительного профессионального образования «Российская медицинская академия последипломного образования» Федерального агентства по здравоохранению и социальному развитию Российской Федерации
Защита диссертации состоится «19» июня 2008 года в 13- 00 часов на заседании диссертационного совета Д 215.002.05 при Военно-медицинской академии им. С.М. Кирова (194044, Санкт-Петербург, ул. Академика Лебедева, д. 6).
С диссертацией можно ознакомиться в фундаментальной библиотеке Военно-медицинской академии им. С.М. Кирова.
Автореферат разослан «11» марта 2008 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Цвелев Юрий Владимирович
ВВЕДЕНИЕ
Актуальность проблемы. Своевременная диагностика и лечение больных с органической обструкцией мочеточников остается одной из наиболее сложных проблем современной урологии. Количество таких пациентов продолжает увеличиваться. Прежде всего это связано с расширением показаний к операциям на органах брюшной полости и забрюшинного пространства, а в онкологической практике – со стремлением любой ценой избавить пациента от опухоли (Кан Д.В.,1986; Лоран О.Б. и соавт., 1995; 2002; Петров С.Б., 2002; Selzman A.A., Spirnak J.P., 1998; Berkmen F. et al., 2000; Wang P.H. et al., 2001; Keith J., 2004 Lynch T.H. et al., 2005). За последние десятилетия повреждения мочевыводящих путей с последующим образованием рубцовых сужений обусловлены также широким внедрением эндоскопических методов лечения (Лоран О.Б. и соавт., 2000; Liu C.H. et al., 1997; Lekas A. et al., 2007; Yazdani M. et al., 2007). Как первичные, так и вторичные сужения мочеточников могут протекать бессимптомно, что со временем приводит к выраженным функциональным и морфологическим изменениям со стороны верхних мочевых путей (ВМП) и почек, когда выполнить органосохраняющую операцию уже не представляется возможным.
Обструкция лоханочно-мочеточникового сегмента (ЛМС) является одной из частых причин развития гидронефротической трансформации. Несмотря на хорошо разработанную технику этого вмешательства, до сих пор дискутабельным остается вопрос о методах оперативной коррекции ЛМС (Лопаткин Н.А., 1986, 1998; Григорян В.А., 1998; Мартов А.Г., 1993, 2001; Гудков А.В., Пугачев А.Г., 2007; Marcovich R. et al., 2003; Tan B.J. et al., 2005; Ost M.C. et al., 2005; Rassweiler J.J. et al., 2007; Eden C.G., 2007). Продолжается поиск наиболее оптимального способа создания пиелоуретероанастомоза после резекции ЛМС (Коган М.И. и соавт., 2005), в то же время в ряде случаев выполняются оперативные вмешательства без резекции измененного ЛМС (операции по методам Foley, Lichtenberg, Fenger и др.). В литературе имеются единичные публикации о гистохимических исследованиях ЛМС при гидронефротической трансформации (Chuang Y. et al., 2001; Kim D.S. et al., 2005; Kajbafzadeh A. et al., 2006). Эти работы не позволяют объективно прогнозировать результаты пластических вмешательств, что указывает на целесообразность проведения морфологических исследований резецированных ЛМС и биоптатов почек.
При стриктуре одного из мочеточников удвоенной почки продолжают выполнять межмочеточниковые анастомозы «бок в бок» (Лопаткин Н.А., Люлько А.В., 1987; Казимиров В.Г., Бутрин С.В., 2001; Schlussel R.N., Retik A.B., 1998; Horst M., Smith G.H., 2008). Однако данная операция порочна с точки зрения нормализации уродинамики, что требует разработки новых способов лечения больных с такой аномалией ВМП. Перспективной является идея использования мочеточника, оставшегося после нефрэктомии для замещения патологически измененного противоположного мочеточника. Данная методика пластики ВМП требует дальнейшей разработки, определения к ней показаний и противопоказаний.
Уретероцистоанастомоз (УЦА) в различных модификациях остается методом выбора при стриктурах тазового отдела мочеточника (Кан Д.В., 1968, 1986; Лопаткин Н.А., Пугачев А.Г., 1990; Motiwala H.G. et al., 1990; Ravi G. et al., 1993; Frank J.J., Smith J.A., 1997). При этом разными авторами используются экстравезикальный или трансвезикальный способы имплантации мочеточника в мочевой пузырь (МП) по антирефлюксной методике, которых в настоящее время предложено огромное количество (Кан Д.В., 1968; Лопаткин Н.А., Пугачев А.Г., 1990; Переверзев А.С., 2000; Джавад-Заде М.Д., Гусейнов Э.Я., 2004; Nickel J.C., 2000). Каждая клиника пропагандирует тот метод, которым она чаще всего пользуется на практике. Это объясняется отсутствием определенной тактики лечения больных со стриктурой тазового отдела мочеточника в зависимости от особенностей того или иного клинического случая. Недостаточно изучено влияние восстановительных операций на тазовом отделе мочеточника на функцию МП (Leissner J. et al., 2001; Christoph S. et al., 2002; Self Ch. et al., 2002).
Важным этапом развития оперативной урологии стало экспериментальное обоснование и внедрение в клиническую практику операций по замещению мочеточника различными сегментами желудочно-кишечного тракта (Комяков Б.К. и соавт., 2005; Новиков А.И., 2006; Стаховский Э.А. и соавт., 2007; Moreira S.G. et al., 2004; Chung B.I. et al., 2006). До сих пор продолжается дискуссия в отношении хирургической техники и выбора оптимального пластического материала. Тонкокишечная пластика мочеточника была внедрена в клиническую практику в 1940 году R.Nissen и в настоящее время получила заслуженное признание (Кан Д.В.,1968; Карпенко В.С.,2001; Стаховский Э.А. и соавт., 2007; Bonfig R. et al., 2004; Moreira S. et al., 2004; Chung B.I. et al., 2006; Hinev A. et al., 2007). Однако, такие основные этапы данной операции, как создание уретерокишечного и кишечно – пузырного анастомоза, транспозиция кишечной петли, остаются предметом дискуссии. До сих пор среди методов реконструкции не определено место аппендикоуретеропластики (Комяков Б.К. и соавт., 2003; Павлов В.Н. и соавт., 2007; De Greter P. еt al., 2000; Bartoletti R. еt al., 2002) и использование с этой целью желудка (De Toledo A.F., Carvalhal G.F., 2000; Muraishi O. et al., 2001; Austin P.F. et al., 2001). Отсутствуют данные о возможном использовании части желудка при лечении сочетанных заболеваний МП и мочеточников.
Наиболее частой причиной экстенсивных стенозов мочеточников являются опухоли малого таза и органов брюшной полости. Большинство таких пациентов погибают от постренальной олигоанурии и метаболических нарушений, а не от основного заболевания (Кан Д.В., Пронин В.И., 1988; Городецкий Е.А., 2006; Culkin D.J. et al., 1987; Lau M.W. et al., 1995). Единственной возможностью, позволяющей продлить им жизнь, являются различные методы надпузырного отведения мочи. В настоящее время основным и наиболее простым из них является чрескожная пункционная нефростомия (ЧПНС) (Goodwin W.E. et al., 1955; Barton D.P. et al., 1992; Lau M.W. et al., 1995; Wilson J.R. et al., 2005). Однако данное вмешательство подразумевает наличие постоянного наружного дренажа, необходимость регулярного ухода за ним, что значительно ухудшает качество жизни больных. Появление биосовместимых мочеточниковых стентов из полиуретана или силикона и нитиноловых эндопротезов позволило обеспечить внутреннее дренирование ВМП в течение длительного времени (Каприн А.Д. и соавт., 2006; Yossepowitch O. et al., 2001; Fromer D.L et al., 2002; Chung S.Y. et al., 2004; Jeong I.G. et al., 2007). Однако на сегодняшний день имеется довольно скромный опыт эндопротезирования мочеточника в единичных зарубежных клиниках (Barbalias G.A. et al.,1998, 2002; Lopez-Martinez R.A. et al., 1997; Burgos R.J. et al., 2004; Liatsikos E. et al., 2007), отсутствуют данные об отдаленных результатах такого рода оперативных вмешательств. Вместе с тем, при протяженной облитерации мочеточника технически не всегда удается установить стент или эндопротез. В таких случаях альтернативой является подкожное нефровезикальное шунтирование ВМП. В зарубежной литературе имеются единичные сообщения о таком способе паллиативного дренирования ВМП (Lingam K. et al., 1994; Nissenkorn I., Gdor Y., 2000; Schmidbauer J. et al., 2006). Отсутствуют данные о показаниях и противопоказаниях к различным способам паллиативного дренирования ВМП, не изучено качество жизни пациентов после подобных операций.
Таким образом, высокая частота больных с врожденными и приобретенными сужениями, облитерациями и дефектами мочеточников, их несвоевременная диагностика, а также не всегда успешные результаты реконструктивно-восстановительных операций на мочеточниках заставляют постоянно совершенствовать известные и искать новые способы восстановления целостности верхних мочевых путей, что и определяет актуальность нашей работы.
Цель исследования
Разработать эффективную тактику хирургического лечения больных с органической обструкцией мочеточников и улучшить результаты реконструктивных операций на верхних мочевыводящих путях.
Задачи исследования
- Обосновать целесообразность ранней коррекции и эффективность резекции сужений пиелоуретерального сегмента с позиции патогенеза заболевания и разработать критерии прогнозирования результатов данных операций.
- Разработать новые методы пластики мочеточников, модифицировать способ уретеросигмоанастомоза.
- Усовершенствовать методы уретероцистоанастомоза и способы антирефлюксной пересадки мочеточников.
- Обосновать выбор оптимального сегмента желудочно-кишечного тракта для реконструкции мочеточника.
- Изучить влияние реконструктивных операций на тазовом отделе мочеточника на функциональное состояние верхних и нижних мочевых путей.
- Разработать новый способ ортотопической цистопластики при сочетанной патологии мочевого пузыря и тазовых отделов мочеточников
- Установить показания и противопоказания к эндоскопическому лечению больных со стриктурами мочеточника трансплантированной почки и мочеточниково-кишечных анастомозов.
- Усовершенствовать существующие и разработать новые паллиативные способы дренирования верхних мочевыводящих путей при опухолевых обструкциях мочеточников различного генеза.
- Изучить ближайшие и отдаленные результаты оперативных вмешательств у больных с органической обструкцией мочеточников.
- Изучить качество жизни больных после различных способов паллиативного дренирования верхних мочевыводящих путей.
Научная новизна.
Впервые на большом и разнообразном клиническом материале определена современная тактика оперативного лечения больных с органической обструкцией мочеточников различной локализации. Разработаны новые способы формирования уретеросигмоанастомоза (патент на изобретение № 2183425 от 26.07.2001 г), хирургического лечения гидроуретеронефроза при полном удвоении почки и стриктуре мочеточника ее нижней половины (патент на изобретение № 2277386 от 10.06. 2006 г), уретероцистопластики при сочетанной патологии мочевого пузыря и тазовых отделов мочеточников (приоритетная справка № 2005117664 от 07.06.2005 г), хирургического лечения протяженных стриктур тазового отдела мочеточника (патент на изобретение № 2308893 от 27.10.2007 г)
Доказана целесообразность резекции пиелоуретерального сегмента при гидронефрозе с позиции его патогенеза. Проведены гистохимические исследования пиелоуретерального сегмента, отмечена возможность прогнозирования результатов пластических вмешательств в зависимости от полученных данных. Показана возможность и эффективность замещения различных отделов мочеточника червеобразным отростком. Впервые изучены морфологические изменения изолированного сегмента тонкой кишки, используемого для замещения мочеточника, проведено их сравнение с подобными данными, полученными после илеоцистопластики. Изучено влияние восстановительных операций на тазовом отделе мочеточника на функцию нижних мочевых путей. Разработаны и усовершенствованы способы паллиативного лечения больных с опухолевой обструкцией мочеточников. Впервые изучено качество жизни больных после различных способов паллиативного дренирования верхних мочевыводящих путей.
Практическая значимость.
Разработан оптимальный алгоритм диагностических исследований при органической обструкции мочеточников. С учетом степени нарушения уродинамики и анатомо-функционального состояния верхних мочевых путей даны конкретные рекомендации по выбору наиболее рационального оперативного пособия при сужениях различных отделов мочеточника. Определены критерии отбора больных для пластики мочеточника с использованием сегментов желудочно-кишечного тракта. Изучены результаты и осложнения, возникающие после реконструктивных операций на ВМП. Подтверждена возможность развития дисфункций нижних мочевых путей после восстановительных операций на тазовых отделах мочеточников, разработана этиопатогенетическая терапия этих осложнений. Широкое внедрение чрескожной пункционной нефростомии у больных с нарушением оттока мочи из почек и применение современных функциональных методов позволили объективно оценить резервные возможности ВМП и почек. Показана целесообразность резекции пиелоуретерального сегмента при его сужениях. Усовершенствована техника уретероцистоанастомоза, доказана эффективность экстравезикальных методов антирефлюксной пересадки мочеточника. Показана возможность и эффективность замещения различных отделов мочеточника не только подвздошной кишкой, но и червеобразным отростком. Разработаны и модифицированы способы внутреннего дренирования при опухолевых обструкциях мочеточников. Определены особенности предоперационной подготовки и послеоперационного ведения пациентов после реконструктивных операций на мочевыводящих путях с использованием сегментов желудочно-кишечного тракта.
Основные положения, выносимые на защиту.
- Резекция пиелоуретерального сегмента с пластикой по Хайнс-Андерсену является патогенетически обоснованным лечением больных с гидронефрозом. Прогностическими факторами результативности операции наряду с исходной стадией заболевания и функциональным состоянием почки, могут быть содержание эластина и коллагена в удаленном лоханочно-мочеточниковом сегменте и лоханке.
- Верхний уретеропиелоуретероанастомоз позволяет восстановить адекватный отток мочи при стриктуре мочеточника нижней половины удвоенной почки по одному неизмененному мочеточнику. При протяженных сужениях мочеточника методом выбора может быть использование нормального противоположного мочеточника удаленной почки.
- Наиболее частой причиной развития обструкции тазовых отделов мочеточников являются их ятрогенные повреждения во время хирургических вмешательств на органах брюшной полости и малого таза. Операцией выбора при стриктурах данной локализации является уретероцистоанастомоз.
- При протяженных дефектах одного или обоих мочеточников наиболее оптимальным является тонкокишечная пластика, которая при необходимости позволяет одновременно производить реконструкцию мочевого пузыря с сохранением самостоятельного мочеиспускания. При отборе больных для кишечной пластики необходимо учитывать не только анатомо-функциональное состояние почек и верхних мочевыводящих путей, но и органов желудочно-кишечного тракта.
- Аппендикоуретеропластика при условии наличия достаточно длинного червеобразного отростка на хорошо кровоснабжаемой и мобильной брыжейке является эффективным и малотравматичным способом пластики тазового отдела мочеточника с хорошими функциональными результатами.
- В единичных случаях, при наличии противопоказаний к кишечной пластике мочевых путей альтернативой может быть замещение мочеточника и мочевого пузыря сегментом желудка.
- Нарушения уродинамики нижних мочевых путей у больных с сужениями тазовых отделов мочеточников обусловлены не только аномалиями развития мочеполовой системы, заболеваниями и повреждениями позвоночника и центральной нервной системы, а также предшествующими, порой неоднократными, оперативными вмешательствами на органах малого таза.
- Эндоскопические способы лечения являются методом выбора при непротяженных сужениях пиелоуретерального сегмента и других отделов мочеточника, а также при стриктурах мочеточника пересаженной почки и уретерокишечных анастомозов.
- У больных с опухолевой обструкцией мочеточников, при невозможности выполнения радикальных операций, верхние мочевые пути можно дренировать с помощью различных паллиативных способов. Среди них наиболее перспективными являются эндопротезирование мочеточника и нефровезикальное шунтирование.
- При паллиативном дренировании верхних мочевых путей лучшие показатели качества жизни наблюдаются при внутренних методах отведения мочи по сравнению с наружными. При этом наилучшие данные качества жизни получены при эндопротезировании мочеточника по сравнению с нефровезикальным шунтированием.
Апробация работы.
Материалы диссертации доложены на III Дальневосточной конференции урологов (Владивосток, 2003); I съезде амбулаторных хирургов РФ (СПб., 2004); V Всероссийской научно-практической конференции с международным участием «Актуальные вопросы лечения онкоурологических заболеваний» (Обнинск, 2003), XXI Международном конгрессе по эндоурологии (Монреаль, 2003); V Российской школе урологов по оперативной и эндоскопической урологии (Москве, 2004); XXII Сирийском урологическом конгрессе (Алеппо, 2004); XXVII конгрессе Международной ассоциации урологов (Гонолулу, 2004); научно-практической конференции «Актуальные вопросы урологии. Заболевания предстательной железы. Новые технологии в урологии» (Абзаково, 2005); научно-практической конференции «Современные проблемы урогинекологии» (СПб., 2005); юбилейной межрегиональной научно-практической конференции «Современные подходы к лечению мочекаменной болезни у взрослых и детей (Ярославль, 2006); IV Международном конгрессе по реконструктивной урологии (Гамбург, 2006); XIV Международной научно-практической конференции «Достижения и перспективы в онкоурологии» (Харьков, 2006); научно-практической конференции «Актуальные вопросы урологии и гинекологии у взрослых и детей» (СПб., 2006); пленумах Правления Российского общества урологов (Сочи, 2003, Екатеринбург, 2006); научно-практической конференции, посвященной 75-летию медицинской службы ГУВД СПб и Ленинградской области (СПб., 2006); научно-практической конференции урологов Сибири (Томск, 2006); 3-й и 4-й Международных конференциях «Малоинвазивные методы диагностики и лечения в современной урологии» (СПб., 2006, 2007); XI съезде Всероссийского общества урологов (Москва, 2007), 865-м, 873-м, 879-м, 894-м, 898-м заседаниях Санкт-Петербургского научного общества урологов им С.П. Федорова (СПб., 2004, 2005, 2006, 2007, 2008); научно-практической конференции «Актуальные вопросы клинической и экспериментальной медицины – 2007» (СПб., 2007); Всероссийской научно-практической конференции «Проблемы хирургии в современной России» (СПб., 2007); заседании проблемно-экспертного совета СПбГМА имени И.И. Мечникова по хирургии и смежным специальностям (СПб., 2008).
Внедрение.
Разработанные в диссертации методы реконструктивных операций на мочевыводящих органах внедрены в практическую деятельность урологических отделений городских больниц №№ 2, 3, ЦМСЧ № 122 Санкт-Петербурга, Ленинградской областной клинической больницы, фтизиоурологического отделения НИИ фтизиопульмонологии, клиник урологии СПбГМА им. И.И. Мечникова и СПбГПМА. Результаты исследования используются в преподавании урологии в учебных программах лечебного факультета и при подготовке интернов, клинических ординаторов и усовершенствовании врачей-урологов по программе факультета последипломного образования на кафедре урологии СПбГМА имени И.И. Мечникова.
Публикации.
По теме диссертации опубликованы 83 научные работы, в том числе 21 в центральных периодических изданиях, рекомендованных ВАК РФ, издана одна монография, получено 3 патента и одна приоритетная справка на изобретение.
Объем и структура диссертации.
Диссертация изложена на 407 страницах, состоит из введения, обзора литературы, 7 глав собственных исследований, выводов, практических рекомендаций, указателя литературы и приложений. Работа иллюстрирована 58 таблицами, 104 рисунками. Библиографический указатель включает 524 источника, из них 140 отечественных и 384 иностранных.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Настоящее исследование основано на изучении результатов клинических наблюдений за 709 больными с органической обструкцией мочеточников различной этиологии, которые были оперированы и наблюдались в урологической клинике СПбГМА имени И.И. Мечникова на базе урологического отделения городской многопрофильной больницы № 2 с 1995 по 2007 год. 621 (87,6%) из них поступили в клинику в плановом порядке и 88 (12,4%) по экстренным показаниям, в связи с почечной коликой и обострением ХП. Мужчин было 284 (40,1%) и женщин – 425 (59,9%). Возраст больных колебался от 17 до 76 лет и в среднем составил 53,2 ± 4,6 года.
Первичные сужения мочеточников были диагностированы у 171 (24,1%) пациента, 20 (11,7%) из которых имели пороки развития почек и ВМП. Приобретенные сужения различных отделов мочеточников выявлены у 538 (75,9%) больных. Сужения пиелоуретерального сегмента диагностированы у 230 (32,4%), стриктура брюшного отдела мочеточника – у 91 (12,8 %), тазового – у 353 (49,8%) и тотальное поражение мочеточника – у 9 (1,3%) больных. Сужение мочеточника аллотранcплантированной почки было у 14 (2,0%) и стриктура уретерокишечного анастомоза после деривации мочи у 12 (1,7%) пациентов. Среди пациентов с приобретенными постоперационными стриктурами мочеточников основную долю составили 122 больных с ятрогенными повреждениями. Подавляющее большинство из них наблюдалось после акушерско-гинекологических вмешательств (76,2%), операций на сигмовидной и прямой кишке – (13,1%), протезирования брюшного отдела аорты и аортобедренного бифуркационного шунтирования – (6,6%). Короткие сужения мочеточника были выявлены у 316 (44,6%) и протяженные – у 393 (55,4%) больных. Единственная или единственно функционирующая почка имелась у 56 (7,9%) пациентов.
Всем больным проведено комплексное исследование органов мочевыделительной системы до и после операции, включающее в себя изучение жалоб, сбор анамнеза, лабораторные анализы, радионуклидные, рентгенологические и ультразвуковые исследования, в том числе ультразвуковую допплерографию сосудов почек, комплексное сосудистое исследование почек (ангиографию), спиральную компьютерную томографию. Кроме того, применялись инструментальные, эндоскопические, уродинамические и морфологические методы исследования. Больным после пластических операций на тазовых отделах мочеточников до и после операции выполняли комбинированное уродинамическое исследование нижних мочевыводящих путей. Полученные уродинамические показатели сравнивали со стандартными величинами здоровых лиц, учитывая рекомендации I.C.S. от 2002 г. При исследовании качества жизни у больных после паллиативных методов дренирования ВМП использовали опросный лист ECOG и шкалу Карновского. Отдаленные результаты хирургических вмешательств на ВМП оценивались по трехстепенной системе: хороший, удовлетворительный и плохой. Хорошим считали результат лечения, когда пациент чувствовал себя здоровым, жалоб не предъявлял, анализы мочи за все время наблюдения были нормальными. Рентгенологический контроль устанавливал полную проходимость мочеточника, значительное сокращение расширенных полостей почки и мочеточника, хорошее состояние паренхимы почки по данным ультразвукового исследования (УЗИ). По данным радионуклидных методов исследования определялось значительное улучшение или нормализация функции почки. Больные были трудоспособны. Удовлетворительным расценивали результат при отсутствии жалоб больного, сравнительном улучшении функции ВМП и почек, когда определялась умеренная лейкоцитурия, отсутствие или незначительное сокращение полостей почки и мочеточника. По данным УЗИ паренхима почки умеренно истончена. Трудоспособность больных сохранена или временно утрачена, когда они вынуждены прерывать работу в связи с периодическим лечением обострения хронического пиелонефрита (ХП). При плохом результате отмечается боль в поясничной области, субфебрильная температура, пиурия, рост микроорганизмов при посеве мочи. Клубочковая фильтрация снижена, часто наблюдается разной степени хроническая почечная недостаточность (ХПН). На экскреторной урограмме контрастирование полостной системы почки отсутствует или замедлено, чашечно-лоханочная система (ЧЛС) почки и мочеточник расширены. Слой паренхимы истончен, определяется рецидив стриктуры или пузырно-мочеточниковый рефлюкс (ПМР). Имеется стойкая потеря трудоспособности.
Для сравнения количественных данных в группах с нормальным распределением использовали критерий Стьюдента. При сравнении показателей, характеризующих клинико-лабораторное и функциональное состояние ВМП до и после операции, использовали критерий Вилкоксона. Если по критерию Вилкоксона М1 М2 (р<0,05), то изучаемые признаки относятся к разным генеральным совокупностям и достоверно влияют на исход оперативного лечения.
Результаты исследования и их обсуждение
Среди 709 больных с органическим поражением различных отделов мочеточников у 698 (98,4%) выявлены разной степени ретенционные изменения со стороны ВМП. Одностороннее нарушение уродинамики диагностировано у 556 (79,7%) пациентов, двухстороннее – у 142 (20,3%). Явления ХП, по данным обследования, имели место у 579 (81,7%) больных. Нарушение функции почек наблюдалось у 146 (20,6%), в том числе из них у 112 пациентов была выявлена латентная стадия ХПН, у 28 – компенсированная, и у 6 больных имелась интермиттирующая стадия ХПН.
Все пациенты были оперированы. В окончательном варианте пластические операции были выполнены 310 (43,7%), эндоскопические – 109 (15,4%), паллиативные и органоуносящие – 290 (40,9%) больным. Характер хирургических вмешательств, выполненных наблюдаемым нами больным, приведен в таблицах 1 и 2.
Таблица 1
Характер реконструктивных оперативных вмешательств, выполненных больным с органической обструкцией мочеточников
| Виды оперативных вмешательств | Количество больных | |
| абс. | % | |
| Резекция ЛМС с пластикой по Хайнс-Андерсену Пластика ЛМС по Калп-Де Вирд Резекция ЛМС с пластикой и истмотомией при подковообразной почке Уретерокаликоанастомоз по Нейверту Верхний уретеропиелоуретероанастомоз Люмбальный перекрестный уретероуретероанастомоз Операция Комякова-Гулиева Уретероуретероанастомоз Уретеросигмоанастомоз Прямой уретероцистоанастомоз Непрямой уретероцистоанастомоз Кишечная пластика мочеточников Аппендикоуретеропластика Аутотрансплантация почки | 138 3 6 10 4 3 3 10 7 32 57 24 10 3 | 19,5 0,4 0,8 1,4 0,5 0,4 0,4 1,4 1,0 4,6 8,1 3,4 1,4 0,4 |
| Всего | 310 | 43,7 |
Таблица 2
Характер эндоскопических, паллиативных и органоуносящих оперативных вмешательств, выполненных больным с органической обструкцией мочеточников
| Виды оперативных вмешательств | Количество операций | |
| абс. | % | |
| 46 6 17 14 14 12 | 6,5 0,8 2,4 2.0 2,0 1,7 |
| II. Паллиативные методы дренирования ВМП Пункционная нефростомия Уретерокутанеостомия Внутреннее стентирование мочеточника Эндопротезирование нитиноловым стентом Нефровезикальное шунтирование | 108 22 92 21 12 | 15,2 3,1 13,0 3,0 1,7 |
| III. Органоуносящие операции Открытая нефрэктомия Открытая нефруретерэктомия Лапароскопическая нефрэктомия | 11 18 6 | 1,5 2,6 0,8 |
| Всего | 399 | 56,3 |
Восстановительные операции с использованием собственных тканей мочевыводящих путей
Восстановительные операции на ВМП с использованием собственных тканей выполнены нами 276 (38,9%) пациентам. У 157 (56,7%) из них стриктура была локализована в ЛМС. С гидронефрозом мы наблюдали 230 больных, у 164 (71,3 %) из которых была установлена II стадия, у 45 (19,6%) – III стадия, а у 21 (9,1%) – IV стадия заболевания. Распределение больных с сужениями ЛМС в зависимости от этиологии приведены таблице 3.
Таблица 3
Причины обструкции лоханочно-мочеточникового сегмента у обследованных больных
| Причины сужения пиелоуретерального сегмента | Количество больных | |
| абс. | % | |
| I. Первичные стриктуры 1.1. Врожденные 1.2. Рубцовый процесс в области ЛМС 1.3. Сужение ЛМС на фоне нижнеполярного сосудистого пучка 1.4. Сужения мочеточника подковообразной почки II. Вторичные стриктуры 2.1. Рецидивные стриктуры пиелоуретерального сегмента 2.2. Сужения пиелоуретерального сегмента после пиелолитотомии 2.3. Сужения пиелоуретерального сегмента после перкутанной нефролитотрипсии | 68 55 22 6 24 49 6 | 29,6 23,9 9,6 2,6 10,4 21,3 2,6 |
| Всего | 230 | 100,0 |
Из 230 больных с сужениями ЛМС открытые хирургические вмешательства произведены 157 (68,3%), эндоскопические – 52 (22,6%) и органоуносящие – 21 (9,1%) пациенту. Выбор необходимого способа оперативной коррекции зависел от протяженности сужения, давности процесса, наличия нижнеполярного сосуда и функционального состояния пораженной почки. При первичных сужениях ЛМС, особенно при наличии нижнеполярного сосудистого пучка, выполняли резекцию измененного участка с последующим антевазальным пиелоуретероанастомозом на внутреннем стенте. Из открытых пластических вмешательств на ЛМС в 138 случаях выполнена стандартная резекция пиелоуретерального сегмента с пластикой по Хайнс-Андерсену. Для коррекции гидронефроза у 6 больных с подковообразной почкой наряду с резекцией структурно измененного ЛМС с пиелоуретероанастомозом по Хайнс-Андерсену требовалось также удаление почечного перешейка. У 3 пациентов выполнена пиелопластика ЛМС по лоскутной методике Кальп – Де Вирда. У 10 больных с протяженными сужениями ЛМС, когда не удавалось выполнить анастомоз лоханки и мочеточника, произведен уретерокаликоанастомоз по Нейверту. Данная операция применяется не так часто, поэтому необходимо помнить о некоторых ее особенностях. Среди них наиболее важным, на наш взгляд, является достаточное освобождение стенки нижней чашки от почечной паренхимы, что в последующем позволяет избежать механического сдавления анастомоза.
У 46 (20,0%) оперированных больных с сужением ЛМС для сравнения клинико-рентгенологических данных со структурными изменениями ЛМС и почечной паренхимы, а также прогнозирования результатов пластической операции производилось гистологическое и гистохимическое исследования измененного сегмента и биоптата из паренхимы почки. Наряду с измененным участком ЛМС изучали морфологию самой лоханки и нормального мочеточника ниже сужения. Контрольную группу составили 28 больных, которым выполнялась нефруретерэктомия по поводу небольших опухолей почки с нормальным ЛМС. Изучалось состояние апоптоза, процентное содержание мышечного компонента, коллагена и эластина в стенке ЛМС. Результаты гистохимических исследований приведены в таблице 4.
Таблица 4
Показатели гистохимических исследований пиелоуретерального сегмента
| Результаты гистохимических исследований | Сужение пиелоуретераль-ного сегмента (n – 46) | Контрольная группа (n – 28) | Р |
| 1. Индекс апоптоза гладкомышечного компонента Почечная лоханка Пиелоуретеральный сегмент Мочеточник | 4,68 ±0,18 5,74±0,22 3,86±0,16 | 3,54±0,12 | < 0,05 |
| 2. Содержание гладкомышечного компонента (%) Почечная лоханка Пиелоуретеральный сегмент Мочеточник | 35,54±2,52 30,06±2,64 41,84±3,46 | 50,34±1,21 | < 0,05 |
| 3. Коллаген (%) Почечная лоханка Пиелоуретеральный сегмент Мочеточник | 38,72±1,70 42,68±1,76 31,56±2,14 | 25,32±2,12 | < 0,01 |
| 4. Эластин (%) Почечная лоханка Пиелоуретеральный сегмент Мочеточник | 20,24±0,94 17,95±0,96 14,46±1,09 | 14,16±1,18 | < 0,001 |
Результаты данного исследования свидетельствует о том, что состояние стенки мочеточника ниже резецируемого ЛМС и лоханки после операции является важным фактором для предсказания исхода операции. Так, у пациентов с низким содержанием эластина в почечной лоханке, ЛМС и мочеточнике отмечались лучшие результаты спустя шесть месяцев после пиелопластики (p<0,001). Увеличение эластина в почечной лоханке и в мочеточнике указывало на снижение эластичности стенки лоханки и мочеточника и в этих случаях после резекции ЛМС наблюдались плохие результаты. Кроме того, существует тесная взаимосвязь между мышечным апоптозом и процентным соотношением коллагена и нитей эластина в различных пропорциях в области обструкции ЛМС. По-видимому, мышечный апоптоз играет побудительную роль в индуцировании последующих фиброзных изменений в зоне ЛМС.
Отдаленные результаты хирургического лечения гидронефроза изучали с помощью анализа жалоб, рентгенорадиологических и ультразвуковых исследований. Данные обследования ретроспективно сравнивали с морфологическими данными. Проведенные нами гистологические исследования резецированных ЛМС позволили выяснить, что в патогенезе рубцового стеноза ЛМС решающая роль принадлежит необратимым структурным изменениям. Данный факт являлся основанием для выполнения принципиально однотипных операций, направленных на резекцию порочно сформированного ЛМС и создание полноценного в морфофункциональном отношении анастомоза. Этим требованиям отвечает операция – резекция ЛМС с пластикой по Хайнс-Андерсену. При гистологическом исследовании были выявлены структурные изменения на уровне ЛМС в виде гипоплазии мышечного аппарата, концентрического склероза и дезорганизации мышечного аппарата и гипоплазия всех структур его стенки. Описанные структурные изменения были выявлены во всех случаях, независимо от наличия нижнеполярного сосуда, высокого отхождения мочеточника, его фиксированного перегиба, сужения или визуально неизмененного мочеточника. При гистологическом исследовании почечных биоптатов во всех случаях были выявлены признаки нефросклероза, а ХП диагностирован у 119 (86,2 %) из 138 больных. Выявленный нефросклероз являлся, видимо следствием не только повышенного гидростатического давления, но и исходом воспалительного процесса. Отдаленные результаты пластических вмешательств на ЛМС в зависимости от стадии гидронефроза, дооперационного функционального состояния почки приведены в таблице 5.
Таблица 5
Отдаленные результаты пластических операции на лоханочно-мочеточниковом сегменте (п – 138)
| Стадия гидронефроза | Результаты операций | |||||
| Хорошие | Удовлет-ворительные | Неудовлет-ворительные | ||||
| абс. | % | абс. | % | абс. | % | |
| 2 стадия | 92 | 66,7 | 10 | 7,2 | 2 | 1,4 |
| 3 стадия | 24 | 17,4 | 4 | 2,9 | 6 | 4,4 |
| Всего | 116 | 84,1 | 14 | 10,1 | 8 | 5,8 |
| Дооперационная функция почки | абс. | % | абс. | % | абс. | % |
| Более 50 % | 90 | 65,2 | 12 | 8,7 | – | – |
| 40 – 50 % | 20 | 14,5 | 3 | 2,2 | 1 | 0,7 |
| Менее 40 % | 4 | 2,9 | 1 | 0,7 | 7 | 5,1 |
| Всего | 114 | 82,6 | 16 | 11,6 | 8 | 5,8 |
Высокая эффективность (94,2%) выполненных нами операций обусловлена их патогенетичностью, так как удаляется измененный ЛМС и формируется пиелоуретеральный сегмент за счет полноценных в морфофункциональном отношении тканей, чем и обеспечивается существенное улучшение уродинамики. По данным гистохимических исследований именно у больных с неудовлетворительными результатами наблюдалось снижение процентного содержания гладкомышечных клеток в стенке лоханки, ЛМС и мочеточника, а количество коллагена и эластина наоборот увеличивалось.
Из остальных 119 больных, которым выполнялись реконструктивные операции с использованием собственных тканей МВП, показаниями к хирургическому лечению у 20 (2,8%) были сужения брюшного отдела мочеточника, у 89 (12,6%) – тазового отдела. Основной причиной органической обструкции ВМП у этих пациентов были ятрогенные повреждения мочеточников, большинство из которых наблюдались при акушерско-гинекологических операциях (76,2%), в особенности после экстирпации матки (41,0%) и операции Вертгейма-Мейгса (15,6%). Ятрогенными повреждениями во время хирургических вмешательств мы считаем случайную травму органов, сосудов и тканей, не являющихся объектом данной операции. Такой подход к трактовке ятрогении в хирургической практике позволяет нам провести четкую границу между ятрогенией и осложнениями, возникающими во время и после хирургических вмешательств.
Уретероуретероанастомоз был выполнен 10 больным с непротяженными стриктурами или при обнаружении ятрогенной травмы мочеточника интраоперационно. Осложнений после этих хирургических вмешательств мы не наблюдали, результаты операций были удовлетворительными. У четырех больных произошло ятрогенное повреждение мочеточника нижней половины полностью удвоенной почки. Им была выполнена пластика мочеточника по разработанному нами методу (патент на изобретение № 2277386 от 10.06.2006 г) с отведением мочи из верхней и нижней половин почки по одному неизмененному мочеточнику (рис.1, 2).
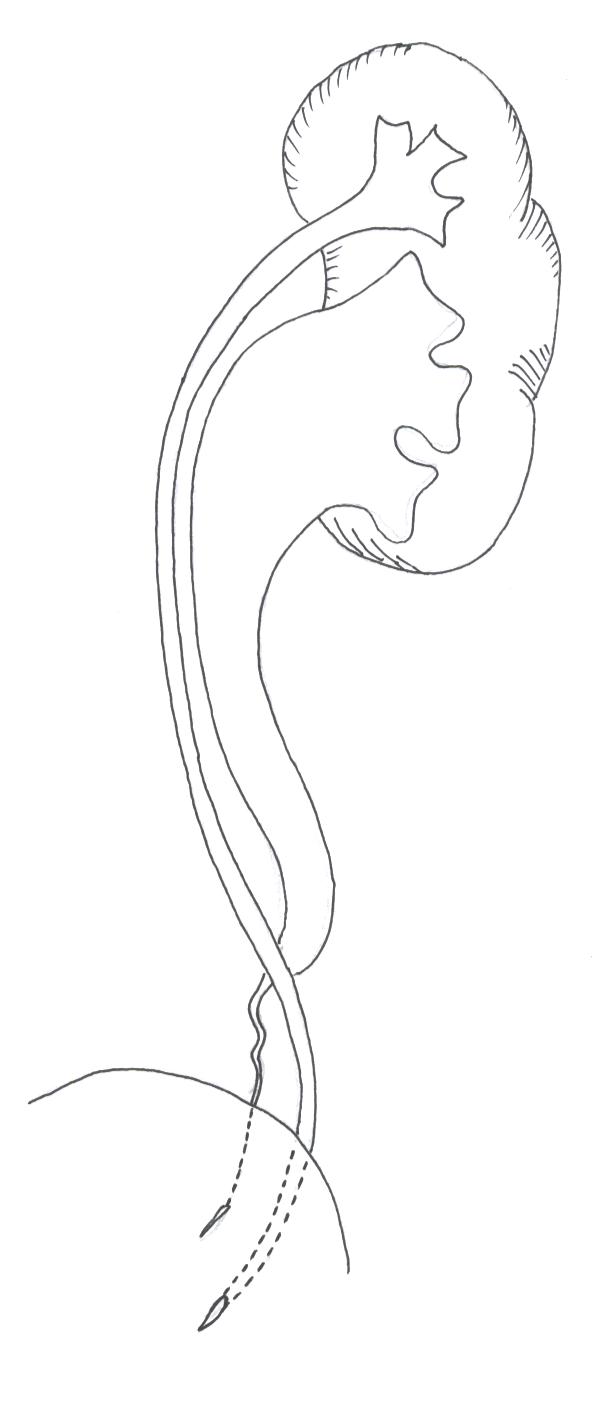

| Рис.1 Стриктура тазового отдела мочеточника нижней половины удвоенной почки | Рис.2 Схема операции. Отведение мочи из почки осуществляется по одному неизмененному мочеточнику |
При протяженных сужениях мочеточника для его полного или частичного замещения можно использовать здоровый контралатеральный мочеточник удаленной или нефункционирующей (недоразвитой) почки. Наиболее рациональным является использование мочеточника, оставшегося после нефрэктомии. Известно, что такой мочеточник остается неизмененным и может вернуться к нормальной функции спустя много лет после удаления почки. Техника данной операции заключается в чрезбрюшинной мобилизации мочеточника на протяжении поясничного отдела до перехода в тазовый отдел, где по возможности необходимо сохранить мочеточниковые сосуды. Далее спереди от магистральных сосудов формируется забрюшинный тоннель, и мочеточник проводится в противоположную сторону. Выделяется нижний полюс почки, лоханка и проксимальная часть мочеточника. На стенте выполняется уретеропиело- или уретероуретероанастомоз «конец-в-конец» (рис. 3, 4).


| Рис.3. Протяженная стриктура правого мочеточника. Оставшийся после нефрэктомии левый мочеточник не изменен | Рис.4. Правый мочеточник замещен нормальным левым |
Данное вмешательство было произведено нами 3 пациентам, у которых имелась протяженная стриктура правого мочеточника, обусловленная предыдущими операциями на нем, а левая почка была удалена в связи с вторичным нефросклерозом (2 больных) и пионефрозом (1 больной). Всем этим пациентам выполнено замещение пораженного мочеточника нормальным противоположным мочеточником. Результаты операции были успешными во всех случаях.
Основную группу больных, которым выполнялись реконструктивные вмешательства, составили 89 пациентов с сужениями тазовых отделов мочеточников. При этом короткие стриктуры были выявлены у 32 (36,0%), а протяженные – у 57 (64,0%) больных. В большинстве случаев причиной сужения тазовых отделов мочеточников явились ятрогенные повреждения, наступившие в процессе акушерско-гинекологических операций и хирургических вмешательств на толстой кишке. Анализ данной группы больных показал, что травма мочеточника в виде перевязки, пересечения или прошивания, как правило, возникала при попытке хирургов остановить кровотечение. Прямой УЦА с антирефлюксным механизмом был выполнен 32 пациентам. Использовали как трансвезикальную имплантацию мочеточника по Политано-Лидбеттеру (21 пациент), так и экстравезикальную, также с созданием подслизистого тоннеля (11 пациентов). Экстравезикальную имплантацию применяли в случаях, когда мочеточник выше сужения не был расширенным, отечным и ригидным. Данный метод, в отличие от операции по Политано-Лидбеттеру, более прост, сокращает время вмешательства, а МП наносится меньшая травма (таблица 6).
Таблица 6
Сравнительная характеристика методов имплантации мочеточников в мочевой пузырь
| Методы пересадки мочеточника | Кол-во боль-ных | Параметры оценки | |||
| Время операции (мин) | Средний койко-день | Ослож-нения (%) | Частота обезболи-вания | ||
| Трансвезикальный уретероцистанастомоз | 21 | 58 ±12 | 4,9 ± 1,0 | 5,6 ± 0,8 | 3,2 ± 0,8 |
| Экстравезикальный уретероцистанастомоз | 11 | 34 ± 13 | 3,0 ± 1,0 | 4,3 ± 0,7 | 2,5 ± 0,6 |
| Р | – | < 0,01 | < 0,01 | < 0,05 | < 0,01 |
Непрямой УЦА был выполнен 57 пациентам. В основном использовался внебрюшинный доступ (73,7%), который наиболее безопасен, исключает развитие перитонита и позволяет хорошо выделить мочеточник и МП для последующей пластической операции. У 15 (26,3%) пациентов непрямой УЦА выполняли чрезбрюшинным доступом. Нами проведен сравнительный анализ некоторых показателей, полученных после выполнения непрямого УЦА ретроперитонеальным и чрезбрюшинным доступами. При этом существенной разницы во времени операции, послеоперационном койко-дне и проценте развившихся осложнений между двумя доступами при выполнении непрямого УЦА не было. Наблюдалось небольшое различие в сроках дренирования МП уретральным катетером. Так при чресбрюшинном доступе МП дренировали в среднем в течение 6,7 ± 1,6 дней, а при ретроперитонеальном – 5,4 ± 1,1 дня. Однако и эта разница не была статистически достоверной (р > 0,05).
Одним из важных этапов непрямого УЦА является правильное формирование лоскута из МП. На наш взгляд, он должен отвечать следующим основным требованиям: иметь широкое основание для хорошего кровоснабжения и иннервации; быть достаточной длины, чтобы выполнить анастомоз без натяжения тканей и швов; иметь в своей части, обращенной к мочеточнику, достаточную площадку для формирования соустья с использованием антирефлюксных механизмов. Отдаленные результаты реконструктивных вмешательств на тазовом отделе мочеточника приведены в таблице 7.
Таблица 7
Отдаленные результаты после различных методов уретероцистоанастомоза
| Вид операции | Кол-во больных | Результаты операций | |||||
| Хорошие | Удовлет- ворительные | Неудовлет- ворительные | |||||
| абс. | % | абс. | % | абс. | % | ||
| Прямой УЦА | 32 | 24 | 75,0 | 6 | 18,8 | 2 | 6,2 |
| Непрямой УЦА | 57 | 47 | 82,4 | 7 | 12,3 | 3 | 5,3 |
| Всего | 89 | 71 | 79,8 | 13 | 14,6 | 5 | 5,6 |
Таким образом, эффективность прямого УЦА составила – 93,8 %, непрямого УЦА – 94,7 %. Общий успех после двух форм УЦА был получен у 94,4 % больных. В отдаленном периоде после различных вариантов УЦА у 3 (3,4%) пациентов была выявлена стриктура анастомоза. Им была произведена трансуретральная эндоуретеротомия со стентированием мочеточника. В 2 (2,2%) случаях наблюдался ПМР без клинических проявлений.
Интестинальная пластика мочеточников
Интестинальная пластика мочеточников выполнена 34 пациентам в возрасте от 28 до 69 лет. Для реконструкции у 24 больных использовали подвздошную кишку и у 10 – червеобразный отросток. Замещение сегментом тонкой кишки одного мочеточника произведено 14, двух – 10 больным. Длина пораженного дистального участка у всех пациентов составляла не менее 10 см и зона повреждения распространялась выше подвздошных сосудов. Тотальное одностороннее замещение мочеточника сегментом подвздошной кишки произведено у 3-х пациентов. Причины поражения мочеточников и варианты их тонкокишечной пластики представлены в таблице 8.
Таблица 8
Причины поражения мочеточников и варианты реконструктивных операций
| Причины поражения | Одно-сто-роннее (n – 14) | Варианты операций | Двусто-роннее (n – 10) | Варианты энтеро- пластики |
| Стриктура мочеточника неясного генеза | 2 | Энтеропластика вертикальной петлей | 2 | U – образная энтеропластика |
| Постлучевая стриктура | 4 | Энтеропластика вертикальной петлей | 1 | U – образная энтеропластика |
| Ятрогенные повреждения при хирургических вмешательствах | 5 | Энтеропластика вертикальной петлей | 6 | U – образная (4) S – образная (2) |
| Микроцистис, двусторонний гидроуретеро-нефроз | 2 | Нефрэктомия и аугментационная илеоцистопластика по Studer | 1 | Илеоцисто-пластика по Studer |
| Атония мочевого пузыря, двусторонний гидроуретеро-нефроз | 1 | Нефрэктомия и аугментационная илеоцистопластика по Studer | – | – |
При односторонней пластике длина изолированного отрезка кишки составляла от 20 до 30 см, при двусторонней – не более 40 см. Кишечные трансплантаты всегда располагали в брюшной полости. При кишечной пластике одного мочеточника стремились к изоперистальтическому расположению кишечного трансплантата. Это не вызывало сложностей при замещении левого мочеточника. При энтероуретеропластике справа после резекции тонкой кишки межкишечный анастомоз выполняли кзади от трансплантата, что относительно облегчало его изоперистальтическое расположение. У двух пациентов из-за короткой брыжейки не удалось повернуть сегмент кишечника вокруг оси на 180 и пришлось оставить его в антиперистальтическом положении. Уретеро-кишечные анастомозы располагались внебрюшинно, за исключением пациентов, которым производилась илеоцистопластика по методу Studer (4) и S–образная (2) энтероцистопластика. При вертикальной или U – образной пластике уретерокишечный анастомоз выполнялся «конец в конец», а при операции по Studer – «конец в бок» по методу Nesbit, в одном случае, при удвоении почки, по Wallace. С целью минимальной травматизации экстраперитонизацию МП мы не производили. Кишечно-пузырный анастомоз осуществлялся в области верхушки МП шириной не менее 5 см. В послеоперационном периоде только у одного из 10 больных с вертикальной илеоуретеропластикой наблюдался пузырно-лоханочный рефлюкс, у 6 – заброс мочи в кишечный сегмент. У 9 больных внутрилоханочное давление колебалось от 12,0 до 14,2 см водн. столба. Эти данные свидетельствуют о нецелесообразности выполнения антирефлюксного уретерокишечного анастомоза при интестинальной пластике мочеточника, тем более, что всегда существует опасность развития его стеноза. Нами проведено гистологическое исследование стенки кишки, выполняющей функцию мочеточника, у 12 пациентов. Влияние мочи на слизистую тонкой кишки было одинаковым у всех пациентов и характеризовалось атрофией ворсин, отеком стромы со смешанно-клеточной воспалительной инфильтрацией разной степени выраженности. Процессы воспаления и склерозирования в различных слоях кишки были наиболее активны в первые 6 месяцев после операции. В более поздние сроки слизистая постепенно адаптировалась к новым условиям, о чем свидетельствовало постепенное стихание воспалительного процесса. Замещения кишечного эпителия уротелием в течение наблюдения не наступало.
Аппендикоуретеропластика выполнена 1 мужчине и 9 женщинам. Кроме повреждения одного или обоих мочеточников одна пациентка имела пузырно-влагалищный свищ, другая – мочеточниково-кожный свищ. Одному больному по поводу протяженной стриктуры верхней трети правого мочеточника, развившейся после огнестрельного ранения, выполнена пластика верхней трети мочеточника. В одном случае замещен поясничный отдел правого мочеточника аппендиксом в комбинации с лоскутной операцией по Боари. Остальным восьми пациенткам произведено замещение нижней трети мочеточника – уретероаппендикоцистоанастомоз. В двух случаях впервые в России червеобразным отростком замещен тазовый отдел левого мочеточника. У семи пациенток аппендикоуретеропластика выполнялась по предложенной нами модифицированной методике (патент на изобретение ФИПС № 2308893 от 27.10.2007 г). Техника операции следующая: после мобилизации на брыжейке аппендикс резецируется вместе с окружающей его устье частью купола слепой кишки диаметром около 15 – 20 мм. Каудальная часть отростка резецируется на протяжении 20-25 мм. Таким образом, получается трансплантат на питающей ножке, состоящий из аппендикса с частью купола слепой кишки и имеющий сквозной просвет. Червеобразный отросток разворачивается для замещения мочеточника в изоперистальтическом направлении – центральным концом к МП (рис. 5). Выполняется анастомоз с дистальным концом мочеточника по типу «конец-в-конец» и широкий анастомоз округлой площадки из купола слепой кишки с МП.


а б
Рис. 5. Схема операции уретероаппендикоцистоанастомоза в нашей модификации. а - отсечение его на брыжейке вместе с частью купола слепой кишки; б - анастомозирование проксимального конца отростка с мочеточником, имплантация слепокишечной «площадки» в мочевой пузырь.
При использовании подвздошной кишки для замещения мочевыводящих путей в результате резорбции электролитов может развиться гиперхлоре-мический метаболический ацидоз, который наиболее часто возникает при ХПН. С этой точки зрения замещение мочеточника сегментом подвздошной кишки может представлять определенную опасность, особенно на фоне исходно имеющейся ХПН. Нами были изучены средние показатели кислотно-основного состояния и содержания электролитов в крови в раннем послеоперационном периоде и через 6 – 12 месяцев после тонкокишечной реконструкции мочеточников и их замещения аппендиксом. Полученные результаты свидетельствуют о том, что показатели кислотно-основного состояния и электролитного баланса крови больных в различные сроки после этих операций остаются в пределах нормы. Использование, как червеобразного отростка, так и петли подвздошной кишки длиной не более 30 см не приводит к метаболическим и электролитным нарушениям. Явлений метаболического ацидоза не наблюдается даже у пациентов с пассивным пузырно-кишечно-лоханочным рефлюксом и явлениями ХПН. Лишь у одной больной в раннем послеоперационном периоде после илеоуретеропластики наблюдался дефицит оснований до – 6,0, но затем этот показатель быстро нормализовался. Ранние послеоперационные осложнения при интестинальной пластике мочеточников возникли у 3 (8,8%) и поздние – у 7 (20,6%) больных.
Уродинамические исследования НМП были проведены до операции и после различных модификаций непрямого УЦА и кишечно-аппендикулярной пластики мочеточника через 3, 6 и 12 месяцев. Оказалось, что ухудшение основных показателей уродинамики наблюдалось до 12 месяцев после пластических операций. При этом умеренные нарушения функции МП выявлены после операций по методу Боари, а значительные при операции Демеля в сочетании с psoas-hitch. Это связано с тем, что при данном вмешательстве наряду с выкраиванием широкого и длинного лоскута из МП, производится его достаточная мобилизация и фиксация к m.psoas, что и обусловливает степень выраженности расстройств мочеиспускания. Так, объем МП после операции Боари уменьшался незначительно: с 475,1 ±18,8 мл до 406 ±18,8 мл, а при операции Демеля + psoas-hitch с 469,2 ± 8,1 мл до 348,2 ± 7,2 (р <0,05). Также отмечалось достоверное снижение объема возникновения первого позыва с 178,3 ± 5,9 мл до 132 ± 8,8 мл (р<0,05). При операции по Боари этот показатель снижался с 173,2 ± 11,8 мл до 148,2 ± 5,1 мл, что не было статистически достоверным. Но показатели уродинамики НМП в различные сроки после аппендикоуретеропластики и кишечного замещения мочеточников оставались такими же, как до операции. Достоверных изменений этих показателей мы не наблюдали. Поэтому в дальнейшем больных после этих двух видов операций объединили в одну группу и проводили сравнительную оценку между ней и пациентами, которым был выполнен непрямой УЦА. При этом спустя год после выполнения непрямого УЦА при более протяженных стриктурах тазового отдела мочеточника или двусторонних поражениях наблюдалось достоверное снижение емкости МП и объема возникновения первого позыва к мочеиспусканию. Максимальное давление в МП повышалось с 18,3± 3,2 до 27,8 ± 5,9 см H2O, увеличивалась частота мочеиспускания с 5,17 ± 0,24 до 7,75 ± 0,33. Данные уродинамические изменения, мы считаем, связаны с выкраиванием более широкого и длинного лоскута из МП, приводящим к ухудшению его функциональных показателей.
У семи пациентов при операции по Mainz II уретерокишечный анастомоз выполняли по антирефлюксной методике (патент на изобретение № 2183425 от 26.07.2001 г). При формировании резервуара нижние лоскуты рассеченной кишки сшивали между собой серозно-серозными швами. Интубированные мочеточники укладывали навстречу друг к другу на сформированную туннель на задней стенке резервуара, узловыми швами выполняли мочеточниково-кишечные анастомозы. Далее стенки кишки сшивали над мочеточниками и тем самым заканчивали создание серозного экстрамурального тоннеля. Последним этапом ушивали переднюю стенку создаваемого резервуара.
При заболеваниях МП, сопровождающихся протяженными сужениями тазовых отделов мочеточников, противопоказаниях к кишечной пластике мочевых путей, предложена операция по формированию артифициального МП из желудка по оригинальной методике (приоритетная справка ФИПС № 2005117664 от 07.06.2005 г). Из тела желудка на правых желудочно-сальниковых сосудах выкраивается лоскут в виде колбы, обращенной дном к его антральному отделу, проводится через мезоколон и брыжейку подвздошной кишки в полость малого таза. Далее выполняется желудочно-уретральный анастомоз, а мочеточники имплантируются в трубчатый лоскут. Данная операция позволяет одновременно заместить МП и тазовые отделы мочеточников.
Эндоскопическое лечение стриктур верхних мочевыводящих путей
Эндоскопическое лечение стриктур ВМП проведено 109 (15,4%) пациентам. Чрескожная эндоскопическая коррекция стриктур ЛМС и мочеточника выполнена 78 (71,6%) из них. У 31 (28,4%) больного проводилось ретроградное лечение сужения мочеточника (таблица 9).
Таблица 9
Причина и локализация стриктур лоханочно-мочеточникового сегмента и мочеточника у больных, подвергнутых эндоскопическому лечению
| Этиология | Количество больных | Локализация стриктур | |||||
| абс. | % | ЛМС | В/треть | С/треть | Мочеточник пересаженной почки | Мочет-кишеч. анаст-з | |
| Первичные | 21 | 19.3 | 16 | 3 | 2 | – | – |
| Вторичные | 88 | 80,7 | 45 | 12 | 5 | 14 | 12 |
| Всего | 109 | 100 | 61 | 15 | 7 | 14 | 12 |
При антеградном лечении стриктур ВМП положение больного и способ создания доступа к полостной системе почки были такими же, как при перкутанной нефролитотрипсии. После этого производилось рассечение суженного участка мочеточника «холодным» ножом через всю стенку до парауретеральной жировой ткани. Индикатором адекватного рассечения суженного участка являлся затек контрастного вещества при антеградной пиелоуретерографии. Устанавливался мочеточниковый стент с расширителем (6-7/12-14 Шр) и нефростомический дренаж. Эндоскопическое лечение урологических осложнений, развившихся после аллотрансплантации почки, проводилось у 14 (2,0%) пациентов. Им в различные сроки до развития подобных осложнений выполнялась пересадка трупной почки по поводу терминальной стадии ХПН, развившейся на фоне хронического гломерулонефрита (12 пациентов) и поликистоза почек (2 пациента). Успех оперативного лечения этих пациентов во многом определяется правильно проведенной предоперационной подготовкой. Одним из основных условий таковой является адекватная декомпрессия почки путем ЧПНС, которая была произведена 12 пациентам. Особенности выполнения данного вмешательства связаны с локализацией почки в подвздошной области, поэтому операция производилась в положении «на спине». ЧПНС позволяла разгрузить почку, выяснить ее функциональное состояние, провести противовоспалительную терапию. Все пациенты были оперированы. Им проводились различные эндоскопические вмешательства, направленные на устранение урологических осложнений трансплантации почки. У 12 больных операция производилась перкутанным, а у 2 – трансуретральным способом. Отдаленные результаты этих операций были эффективными у 11 (78,6%) пациентов. Остальным трем в связи с рецидивом стриктуры проводилось эндопротезирование мочеточника. У 12 (1,7%) больных с сужением мочеточниково-кишечного анастомоза произведена антеградная эндотомия с баллонной дилатацией суженного участка и дренированием ВМП стентом. Данная операция была успешной у 10 (83,3%) из 12 пациентов. На экскреторных урограммах, выполненных в различные сроки после операции, наблюдалась нормализация уродинамики ВМП или ее сравнительное улучшение. Из двух пациентов с неудовлетворительным результатом одному выполнено эндопротезирование анастомоза, другому – реимплантация мочеточника открытым доступом. В настоящее время в литературе описана техника ретроградного инвагинационного метода рассечения сужения мочеточниково-кишечного анастомоза. Однако мы, опираясь на свой большой опыт радикальной цистэктомии с кишечной пластикой, считаем наиболее оптимальным использование антеградного доступа. При отдаленном анализе 81 эндоскопического вмешательства (исключены больные со стриктурой мочеточника пересаженной почки и сужениями мочеточниково - кишечного анастомоза) в сроки от 6 до 36 месяцев хорошие результаты получены только у 61 (75,3%), удовлетворительные – у 12 (14,8%), неудовлетворительные – у 8 (9,9%) пациентов. Неудовлетворительные результаты в основном были получены у больных с первичными сужениями (14,3%), что связано с оставлением измененного ЛМС. У этих больных лоханка была внутрипочечной, поэтому у них целесообразнее лечение начинать с эндоскопических методов. В дальнейшем им выполнялись открытые реконструктивно-пластические операции.
Паллиативное дренирование верхних мочевыводящих путей
У 255 (36,0%) больных с органической обструкцией мочеточников применялись паллиативные методы дренирования ВМП. Основными показаниями к паллиативному дренированию у наших пациентов были опухолевая обструкция мочеточников с развитием ХПН и протяженные стриктуры или облитерации мочеточника, когда выполнение пластических операций было невозможным, а пациенты отказывались от нефрэктомии или имели единственную или единственно функционирующую почку. Причины органической обструкции мочеточников и методы паллиативного дренирования приведены в таблице 10.
Таблица 10
Характер паллиативных методов дренирования верхних мочевыводящих путей, выполненных больным с органической обструкцией мочеточников
| Причины обструкции мочеточников | Метод дренирования | ||||
| ЧПНС | Уретерокутанео-стомия | Мочеточ-никовый стент | Нитино-ловый стент | Нефро-вези-кальный шунт | |
| Рак мочевого пузыря Опухоли женских половых органов Рак прямой или сигмовидной кишки Рак предстательной железы Болезнь Бурневилля-Прингла Протяженные облитерации мочеточника | 25 66 10 7 – – | 22 – – – – – | – 80 7 5 – – | – 5 2 – 1 13 | – 6 3 2 – 1 |
| Всего | 108 | 22 | 92 | 21 | 12 |
ЧПНС обычно выполняли в положении больного на животе под ультразвуковым и рентгенологическим контролем. В некоторых случаях, когда пациент не мог лежать на животе, ЧПНС осуществляли в положении «на боку». Нефростомия была выполнена без осложнений у 89 (82,4%) из 108 пациентов. Незначительные осложнения наблюдали у 19 (17,6%) больных. Самым частыми из них были смещение дренажа и его обструкция, наблюдавшиеся у 8 из 19 (42,1%) пациентов. Для внутреннего дренирования использовали силиконовые или полиуретановые стенты. У пациентов с двусторонней обструкцией мочеточников производилось дренирование только одной, функционально наиболее сохранной, почки. При необходимости до установки стента проводилось бужирование мочеточника до 10 Шр. В дальнейшем больные находились под наблюдением, периодически выполнялось ультразвуковое исследование почек. Показанием к смене стента являлось расширение полостной системы почки, что указывало на плохую функцию стента вследствие инкрустации его солями. Длительное дренирование стентом было успешным у 78 (84,8%) пациентов. У 14 (15,2%) остальных больных из-за плохой переносимости (частые обострения хронического цистита) пришлось его удалить и выполнить ЧПНС. Перспективным способом дренирования ВМП, в особенности у онкологических больных, является протезирование мочеточника металлическими стентами, изготовляемыми из нитинола титана. При обструкции мочеточника мы использовали подобный стент у 21 больного. У семи больных причиной стеноза была опухоль прямой кишки (2) и рак шейки матки (5), поэтому эндопротез устанавливали в тазовый отдел мочеточника. У одной пациентки, у которой нарушение уродинамики было вызвано ангиолипоматозными узлами (болезнь Бурневилля-Прингла), металлический протез устанавливали в пиелоуретеральный сегмент единственной правой почки. У 13 пациентов имели место протяженные сужения брюшного отдела мочеточника (6), ЛМС (4) и мочеточника пересаженной почки (3). Во всех случаях была восстановлена проходимость мочеточника, которая сохранялась в течение всего периода наблюдения (6 – 62 мес) за этими больными. Но при этом на экскреторных урограммах отмечалось умеренное расширение ВМП выше эндопротеза, что мы объясняли его негативным влиянием на перистальтику мочеточника. Однако при протяженной облитерации мочеточника технически не всегда удается установить стент, а наличие наружных дренажей, необходимость постоянного ухода за ними и смены ухудшают качество жизни больных и их социальную адаптацию. При таких случаях альтернативой является экстраанатомическое субкутанное дренирование ВМП путем установки нефровезикальных стентов, которые мы применили у 12 больных: 11 с опухолевой обструкцией и 1 пациент с протяженной облитерацией мочеточника, развившейся после резекции аневризмы брюшного отдела аорты и двух пластических вмешательств на ВМП. У всех 11 пациентов с опухолевой обструкцией мочеточников была единственно функционирующая почка. Они поступали в экстренном порядке с явлениями уремии, поэтому для стабилизации их общего состояния предварительно выполняли ЧПНС. Нефровезикальное шунтирование производили в латеропозиции больного. Вначале пунктировали ЧЛС почки, расширяли свищ и устанавливали почечный конец шунта. Затем его подкожно проводили в надлобковую область. В двух случаях при использовании нефровезикального шунта диаметром 29 Шр и длиной 71,5 см выполняли цистотомию. У остальных пациентов дистальный конец шунта диаметром 8,5 Шр устанавливали пункционным способом. В сроки наблюдения от 3 до 18 месяцев только у одной больной диагностирована обструкция шунта вследствие сдавления прогрессирующей опухолью шейки матки. Он был удален, почка вновь дренирована нефростомой. У одного больного через 5 месяцев проводилась смена шунта.
Учитывая противоречивые данные о значимости ПМР, особенно при наличии стента в ВМП, нами определялось внутрилоханочное давление у больных после внутреннего стентирования и нефровезикального подкожного шунтирования. Этим пациентам ранее выполнялась ЧПНС для декомпрессии почки. Внутрилоханочное давление измеряли после ЧПНС, через 7 дней и 2 недели после операции при пустом МП и наполненном до максимального объема. Полученные результаты приведены в таблице 11.
Таблица 11
Показатели внутрилоханочного давления после стентирования мочеточника и нефровезикального шунтирования
| Вид дренирования верхних мочевых путей | Коли-чество боль-ных | Внутрилоханочное давление в см водного столба | ||||
| После ЧПНС | Через 7 дней | Через 2 недели | ||||
| Пустой МП | Макс. объем МП | Пустой МП | Макс. объем МП | |||
| Ретроградное стентирование мочеточника | 24 | 16,32 ± 0,15 | 17,30± 0,17 | 25,24 ± 0,14 | 16,90± 0,15 | 19,14 ± 0,16 |
| Нефровези-кальное шунтирование* | 8 | 16,11 ± 0,17 | 17,18 ± 0,15 | 25,25± 0,15 | 17,02± 0,14 | 19,55 ± 0,17 |
*– использовались нефровезикальные стенты 8,5 Шр
Из таблицы видно, что внутрилоханочное давление после двух форм дренирования ВМП при максимальном наполнении МП значительно возрастало по сравнению с аналогичными показателями до операции и при пустом МП (р < 0,05). Однако достоверной разницы между показателями внутрилоханочного давления до операции и при пустом МП в различные сроки после операции мы не наблюдали.
Качество жизни больных после паллиативных методов дренирования ВМП было изучено у 152 (59,6%) пациентов. Для этого использовали опросный лист ECOG и шкалу Карновского. Производился подсчет суммы средних баллов основных показателей качества жизни, результаты которых приведены в таблице 12.
Таблица 12
Средние показатели качества жизни больных после различных способов паллиативного дренирования верхних мочевыводящих путей
| Вид операции | Коли-чество больных | Общий статус | |
| по шкале Карновского, % | по критериям ECOG | ||
| ЧПНС | 52 | 68,5 ± 7,2 | 2 – 3 |
| Уретерокутанеостомия | 20 | 60,5 ± 5,4 | 2 – 3 |
| Стентирование мочеточника | 47 | 76,0 ± 7,4 | 1 – 2 |
| Эндопротезирование мочеточника | 21 | 84,5 ± 8,2 | 0 – 1 |
| Нефровезикальное шунтирование | 11 | 74,0 ± 7,0 | 1 – 2 |
Из таблицы видно, что уровень качества жизни при внутреннем дренировании ВМП гораздо лучше, чем при использовании постоянного нефростомического дренажа. Среди методов внутреннего дренирования лучшие показатели были получены при эндопротезировании мочеточника, а наихудшие – после стентирования полиуретановым стентом. Это было связано с необходимостью периодического выполнения цистоскопии для смены стента, а также с раздражением шейки МП дистальным концом стента, что отмечали многие пациенты. Таким образом по данным проведенного опроса, качество жизни больных после внутреннего дренирования ВМП было намного выше, чем у пациентов с постоянным нефростомическим дренажом (р < 0,05).
ВЫВОДЫ
- Гидронефроз обусловлен структурными изменениями пиелоуретерального сегмента, среди которых, независимо от наличия нижнеполярного сосудистого пучка, высокого отхождения мочеточника, сужения или визуально неизмененного пиелоуретерального сегмента, преобладают однотипные склеротические изменения различной распространенности и интенсивности, гипоплазия и дезорганизация мышечного аппарата. Процентное содержание коллагена и эластина в стенке лоханки и пиелоуретерального сегмента является достоверным показателем прогнозирования отдаленных результатов пластики пиелоуретерального сегмента. Резекция измененного пиелоуретерального сегмента с пластикой по Хайнс-Андерсену соответствует патогенетическим аспектам развития гидронефроза. Данная операция является наиболее эффективным способом лечения и позволяет достичь хороших и удовлетворительных результатов у 94,2 % больных с данной патологией.
- Разработанный метод оперативного лечения при полном удвоении верхних мочевыводящих путей и стриктуре тазового отдела мочеточника нижней половины почки позволяет восстановить адекватный отток мочи при данной аномалии по одному неизмененному мочеточнику. Неизмененный мочеточник удаленной или нефункционирующей почки можно использовать для замещения протяженных дефектов противоположного мочеточника. При формировании резервуара низкого давления по Mainz II методом выбора имплантации мочеточников является уретеросигмоанастомоз в нашей модификации.
- Ятрогенные повреждения мочевыводящих путей во время хирургических вмешательств на органах брюшной полости и малого таза, являются одной из частых причин развития обструкции мочеточников и мочеполовых свищей. Как правило, повреждаются тазовые отделы мочеточников. Операцией выбора при стриктурах данной локализации является уретероцистоанатомоз. Эффективность его зависит не только от функционального состояния верхних мочевыводящих путей и почки, но и от правильности выбранного метода уретероцистанастомоза, способа пересадки мочеточника и квалификации оперирующего хирурга.
- Изолированный сегмент подвздошной кишки является оптимальным пластическим материалом, позволяющим заместить протяженные дефекты одного или обоих мочеточников, а при необходимости одновременно выполнить реконструкцию мочевого пузыря с сохранением самостоятельного мочеиспускания. При отборе больных для кишечной пластики необходимо учитывать анатомо-функциональное состояние верхних мочевыводящих путей и почек, а также органов желудочно-кишечного тракта.
- Замещение мочеточника червеобразным отростком является тонким и кропотливым методом кишечной реконструкции, однако, при тщательном отборе больных, аккуратном соблюдении необходимых технических условий и приемов уретероаппендикоцистоанастомоз в нашей модификации становится наиболее эффективным и малотравматичным способом пластики тазового отдела мочеточника с хорошими функциональными результатами. Пластика мочеточника аппендиксом условно представляет собой его удлинение до мочевого пузыря. Таким образом, червеобразный отросток в роли трансплантата является, скорее, мочеточником, поэтому такое замещение можно назвать «идеальной» пластикой мочеточника.
- Анатомическое строение желудка позволяет использовать его для замещения мочевого пузыря и мочеточника. Выкраивание лоскута из его большой кривизны по предложенной нами методике позволяет выполнить реконструкцию мочевого пузыря и заместить дефекты нижних отделов мочеточников.
- Нарушения функции нижних мочевыводящих путей были выявлены у 17,1% больных после пластических операций по поводу стриктур тазовых отделов мочеточников, большинство из которых (62,0%) имело место при различных модификациях непрямого уретероцистанастомоза. Степень их зависела от величины и объема сформированного трубчатого лоскута и фиксации его к мышцам таза. Среди расстройств функции нижних мочевыводящих путей у больных с сужениями тазовых отделов мочеточников превалируют детрузорная гиперактивность и гипотония мочевого пузыря.
- Эндоскопические оперативные пособия являются современными малоинвазивными методами лечения больных со стриктурами различных отделов мочеточников. Показаниями к эндоскопическому лечению являются непротяженные сужения лоханочно-мочеточникового сегмента и мочеточника без выраженных нарушений уродинамики верхних мочевыводящих путей, а также стриктуры мочеточника пересаженной почки и уретерокишечных анастомозов.
- Органические обструкции верхних мочевыводящих путей, обусловленные сдавлением мочеточников местнораспространенными опухолями органов малого таза и брюшной полости, являются показаниями к различным методам паллиативного дренирования почек. Среди наружных методов отведения мочи чаще применяется пункционная нефростомия, которая является малотравматичной, эффективной, практически не имеющей противопоказаний операцией. Из внутренних методов дренирования верхних мочевыводящих путей стентирование мочеточника остается наиболее распространенным и простым. При невозможности выполнения внутреннего стентирования показано эндопротезирование мочеточника или подкожное нефровезикальное шунтирование.
- Паллиативное дренирование верхних мочевых путей при опухолевых обструкциях мочеточников позволяют улучшить не только общее состояние больных, но и качество их жизни. При этом наиболее оптимальные показатели качества жизни отмечались при внутренних методах дренирования мочи по сравнению с наружными формами отведения (р < 0,05). Среди внутренних методов дренирования верхних мочевыводящих путей наилучшие данные качества жизни получены при эндопротезировании мочеточника по сравнению с нефровезикальным шунтированием (р < 0,01).
Практические рекомендации.
- При пластических операциях по поводу стриктуры пиелоуретерального сегмента оптимальным является внутреннее дренирование верхних мочевыводящих путей с помощью стента.
- При нефрэктомии, особенно в сочетании с патологией контралатеральной почки, целесообразно максимально оставлять мочеточник, который в дальнейшем может быть использован для замещения противоположного.
- При кишечной или аппендикулярной пластике мочеточника используемый сегмент желудочно-кишечного тракта лучше оставлять в брюшной полости, что является для него более физиологичным.
- При кишечной пластике мочеточника удвоенной почки уретерокишечный анастомоз целесообразнее выполнять по методу Wallace.
- При выполнении пластических операций на тазовых отделах мочеточников необходимо учитывать не только состояние верхних мочевыводящих путей, но и анатомо-функциональные особенности мочевого пузыря.
- Эндоскопическую коррекцию сужений мочеточника пересаженной почки и стриктур уретерокишечных анастомозов целесообразно проводить антеградным перкутанным доступом.
- Восстановление уродинамики верхних мочевыводящих путей происходит в течение первого года после реконструктивно-восстановительной операции, что диктует необходимость диспансерного наблюдения за такими больными в течение указанного периода.
- Чрескожную пункционную нефростомию под ультразвуковым контролем следует шире выполнять при нарушении уродинамики верхних мочевыводящих путей и функционального состояния почек вследствие послеоперационной обструкции мочеточников. Применение её расширяет возможности диагностических исследований, позволяет быстро осуществить декомпрессию почки, купировать обострение хронического пиелонефрита и уменьшить число осложнений.
- Эндопротезирование мочеточника можно выполнять как перкутанным, так и трансуретральным доступом. Установку эндопротеза необходимо проводить под рентгенологическим контролем, при этом длина нитинолового протеза должна быть больше на 1,0 см дистальнее и проксимальнее зоны сужения.
- Внутренние способы дренирования верхних мочевыводящих путей обеспечивают лучшее качество жизни больным с опухолевой обструкцией мочеточников. При невозможности внутреннего стентирования мочеточника показано нефровезикальное шунтирование почки.
- Нефровезикальное шунтирование целесообразно выполнять в латеропозиции. Данное положение больного позволяет установить вначале почечный конец шунта, а затем, не меняя положение, и дистальный конец. При этом пузырный конец шунта также можно устанавливать пункционным способом.
Список печатных работ, опубликованных по теме диссертации
- Комяков Б.К., Гулиев Б.Г., Алхадж М.А. Эндоскопическое лечение коротких стриктур мочеточника //III Дальневосточная конференция урологов «Избранные вопросы урологии и андрологии. Диагностика и лечение». Материалы. Владивосток, 2003. – С. 38 – 39.
- Комяков Б.К. Новиков А.И., Гулиев Б.Г., Идрисов Ш.Н., Лебедев М.А., Мангушло А.А Пункционная нефростомия в лечении обструктивной уропатии при новообразованиях малого таза. //Современные направления в диагностике, лечении и профилактике заболеваний: Труды ГМПБ № 2 г. Санкт-Петербурга. Выпуск II. – СПб., «Ольга», 2003. – С. 228 – 230.
- Комяков Б.К., Новиков А.И., Гулиев Б.Г., Идрисов Ш.Н., Сергеев А.В., Лебедев М.А., Попов С.В., Мангушло А.А Функциональные исследования верхних мочевых путей при обструктивной уропатии. //Современные направления в диагностике, лечении и профилактике заболеваний: Труды ГМПБ № 2 г. Санкт-Петербурга. Выпуск II. – СПб., «Ольга», 2003. – С. 235 – 237.
- Комяков Б.К., Новиков А.И., Гулиев Б.Г., Лебедев М.А. Оперативное лечение повреждений верхних мочевых путей в акушерской и гинекологической практике. //Современные направления в диагностике, лечении и профилактике заболеваний: Труды ГМПБ № 2 г. Санкт-Петербурга. Выпуск II. – СПб., «Ольга», 2003. – С. 237 – 240.
- Komjakov B.K. Novikov A.I., Gouliev B.G., Sergeev A.V., Ode M. Percutaneous treatment of ureterointestinal anastomotic strictures following urinary diversion. //J. Endourol. – 2003. – Vol. 17, № 7 (Suppl. 1). – P. 236 – 237.
- Комяков Б.К., Новиков А.И., Идрисов Ш.Н. Гулиев Б.Г., Эндоскопическое лечение опухолей верхних мочевых путей. //V Всероссийская научно-практическая конференция с участием стран СНГ «Актуальные вопросы лечения онкоурологических заболеваний». Материалы. – Москва, 2003. – С.76 – 77.
- Комяков Б.К., Горелов А.И., Новиков А.И., Жолобов В.Е., Идрисов Ш.Н., Гулиев Б.Г., Попов С.В., Лебедев М.А. Эндоскопические методы исследования верхних мочевыводящих путей. //Метод. рекомендации. СПб, 2003. – 20 с.
- Комяков Б.К. Горелов А.И., Новиков А.И.. Горелов С.И., Гулиев Б.Г., Рябинов Е.В., Прохожев А.Ю. Пересадка мочеточников в сигмовидную кишку. //Метод. рекомендации. СПб, 2003. – 20 с.
- Komjakov B.K. Novikov A.I., Gouliev B.G., Dorofeev S.Y., Al-Issa A.M., Lebedev M.A. Results of intestinal reconstruction of ureter. //22nd annual congress of Syrian urological society. Abstracts. Aleppo, 2004. – P. 6.
- Комяков Б.К., Идрисов Ш.Н., Новиков А.И. Гулиев Б.Г. Оперативное лечение эпителиальных опухолей верхних мочевых путей. //Урология. – 2004. – № 4. – С. 12 – 16.
- Комяков Б.К., Гулиев Б.Г., Аль-Исса А. Дорофеев С.Я. Функциональное состояние нижних мочевых путей при восстановительных операциях на тазовом отделе мочеточника. //Современные направления в диагностике, лечении и профилактике заболеваний: Труды ГМПБ № 2 Санкт-Петербурга. Выпуск III. – СПб., «Ольга», 2004. – С. 202 – 206.
- Комяков Б.К., Гулиев Б.Г., Новиков А.И., Лебедев М.А., Аль-Исса А. Использование различных сегментов кишечника в реконструкции мочеточника. //Современные направления в диагностике, лечении и профилактике заболеваний: Труды ГМПБ № 2 Санкт-Петербурга. Выпуск III. – СПб., «Ольга», 2004. – С. 196 – 202.
- Комяков Б.К., Гулиев Б.Г., Новиков А.И., Дорофеев С.Я., Лебедев М.А. Оперативное лечение повреждений мочевых путей и их последствий в акушерско-гинекологической практике. //Акушерство и гинекология. – 2004. – № 6. – С. 39 – 42.
- Новиков А.И., Гулиев Б.Г., Аль-Исса А., Лебедев М.А. Пластика мочеточника кишечными сегментами. // Проблемы укрепления здоровья и профилактика заболеваний. //Под ред. акад. РАМН А.В. Шаброва, проф. В.Г. Маймулова. – СПб., СПбГМА им. И.И. Мечникова, 2004. – С. 204 – 205.
- Komjakov B.K., Gouliev B.G., Novikov A.I., Rodygin L. Appendix interposition of the ureter. //BJU Int. – 2004. – Vol. 94 (suppl. 2). – P. 297.
- Komjakov B.K., Gouliev B.G. A new method for long-segment lumbar ureteral replacement. //BJU Int. – 2004. – Vol. 94 (suppl. 2). – P. 297.
- Komjakov B.K., Gouliev B.G., Novikov A.I., Atmadschev D., Prohozhev A., Darienko R. Using the segment of stomach in urinary tract surgery. //BJU Int. – 2004. – Vol. 94 (suppl. 2). – P. 167.
- Комяков Б.К.. Гулиев Б.Г., Дорофеев С.Я., Аль-Исса А. Уродинамика нижних мочевых путей при восстановительных операциях на тазовом отделе мочеточника. // Вестник СПбГМА им. И.И. Мечникова. – 2004. – № 2.– С. 82 – 85.
- Гулиев Б.Г. Восстановительные операции при стриктурах тазового отдела мочеточника. // Вестник СПбГМА им. И.И. Мечникова. – 2004. – № 4. – С. 173 – 177.
- Комяков Б.К.. Гулиев Б.Г., Попов С.В. Эндоскопическое лечение камней мочеточников. //Эндоскопическая хирургия. – 2004. – № 4. – С. 47 – 52.
- Комяков Б.К. Гулиев Б.Г., Горелов Д.Н., Насыров Д. Внутреннее дренирование верхних мочевыводящих путей при опухолевых обструкциях мочеточников. //Материалы конференции «Онкологическая урология: от научных исследований к клинической практике (современные возможности диагностики и лечения опухолей предстательной железы, мочевого пузыря и почки). – М., 2004. – С. 181.
- Комяков Б.К., Гулиев Б.Г., Новиков А.И., Лебедев М.А. Диагностика и лечение ятрогенных повреждений мочевых путей в акушерско-гинекологической практике. // Амбулаторная хирургия. «Амбулаторная гинекология». – 2004. – №3 (15). – С. 56 – 58
- Гулиев Б.Г., Дорофеев С.Я.. Диспансеризация больных после пластических операций на мочеточниках. // Амбулаторная хирургия. «Материалы I съезда амбулаторных хирургов РФ 18-19 ноября 2004 года». – 2004. – №4 (16). – С. 67
- Комяков Б.К., Гулиев Б.Г. Отдаленные результаты реконструктивных вмешательств при протяженных стриктурах мочеточников. // Амбулаторная хирургия. «Материалы I съезда амбулаторных хирургов РФ». – 2004. – №4 (16). – С.104 – 105.
- Комяков Б.К., Гулиев Б.Г. Эндоскопическое лечение урологических осложнений трансплантации почки. // Эндоскопическая хирургия. – 2005. – № 2. – С. 13 – 16.
- Комяков Б.К., Новиков А.И., Гулиев Б.Г., Зубань О.Н., Атмаджев Д.Н. Дариенко Р.О. Замещение протяженного дефекта мочеточника червеобразным отростком. // Вестник хирургии им. Грекова. – 2005. – Т.164, № 2. – С. 73 – 76.
- Комяков Б.К., Идрисов Ш.Н., Гулиев Б.Г., Эль-Аттар Т.Х., Карлов П.А. Хирургическое лечение опухолей почечной лоханки и мочеточника. // Здравоохранение Башкортостана, специальный выпуск № 3.-«Актуальные вопросы урологии. Заболевания предстательной железы. Новые технологии в урологии». – 2005. – С.190 – 192.
- Комяков Б.К., Гулиев Б.Г. Пластика протяженной стриктуры поясничного отдела мочеточника: новое решение. //Здравоохранение Башкортостана, спец. выпуск № 3. – «Актуальные вопросы урологии. Заболевания предстательной железы. Новые технологии в урологии». – 2005. – С. 283 – 285.
- Комяков Б.К., Гулиев Б.Г., Новиков А.И., Дорофеев С.Я., Лебедев М.А., Аль-Исса А. Наш опыт замещения мочеточников участком подвздошной кишки и червеобразным отростком. //Здравоохранение Башкортостана, спец. выпуск № 3. – «Актуальные вопросы урологии. Заболевания предстательной железы. Новые технологии в урологии». – 2005. – С. 285 – 287.
- Гулиев Б.Г. Использование металлических стентов при лечении стриктур мочеточников. //Здравоохранение Башкортостана, спец. выпуск № 3. – «Актуальные вопросы урологии. Заболевания предстательной железы. Новые технологии в урологии». – 2005. – С. 276 – 278.
- Комяков Б.К., Гулиев Б.Г., Новиков А.И., Лебедев М.А. Аль-Исса А. Интестинальная пластика мочеточника. //Урология. – 2005. – № 2. – С. 24 – 28.
- Комяков Б.К., Гулиев Б.Г. Риск, причина и предупреждение органической обструкции мочеточников (обзор литературы). //Урология. – 2005. – № 3. – С. 66 – 69.
- Комяков Б.К., Новиков А.И., Гулиев Б.Г., Дорофеев С.Я., Зубань О.Н. Атмаджев Д.Н. Восстановление мочевыводящих путей различными отделами желудочно-кишечного тракта. //Урология. – 2005. – № 5. – С. 12 – 17.
- Комяков Б.К., Гулиев Б.Г., Новиков А.И. Эндопротезирование мочеточника единственной почки при болезни Бурневилля - Прингла, осложненной гидронефрозом. //Урология. – 2005. – № 6. – С. 49 – 51.
- Гулиев Б.Г. Результаты реконструктивных операций при стриктурах пиелоуретерального сегмента. //Вестник СПбГМА им. И.И. Мечникова. – 2005. – № 5. – С. 157 – 160.
- Комяков Б.К., Гулиев Б.Г., Дорофеев С.Я., Лебедев М.А. Оперативное лечение мочеточниково-влагалищных и пузырно-влагалищных свищей. //Научно-практическая конференция «Современные проблемы урогинекологии». Материалы. СПб., 2005.– С. 7 – 8.
- Комяков Б.К., Гулиев Б.Г., Новиков А.И., Дорофеев С.Я., Лебедев М.А., Аль- Исса А. Хирургическое лечение последствий ятрогенных повреждений мочеточников у женщин. //Научно-практическая конференция «Современные проблемы урогинекологии». Материалы. СПб., 2005.– С. 17 – 18.
- Идрисов Ш.Н., Гулиев Б.Г., Комяков Б.К., Карлов П.А. Возможность органосохраняющего лечения опухолей почечной лоханки и мочеточника. //Российская онкологическая конференция «Методы диагностики и лечения онкоурологических заболеваний». Материалы. СПб., 2005. – С.4 –5.
- Комяков Б.К., Гулиев Б.Г., Аль-Исса А. Эндоскопическое лечение камней почки и мочеточника у больных перенесших уретероцистанастомоз. //Юбилейная межрегиональная научно-практическая конференция «Современные подходы к лечению мочекаменной болезни у взрослых и детей». Тезисы докладов. Ярославль, 2006. – С. 31 –32.
- Комяков Б.К., Гулиев Б.Г., Давранов А.Д. Нефровезикальное шунтирование – новый метод дренирования почек. //3-я международная конференция «Малоинвазивные методы диагностики и лечения в современной урологии». Сборник трудов. СПб., 2006. – С. 92 – 93.
- Комяков Б.К.Гулиев Б.Г., Попов С.В., Нечаев И.И. Малоинвазивная хирургия стриктур мочеточника, осложненных уролитиазом. //3-я международная конференция «Малоинвазивные методы диагностики и лечения в современной урологии». Сборник трудов. СПб., 2006. – С. 94 – 95.
- Гулиев Б.Г. Внутреннее дренирование при обструкции мочеточников у онкологических больных. //XIV научно-практическая конференция урологов с международным и межрегиональным участием «Современные достижения онкоурологии». Материалы. Харьков, 2006. – С. 123 – 124.
- Комяков Б.К., Гулиев Б.Г., Давранов А.Д., Эль-Аттар Т.Х. Обходное субкутанное нефровезикальное дренирование при опухолевой обструкции мочеточников. //XIV научно-практическая конференция урологов с международным и межрегиональным участием «Современные достижения онкоурологии». Материалы. Харьков, 2006. – С. 125 – 127.
- Гулиев Б.Г., Ал-Исса А. Влияние восстановительных операций на тазовом отделе мочеточника на уродинамику нижних мочевыводящих путей. //Конференция, посвященная 145-летию ФГУ «Северо-Западный окружной медицинский центр Федерального агентства по здравоохранению и социальному развитию» Современные диагностические и лечебные технологии в многопрофильной клинике. Материалы. СПб., 2006. – С. 58 – 59.
- Дорофеев С.Я., Гулиев Б.Г. Замещение дефектов мочеточника сегментами кишечного тракта. //Конференция, посвященная 145-летию ФГУ «Северо-Западный окружной медицинский центр Федерального агентства по здравоохранению и социальному развитию» Современные диагностические и лечебные технологии в многопрофильной клинике. Материалы. СПб., 2006. – С. 66– 67.
- Комяков Б.К., Гулиев Б.Г., Дорофеев С.Я. Огнестрельное ранение правого мочеточника. //Научно-практическая конференция, посвященная 75-летию Медицинской службы ГУВД СПб и Ленинградской области «Актуальные вопросы развития ведомственной медицины МВД России». Материалы. СПб., 2006. – С. 135 – 136.
- Комяков Б.К., Гулиев Б.Г., Дорофеев С.Я., Аль-Исса А.М., Бурлака О.О. Редкие операции в плановой хирургии мочеточника. //Научно-практическая конференция, посвященная 75-летию Медицинской службы ГУВД СПб и Ленинградской области «Актуальные вопросы развития ведомственной медицины МВД России». Материалы. СПб., 2006. – С. 231 – 233.
- Гулиев Б.Г. Диспансерное наблюдение больных после реконструктивных операций на мочеточнике. //Научно-практическая конференция, посвященная 75-летию Медицинской службы ГУВД СПб и Ленинградской области «Актуальные вопросы развития ведомственной медицины МВД России». Материалы. СПб., 2006. – С. 203 – 204.
- Комяков Б.К., Кириченко О.А., Гулиев Б.Г., Карлов П.А. Эндоскопическое лечение заболеваний почек с нарушением уродинамики. //Научно-практическая конференция, посвященная 75-летию Медицинской службы ГУВД СПб и Ленинградской области «Актуальные вопросы развития ведомственной медицины МВД России». Материалы. СПб., 2006. – С. 234.
- Гулиев Б.Г., Комяков Б.К., Бурлака О.О. Эндоскопическое лечение непротяженных сужений мочеточника. //Пленум Правления Российского общества урологов. «Достижения в лечении заболеваний верхних мочевых путей и стриктур уретры». Материалы. Екатеринбург, 2006. – С.201– 202.
- Комяков Б.К., Гулиев Б.Г., Давранов А.Д. Нефровезикальное шунтирование – новый метод дренирования почек. //Пленум Правления Российского общества урологов. «Достижения в лечении заболеваний верхних мочевых путей и стриктур уретры». Материалы. Екатеринбург, 2006. – С. 79 – 80.
- Комяков Б.К., Гулиев Б.Г. Нитиноловые стенты при лечении стриктур мочеточника. //Пленум Правления Российского общества урологов. «Достижения в лечении заболеваний верхних мочевых путей и стриктур уретры». Материалы. Екатеринбург, 2006.– С. 212 –213.
- Комяков Б.К., Гулиев Б.Г., Сергеев А.В., Фадеев В.А., Антеградное эндоскопическое лечение стриктур мочеточниково-кишечных анастомозов. //Пленум Правления Российского общества урологов. «Достижения в лечении заболеваний верхних мочевых путей и стриктур уретры». Материалы. Екатеринбург, 2006. – С. 213 – 214.
- Гулиев Б.Г. Перкутанное лечение осложнений пересаженной почки. //Пленум Правления Российского общества урологов. «Достижения в лечении заболеваний верхних мочевых путей и стриктур уретры». Материалы. Екатеринбург, 2006. – С. 52 – 53.
- Гулиев Б.Г. Эндоскопическое лечение заболеваний почек и верхних мочевых путей. //Вестник СПбГМА им. И.И. Мечникова. – 2006. – №2. – С. 96 – 100.
- Комяков Б.К., Гулиев Б.Г. Эндопротезирование мочеточника. //Урология. – 2006. – № 3. – С. 50 – 53.
- Комяков Б.К., Гулиев Б.Г., Дорофеев С.Я., Бурлака О.О. Аппендикоуретеропластика. //Урология – 2006. – № 5. – С.19 – 24.
- Гулиев Б.Г. Паллиативное лечение обструкции мочеточников у онкологических больных. //Вестник СПбГМА им. И.И. Мечникова. – 2006. – № 3. – С. 102 – 104.
- Гулиев Б.Г. Качество жизни после паллиативных методов дренирования верхних мочевых путей. //Научно-практическая конференция «Актуальные вопросы урологии и гинекологии у взрослых и детей». Материалы. СПб., 2006. – С. 27.
- Комяков Б.К., Дорофеев С.Я., Гулиев Б.Г., Бурлака О.О. Реконструкция мочеточников изолированными сегментами аппендикса. //V региональная научно-практическая конференция урологов Сибири «Актуальные вопросы детской и взрослой урологии». Материалы. Томск, 2006. – С.125 – 127.
- Новиков А.И., Атмаджев Д.Н., Гулиев Б.Г., Короходкина М.В., Дорофеев С.Я. Метаболический ацидоз у больных раком мочевого пузыря после ортотопической цистопластики. //I Конгресс российского общества онкоурологов. Материалы. Москва, 2006. – С. 101 – 102.
- Дорофеев С.Я, Гулиев Б.Г., Субелиани З.Г. Особенности замещения протяженных дефектов мочеточников сегментами кишечного тракта. //Всероссийская научная конференция «Здоровье – основа человеческого потенциала: проблемы и пути их решения». Труды. СПб., 2006. – С. 66 – 67.
- Комяков Б.К., Гулиев Б.Г., Давранов А.Д., Эль-Аттар Т.Х. Паллиативное лечение опухолевых обструкций мочеточников. //Современные направления в диагностике, лечении и профилактике заболеваний: Труды ГМПБ № 2. Выпуск V. СПб., «Ольга», 2006. – С. 151 – 155.
- Комяков Б.К., Гулиев Б.Г., Дорофеев С.Я., Бурлака О.О. Новый способ замещения мочеточника червеобразным отростком. //Современные направления в диагностике, лечении и профилактике заболеваний: Труды ГМПБ № 2. Выпуск V. СПб., «Ольга», 2006. – С. 137 – 143.
- Комяков Б.К., Новиков А.И., Гулиев Б.Г., Попов С.В., Лебедев М.А. Хирургическая тактика при стриктуре мочеточника нижней половины удвоенной почки. //Современные направления в диагностике, лечении и профилактике заболеваний: Труды ГМПБ № 2. Выпуск V. СПб., «Ольга», 2006. – С. 137 – 143.
- Гулиев Б.Г. Малоинвазивная хирургия урологических осложнений пересаженной почки. //Современные направления в диагностике, лечении и профилактике заболеваний: Труды ГМПБ № 2. Выпуск V. СПб., «Ольга», 2006. – С. 192 – 197.
- Комяков Б.К., Гулиев Б.Г., Карлов П.А., Эль-Аттар Т.Х. Органосохраняющие операции при опухолях верхних мочевых путей. //Онкоурология. – 2007. – № 2. – С. 26 – 29.
- Комяков Б.К., Гулиев Б.Г., Дорофеев С.Я., Стецик О.В., Родыгин Л.М. Урологические осложнения лапароскопических операций в гинекологии. //2-й Международный научный конгресс «Оперативная гинекология – новые технологии». Журнал акушерства и женских болезней. – 2006. – Т. LV. – Спецвыпуск. – С. 124.
- Комяков Б.К., Гулиев Б.Г., Давранов А.Д. Экстраанатомическое нефровезикальное шунтирование при обструкции мочеточника. //2-й Международный научный конгресс «Оперативная гинекология – новые технологии». Журнал акушерства и женских болезней. – 2006. – Т. LV. – Спецвыпуск. – С. 125.
- Комяков Б.К., Новиков А.И., Гулиев Б.Г., Попов С.В. Верхний уретеропиелоуретероанастомоз при стриктуре мочеточника нижней половины удвоенной почки. //Метод. рекомендации. СПб, 2007. – 20 с.
- Гулиев Б.Г., Нечаев И.И. Перкутанное лечение стриктур верхних мочевых путей. //4-я международная конференция «Малоинвазивные методы диагностики и лечения в современной урологии». Сборник трудов. СПб., 2007. – С.79 – 80.
- Комяков Б.К.,Гулиев Б.Г., Новиков А.И. Замещение протяженных дефектов мочеточника неизмененным мочеточником контралатеральной нефункционирующей или удаленной почки. //4-я международная конференция «Малоинвазивные методы диагностики и лечения в современной урологии». Сборник трудов. СПб., 2007. – С.82 – 83.
- Гулиев Б.Г. Результаты эндопротезирования протяженных сужений мочеточника. //4-я международная конференция «Малоинвазивные методы диагностики и лечения в современной урологии». Сборник трудов. СПб., 2007. – С. 88 – 89.
- Комяков Б.К., Гулиев Б.Г., Кириченко О.А. Лапароскопическая нефрэктомия при гидронефрозе. //4-я международная конференция «Малоинвазивные методы диагностики и лечения в современной урологии». Сборник трудов. СПб., 2007. – С.102 – 103.
- Гулиев Б.Г. Эндоскопическое лечение сужений мочеточников. //Научно-практическая конференция, посвященная 100-летию СПбГМА им. И.И. Мечникова «Состояние здоровья населения и факторы риска». Материалы. СПб., 2007. – С. 12 – 13.
- Гулиев Б.Г. Эндоскопическое лечение стриктур верхних мочевых путей. //Научно-практическая конференция молодых ученых «Актуальные вопросы клинической и экспериментальной медицины – 2007». Сборник тезисов. СПб., 2007. – С. 273 – 274.
- Комяков Б.К., Гулиев Б.Г., Родыгин Л.М. Оперативное лечение ятрогенных повреждений мочевыводящих путей и их осложнений. //Урология. – 2007. – № 3. – С. 7 – 11.
- Гулиев Б.Г. Влияние кишечной пластики мочеточников на вводно-электролитный баланс. // Всероссийская научно-практическая конференция «Проблемы хирургии в современной России». Материалы. СПб., 2007. – С. 42 – 44.
- Комяков Б.К., Гулиев Б.Г., Очеленко В.А. Обструкция мочеточников после реконструктивных операций на аорте и ее ветвях. //Всероссийская научно-практическая конференция «Проблемы хирургии в современной России». Материалы. СПб., 2007. – С. 65 – 67.
- Гулиев Б.Г. Чрескожное антеградное лечение сужений верхних мочевых путей. //Эндоскопическая хирургия. – 2007. – № 5. – С. 33 – 35.
- Комяков Б.К., Гулиев Б.Г., Давранов А.Д. Нефровезикальное шунтирование. //Урология. – 2007. – № 5. – С. 7 – 11.
- Комяков Б.К., Гулиев Б.Г., Дорофеев С.Я. Аппендикоуретеропластика. //Пособие для врачей. СПб., 2008. – 24 с.
- Комяков Б.К., Новиков А.И., Гулиев Б.Г., Попов С.В. Верхний уретеропиелоуретероанастомоз при обструкции мочеточника нижней половины удвоенной почки. //Урология. – 2008. – № 1. – С. 20 – 23.
Монография.
- Комяков Б.К., Гулиев Б.Г. Хирургия протяженных сужений мочеточников. //СПб.: Невский диалект, 2005. – 257 с.
Изобретения по теме диссертации
- Комяков Б.К., Горелов С.И., Гулиев Б.Г., Новиков А.И., Горелов А.И., Сергеев А.В., Фадеев В.А., Каган О.Ф. Способ формирования уретеросигмоанастомоза. //Патент на изобретение № 2183425 от 26.07.2001 г.
- Комяков Б.К., Гулиев Б.Г., Новиков А.И., Попов С.В., Лебедев М.А. Способ хирургического лечения уретерогидронефроза при полном удвоение почки и стриктуре мочеточника ее нижней половины. //Патент на изобретение № 2277386 от 10.06. 2006 г.
- Комяков Б.К., Гулиев Б.Г., Строкова Л.А., Сергеев А.В., Дариенко Р.О., Идрисов Ш.Н. Способ хирургического лечения заболеваний мочевого пузыря, сопровождающихся протяженными стриктурами тазовых отделов мочеточника. //Приоритетная справка № 2005117664 от 07.06.2005
- Комяков Б.К., Дорофеев С.Я., Бурлака О.О. Способ хирургического лечения протяженных стриктур тазового отдела мочеточника. //Патент на изобретение № 2308893 от 27.10.2007 г.
Список сокращений и условных обозначений:
ВМП – верхние мочевыводящие пути
ГУН – гидроуретеронефроз
ЛМС – лоханочно-мочеточниковый сегмент
МП – мочевой пузырь
ПМР–пузырно-мочеточниковый рефлюкс
УЦА – уретероцистанастомоз
ХП – хронический пиелонефрит
ХПН – хроническая почечная недостаточность
УЗИ – ультразвуковое исследование
ЧЛС – чашечно-лоханочная система
ЧПНС – чрескожная пункционная нефростомия

