Клинико-морфологическая характеристика рецидивирующей гиперплазии эндометрия на современном этапе
На правах рукописи
МЕДВЕДЕВА
ЮЛИЯ АЛЕКСЕЕВНА
КЛИНИКО-МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА РЕЦИДИВИРУЮЩЕЙ ГИПЕРПЛАЗИИ ЭНДОМЕТРИЯ НА СОВРЕМЕННОМ ЭТАПЕ
14.03.02 – патологическая анатомия
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Челябинск – 2010
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Челябинская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию» на кафедре патологической анатомии с секционным курсом и кафедре акушерства и гинекологии №1
Научные руководители:
доктор медицинских наук,
профессор Казачков Евгений Леонидович
доктор медицинских наук,
профессор Казачкова Элла Алексеевна
Официальные оппоненты:
доктор медицинских наук,
профессор Рыбакова Маргарита Григорьевна
доктор медицинских наук,
профессор Гиниатуллин Равиль Усманович
Ведущая организация: Государственное образовательное учреждение высшего профессионального образования «Самарский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Защита состоится «___ » октября 2010 года в ___ часов на заседании Диссертационного Совета Д 208.117.01 при Государственном образовательном учреждении высшего профессионального образования «Челябинская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию» по адресу: 454092, г. Челябинск, ул. Воровского, 64
С диссертацией можно ознакомиться в библиотеке Государственного образовательного учреждения высшего профессионального образования «Челябинская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию»
Автореферат разослан «___» __________ 2010 года
Ученый секретарь
Диссертационного Совета
доктор медицинских наук,
профессор Долгушина Валентина Федоровна
Общая характеристика работы
АКТУАЛЬНОСТЬ ПРОБЛЕМЫ. В последние годы отмечается рост заболеваемости гиперплазией эндометрия (ГЭ), что связывают с увеличением продолжительности и изменением общественного образа жизни женщин, использованием различных видов контрацепции, широким распространением искусственного прерывания беременности, ростом числа соматических страданий и ограниченными возможностями консервативного лечения, обусловленными противопоказаниями к гормонотерапии (Побединский Н.М. и др., 2001; Родкина Р.А. и др., 2002; Ашрафян Л.А. и др., 2007; Станоевич И.В., 2007; Ищенко А.И. и др., 2008; Станоевич И.В., 2009).
ГЭ страдают до 50% женщин позднего репродуктивного и перименопаузального возраста и от 15 до 40% женщин в постменопаузе (Баянова Л.Р., 1997; Прилепская В.Н. и др., 2006). Неослабевающий интерес к ГЭ определяется тенденцией на современном этапе к рецидивирующему течению этого заболевания. При этом рецидивом ГЭ принято считать возобновление клинических симптомов и гистологической картины гиперпластического процесса в эндометрии в течение 2-х лет после окончания гормональной терапии (Егорова Е.А., 2000; Вдовенко И.А., 2006). Частота рецидивирования ГЭ колеблется от 30 до 50%, а атипичной гиперплазии (АГЭ) – до 60,4% с вероятностью последующей малигнизации 0,3-45,1% (Никитин С.В., 2003; Гаспарян Н.Д. и др., 2004; Кузнецова И.В. и др., 2005; Карселадзе А.И., 2006; Примак А.В., 2006; Trimble C.L. et al., 2006).
По современным представлениям (Бохман Я.В., 1989), ГЭ рассматривают как фоновый процесс для развития рака эндометрия (РЭ). Возникновение инвазивного рака тела матки у больных с рецидивирующей ГЭ (РГЭ) отмечается в каждом 4-м случае (Кулаков В.И. и др., 2001). При этом АГЭ считается «морфологическим» предраком (частота малигнизации колеблется от 1,5 до 45%) (Бохман Я.В., 1989; Horn L.C. et al., 1997; Lindahl B. et al., 1998), а РГЭ определяют как «клинический» предрак, поскольку РЭ у больных этой группы отмечен в 20-30% случаев (Макаров О.В. и др., 1993; Мгдесян К.К., 2002).
Принято считать (Автандилов Г.Г., 2000; Подзолкова Н.М. и др., 2007; Sherif L.S. et al., 2005), что риск прогрессирования ГЭ (рецидив, переход в атипичный вариант, малигнизация) во многом зависит от пролиферативной активности клеток железистого эпителия. Железисто-стромальные и цито-кариометрические характеристики гиперплазированного эндометрия, выявляемые с помощью морфометрии, являются морфологическим проявлением пролиферативной активности клеток (Agorastos T. et al., 1997; Orbo A. et al., 2000).
Методом, объективно отражающим степень напряженности белковосинтетической и пролиферативной активности клеток при различных патологических процессах, является исследование районов ядрышковых организаторов (ЯО) (Эллиниди В.Н. и др., 1999; Лазарев А.Ф. и др., 2002; Белосохов М.В., 2006). При этом важны показатели функционального состояния клетки: число ядрышек, количество в них ЯО и распределение ЯО в кариоплазме (Derenzini M. et al., 1991).
Не утратил своей актуальности и способ сравнительной микроспектрофотометрии с применением компьютерного анализатора изображений как альтернативный морфометрический метод, позволяющий получить количественную и качественную («пролиферативная активность» и «индекс дисдифференцировки») характеристику плоидности исследуемых ядер клеток (Автандилов Г.Г. и др., 2002).
Следует отметить, что информативные количественные методы исследования белковосинтетической и пролиферативной активности клеток при РГЭ используются незаслуженно редко, а морфологические критерии прогноза возможного развития рецидива ГЭ в доступной литературе нам встретить не удалось.
ЦЕЛЬ ИССЛЕДОВАНИЯ – изучить клинико-морфологические особенности рецидивирующей гиперплазии эндометрия на основании проведения анализа медицинской документации и комплексного морфологического исследования соскобов слизистой оболочки матки для выявления критериев прогноза рецидивирования эндометриальной гиперплазии.
ЗАДАЧИ ИССЛЕДОВАНИЯ:
- Охарактеризовать медико-социальный портрет больных рецидивирующей гиперплазией эндометрия.
- Установить структурные и морфометрические особенности эндометрия при рецидивирующем течении эндометриальной гиперплазии.
- Изучить плоидность эндометриальных железистых эпителиоцитов и особенности белковосинтетической и пролиферативной активности эндометриального эпителия при рецидивирующей гиперплазии эндометрия.
- Установить прогностические критерии развития рецидива эндометриальной гиперплазии.
Научная новизна исследования
Впервые при комплексном исследовании медицинской документации и соскобов эндометрия выявлены структурные и морфометрические особенности слизистой оболочки матки при рецидивирующем течении гиперплазии эндометрия.
Проведена сравнительная оценка пролиферативной активности и плоидности эпителиальных клеток эндометриальных желез при нерецидивирующем и рецидивирующем течении эндометриальной гиперплазии, а также при атипичном ее варианте. Установлено, что рецидивирующая гиперплазия эндометрия по ряду морфометрических показателей, плоидности и пролиферативной активности железистых эпителиоцитов эндометрия занимает промежуточное положение между гиперплазией эндометрия без атипии с нерецидивирующим течением и атипичной гиперплазией.
Выявлены достоверные морфологические критерии развития рецидива гиперплазии эндометрия.
Практическая значимость работы
Прогнозирование развития рецидива гиперплазии эндометрия позволяет предупредить переход гиперпластического процесса без атипии в атипичную гиперплазию эндометрия и дальнейшее прогрессирование процесса вплоть до формирования рака эндометрия.
Использование морфометрического метода с анализом изображения, метода оценки пролиферативной активности путем выявления районов ядрышковых организаторов с помощью импрегнации нитратом серебра, микроспектрофотометрического метода определения плоидности позволяет прогнозировать вероятное рецидивирование гиперплазии эндометрия без использования дорогостоящих иммуногистохимических методик.
Положения диссертации, выносимые на защиту
- Рецидивирующая гиперплазия эндометрия имеет клинические и морфологические особенности, отличные от нерецидивирующего течения гиперплазии эндометрия.
- Рецидивирующую гиперплазию эндометрия можно прогнозировать с использованием морфологических критериев, получаемых с помощью доступных средств оценки количественных параметров и пролиферативной активности.
- Рецидивирующая гиперплазия эндометрия по ряду морфометрических показателей, плоидности и пролиферативной активности железистых эпителиоцитов занимает промежуточное положение между гиперплазией эндометрия и атипичной гиперплазией эндометрия.
ВНЕДРЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ В ПРАКТИКУ
Результаты исследования внедрены в работу отделения № 3 Челябинского областного патологоанатомического бюро и патологоанатомического отделения Клиники ГОУ ВПО ЧелГМА Росздрава, в учебный процесс на кафедре патологической анатомии и кафедре акушерства и гинекологии №1 Челябинской государственной медицинской академии.
АПРОБАЦИЯ РАБОТЫ
Материалы диссертации представлены на V-м съезде врачей Челябинской области (Челябинск, 2004), Всероссийской научно-практической патологоанатомической конференции (Миасс, 2008), VI-ой итоговой научно-практической конференции молодых ученых Челябинской государственной медицинской академии (Челябинск, 2008), заседании Челябинского отделения Российского общества патологоанатомов (Челябинск, 2008), III-м съезде Российского общества патологоанатомов (Самара, 2009).
ПУБЛИКАЦИИ
По теме диссертации опубликовано 15 работ, из них 2 – в ведущих рецензируемых научных журналах и изданиях, определенных Высшей аттестационной комиссией.
ОБЪЕМ И СТРУКТУРА ДИССЕРТАЦИИ
Работа состоит из введения, обзора литературы, 4 глав собственных исследований, обсуждения результатов, выводов, практических рекомендаций и списка литературы. Материал изложен на 175 страницах, иллюстрирован 59 рисунками, 14 таблицами, 1 схемой. В указателе литературы приведено 319 источников (195 отечественных и 124 зарубежных публикаций).
СОДЕРЖАНИЕ РАБОТЫ
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материалом для настоящего исследования послужили соскобы слизистой оболочки матки, полученные в ходе раздельного диагностического выскабливания стенок полости матки и цервикального канала под контролем гистероскопии или ультразвукового исследования органов малого таза у 145 пациенток гинекологических отделений МУЗ ГКБ № 6 и Клиники ГОУ ВПО ЧелГМА Росздрава за 2004-2006гг. с установленным патоморфологическим диагнозом ГЭ.
Критерии включения в исследование: пациентки, поступившие на стационарное лечение с различными видами нарушений менструального цикла и установленным первичным гистологическим диагнозом ГЭ, давшие информированное согласие на участие в исследовании. В группу РГЭ включены женщины с установленным рецидивом гиперпластического процесса в течение 2-х лет после окончания гормонотерапии.
Критерии исключения из исследования: пациентки, имеющие сочетание ГЭ с полипами слизистой оболочки матки либо опухолевым процессом в эндометрии.
Для выполнения настоящего исследования был проведен ретроспективный анализ медицинской документации пациенток (амбулаторные карты, истории болезни), в ходе которого установлено, что у 105 женщин ГЭ без атипии (ГЭБА) была выявлена впервые, с установленным положительным терапевтическим эффектом, без рецидивов во время лечения и периода наблюдения в течение 2 лет. Эти пациентки составили 1-ю группу наблюдений.
У 26 женщин ГЭ носила рецидивирующий характер, наступление рецидива отмечалось в течение 2 лет после окончания курса гормонотерапии (2-я группа наблюдений). Рецидивом ГЭ считали возобновление клинических симптомов и гистологической картины патологической пролиферации эндометриальных желез после проведенной гормональной терапии. Для объективизации суждения о рецидиве в исследование были включены соскобы слизистой оболочки матки от 24 пациенток 2-й группы (РГЭ), полученные в ходе первоначального морфологического исследования.
При ретроспективном анализе соскобов эндометрия от пациенток с ГЭ мы оставляли за собой право изменения патологоанатомического диагноза в соответствии с положениями современной теории диагноза (Коваленко В. Л., 1995; Пальцев М.А. и др., 2002) и классификации эндометриальной гиперплазии (Silverberg S. G. et al., 2003). Градация ГЭ осуществлялась на основании наличия или отсутствия клеточной атипии (без атипии и атипичная), а также в зависимости от степени выраженности тканевых перестроек (простая и сложная).
Первичный диагноз АГЭ был установлен в 15 случаях. После пересмотра архивного материала диагноз подтвержден в 13 наблюдениях, а в 2 отмечена ложноположительная диагностика АГЭ (в 1-м верифицирована сложная смешанная гиперплазия эндометрия без атипии, во 2-м – гиперпластический полип эндометрия). Кроме того, в одном случае первичная диагностика ГЭ оказалась ложноотрицательной: процесс идентифицирован как очаговая железистая гиперплазия на фоне секреторного эндометрия (после пересмотра – сложная АГЭ). В результате у 14 пациенток при повторном гистологическом исследовании выявлены признаки клеточной атипии эпителия желез эндометрия. Эти женщины составили 3-ю группу исследования.
Таким образом, в зависимости от клинического течения и морфологического варианта ГЭ пациентки были разделены на три группы. 1-ю группу составили 105 женщин с выявленной впервые ГЭБА, при этом простая ГЭ без атипии (ПГЭБА) встретилась в 64 случаях (53,7%) (подгруппа А1), сложная ГЭ без атипии (СГЭБА) – в 41 (34,5%) (подгруппа Б1). 2-я группа была представлена 26 пациентками с рецидивирующей ГЭ без атипии (РГЭБА), у половины женщин верифицирована простая РГЭ без атипии (ПРГЭБА) (подгруппа А2), у другой половины – сложная РГЭ без атипии (СРГЭБА) (подгруппа Б2). 3-ю группу составили 14 пациенток с АГЭ.
С целью характеристики медико-социального портрета женщин, страдающих различными вариантами ГЭ, проведен анализ историй болезни и амбулаторных карт. Во внимание принимались возраст пациенток, социальный статус, становление и характер менструальной и репродуктивной функций, жалобы и анамнез основного заболевания, наличие сочетанной (сопутствующей) соматической и гинекологической патологии, данные лабораторных и инструментальных исследований. Антропометрический анализ проводили путем вычисления индекса массы тела (ИМТ) по формуле G. Brey.
Гистологическим методом изучены архивные микропрепараты соскобов слизистой оболочки матки, полученных в ходе раздельного диагностического выскабливания стенок полости матки и цервикального канала от 145 пациенток исследуемых групп с целью морфологической верификации вариантов ГЭ (ВОЗ, 2003). Для микроскопического анализа активности воспалительного процесса при хроническом неспецифическом эндометрите (ХНЭ), сопутствующем ГЭ, использовали полуколичественный метод оценки степени выраженности лимфоцитарной и гранулоцитарной инфильтрации, плазматизации и фибротизации стромы эндометрия в биопсийном материале (Казачкова Э.А., 1984; Медведев Б.И. и др., 2001; Алимова О.А. и др., 2008).
Для морфометрического анализа и дополнительных гистохимических окрасок микропрепараты изготовлялись из архивных парафиновых блоков, приготовленных в соответствии с принятыми на момент архивации методами фиксации соскобов эндометрия: 10%-ный раствор формалина pH 7,2-7,4. С каждого блока готовили плоскопараллельные тканевые срезы толщиной 5-7 микрон, которые окрашивали для морфометрии гематоксилином и эозином по правилам общепринятых прописей (Меркулов Г.А., 1951).
Морфометрический анализ ГЭ проводили с помощью микроскопа «Leica DMXRA» (Германия), используя программу анализа изображения «Диа-Морф_Cito_W» (Россия) с учетом разработанных критериев морфометрической диагностики патологии эндометрия (Автандилов Г.Г., 1990; Автандилов Г.Г., 2002). Определяли средние значения площади желез, стромы, клетки, ядра, периметр, диаметр, наименьший и наибольший размеры, фактор формы ядра (ФФ – отношение наименьшего размера ядра к наибольшему). На основании этих параметров вычисляли значение стереометрических индексов: железисто-стромальный коэффициент (ЖСК) и ядерно-клеточное отношение (ЯКО).
Изучение уровня экспрессии аргентаффинных белков районов ядрышковых организаторов (ЯО) эпителиоцитов эндометриальных желез проводилось методом импрегнации гистологических срезов 50% коллоидным раствором нитрата серебра по J. Crocker, P. Nar (1987). При этом зоны ЯО в виде аргентаффиных включений (AgNORs) окрашивались в черно-коричневый цвет. Учет реакции проводили в 100 эпителиоцитах каждого среза, оценивали окрашенные срезы при увеличении х1000 с масляной иммерсией и зеленым светофильтром, редуцирующим хроматические абберации (Crocker J. et al., 1988), используя микроскоп «Leica CME».
Клетки, содержащие внутри- и внеядрышковые аргентаффинные включения, подразделяли на три типа: I тип (AgNORs-1) – выявляются целиком прокрашенные ядрышки или гранулы серебра только внутри ядрышек (покоящиеся клетки); II тип (AgNORs-2) – выявляются гранулы серебра как внутри ядрышек (ядрышки могут прокрашиваться целиком), так и свободно диспергированные по ядру (пролиферирующие клетки); III тип (AgNORs-3) – выявляются множественные свободно лежащие в ядре депозиты серебра различных размеров и формы, ядрышки не дифференцируются (злокачественные клетки) (Crocker J. et al., 1989). Процентное содержание клеток всех типов рассчитывали для каждого среза.
Дополнительно вычисляли показатели, характеризующие различные виды ГЭ (Эллиниди В.Н. и др., 1999, 2000): среднее количество ядрышек на ядро, общее количество гранул на ядро, среднее число внутриядрышковых и внеядрышковых гранул на ядро.
Для оценки плоидности использовали метод окраски гистологических срезов по Фельгену. Этот метод оптимально подходит для проведения микроспектрофотометрического исследования, обеспечивая полное соответствие количества сорбированного красителя количеству молекул ДНК в ядре клетки. Результаты оценивали в соответствии с рекомендациями Г.Г. Автандилова (2002). Содержание ДНК в ядре вычисляли в абсолютных единицах по значению интегральной плотности ядра клетки. За единицу «тканевого стандарта плоидности» принимали половину среднего значения интегральной плотности ядер малых лимфоцитов в том же срезе и автоматически относили в качестве знаменателя к интегральной плотности ядер исследуемых клеток. «Пролиферативную активность» исследуемого клона клеток оценивали по превышению среднего содержания ДНК в интерфазных ядрах клеток уровня 2с. О динамике активности и интенсивности пролиферации клеток судили по значениям «индекса дисдифференцировки», который получали путем деления количества анеуплоидных ядер с плоидностью более 4с на число тетраплоидных ядер, т.е. клеток, готовых к митозу (Автандилов Г.Г. и др., 1973; Автандилов Г.Г., 2000-2002). Количественное определение ДНК клеток проводилось с помощью микроскопа «Leica DMXRA» (Германия) и программы анализа изображения «Диа-Морф_Cito_W» (Россия).
Микрофотографии выполнялись с использованием микроскопа Axios Kop 40 фирмы «Carl Zeiss» и видеокамеры захвата изображения Pixera, совмещенных с персональным компьютером.
Статистическая обработка полученных данных проводилась на персональном компьютере с использованием пакета лицензионных программ «Microsoft Office 2007» («MS Excel», «MS Word») и «STATISTICA 6.0» по принятым методикам статистического анализа (Гланц С., 1999; Реброва О.Ю., 2002). Обработка данных, статистический анализ, построение таблиц, диаграмм и графиков осуществлялись в среде «Windows XP Professional Edition» на персональном компьютере IBM PC на базе процессора «Intel Celeron-1700» и в среде «Windows 7 Home Basic» на персональном компьютере IBM PC на базе процессора «Intel Core 2 Duo».
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
При анализе наблюдений с различными вариантами ГЭ был составлен медико-социальный портрет пациенток. Возраст больных варьировал от 25 до 58 лет. Более молодыми были пациентки 1-й группы (ГЭБА) (средний возраст – 44,3 года; 95%ДИ = 42,6-46,0). Средний возраст женщин 2-й группы (РГЭБА) составил 46,2 года (95%ДИ = 43,8-48,5). Более старшая возрастная категория представила 3-ю группу (в среднем 48,8 года; 95%ДИ = 44,6-52,9). Таким образом, средний возраст пациенток с ГЭ в группах практически не отличался, однако у женщин с ГЭБА приходился на нижнюю границу позднего репродуктивного возраста, а с РГЭБА и АГЭ относился к перименопаузальному, что согласуется с данными литературы (Каппушева Л.М. и др., 2005; Кузнецова И.В. и др., 2007; Станоевич И.В. и др., 2008).
Во всех группах исследования среди пациенток преобладали женщины с социальным статусом служащих, что отмечено и другими авторами (Гущина М.Ю. и др., 2009). В группе с АГЭ данный социальный статус отмечался реже (35,7%), причем в статусе женщин-служащих между группами ГЭБА и АГЭ выявлено статистически значимое отличие (р<0,05). В группах практически одинаковое количество женщин имели рабочие специальности. Вместе с тем, женщин-пенсионерок в 1-й группе было 3,8%, во 2-й группе их количество значительно возросло (19,2%; р<0,005) и продолжало расти в группе с АГЭ (28,6%; в сравнении с группой ГЭБА р<0,001). Возможно, отстранение от активной социальной жизни и работы способствует прогрессии ГЭ в виде рецидива и атипичного течения процесса.
У большинства пациенток всех групп менструации установились в короткий срок после наступления менархе, были регулярными и умеренными. Обильные выделения при менструации несколько чаще отмечали у себя женщины с РГЭБА (38,5%), чем с ГЭБА (29,5%), и гораздо реже – больные с АГЭ (14,3%). При этом пациентки с рецидивирующим течением ГЭ достоверно чаще отмечали болезненность менструаций (42,3%), чем больные с нерецидивирующей формой (15,2%) (р<0,005); у пациенток с АГЭ альгоменорея отмечалась чаще, чем при ГЭБА, но реже, чем при РГЭБА (21,4% случаев).
Почти все пациентки исследуемых групп отметили наличие беременности в анамнезе (в 1-й группе – 92,4%, во 2-й – 92,3%, в 3-й – 100%). Все указали на большое количество медицинских абортов: самая высокая их частота (до 15 абортов на одну пациентку) отмечена в группе ГЭБА, несколько меньшая (до 10 абортов) – в группах с РГЭБА и АГЭ, что согласуется с данными литературы, указывающими на роль искусственных прерываний беременности в генезе гиперпластических процессов в эндометрии (Станоевич И.В., 2009). При этом наибольшее количество женщин, имевших медицинские аборты, отмечено в группе с ГЭБА (88,7%) и с АГЭ (71,4%). Пациентки в группе РГЭБА (65,4%) достоверно реже отмечали в анамнезе искусственные аборты.
В гинекологическом анамнезе у половины женщин во всех группах имелись указание на наличие миомы тела матки (МТМ): у 50,5% женщин с ГЭБА, у 57,5% - с РГЭБА и у 42,9% - с АГЭ. По мнению ряда авторов (Пасман Н.М. и др., 2006; Станоевич И.В. и др., 2008), МТМ не только ассоциирована с ГЭ, но и повышает риск рецидива гиперпластического процесса. Однако наши исследования не выявили сочетания с МТМ почти у половины пациенток с рецидивирующим течением ГЭ.
Отягощенный инфекционно-воспалительными заболеваниями гинекологический анамнез отмечен у пациенток всех исследуемых групп, что совпадает с результатами различных исследователей, выявивших связь воспалительных поражений органов малого таза с ГЭ (Зуева Е.А., 2000; Пушкарев В.А. и др., 2005; Попов А.А. и др., 2007). Указания на перенесенный хронический аднексит чаще отмечались у женщин с РГЭБА (27%), чем с ГЭБА (6,7%) (р<0,005), пациентки с АГЭ страдали хроническим воспалением придатков матки реже (14,3%), чем с РГЭБА. Наличие в анамнезе ХНЭ достоверно чаще регистрировалось у пациенток с РГЭБА (76,9%), чем с ГЭБА (21%) (р<0,001) и с АГЭ (21,4%). Таким образом, хронически протекающие воспалительные заболевания эндометрия могут, на наш взгляд, способствовать рецидивированию ГЭ.
Соматическая патология была также выявлена у всех пациенток исследуемых групп. Ожирение, обнаруживаемое у большинства женщин с ГЭ (Сухих Г.Т. и др., 2005; Буянова С.Н. и др., 2009; Чернуха Г.Е., 2009; Epplein M. et al., 2008), выявлено более чем у трети пациенток с ГЭБА (35,2%) и у половины больных с АГЭ. Женщины с рецидивирующим течением ГЭ достоверно чаще страдали ожирением (61,5%), чем пациентки 1-й группы (р<0,025). Таким образом, ожирение является не только патогенетическим звеном развития ГЭ, но и фактором риска развития рецидива гиперпластического процесса.
Сочетанной экстрагенитальной патологией страдали 16,2% женщин с ГЭБА, 30% - с РГЭБА и 50% - с АГЭ. При этом в 3-й группе сочетанная патология в анамнезе отмечалась достоверное чаще, чем в группе с ГЭБА (р<0,005), что может свидетельствовать о влиянии отягощенного соматического анамнеза на прогрессию течении гиперпластического процесса в эндометрии (Гущина М.Ю. и др., 2009). Артериальной гипертензией страдали 24,8% пациенток с ГЭБА, однако у женщин с РГЭБА достоверно чаще (р<0,05) имелись указания в анамнезе на наличие артериальной гипертензии (46,2%). Половина больных с АГЭ также отмечали стойкое повышение артериального давления (р<0,05 по сравнению с ГЭБА). Между группами ГЭБА и РГЭБА обнаружено достоверное отличие (17,1% и 46,2% соответственно; р<0,005) в отношении сочетания артериальной гипертензии и ожирения, которые, как известно, являются основными компонентами метаболического синдрома, способствующего развитию пролиферативных заболеваний матки (Подзолкова Н.М. и др., 2003; Ищенко А.И. и др., 2008; Weiderpass E. et al., 2000).
Достоверно большее количество пациенток (34,6%) страдали заболеваниями печени в группе с РГЭБА (р<0,001), чуть меньшее (28,6%) – в группе с АГЭ (р<0,001), чем в группе с ГЭБА (4,8%). Гипопротеинемия, выявленная в биохимическом анализе крови, достоверно чаще отмечалась у женщин с РГЭБА (38,5%), чем с ГЭБА (5,7%) (р<0,001). Следовательно, гепатобилиарная патология, при которой снижается синтез белков, связывающих половые стероиды и ростковые факторы (Берштейн Л.М., 2002; Романовский О.Ю., 2005), может способствовать развитию рецидива ГЭ.
Маточные кровотечения, которые считаются ведущим симптомом ГЭ (Роузвиа С.К., 2004; Горенкова О.С., 2005; Кузнецова И.В. и др., 2007; Подзолкова Н.М. и др., 2007; Paraskevaidis E. et al., 2002), имели место более чем у 90% пациенток всех групп наблюдения. Чаще они проявлялись метроррагией, которая наблюдалась у большинства женщин с ГЭБА (60,8%), у 50% - с АГЭ и чуть реже при РГЭБА (41,7%). Гиперполименорея отмечена у половины пациенток с РГЭБА, у трети – с ГЭБА (32%) и чуть меньше – с АГЭ (21,47%). Пациентки с РГЭБА жаловались одновременно на маточные кровотечения и боли внизу живота (20,8%), причем достоверно чаще, чем в группе с ГЭБА (6,7%) (р<0,05), и несколько реже, чем в группе с АГЭ (26,8%). Слабость и головокружение, указывающие на значительную кровопотерю, которая может стать причиной анемии и гиповолемии, вплоть до развития коллапса и шока (Рыбакова М.Г., 2002), также достоверно чаще отмечали женщины с РГЭБА (33,3%), чем с ГЭБА (11,4%) (р<0,025). Полагаем, что на возможность развития рецидива ГЭ может указывать клинический симптомокомплекс в виде сочетания маточных кровотечений с выраженным болевым синдромом, чувством слабости и головокружения.
При проведении морфометрического исследования установлено достоверное увеличение железистого компонента от ГЭБА (среднее значение площади желез 0,52 мм2) к РГЭБА (0,62 мм2) (р<0,01), который при рецидивирующем варианте ГЭ был приблизительно таков же, как и при АГЭ (0,6 мм2) (табл. 1). Обнаружена тенденция к уменьшению стромальной составляющей: показатели среднего значения площади стромы уменьшались от ГЭБА (0,95 мм2) к РГЭБА (0,91 мм2) и к АГЭ (0,85 мм2). Это проявлялось значительным возрастанием ЖСК от 0,58 при ГЭБА до 0,69 при РГЭБА (p<0,05) и далее к 0,9 при АГЭ. Следовательно, при рецидиве ГЭ достоверное увеличение железистого компонента происходит как за счет самой ГЭ, так и за счет снижения стромообразования, что отражается в среднем значении площади желез и ЖСК. По этим морфометрическим показателям рецидивирующая ГЭ ближе к АГЭ и РЭ (Станоевич И.В. и др., 2008).
Таблица 1
Соотношение железистого и стромального компартментов при различных вариантах гиперплазии эндометрия
| Исследуемая группа | Среднее значение площади желез, мм2 | Среднее значение площади стромы, мм2 | Железисто-стромальный коэффициент |
| ГЭБА | 0,52 (0,46-0,58) | 0,95 (0,9-1) | 0,58 (0,48-0,68) |
| РГЭБА | 0,62* (0,56-0,68) | 0,91 (0,86-0,96) | 0,69** (0,59-0,79) |
| АГЭ | 0,6 (0,45-0,75) | 0,85 (0,7-1) | 0,9 (0,5-1,3) |
Примечание. * - достоверность p<0,01, в сравнении с группой ГЭБА; ** - достоверность p<0,05, в сравнении с группой ГЭБА; ГЭБА – гиперплазия эндометрия без атипии; РГЭБА – рецидивирующая гиперплазия эндометрия без атипии; АГЭ – атипичная гиперплазия эндометрия.
Морфометрия клеточного компонента ГЭ позволило выявить тенденцию к нарастанию ядерно-клеточных показателей от ГЭБА к РГЭБА и далее к АГЭ (табл. 2). При рецидивировании ГЭ клетки железистого эпителия имеют большую площадь, увеличенные кариометрические значения: площадь, периметр, диаметр, наибольший размер ядра. Однако различия имеют статистическую достоверность только в значении наибольшего размера ядра (р<0,05). Параметры ЯКО, наименьшего размера ядра и ФФ ядра (р<0,01) при РГЭБА были несколько меньше, чем при ГЭБА. Ядра клеток желез при рецидивировании ГЭ имели увеличенный наибольший размер, меньшие значения наименьшего размера и ФФ, что характеризовало форму ядра как вытянутую, палочковидную. Практически все цито-кариометрические показатели при АГЭ (кроме наибольшего размера ядра) были достоверно выше одноименных параметров при РГЭБА (р<0,01). Ядра клеток железистого эпителия при АГЭ имели примерно такое же значение наибольшего размера, увеличенные показатели наименьшего размера ядра и ФФ, что указывало на округлую форму ядра. В литературе имеются указания на то, что уменьшение значений таких морфометрических показателей как диаметр и периметр ядра эпителиальных клеток при ГЭ свидетельствует о снижении митотической активности клеток (Agorastos T. et al., 1997). Следовательно, увеличение этих значений ядер эпителиоцитов желез при РГЭБА и АГЭ говорит об увеличении пролиферативной активности клеток в сравнении с ГЭБА.
Таблица 2
Карио-цитометрические показатели при различных вариантах
гиперплазии эндометрия
| Иссле-дуемая группа | Среднее значение площади клетки, мкм2 | Среднее значение площади ядра, мкм2 | ЯКО | Пери-метр ядра, мкм | Диа-метр ядра, мкм | Наи-мень-ший раз-мер ядра, мкм | Наи-боль-ший раз-мер ядра, мкм | ФФ |
| ГЭБА | 232,3 (212,5-252,1) | 108,4 (101,1-115,7) | 47,8 (46,2-49,4) | 44,7 (43,1-46,3) | 11,72 (11,3-12,1) | 6,8 (6,4-7,2) | 15,7 (6,4-7,2) | 0,69 (0,67-0,71) |
| РГЭБА | 245,5 (223,7-267,3) | 112,4 (102,3-122,5) | 46,5 (44,2-48,8) | 46,7 (44,8-48,6) | 11,8 (11,3-12,3) | 6,51 (6,16-6,86) | 16,8** (16,1-17,5) | 0,65* (0,63-0,67) |
| АГЭ | 294,5^ (259,6-329,4) | 161,7^ (142,6-180,8) | 55,8^ (53,3-58,3) | 50,8^^ (47,1-54,5) | 14^ (13,1-14,9) | 8,9^ (8,3-9,5) | 17 (15,7-18,3) | 0,76^ (0,74-0,78) |
Примечание. * - достоверность p<0,01, в сравнении группой ГЭБА; ** - достоверность p<0,05, в сравнении группой ГЭБА; ^ - достоверность p<0,01, в сравнении группой РГЭБА; ^^ - достоверность p<0,05, в сравнении группой РГЭБА; ГЭБА – гиперплазия эндометрия без атипии; РГЭБА – рецидивирующая гиперплазия эндометрия без атипии; АГЭ – атипичная гиперплазия эндометрия.
Результаты исследования активности ЯО путем подсчета и регистрации распределения в ядре аргентаффинных включений (AgNORs), а также числа ядрышек в ядрах клеток железистого эпителия, представлены на рис.1. Из рис.1 следует, что при РГЭБА статистически достоверно происходит возрастание средних значений количества ядрышек на ядро эпителиальной клетки, общего количества аргентаффинных гранул в ядре клетки, количества внеядрышковых гранул в сравнении с ГЭБА (p<0,01). При АГЭ достоверно возрастают средние значения количества ядрышек на ядро и количества внеядрышковых гранул в ядре эпителиоцита в сравнении с РГЭБА (p<0,01).
Таким образом, при РГЭБА не только увеличивается количество ядрышек на ядро и общее количество аргентаффинных гранул, но и возрастает доля внеядрышковой составляющей. Обнаружено статистически достоверное увеличение содержания клеток 2 типа от ГЭБА (37,8%) к РГЭБА (83,5%) (р<0,01), которое приблизилось по значению к суммарному содержанию клеток 2 и 3 типов при АГЭ (88,3), что свидетельствует о большем количестве активно пролиферирующих эпителиоцитов при РГЭБА, чем при ГЭБА.
 Рис. 1. Активность ядрышковых организаторов эпителия эндометриальных желез при различных вариантах гиперплазии эндометрия
Рис. 1. Активность ядрышковых организаторов эпителия эндометриальных желез при различных вариантах гиперплазии эндометрия
Примечание. * - достоверность p<0,01, в сравнении группой ГЭБА; ** - достоверность p<0,01, в сравнении с группой РГЭБА, ГЭБА – гиперплазия эндометрия без атипии; РГЭБА – рецидивирующая гиперплазия эндометрия без атипии; АГЭ – атипичная гиперплазия эндометрия.
Исследователями ЯО выявлен рост значений показателей (количество ядрышек на ядро, количество внутриядрышковых гранул, общее количество гранул на ядро) в ряду изменений в эндометрии: пролиферативная фаза цикла железистая ГЭ АГЭ РЭ (Эллиниди В.Н. и др., 1999, 2000). По нашим данным, с учетом показателей активности ЯО РГЭБА располагается между ГЭБА и АГЭ.
Результаты метода плоидометрии ядер клеток эпителия эндометриальных желез представлены на рис.2. Из рис.2 следует, что при РГЭБА происходит достоверное возрастание средних показателей плоидности ядер эпителиоцитов эндометрия, «пролиферативной активности» и «индекса дисдифференцировки» в сравнении с ГЭБА (р<0,05) и приближение значений к таковым при АГЭ.
Некоторые исследователи определили возрастание значений плоидности, «пролиферативной активности» клеток и «индекса дисдифференцировки» в ряду изменений в эндометрии: пролиферативная фаза цикла железистая ГЭ АГЭ РЭ (Автандилов Г.Г. и др., 2002; Сидорова И.С. и др., 2004). Результаты наших исследований определили положение РГЭБА между ГЭБА и АГЭ.
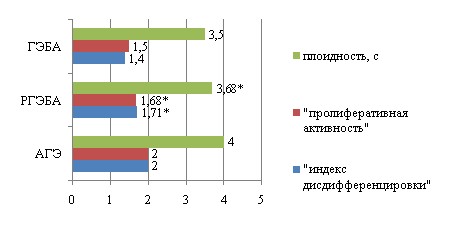 Рис. 2. Плоидометрическая характеристика ядер эпителиоцитов желез при различных вариантах гиперплазии эндометрия
Рис. 2. Плоидометрическая характеристика ядер эпителиоцитов желез при различных вариантах гиперплазии эндометрия
Примечание. * - достоверность p<0,05, в сравнении группой ГЭБА; ГЭБА – гиперплазия эндометрия без атипии; РГЭБА – рецидивирующая гиперплазия эндометрия без атипии; АГЭ – атипичная гиперплазия эндометрия.
Ядра эпителиоцитов маточных желез при ГЭБА по содержанию генетического материала находятся, главным образом, в пределах паратриплоидных значений (38,8% клеток имеют набор хромосом 2с, 33,7% – 3с), что, по данным литературы (Лысенко О.Н., 2003), соответствует пролиферативной активности эндометрия. При рецидивирующем течении ГЭ (28,1% клеток с хромосомным набором 2с, 35% – 3с, 15,4% – 4с) возникают более выраженные изменения клонального профиля клеток, свойственные легкой дисплазии эпителиальных структур, которые имеют паратетраплоидные значения. При АГЭ появляется большое количество клеток с анеуплоидными ядрами (33,9% клеток с набором хромосом 3с, 31% – более 4с), характерные для умеренной и тяжелой дисплазии эпителия, о чем свидетельствуют и другие авторы (Автандилов Г.Г. и др., 2002; Лысенко О.Н., 2003).
Таким образом, РГЭБА гистологически отличается от нерецидивирующего варианта ГЭБА увеличением доли железистого компонента эндометрия и возрастанием ЖСК, уменьшением содержания стромы, несколько большими размерами клеток железистого эпителия, ядер, меньшими ЯКО и ФФ ядра. Увеличение количества ядрышек, общего количества аргентаффинных гранул за счет возрастания доли внеядрышковых гранул, преобладание клеток 2 типа при РГЭБА свидетельствует об усилении пролиферативных процессов при рецидивирующем течении. Рецидивирующее течение ГЭ характеризуется более высоким содержанием генетического материала, что отражается в увеличении среднего показателя плоидности ядер эпителия желез, усилением «пролиферативной активности» и возрастанием «индекса дисдифференцировки», свидетельствующем о небольшом увеличении выраженности полиплоидии ядер.
В свете изложенного полагаем, что достоверными прогностическими критериями возможного развития рецидива ГЭ следует считать: увеличение среднего значения площади желез до 0,6 мм2 (объемная доля желез до 40,5%) при ЖСК равном 0,69 и выше; увеличение наибольшего размера ядра до 16,8 мкм при уменьшении фактора формы ядра до 0,65 и меньше; увеличение количества аргентаффинных гранул до 4,86 на ядро эпителиоцита при возрастании количества внеядрышковых включений до 1,99, что составляет 41% от всех гранул в клетке и более; возрастание среднего количества ядрышек на ядро эпителиоцита до 1,53 и больше; увеличение количества клеток 2 типа среди эпителиоцитов до 83,46% при уменьшении количества клеток 1 типа до 16,54%; увеличение средней плоидности ядер эпителия желез до 3,68с; усиление «пролиферативной активности» до 1,68 единиц; возрастание «индекса дисдифференцировки» до 1,71.
Дальнейшее увеличение размеров клеток железистого эпителия, площади, диаметра, фактора формы ядра, ядерно-клеточного отношения, при уменьшении стромального компонента и высоком железисто-стромальном коэффициенте, увеличение количества ядрышек, возрастание количества внеядрышковых аргентаффинных гранул, появление среди эпителиоцитов клеток 3 типа, нарастание значений средней плоидности ядер клеток, «пролиферативной активности», «индекса дисдифференцировки» может свидетельствовать о возможном переходе процесса в фазу атипичной гиперплазии.
ВЫВОДЫ
- В настоящее время рецидивирующей гиперплазией эндометрия страдают женщины позднего репродуктивного и перименопаузального возраста (средний возраст – 46,2 лет, 95%ДИ = 43,8-48,5), чаще (57,7%) служащие или неработающие (из них 19,2% пенсионерок), имеющие отягощенный акушерско-гинекологический анамнез (альгоменорея, частые искусственные аборты, хронический эндометрит и аднексит, миома тела матки) и соматический анамнез (избыточная масса тела и ожирение, артериальная гипертензия, заболевания гепатобилиарной системы). Ведущими клиническими проявлениями рецидива гиперплазии эндометрия являются маточные кровотечения, выраженный болевой синдром, чувство слабости и головокружения.
- Структурными и морфометрическими особенностями эндометрия при рецидивирующей гиперплазии слизистой оболочки матки в сравнении с нерецидивирующим вариантом является в равной степени частая регистрация простой и сложной форм гиперплазии, ее сочетание в трети наблюдений с хроническим неспецифическим эндометритом низкой степени активности воспалительного процесса, преобладание железистого компартмента над стромальным (рост средних показателей площади желез и железисто-стромального коэффициента), нарастание ядерно-клеточных показателей (среднего значения площади клетки, площади, периметра, диаметра и наибольшего размера ядра, имеющего характерную палочковидную форму).
- При рецидивирующей гиперплазии эндометрия по сравнению с нерецидивирующей гиперплазией возрастает плоидность клеток, что проявляется увеличением значений показателя «пролиферативная активность» и «индекс дисдифференцировки», содержания паратриплоидных (35%) и парадиплоидных (28,1%) ядер.
- При рецидивирующей гиперплазии эндометрия в сравнении с нерецидивирующим вариантом гиперплазии происходит усиление белковосинтетической и пролиферативной активности, а также возрастание скорости пролиферации клеток железистого эпителия, что проявляется увеличением значений среднего количества ядрышек на ядро, общего числа аргентаффинных гранул в ядре, внеядрышковых гранул, представительства клеток 2 типа (83,5%) по отношению к клеткам 1 типа (16,5%).
- Достоверными морфометрическими прогностическими критериями вероятного развития рецидива гиперплазии эндометрия следует считать:
- увеличение среднего значения площади желез до 0,6 мм2 (объемная доля желез до 40,5%) при железисто-стромальном коэффициенте равном 0,69 и выше;
- возрастание наибольшего размера ядра до 16,8 мкм при уменьшении фактора формы ядра до 0,65 и ниже;
- увеличение количества аргентаффинных гранул до 4,86 на ядро эпителиоцита при возрастании числа внеядрышковых включений до 1,99, составляющих 41% и более от всех гранул в ядре;
- повышение уровня среднего количества ядрышек на ядро эпителиоцита до 1,53 и больше;
- увеличение количества клеток 2 типа среди эпителиоцитов до 83,5%;
- увеличение средней плоидности ядер эпителия желез до 3,68с и выше, усиление «пролиферативной активности» до 1,68 единиц и выше, возрастание «индекса дисдифференцировки» до 1,71 и выше.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Для построения прогноза вероятного развития рецидива гиперплазии эндометрия целесообразно проведение морфометрического исследования биоптатов слизистой оболочки матки с верификацией ряда параметров, отражающих усиление пролиферативного потенциала патологически измененного эндометрия и имеющих достоверное прогностическое значение: площади желез, стромы, клетки, ядра, периметра, диаметра, наименьшего и наибольшего размеров и фактора формы ядра с вычислением значения стереометрических индексов (железисто-стромального коэффициента и ядерно-клеточного отношения).
- Для оценки пролиферативной активности эпителиальных клеток эндометриальных желез при гиперплазии эндометрия следует использовать доступный метод выявления уровня экспрессии аргентаффинных белков областей ядрышковых организаторов, имеющий большую диагностическую ценность в определении скорости клеточной пролиферации и прогнозировании вероятного рецидива болезни.
- Для исследования плоидности эпителиоцитов слизистой оболочки матки, отражающей динамику и интенсивность их пролиферации, с целью построения прогноза вероятного рецидива гиперплазии эндометрия следует использовать доступный и быстрый метод микроспектрофотометрии с анализатором изображения с вычислением показателей «пролиферативной активности» и «индекса дисдифференцировки».
- Для профилактики рецидива гиперплазии эндометрия помимо традиционных гормональных воздействий с учетом рецептивности слизистой оболочки матки и этиотропной противовоспалительной терапии сочетанной патологии внутренних гениталий целесообразно применять таргетные медикаментозные препараты с антипролиферативным действием.
СПИСОК РАБОТ ОПУБЛИКОВАННЫХ ПО ТЕМЕ
ДИССЕРТАЦИИ
- Казачков Е.Л. Патоморфология лейомиомы матки в сочетании с гиперплазией эндометрия в репродуктивном возрасте / Е.Л. Казачков, Э.А. Казачкова, Ю.А. Медведева // Актуальные проблемы морфологии: сб. науч. тр. Всерос. науч. – практ. конф. – Красноярск, 2004. – С.125-126.
- Медведева Ю.А. Лейомиома матки в сочетании с гиперпластическими процессами эндометрия: морфологическая характеристика в возрастном аспекте / Ю.А. Медведева, Е.Л.Казачков, Казачкова Э.А., Егунян А.Ш. // Актуальные вопросы хирургии: сб. науч.-практ. работ. – Челябинск, 2004. – Т.1, вып.5. – С. 260-265.
- Медведева Ю.А. Патоморфологическая характеристика гиперпластических процессов эндометрия, лейомиомы матки и их сочетаний в возрастном аспекте / Ю.А. Медведева, Казачкова Э.А., Казачков Е.Л., Егунян А.Ш., Родионов А.С. // Материалы V съезда врачей Челябинской области – Челябинск, 2004. – Т. II. – С.266-268.
- Медведева Ю.А. Атипическая гиперплазия эндометрия: терминология, классификация, морфологические критерии на современном этапе / Ю.А. Медведева, Е.Л. Казачков, Э.А. Казачкова, Е.Е Воропаева // Сборник научных работ сотрудников АНО «МСЧ Аги ОАО «ММК»» – Магнитогорск: МиниТип, 2006. – С.159-163
- Медведева Ю.А. Атипичная гиперплазия эндометрия: обзор литературы и собственное исследование / Ю.А. Медведева, Е.Л. Казачков, Э.А. Казачкова // Верхневолжский мед. журн. – 2007. – Т.5, вып. 1-2. – С.69-70.
- Медведева Ю.А. Атипичная гиперплазия эндометрия: современный взгляд на проблему (обзор литературы и собственные исследования) / Ю.А. Медведева, Е.Л.Казачков, Э.А. Казачкова // Актуальные вопросы акушерства и гинекологии в последипломном образовании врача: сб. науч. работ конференции. – Челябинск, 2007 – С.30-31.
- Медведева Ю.А. Морфологический анализ атипичной гиперплазии эндометрия / Ю.А. Медведева, Е.Л.Казачков, Э.А. Казачкова // Вестн. Рос. воен.-мед. акад. – 2007. – № 1(17). – С.707-708.
- Коваленко В.Л. Актуальные вопросы патоморфологии инфекционно-воспалительных, гиперпластических и опухолевых процессов женской половой сферы / В.Л.Коваленко, Е.Л.Казачков, Э.А.Казачкова, О.В.Подобед, И.В.Фоминых, Е.Е.Воропаева, Г.В.Сычугов, Ю.А. Медведева, Е.В.Малахова, А.Ш.Егунян, О.А.Алимова, Е.О.Бирюкова, К.С.Тукай, И.Г. Хелашвили // Медицинская наука и образование Урала. –2008. – Т.52, №2. – С.44-47.
- Медведева Ю.А. Рецидивирующая гиперплазия эндометрия: морфологические критерии прогноза / Ю.А. Медведева, Э.А. Казачкова, Е.Л. Казачков, // Материалы II-го регионального научного форума «Мать и дитя» – Сочи, 2008. – С.177.
- Медведева Ю.А. Морфометрические критерии прогноза рецидивирования гиперплазии эндометрия / Ю.А. Медведева, Казачков Е.Л., Казачкова Э.А. Медведева Т.В. // Актуальные проблемы патологоанатомической службы муниципальных учреждений здравоохранения: материалы Всерос. науч.-практ. патологоанатомической конф. – Челябинск, 2008. – С.267-269.
- Медведева Ю.А. Активность ядрышковых организаторов железистого эпителия при рецидивирующей гиперплазии эндометрия / Ю.А. Медведева // Новые технологии в здравоохранении: сб. науч. тр. – Челябинск, 2008. – Вып. 7. – С.216-217.
- Медведева Ю.А. Морфологическая характеристика атипичной гиперплазии эндометрия / Ю.А. Медведева // Материалы VI итоговой научно-практической конференции молодых ученых Челябинской государственной медицинской академии. – Челябинск, 2008. – С.82-83.
- Медведева Ю.А. Плоидность железистого эпителия слизистой оболочки матки при рецидивирующей гиперплазии эндометрия / Ю.А. Медведева, Казачков Е.Л., Казачкова Э.А. // Актуальные вопросы патологической анатомии: материалы III съезда Рос. общ-ва патологоанатомов. – Самара, 2009. – Т.2. – С.316-318.
- Казачков Е.Л. Морфологические критерии прогноза рецидивирования гиперплазии эндометрия / Е.Л.Казачков, Ю.А. Медведева, Э.А. Казачкова // Уральский мед. журн. – 2009. – №4. – С.35-41.
- Казачкова Э.А. Структурные критерии прогноза рецидивирования гиперплазии эндометрия / Э.А. Казачкова, Е.Л.Казачков, Ю.А. Медведева // Материалы Х-го Всероссийского научного форума «Мать и дитя». – М., 2009. – С. 316-317.
СПИСОК СОКРАЩЕНИЙ
АГЭ – атипичная гиперплазия эндометрия.
ГЭ – гиперплазия эндометрия.
ГЭБА – гиперплазия эндометрия без атипии.
ЖСК – железисто-стромальный коэффициент.
ИМТ – индекс массы тела.
ПГЭБА – простая гиперплазия эндометрия без атипии.
ПРГЭБА – простая рецидивирующая гиперплазия эндометрия без атипии.
РГЭБА – рецидивирующая гиперплазия эндометрия без атипии.
РЭ – рак эндометрия.
с – единица плоидности клеток, равна половине диплоидного набора хромосом в ядрах малых лимфоцитов.
СГЭБА – сложная гиперплазия эндометрия без атипии.
СРГЭБА – сложная рецидивирующая гиперплазия эндометрия без атипии.
ФФ – фактор формы.
ХНЭ – хронический неспецифический эндометрит.
ЯКО – ядерно-клеточное отношение.
ЯО – ядрышковые организаторы.
95% ДИ – доверительный интервал, 95% уровень надежности.
AgNORs (argyrophilic nucleolar organizer regions) – районы ядрышковых организаторов.
На правах рукописи
МЕДВЕДЕВА
ЮЛИЯ АЛЕКСЕЕВНА
КЛИНИКО-МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА РЕЦИДИВИРУЮЩЕЙ ГИПЕРПЛАЗИИ ЭНДОМЕТРИЯ НА СОВРЕМЕННОМ ЭТАПЕ
14.03.02 – патологическая анатомия
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Челябинск – 2010

