Клинико-иммунологические и нейроэндокринные особенности течения генерализованной формы миастении
На правах рукописи
ЦИНЗЕРЛИНГ
Наталья Всеволодовна
КЛИНИКО-ИММУНОЛОГИЧЕСКИЕ И НЕЙРОЭНДОКРИННЫЕ ОСОБЕННОСТИ ТЕЧЕНИЯ ГЕНЕРАЛИЗОВАННОЙ ФОРМЫ МИАСТЕНИИ
14.00.13 – нервные болезни
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт-Петербург
2008
Работа выполнена в Государственном образовательном учреждении дополнительного профессионального образования «Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию».
Научные руководители:
доктор медицинских наук профессор Жулёв Николай Михайлович
Официальные оппоненты:
доктор медицинских наук профессор Помников Виктор Григорьевич
доктор медицинский наук профессор Одинак Мирослав Михайлович
Ведущая организация: ГОУ ВПО «Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова Федерального агентства по здравоохранению и социальному развитию».
Защита состоится «____» ______________ 2008 г. в _____ часов на заседании диссертационного совета Д 208.089.05 при ГОУ ДПО «Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию» (191015, Санкт-Петербург, ул. Кирочная, 41).
С диссертацией можно ознакомиться в фундаментальной библиотеке ГОУ ДПО «Санкт-Петербургская медицинская академия последипломного образования Росздрава» (195196 Санкт-Петербург, Заневский пр., 1/82).
Автореферат разослан «_____» _____________ 2008 г.
Ученый секретарь диссертационного совета доктор медицинских наук профессор В.В. Кирьянова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Проблема нервно-мышечных заболеваний продолжает оставаться одной из сложных в неврологии (Кузин М.И., Гехт Б.М., 1996; Косачев В.Д., 2007; Barohn R.J., 2008).
Миастения (myasthenia gravis) представляет собой тяжёлое аутоиммунное заболевание с прогрессирующим типом течения, в основе патогенеза которого лежит антителоопосредованное нарушение нервно-мышечного проведения, клинически проявляющееся развитием патологической мышечной слабости и утомляемости различных мышечных групп (Гехт Б.М., 1982; Лайсек Р.П., Барчи Р.Л., 1984; Лобзин С.В., Долго-Сабуров Б.В., 2004; Drachman D.B.1994).
В последнее время отмечается тенденция к увеличению заболеваемости миастенией (Гехт Б.М., Санадзе А.Г. с соавт., 2003; Barohn R.J., 2008). Наиболее часто (до 80%) встречается генерализованная форма заболевания, нередко приводящая к тяжелой инвалидизации пациентов.
Несмотря на постоянно расширяющийся арсенал медикаментозных средств, используемых в лечении генерализованной миастении и направленных на подавление патологических аутоиммунных процессов, зачастую не удается достигнуть должного терапевтического контроля над этим тяжелым, жизнеугрожающим заболеванием. Данный факт косвенно подтверждает существование иных механизмов активации и поддержания активности патологического аутоиммунного процесса. В частности, выявленное взаимное влияние нервной, эндокринной и иммунной систем способно оказывать воздействие на возникновение и течение аутоиммунных заболеваний (Besedovsky H.O., Del Ray A., 1996; Freeman M.E. et al., 2000).
В частности, значительный интерес представляет изучение тимуса – органа, который является одновременно частью и иммунной и эндокринной систем, служит как источником гормонов, так и местом приложения их действия. Помимо этого вилочковой железе отведена важная роль в иммунопатогенезе миастении (Сепп Е.К., Ланцова В.Б., 2002; Nicolle M.W., 2002).
Доказано влияние глюкокортикоидных, половых и тиреиодных гормонов на процессы созревания и дифференцировки Т-лимфоцитов в ткани вилочковой железы, что дает основание предполагать наличие строгого гормонального контроля всех основных событий, происходящих в вилочковой железе (Blalock E.D., 1994; Besedovsky H.O., Del Ray A., 1996). Изучение же влияния группы пептидов гормона роста, в частности пролактина, на иммунную систему человека на настоящем этапе проведено недостаточно.
Пролактин вырабатывается не только лактотрофными клетками передней доли гипофиза, но и экстрапитуитарно, в частности клетками иммунной системы, выполняя роль цитокина (Ben-Jonathan N. et al., 1996; Freeman M.E. et al., 2000; Harris J. et al., 2004). Рецептор пролактина также является представителем рецепторов цитокинов I класса, экспрессируется на моноцитах, макрофагах, Т- и, преимущественно, В-лимфоцитах, клетках-киллерах, гранулоцитах и эпителиальных клетках тимуса (Bazan J.F., 1989; Peeva E., Zouali M., 2005)
Пролактин регулирует созревание CD 4- и CD 8- тимоцитов в CD 4+ и CD8+ Т-лимфоциты посредством экспрессии рецептора IL-2 и усиливает генерацию клеток-предшественников В-лимфоцитов, усиливает синтез иммуноглобулинов, а также вызывает уменьшение апоптоза среди переходных В-клеток, медиатором которого является иммуноглобулин IgM, и может играть важную роль в нарушении аутотолерантности В-клеток и развитии аутоиммунных реакций (Lahat N. et al., 1993; Orbach H., Shoenfeld Y., 2007). Пролактин также положительно регулирует Th1 класс цитокинов, является триггером в продукции IL-12, IL-1, IL-6 и интерферона- (INF) и усиливает влияние IL-2 на лимфоциты (Vera-Lastra O. et al., 2002; Peeva E., Zouali M., 2005).
Изучение взаимовлияния нервной, эндокринной и иммунной систем позволит разработать адекватную тактику лечения и контроля за течением миастении, улучшить прогноз заболевания. Учитывая все представленное, следует считать данную тему актуальной.
Цель исследования
Изучить влияние нейроэндокринных факторов на течение генерализованной формы миастении и определить влияние терапевтического и хирургического методов лечения на активность аутоиммунного процесса и титр антител к ацетилхолиновому рецептору.
Задачи исследования
- Проанализировать клинические особенности течения миастении у 180 больных генерализованной формой заболевания в зависимости от варианта морфологического изменения вилочковой железы.
- Изучить возможное влияние на показатели иммунитета и клиническую значимость пролактина при генерализованной форме миастении.
- Определить возможную корреляцию титра антител к ацетилхолиновому рецептору и уровня пролактина сыворотки у больных генерализованной формой миастении.
- Изучить взаимосвязь между титром антител к ацетилхолиновому рецептору и оперативным лечением миастении.
Научная новизна исследования
Проведены клинические, эндокринные и иммунологические сопоставления на большом количестве материала (180 больных генерализованной формой миастении). Изучены сопоставления гистологического варианта изменений тимуса и уровня антител к ацетилхолиновому рецептору и сывороточному пролактину. Выполнена оценка клинических особенностей течения генерализованной формы миастении в зависимости от титра антител к ацетилхолиновому рецептору с учетом тяжести заболевания и проводимой терапии.
Проведено исследование взаимосвязи титра антител к ацетилхолиновому рецептору и уровня пролактина сыворотки в исследуемой группе.
Определено влияние пролактина в качестве иммунологически активного агента на течение генерализованной формы миастении.
Практическая значимость
Знание особенностей взаимодействия нервной, эндокринной и иммунной систем организма человека, их взаимного влияния, позволит приобрести более полный контроль над тяжелым инвалидизирующим нервно-мышечным заболеванием, каковым является генерализованная миастения.
Подход к комплексной терапии миастении должен учитывать нейроиммунноэндокринную характеристику пациента, что может помочь в разработке стратегии индивидуального терапевтического лечения, прогнозировании течения заболевания.
Основные положения, выносимые на защиту
- В условиях адекватной иммуносупрессивной терапии течение генерализованной миастении ассоциированной с тимомой не отличается от других морфологических вариантов заболевания.
- Уровень пролактина сыворотки повышен у больных генерализованной формой миастении.
- Возможна корреляция титра антител к ацетилхолиновому рецептору и пролактином.
- Проведение хирургического лечения миастении приводит к изменению титра специфических антител.
Личный вклад соискателя
Личное участие соискателя охватывает отбор пациентов для исследования и лечения, формирование базы данных, определение уровня пролактина, статистическую обработку полученного материала, проведение лечебных мероприятий, разработку индивидуальных схем лечения.
Апробация работы
Основные положения диссертационной работы были представлены и обсуждены на международной конференции по проблемам аутоиммунных заболеваний Autoimmunity в Будапеште (2004), научно-практической конференции «Давиденковские чтения» (2006), IX Всероссийском съезде неврологов в Ярославле (2007).
Публикации
По материалам диссертации опубликовано 9 печатных работ, в том числе в российских журналах рекомендованных ВАК - 2, три в международных журналах на английском языке, 1 монография на английском языке.
Внедрение результатов работы
Результаты диссертационного исследования внедрены в практическую работу клиники нервных болезней Санкт-Петербургской медицинской академии последипломного образования. Основные научно-практические положения диссертации используются в педагогическом процессе на циклах повышения квалификации врачей на кафедре невропатологии им. акад. С.Н. Давиденкова Санкт-Петербургской медицинской академии последипломного образования.
Структура и объём диссертации
Диссертация состоит из введения, 5 глав (3 из них включены в раздел «Результаты собственных исследований»), заключения, выводов, практических рекомендаций и приложения. Список использованной литературы включает 167 литературных источников, из них 57 отечественных и 110 зарубежных авторов. Работа иллюстрирована 18 рисунками и содержит 9 таблиц.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
В ходе работы проанализированы результаты комплексного обследования и лечения 180 больных генерализованной формой миастении с дебютом заболевания в возрасте от 5 до 77 лет. Специальная выборка пациентов не проводилась.
Пациенты наблюдались и обследовались на базе клиники нервных болезней Санкт-Петербургской медицинской академии последипломного образования и базе центра по изучению миастении при Каролинском институте Стокгольма, в Швеции (Karolinska Institutet). Иммунологические исследования выполнены в Центре Молекулярной Медицины (Center for molecular medicine) при Каролинском институте Стокгольма, в Швеции.
На момент включения в базу данных средний возраст пациентов составил 51 год (16-89 лет). Среди пациентов преобладали женщины – 122 человека (67,8%), мужчин было 58 человек (32,2%). Продолжительность заболевания от момента установления диагноза до внесения в базу данных составила в среднем 17 лет (2-67 лет). Средний возраст пациентов на момент установления диагноза составил 35 лет (5-77 лет).
В диагностике генерализованной миастении был использован алгоритм, предложенный как в отечественной, так и в зарубежной литературе: неврологический осмотр с выполнением нагрузочных тестов, фармакологический тест, электронейрофизиологическое исследование (стимуляционная электронейромиография), методы лучевой диагностики (КТ, МРТ), морфологическое исследование операционного материала.
При сборе анамнеза особое внимание уделялось выявлению характерных симптомов миастении: факт наличия и особенность формулы двигательных расстройств, обусловленных патологической мышечной слабостью и утомляемостью; «миграция», изменчивость симптоматики во времени, склонность к волнообразному течению заболевания.
Неврологический осмотр состоял из общей и специфической части, к которой относились специальные методы выявления патологической мышечной утомляемости. Всем пациентам была проведена фармакологическая проба с подкожным введением 2,0 мл 0,05% раствора прозерина. Оценка мышечной силы до и после введения препарата проводилась по пятибалльной шкале (1 – парез, 5 – нормальная мышечная сила) с занесением в карту пациента.
Исследование нервно-мышечного поведения проводилось у всех пациентов в рамках диагностического алгоритма методом ритмической стимуляции, с использованием широко известной методики ( Гехт Б.М., Санадзе А.Г. с соавт., 2004; Санадзе А.Г., Касаткина Л.Ф., 2006; Nicolle M.W., 2002).
Методы лучевой диагностики применялись у всех больных на дооперационном этапе с целью установления состояния вилочковой железы и в 28,3% случаев (51 пациент) в отдаленном послеоперационном периоде при подозрении на рецидив новообразования или наличие эктопических очагов ткани тимуса.
Оперативное лечение, тимэктомия, было проведено всем пациентам исследуемой группы. Гистологическое исследование операционного материала проводилось также во всех случаях. Тимэктомия проводилась на отделения хирургии Медицинской Академии Последипломного Образования в С-Петербурге и Центра торакальной хирургии Каролинского института в Стокгольме по стандартным методикам. Операционный материал фиксировался в формалине и заливался в парафин по стандартным методам. Срезы окрашивались гематоксилином-эозином и пикрофуксином по Ван-Гизону. Оценка структурных изменений проводилась патологами соответствующих лабораторий.
Иммунологические обследования выполнялись в лаборатории Центра Молекулярной Медицины (руководитель лаборатории профессор Анн Кари Лефверт Prof. Ann-Kari Lefvert) при Каролинском институте в Стокгольме (Center for Molecular Medicine, Karolinska Institutet). Концентрацию антител к ацетилхолиновым рецепторам определяли радиоиммунологическим методом с помощью коммерческой тест системы (DLD Diagnostica GMBH, Германия). Определение субпопуляций лимфоцитов осуществлялось с применением специфических моноклональных антител в микроварианте лимфоцитотоксического комплемент-зависимого теста у 20 больных генерализованной формой миастении.
Определение уровня сывороточного пролактина проводено нами с помощью стандартного набора реагентов производства «Anogen, ON, Canada» у 160 пациентов исследуемой группы. Всем исследуемым лицам как исследуемой, так и контрольной групп, женского пола было проведено скрининговое исследование уровня хорионического гонадотропина в сыворотке крови для исключения беременности. Ни в одном случае факт беременности не подтвердился.
Полученные в процессе исследования медико-биологические данные обрабатывались c помощью программной системы STATISTICA for Windows (версия 5.11 Лиц. №AXXR402C29502 3FA). Данная система является интегрированной средой статистического анализа и обработки данных. Она осуществляет все расчеты по стандартным формулам математической статистики, используя только существующие, измеренные данные (все пропуски исключаются из расчетов и не учитываются при формировании выводов).
Результаты исследования
Все 180 пациентов были распределены на три группы в зависимости от варианта морфологических изменений вилочковой железы: I группа – тимома, 46 человек (25,4%), II группа – гиперплазия тимуса, 94 пациента (51,9%) и III группа – гистологически нормальное строение вилочковой железы – 40 человек (22,1%).
Таблица 1
Общая характеристика больных по группам
| Количество (n; %) | Пол | Дебют заболевания (среднее, лет) | ||
| Мужчины | Женщины | |||
| Тимома | 46 (25,4%) | 21 (45,7%) | 25 (54,3%) | 44 |
| Гиперплазия | 94 (51,9%) | 14 (14,9%) | 80 (85,1%) | 26 |
| Нормальное строение тимуса | 40 (22,1%) | 23 (57,5%) | 17 (42,5%) | 46 |
| ВСЕГО | 180 (100%) | 58 (32,2%) | 122 (67,8%) | 35 |
Характеристика пациентов по группам в соответствии со степенью тяжести миастении на момент установления диагноза представлена в Таблице 2.
Таблица 2
Характеристика пациентов по группам в соответствии со степенью тяжести миастении на момент установления диагноза
| Степень тяжести заболевания | ||||
| 2а | 2в | 3а | 3в | |
| Тимома | 18 (39,1%) | 20 (43,5%) | 6 (13,0%) | 2 (4.3%) |
| Гиперплазия | 82 (87,2%) | 12 (12,8%) | 0 (0%) | 0 (0%) |
| Нормальное строение тимуса | 27 (67,5%) | 9 (22,5%) | 3 (7,5%) | 1 (2,5%) |
| ВСЕГО | 126 (70,0%) | 42 (23,3%) | 9 (5,0%) | 3 (1,7%) |
Неврологическая картина заболевания у обследованных пациентов не отличалась от таковой, описанной в отечественной и зарубежной литературе (Кузин М.И., Гехт Б.М., 1996; Сепп Е.К., Ланцова В.Б., 2002; Barohn R.J., 2008). Наиболее часто нами было описано наличие у пациентов патологической слабости и утомляемости скелетных мышц (96,7%), птоза (92,8%), слабости передней группы мышц шеи (88,3%), а также глазодвигательных нарушений (79,4%). Формула двигательных расстройств в исследуемой группе соответствовала классической схеме, описанной в литературе (Гехт Б.М., Санадзе А.Г., 2003; Grob D. et al., 1987).
Оперативное лечение – тимэктомия – было проведено всем пациентам в исследуемой группе. Средний возраст пациентов на момент операции составил 39 лет (8-81 год).
Определение титра антител к АХР до или после оперативного лечения проводилось у всех пациентов исследуемой группы (Таблица 3).
Таблица 3
Определение антител к ацетилхолиновому рецептору в исследуемых подгруппах
| До операции (n, %) | После операции (n, %) | Серопозитивные до операции (n, %) | Серонегативные до операции (n, %) | |
| Тимома | 35 (76,1%) | 11 (23,9%) | 42 (91,3%) | 4 (8,7%) |
| Гиперплазия | 86 (91,5%) | 8 (8,5%) | 82 (87,2%) | 12 (12,8%) |
| Нормальное строение тимуса | 36 (90%) | 4 (10%) | 29 (72,5%) | 11(82,5%) |
| ВСЕГО | 157 (87,2%) | 23 (12,8%) | 153 (85%) | 27(15%) |
В большинстве случаев (87,2%) иммунологическое исследование проводилось в структуре клинического алгоритма установления диагноза генерализованной миастении. У 23 пациентов определение титра антител к АХР было выполнено после оперативного лечения. В подавляющем большинстве случаев (85%) миастения носила серопозитивный характер и лишь в 15% случаев (27 человек) при предоперационном исследовании была выявлена серонегативная форма заболевания. В этих случаях диагноз был подтвержден клиническими и нейрофизиологическими данными.
На графике (рис.1) представлены результаты статистического анализа уровня антител к АХР для всех пациентов на до- и послеоперационном этапе.

Рис.1. Уровень сывороточных антител к ацетилхолиновому рецептору относительно тимэктомии (ммоль/л)
По результатам статистического анализа выявлена тенденция к снижению уровня сывороточных антител к АХР после тимэктомии, однако достаточной статистической достоверности получено не было (0,05 р 0,1).
Нами был проведен анализ уровня антител к АХР до и после операции в исследуемых подгруппах, по результатам которого в группе II было отмечен более высокий уровень иммунологической активности на дооперационном этапе.
Результаты исследования после операционного периода не показали статистически достоверных различий между исследуемыми группами (р< 0,05).
Определение общего иммунологического статуса (субпопуляции лимфоцитов) было проведено у 20 больных генерализованной формой миастении. Специальной выборки этих пациентов не проводилось. Пациенты, вошедшие в данное исследование, получали различные варианты лечения: базовая терапия АХЭП в индивидуальных дозировках (100%), кортикостероидные препараты в малых дозах (12 больных, 60%), азатиоприн (3 больных, 15%). Среди больных 2 пациента относились к I группе, 14 – ко второй и 4 пациента – к III группе.
Определение уровня пролактина сыворотки было проведено у 160 пациентов из исследуемой группы. В качестве группы контроля была использована сыворотка здоровых доноров (группа сравнима по полу и возрасту) из биобанка для научных исследований Центра Молекулярной медицины при Каролинском институте Стокгольма. По результатам проведенного статистического анализа, показано, что статистически достоверно уровень пролактина сыворотки был повышен у пациентов исследуемой группы (до 11,9 ммоль/л). Наиболее значительно (p<0,00074) данный показатель был повышен у больных миастенией женского пола.
Результаты анализа уровня пролактина сыворотки в зависимости от типа морфологических изменений тимуса представлены на рисунке 16. Как видно из представленного графика, уровень пролактина сыворотки не имел статистически достоверных различий в исследуемых подгруппах, равно как и статистической корреляции с вариантом изменения структуры вилочковой железы.
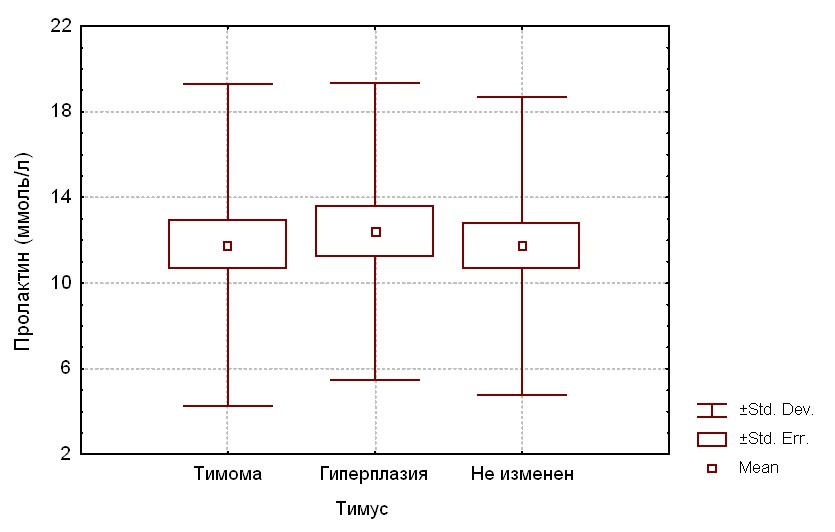
Рис. 2. Уровень пролактина (ммоль/л) в исследуемых подгруппах
Также нами был проведено исследование возможной корреляции между уровнем антител к АХР и уровнем пролактина сыворотки до и после операции в исследуемой группе. В обоих случаях статистически достоверная корреляция получена не была (р = 1,026).
Схема терапии в исследуемой группе включала в себя базовый прием антихолинэстеразных препаратов (пиридостигмина бромид) в индивидуально подобранных дозах, а также иммуносупрессивные препараты в виде моно- или комбинированной терапии. В исследуемой группе 98 пациентов (54,4%) получали только базовую терапию АХЭП.
Из группы иммуносупрессивных препаратов наиболее часто применялись глюкокортикостероидные средства (метилпреднизолон), азатиоприн, циклоспорин, циклофосфамид. В единичных случаях были применены микофенолата мофетил, такролимус, внутривенное введение иммуноглобулина.
В 82 случаях (45,6%) описано применение как монотерапии одним из указанных средств, так и комбинированного лечения. Монотерапия одним из указанных иммуносупрессантов использовалась в 46 случаях (25,6%). У 36 пациентов (20%) были применены комбинированные варианты лечения.
Продолжительность цитостатической терапии составляла от нескольких дней (в случае пульс-терапии кортикостероидными препаратами) до 32 лет, в среднем, длительность приема составила 4 года. Длительность приема иммуносупрессивных препаратов относительно исследуемых подгрупп отражена в рисунке 3.

Рис. 3. Длительность иммуносупрессивной терапии в исследуемых группах (годы)
Глюкокортикостероидные препараты применялись в виде пульс-терапии из расчета 1,5-2-2,5 мг/кг/сут. Дозу препарата определяла тяжесть состояния пациента и переносимость. Кортикостероидные средства вводились, как правило, 3-4 суток внутривенно, капельно. Интервал проведения пульс-терапии составлял 4-12 месяцев (в среднем она проводилась каждые 6 месяцев) и определялся степенью тяжести заболевания.
Цитостатические препараты использовались строго в соответствии с рекомендациями по их применению. Наиболее часто (62 пациентов; 75,6%) отмечено применение азатиоприна, как в качестве монотерапии, так и в составе комбинированного лечения.
С учетом существования традиционного мнения (Лобзин В.С. с соавт., 1988; Косачев В.Д. с соавт., 2006) о возможном повышении частоты встречаемости онкологических заболеваний у пациентов, получающих цитостатическую терапию, мы провели соответствующий статистический анализ материала.
В ходе анализа нами не было найдено статистической корреляции между частотой использования цитостатиков и развитием онкологических заболеваний у пациентов в исследуемых группах: среди группы пациентов не получавших цитостатические препараты частота онкологических заболеваний составила 8,2% случаев, тогда как у получавших данный вариант лечения она составила 9,8% (р<0,05).
При условии проведения индивидуального лечения с использованием, в том числе различных иммуносупрессивных препаратов, ремиссия была достигнута в 31,1% (56 человек).
Под понятием «ремиссия» мы понимали полностью бессимптомное течение миастении без приема АХЭП, в том числе при условии адекватных физических нагрузок, при этом использование цитостатических препаратов мы считали приемлемым.
Максимальная длительность ремиссии на момент закрытия базы данных составила 32 года (группа II), минимальная – 6 месяцев. Частота наступления случаев ремиссии в исследуемых группах представлена на рисунке 4.

Рис.4. Частота наступления ремиссии в исследуемых группах
Частота ремиссии в исследуемых группах не отличалась, в том числе и у пациентов с тимомой: так в I группе ремиссия отмечена у 13 пациентов (28,2%), во второй группе – у 94 (37,2%) и в III группе у 9 больных (22,5%).
ВЫВОДЫ
- Установлена связь заболевания с наличием патологии вилочковой железы: среди обследованных 180 больных генерализованной формой миастенией в 77,8% (140 пациентов) отмечалось изменение морфологической структуры тимуса. В 32,9% случаев нами описано наличие тимомы, в 67,1% - лимфофолликулярной гиперплазии.
- Течение генерализованной формы миастении ассоциированной с тимомой по степени тяжести не отличается от других форм при условии адекватного использования цитостатических и иммуносупрессивных препаратов (уровень ремиссии в I группе составил 28,2%, во II - 37,2%, в III – 22,5%).
- Активное использование иммуносупрессантов не приводит к росту числа онкологических заболеваний (р < 0,05).
- Пролактин повышен у всех больных генерализованной формой миастении (11,9 ммоль/л, p<0,0025), однако у женщин он достигает более высоких значений (14,8 ммоль/л, p<0,00074), вне зависимости от варианта морфологических изменений вилочковой железы.
- Уровень пролактина сыворотки не коррелирует с уровнем антител к ацетилхолиновому рецептору (р = 1,026).
- Отсутствует достоверное снижение уровня антител к ацетилхолиновому рецептору после оперативного удаления вилочковой железы (0,05 р < 0,1).
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Лечение генерализованной формы миастении рекомендовано с учетом морфологического строения тимуса.
2. Активное использование иммуносупрессивной и цитостатической терапии, особенно в случае наличия тимомы, является обоснованным и приводит к более благоприятному варианту течения заболевания и высокой частоте ремиссии.
3. Определение титра антител к ацетилхолиновому рецептору следует использовать в рамках диагностического алгоритма при установлении диагноза генерализованной миастении.
4. Для исключения дополнительного патологического влияния со стороны эндокринной системы рекомендовано определение гормонального профиля у больных генерализованной формой миастении, в частности, уточнение уровня пролактина сыворотки.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Шабалов Н.П. Дифференциальная диагностика миастении у
детей / Н.П. Шабалов, М.Л. Чухловина, Н.В. Цинзерлинг // Материалы Российской научной конференции "Из XIX в XX век". СПб, 2005. С.210 211.
2. Шабалов Н.П. Особенности патогенеза, клиники и диагностики миастении в детском возрасте / Н.П. Шабалов, М.Л. Чухловина, Н.В. Цинзерлинг // Педиатрия – 2006. – №3. – С. 90 – 94.
3. Жулев Н.М. Диагностика и лечение миастении / Н.М. Жулев, А. Кери, В.Д. Косачев, Л.А. Полякова, Л.Н. Дементьева, В.В. Баранов, С.А. Кондратьев Н.В. Цинзерлинг // Научные труды IX Всероссийского съезда неврологов. - Ярославль, 2006. – С. 104.
4. Цинзерлинг Н.В. Клинико-эпидемиологические аспекты миастении в Швеции / Н.В. Цинзерлинг, Н.М. Жулев, А.К. Лефверт, Р. Пирсканен, С.А. Кондратьев // Материалы конференции, посв. 80-летию со дня рождения проф. Б.М. Гехта / под ред. Е.И. Гусева и др. – М.: ЗАО «Светлица», 2007. – С. 151–156.
5. Косачев В.Д. Стимуляционная электромиография в диагностике миастении / В.Д. Косачев, Н.М. Жулев, В.В. Баранов, В.В. Косачев, Н.В. Цинзерлинг // Вестник Российской Военно-медицинской академии. – 2007. – Ч.1. – С.337.
6. Tsinzerling N. Patients with myasthenia gravis accompanied by thymoma constitute a separate disease entity / N. Tsinzerling, G. Matell, R. Pirskanen, A.K. Lefvert // Autoimmunity reviews. – 2004. – Vol.3.– P.77.
7. Tsinzerling N. Raised prolactin levels in myasthenia gravis: two case reports and a study of two patient populations / N. Tsinzerling, R. Pirskanen, G. Matell, N.M. Zhulev, M.L. Chukhlovina, A.K. Lefvert // Acta Neurol. Scand. – 2006. – Vol.114, №5. – P.346 – 349.
8. Tsinzerling N. Myasthenia gravis: clinical aspects and possible involvement of prolactin. – Karolinska University Press. – 2006. – 56 P.
9. Tsinzerling N. Myasthenia gravis: a long term follow-up study of Swedish patients with specific reference to thymic histology / N. Tsinzerling, A.K. Lefvert, G. Matell, R. Pirskanen- Matell // J. Neurol. Neurosurg. Psychiatry. – 2007. – Vol.78, №10. – P.1109 – 1112.

