Диагностика и лечение ингибиторной формы гемофилии
На правах рукописи
ЗОЗУЛЯ
НАДЕЖДА ИВАНОВНА
ДИАГНОСТИКА И ЛЕЧЕНИЕ
ИНГИБИТОРНОЙ ФОРМЫ ГЕМОФИЛИИ
14.01.21 – гематология и переливание крови
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Москва - 2010
Работа выполнена в Учреждении Российской академии медицинских наук Гематологический научный центр РАМН
Научный консультант:
доктор медицинских наук, профессор,
действительный член АТН РФ Плющ Ольга Павловна
Официальные оппоненты:
доктор медицинских наук, профессор,
член-корреспондент РАМН Румянцев Александр Григорьевич
доктор медицинских наук, профессор Васильев Сергей Александрович
доктор медицинских наук, профессор Папаян Людмила Петровна
Ведущая организация:
Федеральное государственное учреждение Кировский научно-исследовательский институт гематологии и переливания крови Федерального медико-биологического агентства России.
Защита состоится «_____» _________________ 2010 года в ______ часов на заседании диссертационного совета Д 001.042.01 в Учреждении Российской академии медицинских наук Гематологический научный центр РАМН (125167, г. Москва, Новый Зыковский проезд, дом 4).
С диссертацией можно ознакомиться в библиотеке Учреждения Российской академии медицинских наук Гематологический научный центр РАМН
Автореферат разослан «_____» ________________ 2010 г.
Ученый секретарь диссертационного совета,
кандидат медицинских наук Зыбунова Елена Евгеньевна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. У каждого пациента с гемофилией, получающего заместительную терапию, имеется потенциальный риск развития ингибиторов к факторам свертывания крови (В.В. Вдовин, 1999; О.П. Плющ с соавт., 2005; Y. Sultan 2002; E. Berntorp et al., 2006; D. DiMichele et al., 2006). Принадлежность гемофилии к орфанным заболеваниям (Ю.Н. Андреев, 2006; В.М. Чернов с соавт., 2008; P.H.B. Bolton-Maggs et al., 2003; J. Astermark, 2006; Katherine A. Lyseng-Williamson et al., 2007), относительно редкая частота возникновения ингибиторов в общей группе больных (H.H. Brackmann et al., 2002; J. Wight et al., 2003; N.S. Key et al., 2004; C.R.M. Hay et al., 2006) и недавно появившаяся возможность выбора разных методов терапии для данной когорты пациентов в России (А.И. Воробьев с соавт., 2006) обуславливают отсутствие опыта ведения этих больных у практикующих врачей нашей страны. Малочисленность пациентов с их разрозненным наблюдением в различных гематологических клиниках приводят к частым ошибкам в диагностике этого осложнения и лечении данных больных.
Проблема возникновения и элиминации ингибиторов остается приоритетной в терапии пациентов с гемофилией, так как появление антител значительно повышает стоимость лечения больных (О.П. Плющ с соавт., 2006; J. Goudemand, 1999; P. Gautier et al., 2002; E.G. Rogoff et al., 2002; C. Knight, 2005; J. Teitel, 2006), ухудшает их качество жизни (КЖ) (A. Gringeri et al., 2003; L. Scalone et al., 2006; M. Morfini et al., 2007), приводит к инвалидизации пациентов (C.R.M. Hay et al., 2000; M. Koestenberg, 2000; A. Sharathkumar et al., 2003) и их ранней смертности (S.C. Darby, 2004).
Кроме недостатка знаний врачей о данном осложнении гемофилии существуют также и другие проблемы: нет эпидемиологических сведений о распространенности этого заболевания в нашей стране, имеются лишь единичные сведения об иммунологических нарушениях при ингибиторной форме гемофилии (К.Г. Копылов, 1996; Е.В. Журавлева, 1999; M. Sasgary et al., 2002; K. Pfistershammer et al., 2006; B. Waters et al., 2009), нет достаточной ясности в вопросах проведения индукции иммунологической толерантности (ИИТ), окончательно не определено влияние прогностических факторов на успех терапии, не выполнялся анализ затрат на лечение больных. Проведение фармакоэкономического анализа вкупе с оценкой клинической эффективности и КЖ пациентов позволяет обосновать целесообразность выбора различных вариантов лечения больных.
Повышению качества лечебно-профилактической помощи больным гемофилией и оптимизации планирования затрат на медикаментозное обеспечение будет способствовать создание единого Всероссийского регистра пациентов с ингибиторной формой гемофилии с персонификацией дозировок антигемофильных препаратов. Регистр позволит планировать оказание медицинской и социальной помощи конкретному пациенту, контролировать ее адекватность и эффективность, гарантировать оказание больным своевременной современной медицинской помощи.
Цель работы: разработать и внедрить в практику стандарты диагностики и лечения пациентов с ингибиторной формой гемофилии на основе персонифицированного учета пациентов и планирования средств на медикаментозное обеспечение.
Основные задачи:
- Создать Всероссийский регистр пациентов с ингибиторной формой гемофилии.
- Определить алгоритм диагностики наличия ингибиторов к факторам свертывания крови.
- Внедрить и провести сравнение стандартных методов лечения пациентов с ингибиторной формой гемофилии.
- Оценить степень влияния проведения различных дополнительных методов тестирования in vitro (теста генерации тромбина, индивидуального подбора препарата) перед началом ИИТ на повышение эффективности лечения.
- Изучить состояние клеточного и гуморального иммунитета у больных с наличием ингибиторов и провести мониторинг выявленных нарушений.
- Определить возможные иммунологические маркеры достижения толерантности.
- Проанализировать качество жизни больных с ингибиторной формой гемофилии при проведении различных вариантов лечения.
- Провести фармакоэкономический анализ лечения пациентов с наличием ингибиторов.
- Разработать модели лечения пациентов с ингибиторной формой гемофилии.
Научная новизна.
Впервые проведено комплексное изучение ингибиторной формы гемофилии. Проанализирован клинический фенотип заболевания и анамнестические данные 168 пациентов, позволяющие определить возможные факторы риска для развития ингибиторов.
Впервые определено состояние клеточного и гуморального иммунитета у больных с ингибиторной формой гемофилии, разделенных на группы в зависимости от вида получаемого лечения. Проведен мониторинг основных параметров иммунного статуса через 6 и 12 месяцев терапии. Обозначены субпопуляции лимфоцитов, имеющие ключевое значение для поддержания и/или элиминации ингибиторов. Выявлены нарушения в количественном соотношении субклассов иммуноглобулина G (IgG) на различных этапах проведения ИИТ. Определены возможные иммунологические маркеры достижения толерантности к FVIII.
Впервые большой группе пациентов с ингибиторной формой гемофилии (24% от общего числа зарегистрированных больных) проведена терапия, направленная на достижение иммунологической толерантности. С учетом наличия прогностически неблагоприятных для ИИТ факторов у 94% пациентов, перед началом лечения были использованы методики индивидуального подбора препарата и тест генерации тромбина, позволившие, по нашему мнению, повысить эффективность терапии.
Представлены результаты высокой эффективности применения эптаког альфа (активированного) в лечении пациентов с ингибиторной формой гемофилии. Доказана необходимость строгого соблюдения стандартов терапии данным препаратом.
Проанализировано КЖ пациентов с ингибиторами при проведении различных методов лечения. Обнаружены существенные позитивные сдвиги во всех сферах жизнедеятельности больных при получении адекватной современной терапии. Получены подтверждения целесообразности проведения дорогостоящих методов лечения.
Впервые произведена оценка затрат на общие прямые медицинские расходы лечения пациентов с ингибиторной формой гемофилии. Определено понятие Точка Наступления Рентабельности (ТНР). Продемонстрирована экономическая целесообразность проведения ИИТ в сравнении с пожизненной терапией препаратами шунтирующего действия по требованию. Представлены возможности экономии затрат на здравоохранение в долгосрочной перспективе.
Практическая значимость работы.
Разработаны стандарт и «Протокол ведения больных. Гемофилия», включающий в себя модели лечения ингибиторной формы гемофилии.
Подробно очерчен алгоритм диагностических действий стандартного обследования пациента с гемофилией, позволяющий улучшить диагностику наличия ингибиторов и своевременно актуализировать лечение каждого пациента.
Проведен общероссийский скрининг пациентов с гемофилией с целью определения наличия ингибиторов к факторам свертывания крови, что способствовало созданию достоверного регистра пациентов с ингибиторной формой гемофилии с возможностью персонификации лечения.
Представлены современные возможности лечения пациентов с ингибиторами с точными указаниями доз и режимов введений препаратов, что представляется особенно ценным в практике врача, редко встречающегося с данной патологией.
Определены иммунологические маркеры достижения толерантности к фактору свертывания крови VIII (FVIII), что вкупе с проведением фармакокинетических тестов позволит оценить состояние иммунного статуса пациента при проведении ИИТ.
Продемонстрировано значимое улучшение клинического течения заболевания во время проведения ИИТ у большинства пациентов. Существенное уменьшение числа спонтанных кровотечений может служить дополнительным фактором принятия решения о продолжении высокодозной терапии в случае ее неубедительной эффективности при достаточной продолжительности.
Предложено в качестве критерия обоснования целесообразности проведения того или иного вида лечения использование фармакоэкономического анализа.
Положения, выносимые на защиту.
- Ингибиторная гемофилия представляет собой особую редкую форму заболевания, требующую проведения специфической терапии, отличной от лечения неосложненной гемофилии.
- Фенотипически ингибиторная форма гемофилии не отличается от гемофилии без ингибитора, однако функциональные и фармакокинетические методы исследования демонстрируют существенную разницу между этими двумя заболеваниями.
- Ингибиторы могут появиться у любого пациента с гемофилией, получающего заместительную терапию концентратами FVIII или FIX.
- Выбор рациональной тактики лечения пациента зависит в большей степени от титра ингибитора и клинического течения заболевания.
- Проведение лечения, направленного на достижение иммунологической толерантности, показано даже при наличии прогностически неблагоприятных для успеха ИИТ факторов.
- Эффективность гемостатической терапии эптаког альфа (активированным) по требованию при строгом соблюдении стандартов лечения составляет 100%.
- Эффективность иммунотолерантной терапии в группе пациентов с наличием большого количества прогностически неблагоприятных для успеха ИИТ факторов составляет 82,4%.
- Проведение тестов индивидуального подбора препарата и генерации тромбина до начала ИИТ способствует повышению эффективности лечения.
- Имеются нарушения в иммунном статусе пациентов с ингибиторной формой гемофилии, выраженность которых зависит от титра ингибитора, вида и продолжительности проводимой терапии.
- Мониторинг основных показателей иммунной системы позволяет прогнозировать вероятность наступления иммунологической толерантности.
- Проведение регулярной заместительной терапии способствует оптимизации КЖ пациентов.
- Для повышения эффективности лечебно-профилактической помощи больным с ингибиторной формой гемофилии рекомендуется персонифицированный подход к выбору терапии.
- Фармакоэкономическая оценка лечения может быть ценным источником при выборе рационального лечения.
- Ведение общероссийского регистра пациентов с ингибиторной формой гемофилии позволит улучшить качество медицинской и социальной помощи пациентам.
Внедрение в практику. Основные положения диссертации включены в материалы лекционного курса и программу семинарских и практических занятий для клинических ординаторов, аспирантов и практикующих врачей на кафедре гематологии Российской медицинской академии последипломного образования. Разработанные программы внедрены в клинических подразделениях ГНЦ РАМН, центрах гемофилии и гематологических стационарах других регионов РФ.
Апробация работы и публикации. Апробация работы состоялась на заседании проблемной комиссии Учреждения Российской академии медицинских наук Гематологический научный центр РАМН «Патология гемостаза» 26 февраля 2010 г.
Основные положения работы докладывались на I Межрегиональной конференции по гемофилии Северо-Западного федерального Округа, г. Выборг (2005 г.), IV и V Всероссийских научно-практических конференциях по гемофилии, г. Москва (2006 г., 2009 г.), Съезде гематологов и трансфузиологов, приуроченном к 80-летию создания ГНЦ РАМН, г. Москва (2006 г.), международных гематологических декадниках, г. Москва (2006 г., 2008 г., 2009 г.), научно-практической конференции «Современное лечение гемофилии и болезни Виллебранда», г. Барнаул (2006 г.), международной конференции «Новые возможности лечения гемофилии», Стреза, Италия (2006 г.), научно-практических конференциях «Современные методы лечения гемофилии», г. Чебоксары (2006 г.), г. Белгород (2006 г.), г. Магнитогорск (2007 г.), г. Владивосток (2007 г.), г. Казань (2007 г.), г. Воронеж (2008 г.), г. Хабаровск (2008 г.), г. Иркутск (2009 г.), XX Европейском Консорциуме по гемофилии, Парма, Италия (2007 г.), XXIst Сongress of the International Society on Thrombosis and Haemostasis (ISTH), Geneva, Switzerland (2007 г.), IV конгрессе балтийских стран по трансфузиологии, Рига, Латвия (2007 г.), Всероссийской конференции «Новые подходы к лечению болезни Виллебранда, г. Москва (2007 г.), 1-ом и 2-ом рабочих совещаниях «Ингибиторная гемофилия: скрининг, диагностика, лечение», Ялта и Киев, Украина (2007 г., 2009 г.), научно-практической конференции «Нарушения гемостаза в повседневной клинической практике», г. Новосибирск (2007 г.), II-ой и III-ей научно-практических международных конференциях по гемофилии, Алма-Ата, Казахстан (2007 г., 2009 г.), Всероссийском семинаре «Организация амбулаторного лечения больных гемофилией. Школа для больных гемофилией», г. Москва (2008 г.), I, II и III-ей научно-практических конференциях «Современная гематология. Проблемы и решения», г. Москва (2007 г., 2008 г., 2009 г.), международном совещании «Опыт лечения пациентов с ингибиторами», Прага, Чехия (2008 г.), научно-практическом семинаре «НовоСэвен, однократное введение», г. Москва (2008 г.), V Съезде гематологов и трансфузиологов Украины, Винница (2008 г.), XXVIII Международном Конгрессе Всемирной Федерации Гемофилии, Стамбул, Турция (2008 г.), 6-ом рабочем Совещании ведущих специалистов в области гемофилии, Рига, Латвия (2008 г.), 54-ом Совещании Научного и Стандартизационного Комитета Всемирного Общества по Тромбозу и Гемостазу, Вена, Австрия (2008 г.), международном совещании специалистов в лечении гемофилии, Франкфурт-на-Майне, Германия (2008 г.), XVII-ом Съезде по гемофилии Мексики, Гвадалахара, Мексика (2008 г.), XV-ом чешско-словацком съезде гематологов и трансфузиологов, Спиндлерув Млын, Чехия (2008 г.), XXI-ом Международном Консорциуме по гемофилии, Дублин, Ирландия (2008 г.), 2-ом Международном совещании исследователей по созданию Регистров пациентов с ингибиторной формой гемофилии, Ницца, Франция (2008 г.), межрегиональной научно-практической конференции «Актуальные проблемы педиатрии и гемостазиологии», Новосибирск (2008 г.), конференции-семинаре «Физиотерапия при врожденных коагулопатиях», Санкт-Петербург (2008 г.), международной конференции «Инновации в лечении ингибиторной формы гемофилии», Санкт-Петербург (2008 г.), образовательном правительственном семинаре «Лекарственное обеспечение больных гемофилией за счет средств федерального бюджета», г. Москва (2008 г.), XI-ом и XII-ом международных конгрессах МОО Общества фармакоэкономических исследований «Справедливость, качество, экономичность», г. Москва (2008 г., 2009 г.), научной конференции «Естественные протеины человека – пациентам», г. Москва (2009 г.), школе для врачей по специальности «Гематология. Клиническая гемостазиология». В рамках Конгресса «Человек и лекарство», г. Москва (2009 г.), XXIInd Сongress of the International Society on Thrombosis and Haemostasis (ISTH), Boston, USA (2009 г.), научно-практической конференции «Новые возможности лечения гемофилии и болезни Виллебранда», Ташкент, Узбекистан (2009 г.), научно-практической конференции «Достижения в гематологии и трансфузиологии», г. Москва (2009 г.).
По теме диссертации опубликовано 38 работ в отечественных и иностранных изданиях, в том числе 10 – в журналах, утвержденных Высшей аттестационной комиссией Минобрнауки РФ.
Объем и структура диссертации. Диссертация представляет рукопись на русском языке объемом 260 машинописных страниц и состоит из введения, 6 глав, заключения, выводов, практических рекомендаций, указателя литературы и приложений. Работа иллюстрирована 39 таблицами и 14 рисунками. Указатель литературы содержит 302 источника, из которых 37 отечественных и 265 зарубежных.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования.
Объем наблюдений составляет 168 больных с ингибиторной формой гемофилии в возрасте от 1,2 до 67 лет. Критериями включения пациентов в исследование служили: лица с врожденной гемофилией А и В любой степени тяжести, имеющие положительный титр ингибитора ( 0,6 Бетезда единиц (БЕ)), не страдающие другими коагуляционными нарушениями. Из обследования исключались пациенты с транзиторным ингибитором и пациенты с приобретенной гемофилией. Период наблюдения 2004 – 2009 гг.
Алгоритм обследования больных включал тщательный сбор анамнестических данных, полную характеристику объективных соматических и клинико-гематологических симптомов заболевания, лабораторное обследование с количественным определением FVIII/FIX и ингибиторов к ним, проведением фармакокинетических тестов, оценку иммунного статуса пациентов с проведением иммунофенотипирования лимфоцитов с помощью моноклональных антител к CD-антигенам в реакции иммунной флюоресценции с учетом результатов на проточном цитофлуориметре CyAn ADPTM (USA) и определением концентраций иммуноглобулинов классов G (и его подклассов), A, M в сыворотке крови пациентов с помощью иммуноферментного анализа методом ELISА на автоматическом ИФА анализаторе Microlab SD Star IVD ELISA c использованием диагностических тест-систем Dako Inc (Denmark). Иммунологическое исследование проводилось по образцам замороженной плазмы в лаборатории Inserim U872, Paris University (France).
В исследование были включены пациенты, получающие лечение в гематологических клиниках г. Барнаула, г. Владимира, г. Кирова, г. Екатеринбурга, г. Москвы и Московской области, г. Омска, г. Томска, г. Санкт-Петербурга и области.
Скрининговое обследование пациентов с наследственными коагулопатиями из разных регионов страны на наличие ингибиторов к факторам свертывания крови проводилось заочно по образцам замороженной плазмы или очно с консультацией пациентов и исследованием образцов плазмы в коагуологической лаборатории Отдела гемофилии и других коагулопатий Гематологического научного центра РАМН.
Динамическое исследование количественного содержания FVIII, FIX проводилось одностадийным клоттинговым методом (C.K. Kasper et al., 1975) по рекомендациям рабочей группы Проблемной комиссии РАМН «Патология гемостаза» (З.С. Баркаган, 1991) на коагулометре Merlin medical® MC 10 plus (Germany) с использованием реактивов фирмы Siemens Healthcare Diagnostic Inc (Germany).
Активность ингибитора определялась в БЕ по оригинальному методу C.K. Kasper с модификацией по Нимегену с буферизацией нормальной плазмы и добавлением имидазола до уровня рН 7,4 (B. Verbruggen, 1995). За 1 БЕ принято количество антител, требующееся для нейтрализации активности 50% FVIII или FIX в смеси равного количества плазмы больного и нормальной плазмы при инкубации в течение 2-х часов при температуре 37°. Титр ингибитора считался положительным при цифрах > 0,6 БЕ. Титр ингибитора считался высоким при уровне ингибиторных антител 5 БЕ, низким - при титре 0,6 – 4,9 БЕ.
Фармакокинетические тесты проводились для оценки постинфузионного повышения FVIII и включали в себя определение времени восстановления и полужизни FVIII. Для расчета показателей использовались следующие формулы (S. Bjorkman, 2007):
- Восстановление активности FVIII:

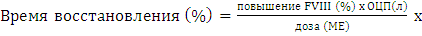 1000, где
1000, где
повышение FVIII = пиковое постинфузионное значение FVIII, % - базальный уровень FVIII до инфузии, %; ОЦП - объем циркулирующей плазмы, л.
ОЦП, в свою очередь, рассчитывался по формуле:
![]()
ОЦК – объем циркулирующей крови, л.; Ht – гематокрит.
Нормальные значения времени восстановления: 70 – 120%.
- Время полужизни FVIII представляет собой расчетную величину, характеризующую скорость снижения максимального уровня активности FVIII после выведения на 50%. Для расчета времени полужизни использовалась стандартная компьютерная программа - Half-life 3 (MS Exell).
По результатам динамического определения активности ингибитора к FVIII и данным фармакокинетических исследований проводилась оценка эффективности лечения пациентов методом ИИТ.
ИИТ считалась эффективной при достижении следующих критериев: отсутствие ингибитора (< 0,6 БЕ), нормализация времени восстановления FVIII (> 66%), нормализация времени полужизни FVIII (> 7 часов). Полным успехом лечения считалось достижение трех критериев, частичным успехом - нормализация двух из трех критериев, частичным ответом - наличие одного из трех критериев. В случае отсутствия снижения титра ингибитора на 50% и более от исходного в течение 12 месяцев лечения методом ИИТ терапия определялась как неэффективная.
Для достижения иммунологической толерантности проводилась высокодозная терапия концентратами факторов свертывания крови по Боннскому протоколу (H.H.Brackmann, 1977). Пациенты с титром ингибитора 5 БЕ получали стартовую заместительную терапию в дозе 100–150 МЕ/кг массы тела каждые 12 часов, пациентам с низким титром ингибитора производились инфузии препарата в дозе 50-100 МЕ/кг массы тела однократно в сутки ежедневно. Для купирования острых эпизодов кровотечений, возникающих во время проведения лечения методом ИИТ, использовалось введение эптаког альфа (активированного) или антиингибиторного коагулянтного комплекса в стандартных дозах.
Для проведения ИИТ использовались полученные из человеческой плазмы концентраты FVIII, содержащие vWF: «Octanate» (Octapharma Nordic AB, Sweden), «Haemoctin SDH» (Biotest Pharma, Germany), «Koate-DVI» (Bayer, USA). Для каждого пациента перед началом ИИТ выполнялся тест индивидуального подбора препарата по оригинальному New Oxford методу с модификацией W. Kreuz и C. Escuriola-Ettingshausen (K. Sukhu et al, 2000; G. Tagariello et al., 2007) и тест генерации тромбина (E. Berntorp, 2007). Тестирование образцов замороженной плазмы пациентов проводилось, соответственно, в Johann-Wolfgang-Goethe University Hospital (Frankfurt am Main, Germany) и в Lund University (Malmo, Sweden).
Для оценки параметров удовлетворенности КЖ у пациентов с ингибиторной формой гемофилии, получающих регулярную гемостатическую терапию эптаког альфа (активированным) по требованию, оценивались 3 основных сферы человеческой жизнедеятельности: физическая, отражающая такие факторы как боль, способность к движению, выполнение повседневных задач; психическая, отражающая чувственное восприятие, счастье, самоуважение, тревогу и социальная сфера, отражающая взаимодействие с другими людьми, дружбу, степень одиночества. Оценка КЖ пациентов, получающих терапию по требованию, производилась на основе сопоставительного анализа ряда методов, включающих в себя: клинико-психологическое интервью, опросник SF-36, визуально-аналоговые шкалы (VAS), опросник выраженности психопатологической симптоматики. Изучение КЖ проводилось совместно с сотрудниками кафедры клинической психологии МГУ имени М.В. Ломоносова (Г.А. Арина). Анализ параметров проводился в двух временных периодах: в настоящее время и ретроспективно – до начала систематической терапии эптаког альфа (активированным).
Cовместно с обществом фармакоэкономических исследований (П.А. Воробьев, О.В. Борисенко) и Всероссийским обществом больных гемофилией (Ю.А. Жулев) проводилась сравнительная оценка КЖ пациентов с ингибиторной формой гемофилии, получающих различные варианты лечения. Для анализа использовались международный опросник EuroQoL-5D и VAS.
Статистическая обработка результатов исследования проводилась с помощью пакета статистических программ «Excel 6.0 for Windows» с использованием контент-анализа и методов непараметрической статистики. Для средних величин приведены значения стандартной ошибки. Оценка достоверности различий средних величин осуществлялась с помощью t-критерия Стьюдента. Достоверными считались различия при степени вероятности безошибочного прогноза менее 95% (p < 0,05). Для установления корреляционных связей использовался коэффициент корреляции Спирмена. Анализ эпидемиологических данных проводился с использованием методов описательной статистики, сравнительный анализ в подгруппах проводился с использованием статистических критериев 2 (данные EuroQoL-5D) и t-критерия Стьюдента (данные визуально-аналоговых шкал) (Г.Ф. Лакин, 1990; А.Н. Мамаев, 2006).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ. ОБСУЖДЕНИЕ
К декабрю 2009 года создан и непрерывно актуализируется регистр пациентов с ингибиторной формой гемофилии, содержащий анамнестические сведения, информацию о диагнозе, тяжести и клиническом течении заболевания, лечении пациентов на местах, его эффективности и обеспеченности больных необходимыми лекарственными средствами, а также данные о социальном статусе пациентов.
В период с мая 2005 по декабрь 2009 года проведено исследование 1613 образцов замороженной плазмы пациентов с гемофилией из 47 городов России (из 9 городов заочный скрининг образцов проводился дважды, из 8 городов – трижды, из 5 городов – четыре раза). Первичную очную консультацию с обследованием в Гематологическом научном центре получили 63 пациента. Общее количество проведенных коагуологических исследований (АЧТВ, FVIII, FIX, ингибиторы к факторам) - 20112.
В результате проведенного скрининга уточнены данные Всероссийского регистра пациентов с наследственными коагулопатиями (рис. 1), наличие ингибиторов к факторам свертывания крови впервые выявлено у 96 пациентов, диагнозы изменены у 34-х пациентов (гемофилия А вместо гемофилии В, гемофилия А вместо болезни Виллебранда и наоборот). Каждому больному выдано медицинское заключение с подробными рекомендациями по лечению и индивидуальным расчетом потребности в необходимых лекарственных препаратах.
К декабрю 2009 года Всероссийский регистр пациентов с ингибиторной формой гемофилии включает 168 больных, что составляет 3,2% от общего количества зарегистрированных пациентов с гемофилией в нашей стране.
Из общего числа больных 74 пациента (44%) имеют высокий титр ингибитора, у 94 пациентов (56%) титр ингибитора < 5 БЕ. У 166 пациентов (99%) обнаружены ингибиторы к FVIII, у 2-х больных (1%) – к FIX.
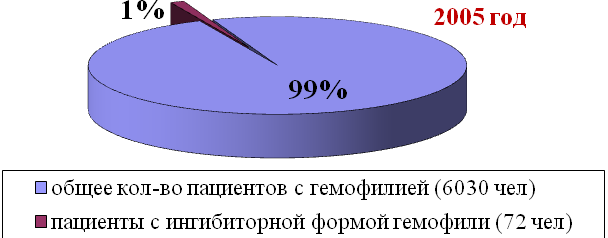
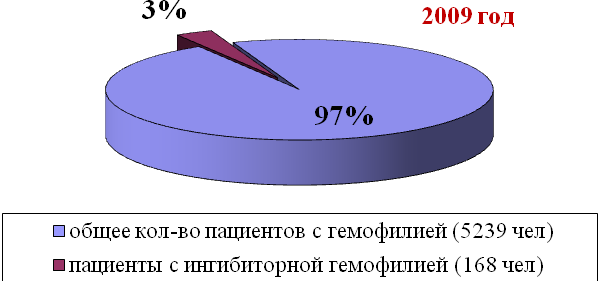
Рис. 1. Количество пациентов с ингибиторной формой гемофилии в РФ.
Географическое распределение пациентов с ингибиторной формой гемофилии неравномерно, не соответствует территориальному населению и, вероятнее всего, обусловлено диагностическими возможностями в различных регионах страны. 80% пациентов с ингибиторами наблюдается в Центральном (27%), Приволжском (20%), Северо-Западном (17%) и Южном (16%) федеральных округах РФ.
Оценка анамнестических данных пациентов также свидетельствует о проблемах в диагностике наследственных коагулопатий в нашей стране: средний возраст при верификации диагноза гемофилии - 2,4 года (у 61% пациентов с тяжелыми формами заболевания дефицит факторов свертывания крови обнаружен после 1 года жизни), сведениями о наличии гемофилии в семейном анамнезе располагают не более 41% больных, присутствие ингибиторов у кого-либо в семье отмечают лишь 3% пациентов.
Значимых возрастных различий при обнаружении ингибиторов к факторам свертывания крови не обнаружено: 97 больных (58%) - взрослые (18 лет и старше) и 71 (42%) - дети.
Частота появления ингибиторов зависит от тяжести заболевания: 86% случаев ингибиторной формы гемофилии наблюдаются при тяжелой форме гемофилии, 13% - при гемофилии средней тяжести и лишь 1% - при легкой форме гемофилии (ингибиторы к FVIII впервые были обнаружены после проведения интенсивной заместительной терапии во время оперативных вмешательств).
У 133 пациентов (79%) имеются сведения о наличии, помимо гемофилии, хронического вирусного гепатита С, что свидетельствует о значительной трансфузионной нагрузке этой когорты больных в анамнезе. Специфическая противовирусная терапия не проводилась ни одному пациенту.
Клинические проявления заболевания у пациентов с наличием ингибиторов к факторам свертывания крови характерны для гемофилии, частота возникновения геморрагического синдрома достоверно не отличается от таковой в группе пациентов без ингибиторов. Вследствие часто рецидивирующих гемартрозов у 153 пациентов с ингибиторной формой гемофилии (91%) имеется деформирующая гемофилическая артропатия суставов-мишеней. В анамнезе 72-х (43%) пациентов отмечались жизнеугрожающие кровотечения: травмы головы с кровоизлиянием в головной мозг – у 8 пациентов (5%), желудочно-кишечные кровотечения – у 29 больных (17%), забрюшинные гематомы - у 35 пациентов (21%). За период наблюдения 2 пациентов умерли от некупируемых кровотечений в головной мозг, 1 пациент – от множественных посттравматических кровоизлияний в органы брюшной полости.
До обнаружения ингибитора 166 пациентам проводилась смешанная заместительная терапия различными препаратами: криопреципитатом - 79% больных, свежезамороженной плазмой - 28% больных, различными концентратами FVIII/FIX, полученными из плазмы человека, - 61% пациентов, рекомбинантным FVIII - 13% больных. Каждый из предварительно леченых пациентов на протяжении жизни менял торговые наименования препаратов в зависимости от их актуального наличия не менее 3-х раз. Таким образом, точное определение препарата, лечение которым привело к появлению ингибитора, не представляется возможным. Лишь у 2-х предварительно нелеченых пациентов ингибиторы к FVIII были обнаружены впервые после начала терапии концентратами FVIII, полученными из плазмы человека.
В среднем для купирования эпизода умеренного кровотечения у пациентов с ингибиторной формой гемофилии при проведении смешанной терапии требовалось 5,9 введений препаратов (разброс 3 – 16 введений). При этом средние дозы гемостатических препаратов, использовавшиеся для однократного введения были, в большинстве случаев, неадекватными.
В настоящее время 78% пациентов с ингибиторной формой гемофилии получают современные методы лечения: 24% - высокодозное лечение с целью достижения иммунологической толерантности, 54% - адекватную терапию по требованию с использованием эптаког альфа (активированного) (rFVIIa) в стандартных терапевтических режимах. 22% пациентов с ингибиторной формой гемофилии по различным причинам (нежелание самого больного, отсутствие необходимого количества препарата, нереализация рецепта) не получают адекватной регулярной гемостатической монотерапии и для остановки возникающих кровотечений используют разные препараты (rFVIIa, антиингибиторный коагулянтный комплекс (aPCC), концентраты факторов свертывания крови, криопреципитат) ситуационно (рис. 2).
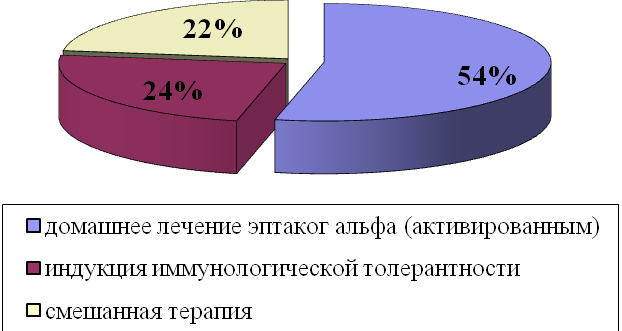
Рис. 2. Лечение пациентов с ингибиторной формой гемофилии.
Появление ингибиторов приводит к частичной или полной неэффективности заместительной терапии концентратами дефицитных факторов свертывания крови и требует немедленной смены лечения (А.И. Воробьев с соавт., 2006; D. DiMichele, 2006). В настоящее время существует 2 принципиально различных по конечным точкам метода терапии пациентов с ингибиторной формой гемофилии: 1) лечение по требованию в случае возникновения кровотечения с целью его купирования и 2) лечение, направленное на элиминацию ингибитора, методом ИИТ.
Сравнительный анализ эффективности лечения по требованию двумя наиболее широко используемыми препаратами шунтирующего действия: эптаког альфа (активированным) и антиингибиторным коагулянтным комплексом демонстрирует преимущества первого.
В период с мая 2005 года по апрель 2006 года был проведен проспективный анализ домашнего и амбулаторного лечения rFVIIa у 13 пациентов (4 детей и 9 взрослых) с ингибиторной формой гемофилии. Все включенные в исследование пациенты наблюдались в 2-х специализированных учреждениях – Гематологическом научном центре РАМН и Измайловской детской городской клинической больнице. Средний возраст больных - 23,5 лет (5 лет – 51 год). Все пациенты страдали тяжелой формой гемофилии: 12 – гемофилией А, 1 – гемофилией В. У 6 пациентов отмечался постоянно высокий титр ингибитора ( 5 БЕ). В группу наблюдения по применению aPCC вошло
всего 4 пациента, что являлось недостаточным для проведения анализа. Для сравнения использовались репрезентативные результаты применения антиингибиторного коагулянтного комплекса за рубежом, опубликованные в литературе (W.M. Hart, 2002; S. Dundar et al., 2005; M.C. Ozelo et al., 2007).
Эптаког альфа (активированный) применялся для остановки умеренных кровотечений: гемартрозов (за исключением гемартроза тазобедренного сустава), гематурии (длительностью более 48 часов), гематом мягких тканей, кровотечений из слизистых оболочек и ран. Лечение проводилось самим пациентом (или его родителями) на дому. Препарат вводился в дозе 90 мкг/кг массы тела больного до достижения эффекта лечения. Терапию считали эффективной, если через 24 ч от начала терапии боль уменьшалась или исчезала. Терапию оценивали как неэффективную, если через 24 ч от начала лечения боль была прежней степени выраженности или усиливалась. В случае кровотечения из слизистых терапию считали эффективной при остановке кровотечения. Рецидив геморрагического синдрома определяли как повторное кровотечение той же локализации в период от 24 ч до 5 дней после введения последней дозы препарата.
При анализе терапии 81 геморрагического эпизода установлено, что эффективность лечения зависит от локализации кровотечения, доз и количества инфузий эптаког альфа (активированного) (табл. 1).
Таблица 1
Результаты домашнего и амбулаторного лечения эптаког альфа (активированным) пациентов с ингибиторной формой гемофилии
| Характер кровотечения | Количество геморрагических эпизодов | Средняя доза rFVIIa, мкг/кг | Среднее количество инъекций rFVII | Успешное лечение (оценка эпизодов кровотечений через 24 ч), % |
| гемартроз | 61 | 89,58 ± 2,43 | 2,1 ± 0,65 | 70 |
| гематома мягких тканей | 16 | 91,76 ± 3,14 | 2,4 ± 0,73 | 81 |
| кровотечение из слизистых оболочек | 4 | 99,16 ± 7,91 | 4,5 ± 0,91 | 75 |
| 81 | 93,5 ± 2,90 | 3 ± 0,76 | 75,3 ± 3,18 |
Индивидуальная оценка проводимой терапии каждого геморрагического эпизода позволила определить причины различий в эффективности лечения. Ими являются нарушения в режиме введений и дозах препарата: позднее начало терапии (> чем через 3 часа после возникновения кровотечения); недостаточные дозы вводимого препарата (< 90 мкг/кг массы тела пациента); несоблюдение интервалов между введениями (> 3-х часов) и необоснованное раннее прекращение терапии.
После анализа всех пролеченных случаев кровотечений с применением эптаког альфа (активированного) нами была произведена выборка тех эпизодов кровотечений, которые были пролечены в строгом соответствии со стандартами терапии. В итоге были собраны данные о 49 эпизодах кровотечений (табл. 2) у 10 пациентов, получавших терапию rFVIIa (20% от общего числа пациентов, получавших лечение эптаког альфа (активированным) в 2005 - 2006 гг.).
Таблица 2
Домашнее и амбулаторное лечение пациентов с ингибиторной формой гемофилии
эптаког альфа (активированным) и антиингибиторным коагулянтным комплексом
при соблюдении стандартов терапии
| Характеристики | rFVIIa (n = 10) | aPCC (литература) |
| Среднее число введений на один эпизод кровотечения | 1,55 ± 0,3 | 1,73 |
| Средняя терапевтическая доза препарата для купирования 1 эпизода умеренного кровотечения | 157,1 ± 19,4 мкг/кг | 134,9 Ед/кг |
| Затраты на купирование 1 эпизода умеренного кровотечения, доллары США | 14 137 | 14 703 |
| Побочные эффекты | нет | нет |
| Эффективность терапии (остановка кровотечения, уменьшение болевого синдрома), % | 100 | 79 |
100%-ный показатель эффективности лечения rFVIIa кажется несколько завышенным. По нашему мнению, он является следствием применения жестких критериев включения в анализ только тех геморрагических эпизодов, лечение которых полностью соответствовало стандартам. Нарушения в режиме введения эптаког альфа (активированного) приводят к существенному увеличению суммарного количества rFVIIa, требующегося для купирования геморрагического эпизода – 280,5 мкг/кг массы тела пациента, что отражается на стоимости лечения (рис. 3).

Рис. 3. Различия в количестве препарата, необходимом для купирования одного эпизода кровотечения при проведении домашнего и амбулаторного лечения у больных с ингибиторной формой гемофилии.
Оценка прямой стоимости лечения легких и умеренных кровотечений препаратами шунтирующего действия у пациентов с ингибиторной формой гемофилии проводилась по модели принятия решений (рис. 4). Методика представляла собой модель минимизации затрат и учитывала: терапию первой линии; последующее лечение кровотечения; вероятность перехода от одного вида лечения к другому; длительность и эффективность каждого вида терапии; вероятность рецидивного кровотечения; лечение рецидивного кровотечения. В качестве препарата первой линии пациенты получали либо эптаког альфа (активированный), либо антиингибиторный коагулянтный комплекс. Фармакоэкономический анализ проводился при поддержке EcoStat Consulting Group (Мадрид, Испания).
Были вычислены средние затраты на лечение одного эпизода кровотечения, исходя из средней общей дозы препаратов в пересчете на 1 кг массы тела пациента и средней стоимости различных препаратов. Затраты на лечение одного эпизода кровотечения с применением эптаког альфа (активированного) были выше, чем при использовании aPCC: 12293 и 10957 долларов США соответственно. Таким образом, разница в затратах на лечение одного эпизода кровотечения составила 12,2%. Анализ по модели принятия решений показал, что rFVIIa более эффективен, а затраты при его использовании для остановки кровотечений были ниже, чем при использовании альтернативного препарата – aPCC. Общие прямые медицинские расходы на весь процесс лечения при применении эптаког альфа (активированного) в качестве терапии первой линии составили 14137 долларов США, при лечении антиингибиторным коагулянтным комплексом -14703 долларов США.

Рис. 4. Основная модель дерева принятия решений для сравнения эптаког альфа (активированного) и антиингибиторного коагулянтного комплекса, используемых в качестве первоочередной терапии.
Анализ чувствительности полученных результатов к изменению величины ключевых переменных (эффективность терапии первой линии, средняя доза и вероятность рецидива) демонстрирует, что rFVIIa всегда будет более дешевым вариантом лечения, чем aPCC, если эффективность первого превышает 94,3% (рис. 5).

Рис. 5. Анализ чувствительности показателя общих медицинских затрат при варьировании вероятной эффективности rFVIIa от 85% до 100% по сравнению с aPCC. К = 1000; EV - ожидаемое значение.
Оценка чувствительности показателя общих медицинских затрат в зависимости от изменения частоты рецидивов (10% и 20% вероятность) и дозы препарата (± 20%), использованного в качестве терапии первой линии, свидетельствуют о том, что общие затраты на курс лечения одного эпизода кровотечения несколько ниже при использовании rFVIIa чем при применении aPCC. Исключение составляют снижение дозы aPCC на 20% при сохранении стандартной дозы rFVIIa и повышение дозы rFVIIa на 20% при возможных введениях aPCC в дозах, находящихся в пределах стандартных.
Таким образом, результаты проведенного моделирования убедительно демонстрируют экономически обоснованную целесообразность проведения своевременного домашнего лечения эптаког альфа (активированным) в качестве препарата первой линии для купирования легких и умеренных эпизодов кровотечений у пациентов с ингибиторной формой гемофилии.
Клиническое наблюдение за пациентами, получающими эптаког альфа (активированный), позволило отметить определенные позитивные тенденции в динамике объективной клинической картины заболевания: в 2 – 3 раза реже стали регистрироваться обращения в амбулаторный центр гемофилии; значительно уменьшился процент пациентов, нуждающихся в госпитализации; сократилось количество дней вынужденного пребывания дома для купирования одного эпизода кровотечения; причиной госпитализации чаще стали не экстренные ситуации, связанные с тяжелыми некупирующимися кровотечениями, а плановые операции; физическое состояние пациентов сделало возможным проведение высокотехнологичных оперативных вмешательств, в том числе эндопротезирования суставов. При этом ни частота возникновения, ни локализация преимущественных кровотечений существенно не изменились, что в целом, отражает тяжесть заболевания.
Большинство пациентов с ингибиторной формой гемофилии, получающих регулярное лечение эптаког альфа (активированным) по требованию, отмечают существенные позитивные сдвиги КЖ.
Наиболее значимые изменения регистрируются по параметрам физического функционирования в повседневной жизни (рис. 6): пациенты испытывают меньше ограничений при исполнении работы и повседневных обязанностей; их социальная активность, контакты и общение в меньшей степени страдают из-за физического состояния.
Изменения касаются не только субъективной удовлетворенности жизнью, но и реальных возможностей (рис. 7): значительно возрастает мобильность пациентов (в 1,68 раза), уменьшается интенсивность болевого синдрома (в 1,73 раза).
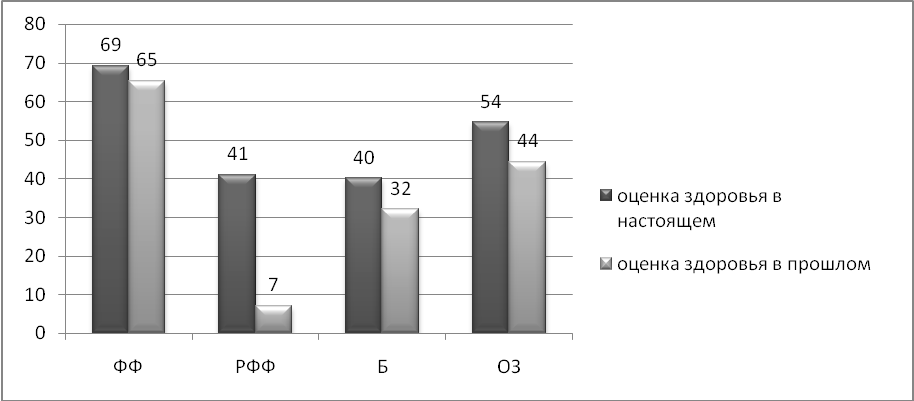
Рис. 6. Показатели качества жизни в настоящем и в прошлом (до лечения эптаког альфа (активированным) по параметрам физического здоровья.
ФФ - физическое функционирование, РФФ - ролевое физическое функционирование,
Б – влияние боли, ОЗ – общее здоровье.
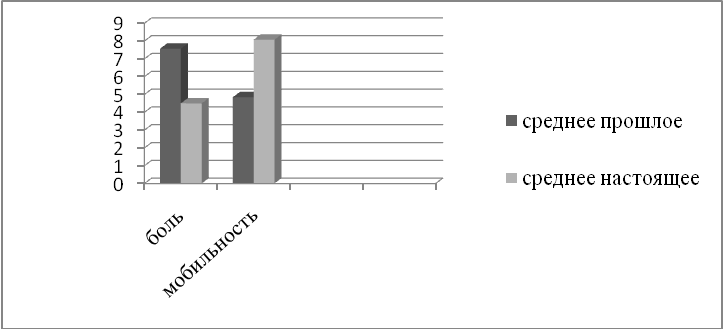
Рис. 7. Динамика субъективных оценок боли и мобильности на фоне лечения эптаког альфа (активированным).
При снижении субъективной интенсивности боли повышается удовлетворенность лечением, что на мотивационном уровне оборачивается более оптимистическим и конструктивным отношением к жизни: возрастает удовлетворенность жизнью и собой, настроенность на будущие возможности, появляются планы и надежды (рис. 8). Отмечаются положительные изменения в эмоциональном статусе больных. При этом прослеживается зависимость КЖ от индивидуально-психологических и личностных особенностей пациентов.
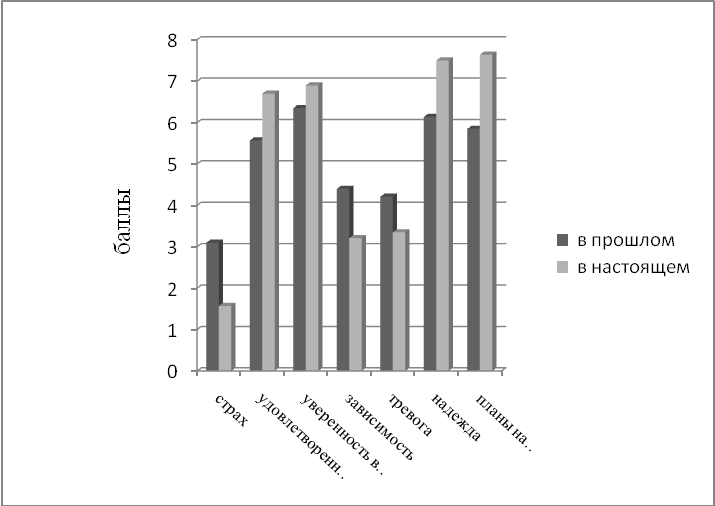
Рис. 8. Динамика показателей психологической адаптации на фоне лечения эптаког альфа (активированным).
Обнаружена важная роль трудового статуса пациентов, оптимизирующего все параметры КЖ. Все позитивные изменения у работающих больных более ярко выражены, болевой синдром меньше их инвалидизирует, эмоциональная дезадаптация не наступает.
40 пациентам с ингибиторной формой гемофилии проводилось лечение методом ИИТ. Окончательный анализ выполнен в когорте 34 пациентов (20% от общего числа зарегистрированных пациентов с ингибиторной формой гемофилии А), получающих высокодозную терапию концентратами FVIII более 1 года.
При анализе индивидуального прогноза ИИТ обнаружено, что у 32-х из 34-х пациентов (94%) до начала высокодозной терапии имелся один или несколько прогностически неблагоприятных для успеха ИИТ факторов (рис. 9).
Стартовые дозы и режимы введения препаратов соответствовали Боннскому протоколу. У 85% пациентов в течение первого месяца высокодозной терапии отмечалось повышение титра ингибиторов (max до 8800 БЕ), что может оказывать влияние на конечные результаты лечения. Пациенты получали лечение длительностью от 13 месяцев до 3-х лет.

Рис. 9. Наличие неблагоприятных для успеха ИИТ прогностических факторов в группе пациентов, получающих высокодозную терапию концентратами FVIII.
Исчезновение ингибитора было достигнуто у 18 из 21 пациента с высоким титром ингибитора (85,7%) и у всех 13 пациентов с низким титром ингибитора (100%), что свидетельствует о достижении частичного ответа у 91% пациентов, получающих лечение методом ИИТ. Титр ингибитора < 0,6 БЕ был достигнут в среднем через 2,1 месяца в группе пациентов с высоким титром ингибитора и через 3,7 месяцев в группе пациентов со стартовым уровнем ингибитора < 5 БЕ (рис. 10).
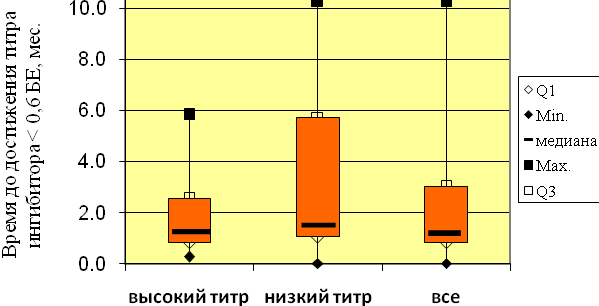
Рис. 10. Время до достижения титра ингибитора < 0,6 БЕ.
Нормализация времени восстановления FVIII зарегистрирована у 17 из 21 пациента с высоким титром ингибитора (80,9%) через 3,0 месяца и у 13 пациентов с низким титром антител (100%) через 4,8 месяцев, что свидетельствует о достижении частичного успеха у 88,2% пациентов, получающих лечение методом ИИТ. В среднем для нормализации времени восстановления FVIII в общей группе пациентов потребовалось 3,7 месяца (медиана – 3,0 месяца).

Рис. 11. Время до нормализации времени восстановления FVIII.
Полный успех был достигнут у 16 из 21 пациента (76,2%) с высоким титром ингибитора и у 12 из 13 пациентов (92,3%) с низким титром ингибитора. Таким образом, полной иммунологической толерантности удалось достичь у 82,4% пациентов. Общая длительность лечения в группе пациентов с высоким титром ингибитора до перевода на профилактику была в 1,5 раза выше по сравнению с длительностью высокодозной терапии у пациентов с низким титром ингибитора (14,7 и 8,3 мес. соответственно). Средняя продолжительность ИИТ составляет 12,4 мес. в общей группе пациентов с медианой достижения полной иммунологической толерантности 10,1 мес. (рис. 12).

Рис. 12. Время до нормализации времени полужизни FVIII.
К декабрю 2009 года 17 пациентов переведены на профилактическое лечение концентратами FVIII в режиме 35-40 МЕ/кг массы тела каждый второй день. У 2-х пациентов с высоким титром ингибитора (9,5%) и наличием 4-х прогностически неблагоприятных для проведения ИИТ факторов после 12 месяцев терапии лечение было прекращено ввиду неэффективности.
При проведении ИИТ отмечается существенное улучшение клинического течения заболевания со значимым уменьшением числа спонтанных кровотечений. Переносимость высокодозного лечения удовлетворительная. Ни у одного пациента во время достижения ИИТ не отмечалось нежелательных явлений.
Оценка затрат на общие прямые медицинские расходы лечения пациентов с ингибиторной формой гемофилии демонстрирует экономическую целесообразность проведения ИИТ в сравнении с пожизненной терапией препаратами шунтирующего действия по требованию.
Затраты на проведение высокодозной терапии становятся сопоставимыми со стоимостью лечения эптаког альфа (активированным) через различные временные интервалы, прямо коррелирующие с длительностью ИИТ, и далее постепенно снижаются. Временная точка достижения равной суммарной стоимости лечения при использовании различных препаратов обозначена нами как точка наступления рентабельности (ТНР). Терапия пациентов с ингибиторной формой гемофилии эптаког альфа (активированным) после достижения ТНР всегда достоверно дороже лечения концентратами факторов свертывания крови.
Для 17 пациентов, достигших полной иммунологической толерантности были посчитаны суммарные индивидуальные затраты на медикаментозное обеспечение в течение всего периода ИИТ, включая FVIII, rFVIIa и aPCC, использовавшиеся для купирования геморрагического синдрома во время ИИТ (рис. 13). Для той же группы пациентов были посчитаны возможные суммарные затраты на обеспечение их эптаког альфа (активированным) вместо проведения ИИТ. Расчетный временной период соответствовал времени ИИТ до перехода на профилактическое лечение. Потребность в эптаког альфа (активированном) для каждого пациента рассчитывалась исходя из средней частоты кровотечений в месяц, среднего количества инфузий препарата, необходимого для купирования геморрагического синдрома, и средней разовой дозы введения препарата, зависящей от веса пациента.
Обнаружено, что проведение ИИТ даже с учетом неуспешных случаев является экономически оправданной, так как ТНР определяется и в этом случае, но отсроченно по сравнению со случаями эффективной терапии пациентов (через 6,5 и 2,8 лет соответственно). После достижения иммунологической толерантности и перехода на профилактическое лечение суммарные затраты на лечение пациентов существенно уменьшаются. ИИТ с эффективностью 80% и выше экономит затраты на здравоохранение в долгосрочной перспективе даже с учетом случаев неуспешной терапии.

Рис. 13. Динамика итоговых затрат на обеспечение 17 пациентов с успешной и 2-х пациентов с неуспешной ИИТ плазматическим концентратом FVIII и эптаког альфа (активированным).
Сравнительная оценка КЖ пациентов с ингибиторной формой гемофилии, получающих разные виды лечения (ИИТ или по требованию) свидетельствует о большей удовлетворенности КЖ пациентов из ИИТ-группы. Анализ фенотипа заболевания демонстрирует меньшую частоту возникновения геморрагического синдрома у пациентов, находящихся на высокодозном лечении (у 53,3% пациентов отмечался 1 эпизод кровотечения в течение последнего месяца), по сравнению с группой пациентов, получающих терапию по требованию (эпизоды кровотечений отмечались у 70,3% пациентов). ИИТ-группа пациентов использует меньше ресурсов здравоохранения чем пациенты с ингибиторной гемофилией, получающие гемостатическую терапию по требованию: 3 (10%) и 7 (18,9%) пациентов, соответственно, госпитализировались; 0 и 7 (18,9%) пациентов, соответственно, вызывали скорую помощь за последний месяц.
Значимые различия КЖ пациентов двух групп отмечаются по параметрам в психологической сфере: тревога и депрессия более выражены у пациентов, получающих терапию по требованию, в сравнении с пациентами из ИИТ-группы (38,1% и 69,7% соответственно). При динамическом мониторинге КЖ через год достоверно большее количество пациентов в ИИТ-группе отметили позитивные изменения своего состояния по сравнению с пациентами группы по требованию (61,9% и 21,2% соответственно). Проведение прямой оценки динамики самочувствия самими пациентами (по VAS) демонстрирует большую удовлетворенность КЖ пациентов ИИТ-группы по сравнению с пациентами группы терапии по требованию: 69,04 и 52,75 соответственно.
Для оценки иммунного статуса пациентов с ингибиторной формой гемофилии проведено изучение показателей клеточного и гуморального иммунитета у 40 пациентов, которые были разделены на 2 группы: группа больных, получающих терапию по требованию препаратами шунтирующего действия (n=20) и группа пациентов, находящихся на высокодозной терапии FVIII для достижения иммунологической толерантности (n=20). В качестве группы контроля взяты 20 пациентов с тяжелой формой гемофилии А, не имеющие ингибиторов к факторам свертывания крови, сопоставимые по возрасту и наличию сопутствующих заболеваний (75% пациентов в каждой группе имели хронический вирусный гепатит С). В группе пациентов, получающих ИИТ, проводилось 3-х-кратное динамическое исследование состояния системы иммунитета с интервалом в 6 месяцев: до начала лечения, через 6 и 12 месяцев терапии. В группе пациентов, получающих терапию по требованию, исследование проводилось дважды с интервалом в 6 месяцев.
Состояние клеточного иммунитета у пациентов с ингибиторной формой гемофилии до проведения ИИТ аналогично иммунитету пациентов без ингибитора, что, вероятно, обусловлено сходством заместительной терапии, которую получало большинство пациентов в обеих группах на протяжении всей жизни. Обнаружены статистически недостоверные различия состояния клеточного иммунитета в этих двух группах: у 85% пациентов с ингибиторами выявлено умеренное снижение уровня общих Т-лимфоцитов (CD2+, CD3+), у 15% - уменьшение количества CD4+ Т-клеток, у 63% - увеличение субпопуляции CD8+ и CD16+ Т-лимфоцитов, у 80% - повышение CD25+, у 20% пациентов отмечалось увеличение субпопуляции CD20+-клеток. Иммуннорегуляторный индекс снижен в обеих группах наблюдения, что свидетельствует о наличии иммунодефицита у пациентов с гемофилией как с присутствием ингибитора, так и без него.
При оценке клеточного иммунитета пациентов с ингибиторной формой гемофилии обнаружено достоверное снижение количества CD38+-лимфоцитов по сравнению с группой пациентов без ингибитора.
Изучение гуморального иммунитета выявило повышение количества циркулирующих иммунных комплексов у пациентов с ингибиторами (у 60% пациентов в группе лечения по требованию и у 50% - перед началом ИИТ) и без ингибиторов (у 40% больных), что может быть обусловлено и наличием хронического персистирующего гепатита у 75% наблюдаемых пациентов в каждой группе.
Количественное содержание IgG существенно выше в группах пациентов с ингибиторами к факторам свертывания крови по сравнению с неосложненной гемофилией: у 20% пациентов с низким титром ингибитора и у 80% пациентов с титром ингибитора 5 БЕ. Прямые корреляции между уровнем IgG и титром ингибитора подтверждают принадлежность последнего к G классу иммуноглобулинов.
Динамических изменений состояния иммунной системы у пациентов, получающих терапию по требованию, не обнаружено. Мониторинг состояния иммунного статуса пациентов через 6 месяцев проведения высокодозной терапии демонстрирует существенные сдвиги в клеточном звене иммунитета, что свидетельствует об участии Т-лимфоцитов в механизмах элиминации ингибиторных антител. По сравнению с исходным состоянием выявлено достоверное повышение средних значений CD38+-лимфоцитов, умеренное снижение CD8+ и CD4+ Т-клеток, увеличение количества субпопуляции CD25+ и повышение CD2+, CD3+-клеток.
Динамическая оценка гуморального иммунитета позволила обнаружить изменения в количественном соотношении субпопуляций IgG по сравнению с исходными: перед началом высокодозной терапии преобладали IgG4, через 6 месяцев ИИТ - IgG1 и IgG2 (у 70% пациентов) и IgG4 c IgG1 и IgG2 в равных долях (у 30% пациентов), через 12 мес. терапии у 80% пациентов определялись IgG1 и IgG2.
В клеточном звене иммунитета через 12 месяцев проведения ИИТ сохранялись высокие значения CD38+, сопоставимые с показателями в группе пациентов без ингибиторов; наблюдалась повышенная экспрессия CD25+ по сравнению с исследованием в 6 месяцев и увеличение количества CD4CD25+-клеток, что свидетельствует о поддержании толерантности к FVIII.
На основе проведенных исследований нами были разработаны модули диагностики (рис. 14) и лечения (рис. 15) пациентов с ингибиторной формой гемофилии. Алгоритм проведения ИИТ представлен на рис. 16. Выбор тактики проведения ИИТ в зависимости от наличия прогностических для успеха высокодозного лечения факторов представлен на рис. 17.
ВЫВОДЫ
- Создание Всероссийского регистра пациентов с ингибиторной формой гемофилии позволяет планировать потребности в дорогостоящих препаратах, персонифицировать лечение пациентов, что, в свою очередь, улучшает качество оказания медицинской и социальной помощи конкретному пациенту, дает возможность контролировать ее адекватность и эффективность, гарантировать оказание медицинской помощи каждому больному.
- Своевременная диагностика наличия ингибитора позволяет провести коррекцию лечения пациента, что способствует контролю фенотипа заболевания, предотвращению развития артропатий и улучшению качества жизни пациента.
- Препаратом первой линии для остановки кровотечений у пациентов с ингибиторной формой гемофилии является эптаког альфа (активированный). В общей группе пациентов препарат эффективен в 75% случаев, в то время как строгое соблюдение стандартов режима и доз введений препарата обеспечивает 100% эффективность лечения. Альтернативным средством для проведения
Верификация диагноза гемофилии, начало заместительной терапии
обследование на наличие ингибитора
не определяется ингибитор определяется
Рис. 15. Рекомендации тактики ведения пациентов с гемофилией при обнаружении ингибитора.
- возможный вариант, - предпочтительный вариант.
Рис. 16. Алгоритм проведения ИИТ.
- терапии по требованию является антиингибиторный коагулянтный комплекс, эффективность лечения которым составляет 79%.
- Общие прямые медицинские затраты на лечение одного эпизода умеренного кровотечения у пациента с ингибиторной формой гемофилии эптаког альфа (активированным) на 566 долларов США дешевле лечения антиингибиторным коагулянтным комплексом (14137 и 14703 долларов США соответственно). Фармакоэкономический анализ вкупе с оценкой клинического течения заболевания позволяет определить долгосрочную потребность в препаратах и стоимость лечения.
- Проведение лечения, направленного на достижение иммунологической толерантности, даже при наличии прогностически неблагоприятных для успеха ИИТ факторов высокоэффективно – 82,4%. Выполнение теста индивидуального подбора препарата и теста генерации тромбина до начала ИИТ способствует повышению эффективности лечения.
- У пациентов, получающих высокодозную терапию, имеются динамические изменения клеточного и гуморального иммунитета. Достижению толерантности способствует увеличение количества CD38+, CD25+ и CD4CD25+-лимфоцитов. По изменению количественного соотношения субклассов IgG можно прогнозировать вероятность наступления иммунологической толерантности: при успешной терапии определяются преимущественно IgG1и IgG2, в случае неэффективного лечения - IgG4.
- Проведение регулярной заместительной терапии повышает качество жизни пациентов с ингибиторной формой гемофилии во всех сферах жизнедеятельности. Большая удовлетворенность качеством жизни отмечается у пациентов, находящихся на высокодозной иммунотолерантной терапии по сравнению с пациентами, получающими терапию по требованию.
- ИИТ с эффективностью 80% и выше экономит затраты на здравоохранение в долгосрочной перспективе даже с учетом случаев неуспешной терапии. Для обоснования целесообразности проведения высокодозной терапии может быть проведен фармакоэкономический анализ с использованием ТНР. Стоимость ИИТ возрастает с продолжительностью лечения.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Изменение клинического ответа на стандартную заместительную терапию при гемофилии свидетельствует о возможном образовании ингибиторов к факторам свертывания крови. Для выявления данного осложнения и своевременной коррекции лечения необходимо проведение функциональных (АЧТВ, количественное определение FVIII/FIX, Бетезда и Нимеген тесты) и фармакокинетических (время восстановления, время полужизни FVIII/FIX) методов исследования. Плановые обследования на наличие ингибитора в течение первых 50 дней экспозиции фактора рекомендуется выполнять ежемесячно, далее - не реже двух раз в год постоянно.
- Группа риска по возможному возникновению ингибиторов – пациенты с тяжелой формой гемофилии, предварительно не получавшие лечения, с семейным анамнезом наличия ингибиторов, получающие интенсивную заместительную терапию концентратами факторов свертывания крови, имеющие нарушения в иммунологическом статусе (повышение IgG4, снижение уровня общих Т-лимфоцитов (CD2+, CD3+) и CD38+, увеличение субпопуляций CD8+, CD16+, CD25+).
- При возникновении ингибитора стандартная заместительная терапия становится неэффективной. Требуется немедленное индивидуальное изменение тактики лечения.
- В случае обнаружения ингибитора в высоком титре ( 5 БЕ) терапией первой линии является проведение лечения, направленного на достижение иммунологической толерантности. Предпочтительнее начинать ИИТ как можно скорее от момента обнаружения ингибитора, при титре последнего < 10 БЕ.
- Пациентам с низким титром ингибитора (< 5 БЕ) ИИТ абсолютно показана в случае наличия высокого анамнестического ответа или в случае возникновения неконтролируемых гемостатической терапией кровотечений. При благоприятном фенотипе заболевания следует рассмотреть возможность проведения альтернативных методов лечения.
- Проведение высокодозной терапии (из расчета FVIII 100 МЕ/кг массы тела в сутки) с использованием концентратов FVIII, содержащих vWF, и строгим соблюдением режима введения препарата повышает эффективность ИИТ.
- Оптимальный выбор препарата для иммунотолерантной терапии может быть произведен с помощью теста индивидуального подбора препарата и теста генерации тромбина до начала ИИТ.
- Эффективность ИИТ оценивается по фармакокинетическим параметрам. Критериями успеха терапии следует считать: отрицательные значения ингибитора (< 0,6 БЕ), нормализацию времени восстановления FVIII ( 66%) и периода полувыведения FVIII ( 7 ч.) в плазме с отсутствием анамнестического ответа при последующей экспозиции FVIII. Достижение 3-х критериев свидетельствует о полном успехе, 2-х – частичном успехе, 1-го – частичном ответе на лечение. В случае отсутствия снижения титра ингибитора на 50% и более от исходного в течение 12 месяцев лечения констатируется неуспех ИИТ.
- После достижения иммунологической толерантности пациент переводится на профилактическое лечение концентратами факторов свертывания крови в режиме 25-35 МЕ/кг массы тела пациента каждый второй день.
- Решение о повторной попытке ИИТ в случае неуспеха предыдущей должно основываться на клиническом течении заболевания и индивидуальном ответе пациента на терапию по требованию препаратами шунтирующего действия. Принципиальной является смена препарата для проведения высокодозной терапии.
- Проведение процедур плазмафереза или иммуноадсорбции с протеином А, введение в/в иммуноглобулина показано пациентам с титром ингибитора 10 БЕ с целью снижения уровня антител при старте ИИТ.
- ИИТ должна проводиться при условии хорошего венозного доступа и комплаентности пациента. Преждевременное прерывание лечения недопустимо, так как может привести к росту титра ингибитора (вследствие анамнестического ответа) и фатальным кровотечениям.
- Показатели клеточного иммунитета у больных с ингибиторной формой гемофилии представляют низкие значения иммунорегуляторного индекса и дисбаланс субпопуляций лимфоцитов (см. пункт 3), что свидетельствует о наличии иммунодефицита. Это диктует необходимость коррекции стандартных программ лечения гемофилии с ингибиторами препаратами иммуномодулирующего действия.
- При возникновении кровотечений, в том числе и во время проведения ИИТ, пациентам с ингибиторной формой гемофилии показано проведение гемостатической терапии эптаког альфа (активированным) со строгим соблюдением стандартов режима введений и дозировок препарата. При отсутствии эптаког альфа (активированного) препаратом выбора является антиингибиторный коагулянтный комплекс.
- В программу клинического обследования пациентов с гемофилией в качестве обязательного компонента должно быть включено исследование иммунной системы с определением уровня IgG (и его субклассов), CD4+, CD8+, CD25+, CD4CD25+, CD38+. Их нарушения позволяют прогнозировать степень риска возникновения осложнений гемофилии и эффективности проводимой терапии.
- При обнаружении ингибитора у пациента с гемофилией рекомендуется внесение соответствующей информации в регистр пациентов с ингибиторной формой гемофилии для получения возможности разработки персонифицированной тактики ведения больного и дальнейшего мониторирования состояния пациента.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Plyushch O.P., Zozulya N.I., Kopylov K.G. Results of “Home Treatment” for patients with using factor VIII concentrate Hemoctin STD. 51st annual SSC meeting of XXIInd Congress of the International Society on Thrombosis and Haemostasis, 2005; P0834.
- Plyushch O.P., Zozulya N.I. The National Register of patients with inherited coagulopathies in Russia. 51st annual SSC meeting of XXIInd Congress of the International Society on Thrombosis and Haemostasis, 2005; P2012.
- Плющ О.П., Копылов К.Г., Зозуля Н.И., Северова Т.В. Применение Гемоктина СДТ у пациентов с гемофилией А. Новое в трансфузиологии, 2005; 41: 5-11.
- N.I.Zozulya, O.P.Plyushch, Kopylov K.G., T.V.Severova. Russian register of patients with inhibitor haemophilia. XXVIII International Congress of the World Federation of Haemophilia 2006; 12, 2: 07 РО 212.
- N.I.Zozulya, O.P.Plyushch, Kopylov K.G. The retrospective analysis of NovoSeven using in treatment of patients with inhibitors to factors VIII/IX and with factor VII deficient. XXVIII International Congress of the World Federation of Haemophilia 2006; 12, 2: 05 РО 134.
- O.P.Plyushch, N.I.Zozulya Using of standart information system in patients with inherited coagulopathies. XXVIII International Congress of the World Federation of Haemophilia 2006; 12, 2: 07 РО 208.
- Зозуля Н.И., Плющ О.П., Копылов К.Г., Вдовин В.В., Северова Т.В., Чернов В.М., Hart W.M., Кудрявцева Л.М. Гемофилия, осложненная наличием ингибитора к факторам свертывания крови: создание Всероссийского национального регистра пациентов, анализ проведения домашнего лечения препаратом НовоСэвен в России, экономическая оценка различных видов лечения. Проблемы гематологии и переливания крови 2006; 2: 17-24.
- Плющ О.П., Копылов К.Г., Зозуля Н.И., Вдовин В.В., Чернов В.М., Hart W.M., Karamalis M. Экономическая оценка лечения эпизодов кровотечений легкой и умеренной степени тяжести у пациентов с ингибиторной формой гемофилии в России. Вопросы гематологии/онкологии и иммунопатологии в педиатрии, 2006; 5, 3: 16-22.
- Кудрявцева Л.М., Плющ О.П., Копылов К.Г., Зозуля Н.И., Яструбинецкая О.И. Характеристика алгоритмов гемостатической терапии гемофилии. Проблемы гематологии и переливания крови, 2006; 2: 41-46.
- Плющ О.П., Копылов К.Г., Кудрявцева Л.М., Зозуля Н.И., Лихачева Е.А., Тенцова И.А. Гемофилия. Стандарты лечения. Проблемы гематологии, 2006; 1: 58-59.
- N.I.Zozulya, O.P.Plyushch, T.V.Severova. Interim results of Immune Tolerance Induction in haemophilia A patients with inhibitors to factor VIII in Russia. XX European Haemophilia Consortium, Parma, Italy 2007. Poster.
- Plyushch O.P., Zozulya N.I. The national register of patients with inherited coagulopathies in Russia. Journal of Thrombosis and Haemostasis, 2007; 3, 1: P2012.
- Plyushch O.P., Zozulya N.I., Kopylov K.G. Results of “home treatment” for patients with using factor VIII concentrate Hemoctin STD. Journal of Thrombosis and Haemostasis, 2007; 3,1: P0834.
- N.I.Zozulya, O.P.Plyushch, T.V.Severova. First experience with immune tolerance induction in haemophilia A patients with inhibitor to factor VIII in Russia. 53 annual SSC meeting of XXIst congress of the International Society on Thrombosis and Haemostasis, 2007; poster P-W-142.
- Vdovin V.V., Plyushch O.P., Zozulya N.I., Kopylov K.G. Home treatment with recombinant VIIa factor in haemophilia patients with inhibitor. 53 annual SSC meeting of XXIst congress of the International Society on Thrombosis and Haemostasis, 2007; poster P-W-153.
- N.I.Zozulya The Octanate ITI experience in patients with poor ITI prognosis. XXIst Congress of the International Society on Thrombosis and Haemostasis, 2007; 13-15.
- Зозуля Н.И., Северова Т.В. Российский опыт использования препарата НовоСэвен в домашнем лечении умеренных и легких эпизодов кровотечений у пациентов с ингибиторами к факторам свертывания крови VIII/IX. Мат-лы XXIst Congress of the International Society on Thrombosis and Haemostasis, 2007.
- Яструбинецкая О.И., Попова О.В., Сарычева Т.Г., Тенцова И.А., Лопатина Е.Г., Зозуля Н.И. Изменение периферического звена эритрона у больных гемофилией. Мат-лы XXIst congress of the International Society on Thrombosis and Haemostasis, 2007.
- Шавлохов В.С., Силаев М.А., Полянская Т.Ю., Зозуля Н.И., Зоренко В.Ю., Ефимов И.В., Матвеева Т.И., Бадиков Э.Ф., Бычинин М.В., Мамонов В.Е. Успешное хирургическое лечение гигантской пахово-мошоночной грыжи у больного с ингибиторной формой гемофилии А. Гематология и трансфузиология 2007; 52, 3: 50-51.
- Зозуля Н.И., Плющ О.П., Копылов К.Г., Северова Т.В., В.В. Вдовин, В.М. Чернов. Российский опыт домашнего лечения препаратом НовоСэвен больных гемофилией, осложненной наличием ингибиторов к факторам свертывания крови. Вопросы гематологии, онкологии и иммунопатологии в педиатрии 2007; 1: 43-48.
- Зозуля Н.И., Плющ О.П., Иванова В.Л. Ингибиторная форма гемофилии: современные методы диагностики и лечения. Мат-лы научно-практической конференции «Современная гематология. Проблемы и решения», 2007; 19-20.
- Zozulya N.I., Plyushch O.P., Severova T.V. The Octanate® Immune Tolerance Induction Experience in Haemophilia A Patients with Inhibitors and Poor Prognosis: Prospective Post-Marketing Study in Progress. XXVIII International Congress of the World Federation of Haemophilia 2008; Poster 08 РО 55.
- Zozulya N. I., Plyushch O.P., Severova T.V. The Octanate® immune tolerance induction experience in haemophilia A patients with inhibitors and poor prognosis: prospective post-marketing study in progress. Haemophilia 2008; 14, (Suppl. 2), 150.
- Zozulya N. Treatment of haemophilia A patients with inhibitors and a poor prognosis in Russia: Octanate® in ITI. Transfuze a Hematologie dnes (Sbornik abstract of XV Сesko-Slovensky Hematologicky a Transfusiologicky Sjezd, Spindleruv Mlyn, 6-9 September, 2008) 2008; Suppl. 2: Zari, Rocnik 14, H-O-015, 41.
- Зозуля Н.И., Северова Т.В. Скрининг пациентов с гемофилией для определения наличия ингибиторов к факторам свертывания крови и разработки персонифицированного лечения. Бюллетень сибирской медицины 2008; Приложение 2: 35-36.
- Копылов К.Г., Плющ О.П., Лихачева Е.А., Величко И.В., Северова Т.В., Зозуля Н.И., Тенцова И.А., Иванова В.Л. Лечение Гемоктином СДТ больных гемофилией А и болезнью Виллебранда. Гематология и трансфузиология 2008; 53, 1: 17-21.
- Зозуля Н.И., Арина Г.А. Сравнительный анализ ретроспективной и актуальной оценки качества жизни пациентов с ингибиторной формой гемофилии, получающих лечение препаратом НовоСэвен. Бюллетень сибирской медицины 2008; Приложение 2: 37-38.
- Зозуля Н.И. Опыт индукции иммунной толерантности у пациентов с ингибиторной формой гемофилии А при наличии плохих прогностических факторов. Бюллетень сибирской медицины 2008; Приложение 2: 39-42.
- Зозуля Н.И., Плющ О.П., Иванова В.Л., Северова Т.В. Достижение иммунной толерантности у взрослых пациентов с ингибиторной формой гемофилии А. Материалы II научно-практической конференции «Современная гематология: проблемы и решения» 2008; 27.
- Зозуля Н.И., Арина Г.А., Плющ О.П. Качество жизни пациентов с ингибиторной формой гемофилии, получающих регулярную терапию эптаког альфа (активированным) по требованию. Материалы научно-практической конференции «Современная гематология: проблемы и решения» 2008; 28.
- Андреев Ю.Н., Баркаган З.С., Буевич Е.И., …., Зозуля Н.И., и др. Протоколы ведения больных: Болезнь Виллебранда (ГОСТ Р 52600.1 – 2008). Гемофилия (ГОСТ Р 52600.3 – 2008). М.: Ньюдиамед, 2009. 197 с.
- P.A.Vorobyev, O.V.Borisenko, U.A.Zhulev, N.I.Zozulya, K.G.Kopylov, E.A.Telnova, A.A.Tonoyan. Health-related Quality of Life in Russian patients with hereditary coagulopathies. 55 annual SSC meeting of XXIInd Congress of the International Society on Thrombosis and Haemostasis, 2009; poster PP-MO-553.
- P.A.Vorobyev, O.V.Borisenko, U.A.Zhulev, E.A.Telnova, A.A.Tonoyan, V.U.Zorenko, N.I.Zozulya. Indicators for assessing effectiveness of the state program on drug supply for patients with hereditary coagulopathies. 55 annual SSC meeting of XXIInd Congress of the International Society on Thrombosis and Haemostasis, 2009; poster PP-TH-581.
- N.I.Zozulya. Treatment of haemophilia patients with inhibitors and a poor prognosis: ITI with Octanate. 55 annual SSC meeting of XXIInd Congress of the International Society on Thrombosis and Haemostasis, 2009; poster PP-TH-582.
- P.A.Vorobyev, O.V.Borisenko, U.A.Zhulev, K.G.Kopylov, E.A.Telnova, A.A.Tonoyan, N.I.Zozulya. Epidemiology of hereditary coagulopathies in Russia: patient-reported data. 55 annual SSC meeting of XXIInd Congress of the International Society on Thrombosis and Haemostasis, 2009; poster PP-WW-561.
- M.Baru, J.Spira, O.Plyushch, N.Zozulya, R. Yatuv, I.Dayan, M.Robinson. Safety, pharmacokinetics and efficacy of factor VIIa formulated with pegylated liposomes in hemophilia A patients with inhibitors to factor VIII. 55 annual SSC meeting of XXIInd Congress of the International Society on Thrombosis and Haemostasis, 2009; poster PP-WE-608.
- Воробьев П.А., Борисенко О.В., Тельнова Е.А., Жулев Ю.А., Копылов К.Г., Зозуля Н.И., Литвинов А.Б., Тоноян А.А., Петроченков Г.А. Эпидемиология и качество жизни больных с ингибиторной формой гемофилии: результаты, доложенные пациентами. Клиническая фармакология и фармакоэкономика 2009; 4: 9-15.
- Зозуля Н.И., Плющ О.П., Величко И.В. Промежуточные результаты мультицентрового Российского открытого исследования по оценке применения препарата Гемоктин у больных гемофилией А. Гематология и трансфузиология 2009; 54, 6: 13-18.
Зозуля Надежда Ивановна
ДИАГНОСТИКА И ЛЕЧЕНИЕ
ИНГИБИТОРНОЙ ФОРМЫ ГЕМОФИЛИИ
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Рекомендован к изданию ученым советом
Учреждения Российской академии медицинских наук
Гематологический научный центр РАМН

