Оглы новые оперативно-инструментальные технологии в профилактике и лечении гнойно-воспалительных раневых осложнений в неотложной абдоминальной хирургии (экспериментально-клиническое исследование)
На правах рукописи
ГАРАЕВ ВАЛИХАН НОВРУЗ ОГЛЫ
НОВЫЕ ОПЕРАТИВНО-ИНСТРУМЕНТАЛЬНЫЕ ТЕХНОЛОГИИ В ПРОФИЛАКТИКЕ И ЛЕЧЕНИИ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ РАНЕВЫХ ОСЛОЖНЕНИЙ В НЕОТЛОЖНОЙ АБДОМИНАЛЬНОЙ ХИРУРГИИ
(экспериментально-клиническое исследование)
14.00.27 – Хирургия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Саранск -2009
Работа выполнена в Институте Федеральной службы безопасности Российской Федерации (г. Нижний Новгород)
Научный консультант: доктор медицинских наук
профессор С.Г. Измайлов
| Официальные оппоненты: | доктор медицинских наук профессор Власов Алексей Петрович |
| Заслуженный деятель науки Российской Федерации доктор медицинских наук профессор Тимошин Андрей Дмитриевич | |
| доктор медицинских наук профессор Буткевич Александр Цезаревич |
Ведущее учреждение – Московская государственная медицинская академия им. И.М. Сеченова
Защита диссертации состоится «24» апреля 2009 г. в_____ часов на заседании диссертационного совета Д. 212.117.08 при ГОУ ВПО «Мордовский государственный университет им. Н.П.Огарева» (430000, г.Саранск, ул Большевистская, 68)
С диссертацией можно ознакомиться в библиотеке Мордовского государственного университета им Н.П.Огарева (430000, г.Саранск, ул. Большевистская, 68)
Автореферат разослан "__ _"_________ 2009 года
Ученый секретарь
диссертационного Совета
кандидат медицинских наук
доцент А.Г. Голубев
Актуальность темы. Профилактика и лечение гнойно-воспалительных раневых осложнений остается одной из важнейших проблем современной хирургии (Ипполитов И.Ю., 2001; Чадаев А.П. и соавт., 2003; 2007; Федоров В.Д., Светухин А.М., 2005; Гостищев В.К. и соавт., 2008; Тимошин А.Д. и соавт., 2007; Ботяков А.А., 2008). В общей структуре хирургических заболеваний хирургическая инфекция наблюдается у 35-45% больных и протекает наиболее часто в виде раневой инфекции посттравматических и послеоперационных ран, а также в виде острых и хронических гнойных заболеваний (Ерюхин И.А. и соавт., 2003; Власов А.П., Сараев В.В., 2005; Доброквашин С.В. и соавт., 2007; Шведюк В.В., 2006; Шевченко Н.П., 2007; Рудь А.А., 2008).Особую значимость это проблема приобрела в связи с ростом числа техногенных и природных катастроф, военных конфликтов и террористических актов (Подушкина И.В., 2000; Ботяков А.Г., 2001; Анисимов В.Н. и соавт., 2003; Светухин А.М., Амирасланов Ю.А., 2003; Ефименко Н.А., 2003; Вардаев Л.И., 2005; Гречко В.Н., Воробьев А.В., 2008).
Несмотря на использование новых синтезированных лекарственных препаратов, совершенствование хирургических методов профилактики и лечения раневой инфекции, инфильтраты и нагноения послеоперационных ран в неотложной абдоминальной хирургии не имеют тенденции к снижению, продолжают занимать первое место среди всех госпитальных осложнений и третье место среди основных причин летальности (Блатун Л.А., 2002; Гаджиев Дж.Н., 2003; Шаймарданов Р.Ш. и соавт., 2004; Антонюк А.В., 2007; Измайлов А.Г., 2008; Korenkov M. et al., 2002). Так, частота послеоперационных гнойно-воспалительных раневых осложнений со стороны лапаротомных ран колеблется от 2,7 до 38,5 % (Кукош М.В. и соавт., 2003; Жебровский В.В., 2005; Шакиров М.И., 2005; Малков И.С. и соавт., 2007; Сараев В.В., 2007; Помазкин В.И., Мансуров Ю.В., 2008; Wald D.S., 2002; Hotobkiss R.S. et al., 2003). После релапаротомий, выполняемых в основном по поводу перитонита, процент гнойных осложнений со стороны ран в зависимости от патологии органов брюшной полости находится в пределах 20,8-100%, а летальность достигает 45% (Марченко И.П., 2005; Лузин В.В. и соавт., 2007; Черенков С.П., и соавт., 2007; Врублевский Н.М., 2008; Плоткин Л.Л., 2008; Huseynov S.A., 2004).
Нагноение послеоперационной раны часто приводит к возникновению эвентраций, формированию вентральных грыж, лигатурных и кишечных свищей, способствует генерализации инфекции и развитию различного рода токсико-аллергических реакций, что еще больше ухудшает результаты лечения, увеличивает послеоперационный период и стоимость пребывания больных в стационаре (Бенсман М.М. и соавт., 2005; Бойко В.В. и соавт.,2006; Савельев В.С. и соавт., 2006; Тимошин А.Д., и соавт., 2006; Рысенбеков М.М. и соавт., 2007; Белокуров Ю.Н. и соавт., 2007; Светухин А.М. и соавт., 2007; Hotobkiss R.S., 2003; Gembal P. et al., 2006).
Неблагоприятной в плане прогноза и наиболее тяжелой является категория больных после релапаротомии и с эвентрациями (Гостищев В.К. и соавт., 1983;2005; Кукош М.В. и соавт., 2005; Буткевич А.Ц. и соавт., 2007; Zer M., Dux S., Dintisman M.,1980), у которых несостоятельность швов и рецидивы достигают 30-45% (Шапкин В.С., Хорев П.Н., 1977; Кукуев А.Ю., Мухин В.И., 2003; Савельев В.С., 2006; Storakova D., et al. 1984; Abbott D.E. et. al., 2007), кишечные свищи - 23-61% (Сафронов А.В. и соавт., 1976; Жебровский В.В., Эльбашир Мохаммед Том, 2002; Базаев А.В., 2004; Huseynov S.A., 2004), а летальность варьирует в пределах 20-86% (Шошас И.И.,1986; Левчук А.Л. и соавт., 1999; Полубкова Г.В., 2000; Чадаев А.П. и соавт., 2002; Mazuski J.E.et al., 2002; Finch R. J. et al., 2003).
Немаловажную роль в развитии послеоперационной раневой инфекции может играть излишняя травматизация сшиваемых тканей, которая обусловлена несовершенством используемых инструментов и способов дистракции и ушивания ран (Сигал М.З., Ахметзянов Ф.Ш., 1987; Измайлов С.Г., 1994; Паршиков В.В.,2005; Дерябин А.М., 2006).
Особые трудности при сближении отечных и инфильтрированных тканей встречаются в 65-79% наблюдений (Удод В.М.,1983; Роман Л.И., 1985; Bradley Easterlin M.D., William Bromberg, 2007; Abbott D.E. et. al., 2007). Поэтому вопрос, как зашивать лапаротомную рану в различных ситуациях у данной категории пациентов, достаточно не отражен в научной литературе (Волков А.В., 2007).
С увеличением количества и тяжести травм все чаще стали встречаться больные с обширными гнойными ранами различной локализации (Анисимов В.Н и соавт., 1992,1994; Воробьев А.В.,1998; Федоров В.Д., 2000; Войновский Е.А., 2003; Гостищев В.К., и соавт., 2007). К настоящему времени известны методы адгезивной (Hasse F.M u.a., 1999), спицевой (Амирасланов Ю.А. и соавт., 1989; Липатов К.В., 1996), жидкостно-гелевой (Суламанидзе М.А. и соавт., 1997) дермотензии. Для сопоставления краев раны применяются аппараты различной конструкции (Измайлов С.Г., Бесчастнов В.В., 2003), где в качестве механизма сближения используются пружины, металлические скобы с ”эффектом памяти“, стержни с резьбой (винты), барабаны с нитью или проволокой, реечно-винтовой привод. Однако данные методы сопровождаются относительно высокой частотой осложнений и требуют совершенствования (Измайлов С.Г., Измайлов Г.А., 2004; Зубарев П.Н. и соавт., 2007).
Таким образом, проблема раневой инфекции в абдоминальной хирургии имеет серьезное социально-экономическое значение, что требует дальнейшей разработки новых хирургических технологий, направленных на профилактику и лечение раневых гнойно-воспалительных осложнений.
Цель исследования – улучшить результаты комплексного лечения больных с острыми хирургическими заболеваниями органов брюшной полости путем разработки и научного обоснования новых оперативно-инструментальных технологий в хирургии ран передней брюшной стенки для профилактики и лечения гнойно-воспалительных раневых осложнений.
Задачи исследования:
- Экспериментальными и клиническими исследованиями обосновать новые представления о патогенезе местных гнойно- воспалительных осложнений со стороны операционных ран передней брюшной стенки и на основе полученных данных разработать принципы их профилактики и лечения.
- Усовершенствовать существующие и разработать новые аппараты для раскрытия и закрытия лапаротомных ран, показания и противопоказания к клиническому применению и определить их функциональное назначение.
3. Разработать способы ушивания лапаротомных, релапаротомных и гранулирующих ран, позволяющие снизить травматизацию и уменьшить степень нарушения кровоснабжения сшиваемых тканей, повысить точность сопоставления краев раны и плотность их контакта.
5. Провести анатомо-экспериментальное обоснование целесообразности применения разработанных спицевых абдоминальных раневых контракторов и способов ушивания послеоперационных ран в клинической практике.
6. Изучить в эксперименте на различных моделях раневого дефекта характер заживления и морфофункциональное состояние тканей в области швов раны, ушитой традиционным и аппаратным способами.
7. Внедрить в клиническую практику предложенные новые оперативно-инструментальные технологии для профилактики и лечения гнойно-воспалительных раневых осложнений, дать объективную оценку их эффективности.
Научная новизна. Получены новые сведения по динамике патоморфологических изменений в области различных моделей проблемных ран при традиционном способе ушивания, что позволило сформировать новые представления о патогенезе гнойно-воспалительных осложнений операционных ран передней брюшной стенки. На основе полученных данных определены пути совершенствования хирургических способов профилактики и лечения раневой инфекции.
Проведен комплексный анализ эффективности ушивания лапаротомных ран после релапаротомии традиционным и аппаратным способами. Выявлено, что при патологических состояниях, характеризующихся наличием воспаленных и дистрофически измененных краев раны мышечно-апоневротического слоя, ручное сближение краев раны с помощью шовной нити не только технически сложно и ненадежно, но также чревато осложнениями.
Впервые в эксперименте на модели релапаротомных и гранулирующих ран мягких тканей гистоморфометрическими исследованиями установлено, что их повторное ушивание традиционным способом с помощью нити в условиях действия сил растяжения приводит к образованию не только прямых очагов некроза в области швов, но и непрямого сосудистого некроза на отдаленных участках, находящихся на линии натяжения нити. Эти изменения стимулируют механизм развития вторичного некроза, что является причиной ослабления местной (тканевой) реактивности организма к инфекции, их регенерационной способности и, тем самым, значительно повышает риск развития гнойно-воспалительных осложнений со стороны послеоперационных ран.
Усовершенствовано и научно обосновано перспективное направление в хирургической технологии ушивания лапаротомных ран после релапаротомии с использованием новых спицевых абдоминальных раневых контракторов для раскрытия и закрытия ран, позволяющих повысить резистентность местных тканей к инфекции, уменьшить риск возникновения гнойно-воспалительных раневых осложнений и рецидива заболевания (Патенты РФ на изобретения №2133106; №2153297; №2153298; №2123299; №2198605; №2238683; №2257861; №2322198).
На основании проведенных исследований доказана целесообразность использования разработанного компенсирующего устройства, позволяющего предупредить нарушения местного кровотока при аппаратной коррекции хирургического доступа (Патент РФ на полезную модель №40163).
Разработаны и апробированы новые способы ушивания лапаротомных и релапаротомных ран, позволяющие в комплексной терапии улучшить процессы заживления и, тем самым, повысить качество лечебной помощи данной категории больных (Патенты РФ на изобретения №2223048; №2261665; №2263472; Патент РФ на полезную модель №62822).
Разработано дренажное устройство, позволяющее повысить эффективность дренирования гнойных ран за счет капиллярной структуры и возможности изменения конфигурации с образованием многотрубчатого желоба или дренажного устройства (Патент РФ на полезную модель №48480).
Практическая значимость. Полученные результаты позволили расширить представления о патогенезе местных гнойно-воспалительных осложнений со стороны операционных ран передней брюшной стенки при традиционных способах их раскрытия и закрытия, что определило пути совершенствования оперативно-инструментальных технологий в профилактики и лечения раневой инфекции в неотложной абдоминальной хирургии.
Разработанное новое компенсирующее устройство для коррекции хирургического доступа обеспечило выполнение срединной лапаротомии с минимальным травматическим воздействием на операционную рану и незначительным нарушением местного кровотока. Это приводит к снижению частоты раневых осложнений.
Использование новых способов ушивания срединных ран после лапаротомии с помощью непрерывного матрацного и непрерывного шва с созданием дубликатуры апоневроза позволило снизить количество раневых осложнений при различных оперативных вмешательствах по сравнению с узловым и непрерывным швами. При этом, таких осложнений как эвентрация и послеоперационная вентральная грыжа, не наблюдалось.
Применение разработанного съемного кожно-апоневротического шва для ушивания релапаротомных и гранулирующих ран передней брюшной стенки позволило предупредить прорезывание тканей, образование замкнутых полостей, карманов и лигатурных свищей, повысить прочностные характеристики рубца с одновременным улучшением его косметического эффекта и, таким образом, снизить количество раневых осложнений по сравнению с узловыми с 16,6% до 5,3%.
Разработанные спицевые абдоминальные раневые контракторы нового поколения и реализованные в клинической практике, принципиально отличающиеся от традиционных технологий с применением малой механизации в комплексе терапевтических мероприятий, позволили не только облегчить технику ушивания и сократить продолжительность операции, но и повысить качественные показатели лечения. При этом значительно снизилась частота гнойно-воспалительных раневых осложнений после релапаротомии, число эвентрации и количество кишечных свищей. Уровень летальности уменьшился в 3,6 раза.
Основные положения, выносимые на защиту. Изучение динамики патоморфологических явлений в области различных моделей раневого дефекта, ушитого традиционным ручным способом, позволило выявить новые механизмы развития местных гнойно-воспалительных осложнений со стороны операционных ран передней брюшной стенки и обосновать необходимость совершенствования оперативно-инструментальных технологий в профилактике и лечении раневой инфекции в неотложной абдоминальной хирургии.
Традиционные способы ушивания операционной раны после релапаротомии и гранулирующих ран передней брюшной стенки, в основу которых заложен принцип соединения краев раневого дефекта с помощью нити, приводят не только к интраоперационному прорезыванию сшиваемых тканей с развитием первичных очагов некроза, но и вызывают образование вторичных прямых очагов некроза в области швов и непрямых сосудистых некрозов на отдаленных участках от шва. Это способствует распространению площади вторичного некроза, что снижает местную (тканевую) реактивность организма к инфекции.
Усовершенствованный способ аппаратной коррекции хирургического доступа обеспечивает выполнение срединной лапаротомии с минимальным травматическим воздействием на операционную рану и позволяет предупредить нарушения местного кровотока.
Применение в клинике разработанного непрерывно-матрацного шва и непрерывного шва с образованием дубликатуры апоневроза мышечно-апоневротического слоя и съемного кожно-апоневротического шва улучшает результаты лечения больных после различных хирургических вмешательств путем снижения числа гнойно-воспалительных осложнений со стороны лапаротомных ран, эвентраций и послеоперационных вентральных грыж.
Разработанные спицевые абдоминальные раневые контракторы позволяют закрыть рану без шовной нити, которая в данном случае не является средством для осуществления тракции тканей в процессе их сближения, а служит лишь фиксирующим элементом удержания краев раневого дефекта в сведенном состоянии. Аппаратами достигается точная реконструкция тканей в области раны и минимальное повреждение сшиваемых тканей с уменьшением общей площади вторичного некроза, оптимальные условия для адекватного кровоснабжения в области раневого дефекта и, тем самым, повышается локальный иммунитет перивульнарных тканей к инфекции. Проведенные в эксперименте исследования на животных подтвердили эффективность использования предложенных аппаратов для улучшения заживления раны после релапаротомии и гранулирующих ран передней брюшной стенки, по сравнению с общепринятыми способами ушивания.
Внедрение результатов исследований. Результаты выполненных научных исследований внедрены в работу хирургических отделений городских клинических больниц № 12 г. Н.Новгорода, №5, 7 г. Казани, БСМП г. Дзержинска.
Изготовленные макетные и опытные образцы спицевых абдоминальных раневых контракторов одобрены проблемным научным центром Минздрава РСФСР (1985), специализированной комиссией Комитета по новой медицинской технике МЗ РФ, утверждено предложение на их разработку (протокол №2 от 18.02.1999) и включено в план заказной тематики МЗ РСФСР (1985-1990 гг., позиция № 65, с.42). Изобретения ’’Устройство для сближения краев раны’’ (патент РФ №2153298 от 27.07.2000) и ’’Раневой контрактор’’ (патент РФ №2153297 от 27.07.2000) признаны Экспертным отделом Федерального института промышленной собственности перспективными в плане дальнейшей разработки. Данный фрагмент работы выполнен согласно комплексного научного плана с ГУП ВНИПИМИ- Всероссийским научно-исследовательским проектным институтом медицинских инструментов (г.Казань) и ОАО ’’МИЗ им В.И.Ленина’’ (г.Ворсма) (договор №98/432-16 от 10.01.2000 о совместном проведении научно-конструкторской разработки ’’Набор инструментов для лечения гнойных ран’’).
По теме диссертации изданы учебные пособия: “Оптимизация техники наложения кожного шва’’(1998), “Послеоперационные эвентрации“(1999), “Техника наложения мягких повязок’’(2004) и “Способы ушивания ран’’(2005) (рекомендованы Учебно-методическим объединением по медицинскому образованию ВУЗов России в качестве учебного пособия для системы послевузовского профессионального образования), “Торакоабдоминальные ранения’’(2007). Опубликована монография: “Аппаратный способ лечения послеоперационных эвентраций’’(2004).
Материалы диссертации используются на занятиях с врачами-курсантами Казанской государственной медицинской академии последипломного образования и со слушателями Института ФСБ России (г.Нижний Новгород).
Апробация. По разным фрагментам диссертации сделаны сообщения на: Российской научной конференции “Оперативная микрохирургия и микрохирургическая анатомия“ (г.Оренбург,1997); научно-практической конференции “Актуальные вопросы диагностики и лечения“ (г.Казань, 1997); международной конференции по биомедицинскому приборостроению “Биомедприбор-98” Москва, 6-8.Х.1998; заседании Нижегородского областного общества хирургов (г. Н.Новгород, 1998, 2002, 2006); областной научно-практической конференции хирургов “Актуальные вопросы абдоминальной хирургии“ (г. Павлово-на Оке, 1998; 2005); научно-практической конференции “Актуальные проблемы железнодорожной и военной медицины“, посвященной 80-летию Дорожной клинической больницы ГЖД МПС РФ (г.Нижний Новгород, 2002); научной конференции “Актуальные вопросы абдоминальной хирургии“, посвященной 70-летию профессора О.С.Кочнева (г. Казань,2002 ); научно-практической конференции врачей России, посвященной 100-летию хирургической службы Тверской области (г.Тверь,2002); всероссийской конференции (Ростов-на-Дону, 2005); VI Всеармейской международной конференции “Инфекции в хирургии мирного и военного времени“ (г.Москва, 2006); заседании Казанского общества хирургов (г.Казань, 2006); совместном заседании кафедр хирургических болезней, госпитальной и военно-полевой хирургии с курсом травматологии, ортопедии и комбустиологии Военно-медицинского института ФСБ России, факультетской и госпитальной хирургии, хирургии центра повышения квалификации и профессиональной подготовки специалистов, топографической анатомии и оперативной хирургии Нижегородской государственной медицинской академии (г.Н.Новгород, 2006); научной конференции “Актуальные вопросы абдоминальной хирургии“, посвященной 75-летию профессора О.С.Кочнева (г. Казань, 2007); межкафедральном заседании кафедры хирургических болезней Института ФСБ России и хирургических кафедр ГОУ ВПО “Мордовский государственный университет им. Н.П. Огарева“ (г.Саранск, 2008).
Публикации. По теме диссертации опубликовано 45 научных работы, в том числе 11- в рецензируемых журналах, рекомендованных ВАК для опубликования основных положений диссертационных исследований, изданы 5 учебных пособий и 1 монография. Получено 12 патентов РФ на изобретения и 3 на полезную модель.
Структура и объем диссертации. Диссертация изложена на 261 страницах компьютерного текста, содержит 69 рисунка и 36 таблиц. Работа состоит из введения, обзора литературы, 3 глав собственных исследований, заключения, выводов, практических рекомендаций, указателя литературы (416 отечественных и 121 иностранных источников).
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Анатомо-экспериментальные исследования проведены с целью обоснования клинического применения разработанного съемного кожно-апоневротического шва и спицевых абдоминальных раневых контракторов (СпАРК) на 48 трупах различной конституции и пола. В зависимости от выраженности подкожной жировой клетчатки, трупы разделены на три группы, а по форме телосложения- на две (Г.Е. Островерхов и соавт.,1996). Производился срединный разрез брюшной стенки длиной 200 мм. Спицы проводились под разным углом к поверхности кожи и на различном расстоянии от краев раны. Для измерения угла между осью проведения спицы и поверхностью кожи применялся производственный угломер КИ. Толщина передней брюшной стенки, расстояние от точки вкола и выкола спицы до края раны, замерялись штангенциркулем. После каждого варианта проведения спиц оценивалось качество сопоставления всех слоев брюшной стенки. Результаты подразделены на хорошие, удовлетворительные и неудовлетворительные: хорошие- полностью отсутствовала деформация краев мышечно-апоневротического слоя и подкожной жировой клетчатки; удовлетворительные- наблюдалось неравномерное сопоставление краев раны; неудовлетворительные- не точная кооптация, адаптация слоев брюшной стенки, прохождение спиц в опасной зоне по отношению к сосудам и нервам.
Математическое обоснование применения разработанных СпАРК и способов ушивания ран проводилось с использованием стандартных формул и методов, принятых в механике (Феодосьев В.И.,1970; Писаренко Г.С.и соавт.,1975; Черных К.Ф.,1986). Математические расчеты и вывод формул консультированы доцентом кафедры теоретической механики Казанского государственного университета Ф.Х. Тазюковым.
Экспериментальное исследование основано на моделировании у 56 беспородных белых крыс и 36 собак различных ран (условно-асептических резаных, релапаротомных, гранулирующих) и условий их заживления. Все животные разделены на две группы: опытную- для закрытия ран применялись разработанные различные конструкции СпАРК и контрольную- закрытие ран производилось традиционным способом.
Влияние разработанного непрерывного матрацного шва на заживление условно-асептических резаных ран изучалось на крысах-самцах с использованием модели раны мышечно-апоневротического слоя (56 особей). Каждому животному наносилась одна линейная рана мышечно-апоневротического слоя по средней линии живота (А.С.№1827621). Зашивание лапаротомной раны у животных первой группы (12) осуществлялось узловыми швами, второй группы (22)- непрерывными обвивными швами, третьей группы (22)- непрерывным матрацным швом. Прочность сращения краев раны мышечно-апоневротического слоя на разрыв оценивалась методом пневмопрессии (Poole G.V et. al.,1984).
Релапаротомные раны моделировались у 18 собак, при этом ушивание производилось в условиях воспалительно–измененных краев ран. Гранулирующие раны мягких тканей моделировались у 18 собак, вторичный шов накладывался в условиях стихания воспалительных признаков. В опытной группе сопоставление краев ран производили перед затягиванием швов при помощи СпАРК с реечно-винтовым приводом. Для этого в мягких тканях краев раны проводили спицы, фиксировали в браншах аппарата и затем сопоставлялись края раны, путем сближения бранш вращением ручки реечно-винтового привода. Замеры упругих сил, разъединяющих края раны мягких тканей в эксперименте, проведены методом динамометрии (Рамазанов Р.М., 1983; Измайлов С.Г., 1994).
Эффективность лечения оценивалась на основании субъективных (визуальная оценка состояния раны и послеоперационного рубца) и объективных (качественный и количественный состав раневой микрофлоры, гистологические исследования, тензиометрия) критериев.
Изучение процессов репарации в релапаротомных ранах, ушитых в условиях воспалительно- измененных краев ран, выполнено на 18 беспородных собаках, массой 12-16 кг, которые были распределены на две группы в зависимости от решения поставленных задач. Зашивание лапаротомной раны животным первой группы (6 особей) осуществлялось традиционном способом, а ушивание лапаротомной раны животным во 2-й (12 особей) группе производилось после предварительного сопоставления краев раны СпАРК. На 3-й день выполнялась релапаротомия. Ушивание релапаротомной раны животным 1-й группы выполнялось традиционным способом, у животных 1-й и 2-й серий второй группы края раны сближались с помощью СпАРК. Причем животным 2-й серии проводили дополнительные спицы в области апоневроза параллельно краям раны, затем накладывали апоневротические швы с захватом спиц. Далее, с помощью аппарата сопоставлялись края раны, накладывались швы на мышечно-апоневротический слой, в последнюю очередь затягивались швы на спицах и аппарат удалялся.
Для патогистологического и морфометрического исследования фрагменты раны мышечно-апоневротической ткани, содержащие шовный материал, забирали из верхней, средней и нижней трети раны на 3-й и 5-й дни после релапаротомии. На 5-й день после эвтаназии животным обеих групп проводилась ранотензиометрия методом пневмопрессии.
Экспериментальные исследования заживления гранулирующих ран выполнены на 18 беспородных собаках массой тела 14,5±0,7 кг, которые были распределены на две группы: опытную (12 животных- аппаратный способ ушивания) и контрольную (6 животных– традиционный способ ушивания). Гранулирующую рану моделировали по способу В.И.Стручкова (1975) в модификации С.Г.Измайлова с соавт. (2002) (удостоверение на рационализаторское предложение №1356 от 28.11.02., выданное Военно-медицинским институтом ФПС РФ при НГМА).
В 1-й серии опытной группы после наложения швов СпАРК удаляли, а во 2-й -оставляли на ране на трое суток. В контроле использовали капрон №4, а в опыте- №2. Применяли шовный материал, стерилизованный и упакованный заводским способом.
В спектр микробиологических исследований входило количественное и качественное определение микрофлоры. Для количественного учета микроорганизмов осуществляли подсчет колониеобразующих единиц (КОЕ) при лимитирующих разведениях на 1 мл раневого отделяемого, 1см2 кожных покровов и 1 см шовной нити. Исследовали кожные покровы и шерсть животного в области моделирования гнойной раны, отделяемое из раны в стадии гнойного воспаления и регенерации, а также шовный материал, находящийся внутри тканей.
Микробиологические исследования выполнялись на базе НИИ эпидемиологии и микробиологии МЗ РФ им. И.Н. Блохиной с соблюдением приказа МЗ СССР № 535 от 23.04.85. Для проведения цитологических исследований использовался метод «поверхностной биопсии» по М.Ф. Камаеву (1970). Цитологические и гистологические исследования проводились на 1, 3, 5, 7-е сутки при консультации заведующей кафедры судебной медицины и патологической анатомии ГОУ ВПО НижГМА доктора медицинских наук, профессора А.А. Артифексовой и старшего научного сотрудника доктора медицинских наук А.Г. Монахова. Фоторегистрацию выявленных изменений осуществляли специальным устройством тубусной насадки с гнездом для закрепления объектива фотоаппарата (удостоверение на рационализаторское предложение №757, выданное Военно-медицинским институтом ФПС РФ от 21.01.1999.). Окраска гистологических препаратов осуществлялась по Ван-Гизону, гематоксилин-эозином. Цитологические мазки-отпечатки окрашивались азур-эозиновым красителем по методу Паппенгейма. Ранотензиометрия выполнялась на 3– й день после ушивания гранулирующей раны при помощи специального устройства (Гречко В.Н., 1993).
Выполнение всех операций на животных осуществлялось с соблюдением приказа Министерства здравоохранения СССР №755 от 12.08.1977 г. «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных» и приказа № 701 от 27.07.1978 г. «О внесении дополнений в приказ Министерства здравоохранения СССР № 755 от 12.08.1977 г.»
В основу настоящей работы положен анализ результатов лечения 1105 больных, оперированных по поводу острых хирургических заболеваний органов брюшной полости (табл.1). Мужчин было 567(51,3%), женщин- 538(48,7%). Среди обследованных в основном были пациенты старше 45 лет (рис. 1).
С целью профилактики местных послеоперационных осложнений со стороны операционной раны передней брюшной стенки обследовано 935 больных, которые разделены на 2 группы: пациенты после лапаротомии (п=530) и релапаротомии (п=405). С гранулирующими ранами наблюдалось 170 пациентов. У всех групп больных использовали стандартный комплекс клинических, лабораторных и инструментальных данных. Тяжесть состояния и прогноз выживаемости оценивали при помощи интегральных шкал ССВР (SIRS), APACHE II и МИП, что позволило провести корректный сравнительный анализ.
У больных контрольной группы (334 пациента) после лапаротомии для ушивания срединной лапаротомной раны использовались узловые и непрерывные обвивные швы, края раны разводились ретрактором М.З.Сигала- К.В.Кабанова (1959) без замера силы натяжения тканей. Разработанные новые технические средства и способы ушивания лапаротомных ран (основная группа) для профилактики гнойно–воспалительных осложнений применены у 196 больных. Верхне-срединная лапаротомия выполнена 121 (61,9%) пациенту, средне-срединная– 56 (28,6%), нижнесрединная– 19 (9,5%). Возраст больных колебался от 16 до 75 лет (в среднем - 52±10,9 года). Мужчин было 101 (51,6 %), женщин–
Таблица 1.
Распределение обследованных больных по характеру и частоте основного заболевания
| Этиология заболевания | Количество больных | ||
| абс. | % | ||
| Язвенная болезнь желудка и двенадцатиперстной кишки, осложненная кровотечением и перфорацией | 256 | 23,2 | |
| Открытая и закрытая травма живота | 188 | 17 | |
| Ущемленная грыжа | 155 | 14,1 | |
| Острый холецистит | 155 | 14,1 | |
| Острая спаечная кишечная непроходимость | 108 | 9,8 | |
| Острый аппендицит | 66 | 5,9 | |
| Рак толстой кишки, осложненный кишечной непроходимостью | 59 | 5,3 | |
| Гинекологические заболевания | 42 | 3,8 | |
| Острый панкреатит | 28 | 2,5 | |
| Синдром Маллори-Вейсса | 22 | 2 | |
| Тромбоз мезентериальных сосудов | 9 | 0,8 | |
| Цирроз печени, асцит-перитонит | 9 | 0,8 | |
| Рак желудка | 8 | 0,7 | |
| Всего | 1105 | 100 | |
 | Рис.1.Распределение обследован- ных больных по возрасту |
95 (48,4%). Непрерывный матрацный шов применён у 62 больных, непрерывный шов с образованием дубликатуры у 66, а компенсирующие устройство у 68 больных. В условиях разлитого перитонита непрерывный шов с образованием дубликатуры апоневроза применён у 7 больных, местного перитонита- у 5. С ущемлёнными вентральными грыжами, осложнёнными кишечной непроходимостью наблюдалось 27 пациентов, со спаечной кишечной непроходимостью– 9 больных. После релапаротомии непрерывный матрацный шов применен у 6 больных.
Проведена сравнительная клиническая оценка способов ушивания релапаротомной раны у 405 больных в возрасте от 15 до 89 лет, оперированных по поводу различных острых хирургических заболеваний органов брюшной полости. Мужчин было 270 (66,7%), женщин-135 (33,3%). Из 405 пациентов контрольную группу составили 258 (63,7%), а основную-147 (36,3%) больных. Следует отметить, что по полу и возрасту исследуемые больные были репрезентативны. Средний возраст составил 59±13,1; 63,5% пациентов были в возрасте 60 лет и старше.
Релапаротомия по требованию выполнена 267 (65,9%) больным из 405 пациентов: с перитонитом было 68 (25,4%), эвентрацией -106 (39,7%), кишечной непроходимостью- 51(19,1%), кровотечением- 38 (14,2%) и с панкреонекрозом- 4 (1,5%) пациента. Релапаротомия по программе выполнена 138 (34,1%) пациентам: с разлитым гнойным перитонитом- у 130 (94,2 %) и распространенным панкреонекрозом- у 8 (5,8%).
У больных контрольной группы релапаротомная рана ушивалась послойными узловыми швами у 63 (24,2%) пациентов, 8–образными швами– у 57 (22,1%), П-образными швами на протекторах у 64 (24,8%), швами Савельева–Савчука (1976)- у 59 (22,9%) больных. Металлические опорные внутритканевые спицы для предупреждения прорезывания узловых швов использованы у 15 (5,8%) пациентов.
У больных основной группы релапаротомная рана ушивалась с помощью различных вариантов СпАРК с оставлением их на ране у 117(75,6%) больных и удалением после наложения швов у 30(20,4%) пациентов. После аппаратного сопоставления краев релапаротомной раны накладывались послойные узловые швы у 75 (51 %) больных. Разработанный съемный кожно-апоневротический адаптирующий шов применялся у 72 (49%) пациентов (табл. 2).
Обследовано 170 больных в возрасте от 16 до 84 лет с гранулирующими ранами передней брюшной стенки, образующиеся после частичной эвентрации в гнойную рану и нагноения лапаротомных ран. Мужчин было 100 (58,8%), женщин –70 (41,2%). Средний возраст составил 52,4±3,3 года. Все обследуемые больные разделены на 2 группы: контрольная и основная. Больные по полу и возрасту были репрезентативны.
Нагноения послеоперационных ран в большинстве случаев выявлены после срединной лапаротомии у 154 (91%) больных, после лапаротомии по Волковичу –Дъяконову у 16 пациентов. После экстренных оперативных вмешательств больных было 167 (98,7%).
Традиционный способ лечения (контрольная группа) использовался у 100 больных из 170 пациентов. Мужчин было 58 (58%), женщин 42 (42%). Средний возраст составил (M±m) 52,4±2,4 лет. Гранулирующие раны, с расхождением краев 5 см и более, требующие активной хирургической тактики для закрытия,
Таблица 2
Распределение больных основной группы после релапаротомии в зависимости от варианта применения СпАРК для сближения краев раны и способа наложения шва
| Варианты СпАРК | Число больных | Способ наложения шва | ||
| послойный узловой | съемный кожно-апоневротический | |||
| абс. | % | |||
| СпАРК–I (одномоментное ушивание без оставления АРК) | 30 | 20,4 | 16 | 14 |
| СпАРК–I (с оставлением АРК) | 23 | 15,6 | 20 | 3 |
| СпАРК–II (с оставлением АРК) | 58 | 39,5 | 33 | 25 |
| СпАРК–III (с оставлением АРК) | 20 | 13,6 | 6 | 14 |
| СпАРК-IV (с оставлением АРК) | 16 | 10,9 | - | 16 |
| Итого | 147 | 100 | 75 | 72 |
Примечание: СпАРК-I-II соответственно с перпендикулярным и параллельным проведением спиц; СпАРК–III– с параллельным проведением спиц, выполненных в виде изогнутых хирургических игл; СпАРК-IV– с параллельным проведением парных спиц, выполненных в виде изогнутых хирургических игл (многоступенчатый компрессионно-дистракционный аппарат)
имели место у 34 (34%) больных контрольной группы. Диастаз краев раневого дефекта у 66 (66%) больных был менее 5 см и лишь у 8 пациентов (8%) находился в интервале от 11 до 15 см. При традиционном способе лечения гранулирующих ран применялись простые узловые швы (50,2%), швы на протекторах (12%), П-образные швы (10%), шов Донати-Парина (6,9%), способ В.С.Савельева и Б.Д.Савчука (7,8 %), лейкопластырное сближение краев раны (3,7%) и 8-образные швы (9,4%).
У 59 больных основной группы имелась гранулирующая рана, образующаяся после частичной эвентрации в гнойную рану (фиксированная), у 11 пациентов после нагноения лапаротомной раны с расхождением краев раны мышечно-апоневротического слоя. Одномоментное сближение с ушиванием раны применено у 48 (68,6%) пациентов. Разработанный съемный кожно-апоневротический шов применялся у 32 (45,7%) пациентов основной группы, у 38 (54,3%) больных использовался узловой шов. Дозированное сближение краев раны применено у 22 (31,4%) больных с обширными раневыми дефектами передней брюшной стенки (130,5±6,9 мм) с выраженным натяжением краев раневого дефекта. В процессе лечения применялась активная аспирация с помощью поролоновой дренажной системы, разработанное новое дренажное устройство. Противопоказанием к одномоментному аппаратному закрытию гранулирующих ран являлось наличие дерматита, мацерации кожи, гнойного воспаления мягких тканей в области проведения спиц, выраженное натяжение краев раневого дефекта (падение кожной температуры при сближении краев раны более чем на 0,50С, побледнение и блеск кожных покровов над спицей при сближении краев раны, болевые ощущения у пациента) (Бесчастнов В.В., 2003; Ботяков А.А., 2008).
С целью интраоперационной профилактики гнойно-воспалительных осложнений было разработано специальное устройство, способное компенсировать чрезмерное сдавление ретрактором краев операционной раны лопатками ранорасширителя (Патент на полезную модель №40163, 2004). Оно представляет собой пружинный механизм с указателем степени его сжатия на граудированной шкале. На рис. 2. представлен один из вариантов устройства, установленного на ранорасширителе М.З.Сигала- К.В.Кабанова (1959). При его использовании возникает необходимость оценки контроля силы, прилагаемой ретрактором при смещении краев операционной раны, что должна отражать соответствующая шкала.
С целью уменьшения повреждаемости сшиваемых тканей, улучшения адаптации краев раны и повышения прочности послеоперационного рубца разработан новый способ ушивания лапаротомной раны мышечно-апоневротического слоя с наложением непрерывного матрацного шва с различной шириной захвата и чередующими вколами [(Патент РФ №2261665,2005), рис.3]. Способ наложения непрерывного матрацного шва заключается в том, что на обеих сторонах операционной раны все вколы и выколы осуществляются попеременно в 10 и 20 мм от краев раны и в 10 мм между стежками шва, путем сквозного прошивания брюшины и мышечно-апоневротического слоя. Для профилактики послеоперационных эвентраций и грыж у больных со слабыми мышечно-апоневротическими листками применялся непрерывный шов с созданием дубликатуры белой линии живота [(патент РФ №2263472,2005), рис.4]. Разработан также новый съемный кожно- апоневротический шов для одномоментного ушивания релапаротомных и гранулирующих ран [(Патент РФ №2223048,2004), рис.5]. Предлагаемый способ заключается в том, что ушивание раны осуществляется сначала с использованием двойной лигатуры, а затем после разделения
 |  |
| Рис.2. Компенсирующее устройство, установленное на ретракторе М.З. Сигала- К.В.Кабанова | Рис.3. Непрерывный матрацный шов |
 |  |
| Рис.4. Непрерывный шов с образованием дубликатуры | Рис.5. Съемный кожно- апоневротический шов |
их на две- с применением одинарных лигатур. Для улучшения косметических характеристик послеоперационного кожного рубца разработан и применен новый атравматический хирургический шовный материал (варианты) (Патент на полезную модель № 62822, 2007).
С целью предупреждения прорезывания сшиваемых тканей при ушивании лапаротомной раны после релапаротомии, достижения тщательной адаптации и атравматичного равномерного сближения краев раны использовались в основной группе больных различные конструкции известных и разработанных нами новых СпАРК с перпендикулярным и параллельным проведением спиц через края раны.
Один из вариантов разработанных СпАРК с параллельным проведением спиц к краям раны содержит спицы с обеспечением регулируемого натяжения отжимными гайками, фиксаторы спиц выполнены в виде вилки с возможностью перемещения вокруг оси бранш (Патент РФ №2198605, 2003). Разработан аппарат для раскрытия и закрыти операционной раны с изогнутыми спицами [(Патент РФ №2238683,2004), рис.6] и СпАРК, где спицы выполнены с возможностью закрепления в фиксаторах спиц в несколько рядов параллельно браншам и с возможностью их перемещения в горизонтальном и вертикальном направлениях [(Патент РФ № 2322198, 2008г.) (рис. 7)]. Для лечения гнойных ран передней брюшной стенки в стадии регенерации применены также игольчатые аппараты. Одним из них является раноадаптационно-дистракционное устройство для лечения ран (Патент РФ №2257861, 2005).
 |  |
| Рис. 6. Общий вид аппарата для раскрытия и закрытия операционной раны с изогнутыми спицами | Рис.7. Многоступенчатый компрессионнодистракционный аппарат для коррекции краев раны |
В комплексном лечении гнойных релапаротомных ран и дренирования брюшной полости у 22 больных нами разработано и применено новое дренажное устройство [(Патент на полезную модель № 48480, 2005 г (рис. 8)].
 |
| Рис.8. Дренажное устройство. |
Для определения степени оксигенации крови в ушитой лапаротомной ране проводили прямую оксипульсометрию с помощью прибора пульсоксиметр ЭЛОКС-01М (Алукаев М.И., 2007), модифицированного на кафедре общей и неотложной хирургии Казанской государственной медицинской академии, при различных нагрузках ранорасширителя.
Аппаратная коррекция краев релапаротомной раны осуществлялась под контролем внутрибрюшного давления, которое контролировалось по изменению давления в дыхательных путях в конце вдоха, величина которого определялась в см. вод. ст. при помощи датчика аппарата для искусственной вентиляции легких (РО-6-03) (Андреев С.Д., Адамян А.А., 1991; Ороховский В.И. и соавт., 1992; Bloomfield G. et al., 1999; Tons C. et al., 2002).
Для контроля за течением раневого процесса использовалось ультразвуковое исследование (УЗИ) линии послеоперационного шва раны мышечно-апоневротического слоя передней брюшной стенки на ультразвуковом сканнере HDI-3500 фирмы “ATL” (США) и "PICKER LS -2400" (Германия).
Оценка клинической эффективности разработанных новых оперативно-инструментальных технологий для профилактики и лечения гнойно-воспалительных раневых осложнений в неотложной абдоминальной хирургии осуществлялась по следующим показателям: сроки (в днях) снятия швов (истинная продолжительность лечения) и пребывания больных в стационаре; количество и характер гнойно-воспалительных осложнений со стороны раны (отсутствие признаков пролежней под аппаратом в основной группе считали клинически значимым признаком); сроки стихания местных воспалительных признаков в области раны, отдаленные результаты лечения (наличие или отсутствие послеоперационных вентральных грыж). Косметический эффект оценивали по наличию поперечных борозд в области послеоперационного рубца после удаления швов, наличию пролежней в местах наложения спиц.
Для статистической обработки полученных данных использовались компьютерные программы Statistica и Exsel. Проверка нормальности распределения количественных признаков проводили с использованием критерия Колмогорова-Смирнова и критерия Пирсона 2. Для проверки равенства генеральных дисперсий использовали критериев Фишера и Кохрэна; критерий Стьюдента. При оценке качественных эффектов применялся точный метод Фишера (ТМФ). Критическое значение уровня значимости принималось равным 5% (р 0,05).
Результаты исследований и их обсуждение
Анатомо-экспериментальные исследования
Проведенные математические расчеты показали, что выполнение спиц в виде изогнутых хирургических игл 5/8 окружности обеспечивает глубокий и широкий захват тканей краев раны на ограниченном участке. Давление на ткани было меньше на 36,34% (в 2,8 раза) по сравнению с прямыми спицам, что позволяет снизить травматичность сопоставления краев раны и улучшить адаптацию раневых поверхностей при глубоких дефектах мягких тканей. Доказано, что увеличение числа пар изогнутых спиц, расположенных параллельно к браншам и с возможностью перемещения в горизонтальном и вертикальном направлениях, позволяет осуществлять тягу тканей на разных ступенях-уровнях, определяемых глубиной установки спиц. Увеличение числа спиц уменьшает касательное напряжение и, тем самым, снижает деформацию тканей в околораневой зоне.
Анализ результатов анатомо-экспериментальных исследований свидетельствовал о том, что во всех группах хорошие результаты получены при проведении спицы в косом направлении к поверхности кожи под углом, равным 30-40° (в среднем 35°). В этом случае спица находилась в мышечно-апоневротическом слое на расстоянии 10-15 мм от угла раны данного слоя. При меньшем значении угла наклонения вхождение спицы в апоневроз происходило далеко от угла раны, а при большем– за углом раны, что затрудняло проведение спицы в толще апоневроза, а также чрезмерно деформировало все слои раневого дефекта, в результате чего происходило излишнее сдавление тканей. Оптимальным расстоянием прохождения спиц через апоневроз являлось 10 и 15 мм от краев раны. При этом расстояние вкола на коже от края раны зависело от толщины передней брюшной стенки. При наложении съемного кожно-апоневротического шва проведение двойной нити через апоневроз и одинарных нитей в толще кожи снижает давление их на ткани в 2 раза, тем самым создаются благоприятные условия для адекватного кровоснабжения.
Результаты тензиометрического исследования влияния нового способа ушивания лапаротомной раны с наложением непрерывного матрацного шва на ранозаживление указывали на то, что уже на 3-й день в опытных ранах прочность рубца была больше в 1,5 (Р<0,01) и 1,3 раза (Р<0,01) по сравнению с узловыми и непрерывными швами соответственно. На 5-й день различие в пользу непрерывного матрацного шва сохранялось (Р<0,05). Так, разрыв рубца с применением непрерывного матрацного шва наблюдался при пневмопрессии 31,9±0,1 кПа, а с применением узловых и непрерывных швов соответственно 21,3±0,9 кПа и 26,9±0,7 кПа, что больше на 33,3 и 15,4 % (рис. 9).

Рис.9. Данные исследования прочности рубца методом пневмопрессии (кПа)
На 3-й день после ушивания раны мышечно-апоневротического слоя узловыми швами площадь клеточного инфильтрата составила 49,3±0,98%. В клеточном инфильтрате вокруг шовного материала преобладали сегментоядерные нейтрофилы (41,7±1,1%). Имелась выраженная лейкоцитарная инфильтрация и массивные участки некрозов вокруг шовного материала.
Характерной особенностью гистологической картины с применением узлового шва на 3-й день явилась высокая площадь "целлюлярных" фокусов некроза вокруг нитей шовного материала (10,5±0,3%) и полное отсутствие в формирующейся грануляционной ткани новообразованных сосудов. На 3-й день после ушивания лапаротомной раны мышечно-апоневротического слоя непрерывным швом площадь клеточного инфильтрата вокруг нитей шовного материала была идентична по сравнению с узловым швом (49,3±0,98 и 49,6±1,5%) соответственно (Р>0,05). Однако его состав существенно отличался тем, что сегментоядерные нейтрофилы были представлены в меньшем количестве и в среднем составляли 5,4±0,35%. В отличие от группы животных, где применялся узловой шов, площадь очагов некроза была достоверно меньше (Р< 0,001).
На 3-й день после после ушивания раны мышечно-апоневротического слоя предлагаемым непрерывным матрацным швом площадь клеточной инфильтрации, очагов клеточного некроза по сравнению с узловыми и непрерывным обвивными швами была значимо меньше. Площадь клеточного инфильтрата в группе животных с применением непрерывного шва была сопоставима с таковой в группе животных, которым лапаротомная рана ушивалась узловыми швами (45,8±1,7% и 44,5±1,2% соответственно, Р>0,05). Однако, инфильтрация тканей сегментоядерными нейтрофилами достоверно меньше (4,2±0,5% и 24,3±0,5%, Р<0,001), что указывало на меньшую выраженность фазы воспаления. Площадь очагов некроза составляла 1,6±0,1%. Среди клеточных элементов визуализировались беспорядочно расположенные коллагеновые волокна. В области шовного материала сохранялась лейкоцитарная инфильтрация.
На 5-й день после операции при ушивании узловыми швами сохранялись выраженные некрозы вокруг шовного материала, грануляционная ткань имела клеточно-волокнистый характер. На этих же сроках в препаратах раны с применением разработанного непрерывного матрацного шва площадь клеточной инфильтрации уменьшалась по сравнению с 3-им днем исследования и значимо отличалась от показателей при использовании непрерывного и узлового швов. Площадь новообразованных сосудов в опыте была больше, чем в менее зрелой грануляционной ткани других контрольных серий эксперимента. Грануляционная ткань выглядела волокнисто-клеточной, имела более зрелое строение по сравнению с контролем, с отсутствием нейтрофильной инфильтрации и интенсивным синтезом коллагена.
Таким образом, данные ранотензиометрического и гистоморфометрического исследования указывали на более благоприятное течение раневого процесса с применением непрерывного матрацного шва. Это проявлялось в меньшей травматичности и лучшем сопоставлении краев раны, сокращении сроков стихания процесса воспаления и ускорении образования соединительнотканного рубца. Очевидно, что сохранение кровотока в области тканей раны является одним из определяющих факторов полноценной регенерации в сшиваемых тканях.
Экспериментальные исследования, проведенные на различных моделях проблемных ран показали (рис.10), что при использовании СпАРК прочность сращения краев всех видов опытных ран (релапаротомных, гранулирующих) на разрыв существенно больше по сравнению с контрольными ранами, где для соединения их краев применялся традиционный способ. Так, на 5-й день после ушивания релапаротомной раны у животных опытной группы напряжение разрыва рубца составило в среднем 33,3±0,9 кПа, что было 1,5 раза выше (Р<0,01), чем у животных контрольной группы (22,4±0,6 кПа). На 3-й день после ушива- ния гранулирующих ран у животных опытной группы, где применялся аппаратный способ лечения, прочность рубца была в 1,6 раза выше (Р<0,01) по сравнению с традиционным способом ушивания.
По данным гистоморфометрических исследований релапаротомных ран также прослеживалось преимущество аппаратного способа лечения. Так, на 3-и

Рис. 10. Показатели прочности рубца при аппаратном и традиционном способах
ушивания различных моделей ран мягких тканей в эксперименте (кПа)
сутки в краях релапаротомной раны при традиционном способе ушивания отмечено широкое распространение воспалительной реакции далеко за пределы места наложения швов. Выявлен значительный отек и очаги лейкоцитарной инфильтрации вокруг стежков шва. Площадь воспалительного инфильтрата при этом составляла 56,1±1,3 %, при аппаратном–18,1±0,06% (р<0,001). Клеточный состав инфильтрата вокруг стежков при традиционном способе ушивания представлен преимущественно сегментоядерными нейтрофилами и составлял в среднем 49,7±1,4%, в то время как при аппаратном способе 7,5±0,4% (р<0,001). Площадь очагов некроза вокруг стежков шва при традиционном способе ушивания составляла в среднем 16,3±0,9%, и соответственно 6,7±0,6% при аппаратном (р<0,001). При традиционном способе ушивания очаги некроза были густо инфильтрированы сегментоядерными лейкоцитами с признаками кариопикноза и кариорексиса, что указывало на гнойный характер воспаления. Количество лимфоцитов, плазмоцитов и базофилов при обоих способах ушивания было сопоставимо.
На 5-е сутки после операции площадь клеточного инфильтрата незначительно уменьшалась при обоих способах ушивания, но различие между средними величинами сохранялось значимым: при традиционном- 45,4±2,4%, при аппаратном –14,5±1,8% (р<0,001). Площадь очагов некроза вокруг нитей шва при традиционном способе ушивания уменьшилась в 2 раза, а при аппаратном более чем в 4 раза (средние величины составляли соответственно 9,7±0,2% и 1,6±0,7% (р<0,001). В контрольной группе животных отмечены слабые признаки ангиогенеза. Так, площадь сосудов составляла 0,9±0,02%, в то время как в основной группе ангиогенез протекал более активно и площадь сосудов достоверно была выше по сравнению с контролем и в среднем составляла 4,9±0,1%. Количество сегментоядерных лейкоцитов достоверно снижалось при обоих способах ушивания по сравнению с 3-им днем исследования. Основную долю клеточного инфильтрата при аппаратном способе ушивания составляли лимфоциты и плазмоциты, что говорит о высоком уровне аутоиммунных процессов, протекающих в ране, в то время как при традиционном способе в клеточном инфильтрате преобладали сегментоядерные лейкоциты. Особенностью морфологической картины в краях раны вокруг стежков шва при аппаратном способе ушивания являлось отсутствие отека и наличие единичных лимфоцитарных инфильтратов. При этом отмечалось появление единичных нитей коллагена, чего не наблюдалось при традиционном способе.
Закономерным для традиционного способа ушивания “проблемных ран” как релапаротомных, так и гранулирующих являлось образование не только зоны первичного повреждения тканей в области шва за счет прорезывания их нитью (первичный некроз), но и обширных зон некроза, отека и кровоизлияния в месте затягивания узла (прямой некроз) и на отдаленных участках по линии наложения шва (непрямой сосудистый некроз) (рис.11). В канале образованном шовной нитью имелись некротические массы с лейкоцитами и микробами (рис.12). При аппаратном способе ушивания зона альтерации ограничивалась только диаметром нити- без дополнительного прорезывания ткани, в области канала нити и за её пределами отмечались менее выраженные травматические повреждения по сравнению с контрольной группой животных (рис.13). Шовный материал был контаминированным в 100% случаев у животных всех групп. Наиболее чаще обнаруживался S. epidermidis в монокультуре или ассоциациях с S. aureus и E.faecium. Общее микробное число в среднем составляло в опытной группе (3,4±0,8)·101 КОЕ/см шовной нити и (3,3±0,8)·101 КОЕ/см - в контрольной. Через 3-е сут после наложения швов количество микроорганизмов на шовном материале достоверно не увеличивалось и составляло в среднем (4,1±0,7)·101 КОЕ/см. В эти же сроки у животных контрольной группы имело
 |  |
| Рис.11. Микрофото области канала нити через 3-е сут после ушивания традиционным способом. Определяется прорезывание тканей нитью (1), их значительное смещение (2), обширная зона вторичного некроза вокруг шовного материала (3), отек и кровоизлияния (4). Окраска гематоксилин-эозином. Ув. Х40 | Рис. 12. Микрофото области канала нити через 3-е сут после ушивания традиционным способом. В канале нити, среди шовного материала, имеются некротические массы с лейкоцитами и микробами (1). Окраска гематоксилин-эозином. Ув. Х40 |
 | Рис. 13. Микрофото области канала нити через 3-е сут после аппаратного способа ушивания. Отсутствие прорезывания тканей нитью и их смещения, небольшая зона вторичного некроза вокруг шовного материала. В области канала нити отмечаются менее выраженные травматические повреждения по сравнению с контрольной группой животных (1). Окраска гематоксилин-эозином. Ув. Х40 |
место достоверное увеличение количества микроорганизмов до (3,5±0,6)·105 КОЕ/см. Причем увеличение бактериальной обсемененности шовного материала сопровождалось увеличением частоты обнаружения ассоциаций возбудителей на шовном материале в этой группе животных.
Таким образом, комбинация следующих патологических факторов: травматизация и ишемия паравульнарных тканей, наличие в ране девитализированной ткани, микробное обсеменение шовного материала играет решающую роль в развитии раневых осложнений. Проведенные комплексные экспериментальные исследования на различных моделях ран мягких тканей позволили нам установить, что сближение краев ран традиционным способом с помощью нити в условиях действия сил растяжения, затягивание швов приводит к закономерному образованию не только первичных очагов некроза в области швов, но и вторичных очагов некроза на отдаленных участках от шва, кровоизлияниям и уменьшению васкуляризации сшиваемых тканей. Наиболее выражены эти процессы при ушивании проблемных ран (релапаротомных, гранулирующих). Это является причиной понижения местной резистентности тканей к инфекции, их регенерационной способности, что создает неблагоприятные условия для течения раневого процесса и, тем самым, значительно повышает риск развития гнойно-воспалительных раневых осложнений даже в условиях низкой микробной контаминации раневой поверхности, когда число микробных тел не превышает критический уровень 105.
В отличие от традиционного способа ушивания закрытие ран с использованием АРК осуществляется без шовной нити, которая применяется в последующем только для удержания краев раневого дефекта в сведенном состоянии. Этим достигается анатомически точная реконструкция поврежденных тканей, минимальная их травматизация и уменьшение площади вторичного некроза, что повышает устойчивость местных тканей к микробной инвазии и снижает вероятность развития местных осложнений со стороны ран.
Клинические исследования
Интраоперационная аппаратная коррекция лапаротомной раны с использованием компенсирующего устройства проведена у 68 больных в комплексной профилактике послеоперационных раневых осложнений. Было установлено, что при адекватном хирургическом доступе и мышечной релаксации сила ретракции составляла 63,7±1,9Н. В условиях недостаточной миорелаксации, либо чрезмерного растяжения лапаротомной раны, пружина компенсирующего устройства обеспечивала некоторую амортизацию. Показания градуированной шкалы более 85,2Н свидетельствовали о значительном сдавлении тканей лопатками ретрактора в лапаротомной ране, что требовало уменьшения силы натяжения ранорасширителя.
У 11 больных разведение лапаротомной раны выполняли с компенсирующим устройством при силе ретракции от 85,2Н и свыше 107Н. Нагноение раны при этом произошло у 9 пациентов, у 2-х-диагностированы серомы. Гнойно-воспалительные осложнения отмечались в области ранее находившихся ретракторов и в нижнем углу раны. У остальных 57 больных, которым производилась аппаратная коррекция хирургического доступа, раны зажили первичным натяжением. Сила ретракции при этом варьировала от 49,9Н до 70,5Н. Измерения, производимые во время оперативного вмешательства показали, что при нагрузке на края раны лопатками ранорасширителя более 107Н происходило резкое снижение локальной пульсации и уровня О2 в периферической крови (рис.14).
Рис. 14. Показатели локальной пульсации и уровня О2 в крови краев ла-
паротомной раны при различных нагрузках ранорасширителя.
Гистологические исследования показали, что в случаях, когда при операциях длительностью более 2,5 часов использовался ранорасширитель без компенсирующего устройства, в тканях, взятых под лопатками расширителя, наблюдались признаки массивной деструкции в виде больших полей некроза. В клеточных инфильтратах преобладали лимфоциты, в глубжележащих отделах встречались кровеносные сосуды с облитерированным просветом и резким изменением интимы, а также сохранялись фокусы резкой лейкоцитарно- геморрагической инфильтрации с большим количеством нейтрофильных лейкоцитов. Мышечная ткань имела признаки интерстициального миозита и отёка волокон. Между миоцитами наблюдалась диффузная лимфоцитарная инфильтрация. Кроме того, отмечалось резкое полнокровие, выход форменных элементов за пределы сосудистого русла, периваскулярный отёк мышечно-апоневротического слоя передней брюшной стенки.
У больных, оперированных с использованием ранорасширителя с компенсирующим устройством, во всех случаях после удаления ретракторов наблюдалось отсутствие ишемии тканей (длительность операции более 2,5ч). Массивных фокусов некроза и разлитой воспалительной инфильтрации не выявлено. В клеточном составе преобладали лимфогистиоцитарные элементы. Нейтрофильные лейкоциты практически не встречались, как отсутствовали и крупные фокусы некроза. Наблюдался умеренный периваскулярный интерстициальный отёк мышечно-апоневротического слоя передней брюшной стенки. Отсутствовали признаки гранулематозного воспаления и разлитая воспалительная лейкоцитарная инфильтрация в мышечно–апоневротической ткани.
На основании проведенных клинико-анатомических и экспериментальных исследований установлено, что определенную роль в развитии гнойно-воспалительных осложнений послеоперационных ран играют степень повреждения и возникающие микроциркуляторные нарушения в момент длительного механического сдавления ретрактором. Воспалительная реакция в ране развивалась преимущественно в области нахождения ретрактора. Аппаратная коррекция хирургического доступа ретрактором М.З.Сигала-К.А.Кабанова, дополненным компенсирующим устройством, оказывает положительное влияние на репаративно-пролиферативный процесс, проявляющийся в отсутствии крупных очагов некроза в области избыточного сдавливания мягких тканей брюшной стенки при натяжении их лопатками.
Проведенные исследования у 334 больных контрольной группы, где для ушивания срединной лапаротомной раны использовались узловые и непрерывные обвивные швы, а края раны разводились ретрактором М.З. Сигала-В.К. Кабанова заживление раны без осложнения наблюдалось у 213 больных (63,8%). Гнойно-воспалительные послеоперационные осложнения ран имели место у 121 больного (36,2%). Серомы составили 9,9%, инфильтраты– 8,1%, лигатурные свищи–2,7%, нагноение ран– 13,5%, эвентрации–2,1%. У 38 пациентов имело место сочетание различных гнойно-воспалительных осложнений.
Использование непрерывного матрацного шва апоневроза срединной лапаротомной раны у 62 больных, оперированных с различными острыми хирургическими заболеваниями органов брюшной полости, позволило выявить следующие его преимущества: чередованием захвата тканей в шов различной по ширине достигается хорошая адаптация краев раны брюшины и мышечно-апоневротических слоев и достаточно надежная их фиксация; непрерывность шва с различной шириной захвата обеспечивает равномерное натяжение тканей с сохранением местного кровотока; происходит более точное анатомическое сопоставление тканей передней брюшной стенки; получение более герметичного и прочного шва позволяет полностью изолировать брюшную полость от подкожной жировой клетчатки.
Осложненное течение раневого процесса в виде серомы отмечено у 3(4,8%) больных, инфильтрат- у 2 (3,2) пациентов с ожирением I–II степени. У 2 (3,2%) оперированных с местным гнойным перитонитом в результате деструкции воспалённого органа на ограниченном участке наблюдалось нагноение раны. Послеоперационной эвентрации и грыж не выявлено. У контрольной группы больных нагноение раны выявлено у 35(15,2%) пациентов с применением узловых и у 10(8,1%)- с применением непрерывных обвивных швов. Причем у 7(2,1%) из них с узловыми швами произошла частичная эвентрация в гнойную рану.
По данным УЗИ лапаротомные раны, ушитые с использованием непрерывного матрацного шва, находились в более выгодных условиях, с точки зрения заживляемости, чем раны, ушитые узловыми и непрерывными обвивными швами. Это проявлялось в укорочении воспалительной фазы раневого процесса, в результате чего наблюдалось более раннее образование и созревание соединительно-тканного рубца (рис. 14). Так, на 5-й день после операции ширина гипоэхогенной зоны в основной группе больных была в 1,7 и 1,4 раза меньше по сравнению с больными, у которых для соединения краев раны мышечно-апоневротического слоя использовались узловые и непрерывные обвивные швы соответственно. Это свидетельствовало о том, что в контроле в процесс воспаления вовлекалось более широкая зона апоневроза белой линии живота, чем у пациентов основной группы. Уменьшение ширины гипоэхогенной зоны в области лапаротомной раны на 10-й день после операции, по сравнению с 5-м днем исследования, в основной группе происходило на 39,4%, а с применением узловых и непрерывных обвивных швов соответственно на 13,5% и 27,2%.
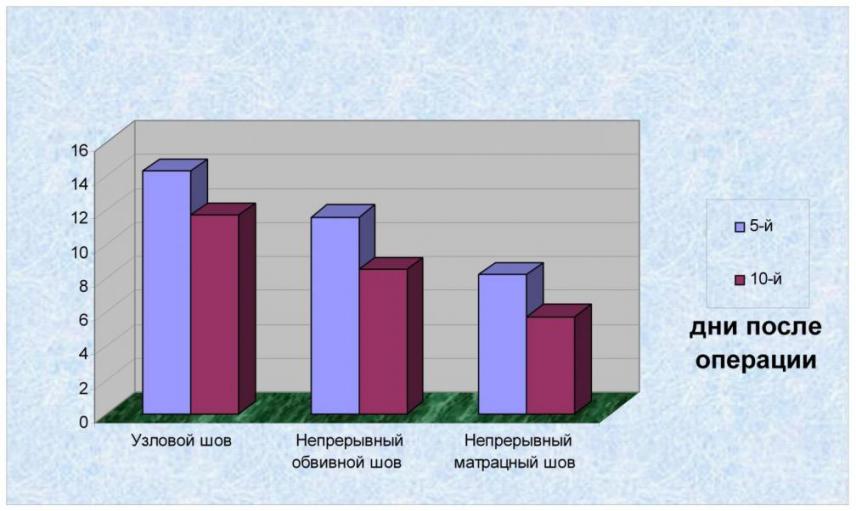
Рис. 14. Показатели УЗИ ширины гипоэхогенной зоны (мм) в области операционной
раны мышечно-апоневротического слоя, ушитой различными способами
Проведенные УЗИ передней брюшной стенки у больных с использованием непрерывного шва с созданием дубликатуры показали, что в первые сутки после операции на эхограммах определялось утолщение ткани в 1,4-1,8 раза. Между слоями сопоставленных участков апоневроза определялся гипоэхогенный слой, толщина которого изменялась в зависимости от сроков заживления раны. Так, толщина гипоэхогенной зоны на 3-и сут составляла 4,3±0,4 мм, на 5-е -3,4±0,3 мм, а на 7-е сут снижалась до 1,3±0,2 мм. На 10-е сут послеоперационного периода мышечно-апоневротический слой в области дубликатуры выглядел как однородная гиперэхогенная структура толщиной 4,8±0,4 мм и шириной 7,2±0,6 мм.
Изменение толщины гипоэхогенной зоны у больных с неосложненным течением раневого процесса было направлено в сторону уменьшения последней, появления участков с повышенной эхогенной структурой, либо сопровождалось переходом гипоэхогенной зоны в гиперэхогенную на 10-е сут послеоперационного периода в фазе регенерации. Увеличение толщины гипоэхогенной зоны через 5 сут после операции (более 4 мм) без тенденции к ее снижению в последующие дни послеоперационного периода позволяло предположить отклонение от нормального течения раневого процесса и свидетельствовало о высокой вероятности развития гнойно-воспалительных осложнений со стороны раны. Наличие данных УЗИ, свидетельствующих о воспалительном процессе в области дубликатуры апоневроза, имело место у 2 больных, которым произведена ревизия раны. Эвентрации и послеоперационной грыжи не наблюдалось. В табл.3 представлены сводные данные о частоте и характере послеоперационных гнойно-воспалительных осложнений со стороны лапаротомных ран у больных контрольной и основной группы.
Таблица 3
Частота и характер послеоперационных гнойно-воспалительных осложнений после лапаротомии у больных контрольной и основной группы
| Характер осложнения | Контрольная п=334 | Основная п=196 | ||||
| абс. | % | абс | % | |||
| Серома | 33 | 9,9 | 5 | 2,5 | ||
| Инфильтрат | 27 | 8,1 | 3 | 1,5 | ||
| Лигатурный свищ | 9 | 2,7 | - | - | ||
| Нагноение | 45 | 13,5 | 5 | 2,5 | ||
| Эвентрация | 7 | 2,1 | - | - | ||
| Итого | 121 | 36,2 | 13 | 6,5 | ||
Проведенное исследование показало, что к моменту выполнения релапаротомии у 364 (90%) больных послеоперационный шов был воспален и инфильтрирован. У 320 (80,2%) пациентов имело место нагноение с частичным некрозом краев раны.
Основной причиной повторного чревосечения являлись послеоперационный перитонит (48,9%), эвентрация (26,2%), кишечная непроходимость (12,6%), кровотечение (9,4%), и панкреатит (2,9 %). Наиболее часто релапаротомии наблюдались у пациентов с язвенной болезнью желудка и двенадцатиперстной кишки, осложненной кровотечением и перфорацией (25,8%), открытой и закрытой травмой живота (19,3%), острым аппендицитом (11,8%), раком ободочной кишки, осложненным кишечной непроходимостью (8,6%), острой спаечной кишечной непроходимостью (7,2 %).
Анализ традиционного способа ушивания операционной раны после релапаротомии показал, что существенным недостатком его является избыточное травмирование воспаленных, инфильтрированных и ригидных тканей в момент их стягивания. Применяемые для этого узловые, П- и 8-образные швы на протекторах, заметными преимуществами по сравнению с другими способами ушивания не обладали. Напротив, захватывание и пережатие больших участков тканей брюшной стенки, значительно ухудшало их кровоснабжение. После ушивания релапаротомной раны с помощью металлических опорных спиц на фоне гнойного воспаления у 7 пациентов из 15 наблюдалось прорезывание швов и частичное расхождение краев раны, что в 1 случае привело к развитию эвентрации. Развившиеся осложнения наступили вследствие выявленных недостатков данного способа: излишняя травматизация краев раны шовными нитями большего диаметра при их сближении в условиях повышенного внутрибрюшного давления; отсутствие надежной иммобилизации краев раны; технические трудности при разведении краев раны во время повторных операций.
После традиционного способа ушивания релапаротомной раны эвентрации возникли у 43 (16,7%) из 258 оперированных, а кишечные свищи- у 25(9,7%) пациентов. Условно-асептическая эвентрация наблюдалась у 12 (27,9%) больных, гнойная– у 31 (72,1%) пациента. Умерло 104 больных (40,3 %). Основной причиной летальности у 67 (64,4%) пациентов явилось полиорганная недостаточность, развившаяся в результате раневого (нагноение ран, эвентрация, кишечные свищи) и абдоминального сепсиа. У 15 (14,4%) больных имелась ТЭЛА и инфаркт миокарда. В послеоперационном периоде выявлено большое количество назокомиальных пневмоний 22 (21,2%) случая), связанных в первую очередь с сохраняющимся повышенным внутрибрюшным давлением, снижением легочной вентиляции и развитием отека легких. На этот факт обращается внимание и в литературе (Врублевский Н.М., 2008).
Разработанный аппаратный способ лечения применялся у 147 больных, из них СпАРК для одномоментного ушивания использован у 30 (20,4%) пациентов. В данной группе релапаротомные раны ушивались послойными узловыми швами у 16 больных. У 5 из них возникло нагноение раны, а у 3- прорезались кожные швы. Съемный кожно-апоневротический шов применялся у 14 больных. Нагноение наблюдалось в 1 случае и прорезывание швов кожи у 1 пациента. Эвентрация возникла в 2 случаях, кишечный свищ- у 2 пациентов. Недостатками одномоментного аппаратного способа ушивания раны являлось: отсутствие иммобилизации краев раны; излишнее давление шовных нитей на сшиваемые ткани после удаления аппарата, что и привело к нагноению послеоперационной раны у 6 (20%) больных.
У 117 (79,6%) больных различные варианты СпАРК оставались на ране после ушивания до образования прочного рубца. После аппаратного сопоставления краев раневого дефекта с оставлением СпАРК, послойными узловыми швами раны ушивались у 59 (40,1%) больных, разработанными съемными кожно-апоневротическими швами- у 58 (39,6%) пациентов из 147 больных. При послойном ушивании узловыми швами нагноение со стороны послеоперационной раны наблюдалось у 10 (16,6%) больных: в 5 случаях с применением СпАРК с перпендикулярным проведением спиц через края раны, в 3- СпАРК с параллельным проведением прямых спиц через края раны и в 2- СпАРК с параллельным проведением изогнутых спиц через края раны. При применении съемных швов нагноение раны выявлено у 3 (5,3%) больных (Р<0,05). Оставление аппаратов на ране позволяло без риска развития эвентрации проводить полную хирургическую обработку гнойного очага и раньше активизировать больных.
Результаты применения аппаратного способа лечения релапаротомных ран приведены в табл.4. Как видно из таблицы, из 147 больных основной группы умерло 29 (19,7%) человек. Причины летальности: полиорганная недостаточность, развившаяся в результате абдоминального сепсиса– 19 (65,5%) случаев, раневого- 3 (10,3%), пневмония– 3 (10,3%), ТЭЛА и инфаркт миокарда– 4 (13,8%) случаев. Снижение летальности в основной группе больных произошло за счет уменьшения как местных, так и общих послеоперационных осложнений. Этому способствовало декомпрессивное дозированное закрытие релапаротомной раны, осуществляемое под контролем внутрибрюшного давления, надежная иммобилизация краев раны до наложения швов и после ушивания раны. Применение аппаратной управляемой программированной релапаротомии в лечении больных с разлитым гнойным перитонитом сокращало время операции и упрощало технику проведения санационной релапаротомии, делая ее малоболезненной, менее травматичной и более совершенной.
Таблица 4
Ближайшие результаты комплексного лечения больных после релапаротомии с применением традиционного и аппаратного способа лечения раны
| Способ лечения | Всего | Умерло | Осложнения | |||
| Эвентрация | Рецидив эвентрации | Нагноение | Кишечный свищ | |||
| Традиционный | 258 | 104(40,3%) | 43(16,7%) | 17(6,6%) | 152(58,9%) | 25(9,7%) |
| Аппаратный | 147 | 29(19,7%) | 2(1,4%) | 2(1,4%) | 19(12,9%) | 3(2,04 %) |
Ультразвуковые исследования свидетельствовали, что на 5-й день после аппаратного способа ушивания раневого дефекта после релапаротомии ширина гипоэхогенной зоны в среднем равнялась 15,6±0,8 мм. На 10-й день происходило достоверное (Р<0,05) уменьшение ширины гипоэхогенной зоны до 10,9±0,3 мм и появлялись участки с повышенной эхогенной структурой. Полученные результаты совместно с клиническими признаками оценки течения раневого процесса использовались для определения показаний к удалению аппарата с раны. Так, средние сроки нахождения аппаратов на ране с момента их установки составили 15,2±1,6 сут, а с момента ушивания-12,8±1,4 сут.
При лечении гранулирующих ран одномоментное аппаратное сближение краев раны применялось у 48 пациентов основной группы. СпАРК с перпендикулярным проведением спиц через края раны использовался у 31 больного. При наличии выраженной подкожной клетчатки СпАРК с перпендикулярным проведением спиц через края раны применен у 9 пациентов. У 12 больных использовался СпАРК с перпендикулярным проведением спиц через края раны со съемными браншами, края которого выполнены закругленными, что предупреждало образование пролежней кожи при длительной репозиции краев раны. СпАРК с параллельным проведением спиц через края раны использовался у 17 пациентов.
Дозированное сопоставление краев раневого дефекта проводилось у 22 больных. У 6 пациентов после эвентрации гранулирующая рана сочеталась с тонкокишечными свищами. Средние сроки дозированного сопоставления краев раны брюшной стенки составили 8,1+1,2 сут. Прижимные пластины сдвигались постепенно, в течение 5-15 дней, с целью «привыкания» тканей к условиям натяжения, что исключало разрывы тканей, не нарушало локального кровообращения и не вызывало болей.
В процессе лечения применялась активная аспирация раневого экссудата и содержимого из брюшной полости с помощью поролоновой дренажной системы и предложенного нами дренажного устройства в комбинации с поролоном. Проведенные исследования показали, что за счет капиллярных трубок малого диаметра (d=3-5 мм) и отверстий на трубках со стороны рабочего конца дренажного устройства происходило адекватное поступление, даже небольшого количества воспалительной жидкости из раневого канала, что позволяло дренировать различные по сложности раневые поверхности. Для изменения формы дренажа подтягивали леску и сворачивали плоское дренажное устройство с образованием многотрубчатого желоба или многотрубчатого дренажного устройства. Использование разработанного дренажа у 22 больных основной группы позволило решить задачу эффективного дренирования, тем самым сократить время течения процесса воспаления и способствовать снижению числа послеоперационных осложнений.
Применение аппаратного способа лечения гранулирующих ран позволяло не дожидаясь плотного спаяния тканей, производить раннюю радикальную хирургическую обработку раневого дефекта с иссечением всех девитализированных тканей и удалением лигатур. Это способствовало в дальнейшем существенному сокращению первой фазы раневого процесса и раннему появлению грануляций (табл. 5).
Таблица 5
Динамика заживления гнойной лапаратомной раны при аппаратном и традиционном способах лечения
| Способ лечения | Сроки (дни) | |||
| Стихания признаков местного воспаления | Появления грануляций | Очищения | Пребывания в стационаре | |
| Традиционный n= 100 | 6,8±0,2 | 13,3 ± 1,2 | 15,2 ± 1,3 | 42,6 ± 5,4 |
| Аппаратный n = 70 | 4,6±0,1 | 4,6 ± 0,4 | 6,8 ± 0,4 | 31,4 ± 4,3 |
| Р | <0,01 | < 0,01 | < 0,01 | < 0,01 |
Установлено, что при аппаратном способе лечения количество микроорганизмов в тканях достоверно уменьшалось к 5-у дню с 108-9 до 102-3 КОЕ/г. При традиционном способе такое снижение наблюдалось лишь к 9-10– му дню с момента начала лечения.
Применение аппаратного способа лечения гранулирующих ран передней брюшной стенки позволило улучшить результаты комплексного лечения больных с данной патологией. Так, по сравнению с традиционным способом наложения швов использование аппаратного способа лечения гранулирующих ран мягких тканей с помощью СпАРК способствовало уменьшению количества послеоперационных гнойно-воспалительных раневых осложнений с 59 до 17,1% (р<0,05). При аппаратном способе лечения хорошие результаты получены у 60 (85,7%) больных, удовлетворительные – у 8 (11,4%), а неудовлетворительные у 2 (2,9%) пациентов, при традиционном способе соответственно у 39(39%) и 38(38%), неудовлетворительные – у 23 (23%) пациентов. Кроме того, в основной группе хороший косметический эффект отмечен у 60 больных (85,7%), а в контрольной – у 35 (35%). При этом средний срок пребывания больных в стационаре сократился на 11,2±1,4 дней.
ВЫВОДЫ
- Экспериментальными и клиническими исследованиями установлено, что одной из основных причин местных гнойно-воспалительных осложнений со стороны операционных ран передней брюшной стенки является образование вторичных прямых очагов некроза в области швов и непрямых сосудистых некрозов на отдаленных участках, находящихся на линии натяжения нити, что приводит к распространению общей площади вторичного некроза и, тем самым, снижает местную реактивность тканей к инфекции. На основе полученных данных разработаны основные принципы и способы их профилактики и лечения.
- На основании проведенных клинико-анатомических и экспериментальных исследований выявлено, что определенную роль в развитии послеоперационных раневых осложнений играют избыточное сдавление мягких тканей и возникающие микроциркуляторные изменения в результате длительного механического растяжения ретрактором. Разработанное компенсирующее устройство для аппаратной коррекции хирургического доступа позволяет достигнуть минимального повреждающего воздействия лопаток ранорасширителя на ткани путем динамичного интраоперационного контроля силы ретракции, что обеспечивает равномерное натяжение тканей без нарушения локального кровотока и уменьшает местную воспалительную реакцию.
- Разработанные способы ушивания срединных ран после лапаротомии с наложением непрерывного матрацного и непрерывного шва с образованием дубликатуры по сравнению с узловыми и непрерывными обвивными швами позволяют создать оптимальные условия для формирования рубца. Так, прочность рубца после операции с применением непрерывного матрацного шва соответственно больше в 1,5 и 1,2 раза по сравнению с узловыми и непрерывными обвивными швами.
- Разработанные новые технические средства и способы ушивания срединных ран после лапаротомии для профилактики гнойно-воспалительных раневых осложнений, включающие компенсирующее устройство для аппаратной коррекции хирургического доступа, непрерывный матрацный шов и непрерывный шов с дубликатурой, позволили улучшить результаты хирургического лечения больных основной группы с острыми заболеваниями органов брюшной полости за счет снижения частоты раневых осложнений с 36,3 до 6,5% и сократить сроки пребывания больных в стационаре.
- Разработанные спицевые абдоминальные раневые контракторы новой конструкции с различными вариантами расположения спиц обеспечивают надежную иммобилизацию краев раневого дефекта, равномерное распределение нагрузки на ткани и снижение напряжения в них за счет декомпрессивного дозированного закрытия релапаротомной раны, осуществляемое под контролем внутрибрюшного давления, что значительно уменьшает травматизацию до наложения швов и после ушивания раны и, тем самым, создает благоприятные условия для течения раневого процесса.
- Анатомо-экспериментальными исследованиями установлено, что при одинаковой толщине спиц давление на ткани в изогнутой спице меньше на 36,34% по сравнению с параллельной прямой. Выявлено, что независимо от варианта аппарата точность и атравматичность сопоставления слоев ткани раневого дефекта зависит от угла наклона спицы к поверхности кожи, толщины передней брюшной стенки, расстояния между спицами и расстояния от последних до краев раны. При применении съемного шва проведение двойной нити через апоневроз и одинарных нитей в толще кожи снижает давление их на ткани в 2 раза.
- Проведенные комплексные экспериментальные исследования на различных моделях хирургических ран мягких тканей позволили установить, что сближение краев ран традиционным способом с помощью нити приводит к закономерному во всех моделях раневого дефекта интраоперационному прорезыванию сшиваемых тканей, уменьшению их васкуляризации и образованию вторичных некрозов за пределами шовного канала. Так, на 5-й день после ушивания релапаротомной раны в основной группе (аппаратный способ) площадь клеточного инфильтрата вокруг стежка составила 14,5±1,8(%) против 45,4±2,4(%) в контроле (Р<0,001); площадь некрозов- 1,6±0,7(%) против 9,7±0,2 (%) (Р<0,001); инфильтрация сегментоядерными нейтрофилами- 4,2±0,06 (%) против 38,2±1,5 (%) (Р<0,001); площадь сосудов- 4,9±0,1(%) против 0,9±0,02 (%) (Р<0,001) соответственно.
- Внедрение разработанного аппаратного способа ушивания релапаротомной раны позволило улучшить результаты лечения этой категории больных. Так, по сравнению с традиционным способом ушивания гнойно-воспалительные раневые осложнения уменьшились с 58,9% до 12,9% (Р< 0,05), эвентрации с 16,7% до 1,4%, рецидивы эвентрации с 6,6% до 1,4% (Р< 0,05). Кишечные свищи наблюдались в 2,04 % случаев. Летальность снизилась с 40,3 до 19,7% (Р< 0,05).
- Применение аппаратного способа лечения гранулирующих ран передней брюшной стенки уменьшило количество послеоперационных гнойно-воспалительных раневых осложнений с 59 до 17,2% (р< 0,05). При аппаратном способе лечения хорошие результаты получены у 60 (85,7%) больных, удовлетворительные– у 8 (11,4%), а неудовлетворительные у 2 (2,9%) пациентов; при традиционном способе соответственно у 39(39%), 38 (38%), а неудовлетворительные– у 23 (23%) пациентов. При этом средний срок пребывания больных в стационаре сократился на 11,2 дня.
Практические рекомендации
- Для улучшения заживления срединных лапаротомных ран после различных оперативных вмешательств в клинической практике целесообразно применять непрерывный матрацный шов с различной шириной захвата тканей.
- У пациентов с высоким риском возникновения послеоперационных вентральных грыж (пожилой и старческий возраст больных, слабость мышечно- апоневротического слоя) следует шире использовать способ ушивания срединной лапаротомной раны с помощью непрерывного шва с созданием дубликатуры белой линии живота.
- С целью снижения травмирования тканей краев операционной раны после срединной лапаротомии ретракторами ранорасширителя целесообразно применять разработанное компенсирующее устройство. При этом сила ретракции при адекватном хирургическом доступе и мышечной релаксации не должна превышать 63 Н.
- Для улучшения заживления ран после релапаротомии и гранулирующих ран передней брюшной стенки необходимо при соединении краев раневого дефекта использовать разработанные спицевые абдоминальные раневые контракторы с параллельным проведением спиц через края раны.
- При толщине брюшной стенки менее 50 мм следует использовать аппарат с прямыми параллельными спицами. Последние необходимо проводить в косом направлении к поверхности кожи под углом 30-40° и на расстоянии 10-15 мм от угла раны.
- При толщине брюшной стенки более 50 мм показано применение аппарата с изогнутыми спицами. При воспаленных и ригидных краях операционной раны после релапаротомии целесообразно использовать аппарат с разноступенчатыми двойными и более спицами для уменьшения травматизации кожи в местах вкола и выкола спиц. Проведении аппаратных многократных программированных санаций и ревизий органов брюшной полости при разлитом гнойном перитоните необходимо осуществлять под контролем внутрибрюшного давления.
- Сроки нахождения аппарата на операционной ране после релапаротомии определяются данными ультразвукового метода исследования, которые необходимо проводить на 5-е и 10-е сут после операции. Критериями неосложненного течения раневого процесса в ушитой ране являются уменьшение в динамике ширины гипоэхогенной зоны в области мышечно-апоневротического слоя и появления участков с повышенной эхогенной структурой.
- Для повышения надежности, прочности рубца и снижения раневых осложнений для ушивания раны после релапаротомии следует применять съемный кожно-апоневротический шов. Швы удаляются в среднем на 15-й день после операции под динамическим ультразвуковым контролем заживления раны.
- Для улучшения косметических характеристик рубца, особенно у пациентов со склонностью развития келоидных рубцов, целесообразно применять разработанный внутрикожный шов.
10. Для повышения эффективности дренирования гнойных ран и брюшной полос- ти следует применять разработанное дренажное устройство.
Список работ, опубликованных по теме диссертации
- Измайлов С.Г. Прецизионный шов брюшной стенки с использованием раноадаптора /С.Г. Измайлов, В.Н. Гараев В.М. Лазарев, М.Ю. Кедрин //Вопросы оперативной микрохирургии и микрохирургической анатомии. Материалы Российской научной конференции.- Оренбург, 1997.- С.14-14
- Измайлов С.Г. Аппаратный способ лечения эвентрации в гнойную рану /С.Г.Измайлов, В.Н. Гараев //Казанский медицинский журнал.- 1997.-№5.- С.344-349.
- Измайлов С.Г. Новый способ внеочагового закрытия хирургических ран /С.Г.Измайлов, В.Н. Гараев //Всероссийский съезд травматологов и ортопедов, 6-й; Материалы.- Н.Новгород, 1997.-С.900.
- Гараев В.Н. Топографо-анатомическое обоснование применения спицевого адаптационно-репозиционного аппарата для сближения краев раны /В.Н. Гараев //Актуальные вопросы хирургии. Тезисы докладов дорожной конференции хирургов Горьковской железной дороги.- Н.Новгород,1998.-С.24.
- Измайлов С.Г. Профилактика эвентрации после релапаротомии /С.Г.Измайлов, В.Н. Гараев, А.А. Бодров //Актуальные вопросы диагностики и лечения. Выпуск-2. Материалы клинико-экспериментальных исследований.- Казань: Изд-во «Матбугат йорты».-1998.-С.59.
- Измайлов С.Г. Ранокорректор /С.Г. Измайлов, В.Н. Гараев, В.В. Бесчастнов //Нижегородский медицинский журнал.- 1999.-№1.С.47-48.
- Измайлов С.Г. Адаптационно-репозиционные технические средства в сочетании с биоактивным фармокологическим препаратом ксимедон для стимуляции заживления ран /С.Г. Измайлов, Г.А.Измайлов, В.С. Резник, В.Н.Гараев и др. //Медицинская техника, 1999.-№2.- С. 16-21.
- Измайлов С.Г. Ускорение заживления ран под действием препарата пиримидинового ряда ксимедона /С.Г. Измайлов, Г.А. Измайлов, В.Н. Гараев, И.В. Подушкина и др. //Казанский медицинский журнал.- 2000.- №5. - С.422-426.
- Измайлов С.Г. Новые технологии в ушивании ран /С.Г. Измайлов, Г.А. Измайлов, В.Н. Гараев, А.А. Бодров, В.В. Бесчастнов //Казанский медицинский журнал.- 2001.- №1. – С.67-71.
- Измайлов С.Г. Профилактика и лечение эвентраций после релапаротомии /С.Г. Измайлов, Г.А. Измайлов, М.Ю. Аверьянов, В.Н. Гараев и др. //Хирургия.- 2001.-№12. – С.14-18.
- Гараев В.Н. Профилактика раневых осложнений после релапаротомии /В.Н. Гараев, С.Г.Измайлов, И.С. Малков и др. //Актуальные вопросы абдоминальной хирургии. Научная конференция. Тезисы докладов. Материалы конференции, посвященной 70-летию профессора О.С.Кочнева.-Казань, 2002.- С.12-14.
- Гараев В.Н. Способ ушивания лапаротомной раны после релапаротомии /В.Н. Гараев, С.Г. Измайлов, И.С. Малков и др. //Актуальные вопросы абдоминальной хирургии. Научная конференция. Тезисы докладов. Материалы конференции, посвященной 70- летию профессора О.С.Кочнева.- Казань, 2002.- С. 15-17.
- Измайлов Г.А. Эффективность применения отечественного препарата ксимедона в хирургической практике /Г.А. Измайлов, С.Г. Измайлов, В.Н. Гараев и др. //Антибиотики и химиотерапия. –2002.- №12.Т47.- С. 20-26.
- Измайлов С.Г. Профилактика эвентраций после релапаротомии /С.Г.Измайлов, М.Г. Рябков, Г.А. Измайлов, В.Н. Гараев и др. //Новые технологии в диагностике и лечении хирургической инфекции на основе доказательной медицины. VI Всероссийская конференция с международным участием «Раны и раневая инфекция».- Москва,2003.-С.51-53.
- Измайлов С.Г. Применение адаптационно- репозиционных аппаратов для профилактики раневых осложнений у больных с острой кишечной непроходимостью /С.Г. Измайлов, В.Н. Гараев, А.А.Бодров и др. //Актуальные проблемы современной хирургии. Труды международного хирургического конгресса.-Москва, 2003. - С.9.
- Измайлов С.Г. Профилактика и лечение эвентраций после релапаротомии /С.Г. Измайлов, Г.А.Измайлов, В.Н. Гараев и др. //Актуальные проблемы современной хирургии. Труды международного хирургического конгресса. -Москва, - 2003. - С.9.
- Гараев В.Н. Профилактика и хирургическое лечение кишечных свишей при эвентрации в гнойную рану /В.Н. Гараев, И.С.Малков, Х.М. Халилов и др. //Современные проблемы развития регионального здравоохранения. Сборник научных трудов, посвященных 50-летию РКБ МЗ РТ. -Казань, 2003. - С.306.
- Гараев В.Н. Профилактика послеоперационных эвентраций при нагноении раны /В.Н. Гараев, И.С.Малков, М.И. Шакиров и др. //Современные проблемы развития регионального здравоохранения. Сборник научных трудов, посвященный 50-летию РКБ МЗ РТ.-Казань, 2003.-С.306.
- Малков И.С. Прогнозирование, профилактика и лечение гнойно-воспалительных осложнений в абдоминальной хирургии /И.С. Малков, М.И. Шакиров, В.Н. Гараев //Современные проблемы развития регионального здравоохранения. Сборник научных трудов, посвященный 50-летию РКБ МЗ РТ. -Казань, 2003. - С.349-350.
- Гараев В.Н. Применений новых технологий в лечении послеоперационных эвентраций /В.Н. Гараев, С.Г. Измайлов //Нижегородский медицинский журнал.- 2003. №2. - С.83-88.
- Измайлов С.Г. Профилактика эвентраций после релапаротомии /С.Г.Измайлов, В.Н. Гараев, М.Г. Рябков и др. //Новые технологии в диагностике и лечении хирургической инфекции на основе доказательной медицины. VI Всероссийская конференция с международным участием «Раны и раневая инфекция».- Москва, 2003.-С.51-53.
- Измайлов С.Г. Экспериментально-клиническое обоснование аппаратного способа лечения послеоперационных эвентраций /С.Г. Измайлов, В.Н. Гараев //Хирургия.- 2004.- №2. – С.23-27.
- Измайлов С.Г. Использование аппаратного способа лечения послеоперационных вентральных грыж с интераоперационным контролем внутрибрюшного давления /С.Г. Измайлов, В.М. Лазарев, В.Н. Гараев и др. //Тезисы сетевой конференции хирургов. - Муром, 2004. - С.120-124.
- Измайлов С.Г. Результаты послеоперационного ультразвукового сканирования раны у пациентов с вентральными грыжами /С.Г.Измайлов, М.Г.Рябков, В.Н. Гараев и др. //Тезисы сетевой конференции хирургов.- Муром, 2004.-С.124-126.
- Измайлов С.Г. Экспериментально-клиническое обоснование лечения гранулирующих ран мягких тканей с помощью устройства для сближения их краев /С.Г.Измайлов, В.В.Бесчастнов, В.Н. Гараев и др. //Вестник хирургии. – 2005. - №5.– С.74-77.
- Измайлов С.Г. Лечение послеоперационных вентральных грыж аппаратным способом под контролем внутрибрюшинного давления /С.Г.Измайлов, Ю.С. Задоян, В.Н. Гараев и др. //Периодическое издание: «Вестник герниологии» (сборник научных статей).-Москва, 2004.-С.52-59.
- Измайлов С.Г. Опыт лечения послеоперационных вентральных грыж с применением аппаратной техники и аутоаллопластического материала /С.Г.Измайлов, Ю.С. Задоян, В.Н. Гараев и др. //Актуальные вопросы герниологии: Тезисы докладов III Международной конф.- Москва, 2004.- Герниология.- 2004.- № 3.-С. 23-24.
- Измайлов С.Г. Ультразвуковое исследование течения раневого процесса при различных методах герниопластики /С.Г.Измайлов, Ю.С. Задоян, В.Н. Гараев и др. //Актуальные вопросы герниологии: Тезисы докладов III Международной конф.- Москва, 2004.- Герниология.- 2004.- № 3.-С. 21-22.
- Измайлов С.Г. Новые технологии в ушивании лапаротомных ран после релапаротомии /С.Г. Измайлов, В.Н. Гараев, М.Г Рябков и др. //Новые технологии в хирургии. Международный хирургический конгресс. Труды конгресса.-Ростов-на Дону, 2005. - С.123-124.
- Измайлов С.Г. Новые направления в хирургических технологиях лечения ран мягких тканей /С.Г. Измайлов, В.В. Бесчастнов, В.Н. Гараев и др. //Вестник Российской Академии медицинских наук.-2005.-№10.-С.25-30.
- Гараев В.Н. Усовершенствование метода ушивания срединных лапаротомных ран в профилактике послеоперационных эвентраций /В.Н. Гараев, М.И. Шакиров //Актуальные вопросы хирургии. Сборник научно–практических работ, посвященный 90-летию кафедры общей хирургии РостГМУ. Ростов-на Дону, 2006.- С.370-379.
- Гараев В.Н. Пути повышения эффективности ушивания лапаротомных ран в профилактике инфекционных осложнений /В.Н. Гараев, М.И. Шакиров //Актуальные вопросы хирургии. Сборник научно–практических работ, посвященный 90-летию кафедры общей хирургии РостГМУ. -Ростов-на Дону, 2006.- С.174-176.
- Малков И.С. Коррекция операционного доступа в профилактике местных гнойно-воспалительных осложнений /И.С. Малков, В.Н. Гараев и др. //Сборник научно –практических работ, посвященный 90-летию кафедры общей хирургии РостГМУ. -Ростов-на Дону, 2006. - С.197-200.
- Малков И.С. Интраоперационная профилактика раневых гнойно-воспалительных осложнений /И.С. Малков, М.И. Шакиров, В.Н. Гараев и др. //Казанский медицинский журнал.–2006. - №2. – С.108-111.
- Бесчастнов В.В. Использование дозированной аппаратной дерматотензии для закрытия обширных дефектов мягких тканей /В.В. Бесчастнов, В.Н.Гараев, Е.С. Одинцов //Сборник материалов- VI Всеармейская международная конференция «Инфекции в хирургии мирного и военного времени.-Москва, 2006.- С.30.
- Измайлов С.Г. Управляемая лапаростомия в лечении разлитого посттравматического и послеоперационного перитонита /С.Г.Измайлов, М.Г. Рябков, В.Н. Гараев и др.//Сборник материалов-VI Всеармейская международная конференция «Инфекции в хирургии мирного и военного времени».-Москва,2006.–С.30.
- Гараев В.Н. Многоступенчатое компрессионно-дистракционное устройство для коррекции краев операционной раны /В.Н. Гараев //Актуальные вопросы хирургии. Материалы научной конференции, посвященной 75-летию профессора О.С.Кочнева. Тезисы докладов.- Казань, 2007.- С.26-29.
- Гараев В.Н. Аппаратный способ лечения эвентраций в гнойную рану /В.Н. Гараев, С.Г. Измайлов, И.С. Малков и др. //Материалы I (VI) съезда РОПРЭХ. Анналы пластической, реконструктивной и эстетической хирургии.-Москва,2008.-С. 46-47.
- Малков И.С. Устройство для профилактики и лечения гнойно-воспалительных осложнений в хирургии /И.С.Малков, В.Н. Гараев, А.М. Зайнутдинов и др. //Материалы I (VI) съезда РОПРЭХ. Анналы пластической, реконструктивной и эстетической хирургии.-Москва,2008.-С. 90.
- Измайлов С.Г. Оптимизация техники наложения кожного шва /С.Г. Измайлов, В.Н. Гараев, В.Н. Гречко, М.Ю. Кедрин //Учебное пособие.-Н.Новгород, 1998.-49с.
- Измайлов С.Г. Послеоперационные эвентрации /С.Г.Измайлов, В.Н. Гараев, М.Ю. Аверьянов //Учебно- методическое пособие для хирургов.- Н.Новгород, Изд-во Нижегородской госуд. Мед. академии, 1999.–44с.
- Измайлов С.Г. Аппаратный способ лечения послеоперационных эвентраций /С.Г.Измайлов, В.Н. Гараев //Монография. Н.Новгород- Казань: Изд-во «Печатные технологии», 2004. – 145с.
- Измайлов С.Г. Техника наложения мягких повязок /С.Г. Измайлов, Г.А. Измайлов, В.Н. Гараев и др. //Учебное пособие. Рекомендовано УМО по медицинскому и фармацевтическому образованию ВУЗов России, Н.Новгород – Казань: Изд-во Казан. гос. техн. ун-та,.2004. – 84 с.
- Измайлов С.Г. Способы ушивания ран /С.Г. Измайлов, В.В.Бесчастнов, А.И. Ротков, А.А. Бодров, В.Н. Гараев и др. //Учебное пособие. Рекомендовано УМО по медицинскому и фармацевтическому образованию ВУЗов России.-Нижний Новгород: Изд-во «Нижегородская ярмарка», 2005. – 96с.
- Биряльцев В.Н. Торакоабдоминальные ранения. /В.Н.Коробков, Х.М.Халилов, В.Н. Гараев и др. // Казань.- Изд-во ООО «Тайц», 2007.- 90 с.
Патенты
- Измайлов С.Г. Устройство для сближения краев раны /С.Г. Измайлов, Г.А. Измайлов, В.Н. Гараев и др. //Патент на изобретение № 2123299, опубликовано: 20.12.98. Бюл. №35.
- Измайлов С.Г. Ранокорректор /С.Г. Измайлов, Г.А. Измайлов, Е.Е. Дятлов, В.Н. Гараев и др. //Патент на изобретение № 2133106, опубликовано: 20.07.99. Бюл.№20.
- Измайлов С.Г. Раневой контрактор /С.Г. Измайлов, Г.А. Измайлов, Е.Е. Дятлов, В.Н. Гараев и др. //Патент на изобретение № 2153297, опубликовано: 27.07.2000. Бюл. №21.
- Измайлов С.Г. Устройство для сближение краев раны /С.Г. Измайлов, Г.А. Измайлов, Е.Е. Дятлов, В.Н. Гараев и др. //Патент на изобретение № 2153298, опубликовано: 27.07.2000. Бюл. №21.
- Измайлов С.Г. Способ лечения ран пишеварительного тракта /С.Г. Измайлов, Г.А. Измайлов, М.Ю. Кедрин, В.С. Резник, М.Х. Герасимова, Р.Ш. Шаймарданов, М.А. Купкенов, В.Н. Гараев и др. //Патент на изобретение № 2159616. опубликовано: 27.11.2000. Бюл.№33.
- Измайлов С.Г. Устройство для сведения краев лапаротомной раны /С.Г. Измайлов, А.Н. Борисов, В.П. Малков, В.Н. Гараев и др. //Патент на изобретение № 2198605, опубликовано: 20.02.2003. Бюл.№5.
- Малков И.С. Компенсаторное устройство /И.С. Малков, М.И. Шакиров, В.Н Гараев и др. //Патент на полезную модель № 40163 от 12 апреля 2004. Зарегистрирован в Государственном реестре полезных моделей Российской Федерации г. Москва, 10.09.2004 г.
- Гараев В.Н. Способ ушивания лапаротомной раны /В.Н. Гараев, М.И. Шакиров, С.Г. Измайлов и др. //Патент на изобретение № 2223048 от 04.06.02. Зарегистрирован в Государственном реестре изобретений Российской Федерации г. Москва, 10.02.2004 г.
- Гараев В.Н. Способ ушивания лапаротомной раны /В.Н. Гараев, Р.Ш. Шаймарданов И.С. Малков, С.Г. Измайлов, М.Р. Тагиров, М.И. Шакиров и др. //Патент на изобретение № 2261665, опубликовано: 10.10.2005. Бюл. № 28.
- Гараев В.Н. Способ ушивания лапаротомной раны с созданием дубликатуры /В.Н. Гараев, М.И. Шакиров, И.С. Малков, С.Г. Измайлов и др. //Патент на изобретение № 2263472, опубликовано: 10.11.2005. Бюл. № 31.
- Гараев В.Н. Инструмент для закрытия и раскрытия операционной раны /В.Н. Гараев, М.И. Шакиров, С.Г. Измайлов и др. //Патент на изобретение № 2238683, опубликовано: 10.11.2005. Бюл.№ 31.
- Зайнутдинов А.М. Дренажное устройство /А.М. Зайнутдинов, И.С. Малков, М.И. Шакиров, Р.Ш. Шаймарданов, Х.М. Халилов, В.Н. Гараев и др. //Патент на полезной модели №48480, опубликовано: 27.102005 Бюл.№30.
- Измайлов С.Г. Раноадаптационно- дистракционное устройство для лечения ран /С.Г. Измайлов, Г.А. Измайлов, М.Н.Киселев, С.В. Осмоловский, А.Г. Измайлов, В.В. Бесчастнов, В.Н. Гараев //Патент на изобретение №2257861, опубликовано: 10.08.2005. Бюль.№22.
- Гараев В.Н. Многоступенчатое компрессионно-дистракционное устройство для коррекции краев лапаротомной раны /В.Н. Гараев, С.Г. Измайлов, М.И Шакиров, Л.В. Скурлатова, А.В. Бердников //Патента на изобретение № 2322198 опубликовано: 20.04.2008. Бюл. №11.
- Гараев В.Н. Атравматический хирургический шовный материал (варианты) /В.Н. Гараев, С.Г. Измайлов, М.И. Шакиров, Л.В. Скурлатова, А.В. Бердников //Патента на полезную модель № 62822, опубликовано: 10.05.2007. Бюл. №13.



