Клинико-иммунологическая характеристика больных в отдаленные сроки после коронарного шунтирования
На правах рукописи
ХЛОПИНА
Инна Анатольевна
КЛИНИКО-ИММУНОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА БОЛЬНЫХ В ОТДАЛЕННЫЕ СРОКИ ПОСЛЕ КОРОНАРНОГО ШУНТИРОВАНИЯ
14.00.05 – внутренние болезни
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Архангельск
2008
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Северный государственный медицинский университет (г. Архангельск)» Федерального агентства по здравоохранению и социальному развитию Российской Федерации на кафедре поликлинической терапии
Научный руководитель:
доктор медицинских наук, профессор Елена Николаевна Шацова
Официальные оппоненты:
доктор медицинских наук, профессор Сергей Иванович Мартюшов
доктор медицинских наук, профессор Борис Федорович Немцов
Ведущая организация:
ГОУ ВПО «Санкт-Петербургский государственный медицинский университет им. И.П. Павлова» Федерального агентства по здравоохранению и социальному развитию Российской Федерации
Защита диссертации состоится «____» _____________ 2008г. в ____ часов на заседании совета по защите докторских и кандидатских диссертаций Д 208.004.02 при Северном государственном медицинском университете по адресу: 16300, г. Архангельск, пр. Троицкий, 51.
С диссертацией можно ознакомиться в научной библиотеке Северного государственного медицинского университета.
Автореферат разослан «____» ______________ 2008г.
Ученый секретарь совета по защите
докторских и кандидатских диссертаций,
доктор медицинских наук, профессор Л.В. Титова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Первая операция коронарного шунтирования (КШ) в г. Архангельске была произведена по экстренным показаниям и с хорошим результатом врачами А.Н. Шонбиным и И.И. Черновым 4 марта 1993 года. С 1993 по 2006 год было выполнено 1523 операции КШ (Волосевич Е.Е. и др., 2006). Группе врачей больницы, принимавшей непосредственное участие в разработке и внедрении метода КШ в практику в г. Архангельске (И.И. Чернов, А.Н. Шонбин, С.А. Заволожин, Л.Э. Недашковский, А.Ю. Вальков, В.В. Бородин) было присвоено в 1995 году звание Лауреатов Ломоносовского фонда. Развитие сердечно-сосудистой хирургии в г. Архангельске существенно оптимизировало уровень оказания диагностической и лечебной помощи кардиологическим больным во всем регионе (Латухина С.А. и др., 2006).
Значительный опыт кардиохирургического лечения ишемической болезни сердца (ИБС) показал, что причинами неэффективности прямой реваскуляризации миокарда могут быть нарушение проходимости шунтов и неполная реваскуляризация миокарда в течение 1-го года после КШ, а в более отдаленные сроки прогрессирование атеросклеротических изменений в коронарных артериях (Жбанов И.В. и др., 2000). Если у больных ИБС, получающих консервативное лечение, динамика коронаросклероза в целом коррелировала с наличием комплекса традиционных факторов риска: гиперлипидемии (ГЛП), ожирения, артериальной гипертонии (АГ), сахарного диабета (СД) и курения (Какулия М.Ш., 2001), то у больных после паллиативной операции КШ прежде всего с нарушениями липидного профиля (Шишло Л.П. и др., 2000; Harris M. et al., 2004), факторами тромбоцитарного гемостаза (Kulik A., 2005) и показателями иммунологической реактивности (McLachlan C.S., 2005).
Современное понимание патогенеза атеросклероза выдвигает на первое место роль иммунного воспаления, подобного реакции гиперчувствительности замедленного типа (Павликова Е.П. и др., 2003; Гитель Е.П. и др., 2006; Libby P. et al, 2002; Adler A. et al, 2003; Misia-Stek K. et al, 2003).
В серии работ О.А. Миролюбовой с соавт. (2000, 2002), выполненных на группе больных, оперированных в кардиохирургическом центре г. Архангельска с 1998 по 2002 год в условиях искусственного кровообращения (ИК), показано, что при ИБС происходят достоверные существенные сдвиги большинства показателей иммунной системы организма человека, особенно в ближайшее время после КШ. Эти данные не противоречили наблюдениям многих исследователей как в России (Палеев Н.Р. и др., 2001; Инарокова А.М. и др., 2003; Павликова Е.П. и др., 2003), так и за рубежом (Heinisch R.H. et al, 2001; Agnoletti L. et al, 2004; Blacher C. et al, 2005).
Однако результаты динамического наблюдения за состоянием иммунной системы больных ИБС в отдаленные сроки после КШ остаются дискутабельными. Хотя изменения иммунологического статуса, возможно, могут быть одной из характеристик прогрессирования реакций хронического иммунного воспаления, лежащих в основе развития коронаросклероза.
Цель исследования: провести комплексное клиническое обследование больных ишемической болезнью сердца с углубленной оценкой функционального состояния миокарда и иммунной реактивности через 1–3 года после коронарного шунтирования для прогнозирования течения коронарной недостаточности и совершенствования реабилитационных мероприятий.
Задачи исследования:
- Изучить динамику коронарного синдрома и синдрома сердечной недостаточности у больных, прошедших комплексную амбулаторно-поликлиническую реабилитацию, в течение 3-х лет после коронарного шунтирования.
- Оценить факторы риска возможного прогрессирования атеросклероза, в том числе состояние липидного обмена у больных группы наблюдения.
- Установить варианты ремоделирования миокарда у оперированных больных на протяжении периода наблюдения.
- Провести анализ состояния иммунной реактивности больных, в том числе клеточного, гуморального звеньев иммунитета, показателей их кооперации, факторов неспецифической защиты в зависимости от срока и объема операции и традиционных факторов риска прогрессирования атеросклероза.
Научная новизна исследования. Впервые в Северном регионе России показано, что непрерывное иммунное воспаление при хроническом течении ИБС у больных через 2–5 лет после КШ сопровождается иммунным ответом с интерлейкин-2 (ИЛ-2) вариантом активизации лимфоцитов без возрастания уровня проявления реакций апоптоза иммунокомпетентных клеток. Выявлена не только положительная связь содержания цитокина фактора некроза опухолей (TNF-) с индексом массы тела (ИМТ), но и отрицательная корреляция с уровнем холестерина липопротенов высокой плотности (ХС ЛПВП), что указывает на возможное участие ЛПВП в регуляции иммунного ответа. Показано, что соотношения маркеров активизации иммунного воспаления и апоптоза как фактора его сдерживающего, т.е. уровни индексов CD25/CD95 и HLADR/CD95 выше у больных в отдаленном послеоперационном периоде по сравнению с практически здоровыми лицами и отражают хроническое течение коронарного атеросклероза.
Впервые в отдаленные сроки после КШ в условиях искусственного кровообращения (ИК) прослежена динамика функционального состояния миокарда. У больных с дооперационным инфарктом миокарда (ИМ), рецидивирующей стенокардией и признаками I–II функционального класса (ФК) хронической сердечной недостаточности (ХСН) (по классификации NYNA) формировались адаптивные варианты ремоделирования миокарда через 2 года после КШ.
Практическая значимость работы. Если рецидив нестабильной стенокардии у больных в первый год после КШ обусловлен непроходимостью шунтов в большинстве случаев, то рецидив через 1 год свидетельствует о преимущественном стенозировании коронарных сосудов вследствие прогрессирования атеросклероза.
При ведении и лечении больных, перенесших КШ, предлагается ежегодное допплер-эхокардиографическое (ЭхоКГ) исследование динамики ремоделирования миокарда левого желудочка (ЛЖ) с оценкой систолической и диастолической функции ЛЖ с целью ранней диагностики и дифференцированного лечения СН.
У больных трудоспособного возраста после хирургического вмешательства на коронарных артериях с положительной динамикой коронарного синдрома и функционального состояния миокарда должны быть пересмотрены критерии стойкой нетрудоспособности с расширением показаний к возврату к трудовой деятельности, поскольку сохранение инвалидности способствует трудовой дезадаптации этих больных.
Основные положения, выносимые на защиту:
1. В течение 3-х лет после КШ в условиях ИК у больных, страдающих сочетанной кардиальной патологией с множественным поражением венечных артерий и имеющих комплекс факторов риска прогрессирования атеросклероза, наблюдались стабилизация коронарного синдрома и отсутствие признаков прогрессирования СН у преимущественного большинства пациентов, соответственно 94% и 99%.
2. Ремоделирование миокарда в условиях восстановленного венечного кровообращения и медикаментозного лечения происходит по адаптивным вариантам: у больных с АГ и постинфарктным кардиосклерозом с увеличением линейно-объемных размеров ЛЖ и его ударного объема (УО), а у больных без ИМ в анамнезе по типу редуцирующего ремоделирования с тенденцией к уменьшению размеров ЛЖ и сохранению его насосной функции.
3. Иммунный ответ, сопровождающий хроническое стабильное течение ИБС, после эффективного КШ характеризуется активизацией клеточного и гуморального звеньев иммунной системы с увеличением содержания цитокина ИЛ-2 и сохранением физиологического уровня содержания в крови TNF- и лимфоцитов CD95, меченных к Fas-зависимому апоптозу
4. Между показателями иммунного ответа и факторами риска, способствующими прогрессированию атеросклероза, установлен ряд корреляционных связей, в том числе отрицательная средней степени корреляционная зависимость между уровнями содержания TNF-, ИЛ-2, антител к кардиолипину и ХС ЛПВП.
Апробация работы и внедрение результатов в практику. Основные положения диссертации доложены и обсуждены на: 1) VI конгрессе с международным участием «Паллиативная медицина и реабилитация в здравоохранении», средиземноморское побережье Турции – 24 апреля 2004г.; 2) 9 Международном медицинском конгрессе студентов и молодых ученых, Тернополь, Украина – 21 апреля 2005г.; 3) научно-практической конференции молодых ученых «Актуальные вопросы клинической и экспериментальной медицины», Санкт-Петербург – 13 мая 2005г.; 4) Всероссийской конференции с международным участием «Биологические аспекты экологии человека», Архангельск – 1 июля 2004г.; 5) Всероссийской научно-практической конференции с международным участием «Актуальные аспекты жизнедеятельности человека на Севере», Архангельск – 17 ноября 2006г.; 6) Ломоносовских чтениях: XXXIII «Медико-экологические проблемы Российского Севера» – 18 ноября 2004г., XXXIV «Клиническая медицина Севера: новые направления и перспективы» – 17 ноября 2005г.; 7) научной сессии студентов и молодых ученых СГМУ – 16 апреля 2004г., 15 апреля 2005г.
Результаты работы внедрены в практическую деятельность МУЗ «Городская поликлиника №1, №2, №3, №7», Центральной поликлиники «ФГУ СМЦ им. Н.А. Семашко Росздрава» г. Архангельска (акты внедрения от 29.03.2007г., 14.12.2007г., 20.12.2007г., 21.12.2007г., 25.12.2007г.). Результаты исследования используются в учебном процессе на кафедре поликлинической терапии на лечебном факультете, факультете повышения квалификации врачей СГМУ (акт внедрения от 04.05.2007г.).
Работа выполнена по плану НИР «Здоровье населения Европейского Севера» (№ государственной регистрации 01200412481).
По материалам диссертации опубликовано 16 работ, из них в журналах, рекомендуемых ВАК – 2, методических рекомендаций для врачей – 1.
Структура и объем диссертации. Диссертация состоит из введения, глав: обзора научной литературы, описания материалов и методов исследования, результатов собственных исследований и их обсуждения, а также заключения, выводов, практических рекомендаций и списка литературы, который включает 89 работ отечественных и 92 зарубежных исследователей. Работа изложена на 113 страницах, содержит 24 таблицы и иллюстрирована 8 рисунками.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
В рамках настоящей работы проведено ретроспективное исследование 100 больных ИБС, которым в период с 1996 по 2002 год проводилась операция КШ в условиях ИК в отделении сердечно-сосудистой хирургии МУЗ «Городская клиническая больница скорой медицинской помощи №1». Группа из 88 мужчин и 12 женщин формировалась методом сплошной выборки из общей популяции пациентов, перенесших КШ и наблюдавшихся на диспансерном учете в МУЗ г. Архангельска «Городская поликлиника №1, №2, №3, №7» и Центральной поликлинике ФГУ «СМЦ им. Н.А. Семашко Росздрава» в течение 3-х и более лет после операции.
Всем больным проводилось общеклиническое обследование. Концентрации общего ХС, триглицеридов (ТГ) и ХС ЛПВП измерялись на автоматическом анализаторе Cobas Mira Plus, производства компании «Hofman La Rosche», Basel Swtzerland. Многопроекционная коронароангиография по методу Judkins выполнена в МУЗ г. Архангельска «Городская клиническая больница скорой медицинской помощи №1». Электрокардиография, велоэргометрия (ВЭМ), холтеровское мониторирование (ХМ), ультразвуковое дуплексное сканирование брахиоцефальных артерий проводились в городских поликлиниках г. Архангельска.
С помощью ЭхоКГ оценивали следующие параметры: конечно-диастолический размер (КДР) и конечно-систолический размер ЛЖ (КСР). Рассчитывались показатели гемодинамики по методике Теiсholz (1976): конечный диастолический объем (КДО), конечный систолический объем (КСО), фракцию изгнания (ФИ) и УО. Масса миокарда (ММЛЖ) и индекс массы миокарда (ИММЛЖ) вычислялись по методике Реnn сubе.
Для анализа состояния основных показателей иммунного статуса
проведено исследование крови в лаборатории экологической иммунологии
Института физиологии природных адаптаций УрО РАН (Директор института
– д.м.н. Л.С. Щеголева) в 2004г. у 20 пациентов в отдаленные сроки после КШ (основная группа) и у 80 практически здоровых людей без клинических признаков ИБС и АГ (группа сравнения).
Критерии включения больных в иммунологическое исследование:
- Возраст – 65 лет, пол – мужской, житель г. Архангельска.
- Согласие пациента на участие в исследовании.
- Операция КШ – первичная, без манифестирующего СД.
- Стабильное течение коронарного синдрома.
- Отсутствие иммунокомплексных заболеваний и активных воспалительных процессов.
- Отсутствие клинических проявлений застойной СН, устойчивых нарушений ритма сердца.
- Сохраненная исходная функция ЛЖ (ФИ > 50%).
- Отсутствие онкологической патологии.
Субпопуляции Т-лимфоцитов определяли методом непрямой имунопероксидазной реакции с использованием моноклональных антител (НПЦ «МедБиоСпектр», Москва). Для оценки состояния фагоцитарного звена иммунитета изучали фагоцитарный показатель и фагоцитарное число с применением диагностических тестов современной лаборатории «ДиаэМ» (Москва). Для определения уровней циркулирующих иммунных комплексов (ЦИК) с помощью нефелометрии использовали диагностические наборы химической компании «Реакомплекс» (Россия). Методом «конкурентного» иммуноферментного анализа изучали концентрацию TNF- с использованием диагностического теста фирмы «Cytimmune sciences» (США) и ИЛ-2 с применением набора компании «BCM Diagnostics» (США). Методом непрямого иммуноферментного анализа определяли суммарные антитела IgA, IgM, IgG к кадиолипину с помощью диагностического теста фирмы «BCM Diagnostics» (США).
Обработка данных проводилась с использованием пакетов статистических программ Statistica (версия 6.0), SPSS for Windows (версия 11.5), Epitable. Сначала по критерию Колмогорова–Смирнова выборки были проверены на нормальность. Для нормально распределённых показателей достоверность различий средних значений определялась с использованием t-критерия Стьюдента для независимых выборок. Для прочих показателей использовался непараметрический критерий Манна-Уитни. Для анализа связанных измерений дихотомических производных применялся критерий Мак-Нимара. Для выявления зависимостей между показателями были вычислены бивариантные коэффициенты корреляции Пирсона (для нормального распределения) и Спирмена (для прочих). Использовались множественное сравнение ANOVA (для нормального распределения) и критерий Краскела–Уоллиса (для прочих). Для показателей, изучаемых в различные моменты времени, проведен дисперсионный анализ повторных измерений. Для вычисления отношения шансов использовали таблицы сопряженности. Различия для всех видов анализа считались достоверными при р<0,05.
Клиническая характеристика больных до операции
Средний возраст больных на день операции составил 53,9±6,71 лет. Дебют ИБС с ОИМ произошел у 51% пациентов. В прошлом перенесли ИМ 72% пациентов, из них повторный – 11% больных. До операции у больных преобладали тяжелые формы стенокардии на фоне антиангинальной терапии: ФК (по классификации NYNA) у 96 пациентов и ФК IV – у 1. Ишемические изменения, зарегистрированные по данным ВЭМ или ХМ, были выявлены у 52% больных. У 71% пациентов был выявлен атеросклероз сосудов шеи. У 7 пациентов была снижена ФИ, при этом она была менее 50%. У половины (52%) обследованных степень СН была I ФК. Клинически 10% пациентов не имели признаков СН. Только у 38% функциональное состояние сердца соответствовало II ФК.
При анализе коронарограмм поражение ствола левой коронарной артерии имели 14% пациентов. Распределение больных по количеству пораженных коронарных артерий выглядело следующим образом: двухсосудистое – у 53% пациентов и трехсосудистое поражение – у 47%. Степень поражения коронарного русла стала определяющим фактором в выборе объема оперативного вмешательства. Среднее число шунтов составило 3,5±0,94.
Результаты собственных исследований и их обсуждение
Критерием рецидива стенокардии после операции служило появление у пациента стенокардитических болей любой степени выраженности. В течение первого года после операции приступы стенокардии возобновились у 38% больных. Однако они стали более редкими и менее тяжелыми, чем до операции и соответствовали I–II ФК у 34% пациентов. Но у 4 больных прогрессирующая стенокардия потребовала экстренной госпитализации. При проведении КАГ у 2 из них выявлены окклюзии 1–2 шунтов из 3-х наложенных, у 1 – тромбоз 3-х шунтов с последующим отказом от повторного КШ и еще у 1 – шунты были проходимы, но прогрессировал стеноз передней межжелудочковой артерии, в которую был введен стент.
Через 2 года стенокардитические боли, соответствующие I–II ФК отмечали 44% больных. У 1 пациента развился ОИМ задней стенки ЛЖ, шунты при этом были проходимы, но сформировались стенозы ранее неповрежденной правой коронарной артерии. У другого пациента с нестабильной стенокардией выявлено прогрессирование стеноза артерии, 1 шунт к которой не контрастировался при КАГ.
К концу 3-го года наблюдения у 60% пациентов отмечались рецидивы стенокардии I–II ФК. Ишемические изменения при ВЭМ или ХМ регистрировались только у 22 (36,6%) больных с коронарным синдромом. Таким образом, через 3 года после операции 40 % пацентов были без рецидивов стенокардии и 54% больных отмечали стенокардию I–II ФК.
У 99% пациентов ФК СН в течение 3-х лет после КШ сохранился на дооперационном уровне. За наблюдаемый период клинические проявления СН прогрессировали только у 1 больного с АГ и ИМ в анамнезе, который ежегодно госпитализировался по поводу декомпенсации СН. Но в то же время у него по данным ЭхоКГ величина ФИ поддерживалась на уровне 50-52%.
Среди факторов риска в группе наблюдения высокой была распространенность ГЛП (88%) и АГ (81%). Избыточную массу тела имели 53% больных, 15% – ожирение с высоким риском для здоровья. Эффективного снижения массы тела за период наблюдения добились лишь 5 больных. Отягощенная наследственность по ИБС встречалась у 41% больных. На период обследования 38% пациентов являлись курильщиками, а 48% имели вредную привычку к табакокурению до операции и никогда не курили 52%. Наиболее часто встречались различные сочетания трех и более факторов риска (73%).
Статины принимали после операции 45 (51,1%) больных с ГЛП. В зависимости от уровня липидов в крови и длительного курсового лечения статинами больные разделены на 3 группы: 1-ю группу составили 12 пациентов с отсутствием ГЛП, во 2-ю группу вошли 45 больных с ГЛП, не принимавших статины, 3-ю группу составили 43 пациента с ГЛП, получавших длительное лечение статинами. На фоне лечения статинами (рис.1) достоверно снижался уровень общего ХС (с 5,95 до 4,77–4,81 ммоль/л, р<0,001) за счет ХС ЛПНП (с 4,28 до 3,15–3,78 ммоль/л, р<0,001) и коэффициента атерогенности (КА) (с 7,43 до 3,76–4,77, р<0,001).
Рис. 1. Средние показатели липидного обмена в динамике наблюдения у больных на фоне приема статинов (n=43).
При анализе частоты рецидивов (табл. 1) стенокардии по группам в зависимости от уровня липидов в крови выяснилось, что у больных на фоне приема статинов в первые 2 года после КШ были ниже относительный риск возникновения стенокардии в 1,38 раз (95%Cl 0,68–2,8, р=0,12) и число эпизодов дестабилизации стенокардии, потребовавших плановой госпитализации, в 1,89 раз (95%Cl 0,82–4,34, р=0,06), чем у пациентов других групп, не принимавших статины. Через 3 года после операции реваскуляризации частота выявления ангинозного синдрома и число госпитализаций не различались в 3-х группах. Несмотря на то, что различие было статистически недостоверным, прослеживалась тенденция, свидетельствовавшая о преимуществе лечения статинами для профилактики рецидива стенокардии.
Независимо от социального статуса после КШ вернулись к работе в течение 1-го года 2/3 (63%) больных. К концу 3-го года наблюдения сохранили трудоспособность 55% пациентов. Причинами, вызвавшими стойкую нетрудоспособность после операции, явились: острое нарушение мозгового нарушения в раннем послеоперационном периоде у 1 пациента, периоперационный ИМ у 1 пациента, повторный ИМ через 2 года после операции у 1 больного, атеросклероз внекардиальной локализации и заболевания, не связанных с ИБС у 13 больных, 16 пациентов остались нетрудоспособными при стабильном течении коронарного синдрома.
Таким образом, несмотря на значительное улучшение состояния, часть прооперированных пациентов признаются экспертными бюро нетрудоспособными.
Мы проследили динамику функционального состояния миокарда по результатам ЭхоКГ, выполненной ежегодно после операции у 87 больных. Из 57 больных, у которых до операции было зарегистрировано нарушение локальной сократимости ЛЖ при проведении ЭхоКГ, зоны гипокинезии исчезли в течение 1-го года после КШ у 14 пациентов (2=6,82, р=0,009, критерий Мак-Нимара).
В зависимости от перенесенного ИМ до операции и сопутствующей АГ больные разделены на 3 группы: 1-ю группу составили 24 пациента только с АГ, во 2-ю группу вошли 16 больных, перенесших ИМ до КШ, 3-ю группу составили 47 пациентов с АГ и ИМ в анамнезе. До КШ все средние значения эхокардиографических показателей не имели достоверных различий в 3-х группах больных. Важно, что разные виды геометрии ЛЖ сформировались относительно поздно на 2-3 году наблюдения. В каждой из анализируемых групп больных этот процесс имел свою специфику. Так, у больных (табл. 1) 3-й группы под воздействием реваскуляризации происходит увеличение линейных и объемных диастолических размеров ЛЖ (КДР с 5,45 до 5,65 см, p<0,05 и КДО с 146,6 до 159,9 мл, p<0,001), а также его массы (соответственно ММЛЖ с 258,3 до 296,2 г и иММЛЖ с 133,1 до 151,6 г/м2, p<0,05).
Таблица 1
Динамика функционального состояния миокарда по данным ЭхоКГ (M±SE) у больных с АГ и ПИКС в разные сроки после КШ (n=47)
| Показатели | До операции | Через 1 год | Через 2 года | Через 3 года |
| КДР ЛЖ, см | 5,45±0,52 | 5,46±0,61 | 5,65±0,61* | 5,65±0,64* |
| КДО ЛЖ, мл | 146,6±32,31 | 147,5±37,51 | 159,4±42,24* | 159,9±43,20** |
| ФИ ЛЖ, % | 56,8±7,07 | 57,9±7,32 | 59,5±7,53 | 59,3±7,46* |
| ФС ЛЖ, % | 28,3±5,63 | 28,6±5,60 | 29,7±6,82 | 29,6±6,41 |
| УО, мл | 82,3±16,61 | 84,1±19,12 | 93,2±20,19** | 93,2±20,73** |
| ММЛЖ, г | 258,3±48,86 | 268,5±64,81 | 289,5±70,30 | 296,2±72,68** |
| ИММЛЖ, г/м2 | 133,1±26,95 | 137,6±32,61 | 148,4±34,66 | 151,6±36,49* |
Примечание: * – р<0,05, ** – р<0,001 (по данным дисперсионного анализа повторных измерений при сравнении с исходным состоянием).
Такой вариант моделирования носил адаптивный характер, так как такие изменения способствовали улучшению сократительной функции миокарда (ФИ ЛЖ с 56,8% до 59,3%, p<0,05 и УО с 82,3 до 93,2 мл, p<0,001).
У больных 2-й группы линейно-объемные показатели ЛЖ изменялись в том же направлении: КДР с 5,33 до 5,51 см (p<0,05) и КДО с 139,8 до 149,8 см (p<0,05), ММЛЖ и иММЛЖ (соответственно с 236 до 258 г и со 123 до 135 г/м2, p<0,05). А УО и ФИ ЛЖ сохранялись на уровне 78,8–81,9 мл и 56,9-55,3%, соответственно. Однако, и в этом случае можно говорить об эффективности реваскуляризации, поскольку она все же способствует сохранению сокращения дилатированного миокарда.
У пациентов 1-й группы на протяжении последующих 3-х лет наблюдения происходило недостоверное уменьшение ММЛЖ и иММЛЖ, линейно-объемных размеров ЛЖ: КДР и КДО с сохранением ФИ ЛЖ на уровне 60,7% – 59,4%.
Таким образом, реваскуляризация миокарда у больных, перенесших ИМ, позволяет даже в отдаленном послеоперационном периоде, прослеженном нами до 3-х лет, поддерживатъ насосную функцию ЛЖ, активируя компенсаторные резервы сократимости кардиомиоцитов. Положительная динамика УО регистрировалась даже в условиях прогрессирующей дилатации полости ЛЖ. Вместе с тем у больных с АГ без ИМ отпадает необходимость в лишней мышечной массе сердца, поскольку размеры ЛЖ приближаются к оптимальным.
Иммунологическое исследование проведено у 20 больных через 1,5–5 лет после операции реваскуляризации миокарда.
Сравнение уровней большинства изучаемых показателей иммунной реактивности в зависимости от числа лет после операции выявило однонаправленную тенденцию их изменений без достоверных различий среди группы наблюдения (рис. 2). Это позволило всех больных объединить в одну опытную группу.
У оперированных больных значительно, почти в 2 раза было увеличено содержание моноцитов относительно группы сравнения как в абсолютном выражении (0,72±0,25x109 кл/л против 0,30±0,13x109 кл/л, р<0,01), так и в процентном (9,55±3,21 против 4,75±1,97, р<0,01).
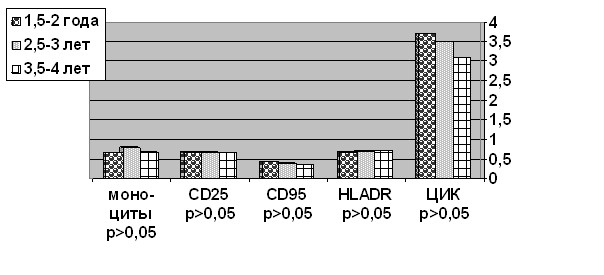 Рис. 2. Иммунологические показатели у больных в зависимости от числа лет
Рис. 2. Иммунологические показатели у больных в зависимости от числа лет
после операции (М для лимфоцитов – x109 кл/л, ЦИК – г/л, n=20).
У больных ИБС наблюдалось низкое процентное содержание активных фагоцитов в отличие от группы сравнения (44,0±8,02 против 49,4±7,43, р<0,05), что сочеталось с увеличением фагоцитарного числа нейтрофилов (15,91±7,34 против 8,55±4,48, р<0,001).
Выявлены признаки активизации клеточного звена иммунного ответа (табл. 2). Так, у больных ИБС достоверно выше уровни лимфоцитов CD3, запускающих процессы антигензависимой активизации Т-клетки (1,05±0,21x109 кл/л против 0,85±0,31x109 кл/л, р<0,01), содержащих альфа-субъединицу рецептора для ИЛ-2 – CD25 (0,69±0,09x109 кл/л против 0,49±0,28x109 кл/л, р<0,01), лимфоцитов HLADR с рецепторами антигенов гистосовместимости класса II (0,72±0,11x109 кл/л против 0,51±0,17x109 кл/л, р<0,01). При этом концентрации иммунорегуляторных лимфоцитов CD4, цитотоксических CD8, естественных киллеров CD16 у больных были близкими по уровню в группе сравнения. Индекс CD4/CD8 был выше у больных после КШ (1,7±0,02 против 1,2±0,09, р<0,05), что указывает на преобладание реакций активизации иммунного ответа против аутоантигенов.
Закономерно, что у больных ИБС выявлены высокие, близкие к токсическим, концентрации ЦИК как с IgA (4,15±1,42 г/л против 2,26±0,91 г/л, р<0,05), так и с IgМ (3,81±1,03 г/л против 2,11±0,87 г/л, р<0,05, достоверно превышающие таковые в группе сравнения, что указывает на активизацию гуморального иммунного ответа (рис. 3).
Таблица 2
Средние значения содержания фенотипов лимфоцитов в исследуемых группах (М±S.D.x109 кл/л.)
| Показатели | Больные, перенесшие операцию n=20 | Группа сравнения n=80 |
| CD3 | 1,05±0,21 | 0,85±0,31* |
| CD4 | 0,51±0,10 | 0,42±0,21 |
| CD5 | 0,46±0,13 | 0,90±0,22* |
| CD8 | 0,30±0,05 | 0,33±0,17 |
| CD16 | 0,30±0,10 | 0,38±0,12 |
| CD25 | 0,69±0,09 | 0,49±0,28* |
| CD71 | 0,24±0,08 | 0,52±0,26* |
| CD95 | 0,40±0,08 | 0,44±0,04 |
| HLADR | 0,72±0,11 | 0,51±0,17* |
Примечание: *** – р<0,001, ** – р<0,01, * – р<0,05 (р – уровень значимости U-критерия Манна-Уитни). 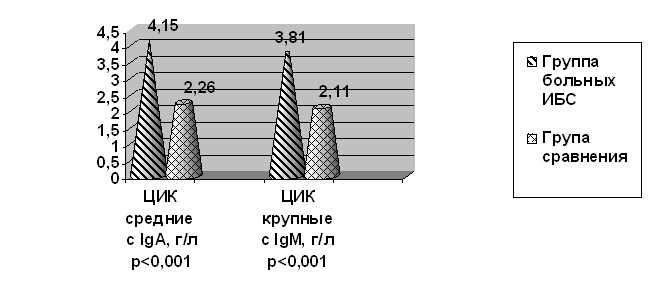
Рис. 3. Средние значения ЦИК с IgA и IgM в анализируемых группах (М, г/л).
Другим доказательством аутосенсибилизации у больных ИБС является присутствие антител к кардиолипину (7,10±2,45 ЕД/мл), относящихся к группе антител к фосфолипидам, хотя уровень их содержания почти не отличается от уровня в группе сравнения (6,9±2,8 ЕД/мл, р>0,05).
У больных ИБС был увеличен уровень продукции цитокина ИЛ-2, который составил 3,01 (2,05–8,51) пг/мл против 0,67±0,08 пг/мл в группе сравнения. Уровень содержания TNF- составил в среднем 14,75 пг/мл (5,26–18,92), не отличаясь от уровня в группе сравнения – 14,15±3,68 пг/мл (р>0,05). Не выявлено достоверных отличий и в содержании субпопуляции лимфоцитов CD95 с рецептором к TNF-. Индексы CD25/CD95 и HLADR/CD95, т.е. расчет соотношений маркеров активизации и апоптоза Т-лимфоцитов у больных ИБС в наших наблюдениях составил 1,7±0,08 против 1,1±0,02 (р<0,01) и 1,8±0,03 против 1,1±0,03 (р<0,01) в группе сравнения, что указывает на преобладание воспалительного компонента иммунного ответа и ограничение Fas-опосредованной гибели активированных лимфоцитов.
Нами был использован метод ROC-кривых (кривые операционной характеристики для диагностических тестов), позволяющих определить точку разделения, выше которой предполагается очень высокий шанс иметь заболевание (Петри А., Сэбин К., 2003). Точки разделения уровней ИЛ-2 – 2,08 пг/мл (чувствительность 70% и специфичность 100%), CD25 – 0,66х109 кл/л (чувствительность 75% и специфичность 83%), HLADR – 0,63х109 кл/л (чувствительность 70% и специфичность 68%), CD25/CD95 – 1,61 (чувствительность 70% и специфичность 82%) и HLADR/CD95 – 1,64 (чувствительность 65% и специфичность 78%).
Установлена отрицательная средней степени связь между уровнями ИЛ-2 и ХС ЛПВП, r=-0,64, p<0,05, антител к кардиолипину и ХС ЛПВП (r=-0,76, p<0,05), TNF- и ХС ЛПВП (r=-0,70, p<0,05). В тоже время выявлена средней степени связь между ИМТ и уровнем содержания TNF- (rS=0,69, p<0,05).
Посредством дисперсионного анализа Краскела–Уоллиса при межгрупповом сравнении выявлено (рис. 4.), что концентрация антител к кардиолипину у больных с ГЛП была достоверно выше, чем у больных без ГЛП (8,8 (7,1–10,9) ЕД/мл против 4,7 (4,0–5,1) ЕД/мл, р<0,05), а у пациентов с ГЛП на фоне приема статинов имела тенденцию к снижению – 7,2 (5,8–7,7) ЕД/мл.
Рис. 4. Уровень антител к кардиолипину в крови в исследуемых группах (Ме, ЕД/мл).
Таким образом, операция КШ у больных в условиях ИК, проведенная в г. Архангельске, оказалась высокоэффективной. Иммунный ответ, соответствующий положительной динамике коронарного синдрома у мужчин, перенесших первичную операцию КШ без клинических признаков прогрессирования СН свидетельствовал о преобладании клеточного пути активизации лимфоцитов с сохранением физиологического уровня реакций апоптоза.
Выводы
- Положительная динамика коронарного синдрома через 3 года после коронарного шунтирования в условиях искусственного кровообращении проявлялась отсутствием загрудинных болей у 40% больных, уменьшением ФК стенокардии с III–IV до I–II у 56% пациентов. Ишемические изменения были зарегистрированы только у 23% больных. У 14 (24,5%) пациентов с постинфарктным кардиосклерозом исчезли зоны гипокинезии. Клинические проявления хронической сердечной недостаточности I–II ФК, зарегистрированные у 89% больных до операции, не прогрессировали.
- Большая часть больных (73%) имела три и более основных факторов риска прогрессирования атеросклероза, а мероприятия вторичной профилактики оказались эффективными у единичных больных: существенного снижения массы тела добились лишь 5 из 68 пациентов, страдающих ожирением или избыточной массой тела, отказались от курения 10 из 48 курящих больных.
- На фоне приема статинов в комплексе послеоперационной медицинской реабилитации у больных достоверно снижался уровень общего ХС (с 5,95 до 4,77–4,81 ммоль/л) за счет ХС ЛПНП (с 4,28 до 3,15–3,78 ммоль/л), имелись тенденции к более редким рецидивам стенокардии и меньшему числу госпитализаций, чем у остальной группы наблюдения.
- Под воздействием реваскуляризации миокарда и медикаментозного лечения независимо от проявлений хронической сердечной недостаточности выявлено адаптивное ремоделирование миокарда левого желудочка: по типу эксцентрической гипертрофии с увеличением линейно-объемных размеров и ударного объема левого желудочка у больных с постинфарктным кардиосклерозом и артериальной гипертонией и по типу регрессии гипертрофии левого желудочка у больных без инфаркта миокарда до операции.
- Изменения иммунной реактивности при хроническом течении ишемической болезни сердца у больных после коронарного шунтирования были однонаправленными несмотря на срок наблюдения, и проявлялись преобладанием воспалительного компонента иммунного ответа и сохранением физиологическим уровнем Fas-опосредованной гибели активированных лимфоцитов.
Практические рекомендации
- Практическим врачам, наблюдающим больных в первый год после коронарного шунтирования, при выявлении нестабильной стенокардии рекомендуется направлять их на коронароангиографию несмотря на наличие инвазивного характера, ионизирующего излучения и высокой стоимости исследования.
- С целью ранней диагностики и дифференцированного лечения сердечной недостаточности участковым терапевтам необходимо ежегодно регистрировать динамику ремоделирования миокарда с оценкой систолической и диастолической функции левого желудочка с помощью допплер-эхокардиографии.
- Содержание цитокина интерлейкина-2 > 2,08 пг/мл, лимфоцитов CD25 > 0,66х109 кл/л, HLADR > 0,63х109 кл/л, уровни индексов CD25/CD95 > 1,61 и HLADR/CD95 > 1,64 могут быть дополнительными критериями стабильного течения коронаросклероза у больных в отдаленные сроки после коронарного шунтирования.
- У больных трудоспособного возраста после хирургического вмешательства на коронарных артериях с положительной динамикой коронарного синдрома и функционального состояния миокарда должны быть пересмотрены критерии стойкой нетрудоспособности с расширением показаний к возврату к трудовой деятельности, поскольку сохранение инвалидности способствует их трудовой дезадаптации.
Список опубликованных научных работ
по материалам диссертации
- Хлопина И.А. Реабилитация больных, перенесших операцию коронарного шунтирования / И.А. Хлопина, О.В. Вешнякова // Бюл. СГМУ. – 2003. – №2. – С. 118-120.
- Хлопина И.А. Сравнительная клинико-функциональная характеристика больных, перенесших операцию реваскуляризации миокарда с возобновлением приступов стенокардии и без клинических проявлений / И.А. Хлопина, О.В. Вешнякова // Бюл. СГМУ. – 2004. – №1. – С. 265-267.
- Хлопина И.А. Динамика коронарной недостаточности у больных после коронарного шунтирования / И.А. Хлопина, Е.В. Феликсова, М.Н. Лабутина // Бюл. СГМУ. – 2004. – №2. – С. 208-210.
- Хлопина И.А. Результаты комплексной реабилитации больных ИБС, перенесших операцию реваскуляризации миокарда / И.А. Хлопина, Е.Н. Шацова // Паллиативная медицина и реабилитация. – 2004. - №2. – С. 31.
- Хлопина И.А. Показатели иммунитета у больных ИБС в ранние и отдаленные сроки после операции реваскуляризации на Севере / И.А. Хлопина, Л.К. Добродеева, Е.Н. Шацова // Биологические аспекты экологии человека: материалы Всерос. конф. с междунар. участием. – Архангельск, 2004. – С. 222-223.
- Хлопина И.А. Изменение продукции некоторых провоспалительных цитокинов у больных с различными вариантами ишемической болезни сердца после операции реваскуляризации миокарда / И.А. Хлопина // IV Всероссийская университетская научно-практическая конференция молодых ученых и студентов по медицине: сб. материалов. – Тула, 2005. – С. 163-164.
- Хлопина И.А. Ремоделирование сердца у больных после коронарного шунтирования / И.А. Хлопина, Е.В. Феликсова, С.Н. Шендрик // Актуальные вопросы клинической и экспериментальной медицины: сб. тезисов докл. науч.-практ. конф. молодых ученых. – С-Пб, 2005. – С. 193-194.
- Хлопина И.А. Комплексная медико-социальная реабилитация у больных Архангельской области, перенесших операцию коронарного шунтирования / И.А. Хлопина, Е.В. Феликсова, А.А. Шлаганова // Бюл. СГМУ. – 2005. – №1. – С. 245-247.
- Хлопина И.А. Основные тенденции изменений иммунной реактивности у больных со стабильным течением ишемической болезни сердца после операции коронарного шунтирования / И.А. Хлопина, Е.Н. Шацова // Юбилейная науч. конф. КГМУ и сессия Центрально-Черноземного науч. центра РАМН, посвященной 70-летию КГМУ: сб. трудов. – Курск, 2005. – С. 142-143.
- Черноземова А.В. Диастолическая функция левого желудочка у больных, перенесших операцию коронарного шунтирования / А.В. Черноземова, И.А. Хлопина, К.В. Великонский // Бюл. СГМУ. – 2005. – №2. – С. 247-248.
- Хлопина И.А. Факторы риска прогрессирования ишемической болезни сердца у больных, перенесших операцию коронарного шунтирования / И.А. Хлопина // Молодые ученые в медицине: тез. докл. Х Всерос. науч.-практ. конф. – Казань. – 2005. – С. 187-188.
- Хлопина И.А. Иммунные нарушения и факторы риска прогрессирования атеросклероза у больных после операции коронарного шунтирования / И.А. Хлопина // 9 Международный медицинский конгресс студентов и молодых ученых: материалы науч.-практ. конф. – Тернополь: Укрмедкнига, 2005. – С. 229.
- Хлопина И.А. Иммунные и липидные нарушения у больных ишемической болезнью сердца после операции коронарного шунтирования / И.А. Хлопина, А.В. Черноземова // ХI Всерос. науч.-практ. конф.: тез. докл. – Казань, 2006. – С. 186.
- Хлопина И.А. Влияние статинов на клинические и иммунологические показатели у больных после операции коронарного шунтирования / И.А. Хлопина, Е.Н Шацова // Экология человека. Приложение 4/1. – 2006. – С. 181-183.
- Хлопина И.А. Характеристика иммунного ответа у больных ишемической болезнью в отдаленные сроки после коронарного шунтирования / И.А. Хлопина, Е.Н. Шацова, Л.К. Добродеева // Экология человека. – 2006. – №12. – С. 14-17.
- Динамическое наблюдение больных после коронарного шунтирования на диспансерно-поликлиническом этапе: Метод. рекомендации / Север. гос. мед. ун-т. Каф. поликл. терапии.; Сост.: Хлопина И.А. и др. – Архангельск, 2007. – 23с.

