Экспериментальное обоснование применения деминерализованного костного имплантата в лечении хронического остеомиелита
На правах рукописи
ЛАДОНИН Сергей Владимирович
ЭКСПЕРИМЕНТАЛЬНОЕ ОБОСНОВАНИЕ ПРИМЕНЕНИЯ
ДЕМИНЕРАЛИЗОВАННОГО КОСТНОГО ИМПЛАНТАТА
В ЛЕЧЕНИИ ХРОНИЧЕСКОГО ОСТЕОМИЕЛИТА
14.01.17 – Хирургия
14.03.02. – Патологическая анатомия
Автореферат диссертации на соискание ученой степени
кандидата медицинских наук
Самара 2011
Работа выполнена в ГБОУ ВПО «Самарский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации
Научные руководители:
доктор медицинских наук, профессор Столяров Евгений Анатольевич
доктор медицинских наук, профессор Волова Лариса Теодоровна
Официальные оппоненты:
доктор медицинских наук, профессор Жуков Борис Николаевич
доктор медицинских наук, профессор Маслякова Галина Никифоровна
Ведущая организация: ГБОУ ВПО Первый Московский государственный медицинский университет им. И.М. Сеченова Министерства здравоохранения и социального развития Российской Федерации.
Защита диссертации состоится « » __________ 2011 года в ___часов на заседании диссертационного совета Д 208.085.01 при ГБОУ ВПО «Самарский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации (443079, Самара, проспект К.Маркса, д. 165 б).
С диссертацией можно ознакомиться в научной библиотеке ГБОУ ВПО «Самарский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации (443001, г. Самара, ул. Арцыбушевская, д. 171).
Автореферат разослан « »___________________2011 года.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Корымасов Е.А.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы исследования
Лечение хронического остеомиелита является одной из основных задач гнойной хирургии, его результаты до настоящего времени оставляют желать лучшего. Рост травматизма, широкое использование эндопротезирования, металлоостеосинтеза в лечении переломов ведут к увеличению числа больных с данной патологией (Липатов К.В., Стан Е.А., 2008; Батаков В.Е., 2010; Patzakis M.J., Zalavras C.G., 2005). Среди гнойно-хирургических инфекций остеомиелиту принадлежит одно из первых мест. У 1,4 – 14,4% пострадавших с открытыми переломами костей и у 1,6 – 22,4% больных после операции остеосинтеза наблюдается развитие остеомиелита (Батаков Е.А. с соавт., 2008). Несмотря на достигнутые успехи в лечении данного заболевания, частота рецидивов достигает 10-40%, пациенты подвергаются многочисленным повторным операциям (Радаев С.В., 2009; Masroor I., Hashmi R., 2002). Инвалидность при развитии данного заболевания составляет 35 - 37,8% (Столяров Е.А. с соавт., 2004; Коваль А.Н., 2009).
Оперативный метод является основным в лечении данной патологии (Амирасланов Ю.А. с соавт., 2006; Зайцев А.Б., Воробьев А.В., 2006; Georgescu N. et al. 2002; Demeeulenaere A., Antoun Y. et al. 2002). Важным этапом операции является пластика костной полости. Хорошие отдалённые результаты получены хирургами, использовавшими для остеопластики аутомышцу на ножке, измельчённую аутомышцу, аутокость (Гаврилов А.Н., 2006; Зайцев А.Б. 2007; Батаков В.Е., 2010). Однако, отдавая должное данным методам, следует отметить ряд проблем связанных с ограничением пластического материала, дополнительной операционной травмой. Всё это заставляет разрабатывать новые методы лечения хронического остеомиелита.
Начиная со второй половины прошлого века в реконструктивной костной хирургии стали применять различные материалы биологического происхождения (Кирилова И.А. 2004; Лекишвили М.В., 2006; Миронов С.П., 2010). Одним из них является деминерализованная костная ткань (ДКТ) «Лиопласт», получаемая из зрелой костной ткани человека. Экспериментальными работами доказано положительное влияние пластических материалов серии «Лиопласт» на регенерацию костной ткани (Волова Л.Т., 1997; Белозерцева Е.А., 2006; Болонкин И.В., 2008; Беланов Г.Н. с соавт., 2010).
Учитывая это, можно высказать предположение о целесообразности использования деминерализованного костного имплантата (ДКИ) «Лиопласт» в комплексном лечении хронического остеомиелита. Решение данных вопросов возможно лишь в эксперименте.
Цель исследования
Изучение влияния аллогенного деминерализованного костного имплантата «Лиопласт» на процессы регенерации костной ткани при хроническом остеомиелите в эксперименте.
Задачи исследования
1. Усовершенствовать экспериментальную модель хронического остеомиелита у кроликов.
2. Разработать способ остеопластики при лечении хронического остеомиелита с использованием лиофилизированного деминерализованного костного имплантата.
3. Изучить с помощью микробиологического метода продолжительность антимикробного действия биоимплантата, изготовленного из компактной кости, насыщенного антибиотиком с помощью ультразвука.
4. Дать сравнительную морфологическую, морфометрическую, рентгенологическую, лабораторную оценку процессов репаративной регенерации при хроническом остеомиелите после пластики мышцей на ножке и после пластики деминерализованной костной тканью с позиций доказательной медицины.
5. Исследовать биотрансформацию костно-пластического материала и перемещаемой мышцы в организме.
Научная новизна
Усовершенствована модель хронического остеомиелита у кроликов для изучения репаративной регенерации при данной патологии (рационализаторское предложение № 414 от 18.06.2004 г. Самарского государственного медицинского университета).
Впервые разработан новый способ остеопластики при хроническом остеомиелите с использованием аллогенной деминерализованной костной ткани насыщенной антибиотиком с помощью низкочастотного ультразвука (Патент РФ на полезную модель № 41600 от 10.11.04).
Установлено пролонгированное антимикробное действие имплантата из компактной кости, насыщенного антибиотиком с помощью низкочастотного ультразвука.
Впервые с помощью комплекса морфологических, морфометрических, рентгенологического, лабораторного методов доказан репаративный характер остеогенеза в большеберцовых костях кроликов после некрсеквестрэктомии и пластики аллогенной деминерализованной костной тканью серии «Лиопласт».
Практическая значимость работы
Результаты проведенной работы дополняют современные представления о характере регенераторных процессов в костной ткани реципиентов под воздействием аллогенных деминерализованных биоимплантатов и о механизмах их рассасывания.
Предложенная модификация способа моделирования хронического остеомиелита нижних конечностей у кроликов позволяет использовать её в дальнейших экспериментальных исследованиях.
Выявленная эффективность применения деминерализованной костной ткани в эксперименте создаёт предпосылки для проведения клинических испытаний нового способа остеопластики.
Реализация работы
Результаты исследования используются в учебном процессе на кафедре общей хирургии ГБОУ ВПО Самарский государственный медицинский университет Минздравсоцразвития России, при выполнении экспериментов на базе Института экспериментальной медицины и биологии (ИЭМБ) ГБОУ ВПО Самарский государственный медицинский университет Минздравсоцразвития России.
Апробация работы
Материалы диссертации доложены на VIII-м съезде травматологов-ортопедов России (Самара, 2006); на Международной конференции «Новые технологии в военно-полевой хирургии и хирургии повреждений мирного времени» (Санкт-Петербург, 2006); на 42-й научно-практической межрегиональной конференции врачей (Ульяновск, 2007); на конференции «Аспирантские чтения 2009» (Самара, 2009); на IV Всероссийском симпозиуме с международным участием «Актуальные вопросы тканевой и клеточной трансплантологии» (Санкт-Петербург, 2010); на научно-практической конференции «Илизаровские чтения» (Курган, 2011).
Публикации по теме научного исследования
По теме диссертации опубликована 21 печатная работа, из них 3 – в журналах из перечня ВАК. Получен 1 Патент РФ на полезную модель, 1 удостоверение на рационализаторское предложение.
Объем и структура диссертации
Диссертация изложена на 143 страницах машинописного текста и состоит из введения, обзора литературы, четырёх глав собственных исследований, заключения, выводов и библиографического указателя. Работа содержит 81 рисунок и 11 таблиц. Список литературы включает 217 источников, из которых 159 отечественных и 58 зарубежных.
Положения выносимые на защиту:
1. Усовершенствованная модель хронического остеомиелита у кроликов приводит к развитию патологического процесса в 100% случаев.
2. Деминерализованная костная ткань серии «Лиопласт» усиливает регенерацию костной ткани после некрсеквестрэктомии в эксперименте, способствуя полному её восстановлению быстрее, чем при пластике мышцей на ножке.
3. Процессы рассасывания аллогенной деминерализованной костной ткани происходят с участием активных макрофагов и остеокластов.
4. Реакция со стороны системы крови при пластике аллогенным имплантом после некрсеквестрэктомии у лабораторных животных минимальна, что доказывает незначительные иммуногенные свойства материала.
5. Объективными критериями активизации регенераторных процессов в костной ткани при лечении хронического остеомиелита являются морфометрические показатели процентного соотношения площадей костной и соединительной тканей, площадь просвета сосудов, показатели уровней свободного и белковосвязанного оксипролина в периферической крови.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Для решения поставленных задач было выполнено экспериментальное исследование на 64 беспородных кроликах обоего пола массой 3200 – 3600 г., на базе ИЭМБ Самарского государственного медицинского университета. Экспериментальные животные были рандомизированы на две серии экспериментов. У кроликов первой серии моделировали остеомиелит, прослеживали его развитие без лечения. Кролики второй серии были разделены на контрольную и основную группы. У животных изучали особенности репаративной регенерации костной ткани, морфофункциональное состояние мышечной и соединительной тканей после моделирования остеомиелита, некрсеквестрэктомии, пластики костной полости в контрольной группе – мышцей на ножке, а у животных основной группы – после пластики ДКТ.
Животных выводили из эксперимента на 14-е, 30-е, 90-е, 180-е сутки путём внутрисердечной инъекции раствора эфира. Перед экспериментом, во все его сроки проводили забор крови для общеклинических, иммунологических и биохимических исследований.
Распределение экспериментальных животных по группам и сериям приведено в таблице 1.
| Сроки выведения из эксперимента | Серия № 1 | Серия № 2 | |
| Контрольная группа | Основная группа | ||
| 14-е сутки | 4 | 6 | 6 |
| 30-е сутки | 4 | 6 | 6 |
| 90-е сутки | 4 | 6 | 6 |
| 180-е сутки | 4 | 6 | 6 |
| Всего | 64 | ||
Таблица 1
Распределение экспериментальных животных по группам.
Моделирование хронического остеомиелита проводили в первой серии по модификации А.Ю. Сидорова (2004) и нашей методике (рационализаторское предложение № 414 от 29.06.2004 г.), во второй серии – только по нашей методике.
На 14-е сутки после моделирования остеомиелита у кроликов проводили некрсеквестрэктомию, санацию костной полости. Для пластики костной полости в основной группе использовали аллогенный ДКИ «Лиопласт», изготовленный из бедренной кости кролика. В контрольной группе проводили пластику костной полости мышцей, прилегающей к дефекту, на проксимальной ножке.
Для гистологического исследования у кроликов брали участок диафиза оперированной большеберцовой кости с окружающими мягкими тканями в соответствии с намеченными сроками. Взятый материал фиксировали в 12% растворе формалина на фосфатном буфере рН 7,2-7,4 в течение 2-х суток. После фиксации материал промывали в проточной воде 24 часа. Далее осуществляли декальцинацию кости в растворе трилона-Б в течение 3-4 недель. Обезжиривание и обезвоживание материала проводили в растворах этилового спирта возрастающей концентрации (70°, 80°, 96°) 2-3 часа в каждом растворе, с последующей заливкой в парафин. Парафиновые срезы толщиной 5-7 мкм приготавливали на санном микротоме типа Рейхерта. Полученные депарафинированные срезы окрашивали гематоксилином и эозином, пикрофуксином по Ван – Гизон.
По всем сериям и срокам было изготовлено 450 гистологических препаратов. Препараты изучали светооптически и телеметрически с помощью электронной системы визуализации – видеокамеры CCD KOCOM KCC-31 OPD и светового микроскопа Nicon ALPHAPHOT-2 YS2-H (Japan).
Телеморфометрическая установка включала в себя цифровую видеокамеру, совместимый с ней световой микроскоп, персональный компьютер с установленной программой «Видео Тест – Морфо» («ВТ-М» - Россия, г. Санкт-Петербург; рег. уд. МЗ. РФ №29/20010702/6102-04). В ходе гистологического исследования были отобраны препараты для морфометрического исследования. В каждой из подгрупп рассчитывали число замеров по известным формулам, исходя из имеющегося материала (Автандилов Г.Г., 1996).
Объектом исследования являлась цельная кровь, мазки крови на предметных стеклах, плазма крови. Забор крови у кроликов проводили в стерильных условиях, из краевой ушной вены. Далее с помощью стандартных общеклинических и иммунологических методик определяли показатели общего анализа крови и реакцию клеток, осуществляющих фагоцитоз. Для оценки метаболизма коллагена в организме экспериментальных животных биохимически определяли количественное содержание свободного и белковосвязанного оксипролина в плазме крови по реакции с n-диметиламинобензальдегидом, образующим с аминокислотой окрашенное соединение.
Рентгенологическое исследование оперированной конечности кроликов проводили в прямой и боковой проекциях на аппарате РУМ-10 при одних и тех же условиях экспозиции, напряжения тока и расстояния тубуса.
Статистическую обработку полученных числовых результатов выполняли при помощи персонального IВМ-совместимого компьютера с использованием приложения Microsoft Exel програмного продукта Microsoft Office и программы Statsoft Statistica 6.0.
Все полученные в экспериментах результаты подвергли статистической обработке, используя t – критерий Стьюдента. Изменения исследуемых показателей считались статистически значимыми при р<0,05 (Фролов Ю.П., 1996).
Основные результаты исследования
Выполнены эксперименты с моделированием остеомиелита у кроликов. У 16 беспородных кроликов массой 3200 – 3600 г. моделировали остеомиелит по методу О.М. Бушуева (1999). Под наркозом (кетамин 5% - 1 мл, атропин 0,1 % - 0,5 мл, дроперидол 0,25% - 2 мл), в стерильных условиях, производили разрез по передней поверхности правой голени, тупо раздвигались мышцы, формировали дефект средней трети диафиза правой большеберцовой кости, в который вводили взвесь микробных тел Staphylococcus aureus – 109 в 1 мл физиологического раствора. У 8 кроликов производили дефект по модификации А.Ю. Сидорова(2004). Трепанационное отверстие в кости делали с помощью бормашины типа БЭСБ-03 № 1231 диаметром 0,2 см, затем производили распил кости во взаимно перпендикулярных направлениях через дефект общим диаметром до 1 см (рис.1 А).
У 8 кроликов формировали дефект по нашей модификации (рационализаторское предложение № 414 от 18.06.2004 г.). По передней поверхности большеберцовой кости с помощью бормашины типа БЭСБ-03 № 1231, трапецивидной фрезой диаметром 0,2 см продольно с интервалом 0,2 см наносилось четыре трепанационных отверстия с обнажением костномозгового канала. Острым краем трапецивидной фрезы крайние боковые точки отверстий соединялись продольными пропилами (рис. 1Б). У всех животных рана послойно ушивалась.


А Б
Рисунок 1. Схема моделирования хронического остеомиелита большеберцовой кости кроликов: А - по модификации А.Ю. Сидорова,
Б – по нашей модификации.
На 14-е сутки эксперимента при моделировании остеомиелита по модификации А.Ю. Сидорова, у всех кроликов рентгенологически визуализировался дефект диафиза большеберцовой кости Х-образной формы размерами 0,6 х 0,6 см. Распространение костной деструкции в стороны от дефекта не наблюдалось (рис. 2А).


А Б
Рис.2. Рентгенограмма голени на 14-е сутки после моделирования
остеомиелита по модификации А.Ю. Сидорова (А) и по нашей модификации (Б). Трепанационные отверстия (1), отек, утолщение мягких тканей (2), паратравматический склероз костной ткани (3).
В те же сроки, при моделировании остеомиелита по нашей модификации, у всех животных рентгенологически определялся дефект большеберцовой кости размерами 0,3 х 1,5-1,6 см продолговатой формы, расположенный по длиннику кости. Определялись секвестры, выраженная размытость контуров формирующегося дефекта, распространение костной деструкции на 0,1 - 0,2см в стороны от послеоперационных отверстий (рис. 2 Б).
При микроскопии костная ткань в области повреждения была некротизирована, имела дефект. Надкостница и эндоост были отслоены, инфильтрированы лейкоцитами, между ними и подлежащей костной тканью развивались клеточные элементы соединительной ткани. Вокруг участков повреждённой костной ткани было большое количество сегментоядерных лейкоцитов (рис. 3).
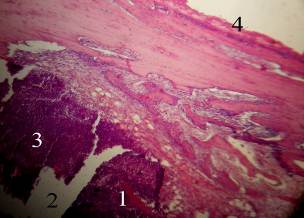
Рис. 3. Микрофотография. Некроз костной ткани (1) в зоне дефекта (2), лейкоцитарные инфильтраты (3), инфильтрация лейкоцитами надкостницы (4). 14-е сутки после моделирования остеомиелита у кролика. Окраска гематоксилином и эозином. Увеличение 70.
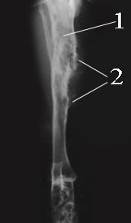
На 180-е сутки у кроликов с нашей модификацией остеомиелита на рентгенограммах сохранялась картина хронического воспаления костной ткани, а именно наличие зоны деструкции с разрежением и остеосклерозом, узурацией краевой пластины (рис. 4 А). В отдельных случаях наблюдалась картина генерализации воспаления с тотальным поражением большеберцовой кости. Кость на всем протяжении была узурирована, участки остеосклероза чередовались с участками разрежения, был выражен периостит (4 Б).

А Б
Рис. 4. Рентгенограмма голени на 180-е сутки моделирования
хронического остеомиелита. Деструкции костной ткани (1), периостит (2).
При морфологическом исследовании в зонах бывших дефектов формировался полиморфный регенерат, заполненный интенсивно развивающейся рыхлой неоформленной соединительной и ретикулофиброзной костной тканями, среди которых имелись фрагменты некротизированной кости – секвестры.
У всех животных, прооперированных по нашей методике, к 14-м суткам визуально, рентгенологически и морфологически наблюдались признаки хронического остеомиелита. Реактивные изменения в костной ткани развивались с образованием секвестров, полостей и деструктивных изменений.
Для радикального лечения хронического остеомиелита нами был разработан новый способ остеопластики с использованием аллогенной компактной костной ткани (Патент РФ на полезную модель № 41600 от 10.11.04). Суть его заключается в следующем. На 14-е сутки после моделирования остеомиелита производили разрез голени через свищ, по старому послеоперационному рубцу. Удаляли некротически изменённую кость, патологические грануляции, секвестры. Трапецивидной фрезой формировали "корытообразную" костную полость длиной 1,2 – 1,5 см. Кость обрабатывали до появления «кровяной росы», что являлось достоверным признаком ее жизнеспособности. Рану промывали 3% раствором перекиси водорода, 0,02% водным раствором хлоргексидина. Дефект кости заполняли 30% раствором линкомицина в котором проводили ультразвуковую кавитацию аппаратом УРСК-7Н в течение одной минуты с частотой 25 кГц (рис. 5 А).


А Б
Рис. 5. А - Аппарат УРСК-7Н, Б - Ультразвуковая камера «Pro-sonic assistant».
Далее проводили пластику костной полости мышцей на ножке или ДКИ «Лиопласт». Перед заполнением дефекта насыщали имплантат линкомицином в ультразвуковой камере «Pro-sonic assistant» «Branson» в течение 3 минут с частотой 40 кГц (рис 5 Б). Костная полость туго заполнялась имплантатом (рис. 6), рана послойно ушивалась.

Рис. 6. Костная полость заполнена ДКИ.
ДКИ «Лиопласт» обладает пористостью благодаря наличию балок и межбалочных пространств. Эта микроструктура создаёт возможность насыщения его различными препаратами, прежде всего антибактериальными, соответствующими чувствительности возбудителя гнойного процесса при хроническом остеомиелите. Насыщение имплантов антимикробными препаратами возможно путём простой регидратации и при помощи различных физических факторов, прежде всего низкочастотного ультразвука (Кириленко А.Г., 1999; Болонкин И.В., 2008; Беланов Г.Н. с соавт., 2010).
С целью проверки эффективности насыщения костного импланта изготовленного из компактной кости антибиотиком с помощью низкочастотного ультразвука было выполнено сравнительное бактериологическое исследование 32 образцов. 16 фрагментов ДКИ размерами 0,5 х 0,5 см насыщали 30% раствором линкомицина в ультразвуковой камере «Pro-sonic assistant» «Branson» в течение 3 минут с частотой 40 кГц, другие 16 фрагментов выдерживали в 30% растворе линкомицина без озвучивания. После обработки фрагменты ДКТ промывали в проточной воде в течение 15 мин для исключения из них антибиотика, не вошедшего в структуру костной ткани, затем помещались во флаконы с физраствором. Обработанный таким образом материал изучали на антибактериальную активность косвенным методом, с помощью прямого посева имплантов на питательные среды с кровяным сахарным агаром, предварительно засеянные микроорганизмами Staphylococcus aureus. На чашках Петри исследуемый материал размещали секторами и инкубировали в течении 48 часов при температуре 37 С. Проводили исследование на 3, 7, 14, 30 сутки с момента насыщения – измеряли диаметр зоны отсутствия роста микроорганизмов вокруг фрагмента ДКТ. Таким образом установлено, что структурные особенности и технология производства имплантов обеспечивают возможность насыщать их антимикробными препаратами соответствующим чувствительности возбудителя. Антимикробный эффект импланта, насыщенного антибиотиком с помощью ультразвука, сохраняется не менее 30 дней (рис. 7, табл. 2).

Рис. 7. Зона отсутствия роста микрофлоры на 30-е сутки вокруг импланта, озвученного в растворе линкомицина (слева), рост микрофлоры вокруг импланта выдержанного в растворе (справа).
Таблица 2.
Размеры зон отсутствия роста микроорганизмов (в сантиметрах)
| 3суток | 7суток | 14 суток | 30 суток | ||||
| озвуч. | неозв. | озвуч. | неозв. | озвуч. | неозв. | озвуч. | неозв. |
| 4,0 | 3,8 | 3,6 | 3,5 | 3,6 | 3,0 | 3,6 | 0 |
| 3,6 | 3,5 | 3,6 | 3,5 | 3,4 | 2,7 | 3,5 | 0 |
| 3,8 | 3,9 | 3,5 | 3,6 | 3,7 | 2,0 | 3,8 | 0 |
| 3,5 | 4,6 | 3,6 | 3,6 | 3,8 | 2,4 | 3,6 | 0 |
На 14-е сутки после некрсеквестрэктомии и пластики дефекта мышцей на ножке определялась костная полость заполненная волокнами поперечнополосатой мышцы, рыхлой неоформленной соединительной тканью. Прилежащие к месту повреждения поперечнополосатые скелетные мышечные волокна находились в различном состоянии. В основном это были участки, сохранившие структурные признаки жизнеспособности, в межуточных пространствах которых имелись расширенные капилляры. В других участках, близких к повреждению, наблюдались деструктивные изменения: явления межуточного отека и фрагментации волокон. Некоторые волокна были лишены ядер, пространство между волокнами было заполнено хорошо васкуляризированной рыхлой неоформленной соединительной тканью.
На 14-е сутки после проведения некрсеквестрэктомии и пластики образовавшегося дефекта аллогенной ДКТ в прилежащих к месту дефекта участках кости наблюдали гомогенизацию тканей, склероз гаверсовых каналов. В образовавшейся полости определялись фрагменты ДКТ, имеющие структурную организацию пластинчатой костной ткани (рис. 8).

Рис. 8. Микрофотография. Ретикулофиброзная костная ткань (1), фрагмент ДКТ (2), рыхлая соединительная ткань (3) в области пластики дефекта. 14-е сутки после пластики ДКТ. Окраска гематоксилином и эозином. Увеличение 70.

Рис. 9. Микрофотография. Остеобласты (1) и остеокласты (2) в зоне регенерата. 14-е сутки после пластики ДКТ. Окраска гематоксилином и эозином. Увеличение 400.
Характерной чертой являлось наличие в зоне пластики большого количества тканевых макрофагов и остеокластов, интенсивно рассасывающих пересаженный материал и резорбирующих продукты лизиса.
Они имели вид крупных полиморфных клеток с темной цитоплазмой, содержащих два и более базофильных ядра, которые располагались в непосредственной близости от имплантата (фибробласты) и в нем самом (остеокласты) (рис. 9).
При морфометрическом исследовании измеряли процентное соотношение площади костной и соединительной тканей, площадь просвета сосудов. Все вышеуказанные показатели измерялись при моделировании остеомиелита, и затем через 14, 30, 90, и 180 суток после операции. Полученные результаты были статистически обработаны.
При сформированной модели остеомиелита, а также на 14-е сутки эксперимента в месте операции отмечалось статистически значимое уменьшение площади костной ткани в обеих сериях. К 30-м суткам в контрольной группе сохранялось значимое снижение площади костной ткани на 5,18% от нормального, в то время как в основной группе этот показатель приблизился к контрольному значению. В отдаленные послеоперационные сроки (90 и 180 суток) в обеих группах колебания объемной доли костной ткани в процентах были в пределах нормы (табл. 3).
Таблица 3
Динамика изменения объёмной доли костной ткани в зоне регенерата (%) (значения X ± при p < 0,05).
| Срок выведения животных из эксперимента | Серия № I – пластика собственной мышцей | Серия № II – пластика аллогенной ДКТ |
| Модель остеомиелита | 60,97±1,87 | 61,58±1,57 |
| 14 суток | 61,73±1,49 | 63,35±1,73 |
| 30 суток | 65,91±1,24 | 67,8±1,77 |
| 90 суток | 69,25±1,3 | 70,97±1,27 |
| 180 суток | 70,71±1,01 | 72,14±1,02 |
| Контроль | 71,09±0,55 | |
Измерение площади сосудов кроликов в зоне вмешательства выявило статистически значимое увеличение их просвета в обеих группах на ранних сроках эксперимента (модель остеомиелита, 14-е и 30-е сутки) (табл. 4).
Таблица 4
Динамика изменения объёмной доли микроциркуляторного русла в зоне регенерата (%) (значения X ± при p < 0,05)
| Срок выведения животных из эксперимента | Серия № I – пластика собственной мышцей | Серия № II – пластика аллогенным ДКТ |
| Модель остеомиелита | 334,87±14,5 | 330,57±14,5 |
| 14 суток | 326,72±10,97 | 319,77±12,65 |
| 30 суток | 268,01±12,51 | 250,13±8,33 |
| 90 суток | 214,85±6,52 | 202,27±4,44 |
| 180 суток | 205,12±5,64 | 203,85±5,06 |
| Контроль | 203,52±1,25 | |
Проведя оценку метаболизма коллагена, мы обнаружили, что уровень свободного оксипролина статистически значимо повышается выше нормы при сформированной модели остеомиелита и на 14-е сутки в обеих группах, в то время как на всех остальных сроках эксперимента значимых отличий от нормы не выявлено. Изучение динамики колебаний уровня белковосвязанного оксипролина позволило выявить значимое снижение его показателей на ранних сроках эксперимента (модель остеомиелита, 14-е сутки после операции) в обеих опытных сериях по сравнению с контролем. К 30-м суткам его уровень приближается к нормальному значению также в обеих сериях опытов (табл. 5).
Таблица 5
Динамика изменений уровня белковосвязанного оксипролина в периферической крови кроликов (мкмоль/л) (значения X ± при p < 0,05)
| Срок выведения животных из эксперимента | Серия № I – пластика собственной мышцей | Серия № II – пластика аллогенной ДКТ |
| Модель остеомиелита | 97,08±1,97 | 97,66±2,05 |
| 14 суток | 105,1±2,26 | 112,4±2,23 |
| 30 суток | 129,61±3,87 | 138,76±3,94 |
| 90 суток | 133,64±4,19 | 136,27±3,82 |
| 180 суток | 141,38±7,84 | 140,38±7,84 |
| Контроль | 140,01±4,42 | |
При изучении фагоцитарной активности лейкоцитов (ФАЛ) крови кроликов при остеомиелите отмечается снижение этого показателя в обеих опытных сериях, в то время как на 14-е и 30-е сутки обнаружено его значимое повышение в серии с пластикой ДКИ на 15,17 и 9,77% соответственно. На дальнейших сроках значения ФАЛ приближаются к норме в обеих опытных группах (табл. 6).
Таблица 6
Динамика изменений ФАЛ в периферической крови кроликов (%) (значения X ± при p < 0,05)
| Срок выведения животных из эксперимента | Серия № I – пластика собственной мышцей | Серия № II – пластика аллогенной ДКТ |
| Модель остеомиелита | 39,75±1,39 | 39,21±1,1 |
| 14 суток | 60,75±1,39 | 69,46±1,17 |
| 30 суток | 56,44±1,46 | 64,06±1,42 |
| 90 суток | 53,67±2,21 | 55,75±2,44 |
| 180 суток | 52,83±2,36 | 57,33±2,92 |
| Контроль | 54,29±1,49 | |
Полученные экспериментальные данные свидетельствуют о выраженных остеорепаративных свойствах аллогенного ДКИ. При пластике послеоперационной костной полости биоимплантатом происходит активное купирование воспалительного процесса в кости, постепенная его биодеградация с замещением ретикулофиброзной, а затем пластинчатой костной тканью.
Выводы
1. Усовершенствованная нами экспериментальная модель в 100% случаев вызывает хронический остеомиелит у кроликов, существенно снижает вероятность развития патологических переломов, удобна для разработки новых способов остеопластики.
2. Новый способ остеопластики, разработанный в эксперименте, заключается в заполнении костной полости аллогенным деминерализованным имплантатом, изготовленным по технологии «Лиопласт» и насыщенным антибиотиком с помощью низкочастотного ультразвука с частотой 25 кГц. Данный способ является альтернативой мышечной пластике.
3. Важными этапами оперативного лечения являются ультразвуковая кавитация костной полости и насыщение импланта антибиотиком с помощью низкочастотного ультразвука с частотой 25 кГц. Продолжительность антимикробной активности импланта проявляется более 30 дней.
4. Процессы репаративной регенерации при пластике костной полости аллогенным деминерализованным костным имплантатом характеризуются выраженной активностью. По данным морфометрии, к 30-м суткам после операции площадь костной ткани приближается к нормальному значению, в то время как после пластики мышцей на ножке сохраняется значимое снижение этого показателя на 5,18% от нормального. Восстановление костной ткани после пластики деминерализованным костным имплантатом, по данным рентгенографии, происходит к 90-м суткам, а при пластике мышцей на ножке к 180-м суткам.
5. Для аллогенного деминерализованного костного имплантата характерна высокая скорость рассасывания, за счёт активной его резорбции макрофагами и остеокластами, что подтверждается повышением фагоцитарной активности лейкоцитов на 14-е сутки на 15,17% по сравнению с нормой. Фрагмент мышцы, перемещённый в костную полость, замещается рыхлой неоформленной соединительной тканью к 30-м суткам.
Практические рекомендации
- Усовершенствованная экспериментальная модель хронического остеомиелита перспективна и удобна для изучения процессов, протекающих в костной ткани при данной патологии.
- Аллогенный деминерализованный костный имплантат серии «Лиопласт» оптимален для пластики послеоперационных дефектов длинных трубчатых костей и может быть рекомендован для проведения клинических испытаний при хроническом остеомиелите.
- Для повышения эффекта лечения можно рекомендовать использование низкочастотного ультразвука для санации патологического очага и насыщения имплантата и кости антибактериальным средством, соответствующим чувствительности возбудителя.
- Для оценки регенераторных процессов в костной и соединительной тканях в клинике и эксперименте целесообразно проводить количественное определение свободного и белковосвязанного оксипролина сыворотки крови.
Список работ, опубликованных по теме диссертации
- Столяров Е.А., Батаков Е.А., Ладонин С.В., Ишутов И.В., Д.Г. Алексеев. Экспериментальное использование костного биотрансплантата для пластики костной полости при хроническом остеомиелите длинных трубчатых костей // XIV научные чтения памяти академика Н.Н. Бурденко «Актуальные вопросы современной клинической медицины». Материалы областной научно-практической конференции. – Пенза. – 2004. – С. 331.
- Столяров Е.А., Батаков Е.А., Ладонин С.В., Пак А.А., Ишутов И.В. Применение биотрансплантата для пластики костной полости при хроническом остеомиелите в эксперименте // Российский научно-практический журнал «Скорая медицинская помощь», Том 5, № 3, 2004. Материалы научно-практической конференции хирургов Российской Федерации «Сложные и нерешенные вопросы диагностики и лечения острого аппендицита, острой кишечной непроходимости и сочетанной травмы». - Санкт-Петербург. – 2004. – С.255-256.
- Столяров Е.А., Батаков Е.А., Ладонин С.В., Ишутов И.В. Применение биотрансплантата при хроническом остеомиелите в эксперименте // Материалы II Всероссийского симпозиума с международным участием «Клинические и фундаментальные аспекты тканевой терапии. Теория и практика клеточных биотехнологий». – Самара. – 2004. – С. 50-51.
- Столяров Е.А., Батаков Е.А., Ладонин С.В., Ишутов И.В. Применение костного биотрансплантата при хроническом остеомиелите длинных трубчатых костей в эксперименте // Материалы конференции «Современные аспекты экспериментальной и клинической хирургии». Вестник РГМУ, - 2004, - № 8, - 289-291.
- Алексеев Д.Г., Ладонин С.В., Ишутов И.В. Использование аллогенного костного биотрансплантата при хроническом остеомиелите длинных трубчатых костей в эксперименте // Сборник статей по материалам пятого конгресса молодых ученых и специалистов «Науки о человеке». – Томск. – 2004. – С. 157.
- Алексеев Д.Г., Батаков В.Е., Ладонин С.В., Ишутов И.В. Экспериментальная модель остеомиелита // Сборник материалов Всероссийской конференции молодых исследователей «Физиология и медицина». – Журнал «Вестник молодых ученых». – Санкт-Петербург. – 2005. – С. 48.
- Алексеев Д.Г., Батаков В.Е., Ладонин С.В., Ишутов И.В. Усовершенствование модели экспериментального остеомиелита // Тезисы докладов X Всероссийской научно-практической конференции «Молодые ученые в медицине». – Казань. – 2005. – С. 249-250.
- Алексеев Д.Г., Батаков В.Е., Ладонин С.В., Ишутов И.В. Усовершенствование модели остеомиелита // Сборник материалов итоговой Республиканской конференции студентов и молодых ученых с международным участием «Вопросы теоретической и практической медицины». – Уфа. – 2005. – С. 103-104.
- Столяров Е.А., Батаков Е.А., Алексеев Д.Г., Ладонин С.В., Ишутов И.В. Усовершенствование экспериментальной модели хронического остеомиелита // Материалы II Всероссийской конференции хирургов памяти В. Ф. Войно-Ясенецкого «Актуальные вопросы гнойно-септической хирургии». – Красноярск. – 2005. – С. 290-292.
- Столяров Е.А., Батаков Е.А., Алексеев Д.Г., Ладонин С.В., Ишутов И.В. Моделирование остеомиелита в эксперименте // Международный морфологический журнал «Морфологические ведомости». - 2005. – № 1-2. – Москва-Берлин. Материалы конференции «Сахарный диабет и его осложнения (морфология, патогенез, клиника)». – С.233-234.
- Столяров Е.А., Батаков Е.А., Алексеев Д.Г., Ладонин С.В., Ишутов И.В. Изучение регенерации костной ткани при применении аллогенного биотрансплантата в эксперименте // Материалы Первого съезда травматологов-ортопедов Уральского федерального округа «Высокие технологии в травматологии и ортопедии: организация, диагностика, лечение, реабилитация, образование». - Екатеринбург. – 2005. – С.357-358.
- Столяров Е.А., Батаков Е.А., Ладонин С.В., Ишутов И.В., Кириченко А.А., Батаков В.Е. Обоснование выполнения костной биотрансплантации в лечении хронического остеомиелита в эксперименте // Травматология и ортопедия ХХI века: сборник тезисов докладов VIII съезда травматологов России: В 2 томах. Том II. – Самара. – 2006. – С. 1091-1092.
- Столяров Е.А., Батаков Е.А., Ладонин С.В., Ишутов И.В., Батаков В.Е. Экспериментальное обоснование применения аллогенного остеоматрикса в лечении хронического остеомиелита // Сборник материалов международной конференции «Новые технологии в военно-полевой хирургии и хирургии повреждений мирного времени». – Санкт-Петербург. – 2006. – С. 313-314.
- Столяров Е.А., Батаков Е.А., Алексеев Д.Г., Ладонин С.В., Ишутов И.В., Батаков В.Е. Использование аллокости при экспериментальном остеомиелите // Сборник материалов 42-й научно-практической межрегиональной конференции врачей. – Ульяновск. – 2007. – С. 307-308.
- Столяров Е.А., Батаков Е.А., Алексеев Д.Г., Ладонин С.В., Ишутов И.В., Батаков В.Е. Экспериментальное обоснование применения аллогенного остеоматрикса в лечении хронического остеомиелита длинных трубчатых костей // Сборник научных трудов «Ургентная и реконструктивно-восстановительная хирургия».- Самара. – 2007. – Вып. 3. -С. 256-258.
- Ладонин С.В. Аллоостеопластика в комплексном лечении хронического остеомиелита // Сборник материалов региональной конференции дипломированных специалистов «Молодые ученые - медицине», Аспирантские чтения. – 2009. – С. 40-42.
- Волова Л.Т., Ладонин С.В., Белозерцева Е.А. Экспериментальное обоснование использования аллогенного деминерализованного костного имплантата (ДКИ) в комплексном лечении хронического остеомиелита // Материалы IV Всероссийского симпозиума «Актуальные вопросы тканевой и клеточной» трансплантологии». – Санкт-Петербург. – 2010. – С. 85-86.
- Сонис А.Г., Алексеев Д.Г., Ладонин С.В., Белозерцева Е.А., Вовк Е.А. Моделирование хронического остеомиелита // Вестник экспериментальной и клинической хирургии. – 2011. – Т. IV, № 2. – С. 344-348.
- Ладонин С.В., Белозерцева Е.А. Экспериментальное обоснование использования аллогенного деминерализованного костного имплантата в комплексном лечении хронического остеомиелита // Международный морфологический журнал «Морфологические ведомости». - 2011. – № 1. С. 101-107.
- Ладонин С.В. Особенности репаративного остеогенеза при экспериментальном хроническом остеомиелите после пластики костной полости деминерализованным костным имплантатом // Журнал «Врач-аспирант». – 2011. - № 2.4(45). С. 586-592.
- Махова А.Н., Ладонин С.В., Вовк Е.А., Ишутов И.В. Аллогенный деминерализованный костный имплантат в лечении хронического остеомиелита (экспериментальное исследование) // Материалы научно-практической конференции «Илизаровские чтения». – Курган. – 2011. – с. 222.
Авторские свидетельства, патенты:
Патент РФ на полезную модель № 41600 от 10.11.2004 «Деминерализованный костный трансплантат для замещения костных полостей при лечении посттравматического остеомиелита» / Столяров Е.А., Батаков Е.А., Ладонин С.В., Ишутов И.В.; Самарский государственный медицинский университет. Заявка № 2004119725 от 10.11.2004; приоритет от 29.06.2004. (Россия). Опубликовано 10.11.2004. Бюллетень № 4.
Рационализаторские предложения
Батаков Е.А., Ладонин И.В., Ишутов И.В. Усовершенствование модели хронического остеомиелита. Удостоверение на рационализаторское предложение № 414 от 29.06.04 г., выданное Самарским государственным медицинским университетом.
Подписано в печать 01.07.2011 г.
Формат 6080/16. Объем 1 усл. печ. л. Тираж 100 экз.
Бумага офсетная. Печать оперативная. Заказ № 1576.
Отпечатано в типографии Клиник ГБОУ ВПО
СамГМУ Минздравсоцразвития России
443079, г. Самара, пр. Карла Маркса, 165 «Б»
Тел. 276-77-84

