Возможности коррекции дефицита антитромбина iii в терапии синдрома диссеминированного внутрисосудистого свертывания крови
На правах рукописи
Непорада Елена Леонидовна
ВОЗМОЖНОСТИ КОРРЕКЦИИ ДЕФИЦИТА АНТИТРОМБИНА III
В ТЕРАПИИ СИНДРОМА ДИССЕМИНИРОВАННОГО ВНУТРИСОСУДИСТОГО СВЕРТЫВАНИЯ КРОВИ
14.00.05 – внутренние болезни
14.00.37 – анестезиология и реаниматология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Архангельск - 2008
Работа выполнена в ГОУ ВПО «Северный государственный медицинский университет (г. Архангельск) Федерального агентства по здравоохранению и социальному развитию»
Научный руководитель:
доктор медицинских наук, доцент Воробьева Надежда Александровна
Официальные оппоненты:
доктор медицинских наук, профессор Миролюбова Ольга Алексеевна
доктор медицинских наук, профессор Саввина Ирина Александровна
Ведущая организация:
ГОУ ВПО «Алтайский государственный медицинский университет (г. Барнаул) Федерального агентства по здравоохранению и социальному развитию»
Защита диссертации состоится «9» декабря 2008 г. В «____» часов на заседании Диссертационного Совета Д. 208.004.02 Северного государственного медицинского университета по адресу: 163000, г. Архангельск, Троицкий проспект, 51.
С диссертацией можно ознакомиться в научной библиотеке ГОУ ВПО «Северный государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию», (163000, г. Архангельск, Троицкий проспект, 51).
Автореферат разослан «__» ноября 2008 г.
Ученый секретарь диссертационного совета:
доктор медицинских наук, профессор Л. В. Титова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования:
Диссеминированное внутрисосудистое свертывание (ДВС) крови является одной из наиболее частых форм клинической патологии, уносящей жизни многих людей. Установлено, что ДВС, будучи неспецифическим синдромом, развивается при многих заболеваниях, встречающихся в клинике внутренних болезней, при всех терминальных состояниях, шоках, деструктивных процессах в органах и тканях, в том числе при инфаркте миокарда, пневмонии, сепсисе, травмах, всех видах гемолиза, лейкозах, других злокачественных новообразованиях и др. Знание природы ДВС-синдрома, клинических проявлений данной патологии, терапевтических подходов к лечению необходимы врачам всех специальностей в повседневной практике [Воробьев П. А., 2004]. Высокая частота ДВС-синдрома среди госпитализированных пациентов с различными видами патологии (по данным разных авторов 10-34% [Воробьева Н. А., 2006, Bakhtiari K., 2004; Cauchie P., 2006;]), и высокий уровень летальности (30-76% [Баркаган З. С., 1989; Spero J. A., 1980]) обуславливает поиск более эффективных методов лекарственной терапии ДВС-синдрома.
Ключевым механизмом развития ДВС-синдрома является нарушение баланса между свертывающей, противосвертывающей и фибринолитической системами крови в сторону преобладания процессов тромбообразования на фоне истощения антикоагулянтных, а затем и коагуляционных факторов. При ДВС-синдроме уже в первой стадии наблюдается значимое снижение уровня основного антикоагулянта – антитромбина III (АТ III) [Levi M., 1997; Seitz R., 1989; Fourrier F., 1992], без которого невозможно нормальное функционирование естественных механизмов антикоагулянтной системы, что снижает эффективность терапии как нефракционированными, так и низкомолекулярными гепаринами [Matsuo T., 1997; Kuhle S., 2006]. В связи с этим устранение дефицита АТ III с целью восстановления естественных антикоагулянтных механизмов и оптимизации антикоагулянтной терапии может являться одним из важных направлений лекарственной терапии ДВС-синдрома.
Традиционно в нашей стране для восстановления баланса факторов системы гемостаза при ДВС-синдроме с начала 1970-х годов применяется свежезамороженная плазма (СЗП) [Баркаган З. С., 1989]. Однако данный вид терапии, при использовании его с целью устранения дефицита АТ III и других естественных антикоагулянтов имеет существенные недостатки. Так, эффективность трансфузии СЗП малопредсказуема, ввиду того, что активность АТ III в плазме доноров изначально не определяется [Воробьева Н. А., 2006].
К тому же при длительных сроках хранения и медленном размораживании СЗП без соблюдения температурного режима возможны значительные изменения активности факторов свертывания в донорской плазме [Isaacs M. S., 2004]. Для коррекции нарушений в системе коагуляции обычно требуются большие объемы плазмы [Hambleton J., 2002], и гиперволемия, сопровождающая трансфузию СЗП, может значительно ограничить ее применение [Popovsky M. A., 2001; Palfi M., 2001; Mueller M. M., 2002; Looney M. R., 2004]. Кроме того, существуют данные, что у пациентов, находящихся в критических состояниях, трансфузия СЗП вызывает легочную дисфункцию с развитием острого повреждения легких и даже острого респираторного дистресс-синдрома [Popovsky M. A., 2001; Palfi M., 2001; Gajic O., 2006; Dara S. I., 2005; Khan H., 2007]. И, наконец, расходование АТ III при ДВС-синдроме может потребовать повторных трансфузий СЗП в течение нескольких суток, что приводит к сенсибилизации иммунной системы, повышению риска аллергических реакций [Sandler S. G., 1995; Reutter J. C., 2001; MacLennan S., 2006] и передачи таких инфекций, как гепатит В, С, ВИЧ-инфекции и др. [Воробьев А. И., 2001; Bochicchio G. V., 2008; O'Shaughnessy D. F., 2004].
В настоящее время концентрат АТ III как стандартизированный источник данного антикоагулянта получил заслуженное внимание в мировой медицине как потенциальное лечебное средство в терапии врожденных и приобретенных состояний, сопровождающихся его дефицитом. В клинических и экспериментальных исследованиях у пациентов с дефицитом АТ III установлено, что концентрат АТ III способен восстанавливать уровень циркулирующего АТ III до нормальных значений [Bucur S. Z., 1998]. Однако в литературе существуют противоречивые сведения о влиянии данного препарата на исход при сепсисе и ДВС-синдроме [Warren B. L., 2001; Kienast J., 2006]. Кроме того, в доступной нам литературе мы не встретили работ, посвященных сравнительной эффективности и безопасности концентрата АТ III и СЗП в терапии ДВС. Это обусловило наш интерес к проблеме коррекции дефицита АТ III при ДВС, определило цель и задачи нашего исследования.
Цель исследования
– оптимизация лекарственной терапии диссеминированного внутрисосудистого свертывания крови путем коррекции дефицита антикоагулянтного звена системы гемостаза.
Задачи исследования:
- Изучить распространенность синдрома диссеминированного внутрисосудистого свертывания крови с использованием диагностической шкалы JAAM DIC у больных с синдромом системного воспалительного ответа (ССВО)
- Изучить распространенность дефицита антитромбина III при диссеминированном внутрисосудистом свертывании крови и синдроме системной воспалительной реакции и оценить его диагностическую значимость
- Оценить влияние различных режимов коррекции дефицита антитромбина III на лабораторные показатели системы гемостаза при синдроме диссеминированного внутрисосудистого свертывания крови
- Определить влияние длительного хранения донорской свежезамороженной плазмы при карантинизации на активность антитромбина III непосредственно перед ее применением
Научная новизна:
Показана распространенность ДВС-синдрома [27% (95% ДИ 19,5; 34,5)] и дефицита антитромбина III [76% (95% ДИ 69; 83)] при синдроме системного воспалительного ответа различного генеза, в том числе при пневмонии [27% (95% ДИ 9,9; 44,1) и 88,5% (95% ДИ 76; 100), соответственно] у пациентов отделения интенсивной терапии.
Выявлена значимая связь между активностью антитромбина III, показателем международного нормализованного отношения (МНО) и количеством тромбоцитов, на основании чего построены регрессионные модели прогнозирования активности антитромбина III при ДВС-синдроме (АТ III= 59,3 + 0,054 х количество тромбоцитов – 12,7 х МНО) и синдроме системного воспалительного ответа (АТ III = 70,1 + 0,05 х количество тромбоцитов – 11,7 х МНО).
Впервые продемонстрирована более высокая эффективность низких доз концентрата антитромбина III по сравнению с донорской свежезамороженной плазмой в отношении коррекции дефицита антитромбина III у пациентов с ДВС-синдромом.
Впервые выявлена связь между активностью антитромбина III в донорской плазме и количеством предыдущих заборов крови у доноров.
Практическая значимость работы и внедрение результатов
Внедрение результатов исследования в клиническую практику способствует решению важной междисциплинарной задачи – оптимизации антикоагулянтной терапии ДВС-синдрома. Исследована частота ДВС-синдрома при синдроме системного воспалительного ответа различного генеза, включая тяжелые пневмонии, у пациентов отделения интенсивной терапии многопрофильного стационара.
Предложены регрессионные модели прогнозирования активности антитромбина III у пациентов с ДВС-синдромом и синдромом системного воспалительного ответа.
Предложен метод оптимизации антикоагулянтной терапии ДВС-синдрома с использованием низких доз концентрата АТ III.
Выявленные изменения активности АТ III у доноров плазмы обусловливают необходимость обследования доноров на исходное состояние антикоагулянтной системы гемостаза.
Научно-практические разработки диссертации внедрены в практическую деятельность отделений интенсивной терапии различных лечебных учреждений г. Архангельска (акт внедрения в лечебный процесс от 25.09.2008). Результаты исследования широко используются в научно-педагогическом процессе на лечебном, педиатрическом факультетах и факультете постдипломного образования и усовершенствования врачей, (акт внедрения в учебный процесс от 2.10.2008).
Основные положения, выносимые на защиту
- Дефицит активности антитромбина III ниже 50% у пациентов с синдромом системного воспалительного ответа увеличивает шансы присутствия синдрома диссеминированного внутрисосудистого свертывания крови в 3,5 (95% ДИ 1,2; 10,4) раза.
- Применение низких доз концентрата антитромбина III по сравнению с донорской свежезамороженной плазмой и комбинированной терапией позволяет более эффективно корригировать дефицит антитромбина III у пациентов с синдромом диссеминированного внутрисосудистого свертывания крови.
- Длительное хранение, замораживание и размораживание донорской свежезамороженной плазмы приводит к снижению активности антитромбина III, которое следует учитывать при использовании свежезамороженной плазмы с целью возмещения дефицита антикоагулянтной системы.
Апробация работы:
Материалы диссертации доложены и обсуждены на следующих конференциях: I научно-практическая конференция "Проблемные вопросы медицины критических состояний" - "Болдинские чтения", г. Болдино, 24-25 августа 2006 г.; Х Всероссийский конгресс анестезиологов и реаниматологов, г. Санкт-Петербург, 19-22 сентября 2006 г.; Научная конференция студентов и молодых ученых с международным участием, г. Архангельск, 20 апреля 2007 г.; II Беломорский симпозиум, Всероссийская конференция с международным участием, г. Архангельск, 28-29 июня 2007 г.; XXI конгресс Международного общества тромбоза и гемостаза, г. Женева, 6-12 июля 2007 г.; IV Съезд анестезиологов и реаниматологов Северо-запада России, г. Санкт-Петербург, 8-10 октября 2007 г.; Научная сессия СГМУ и Северного Научного Центра Северо-Западного РАМН, XXXV Ломоносовские чтения, г. Архангельск, 16-18 ноября 2007 г.; I Архангельская международная медицинская конференция студентов и молодых ученых, г. Архангельск, 16-17 мая 2008 г.; IV Европейский конгресс анестезиологов “Euroanaesthesia 2008”, Копенгаген, 31 мая – июня 2008 г.; ХI Всероссийский конгресс анестезиологов и реаниматологов, Санкт-Петербург, 23-26 сентября 2008 г.
По материалам диссертации опубликовано 14 печатных работ в отечественной и зарубежной медицинской литературе, из них 4 в изданиях, рекомендованных ВАК Министерства образования и науки РФ.
Объем и структура диссертации:
Диссертация изложена на 111 страницах машинописного текста и состоит из введения, четырех глав, заключения, выводов, практических рекомендаций, списка литературы и списка сокращений, содержит 19 таблиц, 16 рисунков. Список литературы включает 167 источника, из них 12 отечественных и 155 иностранных авторов.
Материалы и методы исследования:
Работа основывалась на проспективном рандомизированном клиническом исследовании различных видов коррекции дефицита АТ III при ДВС-синдроме; ретроспективном исследовании распространенности дефицита АТ III и ДВС-синдрома на фоне ССВО у пациентов отделения интенсивной терапии; изучении функциональной активности АТ III в донорской плазме.
Проспективная часть работы проводилась на базе отделения интенсивной терапии ГКБ СМП №1 г. Архангельска в период с марта 2006 по май 2008 гг. и включала 43 пациента с дефицитом активности АТ III ниже 70% и присутствием ДВС-синдрома по диагностической шкале DIC JAAM, включающей оценку выраженности ССВО, количества тромбоцитов, уровня МНО и продуктов деградации фибрина (ПДФ) [Gando S., 2006].
В качестве критериев включения пациентов в исследование были взяты: информированное согласие пациента или его представителя; установленный диагноз ДВС-синдрома по критериям диагностической шкалы JAAM DIC; снижение активности АТ III ниже 70%; возраст пациентов от 16 до 75 лет включительно; масса тела пациентов от 60 до 100 кг включительно.
Были использованы следующие критерии исключения пациентов из исследования: отказ от участия в исследовании; тромбоцитопения менее 60х109/л; злокачественные заболевания крови; продолжающееся кровотечение; применение лекарственных препаратов из групп ингибиторов фибринолиза, витамина К, протамина сульфата, и других гемостатических препаратов.
Пациенты были случайно с использованием метода конвертов распределены в три группы терапии: группа А – терапии концентратом АТ III (n=15); группа В – терапии СЗП (n=15); группа С – комбинированной терапии концентратом АТ III и СЗП (n=13) (табл. 1).
Таблица 1
Характеристика групп пациентов по основной патологии
| Основная патология | Группа А (n=15) | Группа В (n=15) | Группа С (n=13) | |||
| абс | % | абс | % | абс | % | |
| Внебольничная и нозокомиальная пневмония | 5 | 33,3 | 4 | 26,7 | 1 | 7,7 |
| Деструктивный панкреатит | 4 | 26,7 | 9 | 60,0 | 12 | 92,3 |
| Другое | 6 | 40,0 | 2 | 13,3 | 0 | 0,0 |
| Всего | 15 | 100,0 | 15 | 100,0 | 13 | 100,0 |
В группе А (табл. 1) сепсис отмечен у десяти пациентов (67%), из них у пяти пациентов – легочный сепсис на фоне тяжелой пневмонии, в трех случаях – абдоминальный сепсис, причиной которого являлся инфицированный деструктивный панкреатит, и два случая уросепсиса причиной которого служил острый пиелонефрит. Среди пациентов с легочным сепсисом в трех случаях наблюдалась двусторонняя пневмония, и в двух – правосторонняя пневмония. Диагноз внутрибольничной пневмонии был установлен у одного пациента. В трех случаях ДВС-синдром развился на фоне отравлений суррогатами алкоголя и в одном случае – гемолитическим ядом, в одном случае был обусловлен тромбозом крупных вен с массивной ТЭЛА и в одном случае развился на фоне неинфицированного деструктивного панкреатита. Шок присутствовал в семи случаях (47%), у пациентов с пневмонией – в четырех случаях (80%).
В группе В (табл. 1) у 53% пациентов (восемь случаев) ДВС-синдром развился на фоне сепсиса. У четырех пациентов наблюдалась тяжелая пневмония, в двух случаях – нозокомиальная, и у двух пациентов – внебольничная. У трех из четырех пациентов наблюдалась правосторонняя пневмония, и у одного пациента – двусторонняя. В четырех случаях ДВС-синдром развился у пациентов с абдоминальным сепсисом на фоне инфицированного деструктивного панкреатита. В 47% случаев не было выявлено инфекции: в пяти случаях ДВС-синдром развился на фоне неинфицированного панкреатита, в одном случае – на фоне отравления суррогатами алкоголя и у одного пациента вследствие массивной ТЭЛА. Шоковое состояние различного генеза наблюдалось у десяти пациентов (67%), среди пациентов с пневмонией - у трех пациентов (75%).
В группе С (табл. 1) сепсис наблюдался в 70% случаев (девять пациентов), из них у восьми пациентов – абдоминальный сепсис, причиной которого был инфицированный панкреатит, и у одного пациента – легочный сепсис на фоне нозокомиальной пневмонии. В 30% случаев (четыре пациента) наблюдалась неинфекционная причина ДВС-синдрома – неинфицированный панкреатит. Шок отмечен в пяти случаях (38%), у пациента с нозокомиальной пневмонией сепсис не осложнился развитием шока.
На момент включения в исследование между группами не было выявлено различий в частоте сепсиса, шока и тяжести состояния пациента по шкале АРАСНЕ II (2 = 0,90, p=0,64; 2 = 2,41, p=0,30; F=1,65, p=0,21, соответственно) (табл. 2).
Таблица 2
Характеристика групп по прогностической шкале APACHE II на момент включения в исследование
| Количество баллов АРАСНЕ II | Группа А (n=15) | Группа В (n=15) | Группа С (n=13) | |||
| абс | % | абс | % | абс | % | |
| 1-10 | 7 | 46,7 | 4 | 26,7 | 5 | 38,5 |
| 11-20 | 5 | 33,3 | 5 | 33,3 | 6 | 46,2 |
| 21-30 | 3 | 20,0 | 6 | 40,0 | 2 | 15,4 |
| Всего | 15 | 100,0 | 15 | 100,0 | 13 | 100,0 |
В группе А использовались низкие дозы концентрата АТ III (Baxter). В зависимости от исходной активности АТ III и массы тела пациента концентрат АТ III вводился в дозе 1000 МЕ или 500 МЕ. Концентрат АТ III вводился при помощи инфузомата со скоростью 150-300 МЕ/час не позднее 15 минут после приготовления раствора. В группе В трансфузия донорской СЗП выполнялась из расчета 10-15 мл/кг не позднее 15 минут после ее размораживания. В группе С выполнялось комбинированное введение препаратов в указанных дозах. В первую очередь выполнялась трансфузия СЗП, затем спустя два-три часа вводился концентрат АТ III.
В рамках исследования введение перечисленных препаратов производилось ежедневно в течение четырех суток: в день включения пациента в исследование и спустя 24, 48 и 72 часа. Ежедневно оценивалась активность АТ III в плазме пациентов, и в том случае, если она превышала уровень 70%, соответствующие препараты не вводились.
В качестве базисной антикоагулянтной терапии во всех трех группах терапии использовался нефракционированный гепарин (Bayer) в дозе 20 Ед/сутки подкожно через шесть часов или низкомолекулярный препарат надропарин (GlaxoSmithKline) в дозе 5700 Ед/сутки через двенадцать часов.
В течение всего периода исследования ежедневно оценивалось состояние системы гемостаза, а также показатели общего и биохимического статуса крови, газового состава и КЩС артериальной крови. Оценивалась частота геморрагических осложнений, аллергических реакций, трансфузионных конфликтов в ответ на введение исследуемых препаратов.
В случае возникновения перечисленных осложнений дальнейшее лечение согласно протоколу данного исследования прекращалась, и назначалась соответствующая корригирующая терапия. При развитии тяжелого кровотечения, прекращали терапию концентратом АТ III, антикоагулянтами и антиагрегантами, и назначалась гемостатическая терапия.
Эффективность терапии ДВС-синдрома оценивалась по динамике клинических и лабораторных признаков ДВС-синдрома, а также шкале JAAM DIC, тяжести общего состояния пациента по шкалам APACHE II, SOFA, показателям летальности на 30-е сутки, срокам нахождения в отделении интенсивной терапии и стационаре.
Протокол клинического исследования был одобрен локальным этическим комитетом Северного государственного медицинского университета (протокол № 01/5 от 11.10.2005).
В ретроспективную группу исследования была включена сплошная выборка пациентов (n=848), находившихся в отделении интенсивной терапии Первой городской клинической больницы скорой медицинской помощи (ГКБ СМП № 1) с января по октябрь 2007 г. включительно. Из общего числа пациентов в ретроспективную группу были включены пациенты (n=135) с наличием трех и более признаков ССВО как минимум в течение одних суток (средний возраст 50 (95% ДИ 48–53) лет, мужчин 63%) (рис. 1).
 |  | кровотечение травма отравление панкреатит другое сепсис абдоминальный пульмональный уросепсис |
Рис. 1. Распределение больных по этиологии синдрома системной воспалительной реакции и по источнику инфекции при сепсисе
В течение четырех суток с момента появления трех и более признаков ССВО пациенты оценивались на наличие ДВС-синдрома по шкале ДВС-синдрома JAAM DIC без учета уровня ПДФ.
Для оценки тяжести состояния пациенты оценивались по прогностической шкале АРАСНЕ II и шкале органной дисфункции SOFA. В данной группе фиксировались лабораторные биохимические, общеклинические показатели и основные показатели системы гемостаза, такие как уровень фибриногена, функциональная активность АТ III, активированное частичное тромбопластиновое время (АЧТВ), МНО, количество тромбоцитов. Оценивались сроки пребывания в отделении интенсивной терапии и в целом в стационаре, а также летальность на 30-е сутки с момента развития выраженного ССВО.
В группу доноров (n=151) для исследования функциональной активности АТ III в СЗП были включены доноры плазмы или крови (средний возраст 31 (95% ДИ 30-33) год, мужчин – 62%), обследовавшиеся при очередном заборе крови в областной станции переливания крови (ОСПК) г. Архангельск в мае 2007 года. У исследуемых доноров количество предыдущих плазмаферезов и заборов крови варьировало от 0 до 172 (рис. 2).

Рис. 2. Распределение количества предыдущих плазмаферезов и заборов крови
В исследуемой группе доноров кроме обязательных лабораторных исследований, выполняемых в соответствии с инструкцией по заготовке донорской плазмы и эритроцитарной массы, дополнительно забиралось пять миллилитров крови для определения исходной функциональной активности АТ III. Повторное определение активности АТ III в донорской плазме выполнялось после истечения периода карантинизации длительностью девять месяцев после размораживания плазмы. Повторное исследование донорской плазмы на активность АТ III выполнено в 79 пакетах СЗП.
В рамках клинического проспективного исследования проводилось развернутое обследование системы гемостаза. При гемостазиологическом исследовании использованы реактивы фирмы “Diagnostica Stago”, Франция. Исследование проведено на автоматическом коагулометре “STACompact” Diagnostica Stago, Франция.
- Методы лабораторного исследования сосудисто-тромбоцитарного компонента гемостаза:
- определение количества тромбоцитов с помощью фазовоконтрастного микроскопирования в камере Горяева с применением аммония оксалата [Ронин В. С., 1983] в модификации Б. Ф. Архипова и Л. П. Марамзиной (1984) и на автоматическом счетчике крови «Хоффман-ля-Рош», референтный показатель 150-350х109/л;
- экспресс-метод визуальной оценки агрегации тромбоцитов в богатой тромбоцитами плазме [Шитикова А.С., 1984] с использованием двух индукторов агрегации АДФ и адреналина в концентрации 0,5х10-4 М/л и 0,015% соответственно.
- Методы исследования коагуляционного гемостаза:
- общие коагуляционные тесты и методы, характеризующие систему контактной и фосфолипидной активации: активированное частичное тромбопластиновое время (АЧТВ) [Hattersley, 1966; Баркаган З. С., 1975], референтный показатель 30-42 сек.;
- тесты, характеризующие факторы протромбинового комплекса: международное нормализованное отношение (МНО) с Техпластином-ST c ISI 1,2; референтный показатель 0,8-1,1 ед
- методы оценки общего пути коагуляции крови:
– содержание фибриногена хронометрическим методом по Клаусу (1957) в цитратной, бедной тромбоцитами плазме, референтный показатель 2-4 г/л;
– тромбиновое время, референтный показатель 15-18 сек.;
- Определение маркеров внутрисосудистого свертывания крови и фибринолиза:
- качественное и полуколичественное определение ПДФ методом латексной агглютинации (FDP Plasma, Roche Diagnostics, Швейцария), референтный показатель < 2,5 мкг/мл;
- определение фибринолитической активности методом лизиса эуглобиновой фракции плазмы при стимуляции стрептокиназой [Gidron E, 1978] в модификации Лычева В. Г. и Дорохова А. Е. (1981), референтный показатель 75-85 сек.;
- Исследование физиологических антикоагулянтов:
- определение активности АТ III («Рош-Диагностика»), референтный показатель 85-115%.
Забор крови для исследования системы гемостаза осуществлялся согласно общепринятым правилам [Баркаган З. С. и Момот А. П., 1999] в стандартные гемостазиологические вакутейнеры «Vacuette» (Gneiner bio-one) объемом пять миллилитров с использованием стабилизатора 3,8% раствора цитрата натрия в отношении девять частей крови к одной части раствора [Козлов А. А, 2004]. Стабилизированную венозную кровь центрифугировали со скоростью 3000 об./мин в течение десяти минут. Лабораторные исследования системы гемостаза осуществляли в течение 30-60 минут с момента забора крови в вакутейнер [Козлов А. А, 2004]. Исследование системы гемостаза проводилось сотрудниками экспресс-лаборатории МУЗ «Первая городская клиническая больница» (врачи-лаборанты О. В. Турундаевская, Г. Н. Мельникова). Тест ПДФ выполнялся членами исследовательской группы.
Оценка газового состава артериальной крови и КЩС выполнялась на автоматическом газоанализаторе ABL 800 FLEX, Radiometer, Copenhagen. Биохимические показатели выполнялись на биохимическом фотометре Stat Fax 1904® PLUS.
Статистическая обработка результатов исследования
Статистическая обработка результатов выполнялась с использованием программного обеспечения SPSS 15.0, MedCalc.
Результаты тестов считались статистически значимыми при р0,05. При описании групп, внутригрупповых и межгрупповых различий данные представлены в виде средней и 95% доверительного интервала или в виде средней и стандартного отклонения (М±s). При описании переменных с ненормальным распределением данные представлены в виде медианы и межквартильного интервала. Межгрупповые различия в частоте встречаемости события представлены в виде отношения шансов (OR) с 95% доверительным интервалом.
Cравнения между двумя группами выполнялись с использованием t-теста для независимых выборок или U-теста Манна-Уитни в зависимости от характера распределения данных. Внутригрупповые сравнения выполнялись с применением парного t-теста, сравнение пропорций – при помощи теста 2 или точного теста Фишера с расчетом отношения шансов для четырехпольных таблиц.
Сравнения между тремя группами проводились при помощи One-Way ANOVA с применением Post-Hoc теста Бонферрони. Динамика показателей внутри групп в течение четырех суток оценивалась при помощи ANOVA для повторных измерений и Post-Hoc теста Бонферрони.
Для тестирования связи между двумя переменными с нормальным распределением выполнялся корреляционный анализ Пирсона. Для выявления независимой связи между параметрическими показателями использовался линейный регрессионный анализ. Для тестирования связи между показателями с различным распределением данных и бинарным показателем был использован логистический регрессионный анализ. Для определения чувствительности и специфичности дефицита активности АТ III для диагностики ДВС-синдрома использовался анализ ROC-кривой.
Результаты исследования и их обсуждение
В ретроспективной группе была использована шкала JAAM DIC без оценки уровня ПДФ. Известно, что повышение ПДФ свидетельствует о расщеплении фибриногена, фибрина-мономера и стабильного фибрина при системном тромбообразовании и фибринолизе [Boisclair M. D., 1990]. Данные маркеры являются полезным инструментом в диагностике тромбозов и ДВС-синдрома, на основании которых также определяется эффективность терапии [Koga S., 2004]. Тем не менее, на фоне сепсиса уровень ПДФ повышается более чем в 95% случаев [Voves C., 2006], что снижает значимость данного лабораторного теста для диагностики ДВС-синдрома. В связи с этим мы отказались от использования уровня ПДФ для диагностики ДВС-синдрома в нашем исследовании.
По данным ретроспективного исследования частота ДВС-синдрома на фоне ССВО составила 27% (95% ДИ 19,5; 34,5), у пациентов с тяжелой пневмонией – 27% (95% ДИ 9,9; 44,1). Результаты нашего исследования согласуются с данными других авторов, согласно которым ДВС-синдром при ССВО на фоне сепсиса развивается примерно у трети пациентов [Voves C., 2006; Ogura H, 2007].
Наше исследование продемонстрировало, что присутствие ДВС-синдрома обладает прогностическим значением у пациентов отделения интенсивной терапии и достоверно ухудшает исход. Так, летальность в течение 30 суток с момента развития выраженного ССВО в группе пациентов с ДВС-синдромом составила 50% (18/36 пациентов), в группе пациентов без ДВС-синдрома – 30% (30/99 пациентов), различия между группами статистически значимы (2=4,5, р=0,034). Ухудшение прогноза при развитии ДВС-синдрома также подтверждается другими исследованиями [Gando S., 2002; Cauchie P., 2006].
Данные нашего исследования свидетельствуют о высокой распространенности дефицита активности АТ III на фоне сепсиса и ССВО. Так, снижение активности АТ III ниже нормальных значений наблюдалось у 76% (95% ДИ 69; 83) пациентов ретроспективной группы, причем более часто дефицит АТ III отмечался у пациентов с сепсисом – в 90% (95% ДИ 82; 98) случаев, в то время как при отсутствии сепсиса – в 65% (95% ДИ 54; 76) (2=11,6; р=0,001). На фоне пневмонии снижение активности АТ III ниже 80% наблюдалось у 88,5% (95% ДИ 76; 100) пациентов, выраженный дефицит активности АТ III присутствовал у 35% (95% ДИ 17; 53).
Так, дефицит активности АТ III ниже 50% увеличивал шансы присутствия ДВС-синдрома в 3,5 (95% ДИ 1,2; 10,4) раза (табл. 3).
Таблица 3
Значение факторов, прогнозирующих ДВС-синдром
| Независимые переменные | Регрессионный коэффициент B | р | Отношение шансов (ОR) | 95 % ДИ для отношения шансов |
| Пол (женщины по сравнению с мужчинами) | 1,58 | 0,007* | 4,85 | 1,54; 15,30 |
| Дефицит активности АТ III ниже 50% | 1,26 | 0,022* | 3,52 | 1,20; 10,4 |
| Фибринолиз, (с) | -0,02а | 0,049* | 0,98 | 0,96; 1,00 |
* Факторы, значимые на уровне 0,05.
а Отрицательный регрессионный коэффициент свидетельствует о снижении шансов развития ДВС-синдрома при увеличении соответствующей независимой переменной
Если в проспективной группе была выявлена лишь тенденция к существованию зависимости между активностью АТ III и оценкой по шкале JAAM DIC, то в ретроспективной группе было продемонстрировано, что дефицит АТ III ниже 50% является независимым фактором, связанным с ДВС-синдромом (В=1,26; р=0,022) (табл. 3).
Кроме дефицита активности АТ III в число независимых факторов, связанных с ДВС-синдромом, также вошли активность фибринолиза и пол пациентов. Если в отношении активности фибринолиза и дефицита АТ III данные нашего исследования согласуются с результатами других исследований [Levi M., 2003; Sivula M., 2005; Wiedermann C. J., 2006], то увеличение шансов развития ДВС-синдрома (2=5,2, р=0,022) среди пациентов женского пола в стационаре, не оказывающем акушерскую помощь, не совсем понятно и требует дальнейшего исследования.
При проведении ROC-анализа для активности АТ III как индикатора присутствия ДВС-синдрома, ROC-кривая активности АТ III значимо отличалась от диагональной референтной линии (рис. 3). Так, площадь под кривой активности АТ III составила 0,63 (95% ДИ 0,52; 0,74), что значимо (р=0,021) отличается от 0,5.
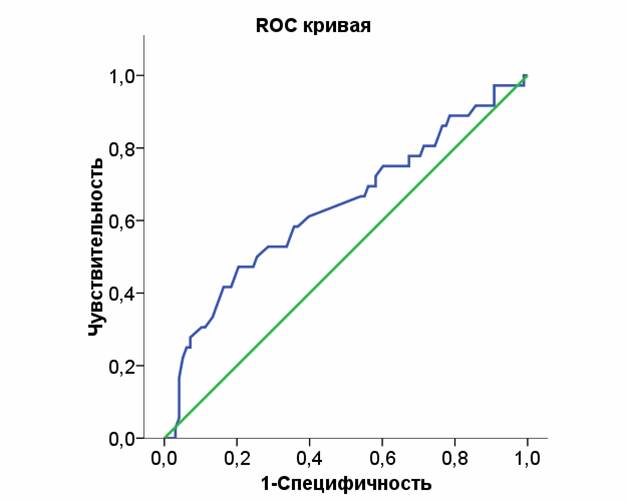
Рис. 3. Чувствительность и специфичность активности антитромбина III в отношении присутствия ДВС-синдрома у пациентов с ССВО
Снижение АТ III ниже нормальных значений обладает достаточно высокой чувствительностью и низкой специфичностью в отношении присутствия ДВС-синдрома, в то время как выраженное снижение активности АТ III ниже 50% обладает чувствительностью 36% и специфичностью 85%.
При тестировании связи между активностью АТ III и другими показателями гемостаза были определены два значимо связанных с АТ III независимых фактора: количество тромбоцитов и показатель МНО (F=10,9; p<0,001), которые и были включены в регрессионную модель: АТ III = 70,1 + 0,05 х количество тромбоцитов – 11,7 х МНО.
Вариации данных показателей, включенных в диагностическую шкалу JAAM DIC, объясняют 24% вариаций активности АТ III (r2=0,24).
Пациенты с дефицитом АТ III и без него не различались по частоте летального исхода на 30-е сутки (2=2,1, р=0,15). Так, при включении в логистическую модель прогнозирования летального исхода таких переменных как дефицит активности АТ III, количество тромбоцитов, МНО, пол, возраст и баллы по прогностической шкале APACHE II, только показатель МНО и оценка по шкале АPACHE II являлись значимыми независимыми факторами 30-суточной летальности (табл. 4). При этом связь между дефицитом АТ III и летальным исходом была незначима (р=0,18).
Таблица 4
Значение факторов, прогнозирующих летальность на 30-е сутки
| Независимые переменные | Регрессионный коэффициент B | р | Отношение шансов (ОR) | 95 % ДИ для отношения шансов |
| МНО | 1,94 | 0,020* | 6,92 | 1,36; 35,25 |
| APACHE II (баллы) | 0,12 | 0,014* | 1,13 | 1,02; 1,24 |
| Возраст (годы) | 0,03 | 0,065 | 1,03 | 1,00; 1,07 |
| Дефицит АТ III ниже 50% | -0,85а | 0,180 | 0,43 | 0,12; 1,48 |
* Факторы, значимые на уровне 0,05
а Отрицательный регрессионный коэффициент свидетельствует о снижении шансов летального исхода при увеличении соответствующей независимой переменной
Наши данные свидетельствуют, что один из общедоступных лабораторных критериев ДВС-синдрома - МНО является независимым предиктором 30-суточной летальности (B=1,94; p=0,02). Продемонстрированное нами прогностическое значение МНО также подтверждается результатами крупного рандомизированного исследования PROWESS включившего 840 пациентов с тяжелым сепсисом [Dhainaut J.F., 2005], в котором была показана связь между протромбиновым временем с одной стороны и тяжестью органной дисфункции, летальностью на 28-е сутки с другой стороны. Тем не менее, то же исследование показало, что выраженный дефицит активности АТ III является независимым предиктором летального исхода. Результат этого и других исследований [Mesters R.W., 1996; Gando S., 2006] расходится с данными нашего исследования, в котором не было выявлено значимой связи между активностью АТ III и летальностью на 30-е сутки. Вероятно, данные результаты объясняются различными критериями включения и относительно небольшим количеством пациентов в нашем исследовании.
На основании того, что наше исследование обладало достаточной мощностью, чтобы продемонстрировать прогностическую значимость МНО, но при этом не показало влияние активности АТ III на прогноз, мы пришли к заключению, что у пациентов с ССВО показатель МНО обладает большей прогностической значимостью, чем активность АТ III.
Результаты проспективного клинического исследования показали более высокую эффективность концентрата АТ III по сравнению со СЗП и комбинированной терапией в отношении коррекции дефицита АТ III (табл. 5). Так, в группе концентрата АТ III наблюдалось достоверное повышение активности АТ III(F=8,1, р=0,003), в то время как в группе СЗП достоверного прироста активности АТ III не было отмечено (F =2,5, р=0,11). В группе С наблюдалась тенденция к повышению активности АТ III в динамике (F=2,8, p=0,056) (рис. 4).
Таблица 5
Динамика активности антитромбина III (%) в группах терапии концентратом антитромбина III (А), свежезамороженной плазмой (В) и комбинированной терапии (С)
| Группа терапии | Срок наблюдения | |||
| 0 момент | 24 часа | 48 часов | 72 часа | |
| Группа А (n = 15) M (95% ДИ) | 53 46; 60 | 69 59; 78 | 72 62; 82 | 73 65; 82 |
| Значение р* | <0,001 | 0,002 | 0,008 | |
| Группа B (n = 15) M (95% ДИ) | 50 43; 56 | 51 44; 59 | 56 49; 64 | 57 48; 66 |
| Значение р** | 0,99 | 0,31 | 0,88 | |
| Группа C (n = 13) M (95% ДИ) | 54 46; 62 | 62 54; 70 | 64 55; 72 | 58 45; 70 |
| Значение р*** | 0,20 | 0,20 | 0,99 | |
| Значение р | 0,66 | 0,009 | 0,024 | 0,017 |
Примечания:
р*, р**, р*** – значение р, полученное при сравнении показателя в начальный момент времени с показателем в другие моменты методом ANOVA для повторных измерений c Post Hoc тестом Бонферрони в группе А, В и С, соответственно.
р – при сравнении показателя между группами в разные моменты времени методом ANOVA.
![Динамика активности антитромбина III [%] (95% ДИ) Более низкая-4](/images1/121906/dinamika-aktivnosti-antitrombina-i.png)
Рис. 4. Динамика активности антитромбина III [%] (95% ДИ)
Более низкая эффективность комбинированной терапии по сравнению с монотерапией концентратом АТ III, несмотря на применение одинаковых доз концентрата АТ III в двух группах, по нашему мнению может объясняться «гашением» эффекта концентрата АТ III донорской плазмой, которая подобно буферному раствору стремится восстановить баланс при избытке антикоагулянтов [Баркаган З. С., 1989; Воробьева Н. А., 2006].
Наше исследование также продемонстрировало, что дыхательная функция зависела от вида заместительной терапии (F=3,3, p=0,05) (табл. 6), причем терапия СЗП сопровождалась самыми низкими показателями индекса оксигенации (рис. 5).
Таблица 6
Динамика индекса оксигенации (РаО2/FiО2, мм рт. ст.) в группах терапии концентратом АТ (А), свежезамороженной плазмой (В) и комбинированной терапии (С)
| Группа терапии | Срок наблюдения | |||
| 0 момент | 24 часа | 48 часов | 72 часа | |
| Группа А (n = 15) M (95% ДИ) | 359 278; 440 | 362 265; 459 | 341 283; 399 | 319 246; 392 |
| Значение р* | 0,99 | 0,64 | 0,42 | |
| Группа B (n = 15) M (95% ДИ) | 312 241; 382 | 251 191; 310 | 253 209; 297 | 235 182; 289 |
| Значение р** | 0,99 | 0,99 | 0,80 | |
| Группа C (n = 13) M (95% ДИ) | 303 246; 360 | 340 289; 392 | 349 272; 427 | 309 210; 409 |
| Значение р*** | 0,46 | 0,98 | 0,99 | |
| Значение р | 0,45 | 0,051 | 0,028 | 0,15 |
Примечания:
р*, р**, р*** – значение р, полученное при сравнении показателя в начальный момент времени с показателем в другие моменты методом ANOVA для повторных измерений c Post Hoc тестом Бонферрони в группе А, В и С, соответственно.
р – при сравнении показателя между группами в разные моменты времени методом ANOVA.
![Динамика индекса оксигенации PaO2/FiO2 [мм рт. ст.] (95% ДИ) При-5](/images1/121906/dinamika-indeksa-oksigenacii-pao2.png)
Рис. 5. Динамика индекса оксигенации PaO2/FiO2 [мм рт. ст.] (95% ДИ)
При выполнении Post Hoc попарных сравнений спустя сутки после начала терапии отмечена тенденция к отличию по индексу оксигенации пациентов группы В от пациентов группы А (р=0,066), спустя двое суток – от пациентов группы А (р=0,072) и С (р=0,055) (табл. 6). Интересно, что в группе монотерапии СЗП донорская плазма вводилась в тех же дозах, что и в группе комбинированной терапии, однако повторное введение требовалось большей части пациентов. Последним обстоятельством, вероятно, и объясняется наиболее выраженная дисфункция дыхательной системы в группе СЗП (рис. 5).
Внутри и между исследуемыми группами не было обнаружено статистически значимых различий по количеству тромбоцитов, показателям МНО, АЧТВ и активности фибринолиза как в момент рандомизации, так и в течение всего периода исследования.
Вне зависимости от характера проводимой заместительной терапии у пациентов наблюдался значимый прирост уровня фибриногена (F = 8,42, р = 0,001), причем на вторые и третьи сутки повышение уровня фибриногена по сравнению с исходным показателем было статистически значимым (p=0,007; р<0,001, соответственно), при этом межгрупповых различий в концентрации фибриногена не было отмечено (F=0,17, p=0,84). Повышение уровня фибриногена вне зависимости от вида заместительной терапии, вероятно, объясняется присутствием ССВО, который в той или иной мере был выражен у большинства исследуемых пациентов. Данный результат ставит под сомнение значимость уровня фибриногена как диагностического критерия ДВС-синдрома на фоне ССВО, что согласуется с результатами других исследований [Levi M., 1999; Sivula M., 2005; Gando S., 2006].
На момент включения пациентов в исследование функциональная активность АТ III коррелировала с количеством тромбоцитов (r=0,49, p=0,001), уровнем фибриногена (r=0,36, p=0,02) и отрицательно коррелировала с МНО (r=-0,37, p=0,03) (рис. 6).



Рис. 6. Корреляция между активностью АТ III, количеством тромбоцитов и уровнем МНО
При регрессионном анализе введение данных показателей в модель прогнозирования активности АТ III значимо улучшало ее предсказательную способность (F=9,6; p<0,001). При этом количество тромбоцитов и МНО являются значимыми независимыми факторами, определяющими активность АТ III (F=11,9, р<0,001), и финальная регрессионная модель имела следующий вид: АТ III= 59,3 + 0,054хколичество тромбоцитов – 12,7хМНО. При этом 40% вариации активности АТ III объясняется вариацией количества тромбоцитов и МНО (r2=0,40).
Таким образом, полученные нами на разных группах пациентов регрессионные модели активности АТ III очень близки друг к другу, что является доказательством точности результатов. Следует отметить, что количество тромбоцитов и МНО входят в число диагностических маркеров всех трех наиболее известных шкал диагностики ДВС-синдрома, а именно JAAM, ISTH, IMHW [Kobayashi N., 1987, Taylor F. B., 2001; Gando S., 2006]. Поэтому связь между дефицитом активности АТ III и ДВС-синдромом возможно объясняется корреляцией активности АТ III с перечисленными показателями гемостаза.
В нашем исследовании среди возможных неблагоприятных реакций на проводимую терапию в группе концентрата АТ III мы отметили два случая (13%) тяжелого нефатального кровотечения, потребовавшего прекращения терапии концентратом AT III и проведения трансфузии СЗП в объеме 800-1000 мл и эритроцитарной массы в объеме 500-1000 мл, в то время как в группе СЗП и комбинированной терапии не было случаев тяжелого кровотечения. В целом между группами не было выявлено значимых различий в частоте кровотечения (точный тест Фишера=2,6, р=0,32). Кроме того, мы не можем отнести возникшие случаи кровотечения исключительно к выбору заместительной терапии, так как частота кровотечения у пациентов группы АТ III не превышала таковую на фоне ДВС-синдрома в отсутствие антикоагулянтной терапии [Okajima K., 2000; Kienast J., 2006]. Более того, у одного из пациентов кровотечение развилось спустя двое суток после последнего использования препарата, а у другого активность АТ III после введения концентрата АТ III оставалась на очень низком уровне – 40-45%. Для сравнения, в исследовании KyberSept средняя активность АТ III сохранялась на уровне 180% в течение всего периода исследования, при этом частота геморрагических осложнений составляла 22% у пациентов с сепсисом [Warren B. L., 2001] и 7% у пациентов с ДВС-синдромом на фоне сепсиса [Kienast J., 2006]. Кроме того, у одного из пациентов внутрибрюшное кровотечение развилось на третьи сутки после начала исследования, когда препарат уже не назначался вследствие достижения эффекта. В данном случае кровотечение было обусловлено нарушением целостности сосудистой стенки крупной артерии вследствие арозивного процесса.
В группе комбинированной терапии мы отметили два случая аллергической реакции в виде острой крапивницы, развившихся сразу после начала введения концентрата АТ III. Тем не менее, между группами не было статистически значимых различий в частоте аллергических реакций (точный тест Фишера=3,2, р=0,09).
Летальность не отличалась между группами (2=0,54, p=0,77) и составила в группе АТ III 40 % (6/15), в группе СЗП – 53,3% (8/15) и группе комбинированной терапии – 46,2 % (6/13). Во всех исследуемых группах летальность была выше прогнозируемого уровня, определенного по шкале АРАСНЕ II на момент включения в исследование (рис. 7).

Рис. 7. Действительная и прогнозируемая летальность в исследуемых группах, (%)
Значительное различие между действительной и прогнозируемой летальностью во всех группах, вероятно, объясняется тем, что шкала APACHE II, которая использовалась для прогнозирования уровня летальности, не включает оценку показателей системы гемостаза, хотя и в литературе [Mesters R. W., 1996; Dhainaut J. F., 2005; Gando S.; 2006] и по данным нашего исследования отдельные показатели системы гемостаза обладали прогностическим значением у больных, находящихся в критическом состоянии.
В целом мощность нашего проспективного исследования не позволяет прийти к определенным выводам в отношении различий в частоте неблагоприятных реакций и летального исхода. Для решения данной задачи необходимы дальнейшие исследования.
При исследовании доноров средняя активность АТ III в плазме крови в момент забора крови соответствовала середине референтного интервала для данного показателя –99,9% (95% ДИ 97,8; 101,9), что свидетельствует о физиологическом функционировании системы гемостаза.
Наше исследование продемонстрировало различия в активности АТ III в зависимости от количества предыдущих заборов крови (96% (95% ДИ 92; 99) и 101% (95% ДИ 99; 102). Более высокая активность АТ III наблюдалась у доноров, которые ранее многократно сдавали кровь. В литературе мы не встретили данных, подтверждающих результаты нашего исследования. Тем не менее, мы предполагаем, что такая зависимость может быть отчасти обусловлена функциональным напряжением системы гемостаза при повторных кровопотерях.
Процесс замораживания, размораживания и хранения СЗП по данным нашего исследования приводил к статистически значимому снижению активности АТ III, что согласуется с данными других авторов, изучавших влияние методов заготовки и режимов хранения донорской плазмы на активность факторов системы гемостаза [Woodhams B., 2001; Buchta C., 2004]. Несмотря на то, что карантинизация СЗП в течение 9 месяцев приводит к относительно небольшому [на 5,7% (95% ДИ 3,6; 7,9)] снижению активности АТ III, его следует учитывать при исходной пограничной активности АТ III у донора. Так, по нашим данным после карантинизации количество единиц донорской СЗП с активностью АТ III ниже 90% достигает 40% (95% ДИ 29; 51) (рис. 8).
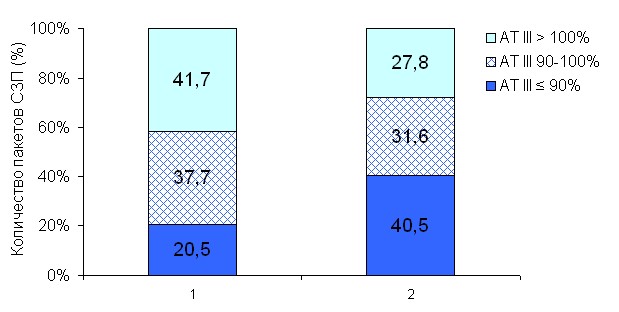
Рис. 8. Распределение донорской плазмы по активности АТ III в момент забора крови и после карантинизации
Очевидно, что в такой ситуации эффективность СЗП малопредсказуема, так как непосредственно перед трансфузией активность АТ III в донорской плазме значительно варьирует, и в почти в половине пакетов существенно снижена. Для решения данной проблемы отдельные авторы предлагают определять активность различных факторов свертывания у доноров непосредственно перед забором крови и выбраковывать плазму с низкими показателями физиологических антикоагулянтов [Воробьева Н. А., 2006]. Другой более перспективный метод заключается в приготовлении из донорской плазмы концентратов отдельных факторов системы гемостаза, которые обладают стандартизованной активностью [Rock G., 2007; Nakashima T., 2005], или использования рекомбинантных препаратов отдельных факторов [Griffin J. H., 2007; Hardy J. F., 2008].
ВЫВОДЫ
- Частота диссеминированного внутрисосудистого свертывания крови на фоне синдрома системного воспалительного ответа различного генеза у пациентов отделения интенсивной терапии многопрофильного стационара составила 27% (95% ДИ 19,5; 34,5), на фоне тяжелой пневмонии – 27% (95% ДИ 9,9; 44,1)
- Дефицит активности антитромбина III ниже 50% у пациентов с синдромом системного воспалительного ответа увеличивал шансы присутствия синдрома диссеминированного внутрисосудистого свертывания крови в 3,5 (95% ДИ 1,2; 10,4) раза
- У пациентов с синдромом диссеминированного свертывания крови и синдромом системной воспалительной реакции активность антитромбина III была связана c диагностическими критериями ДВС-синдрома – количеством тромбоцитов и уровнем международного нормализованного отношения (F=10,9; p<0,001).
- При синдроме системного воспалительного ответа уровень международного нормализованного отношения (B=1,94, р=0,02), по сравнению с активностью антитромбина III (B=-0,85; р=0,18) обладал более высокой прогностической значимостью в отношении исхода на тридцатые сутки
- Применение низких доз концентрата антитромбина III в терапии ДВС-синдрома обладало преимуществом перед донорской СЗП при назначении с целью коррекции дефицита активности антитромбина III (F=6,0; р=0,006)
- Длительное хранение, замораживание и размораживание донорской плазмы привело к снижению активности антитромбина III на 5,7% (95% ДИ 3,6; 7,9), которое следует учитывать при исходных пограничных значениях активности АТ III в донорской плазме в момент забора крови
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Учитывая высокую распространенность синдрома диссеминированного внутрисосудистого свертывания крови на фоне синдрома системного воспалительного ответа, у пациентов с данным состоянием необходимо осуществлять лабораторный скрининг, направленный на диагностику синдрома внутрисосудистого свертывания крови
- Для проведения скрининга на выявление синдрома внутрисосудистого свертывания крови при синдроме системного воспалительного ответа такие общедоступные лабораторные показатели гемостаза, как МНО и количество тромбоцитов, имеют преимущества перед активностью антитромбина III
- С целью своевременной диагностики синдрома внутрисосудистого свертывания крови целесообразно использовать шкалу JAAM DIC
- Для оптимизации лекарственной терапии ДВС-синдрома возможно использование низких расчетных доз концентрата антитромбина III ([70 – активность АТ III пациента] х масса тела пациента) под контролем активности антикоагулянтной системы
- Активным донорам плазмы целесообразно проводить динамический мониторинг функциональной активности антитромбина III
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО МАТЕРИАЛАМ ДИССЕРТАЦИИ
- Воробьева Н. А. Место концентрата антитромбина III в интенсивной терапии ДВС-синдрома. Н. А. Воробьева, Е. Л. Непорада, О. В. Турундаевская, Г. Н. Мельникова // Общая реаниматология – 2006. – №4/1. – C. 151-153.
- Воробьева Н. А. Место концентрата антитромбина III в интенсивной терапии ДВС-синдрома / Н. А. Воробьева, Е. Л. Непорада, О. В. Турундаевская, Г. Н. Мельникова // Анестезиология и реаниматология. – 2007. – №2. – C. 42-44.
- Непорада Е. Л. Концентрат антитромбина III в сравнении со свежезамороженной плазмой при синдроме диссеминированного внутрисосудистого свертывания крови / Е. Л. Непорада, О. В. Турундаевская, Н. А. Воробьева Н. А. Экология человека. – 2008. – №7. – C. 47-51.
- Непорада Е. Л. Коррекция дефицита антитромбина III при синдроме диссеминированного внутрисосудистого свертывания / Е. Л. Непорада, Н. А. Воробьева, Э. В. Недашковский // Общая реаниматология. – 2008. – №5. – С.49-54.
- Непорада Е.Л. Оптимизация антикоагулянтной терапии ДВС-синдрома / Е. Л. Непорада, Н. А. Воробьева, О. В. Турундаевкая, Г. Н. Мельникова // Экология человека. – 2006. – Прилож. 4/2. – С. 357.
- Воробьева Н. А. Первый опыт использования концентрата антитромбина III в терапии ДВС-синдрома / Н. А. Воробьева, Е. Л. Непорада, О. В. Турундаевская, Г. Н. Мельникова // Тезисы докладов X Всероссийского съезда анестезиологов и реаниматологов. – СПб, 2006. – С. 89-90.
- Воробьева Н. А. Концентрат антитромбина III в терапии ДВС-синдрома / Н. А. Воробьева, Е. Л. Непорада, О. В. Турундаевская, Г. Н. Мельникова // Материалы Российской научно-практической конференции, посвященной 75-летию Российского научно-практического института гематологии и трансфузиологии. Вестник гематологии. – 2007. – том III. – №2. – С. 71.
- Непорада Е. Л. Концентрат антитромбина III в сравнении со свежезамороженной плазмой в терапии ДВС-синдрома / Е. Л. Непорада, Н. А. Воробьева, О. В. Турундаевская, Г. Н. Мельникова // Сборник докладов и тезисов II Беломорского симпозиума. – Архангельск, 2007. – C. 97-99.
- Neporada E. L.. Antithrombin III in comparison with fresh frozen plasma in patients with disseminated intravascular coagulation accompanied by antithrombin III deficiency / E. L.Neporada, N. A. Vorobyeva, O. V. Turundaevskaya, G. N. Melnikova // Abstract book of the XXIst Congress of the International Society on Thrombosis and Haemostasis. – Geneva, 2007. – Poster session. – P-T-666.
- Непорада Е. Л. Концентрат антитромбина III в сравнении со свежезамороженной плазмой в терапии ДВС-синдрома / Е. Л. Непорада, Н. А. Воробьева, О. В. Турундаевская, Г. Н. Мельникова // Сборник докладов и тезисов IV Съезда анестезиологов и реаниматологов Северо-запада России. – СПб, 2007. – C. 218-219.
- Воробьева Н. А. Оптимизация антикоагулянтной терапии острого ДВС-синдрома / Н. А. Воробьева, Е. Л. Непорада, О. В. Турундаевская, Г. Н. Мельникова // Материалы Всероссийского конгресса анестезиологов и реаниматологов и главных специалистов с международным участием Современные достижения и будущее анестезиологии и реаниматологии. – Москва, 2007. – С. 176-177.
- Фот Е. В. Дефицит антитромбина III у больных с синдромом системного воспалительного ответа как возможный критерий ДВС-синдрома / Е. В. Фот, Е. Л. Непорада, К. М. Гайдуков, Н. А. Воробьева // Бюллетень СГМУ. – 2008. – №1. – C. 211-212.
- Neporada E. L. Antithrombin III concentrate in comparison with fresh frozen plasma in patients with disseminated intravascular coagulation accompanied by antithrombin III deficiency / E. L. Neporada, O. V. Turundaevskaya, G. N. Melnikova, N. A. Vorobyeva // The European Anaesthesiology Congress. Euroanaesthesia 2008. European Journal of Anaesthesiology. – 2008. – Vol. 25. – Suppl. 44. – P. 87.
- Непорада Е. Л. Коррекция дефицита антитромбина III при ДВС-синдроме / Е. Л. Непорада, Н. А.Воробьева, Э. В. Недашковский // Сборник тезисов XI Всероссийского конгресса анестезиологов. – Санкт-Петербург, 2008. – С. 560.

