Галимзянов виталий захитович кишечная пластика мочевого пузыря: профилактика и лечение осложнений.
НА ПРАВАХ РУКОПИСИ
ГАЛИМЗЯНОВ ВИТАЛИЙ ЗАХИТОВИЧ
КИШЕЧНАЯ ПЛАСТИКА МОЧЕВОГО ПУЗЫРЯ:
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ.
14.01.23 – урология
АВТОРЕФЕРАТ
Диссертация на соискание ученой степени доктора медицинских наук
Москва – 2011
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Башкирский государственный медицинский университет Росздрава»
Научный консультант:
доктор медицинских наук, профессор Павлов Валентин Николаевич
Официальные оппоненты:
Доктор медицинских наук, профессор
Русаков Игорь Георгиевич
Доктор медицинских наук, профессор
Даренков Сергей Петрович
Доктор медицинских наук, профессор
Безруков Евгений Алексеевич
Ведущая организация: ГОУ ДПО «Российская медицинская академия последипломного образования»
Защита диссертации состоится «____» ________________ 2011 г. в _____ часов на заседании диссертационного совета Д 208. 040. 11 в Первом Московский государственном медицинском университете им. И.М. Сеченова по адресу 119991, Москва, ул. Трубецкая, д. 8, стр 2.
С диссертацией можно ознакомиться в Центральной научной медицинской библиотеке Первого Московского государственного медицинского университета им. И.М. Сеченова по адресу: 17998, Москва, Нахимовский проспект, д. 49
Автореферат разослан «____» ____________________ 2011 г.
Ученый секретарь диссертационного Совета:
доктор медицинских наук, профессор Владимир Иванович Тельпухов
ВВЕДЕНИЕ
Актуальность проблемы.
Уровень реконструктивно-пластических вмешательств может являться индикатором развития всей урологической службы в частности и системы здравоохранения, в общем. (Глыбочко П.В.., 2010; Лопаткин Н.А., 2008; Даренков С.П.., 2004; Комяков Б.К., 2005; Коган М.И., и др., 2005; Матвеев В.Б., 2006). Особое место в современной восстановительной урологии занимает проблема замещения функции и структуры мочевого пузыря, утраченного вследствие ряда причин. Основная причина – рак мочевого пузыря, при этом показания к радикальной цистэктомии в последние годы неуклонно расширяются. Необходимость замещения мочевого пузыря другими тканями обусловлена также врожденными аномалиями развития мочеполовой системы (экстрофия мочевого пузыря), состоянием после уретеросигмостомии, нейрогенным мочевым пузырем (гиперрефлекторный мочевой пузырь, миелодисплазия), микроцистисом (интерстициальный цистит, мочевые свищи, травмы), эвисцерации органов малого таза при опухолевых заболеваниях кишечника, туберкулезом мочевого пузыря и постлучевым циститом.
По результатам проведенных сравнительных исследований, ортотопическое замещение мочевого пузыря обоснованно считается лучшим на сегодняшний день. Данный метод не только имеет более низкую частоту осложнений и хорошие функциональные результаты, но и обеспечивает больным наилучшее качество жизни. Ортотопическое замещение мочевого пузыря способствует достижению достаточной социальной, психологической адаптации и высокой самооценки (Комяков Б. К, 2001; Матвеев Б. П., 2001; Studer U. Е., 2000; Perimenis P., 2001; Hautmann R.E., 2003).
Следование показаниям для выполнения этой операции в последние годы позволило увеличить количество радикально оперированных и реабилитированных больных как в мире, так и в Российской федерации. Однако, летальность, связанную с осложнениями кишечной пластики мочевого пузыря в раннем послеоперационном периоде, только в ведущих зарубежных и отечественных клиниках, удалось в последние годы снизить до 1-3%, уровень послеоперационной смертности в пределах 5 % до сих пор считается приемлемым. При этом при развитии поздних осложнений уровень летальности составляет по данным разных авторов от 10% и более (Даренков С.П., Коган М.И., Русаков И.Г.,2007; Галеев Р.Х., 1999 - 2006; Studer U.E., 1997;). По результатам одиннадцатилетнего наблюдения частота развития поздних послеоперационных осложнений, связанных с искусственным мочевым пузырем, достигает 23,4% (Hautmann R.E., et al., 2000). По данным других авторов, поздние послеоперационные осложнения составляют 11-70%. Наиболее часто встречается пиелонефрит - до 10 %, в сочетании с гидронефрозом, либо по отдельности, приводящие к развитию хронической почечной недостаточности (Русаков И.Г., 2005, Herr H.W., 1999).
Сложность проблемы лечения больных с кишечной пластикой мочевого пузыря объясняется тяжелым течением инфекционных процессов, расстройствами водно - электролитного баланса, снижением иммунореактивности организма (Лопаткин Н.А., Даренков С.П., 2005). По признанию многих авторов, существующие методы лечения часто оказываются малоэффективными, и возникает необходимость разработки новых методов диагностики и лечения осложнений с использованием последних научных достижений (Аляев Ю.Г., 2004; Лопаткин Н.А. и соавт., 2000).
Особое внимание уделяется исследованиям функционального состояния артифициального мочевого пузыря, которое определяет как характер осложнений, так и качество жизни больного. Вмести с тем, остаются недостаточно изученными вопросы взаимосвязи микроциркуляции кишечной стенки мочевого пузыря с расстройствами уродинамики, бактериальной обсемененностью, развитием гнойно-воспалительных осложнений со стороны верхних мочевых путей, метаболических расстройств (Дональд С., 2005), требуется проведение комплексных исследований качества жизни больных с кишечной пластикой мочевого пузыря, совершенствования хирургической техники и методики выполнения операции, разработки и внедрения, специфических мер профилактики и лечения основных осложнений.
Целью данного исследования является улучшение результатов лечения больных с доброкачественными и злокачественными заболеваниями мочевого пузыря путем усовершенствования хирургической техники кишечной пластики мочевого пузыря и разработки программы профилактических и лечебных мероприятий в предоперационном, раннем и позднем послеоперационных периодах.
Задачи исследования
1. Изучить закономерности периоперационого периода, характер ранних и поздних послеоперационных осложнений у больных с кишечной пластикой мочевого пузыря.
2. Оценить характер госпитальной и катетер-ассоциированной флоры, их влияние на развитие послеоперационных осложнений и разработать способ профилактики путем применения комбинированной протейно-синегнойно-стафиллококковой вакциной в комплексе предоперационной подготовки.
3. Методом лазерной доплеровской флоуметрии изучить общие закономерности изменений капиллярного кровотока ортотопического тонкокишечного мочевого кишечного пузыря и операционной раны у больных в послеоперационном периоде.
4. Усовершенствовать хирургическую технику операции кишечной пластики мочевого пузыря путем преимущественного использования однорядных хирургических швов, разработки и внедрения клапанных методов антирефлюксной защиты с использованием аллогенного соединительнотканного сухожильного трансплантата.
5. У больных, оперируемых по поводу рака мочевого пузыря использовать метод визуализации лимфатического русла и оценить влияния расширенной лимфаденэктомии на течение послеоперационного периода и отдаленные результаты выживаемости больных.
6. Исследовать степень бактериальной контаминации хирургической раны, характер раневых осложнений у больных с кишечной пластикой мочевого пузыря и разработать специфические и неспецифические методы профилактики и лечения осложнений.
7. Разработать методы профилактики поздних осложнений кишечной пластики мочевого пузыря с использованием препаратов для коррекции микробиоценоза и микроциркуляции.
8. Оценить отдаленные результаты и качество жизни больных с ортотопическим мочевым пузырем.
Научная новизна
1. Впервые в клинических исследованиях внедрены новые методические приемы исследования микроциркуляции артифициального мочевого пузыря и хирургической раны при кишечной пластике мочевого пузыря. При этом впервые в клинических исследованиях получены количественные данные о состоянии микроциркуляторного русла кишечного мочевого пузыря и хирургической раны после оперативного вмешательства
Установлена взаимосвязь между вариантами нарушений микроциркуляции и дисфункцией кишечного мочевого пузыря. Изучена зависимость между состоянием микроциркуляторного русла кишечного мочевого пузыря и развитием основных осложнений - пиелонефритом, мочекаменной болезнью, метаболическим ацидозом, формированием стриктур анастомозов.
2. Впервые в комплекс предоперационной подготовки больных с кишечной пластикой мочевого пузыря включена специфическая иммуномодуляция с применением комбинированной протейно-синегнойно-стафиллококковой вакцины.
3. На основе экспериментальных исследований впервые определены общие закономерности замещения аллогенного соединительнотканного трансплантата для фиксирующей пластики и возможности его использования для формирования инвагинационного клапана кишечного мочевого пузыря.
4. Впервые разработаны и внедрены в клиническую практику методы профилактики раневых осложнений с использованием однорядного хирургического шва, методов раневого диализа и вакуум – аспирации после реконструктивно-пластических операций на органах брюшной полости и малого таза.
5. Впервые получены данные о характере лимфогенного метастазирования у больных с инвазивным раком мочевого пузыря при интраоперационной прижизненной визуализации лимфатических узлов. Впервые проведена оценка риска продолженного лимфогенного метастазирования после различных видов лимфаденэктомии у больных с инвазивным раком мочевого пузыря и показано значение микрометастазов в лимфатические узлы и установлен характер их влияния на частоту местного и регионарного рецидива рака мочевого пузыря.
6. Впервые изучена микроциркуляция и бактериальная обсемененность необладдера и качество жизни пациентов с артифициальным мочевым пузырем при использовании предложенного алгоритма послеоперационного ведения больных, в том числе с применением средств, направленных на коррекцию микроциркуляторных расстройств.
Теоретическая и практическая значимость
Получены новые данные о состоянии микроциркуляции кишечного мочевого пузыря в раннем и позднем послеоперационном периоде, установлено их значение для прогнозирования развития и тяжести послеоперационных осложнений.
Проанализированы изменения ряда показателей состояния иммунной системы больных при кишечной пластике мочевого пузыря в динамике послеоперационного периода, в том числе при применении в схеме предоперационной подготовки комбинированной протейно-синегнойно-стафиллококковой вакцины.
Установлены закономерности изменений микроциркуляции при регенерации хирургической раны у больных с кишечной пластикой мочевого пузыря, проанализирован характер развития раневых осложнений в зависимости от контаминации кишечной и мочевой микрофлорой.
В экспериментальных и клинических исследованиях обоснована возможность применения аллогенного соединительнотканного трансплантата для формирования антирефлюксного клапана при илеоцистопластике.
Разработаны и внедрены в клиническую практику методы коррекции регенерации хирургической раны в комплексной терапии больных после реконструктивно-пластических операций на органах брюшной полости и малого таза.
Получены новые данные о характере лимфогенного метастазирования при инвазивном раке мочевого пузыря, в том числе у больных, ранее перенесших оперативное вмешательство на мочевом пузыре. Впервые в комплексе профилактики местного лимфогенного рецидива при радикальной цистэктомии применена интраоперационная визуализация лимфатических путей с применением красителя синего Эванса. Показана возможность расширенной лимфаденэктомии с интраоперационной визуализацией тазовых лимфоузлов при оперативном лечении инвазивного рака мочевого пузыря.
Проанализированы поздние послеоперационные осложнения у больных с артифициальным кишечным мочевым пузырем, произведена комплексная оценка качества жизни больных. Показано, что в структуре осложнений преобладают пиелонефрит, дисфункция необладдера, стриктура уретровезикального анастомоза, мочекаменная болезнь, ночное недержание мочи и метаболический ацидоз.
Установлено влияние на характер метаболических расстройств и развитие ряда специфических осложнений препаратов растительного происхождения.
В практическом плане материалы работы позволили улучшить результаты лечения больных с илеоцистопластикой. Разработаны и внедрены в клиническую практику методы предоперационной подготовки, усовершенствована хирургическая техника и послеоперационное ведение больных после кишечной пластики мочевого пузыря. Разработана тактика этапного обследования и комплексного лечения поздних послеоперационных осложнений кишечной пластики мочевого пузыря, на основе изменений органной микроциркуляции, бактериальной обсеменённости, кислотно-основного состояния крови и показателей урофлоуметрии.
Установлено преимущество однорядного хирургического шва на всех этапах операции для полноценной регенерации, предотвращения несостоятельности и возможности заживления первичным натяжением. Также обоснована возможность выполнения антирефлюксной защиты верхних мочевых путей при формировании клапанов с использованием аллогенных сухожильных трансплантатов.
У больных с раком мочевого пузыря было выявлено, что при выполнении радикальной цистэктомии расширенная лимфаденэктомия не приводит к увеличению частоты и тяжести ранних послеоперационных осложнений и летальности, а в отдаленные сроки позволяет снизить частоту регионарного рецидива и увеличить 5-летнюю выживаемость больных.
Показано, что включение в комплексную профилактику и лечение дисфункции артифициального мочевого пузыря средств, улучшающих микроциркуляцию, уменьшает количество поздних послеоперационных осложнений и улучшает качество жизни больных после кишечной пластики мочевого пузыря.
Положения, выносимые на защиту
1. При комбинированных операциях на органах малого таза, сопровождающиеся вскрытием просветов кишечной трубки и органов мочевыводящей системы происходят значимые изменения микроциркуляторного русла всех отделов кишечного трансплантата, хирургической раны, сопровождающиеся контаминацией раны комбинированной мочевой и кишечной микробной флорой.
2. Исследование микроциркуляции при кишечной пластике мочевого пузыря методом лазерной допплеровской флоуметрии позволяет достоверно оценить степень выраженности нарушений кровообращения в микроциркуляторном русле кишечного трансплантата, количественные показатели микроциркуляции являются диагностическими критериями выраженности патологического процесса, отражают динамику заживления межкишечных и уретеро-кишечных анастомозов.
3. Применение протейно – синегнойной – стафилококковой вакцины в предоперационной подготовке больных с кишечной пластикой мочевого пузыря позволяет проводить специфическую профилактику внутрибольничной, в том числе катетер-ассоциированной инфекции.
4. Выполнение кишечной пластики мочевого пузыря с использованием однорядного кишечного шва имеет преимущества для полноценной регенерации, предотвращения несостоятельности и возможности заживления первичным натяжением. При формировании антирефлюксной защиты верхних мочевых путей с использованием аллогенного сухожильного трансплантата в клапанной хирургии необладера позволяет в сроки до 6 и более месяцев предотвращать связанные с рефлюксом осложнений со стороны верхних мочевых путей.
5. Расширенная лимфаденэктомия при радикальной цистэктомии в лечении инвазивного рака мочевого пузыря существенно влияет на отдаленные результаты лечения, при этом интраоперационная визуализация лимфатических узлов позволяет определить уровень удаления лимфатических коллекторов и узлов, особенно при распространении выше подвздошных сосудов.
6. В канцерогенезе лимфогенного метастазирования значительную роль играет микрометастазирование, причем нарушение путей лимфотока свидетельствует о раннем лимфогенном метастазировании и возможности продолженного роста опухоли в лимфогенных метастазах за линией резекции.
7. Предложенная тактика диагностики, профилактики и лечения поздних послеоперационных осложнений кишечной пластики мочевого пузыря, коррекция микробиоценоза и микроциркуляции в кишечном трансплантате позволяет уменьшить количество поздних послеоперационных осложнений и улучшает качество жизни больных.
Внедрение результатов работы
Материалы данного исследования внедрены в учебный процесс кафедр хирургического профиля ГОУ ВПО «Башкирский государственный медицинский университет Росздава», методы, использованные в работе, вошли в клиническую практику Республиканской клинической больницы им. Г.Г.Куватова МЗ РБ, Клиник БГМУ, ГКБ№21 г. Уфа, Республиканского клинического онкологического диспансера МЗ РБ, МУЗ БСМП г. Уфа, Городской клинической больницы ГУЗКБ № 1 г. Стерлитамака, МУЗ ГБ г. Белебея и МУЗ ЦРБ г. Белорецка.
Апробация работы
Результаты диссертационного исследования доложены на заседаниях кафедры хирургии ИПО с курсом эндоскопии, кафедры урологии с курсом ИПО ГОУ ВПО БГМУ, Ассоциации хирургов Республики Башкортостан (2007), Республиканского отделения Российского общества урологов (Уфа, 2005–2010), Республиканских конференциях «Новые технологии в хирургии», «Вопросы теоретической и практической медицины» (Уфа, 2005 - 2008), Всероссийской научно-практической конференции «Актуальные вопросы урологии. Заболевания предстательной железы. Новые технологии в урологии» (Абзаково, 2005, 2007,2009), Пленумах российского общества урологов (2000 – 2008), Конгрессах Российского общества онкоурологов (2009,2010).
Публикации
Материалы диссертационной работы представлены в 52 публикациях, в том числе в 15 рекомендованных ВАК для опубликования диссертационных исследований, имеется патент на изобретение.
Объем и структура работы
Диссертация изложена на 307 страницах машинописного текста, иллюстрирована 108 рисунками и 65 таблицами. Список использованной литературы содержит 324 источника из них 163 отечественных и 161 иностранных.
Содержание работы
Характеристика больных и методов обследования
В основе работы анализ результатов комплексного обследования и лечения 258 пациентов с 1999 по 2009 гг. в клинике урологии ГОУ ВПО «Башкирский государственный медицинский университет Росздрава» на базе отделения урологии Республиканской клинической больницы им. Г.Г. Куватова МЗ РБ, урологического центра Клиники ГОУ ВПО «Башкирский государственный медицинский университет Росздрава», отделения онкоурологии ГУЗ Республиканского онкологического диспансера МЗ РБ, МУЗ Больница скорой медицинской помощи г. Уфа и МУЗ Городская клиническая больница № 1 г. Стерлитамак. Возраст больных составил от 37 до 77 лет (средний возраст 55 ± 1,5 года), из них мужчин было 212 (82,3%), женщин - 46 (17,7%) (Табл. 1.).
Таблица 1.
Распределение больных по полу и возрасту.
| Пол Возраст | Группа сравнения | Основная группа | Всего | |||
| Муж | Жен | Муж | Жен | Муж | Жен | |
| Абс (%) | Абс (%) | Абс (%) | Абс (%) | Абс (%) | Абс (%) | |
| 31 – 40 | 4 (1,7) | - | 6 (2,3) | - | 10 (4,0) | - |
| 41 – 50 | 17 (6,9) | 3 (1,1) | 18 (6,9) | 3 (1,1) | 35 (13,7) | 6 (2,3) |
| 51 – 60 | 27 (10,3) | 6 (2,3) | 29 (11,4) | 9 (3,4) | 56 (21,7) | 15 (5,7) |
| 61 – 70 | 54 (13) | 11 (4,0) | 33 (12,6) | 10 (4,0) | 67 (25,8) | 21 (8,0) |
| 71 – 80 | 22 (8,6) | 2 (1,1) | 22 (8,6) | 2 (0,6) | 44 (17,1) | 4 (1,7) |
| Всего | 104 (40,6) | 22 (8,6) | 108 (41,7) | 24 (9,1) | 212 (82,3) | 46 (17,7) |
Контрольную группу, или группу сравнения составили 126 больных, оперированных в 1999 – 2004 гг. с использованием традиционных методов оперативного лечения, предоперационной подготовки и послеоперационного ведения. Результаты лечения этой группы больных были подвергнуты ретроспективному анализу.
В основную группу вошло 132 пациента, проперированных в 2005 – 2009 гг. с использованием разработанного комплекса предоперационной вакцинации, модификации хирургической техники и послеоперационного ведения. Результаты лечения больных этой группы получены в основном путем проспективного анализа.
Сформированные группы больных по возрасту, полу, характеру выполненных оперативных вмешательств, тяжести основного и сопутствующих заболеваний были однородными.
Таблица 2
Распределение больных основной группы и группы сравнения по нозологическим единицам
| Заболевание | Группа сравнения | Основная Группа | ||
| Абс. | % | Абс. | % | |
| Рак мочевого пузыря Т2-Т4 | 94 | 74,6 | 104 | 78,7 |
| Нейрогенная дисфункция мочевого пузыря | 11 | 8,7 | 8 | 6,1 |
| Туберкулёз мочеполовой системы | 8 | 6,4 | 7 | 5,3 |
| Рак сигмовидной и прямой кишки | 8 | 6,4 | 7 | 5,3 |
| Экстрофия мочевого пузыря | 3 | 2,4 | 3 | 2,3 |
| Постлучевой цистит | 2 | 1,6 | 3 | 2,3 |
| Всего | 126 | 100,0 | 132 | 100,0 |
Основным методом деривации мочи был выбран метод илеоцистопластики по Штудеру. Этот метод оперативного вмешательства, по мнению многих хирургов, является наименее травматичным среди способов формирования континентного ортотопического мочевого пузыря. Также в исследование включены больные, оперированные по методам Кокк, Майнц, Пауча. Ряду пациентов для обеспечения адекватного дренирования резервуара была наложена аппендикостома по Митрофанову. Структура оперативных вмешательств выполненных у больных группы сравнения и в основной группе представлена в таблице 3.
Таблица 3
Структура оперативных вмешательств у больных группы сравнения и основной группы
| Вид операции | Основная группа | Группа сравнения | ||
| Абс. | % | Абс. | % | |
| Илеоцистопластика по Studer | 101 | 76,5 | 104 | 82,5 |
| Формирование кишечной стомы по Brisker и Мogg с конверсией по Studer | 28 | 21,2 | 19 | 14,7 |
| Илеоцистопластика по Kock pouch, Mainz pouch II | 3 | 2,2 | 3 | 2,4 |
| Всего | 132 | 100,0 | 126 | 100,0 |
Методы оперативного лечения больных.
При операции применялся эндотрахеальный наркоз в сочетании со спинномозговой и перидуральной анестезией. Перидуральную анестезию мы использовали также для послеоперационного обезболивания в течение 3-4 суток с целью профилактики осложнений, в особенности пареза кишечника.
У большинства больных в 252 случаях был сформирован ортотопический мочевой пузырь по методу Штудера (Studer U.) в стандартном варианте и у 47 – была выполнена двухмоментная цистопластика, при этом в момент первой операции методом деривации мочи была выбрана либо уретерокутанеостомия, либо формирование влажной мочевой кишечной стомы по Брикеру с последующим формированием ортотопического мочевого пузыря.
У 36 больных основной группы операция Штудера была модифицирована, путем создания антирефлюксного клапана кишечного мочевого пузыря из недетубуляризированного отдела кишечного трансплантата. Были использованы манжеты из аллогенного соединительнотканного трансплантата в качестве каркаса клапана, так же для профилактики перерастяжения приводящего сегмента кишки в области клапана (недостаточности клапана). С этой целью был применен аллогенный соединительнотканный трансплантат для фиксирующей пластики, разработанный Всероссийским центром глазной и пластической хирургии (директор - профессор Мулдашев Э.Р.).
Трансплантат прошел обязательные в России токсикологическую экспертизу и процедуру экспериментальных и клинических испытаний при Комитете по новой медицинской технике МЗ РФ (протокол испытаний № 5610, 5611 от 01.12.2005 г. ИЛ ФГУ «ВНИИМТ») и сертифицирован (Регистрационное удостоверение № ФС 01033584/3159-06; Сертификат соответствия № РОСС RU.ИМ 02.В13996; ТУ 42-2-537-2002). С целью определить возможности использования данного препарата у на органе, активно функционирующем, испытывающим значительные динамические и статические нагрузки, были проведены экспериментальные исследования по изучению динамики резорбции аллогенного трансплантата при моделировании клапана
Также у больных раком мочевого пузыря, вошедших в основную группу, для улучшения визуализации лимфатических узлов при тазовой лимфаденэктомии использовали окрашивание регионарной лимфатической системы путем введения 0,05% водного раствора красителя Т1824 - синего Эванса в дозе 2-3 мл, добиваясь интенсивного окрашивания тканей стенки мочевого пузыря и 1 - 3 сторожевых лимфоузлов. При определении лимфатического блока выполняли дополнительное инъецирование. Это позволило больным основной группы, как правило, выполнять расширенную лимфаденэктомию.
С целью профилактики раневых осложнений мы модифицировали хирургическую технику закрытия раневого дефекта у больных основной группы.
Поскольку при удалении мочевого пузыря удаляется урахус и прилежащая к нему брюшина, то практически весь брюшинный покров передней брюшной стенки, ограниченный Plica umbilicalis medialis, удаляется и при ушивании раны использовать брюшину невозможно и в швы захватываются апоневроз и Musculus rectus abdominis. При этом швы проводятся непрерывно, без захлеста, как показано на рис. 1.

Рис. 1. Однорядный непрерывный шов раны у больных основной группы.
Принципиальным условием применения однорядных швов при кишечной пластики мочевого пузыря на всех этапах оперативного лечения мы считаем использование адекватного шовного материала.
Для ушивания дефекта операционной раны у больных основной группы мы использовали шовный материал полиглактин 910 с покрытием (коммерческое название ВИКРИЛ* ПЛЮС), который представляет собой синтетический рассасывающийся стерильный хирургический шовный материал, состоящий из сополимеров гликолида (90%) и L-лактида (10%). Покрытие шовного материала состоит из равных пропорций сополимеров гликолида и лактида (полиглактин 370) и стеарата кальция. Шовный материал содержит Иргакар MP** (триклозан) – антибактериальное средство широкого спектра действия, в количестве не более 270 мкг/м.
В контрольной группе использовали традиционную технику «послойного» ушивания послеоперационной раны.
У больных основной группы в лечении послеоперационной раны применяли метод вакуум-терапии, в основе которого лежит методика активной аспирации. Для этого пользовались интраоперационное введение дренажей в брюшную полость и постоянное их подключение к вакуум – аспиратору низкого давления 0,1 до 0,15 атм (76-115 мм рт. ст.). Для послеоперационного дренирования у нас применялась воздухоструйная аспирация.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ
Гидродинамические показатели клапанов кишечного мочевого пузыря
Для изучения гидродинамических показателей кишечного мочевого пузыря с инвагинационным клапаном были произведены измерения давления жидкости в полости кишечного мочевого пузыря и в недетубулизированной части проксимальнее клапана. Проверялась проходимость мочи через «створки» инвагинационного клапана. Также моделировалась ситуация наполнения мочевого пузыря, при этом проверялась защита верхних мочевых путей от рефлюкса мочи.
Для проведения эксперимента использовался изолированный сегмент тонкого кишечника трупа длиной 60 см. Формировался мочевой пузырь по методике Штудера. При этом с помощью двух полос аллотрансплантата моделировали клапан недетубуляризированной петли необладера (Рис. 2.).

Рис. 2. Схема инвагинационного клапана с использованием аллогенного сухожильного трансплантата.
При заполнении просвета кишечного мочевого пузыря наблюдалась следующая зависимость. До достижения определенного объема (80±25 мл) жидкость свободно заполняла необладдер, затем давление повышалось без существенного повышения объёма жидкости в пузыре до 105±12 см водного столба. Затем в 3 (20%) наблюдениях было появление подкрашенной воды в проксимальном отделе, в остальных 12 (80%) жидкость просачивалась через швы кишечного мочевого пузыря. Эксперименты показали, что предложенный инвагинационный клапан выдерживает гидростатическое давление мочевого пузыря до 105±12 см. водного столба, и это позволило применить данный метод в клинике.
Целью экспериментальной работы на лабораторных животных было обоснование использования аллогенного соединительнотканного трансплантата для фиксирующей пластики в клапанной хирургии кишечного мочевого пузыря.
В результате морфологического изучения процесса приживления трансплантата были выявлены особенности: возможность его моделирования в форме полос, высокие прочность и упругость, небольшое относительное удлинение; строгая ориентированность в одном направлении и упакованность волокон трансплантата без выраженных прослоек рыхлой ткани. Также, он, как и остальные соединительнотканные аллотрансплантаты способен замещаться на ткани реципиента без существенной потери заданных свойств и имеет – минимальный иммунный ответ на трансплантат.
Положительные результаты экспериментальных исследований на трупном материале и лабораторных животных позволили использовать модификацию операции Штудера с применением аллогенного материала для формирования антирефлюксных клапанов в клинике.
РЕЗУЛЬТАТЫ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
Илеоцистопластика по Штудеру с формированием инвагинационного клапана с использованием аллогенного соединительнотканного трансплантата для фиксирующей пластики.
В основной группе больных для защиты верхних мочевых путей от пузырно-мочеточникового рефлюкса из необладера был сформирован клапан с использованием 2-х полос аллогенного соединительнотканного трансплантата для фиксирующей пластики размерами 1х12 см.

Рис. 3. Этап формирования ивагинационного клапана недетубуляризированной петли кишечного мочевого пузыря.

Рис. 4. Фиксация стенки резервуара к проксимальному кольцу аллогенного соединительнотканного трансплантата.
Всего по данной методике прооперированно 36 больных, послеоперационной летальности и осложнений, связанных с искусственным мочевым пузырем, не было.
Продолжительность радикальной цистэктомии с одномоментной илеоцистопластикой по Штудеру составила в среднем 3,0±1,0 часов. В основной группе она была несколько больше и составила 3,5±1,0 часа, что связано с формированием инвагинационного клапана. Интраоперационная кровопотеря в среднем составила 357±125 мл, в основном на этапе цистэктомии.
При исследовании давления в искусственном мочевом пузыре нами были получены данные, сопоставимые с литературными, при средней емкости 250±60 мл через 3 месяца после операции давление при мочеиспускании составляло 25±6 см водного столба. При этом в контрольной группе в 100% был выявлен рефлюкс мочи в верхние мочевые пути.
Характер раннего послеоперационного периода у больных с нейрогенными расстройствами мочеиспускания (опыт кишечной пластики мочевого пузыря с последующей пересадкой почки).
Нами проанализирован ранний послеоперационный период у 258 больных перенесших кишечную пластику мочевого пузыря. Среди них число больных с нейрогенными расстройствами мочеиспускания составило 19. В последнее время проблема нейрогенных расстройств акта мочеиспускания (нейрогенный мочевой пузырь) в урологии занимает одно из центральных мест. Это обусловлено большой распространенностью и многообразием причин, вызывающих эвакуаторную несостоятельность мочевых путей, а также зависимостью между степенью нарушений уродинамики, активностью пузырно-мочеточникового рефлюкса (ПМР), цистита, пиелонефрита и сроками возникновения функциональной недостаточности почек (Аляев Ю.Г., Григорян В.А., 2006; Вишневский Е.Л., Пушкарь Д.Ю., Лоран О.Б., 2004; Kashi S.H., Wynne K.S., Sadek S.A. et al., 2004).
До недавнего времени пациенты с нейрогенными расстройствами мочевого пузыря были исключены из программ по пересадке почки, так как считалось, что мочевой пузырь способствующий разрушению своих почек, представляет угрозу трансплантированной почке, в связи повышенным риском развития посттрансплантационных урологических осложнений, инфекцией мочевого тракта и низкой выживаемостью трансплантата (Luke P.W., Herz D.B., et al., 1999).
В настоящее время в отечественной урологии опубликован один случай родственной пересадки почки у больной с аугментированным мочевым пузырем (Павлов В.Н., Загитов А.Р., Галимзянов В.З. «Урология» №1 2009). Первым этапом была выполнена субтотальная резекция мочевого пузыря с формированием Штудеровского мочевого пузыря и дополнительной аппендикостомой по Митрофанову (рис. 5).


Рис. 5. Кишечная пластика мочевого пузыря по Штудеру с аппендикостомой по Митрофанову. 1 – недетубулизированный участок кишки мочевого пузыря; 2 – необладдер; 3 – аппендикостома.


Рис. 6. Схема реконструктивной операции. 1 – трансплантат; 2 – необладдер; 3 – уретеро-необладдерный анастомоз; 4 – аппендикостома; 5 – шейка мочевого пузыря.


Рис. 7. Магнитно-резонансная томография органов брюшной полости. 1 – почечный трансплантант; 2 – необладдер.
Таким образом, кишечная пластика мочевого пузыря с последующей пересадкой почки может являться операцией выбора у больных с терминальной стадией хронической почечной недостаточности, обусловленной нейрогенной дисфункцией мочевого пузыря.
Характеристика раннего послеоперационного периода и состояние микроциркуляции искусственного мочевого пузыря.
Необходимо отметить, что осложнений, связанных с несостоятельностью швов искусственного мочевого пузыря было в основной 2 (1,5%), и в контрольной группе 6 (4,8%).
Осложнения после замещения мочевых путей зависят от совокупности разных факторов – методики операции, лечения основного заболевания, возраста больного и сроков наблюдения. Ранние осложнения встречаются редко. К ним относятся массивное кровотечение, кишечную непроходимость, мочевые затеки и раневая инфекция. Среди поздних осложнений следует отметить метаболические нарушения, пиелонефрит и образование мочевых камней. К поздним операционным осложнениям относятся также стриктура уретерорезервуароанастамоза, сморщивание почек, ХПН, послеоперационные грыжи (табл. 4).
Таблица 4.
Ранние послеоперационные осложнения после операций кишечной пластики мочевого пузыря
| Виды осложнений | Основная группа (n=132) | Контрольная группа (n=126) | ||||
| Осложнения, связанные с неоцистом (несосотоятельность, мочевой перитонит и др.) | 2 (1,5%) | 6 (4,8%) | ||||
| Осложнения, связанные с уретеро-уретеро-илеоанастомозом | - | 1 (0,8%) | ||||
| Несостоятельность межкишечного анастомоза | 1 (0,8%) | 1(0,8%) | ||||
| Стойкий парез кишечника, динамическая непроходимость | 6 (4,6%) | 10 (7,9%) | ||||
| Ранняя спаечная непроходимость | 2 (1,5%) | 3 (2,4%) | ||||
| Расхождение краев раны, в том числе эвентрация | 2 (1,5%) 2 (1,5%) | 12 (9,5%) 5 (4,0%) | ||||
| Нагноение раны | 9 (6,8%) | 20 (15,9%) | ||||
| Острый пиелонефрит, в том числе потребовавший оперативного лечения | 10 (7,6%) - | 32 (25,4%) 10 (7,9%) | ||||
| Раннее послеоперационное кровотечение | - | 1 (0,8%) | ||||
| Тромбоз глубоких вен нижних конечностей | 1 (0,8%) | 1 (0,8%) | ||||
| острое нарушение мозгового кровообращения | 1 (0,8%) | 2 (1,6%) | ||||
| Послеоперационная пневмония | 1 (0,8%) | 2 (1,6%) | ||||
| Гипертоническая болезнь, ишемическая болезнь сердца | 1 (0,8%) | 2 (1,6%) | ||||
| Инфаркт | 1 (0,8%) | 3 (2,4%) | ||||
| ТЭЛА | - | 1 (0,8%) | ||||
| Всего | 34 (25,8%) | 74 (58,7%) |
При формировании мочевой кишечной стомы, как окончательного варианта операции, больные недовольны результатом операции из-за осложнений со стороны стомы. К этим осложнениям следует отнести стеноз, парастомическую грыжу, контактный дерматит и грибковые инфекции кожи из-за длительного контакта с мочой и компонентами клейких накладок мочеприемников. Поэтому мы, как правило, формировали ортотопический мочевой пузырь одномоментно, либо проводили конверсию мочевого кондуита в кишечный мочевой пузырь.
Исследования микроциркуляции методом лазерной допплеровской флоуметрии показали, что рассечение стенки кишки резко ухудшает показатели микроциркуляции в области разреза (рис. 8).


Рис. 8. ЛДФ-грамма (А) и амплитудно-частотный спектр (Б) микроциркуляторного русла в зоне формирования анастомоза. Стазический характер изменений микроциркуляции.
Так, в первой зоне ЛДФ-грамма и амплитудно-частотный спектр колебаний кровотока соответствует стазической форме нарушений.
Клинические исследования состояния микроциркуляции кишечного трансплантата показали, что илеоцистопластика сопровождается глубокими нарушениями микроциркуляторного звена серозной оболочки кишки. При пересечении кишки и анастомозировании с мочеточниками и уретрой от центра к периферии (неизмененным тканям) состояние микроциркуляции имеет зональное распределение, причем зоны последовательно сменяют друг друга, частично перекрывая. Первая зона – зона некротических изменений и нарушений целостности микроциркуляторного русла располагается непосредственно по краю разреза. Вторая зона – дисфункциональной дилятации всех звеньев микроциркуляции – представляла полосу, шириной 3-5 мм, по краю разреза. Третья зона – зона умеренных нарушений микроциркуляции характеризовалась спазмом артериол, дилятацией венул, нарушением лимфатического дренажа тканей.
Данные изменений микроциркуляции прямо коррелируют с регенераторными процессами. Динамика показателя микроциркуляции показывает на его стабильно низкие значения в первой и второй зонах во все сроки наблюдения, что, очевидно, отражается на степени выраженности репаративных процессов. Вероятно, усиление микроциркуляции в третьей зоне со «сдвигом» ее в направлении центра разреза служит как пролиферативным стимулом, так и базисом для обеспечения регенерации.

Рис. 9. Динамика изменений показателей микроциркуляции при спонтанной регенерации разреза.
- - показатель микроциркуляции;
- - эффективность микроциркуляции.
По видимому, блок микроциркуляции в первой и второй зонах способствует, с одной стороны, уменьшению аутоинтоксикации за счет снижения всасывания продуктов распада. С другой стороны, сосудистая изоляция раневого дефекта ограничивает поступление в кровоток и в интерстициальное пространство факторов стимуляции регенерации (эпидермальный и мезенхимальные факторы роста, и т.д.).
Это, по видимому, также как и сохранение инфекционно-воспалительного процесса, способствует возникновению и прогрессированию хронического пиелонефрита в данной группе больных.
Отсутствие полноценного заживления анастомозов в контрольной группе указывает на хронизацию «цистита необладдера». Это обусловлено воздействием на слизистую оболочку тонкой кишки повреждающих факторов и несовершенство репаративного процесса. Глубокие нарушения транскапиллярного обмена и микроциркуляции в зоне анастомозов приводят либо к несостоятельности, либо к стриктурам уретеро- кишечных и уретро-кишечных анастомозов.
Анализ показателей микроциркуляции показывает, что при использовании однорядного шва не происходит критического падения основных показателей перфузии кровью. Восстановление показателя микроциркуляции происходит к 3 суткам, сосудистого, тонуса – к 5 суткам, эффективность микроциркуляции в первые сутки составила 73,6 ± 6,9 %, во вторые и третьи – 81,5 ±7,5 % и 92,8 ± 10,5 % соответственно. Таким образом, для обычной, протекающей без технических трудностей реконструктивно - пластической операции, наложение второго ряда швов при формировании кишечного мочевого пузыря необоснованно.
Анализ раневых осложнений у больных основной и контрольной групп.
Как показали проведенные исследования, в общей структуре ранних послеоперационных осложнений, осложнения, связанные с состоянием послеоперационной раны, занимают значительное место. При этом на первом месте среди осложнений, потребовавших повторное оперативное вмешательств в ранние сроки среди больных контрольной группы была эвентрация органов брюшной полости.
Бактериологическое исследование мочи, выполненное перед оперативным вмешательством, свидетельствовало о наличии роста микрофлоры в 26,7% клинических наблюдений. Это требовало назначения пред- и интраоперационной антибиотикотерапии в соответствии с общепринятыми стандартами. При этом микробный пейзаж мочи характеризовался выраженным бактериальным полиморфизмом. Было замечено, что в большинстве случаев высевалась грамотрицательная флора, среди которой преобладали возбудители семейства энтеробактерий (кишечная палочка, протей, энтеробактер – 33,2% клинических наблюдений). Грамположительная микрофлора была представлена стафилококком, на долю которого приходилось 16,6% наблюдений. * - р<0,05, в остальных случаях р>0,05
Биохимическое исследование раневого отделяемого, выполненное в первые сутки после операции, свидетельствовало о том, что при использовании однорядного непрерывного хирургического шва в 89,5% наблюдений имела место щелочная реакция раневого экссудата. В остальных 10,5% случаев была зафиксирована нейтральная реакция среды (рис. 10).

Рис. 10. Реакция раневого экссудата после илеоцистопластики в основной и контрольной группах.
У больных, которые перенесли операцию кишечной пластики мочевого пузыря, при ушивании мышечной стенки непрерывным обвивным швом двойной нитью ВИКРИЛ®ПЛЮС 2/0 с прошиванием через все слои, с преимущественным захватом аппоневроза при использовании вакуум-терапии в лечении послеоперационной раны, к середине второй недели лечения имела место дальнейшая нормализация показателей периферической крови и позволяет улучшить результаты лечения послеоперационных ран. В общем анализе мочи сохранялась воспалительная реакция в виде лейкоцитурии и высокой бактериальной обсемененности, где преобладала грамотрицательная флора. В указанные сроки температура кожи околораневой области снижалась до исходного значения. Особенно важным является то, что цитологическая картина раневого экссудата к этому времени характеризовалась достаточным количеством соединительнотканных элементов на фоне минимального содержания нейтрофилов.
В отличие от изложенного при традиционном лечении аналогичных ран объективная оценка развития раневого процесса свидетельствовала о сохранении воспалительной реакции. Об этом свидетельствовала диспротеинемия в биохимическом анализе крови, в цитограммах сохранялся воспалительно-регенеративный тип клеточной реакции.
Количество раневых инфекционных осложнений снижается до 18,75%, что в два раза меньше по сравнению с традиционным лечением послеоперационной раны подобного происхождения (табл. 5.).
Таблица 5.
Ранние послеоперационные осложнения больных основной и контрольной групп
| Вид осложнения | Контрольная группа | Основная группа | ||
| абс. | % | Абс. | % | |
| Расхождение кожных швов | 12 | 21 | 0 | 0 |
| Эвентрация | 5 | 8,8 | 1 | 0 |
| Нагноение раны | 20 | 35 | 9 | 18,75 |
| Кровотечение | 0 | 0 | 0 | 0 |
| Инфильтрация | 22 | 38,6 | 9 | 18,75 |
| Итого | 23 | 40,3 | 9 | 18,75 |
Таким образом, осложнения со стороны операционной раны влияют как на непосредственные, так и отдаленные результаты оперативного вмешательства. Наиболее частое среди тяжелых – эвентрация органов брюшной полости в связи с расхождением или прорезыванием швов.
Таблица 6.
Сравнительная характеристика динамики заживления раны в основной и контрольной группах в период 9-11 сутки
| контрольная | основная | |
| Отек краев раны | ++ | + |
| Гиперемия тканей | ++ | + |
| Промокание повязки | ++ | - |
| Отделяемое по дренажу | 200-300мл | 150-300мл |
| Обсемененность тканей | 73,9% | 62,5% |
| pH тканей | кислая | щелочная |
| Количество белка в экссудате | 42,26±0,47 г/л | 31,16±0,51г/л |
| Количество фибробластов в ткани | 1,34±0,04 | 2,48±0,12 |
| Температура тканей вокруг раны | 34,6±0,07С | 33,3±0,05С |
*–р<0,05, в остальных случаях р>0,05
В раннем послеоперационном периоде в контрольной группе расхождение нескольких швов наблюдалось у 12 (21%) больных из них эвентрация у 5 (8,8%). В основной группе подобных осложнений не было. Нагноение раны было в основной группе у 9 (18,75%) больных, в контрольной – у 20 (35%).
Общее количество осложнений в основной группе составило 9 (18,75%), контрольной 23 (40,3%).
В табл. 6 показана положительная динамика заживления послеоперационной раны у больных основной группы по сравнению с контрольной. Использование шовного материала с антибактериальными свойствами наряду с применением постоянной эвакуации раневого отделяемого имеет выраженный клинический эффект. Сокращение количества послеоперационных осложнений более чем в 2 раза позволяет оценить результаты как существенно влияющие на качество жизни больных и общие результаты лечения.
Таким образом, модифицированная хирургическая техника ушивания послеоперационной раны, наряду с использованием предложенного алгоритма ведения больных в послеоперационном периоде позволяет значительно сократить количество и степень выраженности раневых осложнений и улучшить результаты лечения больных.
Динамика состояния иммунологической реактивности у больных после кишечной пластики мочевого пузыря.
При кишечной пластике мочевого пузыря происходит контаминация необладдера как кишечной, так и мочевой флорой. Однако, клинические проявления в виде инфекционно-воспалительных осложнений в первую очередь связаны с развитием катетер-ассоциированной и внутрибольничной инфекции. С течением времени видовой состав и антибиотикочувствительность возбудителей инфекции мочевых путей в каждой клинике претерпевают изменения, и это диктует необходимость постоянного микробиологического мониторинга. Частота выявления основных микроорганизмов в моче больных в раннем послеоперационном периоде и их антибиотикочувствительность представлена в табл.7.
У больных с артифициальным мочевым пузырем основными микроорганизмами, вызывающими инфекцию мочевых путей, являлись представители грамотрицательной кишечной флоры, относящиеся к семейству Enterobacteriaceae (80%). При наличии воспалительного процесса по сравнению с бессимптомной бактериурией из мочи достоверно чаще высевались представители рода Proteus (28,8%), Enterobacter spp. (13,2%), Ps.aeruginosa (2,4%), St.aureus (2,4%). Доля E.coli в обоих случаях сохранялась примерно на одном уровне. Кроме этого на фоне воспаления в 22,4% случаев были выделены ассоциации микробных агентов, чего не отмечалось при бессимптомной бактериурии.
Развитие вторичного пиелонефрита на фоне дисфункции необладера или неовезико – пузырного рефлюкса характеризовалось высокой частотой высевания из мочи E.Coli (22,6%), Enterobacter spp. (20,3%), Proteus spp. (15,7%), грамположительных представителей семейства Micrococcaceae (14,2%).
Таблица 7
Сравнительная чувствительность основных возбудителей инфекции кишечного трансплантата к антибактериальным препаратам in vitro (%)
| Микроорганизм | E.coli | Proteus spp. | Ps.aeruginosa | Enterobacter аgg. | |||||
| Антибиотик | Исследовано штаммов | Чувствительность % | Исследовано штаммов | Чувствительность % | Исследовано штаммов | Чувствительность % | Исследовано штаммов | Чувствительность % | |
| Офлоксацин | 12 | 87,8 | 26 | 58,2 | 26 | 48,0 | 17 | 70,0 | |
| Пефлоксацин | 36 | 77,9 | 21 | 62,0 | 16 | 55,0 | 16 | 66,0 | |
| Ципрофлоксацин | 33 | 96,0 | 23 | 47,8 | 20 | 55,0 | 23 | 78,2 | |
| Цефотаксим | 16 | 93,0 | 41 | 82,4 | 13 | 76,9 | 12 | 83,3 | |
| Цефамандол | 45 | 66,6 | 20 | 50,0 | 7 | 71,0 | 40 | 70,0 | |
| Цефазолин | 46 | 63,0 | 43 | 27,0 | 16 | 0 | 36 | 8,0 | |
| Гентамицин | 48 | 42,6 | 21 | 52,0 | 10 | 40,0 | 50 | 44,0 | |
| Канамицин | 77 | 49,2 | 40 | 40,0 | 18 | 16,6 | 55 | 49,1 | |
| Мономицин | 67 | 12,0 | 40 | 15,0 | 18 | 16,6 | 55 | 27,0 | |
| Левомицетин | 44 | 27,3 | 10 | 60,0 | 12 | 16,6 | 50 | 30,0 | |
| АМП/СБ | 48 | 52,0 | 21 | 28,0 | 18 | 39,0 | 45 | 66,6 | |
| Карбенициллин | 67 | 28,0 | 40 | 5,0 | 16 | 0 | 55 | 18,1 | |
| Ампициллин | 48 | 0 | 40 | 0 | 20 | 0 | 55 | 0 | |
Развитие воспалительного процесса верхних мочевых путей при наличии уретеро-пиело-неовезико дренажа, выведенного через рану сопровождалось достоверным увеличением в микробном спектре представителей Proteus spp.(22,5%), Ps.aeruginosa (16,7%), Enterococcus fecalis (8,8%). При этом значительно возрастала доля смешанной инфекции (34,3%). Это также требовало удаления данного дренажа в максимально короткие сроки – не более 10-11 суток после операции.
При вторичных воспалительных процессах верхних мочевых путей на фоне осложнений со стороны операционной раны, затрудненного мочеиспускания, продолженного использования уретрального катетера преобладающими микробными агентами являлись представители рода Proteus (38%), E.Coli (21,4%), Enterobacter spp. (9,5%).
Катетер-ассоциированная инфекция кишечного мочевого пузыря характеризовалась еще большей частотой высевания протейной флоры (40,2%), Ps.aeruginosa (15%), Enterobacter spp. (11,2%). Вместе с этим значительно снижалась доля грамположительной флоры семейства Micrococcaceae (2,8%). На фоне наружного дренирования значительно чаще (36,4% случаев) выявлялось сочетание нескольких микробных агентов.
Согласно полученным данным прослеживается четкая связь между колонизацией мочевых путей высоковирулентными микробными агентами Proteus spp., E.Coli, Enterobacter spp., Ps.aeruginosa и развитием воспалительного процесса мочевых путей. Наличие наружного дренирования значительно облегчает процесс колонизации мочевых путей полирезистентными госпитальными штаммами, способствует увеличению доли микробных ассоциаций.
Полученные данные представляют несомненный клинический интерес, поскольку по данным наших исследований, согласующимися с большинством литературных данных, пассивный, либо активный рефлюкс наблюдается сроки до 6 месяцев после операции вне зависимости от способа кишечной пластики мочевого пузыря.
Нами проведено изучение динамики изменений показателей иммунограмм у больных до операции и в послеоперационном периоде. Иммунологические исследования проводились до операции, в 1-5 и на 15-20 сутки после операции (табл. 8).
При развитии пиелонефрита после илеоцистопластики наблюдается исходно сниженный уровень показателей Т-клеточного звена иммунитета. Данный механизм инфекционной иммуносупрессии неспецифичен, обеспечивая быстрое размножение бактерий в период угнетения клеточного компонента. Оперативная агрессия и операционный стресс приводят к еще большему снижению значений Т- и В-лимфоцитов по сравнению с нормой. В ходе проводимого лечения на 15-20 сутки уровень Т-лимфоцитов имел тенденцию к росту, но не достигал нормальных значений, что свидетельствует о неполном завершении воспалительного процесса в организме.
Снижение клеточного компонента при вторичном воспалительном поражении мочевых путей сопровождалось интенсивной активизацией специфических гуморальных факторов иммунитета, особенно иммуноглобулинов G и M. Роль специфического гуморального иммунитета в ограничении воспалительного процесса мочевыводящих путей и защите от инфекции неясна. Условно-патогеная флора, как основной возбудитель инфекции мочевыводящих путей, обладает филогенетически обусловленной толерантностью по отношению к факторам специфического гуморального иммунитета, основным механизмом ее элиминации является фагоцитоз, усиленный опсонизирующей способностью иммуноглобулинов, системой комплемента и лизоцимом. Следовательно, изменения специфического гуморального иммунитета следует рассматривать в связи с факторами фагоцитарной активности.
Таблица 8
Средние значения показателей иммунограммы у больных с катетер-ассоциированной инфекцией верхних мочевых путей (n=31)
| Показатель | Норма | До операции | 1-5 сутки после операции | 15-20 сутки после операции |
| Лк | 5,8±0,3 | 5,4±0,3 | 7±0,4* ** | 5,6±0,3 |
| Лма | 1,6±0,1 | 1,6±0,3 | 1,8±0,2 | 1,5±0,06 |
| Лмо | 29,4±1,1 | 29,7±1,2 | 25,8±1,7* ** | 34,7±1,3* ** |
| Тла | 1,1±0,08 | 1,8±0,03* | 0,75±0,06* ** | 0,9±0,01* ** |
| Тло | 67,3±1,2 | 68,1±1,3 | 56,1±1,9* ** | 64,4±2,9 |
| Вла | 0,1±0,01 | 0,15±0,006* | 0,13±0,008* ** | 0,09±0,005** |
| Вло | 8,2±0,9 | 8,4±0,4 | 7,3±0,6 | 5,4±0,2* ** |
| ФИ | 55,2±1,8 | 42,7±1,7* | 40±1,7* | 42,5±3,9* |
| ФЧ | 6,2±0,3 | 5,1±0,3* | 5±0,3* | 4,8±0,4* |
| НСТс | 7,5±0,5 | 6,2±0,6* | 10,8±0,5* ** | 9,3±0,7* ** |
| НСТи | 15±0,4 | 14,3±0,4 | 11,6±0,3* ** | 12,5±0,6* ** |
| IgG | 14,5±0,7 | 10,2±0,5* | 17,5±0,6* ** | 16,5±0,9* ** |
| IgA | 3±0,2 | 2,1±0,2* | 2,7±0,1** | 2,5±0,2 |
| IgM | 2±0,2 | 1,5±0,1 | 2,2±0,2** | 2,6±0,3** |
Примечание: *- достоверность различий по сравнению с нормой; **- достоверность различий по сравнению с исходным значением (р<0,05).
В первые 5 суток после операции отмечается снижение количества фагоцитирующих нейтрофилов, их функциональной активности и потенциала бактерицидных систем элиминации фагоцитированных бактерий, не восстанавливаясь до нормы и к 15-20 суткам.
На основании полученных данных можно заключить, что послеоперационный период у больных с вторичным пиелонефритом характеризуется снижением функционального потенциала нейтрофильных лейкоцитов, количественным и качественным дефицитом Т-клеточного звена иммунитета и изменением процесса антителогенеза. Указанные иммунологические сдвиги имеют безусловное патогенетическое значение как один из факторов возникновения и прогрессирования воспалительного процесса верхних мочевых путей. Нарушение фагоцитоза, количественная и функциональная недостаточность иммунокомпетентных клеток способствуют инфицированию мочевых путей оппортунистической условно-патогенной микрофлорой, персистенции и дальнейшему размножению бактерий.
Как показали наши исследования, в процессе общепринятого лечения вторичной инфекции верхних мочевых путей после выполнения оперативного вмешательства не происходит нормализации нарушений иммуногомеостаза, наблюдается диссоциация клинико-лабораторных и иммунологических параметров. В конечном счете, несостоятельность иммунологических защитных механизмов ведет к хронизации воспалительного процесса в мочевыводящих путях, ухудшая как непосредственные, так и отдаленные результаты лечения больных с формированием кишечного мочевого пузыря.
Результаты иммунизации стафило-протейно-синегнойной вакциной больных и их оценка.
Эффективность иммунизации стафило-протейно-синегнойной вакциной больных проводили на основании определения частоты и степени выраженности, общих и местных поствакцинальных реакций, наблюдения динамики данных общих и биохимических анализов крови, анализов мочи, показателей неспецифического и специфического иммунитета.
Общие реакции организма в ответ на введение 1,0 мл СПСА-вакцины развились у 30,7% больных. Они проявлялись в виде общего недомогания, субфебрильной температуры тела, умеренной миалгии в течение первых суток после вакцинации и укладывались в допустимые поствакцинальные реакции. При иммунизации дозой 0,5 мл общие реакции наблюдались гораздо реже - в 11,1% случаев (р<0,05). Местная воспалительная реакция после вакцинации дозой 0,5 мл отсутствовала у 5 больных (20,9%), Слабые местные реакции, признаками которых служили эритема на месте инъекции и (или) малоболезненный инфильтрат менее 2,5.см в диаметре, имели место в 17 случаях (77,2%) случаев. Реакции средней степени интенсивности, проявлявшиеся в возникновении инфильтрата диаметром 2,5-5 см, зафиксированы у 4 привитых пациентов (17,9%), причем, если при введении дозы 1,0 мл такие реакции возникали у каждого третьего, то при дозе 0,5 мл они наблюдались в 2 раза реже.
Иммунизация СПСА-вакциной не оказывала влияния на функции печени, почек, сердца у больных; что подтверждалось отсутствием изменений в общих, биохимических показателях крови, ЭКГ и согласовалось с данными исследований у добровольцев (Кунягина О. В., 1996).
Нами применена двукратная схема вакцинации СПСА вакциной, при которой первоначальная прививочная доза составляла 0,5 мл, а ревакцинация проводилась через 14 дней дозой 1,0 мл. При двукратной схеме иммунизации через 10-14 суток после введения 0,5 мл вакцины интенсивность иммунного ответа на все антигены препарата практически не отличалась от таковой при введении дозы 1,0 мл. После ревакцинации дозой 1,0 мл наблюдался дальнейший подъем уровней специфических антител.
На момент операции кратность превышения достигнутых титров над исходными составила: для антистафилококковых антител – 5, антипротейных – 2,3, антисинегнойных – 4. Уровень антистафилолизина возрос в 3,2 раза. Преимущество двукратной схемы иммунизации перед однократной проявлялась в дальнейшем нарастании титра специфических антител после ревакцинации. Так, на период максимально опасный для развития КАИ обусловленный антибиотикорезистентной госпитальной флорой титры антистафилококковых антител в сыворотках привитых достигали 104,33±5,68, антисинегнойных антител – 45,12±5,44, антипротейных – 35,83±4,14. Более выраженный иммунный ответ в сочетании с низкой реактогенностыо вакцины послужили основанием к использованию в дальнейшем этой схемы иммунизации.
Иммунизация СПСА-вакциной способствовала повышению значений некоторых показателей неспецифического, клеточного и гуморального иммунитета (табл. 9).
Таблица 9
Показатели иммунитета у больных вакцинированных СПСА-вакциной
| Обследуемая группа | Норма | До лечения | 1 группа | 2 группа |
| После лечения антибиотиками | После лечения антибиотиками и ПСА вакцинами. | |||
| Кол-во исследованных | 40 | 31 | 14 | 21 |
| Лк | 5,8±0,3 | 7,7±0,3 | 6,6±0,5 | 6,4±0,4* |
| Нетр | 3,8±0,12 | 5,3±0,4 | 4,4±0,2* | 3,9±0,1* ** |
| Лма | 1,6±0,1 | 1.5±0.06 | 1,49±0,13 | 1,99±0,08* ** |
| Лмо | 29,4±1,1 | 26,4±1,4 | 24,7±2,2 | 27,9±1,6 |
| Тла | 1,1±0,08 | 0.8±0.04 | 0,97±0,15 | 1±0,04* |
| Тло | 67,3±1,2 | 55,7±1,4 | 53,9±3,4 | 63,4±2,3* ** |
| Вла | 0,1±0,01 | 0,08±0,009 | 0,08±0,008 | 0,12±0,01 |
| Вло | 8,2±0,9 | 6,5±0,6 | 4,8±0,4 | 7,64±0,9** |
| IgG | 14,5±0,71 | 14,6±0,5 | 18,1±1,5* | 19,2±1,4* |
| IgA | 3±0,2 | 3,4±0,2 | 4±0,3 | 4,1±0,4 |
| IgM | 2±0,2 | 1,6±0,3 | 2,3±0,3* | 2,8±0,6 |
| ФИ | 55,2±1,8 | 36,8±1,3 | 34,6±2,4 | 44,9±3,4* ** |
| ФЧ | 6,2±0,3 | 5,5±0,3 | 4,1±0,4* | 6,2±0,5** |
| НСТс | 7,5±0,5 | 11,5±0,3 | 9,9±0,5* | 9,4±0,6* |
| ИА | 0,09±0,008 | 0,13±0,004 | 0,1±0,007* | 0,11±0,005* |
| НСТи | 15±0,4 | 14,3±0,3 | 11,6±0,7* | 15,7±0,5* ** |
| ИА | 1±0,05 | 0,17±0,008 | 0,13±0,006* | 0,2±0,01* ** |
Примечание: * - достоверность различий с показателями до лечения; **- достоверность различий показателей в группах (р<0.05).
Сравнение динамики изменения иммунологических показателей в группе, где применялась вакцинация с группой, в которой проводилась традиционная схема лечения, показало следующие значимые отличия:
Абсолютное количество лимфоцитов при использования комбинированной терапии (СПСА-вакцина+антибиотик) было выше (1,99±0,8 и 1,49±0,13, р<0,05);
Относительное количество Т-лимфоцитов на фоне вакцинации приходило к концу лечения к нормальным значениям, что наряду с клинической нормализацией являлось показателем завершенности воспалительного процесса. На фоне стандартной схемы лечения относительное количество Т-лимфоцитов не восстанавливалось, оставаясь достоверно ниже (63,4±2,3% и 53,9±3,4%, р<0,05);
Уровень нейтрофилов при применения иммунопрофилактики к концу лечения приходил в норму, в то время как при традиционной схеме лечения количество нейтрофилов на фоне клинического выздоровления оставалось повышенным (3,8±0,1 и 4,4±0,2, р<0,05);
На фоне вакцинотерапии достоверно выше были: доля фагоцитирующих нейтрофилов (44,9±3,4% и 34,6±2,4%, р<0,05), их функциональная активность, определяемая фагоцитарным числом (6,2±0,5 и 4,1±0,4, р<0,05), а также их метаболическая активность, согласно индуцированному НСТ-тесту (15,7±0,5% и 11,6±0,7%, р<0,05) и индексу активации нейтрофилов (0,2±0,1 и 0,13±0,006, р<0,05);
Таким образом, значительно сниженный функциональный потенциал нейтрофилов при традиционной этиотропной терапии не нормализуется. Это свидетельствует о сохранении дефицита бактерицидного потенциала и после проведенного лечения, что способствует прогрессированию гнойно-воспалительных осложнений. Использование комбинированной схемы лечения (вакцинация + антибиотик) не только приводило к выработке защитного титра специфических антител, но способствовало стимуляции неспецифического клеточного звена, увеличивая количество фагоцитирующих клеток, их функциональную и метаболическую активность. Все это приводило к достижению в более короткие сроки клинико-иммунологической нормализации у больных после кишечной пластики мочевого пузыря.
Подводя итоги применения СПСА-вакцины, необходимо оценить эффективность иммунопрофилактики по частоте возникновения гнойно-септических осложнений после подобных операций и сравнить результаты с контрольной группой.
Из 115 пациентов исследуемой группы, перенесших цистэктомию, либо аугментацию мочевого пузыря с последующей илецистопластикой по Studer, интраоперационное инфицирование не возникло ни у одного (табл. 10).
Таблица 10
Частота гнойно-септических осложнений после при тонкокишечной пластике мочевого пузыря и летальность от них у иммунизированных и неиммунизированных больных
| Группа больных | Число больных | Число больных с гнойно-септическими осложнениями | Летальность | ||
| Абс. | % | Абс. | % | ||
| Иммунизированные | 115 | 14 | 18,1 | 0 | 0 |
| Неиммунизированные | 98 | 24 | 28,5 | 2 | 2,5 |
| РI | <0,05 | >0,05 | |||
Примечание. PI - статистические различия между соответствующими показателями 1 и 2 групп; Р2 - то же для 2 и 3 групп;
Частота гнойно-септических осложнений в раннем послеоперационном периоде после операций у больных, подвергшихся иммунопрофилактике СПСА-вакциной, составвило 18,1%, летальность 0%.
Контаминация дренажных систем мочевых путей госпитальными штаммами синегнойной палочки и протея не приводила к развитию острого воспалительного процесса, протекая в виде бессимптомной бактериурии у 66,2% больных обеих групп. При этом бактериурия достаточно быстро купировалась после удаления дренажей мочеточников и необладдера. Из 115 вакцинированных больных только у двух ранний послеоперационный период осложнился атакой острого пиелонефрита.
В контрольной группе инфекционно-воспалительные осложнения развилась у 24 из 98 больных (28,5±3,9%), возбудителями чаще всего выступали протей и синегнойная палочка. Летальность от гнойно-септических осложнений после операций в контрольной группе составила 2,5%. В основной группе летальности не было.
Таким образом, в результате проведенных нами исследований обоснована возможность и целесообразность использования СПСА-вакцины у больных для профилактики осложнений кишечной пластике мочевого пузыря, доказана ее клиническая эффективность, заключающаяся в снижении частоты гнойно-септических осложнений и уменьшении числа смертельных исходов от них после операций.
Таким образом, преобладание в этиологической структуре гнойно-септических процессов стафилококка, синегнойной палочки и протея позволяет рассматривать их в качестве наиболее вероятных возбудителей хирургической инфекции после операций по формированию тонкокишечных мочевых пузырей.
Оперативные вмешательства в значительной степени усугубляют исходный иммунодефицит, имеющийся у больных раком мочевого пузыря, вследствие чего повышается риск возникновения опасных для жизни гнойно-септических осложнений.
Иммунизация СПСА-вакциной по разработанной нами методике хорошо переносится больными и способствует созданию активного специфического иммунитета против основных возбудителей госпитальной инфекции.
Клиническая эффективность специфической иммунопрофилактики СПСА-вакциной заключается в снижении частоты гнойно-септических осложнений после операций по формированию тонкокишечного мочевого пузыря с 28,5 до 18,1 %.
Показатели микроциркуляции у больных основной группы и группы сравнения в позднем послеоперационном периоде.
Нами изучалась микроциркуляция кишечного мочевого пузыря в отдаленном периоде у 23 больных в основной группы и 23 пациентов группы сравнения в динамике ло 3-х лет.
Клинические исследования состояния микроциркуляции кишечного трансплантата через 3 месяца показали, что илеоцистопластика сопровождается глубокими нарушениями микроциркуляторного звена слизистой кишки, как в основной, так и контрольной группах (табл. 11).
Таблица 11
Характеристика микроциркуляции кишечного трансплантата в основной группе и группе сравнения
| Параметры | 3 месяца | 6 месяцев | 1 год | |||
| Группа сравнения | Основная группа | Группа сравнения | Группа сравнения | Основная группа | Группа сравнения | |
| Показатель микроциркуляции (перфузионные единицы). | Группа сравнения | Основная группа | Группа сравнения | Основная группа | Группа сравнения | Основная группа |
| Коэффициент вариации, (Kv) | 2,5±0,3 | 5,2±1,3* | 3,6±0,5 | 8,4±1,3* | 3,7±0,6 | 8,7±1,4* |
| Частота флаксмоций, (Fv) | 12,20±0,03 | 25,39±14,12 | 13,22±0,18 | 24,84±6,07* | 12,24±0,09 | 25,72±1,08* |
| Амплитуда флаксмоций, (Av) | 1,4±0,1 | 1,9±0,2* | 1,4±0,2 | 2,3±0,5* | 1,6±0,4 | 2,8±0,3* |
| Сосудистый тонус (условные единицы), Ст | 0,41±0,02 | 0,71±0,07* | 0,51±0,05 | 0,72±0,05* | 0,8±0,04 | 1,8±0,04* |
| Эффективность микроциркуляции (условные единицы), ЭМ | 1,5±0,3 | 2,5±0,4* | 1,4±0,4 | 2,7±0,5* | 1,9±0,2 | 3,8±0,7* |
Клинические исследования показали, что состояние микроциркуляции кишечного трансплантата в группе сравнения через 6 месяцев, улучшалось в меньшей степени чем, в основной группе. Изучение состояния микроциркуляции через 6 месяцев после операции, показало сохранение нарушений микроциркуляции в группе сравнения, то есть в группе сравнения продолжается хронизация патологического процесса.
Показатели микроциркуляции через 1 год после операции, показало улучшение кровоснабжения в основной группе в отличие от группы сравнения. Таким образом, изучение состояния микроциркуляции на основании ЛДФ-грамм и амплитудно-частотного спектра у больных с необладдером, является существенным компонентом диагностики, позволяющим определить ведущие патогенетические механизмы нарушений у больных после кишечной пластики.
Медленный темп восстановления микроциркуляции в группе сравнения указывает на хронизацию воспалительного процесса в искусственном мочевом пузыре. Это обусловлено воздействием на слизистую оболочку тонкой кишки повреждающих факторов и несовершенство репаративного процесса.
Нарушения регионального кровотока после кишечной пластики мочевого пузыря играют большую роль в патогенезе, осложнений раннего и позднего послеоперационного периода, поскольку действие различных этиологических факторов либо непосредственно изменяет состояние микроциркуляторного русла, либо действует на него опосредованно.
При изучении распределения кровотока у больных с артифициальным мочевым пузырем, при исследовании микроциркуляции в зоне кишечно-уретрального анастомоза, в раннем послеоперационном периоде наблюдалось снижение кровенаполнения слизистой оболочки кишечного резервуара.
Результаты расширенной лимфаденэктомии при радикальной цистэктомии и кишечной пластики мочевого пузыря.
Поскольку как в основной, так и в контрольной группах большинство больных были оперированы по поводу рака мочевого пузыря, мы предприняли попытку расширить объем лимфаденэктомии путем интраоперационной визуализации лимфатического русла и оценить ее влияние на результаты оперативного лечения.
При проведении нашего исследования за основу определения объема лимфаденэктомии были положены данные об особенностях кровоснабжения органа, поскольку пути лимфотока, ориентированы по артериальным магистральным сосудам. Большинство исследователей выделяют 4 основные зоны метастазирования – тазовые, запирательные, подвздошные и бифуркационные лимфоузлы. Соответственно мы поставили задачей определить пути оттока лимфы при опухолевом блоке и поражении этих регионарных зон метастазирования.
Нужно отметить, что инъекция лимфатических узлов при радикальной цистэктомии не представляет больших технических трудностей, на что указывает большинство исследователей, занимавшихся изучением лимфатической системы, и существенно не удлиняет время операции, являясь по существу этапом лимфаденэктомии.
Учитывая возможность перекрестного оттока лимфы от различных отделов, как мочевого пузыря, так и возможность патологического и ретроградного метастазирования, мы инъецировали лимфоузлы запирательных ямок с каждой стороны. В ходе исследования пути регионарного оттока лимфы визуализировались как минимум 15 – 20 лимфоузлов. Количество выявленных регионарных лимфатических узлов отражено в табл. 12.
Таблица 12
Количество удаленных лимфоузлов на этапе лимфаденэктомии
у больных инвазивным раком мочевого пузыря
| Группа больных | Количество удаленных лимфоузлов (М ± м) | Достоверность различий в группах( р) |
| Группа сравнения | 13,2 ± 1,9 | < 0,01 |
| Основная группа | 22,6 ± 2,7 |
Таким образом, наши данные свидетельствуют о значительной вариабельности и индивидуальной анатомической изменчивости регионарного оттока лимфы от пораженного органа при раке мочевого пузыря. Отток лимфы от любого отдела пузыря может осуществляться как в пре-, так в латеро-, ретро- и аортокавальные лимфатические узлы. В свою очередь из любого сегмента зон регионарного метастазирования – запирательных и бифуркационных лимфоузлов - в подвздошные и аортальные бифуркационные лимфатические узлы. Особо необходимо отметить, что окрашивание лимфатических сосудов и узлов в процессе наполнения их красителем происходит как выше, так и ниже подвздошных сосудов без корреляции с инъецируемым количеством лимфатических узлов.
Частоту развития местного и регионарного рецидива рака мочевого пузыря мы изучили у всех 171 больных обеих групп в отдаленные сроки наблюдения. При этом нами установлено, что местный и регионарный рецидив чаще всего происходит в первый год после операции (табл. 13).
Таблица 13
Сроки выявления местного и регионарного рецидива инвазивного рака мочевого пузыря после радикальной цистэктомии (n = 171)
| Срок выявления рецидива | Количество | % |
| от 6 до 9 месяцев | 3 | 1,7 |
| от 9 до 12 месяцев | 5 | 2,9 |
| от 12 до 18 месяцев | 2 | 1,2 |
| от 18 до 24 месяцев | 2 | 1,2 |
| более 24 месяцев | 1 | 0,6 |
| Итого | 13 | 7,6 |
Как видно из таблицы 13, в течение 1 года после операции рецидив возникает у 4,6 % больных. Как видно из табл.14, у больных группы сравнения рецидив рака мочевого пузыря развился у 8 (4,7 %) больных.
Таблица 14
Частота и вид рецидива рака мочевого пузыря
| Вид рецидива | Группа сравнения (n = 88) | Основная группа (n = 83) | Всего (n = 171) | |||
| Абс | % | Абс | % | Абс | % | |
| Местный | 2 | 1,2 | 4 | 2,3 | 6 | 3,5 |
| Регионарный | 6 | 3,5 | 1 | 0,6 | 7 | 4,1 |
| Итого | 8 | 4,7 | 5 | 2,9 | 13 | 7,6 |
Это может свидетельствовать о том, что в ходе радикальной цистэктомии, пораженные микрометастазами лимфоузлы, не были обнаружены и, соответственно не удалены.
В основной группе больных рецидив рака мочевого пузыря у 5 (2,9 %) больных, причем большинство из них (в 4 случаях, или 2,3 %) были местными. Это можно объяснить тем, что по мере накопления опыта цистэктомии с илеоцистопластикой в клинике начали оперировать пациентов с далеко зашедшими местнораспространенными формами рака мочевого пузыря, и операции носили условно радикальный характер. Это косвенно подтверждается тем, что все местные рецидивы развились в течение 1 года после операции.
При сравнении 5-летнй выживаемости больных изучаемых групп выявлено, что она достоверно (р < 0,05) выше и составляет 58,8 % в основной группе, по сравнению с группой сравнения – 48,9 %.
Ранние осложнения после радикальной операции отмечены у 44 (25,1 %) из 171 больных раком мочевого пузыря. Большинство осложнений радикальной операции не представляли опасность для жизни больных и были разрешены консервативными мероприятиями. Так как ни в одном наблюдении в послеоперационном периоде не было лимфорреи, то мы считаем, что лимфаденэктомия не увеличивает количество послеоперационных осложнений.
Ранняя послеоперационная летальность составила 2,3 % и была обусловлена либо осложнениями со стороны других органов и систем, либо общехирургическими (спаечная кишечная непроходимость, несостоятельность межкишечного анастомоза, перитонит). Таким образом, согласно нашим данным, лимфаденэктомия не увеличивает послеоперационную летальность.
В отдаленные сроки после операции из 171 больных раком мочевого пузыря, подвергнутых радикальной операции, рецидив развился у 13 (7,6 %) больных, в том числе у 3,5 % - местный и у 4,1 – регионарный рецидив. У большинства из них местный рецидив сочетался с регионарным, что мы связываем с наличием нераспознанных до операции микрометастазов. Таким образом, лимфаденэктомия при радикальной операции у больных раком мочевого пузыря способствует предупреждению местного и регионарного рецидива.
Характер поздних осложнений кишечной пластики мочевого пузыря в основной группе и группе сравнения и оценка качества жизни оперированных больных.
С целью исследования качества жизни было обследовано 120 больных из числа основной группы больных и 118 пациентов из группы сравнения в сроки через 1 год после кишечной пластики (табл. 15).
Таблица 15
Суммарная оценка основной группы и группы сравнения по шкале Гамильтона
| Показатели | Основная группа | Группа сравнения |
| Депрессивное настроение | 1,2±0,1** | 3,1±0,1 |
| Чувство вины | 0,6±0,1* | 1,4±0,2 |
| Суицидальные намерения | 0,6±0,2 | 0,8±0,1 |
| Ранняя бессонница | 0,8±0,1* | 1,8±0,2 |
| Средняя бессонница | 0,3±0,1** | 1,9±0,2 |
| Поздняя бессонница | 0,4±0,1* | 1,7±0,1 |
| Работоспособность и активность | 1,1±0,2** | 3,7±0,1 |
| Заторможенность | 1,2±0,2* | 2,2±0,1 |
| Ажитация | 0,3±0,1 | 0,5±0,1 |
| Психическая тревога | 1,2±0,2* | 2,8±0,1 |
| Соматическая тревога | 1,5±0,2* | 2,9±0,1 |
| Желудочно – кишечные соматические симптомы | 0,8±0,1* | 1,9±0,2 |
| Общие соматические симптомы | 0,4±0,2* | 1,6±0,1 |
| Генитальные симптомы | 0,3±0,1** | 1,8±0,1 |
| Ипохондрия | 0,8±0,4* | 3,1±0,2 |
| Потеря в весе (А) | 0,7±0,1** | 2,6±0,1 |
| Потеря в весе (В) | 0,2±0,1* | 0,9±0,1 |
| Критичность отношения к болезни | 0,6±0,2* | 1,8±0,1 |
| Суточные колебания (А) | 0,4±0,1** | 1,6±0,1 |
| Суточные колебания (В) | 0,3±0,1* | 1,1±0,2 |
| Деперсонализация и дереализация | 0,7±0,3* | 1,4±0,3 |
| Параноидальные симптомы | 0,5±0,2* | 1,3±0,1 |
| Обсессивные и компульсивные симптомы | 0,7±0,2* | 1,2±0,1 |
Примечание: где - * - р<0,05; - ** - p<0,01
Показатели шкал «психической» и «соматической» тревоги существенно отличались, в группе сравнения соответственно - 2,8±0,1 и 2,9±0,1, в основной - 1,2±0,2 и 1,5±0,2.
Резюмируя вышесказанное, можно сказать, что у больных группы сравнения наблюдается неоднородное умеренное снижение качества жизни по сравнению с основной группой. Это обусловлено, прежде всего, социально-психологической неудовлетворенностью: недостаточной информированностью о своем заболевании, неадекватным отношением к болезни. Это приводит к дезадаптации, а вследствие этого к социальной и самоизоляции личности в условиях онкологического заболевания.
Диаграмма 1
Распределение больных основной и контрольной групп по осложнениям
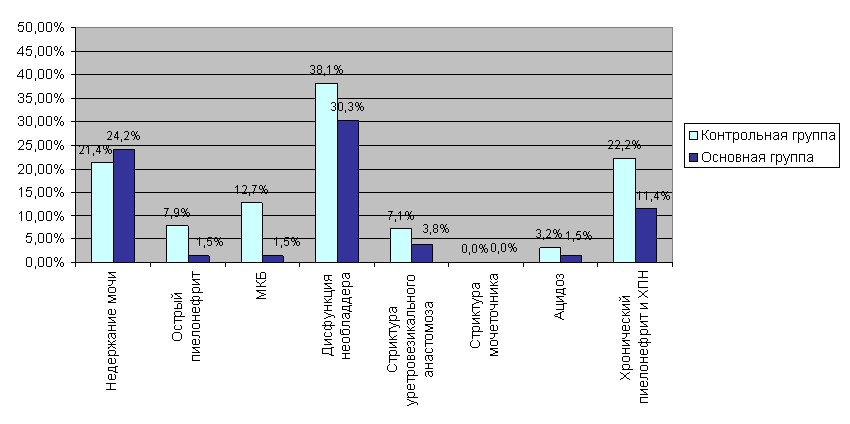
В группе сравнения, неоднократное обострение хронического пиелонефрита отмечено у 28 (22,2%) больных, в основной у 15 (11,4%) пациентов, купированное возобновлением приема фитопрепаратов.
Мочекаменная болезнь в основной группе развилась у 2 (1,5%). Необходимо отметить, что в основной группе солевой диатез наблюдался у 18 (13,6%) больных. В группе сравнения – у 30 (23,8%) и как следствие, камни подвздошного кондуита образовались - у 1 (0,4%) больного и у одного (0,4%) - в почке.
О.Б.Лоран (2005) отмечал, что недержание мочи свидетельствует об отсутствии чувствительности нового пузыря, потере рефлекторного увеличения сфинктерной активности во время наполнения мочевого пузыря, а также — о низком тонусе мочевого пузыря во время сна. В наших исследованиях, недержание мочи в основной группе встретилось у 32 (24,2%) больных, в группе сравнения у 38 (21,4%). Недержание мочи, большинством авторов, не расценивается как осложнение позднего послеоперационного периода. Однако, мы включили данный параметр в исследование, как показатель оценки качества жизни больных после кишечной пластики мочевого пузыря.
Стриктура уретровезикального анастомоза была у 9 (7,1%) больных – группы сравнения и у 5 (3,8%) основной группы. При ретроспективном анализе было установлено, что развитие стриктуры после энтероцистопластики было связано с техническими погрешностями наложения анастомоза на этапе освоения данной методики деривации мочи.
Клинические проявления метаболических нарушений отмечались у 2 (1,5%) больных основной группы и у 4 (3,2%) группы сравнения. Однако, в основной группе они не требовали специальной медикаментозной коррекции. Дисфункция мочевого пузыря – состояние после кишечной пластики, вследствие изменения анатомической структуры. В основной группе была - у 40 (30,3%), в группе сравнения - у 48 (38,1%) больных.
Применение разработанного комплекса диагностики, профилактики и лечения позволяло стабилизировать рН крови и уменьшить степень бактериурии, вследствие этого у больных основной группы уменьшался как риск развития уролитиаза, так и воспалительных осложнений со стороны верхних мочевых путей.
При изучении летальности у больных после кишечной пластики мочевого пузыря нами установлено, что от сопутствующих заболеваний в основной группе погибло 2 (0,8%) больных, в группе сравнения – 4 (1,6%). От поздних послеоперационных осложнений в основной группе погибло 2 (0,8%) пациента, в группе сравнения - 3 (1,2%) (Chi-square, p=0,4991, Fisher, p=0,3867).
Нами, на основании проведенных исследований, предложена нижеследующая схема развития патологических нарушений в отдаленном послеоперационном периоде (рис. 11).

Рис. 11. Схема этиопатогенеза поздних послеоперационных осложнений кишечной пластики мочевого пузыря
Таким образом, замыкается «порочный круг» поздних послеоперационных осложнений кишечной пластики мочевого пузыря.
Применение разработанной тактики диагностики и сроков обследования, включающих изучение состояния микроциркуляции, уродинамики, кислотно-основного состояния, бактериологического исследования мочи, а также комплексных мер профилактики, минимально инвазивных методов хирургического лечения, и средств улучшающих микроциркуляцию, позволило снизить количество поздних послеоперационных осложнений кишечной пластики мочевого пузыря.
Выводы
- Кишечная пластика мочевого пузыря имеют высокий риск развития послеоперационных осложнений, обусловленных тяжестью патологического процесса и операционной травмы, контаминацией мочевой и кишечной флорой, большим объемом десерозированных пространств, наличием условно–герметичных анастомозов в малом тазу. Одним из «пусковых» паготенетических причин развития послеоперационных осложнений являются расстройства органной микроциркуляции в раннем послеоперационном периоде.
- Кишечная пластика мочевого пузыря сопровождается развитием катетер-асоциированной инфекции в 100% случаев, при этом в этиологической структуре осложнений преобладают стафилококк, синегнойная палочка и протей позволяют рассматривать их в качестве наиболее вероятных возбудителей хирургической инфекции после кишечной пластики мочевого пузыря. Развитие гнойно-септических осложнений сопровождается неадекватным иммунным ответом и требует специфических методов иммунопрофилактики.
3. Иммунизация СПСА-вакциной по разработанной нами методике хорошо переносится больными и способствует созданию активного специфического иммунитета против основных возбудителей госпитальной инфекции. Клиническая эффективность специфической иммунопрофилактики СПСА-вакциной заключается в снижении частоты гнойно-септических осложнений после операций по формированию тонкокишечного мочевого пузыря в 2 раза.
4. Основное осложнение, требующее релапаротомии, являлись эвентрация и несостоятельность межкишечного анастомоза у 4,1% больных контрольной группы. При этом клинически значимых осложнений со стороны артифициального мочевого пузыря не было. Основные причины эвентрации это длительные парез и расстройства микроциркуляции хирургической раны после кишечной пластики мочевого пузыря.
5. Модификация хирургической техники с использованием однорядного хирургического шва с антибактериальным шовным материалом и длительное вакуум-дренирование брюшной полости позволяют уменьшить количество раневых осложнений с 40,3% в контрольной группе до 18,75% - в основной.
6. Пассивный и активный рефлюкс мочи из артифициального мочевого пузыря в верхние мочевые пути сохраняется у больных в сроки до 6 месяцев, являясь одной из основных причин послеоперационного пиелонефрита. Модификация операции Штудера с созданием инвагинационного клапана недетубулизированной петли кишечного трансплантата с использованием аллогенного соединительнотканного сухожильного трансплантата позволяет успешно осуществлять противорефлюксную защиту почек.
7. Модификация хирургической техники с интраоперационной визуализацей лимфатических узлов и расширенной лимфаденэктомией не увеличивает частоту ранних послеоперационных осложнений и летальности, позволяет увеличить количество удаляемых лимфоузлов при радикальной цистэктомии с 13,2±1,9 до 22,6 ±2,7. В отдаленные сроки в группе больных, которым была выполнена расширенная лимфаденэктомия, наблюдалось снижение частоты местного рецидива рака с 9,2 % до 4,7 % и увеличение пятилетней выживаемости с 48,9 % до 58,8 %.
8. Расстройства микроциркуляции и дисфункция необладдера, патогенетически связаны между собой. Включение в комплекс профилактики осложнений пластики мочевого пузыря средств улучшающих микроциркуляцию, позволило снизить количество осложнений: острого и хронического пиелонефрита с 30,1% до 12,9%, мочекаменной болезни с 12,7% до 1,5%, кристаллурии с 23,8% до 13,6%. Дисфункции мочевого пузыря с 48% до 30,3%, метаболического ацидоза с 3,2% до 1,5% и предотвратить развитие стриктуры уретровезикального анастомоза с 7,1% до 3,8%.
9. Предложенные методы профилактики и лечения осложнений кишечной пластики мочевого пузыря, достоверно улучшали показатели качества жизни больных, и приводят к снижению послеоперационных осложнений с 50% до 20,8%, и летальности, не связанной с прогрессированием онкологических заболеваний, с 8,3% до 4,3%.
Практические рекомендации
- С целью профилактики раневых осложнений после реконструктивно-пластические операции на органах малого таза, сопровождающиеся вскрытием просветов органов мочевой системы и кишечной трубки рекомендуется антибиотикопрофилактика. За 1–2 сут. до операции проводят стандартную подготовку кишечника, включающую антимикробные средства для приема внутрь. В независимости от наличия результатов посева мочи, необходимо провести профилактику бактериемии – применяют антибиотики широкого спектра действия парентерально за 1 час до оперативного вмешательства и повторно через 6–8 часов.
- Для защиты верхних мочевых путей от рефлюкса мочи при илеоцистопластики рекомендуется сочетание рефлюксного уретеро-тонкокишечного анастомоза и инвагинационного кишечного клапана. При формировании инвагинационного клапана рекомендуется использовать аллогенный соединительнотканный аллотрансплантат для фиксирующей пластики.
- При ушивании хирургической раны рекомендуется использовать двойную викриловую лигатуру с одной иглой, которую необходимо захлестнуть у верхнего края раны, и затем выполнить шов с захватом апоневроза и мышц в зоне до 1,5 см от края раны. Два конца лигатуры завязываются у нижнего края раны после удаления иглы и последнего шва с одной лигатурой.
- В раннем послеоперационного периоде после комбинированных операций на органах брюшной полости и малого таза необходимо длительное вакуум-дренирование брюшной полости на срок до 3–5 суток при создании отрицательного давления 0,05 атм.
- С целью профилактики «поздней» эвентрации хирургической раны в сроки 9–11 суток рекомендуется выполнять полный спектр мероприятии по стимуляции органов желудочно-кишечного тракта и устранению явлений динамической кишечной непроходимости с использованием парэнтерального и энтерального зондового питания.
- Больные после кишечной пластики мочевого пузыря подлежат длительному многолетнему наблюдению с проведением программных мероприятий. В комплекс мероприятий по диагностике поздних осложнений рекомендуем применение урофлоуметрии, бактериологического исследования, изучение показателей микроциркуляции и кислотно-основного состояния. Обследование в течение 1-го года проводится 1 раз в 3 месяца, в последующем 1 раз в 6 месяцев.
Список публикаций по теме диссертации
- Павлов В.Н., Пушкарев А.М., Галимзянов В.З., Магадеев Р.Р., Фазлетдинов А.Д. Специфическая иммунопрофилактика гнойно-воспалительных осложнений после формирования кишечного ортотопического мочевого пузыря // Здравоохранение Башкортостана. – 2004. - № 3: cпец. выпуск: Новые технологии в хирургии. - 2004. – C. 135.
- Павлов В.Н., Галимзянов В.З., Магадеев Р.Р., Фазлетдинов А.Д. Осложнения со стороны верхних мочевых путей после кишечной пластики мочевого пузыря // Здравоохранение Башкортостана. – 2004. - № 3: cпец. выпуск: Новые технологии в хирургии. - 2004. – C. 214.
- Павлов В.Н., Галимзянов В.З., Казихинуров А.А., Чингизова Г.Н., Кутлияров Л.М. Динамика изменений иммунной системы после радикальной цистэктомии с илеоцистопластикой // Онкологическая урология: от научных исследований к клинической практике (современные возможности диагностики и лечения опухолей предстательной железы, мочевого пузыря и почки): материалы конференции. – М., 2004. - С. 156.
- Павлов В.Н., Галимзянов В.З., Казихинуров А.А., Кутлияров Л.М. Динамика изменений иммунологических показателей на фоне терапии бактиспорином после илеоцистопластики // Онкологическая урология: от научных исследований к клинической практике (современные возможности диагностики и лечения опухолей предстательной железы, мочевого пузыря и почки): материалы конференции. – М., 2004. - С. 156-157.
- Павлов В.Н., Галимзянов В.З., Казихинуров А.А., Кутлияров Л.М. Анализ осложнений после радикальной цистэктомии с различными методами деривации мочи // Онкологическая урология: от научных исследований к клинической практике (современные возможности диагностики и лечения опухолей предстательной железы, мочевого пузыря и почки): материалы конференции. – М., 2004. - С. 156-158.
- Павлов В.Н., Галимзянов В.З., Казихинуров А.А., Кутлияров Л.М. Применение пробиотиков на основе Bacillus subtilis в профилактике и терапии мочевой и кишечной инфекции после радикальной цистэктомии с различными методами деривации мочи // Онкологическая урология: от научных исследований к клинической практике (современные возможности диагностики и лечения опухолей предстательной железы, мочевого пузыря и почки): материалы конференции. – М., 2004. - С. 158-159.
- Павлов В.Н., Казихинуров А.А., Сафиуллин Р.И., Галимзянов В.З., Чингизова Г.Н., Мустафин А.Т. Комбинированное лечение неинвазивного рака мочевого пузыря // Онкологическая урология: от научных исследований к клинической практике (современные возможности диагностики и лечения опухолей предстательной железы, мочевого пузыря и почки): материалы конференции. – М., 2004. - С. 159.
- Павлов В.Н., Галимзянов В.З., Казихинуров А.А., Кутлияров Л.М. Анализ результатов хирургического лечения больных с инвазивным раком мочевого пузыря // Онкологическая урология: от научных исследований к клинической практике (современные возможности диагностики и лечения опухолей предстательной железы, мочевого пузыря и почки): материалы конференции. – М., 2004. - С. 159-160.
- Павлов В.Н., Пушкарев А.М., Галимзянов В.З., Казихинуров Р.А., Кутлияров Л.М. Проблема профилактики и лечения гнойно-воспалительных осложнений в лечении рака мочевого пузыря после илеоцистопластики // Здравоохранение Башкортостана. – 2005. - № 3: спец. выпуск: Актуальные вопросы урологии. Заболевания предстательной железы. Новые технологии в урологии. - Уфа, 2005. – С. 221-225.
- Павлов В.Н., Пушкарев А.М., Галимзянов В.З., Казихинуров Р.А., Кутлияров Л.М., Фазлетдинов А.Д. Анализ результатов хирургического лечения больных с инвазивным раком мочевого пузыря // Здравоохранение Башкортостана. – 2005. - № 3: спец. выпуск: Актуальные вопросы урологии. Заболевания предстательной железы. Новые технологии в урологии. - Уфа, 2005. – С. 225-228.
- Павлов В.Н., Пушкарев А.М., Галимзянов В.З., Казихинуров Р.А., Кутлияров Л.М., Фазлетдинов А.Д. Иммунологический статус у больных с инвазивным раком мочевого пузыря после илеоцистопластики // Здравоохранение Башкортостана. – 2005. - № 3: спец. выпуск: Актуальные вопросы урологии. Заболевания предстательной железы. Новые технологии в урологии. - Уфа, 2005. – С. 228-231.
- Павлов В.Н., Пушкарев А.М., Галимзянов В.З., Фазлетдинов А.Д., Мустафин А.Т. Изменения иммунной системы после илеоцистопластики у больных с инвазивным раком мочевого пузыря // Иммунология Урала. – 2005. - № 1 (4): Актуальные проблемы фундаментальной и клинической иммунологии и аллергологии: материалы IV конференции иммунологов Урала. - С. 83-84.
- Павлов В.Н., Пушкарев А.М., Галимзянов В.З., Ногманова В.А., Кутлияров Л.М. Иммунопрофилактика осложнений после кишечной пластики мочевого пузыря // Онкоурология: материалы 1 конгресса Российского общества онкоурологов (4-5 октября 2006 г., Москва). – М., 2006. - С. 104.
- Павлов В.Н., Пушкарев А.М., Галимзянов В.З., Ногманова В.А., Кутлияров Л.М. Состояние иммунной системы после кишечной пластики мочевого пузыря // Онкоурология: материалы 1 конгресса Российского общества онкоурологов (4-5 октября 2006 г., Москва). – М., 2006. - С. 105.
- Павлов В.Н., Галимзянов В.З., Ногманова В.А., Кутлияров Л.М. Возможные осложнения после кишечной пластики мочевого пузыря // Онкоурология: материалы 1 конгресса Российского общества онкоурологов (4-5 октября 2006 г., Москва). – М., 2006. - С. 104-105.
- Павлов В.Н., Пушкарев А.М., Галимзянов В.З., Ногманова В.А., Кутлияров Л.М. Результаты кишечной пластики у больных с инвазивным раком мочевого пузыря // Онкоурология: материалы 1 конгресса Российского общества онкоурологов (4-5 октября 2006 г., Москва). – М., 2006. - С. 104-105.
- Галимзянов В.З., Павлов В.Н., Пушкарев А.М., Кутлияров Л.М., Ногманова В.А. Кишечная пластика у больных с инвазивным раком мочевого пузыря // Медицинский вестник Башкортостана. – 2006. – Т. 1. – С. 34-36..
- Павлов В.Н., Галимзянов В.З., Мустафин А.Т., Ногманова В.А., Загидуллин А.А., Насибуллин И.М. Клапанная хирургия артифициального мочевого пузыря // Медицинский вестник Башкортостана. – 2006. – Т. 1. – С. 104-106.
- Мустафин А.Т., Галимзянов В.З., Загидуллин А.А. Профилактика пузырно-мочеточникового рефлюкса после операции илеоцистопластики по Штудеру // Вестник РГМУ. - 2006. – Спец. выпуск: Материалы 1 международной Пироговской студенческой научной медицинской конференции. - С. 157.
- Пушкарев А.М., Павлов В.Н., Галимзянов В.З., Кутлияров Л.М., Ногманова В.А. Профилактика и лечение инфекционных осложнений после кишечной пластики мочевого пузыря // Медицинский вестник Башкортостана. – 2006. – Т. 1. – С. 120-123.
- Павлов В.Н., Галимзянов В.З., Загидуллин А.А., Ногманова В.А., Кутлияров Л.М., Мустафин А.Т. Качество жизни больных после илеоцистопластики // Медицинский вестник Башкортостана. – 2007. - № 2. – С. 75-78.
- Павлов В.Н., Галимзянов В.З., Загидуллин А.А., Ногманова В.А., Мустафин А.Т. Состояние метаболизма и микробной обсмененности после кишечной пластики мочевого пузыря // Медицинский вестник Башкортостана. – 2007. - № 2. – С. 78-82.
- Павлов В.Н., Галимзянов В.З., Загидуллин А.А., Ногманова В.А., Кутлияров Л.М., Мустафин А.Т. Состояние уродинамики и микроциркуляции необладдера после кишечной пластики мочевого пузыря // Медицинский вестник Башкортостана. – 2007. - № 2. – С. 82-85.
- Павлов В.Н., Галимзянов В.З., Ногманова В.А., Мустафин А.Т., Кутлияров Л.М. Кишечная пластика при протяженных стриктурах мочеточника // Вестник Российской Военно-медицинской академии. – 2007. – № 1, вып. 17. – С. 655.
- Тимербулатов В.М., Павлов В.Н., Галимзянов В.З., Кутлияров Л.М. Кишечная пластика в урологии // Актуальные вопросы колопроктологии: материалы II съезда колопроктологов России с международным участием. – Уфа, 2007. – С. 634.
- Тимербулатов В.М., Павлов В.Н., Галимзянов В.З., Хасанов С.Р., Кутлияров Л.М. Опыт хирургической коррекции у больных с колоректальным раком и раком шейки матки в урологии // Актуальные вопросы колопроктологии: материалы II съезда колопроктологов России с международным участием. – Уфа, 2007. – С. 634-635.
- Павлов В.Н., Галимзянов В.З., Загидуллин А.А., Ногманова В.А., Кутлияров Л.М., Мустафин А.Т. Загитов А.Р. Метаболические нарушения после илеоцистопластики // Наука и технологии. Краткие сообщения XXVII Российской школы, посвященной 150-летию К.Э. Циолковского. – Екатеринбург, 2007. – С. 111-113.
- Павлов В.Н., Галимзянов В.З., Загидуллин А.А., Ногманова В.А., Кутлияров Л.М., Мустафин А.Т. Качество жизни больных с ортотопическим мочевым пузырем // Наука и технологии. Краткие сообщения XXVII Российской школы, посвященной 150-летию К.Э. Циолковского. – Екатеринбург, 2007. – С. 114-116.
- Павлов В.Н., Галимзянов В.З., Казихинуров А.А., Загитов А.Р., Ногманова В.А., Кутлияров Л.М., Мустафин А.Т., Ишемгулов Р.Р. Микроциркуляция необладдера после илеоцистопластики // Наука и технологии. Краткие сообщения XXVII Российской школы, посвященной 150-летию К.Э. Циолковского. – Екатеринбург, 2007. – С. 117-119.
- Павлов В.Н., Галимзянов В.З., Казихинуров А.А., Ногманова В.А., Кутлияров Л.М. Комплексная профилактика поздних осложнений после кишечной пластики мочевого пузыря // Онкоурология: материалы 2 конгресса Российского общества онкоурологов (4-5 октября 2007 г., Москва). – М., 2007. - С. 100.
- Павлов В.Н., Галимзянов В.З., Кутлияров Л.М., Ногманова В.А., Жученко Т.Д. Нервосберегающая цистэктомия в сочетании с консервативной терапией как вариант лечения эректильной дисфункции // Онкоурология: материалы 2 конгресса Российского общества онкоурологов (4-5 октября 2007 г., Москва). – М., 2007. - С. 101.
- Павлов В.Н., Галимзянов В.З., Казихинуров А.А., Ишемгулов Р.Р., Мустафин А.Т. Изменения параметров микроциркуляции мочевого пузыря у пациентов с опухолями мочевого пузыря // Онкоурология: материалы 2 конгресса Российского общества онкоурологов (4-5 октября 2007 г., Москва). – М., 2007. - С. 102.
- Павлов В.Н., Попов С.Л., Галимзянов В.З., Кутлияров Л.М., Ногманова В.А., Фазлетдинов А.Д., Мустафин А.Т. Некоторые этиологические факторы рака мочевого пузыря // Материалы 11 Съезда урологов России. - М., 2007. - С. 559-560.
- Павлов В.Н., Галимзянов В.З., Ногманова В.А., Мустафин А.Т., Кутлияров Л.М. Измайлов А.А. Наш опыт пластики мочеточников червеобразным отростком // Материалы 11 Съезда урологов России. - М., 2007. - С. 560.
- Юлдашев С.М., Хасанов А.Г., Павлов В.Н., Галимзянов В.З., Юлдашев М.Т. Совершенствование хирургического лечения больных со спинномозговой травмой с нарушением естественного мочеиспускания // Вестник Волгоградского государственного медицинского университета. - 2008. – № 3. - С. 70-73.
- Павлов В.Н., Галимзянов В.З., Казихинуров А.А., Ишемгулов Р.Р., Казихинуров Р.А., Махмутов А.Р., Мустафин А.Т. Роль лазерной доплеровской флоуметрии как диагностического критерия расстройств микроциркуляции пузырно-уретрального сегмента и предстательной железы // Урология. 2008. - № 4. – С. 27-30.
- Павлов В.Н., Галимзянов В.З., Казихинуров А.А., Крупин В.Н., Стрельцова О.С., Загитов А.Р., Ишемгулов Р.Р., Мустафин А.Т., Загайнова Е.В., Киселева Е.Б. Изменения ультраструктуры и микроциркуляции стенки мочевого пузыря у пациентов с неинвазивными формами рака // Онкоурология. – 2008. - № 4. - С. 57-60.
- Павлов В.Н., Галимзянов В.З., Мустафин А.Т., Насибуллин И.М. Морфологические аспекты резорбции аллогенного соединительно-тканного трансплантата при формировании артифициального мочевого пузыря в эксперименте // Морфологические ведомости. – 2008. - № 1-2. - С. 275-277.
- Галимзянов В.З., Казихинуров А.А., Кутлияров Л.М., Загитов А.Р., Ногманова В.А. Профилактика и лечение поздних осложнений после кишечной пластики мочевого пузыря // Урология. – 2009. - № 1. – С. 50–55.
- Павлов В.Н., Галимзянов В.З., Курбангулов И.Р., Загитов А.Р. Кишечная пластика мочевого пузыря и родственная пересадка почки // Урология. - 2009. - № 1. - С. 68–69.
- Павлов В.Н., Галимзянов В.З., Кутлияров Л.М., Казихинуров А.А., Загитов А.Р., Измайлов А.А., Чингизова Г.Н., Фазлетдинов А.Д., Мустафин А.Т. Новые возможности в лечении эректильной дисфункции после нервосберегающей цистэктомии // Медицинский вестник Башкортостана. - 2009. - № 2. – С. 78-83.
- Павлов В.Н., Галимзянов В.З., Кутлияров Л.М., Казихинуров А.А., Загитов А.Р., Измайлов А.А., Загидуллин А.А., Мустафин А.Т. Реабилитация и лечение больных после цистэктомии с кишечной пластикой мочевого пузыря // Медицинский вестник Башкортостана. - 2009. - № 2. – С. 83-88.
- Викторова Т.В., Павлов В.Н., Галимзянов В.З., Измайлова С.М., Измайлов А.А., Кутлияров Л.М., Урманцев М.Ф. Ассоциация полиморфного локуса ARG280HIS гена XRCC1 с риском развития рака мочевого пузыря // Медицинский вестник Башкортостана. - 2009. - № 2. – С. 120-124.
- Павлов В.Н., Загитов А.Р., Галимзянов В.З. Кишечная пластика мочевого пузыря и пересадка почки у больных терминальной ХПН // Медицинский вестник Башкортостана. - 2009. - № 2. – С. 154-159.
- Павлов В.Н., Попов С.Л., Галимзянов В.З., Кутлияров Л.М., Ногманова В.А. Влияние хронической задержки мочеиспускания и канцерогенов на развитие поверхностного рака мочевого пузыря // Человек и его здоровье: Курский научно-практический вестник. – 2009. - № 3. - С. 121-124.
- Павлов В.Н., Галимзянов В.З., Загитов А.Р., Казихинуров А.А., Ишемгулов Р.Р., Мустафин А.Т., Кутлияров Л.М. Реабилитация больных после радикальной простатэктомии // Онкоурология. – 2009. - № 1. – С. 53-55.
- Абизгильдин А.Н., Фазлетдинов А.Д., Галимзянов В.З. Спасительная цистэктомия в лечении рака мочевого пузыря с урологическими осложнениями // Онкоурология. – 2009. - № 3. – С. 16-18.
- Павлов В.Н., Галимзянов В.З., Кутлияров Л.М., Загитов А.Р., Измайлов А.А., Измайлова С.М., Фазлетдинов А.Д. Илеоцистопластика при инвазивном раке мочевого пузыря // Онкоурология. – 2009. - № 4. - С. 37-41.
- Павлов В.Н., Галимзянов В.З., Измайлов А.А., Измайлова С.М., Викторова Т.В., Ахмадишина Л.З. Генетические факторы риска развития рака мочевого пузыря // Экспериментальная и клиническая урология. - 2010. - № 2. – С 3.0-34
- Павлов В.Н., Нигматуллин Р.Т., Галимзянов В.З. Аллогенные соединительно-тканные трансплантаты в урологии: монография. – Уфа, 2010. – 293 с.
- Казихинуров А.А., Галимзянов В.З., Казихинуров Р.А., Сафиуллин Р.И., Загидуллин А.А., Ишемгулов Р.Р., Мустафин А.Т., Насибуллин И.М. Расстройства и методы коррекции микроциркуляции при заболеваниях нижних мочевыводящих путей // Медицинский вестник Башкортостана. - 2010. - № 5. – С. 94-97.
- Казихинуров А.А., Казихинуров Р.А., Ишемгулов Р.Р., Галимзянов В.З., Загидуллин А.А., Мустафин А.Т., Насибуллин И.М. Микроциркуляторные и морфологические изменения мочевого пузыря и уретры при моделировании заболеваний нижних мочевых путей // Медицинский вестник Башкортостана. - 2010. - № 6. – С. 91-95.
Патенты
Павлов В.Н., Галимзянов В.З., Измайлов А.А., Измайлова С.М., Викторова Т.В., Кутлияров Л.М. Способ прогнозирования развития рецидивного инвазивного рака мочевого пузыря: пат. на изобретение № 2393772 РФ. - Приоритет изобретение 23 марта 2009 г.

