Комплексная оценка состояния внутренних органов при неоадъювантном и адъювантном лечении больных раком молочной железы ii-iii стадии с her-2-негативным статусом
- На правах рукописи
Королева Ирина Альбертовна
Комплексная оценка состояния внутренних органов при неоадъювантном и адъювантном лечении больных раком молочной железы II-III стадии с HER-2-негативным статусом
14.01.12 – онкология
14.01.04 – внутренние болезни
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Москва – 2010
Работа выполнена в ГОУ ВПО «Московский государственный медико-стоматологический университет Росздрава»
Научные консультанты:
доктор медицинских наук, профессор Вельшер Леонид Зиновьевич
доктор медицинских наук, профессор Казюлин Александр Нисонович
Официальные оппоненты:
доктор медицинских наук, профессор Борисов Василий Иванович
Московский онкологический клинический диспансер №1
доктор медицинских наук, профессор Горбунова Вера Андреевна
ГУ РОНЦ им. Н.Н. Блохина РАМН
доктор медицинских наук, профессор Шептулин Аркадий Александрович
ГОУ ВПО «ММА им. И.М. Сеченова»
Ведущая организация
ГОУ ВПО «Российский государственный медицинский университет Росздрава».
Защита состоится « 18 мая » 2010 года в « ____ » часов на заседании диссертационного совета Д 208.047.01 при ФГУ Московского научно-исследовательского онкологического института им. П.А. Герцена
(125284, Москва, 2-ой Боткинский проезд, д.3).
С диссертацией можно ознакомиться в библиотеке ФГУ Московского научно-исследовательского онкологического института им.П.А. Герцена (125284, Москва, 2-ой Боткинский проезд, д.3).
Автореферат разослан «_______» ______________ 2010 г.
Ученый секретарь
диссертационного совета
доктор медицинских наук, профессор С.А. Седых
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Рак молочной железы (РМЖ) занимает первое место в структуре онкологической заболеваемости женского населения во всем мире (Белоусов Д.Ю. и соавт., 2007; Давыдов М.И., Аксель Е.М., 2008; Parkin D.M., 2002). По данным International Agency For Research On Cancer в мире ежегодно регистрируют более 1 млн. женщин с впервые выявленным РМЖ (Stewart B. и соавт., 2003). В Европе ежегодно регистрируется около 250 тыс. новых случаев РМЖ, от которых умирают около 60 тыс. больных (Imai H. и соавт., 2007). В Российской Федерации ежегодно под наблюдением находится свыше 400 тысяч женщин с РМЖ, их число неуклонно увеличивается (Давыдов М.И., Аксель Е.М., 2008), пик заболеваемости приходится на наиболее социально активный возраст (40–60 лет) (Чиссов В.А. и соавт., 2008).
Смертность женщин от РМЖ находится на первом месте в структуре женской смертности от онкологических заболеваний - 17,1% и неуклонно растет. Если в 2001 году она составляла 16,9, то в 2006 году – 17,2 на 100 000 населения (Давыдов М.И., Аксель Е.М., 2008). Из числа больных с впервые выявленным РМЖ около 12% женщин умирает в течение 1 года с момента установления диагноза (Аксель Е.М., 2006).
Противоопухолевая лекарственная терапия достоверно увеличивает безрецидивную и в ряде случаев общую выживаемость больных РМЖ (Семиглазов В.Ф., Семиглазов В.В., 2008; Rutgers E., 2005). Разработка и внедрение эффективной химиотерапии РМЖ позволили заметно увеличить выживаемость больных; однако в целом она не превышает 60% (Иванов В.Г. и соавт., 2007). Совершенствование химиотерапии идет как по пути повышения воздействия на опухолевые клетки, так и снижения повреждающего действия цитостатических препаратов (Птушкин В.В., 2004).
Длительное лечение, большое число осложнений и, как следствие, ухудшение качества жизни у таких пациентов с потерей трудоспособности и возможностью летального исхода ставят проблему профилактики и лечения токсических реакций у больных, получающих химиотерапию, в ряд социально значимых проблем (Ribas Q.C. и соавт., 2007; Richardson L.C. и соавт., 2007). Наиболее чувствительны к токсическому действию химиопрепаратов быстро делящиеся ткани организма, к числу которых относится костный мозг, эпителий кишечника, а также печень, миокард и поджелудочная железа (ПЖ) (Stewart B. и соавт., 2003; Ribas Q.C. и соавт., 2007). Несвоевременная коррекция осложнений полихимиотерапии может потребовать прекращения специального лечения, изменения схемы заведомо эффективной терапии, что значительно ухудшает эффект химиотерапии, а следовательно, и прогноз заболевания. Наблюдается снижение качества жизни больных, возникает необходимость в дополнительном обследовании и лечении (Stokes M.E. и соавт., 2008). На конец 2007 года в России 255090 больных РМЖ находились на учете 5 и более лет (Чиссов В.А. и соавт., 2008). Поздние токсические реакции ухудшают качество жизни таких больных.
Вопрос о комплексной оценке токсичности современной цитостатической терапии на желудочно-кишечный тракт, печень, ПЖ и миокард остается открытым. Приходится констатировать отсутствие объективных статистических данных по этому вопросу, полученных с позиций доказательной медицины. В то же время профилактическое применение средств поддерживающей лекарственной терапии значительно улучшает качество жизни больных и, таким образом, переносимость химиотерапии и эффект лечения. Комплекс перечисленных выше проблем и определил выбор темы данной научной работы.
Цель исследования
Определение частоты и характера острых и отсроченных токсических реакций со стороны органов пищеварения, сердечно-сосудистой и кроветворной системы у больных раком молочной железы при проведении неоадъювантной и адъювантной полихимиотерапии в рамках ретроспективного исследования.
Задачи исследования
- Определить общую частоту и спектр наиболее часто регистрируемых острых токсических реакций в процессе химиотерапии таксанами и доксорубицином у больных, получивших полный курс адъювантного и неоадъювантного лечения РМЖ в соответствии со стандартным протоколом ведения.
- Определить динамику развития токсических реакций в процессе неоадъювантного и адъювантного лечения РМЖ.
- Сравнить частоту регистрации и тяжесть острых токсических реакций в ходе стандартного протокола, приближенного к реальной практике, с таковой при незапланированных (дополнительных) визитах к врачу в процессе химиотерапевтического лечения.
- Определить наличие взаимосвязей между различными видами острых токсических реакций и оценить возможность прогнозирования поражения других органов-мишеней при наличии одного манифестирующего вида токсичности.
- Определить наличие взаимосвязи между острой и отсроченной токсичностью полихимиотерапии.
- Изучить влияние исходной патологии желудочно-кишечного тракта, поджелудочной железы, печени, сердечно-сосудистой системы, избыточной массы тела, возраста на риск развития острых и отсроченных токсических реакций полихимиотерапии.
- Разработать методику скрининга панкреатоксичности и с ее помощью оценить частоту острой и отсроченной панкреатоксичности, определить факторы риска ее развития.
- Определить, является ли острый лекарственный панкреатит, возникший в процессе полихимиотерапии, фактором риска развития хронического панкреатита в сроки до 5 лет наблюдения.
- Выявить клинико-инструментальные маркеры острой и хронической кардиотоксичности, оценить их динамику.
- Проследить в первичной медицинской документации отражение проявлений токсичности, оценить действия врачей в плане назначения дополнительных обследований, лечебных и профилактических мероприятий.
- На основании полученных данных разработать программу скрининга больных до начала проведения химиотерапии, в процессе ее проведения, а также в течение 5-ти лет после ее завершения.
Научная новизна
В результате ретроспективного анализа выявлен спектр острых токсических реакций у больных РМЖ, прошедших полный курс неоадъювантного и адъювантного лечения таксанами и доксорубицином. Определена частота различных проявлений острой гематологической, гастроинтестинальной токсичности, гепато- и панкреатоксичности, кардиотоксичности. Впервые показано, что истинная частота острой токсичности, оцененная по внеплановым визитам, значительно выше, чем определенная при стандартном ведении больных. Отмечено, что, несмотря на явные клинико-лабораторные и инструментальные признаки токсических реакций, в первичной медицинской документации часто отсутствуют указания о регистрации данных нежелательных побочных эффектов, а при их регистрации корригирующие мероприятия назначаются не всегда. Выявлена взаимосвязь рисков развития и тяжести различных видов острой токсичности, что позволяет прогнозировать вероятность развития токсического поражения органов-мишеней даже при наличии одного манифестирующего вида токсичности. Подтверждена роль описанных ранее факторов риска токсических побочных реакций, а также выявлены новые факторы риска, не описанные ранее. Впервые апробирована новая методика оценки панкреатоксичности в дополнение к известным международным стандартам.
В ходе динамического наблюдения больных в течение длительного периода времени после завершения полихимиотерапии РМЖ (в сроки до 5-ти лет) ретроспективно выявлены проявления поздней токсичности. Доказано, что после завершения полного курса неоадъювантного и адъювантного лечения РМЖ таксанами и доксорубицином в сроки до 5 лет отмечаются признаки токсического поражения сердечно-сосудистой системы, печени и поджелудочной железы. Впервые выявлено, что частота регистрации и тяжесть проявлений кардиотоксичности имеют тенденцию к редукции в первые 2 года с последующим прогрессирующим нарастанием к 5 году наблюдения. Отмечено, что признаки отсроченной панкреатоксичности регистрируются уже через 3 месяца после завершения полихимиотерапии, а частота их регистрации испытывает достоверную тенденцию к росту к 5 году наблюдения. Доказано, что признаки отсроченной гепатотоксичности имеют обратимый характер и в большинстве случаев редуцируются к 1 году наблюдения.
Впервые разработан алгоритм скрининговой диагностики фоновой патологии органов пищеварения, кроветворения и кровообращения, а также алгоритм своевременной диагностики проявлений токсичности, лежащие в основе схемы профилактики и лечения токсических реакций у онкологических больных, получающих химиотерапию.
Практическая значимость
Недоучет исходного состояния больных и наличия широкого спектра различных заболеваний внутренних органов до начала химиотерапии, отсутствие четко разработанных методик контроля состояния органов пищеварения и сердечно-сосудистой системы больных в ходе химиотерапевтического лечения и в динамике после его завершения, могут приводить к поздней диагностике вероятных осложнений цитостатической терапии. Прогнозирование риска, своевременная оценка и профилактика ранней токсичности цитостатиков позволяют минимизировать риск токсических реакций и, тем самым, значительно улучшить качество жизни онкологических больных. Определение риска развития токсических реакций, их тяжести и специфики может модифицировать тактику амбулаторного наблюдения больных, влиять на частоту рекомендуемых визитов больных на контрольное обследование. Реализация подобного подхода, с учетом предложенного алгоритма ведения больных, должна минимизировать риск развития осложнений, улучшать прогноз заболевания, иметь существенный фармакоэкономический эффект.
Личный вклад автора
Научные результаты, обобщенные в диссертационной работе Королевой И.А. получены ей самостоятельно в 4 клиниках Москвы и Самары: Онкологическом центре ЦКБ №2 им. Н.А. Семашко ОАО «РЖД», Городской клинической больнице им. Н.А.Остроумова ДЗ г. Москвы, Онкологическом диспансере №1 ДЗ г. Москвы и Самарском областном клиническом онкологическом диспансере.
Диссертантом выполнено лично:
- определение цели, разработка задач работы и плана их выполнения;
- составление протоколов клинического и инструментального обследования пациентов;
- проведение анализа более 4200 архивных историй болезни и 2900 амбулаторных карт больных, пролеченных / проконсультированных в соответствии с медико-экономическими стандартами ведения больных РМЖ;
- ретроспективная оценка правомочности (убедительности) установления диагноза РМЖ (соответствие критериям включения);
- анализ частоты и тяжести ранних и поздних нежелательных побочных эффектов у 1643 пациенток за время адъювантного и неоадъювантного лечения и в течение 5 лет последующего наблюдения;
- выявление новых факторов риска и маркеров токсичности химиотерапии РМЖ;
- проведение корреляционного анализа между факторами риска и частотой появления и тяжестью токсичности химиотерапевтического лечения РМЖ;
- статистическая обработка материала исследования;
- обобщение материала, формирование выводов и рекомендаций;
- разработаны алгоритмы прогнозирования и скрининга токсичности полихимиотерапии.
Основные положения, выносимые на защиту
- Общая частота острых токсических реакций в процессе химиотерапии таксанами и доксорубицином у больных, получивших полный курс адъювантного и неоадъювантного лечения РМЖ в соответствии со стандартным протоколом ведения, достаточно высока; наиболее часто развивается гемато -, кардио - и гастроинтестинальная токсичность, реже гепато - и панкреатоксичность.
- Для поражения всех органов-мишеней имеется общая тенденция к увеличению частоты острой токсичности от курса к курсу полихимиотерапии.
- Частота регистрации всех видов острой токсичности в ходе стандартного протокола, приближенного к реальной практике, ниже, чем во время внеплановых визитов больных, когда могут регистрироваться более тяжелые токсические реакции.
- Имеется достоверная взаимосвязь между различными видами острой токсичности, позволяющая прогнозировать поражение различных органов-мишеней при наличии хотя бы одного манифестирующего вида токсичности.
- Острая токсичность полихимиотерапии, особенно тяжелая или сочетанная, является фактором риска развития отсроченных панкреа - и кардиотоксических реакций.
- Фактором риска острых и отсроченных токсических реакций является исходная патология органов пищеварения, сердечно-сосудистой системы, сахарный диабет, возраст и масса тела больных.
- Острая панкреатоксичность нередко протекает без болевого абдоминального синдрома; факторами риска ее развития являются наличие исходного хронического панкреатита, острой гемато - и гепатотоксичности.
- Отмечается высокая частота развития хронического панкреатита после завершения полихимиотерапии с наличием клинических проявлений заболевания разной выраженности; только половина случаев из них может быть обусловлена перенесенным острым панкреатитом в процессе химиотерапии.
- Маркерами острой кардиотоксичности являются кардиалгия, изменения конечной части желудочкового комплекса, синусовая тахикардия, экстрасистолия, нарушения проводимости, повышение артериального давления, снижение фракция выброса левого желудочка (ФВ), увеличение КДОИ и сердечный индекс (СИ), развитие диастолической дисфункции, повышение давления в легочной артерии.
- Наиболее ранним эхокардиографическим маркером поздней кардиотоксичности является снижение коэффициента Ve/Va.
- Частота ранней и поздней токсичности полихимиотерапии является более высокой, чем отмечено в первичной медицинской документации.
Внедрение в практику
Основные положения диссертационной работы нашли практическое применение в клинической работе Онкологического центра ЦКБ №2 им. Н.А. Семашко ОАО «РЖД», ГУЗ Самарского областного клинического онкологического диспансера, МУЗ Клинической больницы №5 г.Тольятти, ГУЗ Удмуртского республиканского клинического онкологического диспансера, ГУЗ Вологодского областного онкологического диспансера, ГУЗ Областного онкологического диспансера г. Ульяновска.
Апробация диссертации
Апробация диссертации проведена 15 апреля 2009 года на совместном заседании кафедр пропедевтики внутренних болезней и гастроэнтерологии, онкологии и лучевой терапии, факультетской хирургии №1 ГОУ ВПО МГМСУ, кафедры пропедевтики внутренних болезней и гастроэнтерологии ГОУ ВПО ММА им. И.М. Сеченова.
Основные положения и материалы диссертации докладывались на: The European Cancer Conference (Vienna, 1999); 10th и 20th International Congresses on Anti-cancer Treatment (Paris, 2000; 2009); 37th Annual Meeting of the American Society of Clinical Oncology (San Francisco, 2001); VIII и IХ российском национальном конгрессе «Человек и Лекарство» (Москва, 2001; 2002); конференциях «Дни Российского Онкологического Научного Центра им. Н.Н.Блохина в Самарской области (Самара, 2005-2008), XXII и XXIII Российский конференциях «Гепатология сегодня» (Москва, 2007; 2008), Российской научно-практической конференции с международным участием «Современные методы лечения онкологических больных: достижения и неудачи (Барнаул, 2006); III Российской научно-практической онкологической конференции «Модниковские чтения» (Ульяновск, 2006); XXIII и XXIV Российских Гастроэнтерологических Неделях (Москва, 2007; 2008), Восьмой Восточносибирской гастроэнтерологической конференции с международным участием и Красноярской краевой гастроэнтерологической конференции (Красноярск, 2008); на конференции «Профилактика и лечение заболеваний сердечно-сосудистой системы у онкологических больных» (Самара, 2008); 10-м Юбилейном Славяно-Балтийском научном форуме «Санкт-Петербург-Гастро-2008» (Санкт-Петербург, 2008).
Публикации
Материалы диссертации отражены в 35 научных работах, из них 9 – в рецензируемых журналах, рекомендованных ВАК РФ.
Объем и структура диссертации
Диссертация состоит из введения, обзора литературы, глав с описанием материала и методов исследования, полученных результатов и их обсуждения, выводов, практических рекомендаций, списка литературы. Работа изложена на 338 листах машинописного текста, иллюстрирована 61 таблицами, 18 рисунками. Список литературы содержит 345 источников, из них 85 отечественных и 260 иностранных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Нами проведено ретроспективное мультицентровое случай-контроль исследование на модели неоадъювантной и адъювантной полихимиотерапии РМЖ. Проанализировано более 4200 архивных историй болезни и 2900 амбулаторных карт в 4 клиниках г. Москвы и г. Самары за период 1993-2003 гг., пролеченных / проконсультированных в соответствии с медико-экономическими стандартами РМЖ. Согласно выделенным критериям по исследованным архивным материалам за период 1993-2003 гг. для анализа было отобрано 1643 пациента (женщин). Средний возраст пациенток составил 52,3±2,8 года. Большинство больных находилось в возрастной группе от 41 до 55 лет (66,9 %), преобладали пациентки с III стадией, особенно IIIA; среди больных со II стадией значительно чаще встречались больные со IIВ стадией (Таблицы 1 и 2).
Исследование включало 21 визит (Рис. 1): скрининг (визит 0), визиты для проведения неоадъювантной химиотерапии (визиты 1-4 в четком соответствии со схемой лечения), оперативное лечение с пред- и послеоперационным периодом (визит 5, длительность не более 8 недель, максимум 4 из которых после оперативного лечения), визиты для проведения адъювантной химиотерапии (визиты 6-9 в четком соответствии со схемой лечения), визиты контрольного обследования в течение 5 лет (визиты 10-20).
Все 1643 пациентки, включенные в исследование, явились на первые 10 визитов (визиты 0-9). Далее от визита к визиту количество пациентов уменьшалось за счет лиц, выбывающих из исследования по разным причинам (Табл. 3). В случае большей погрешности явки на визит больные исключались из исследования по причине низкой комплаентности. Лица, пропустившие 1 и более визит без указания в первичной документации причины, считались выбывшими с неуточненной причиной. Частота выбывания больных из исследования с учетом всех возможных причин резко возрастала на 12, 13, 15 и 20 визитах (по сравнению с предшествующим визитом).
Таблица 1
Распределение больных раком молочной железы по возрасту
| Возраст | Число больных (n) | % | Возраст | Число больных (n) | % | |||
| 28-30 | 5 | 0,30 | 51-55 | 307 | 18,69 | |||
| 31-35 | 32 | 1,95 | 56-60 | 154 | 9,37 | |||
| 36-40 | 209 | 12,72 | 61-65 | 98 | 5,97 | |||
| 41-45 | 387 | 23,55 | 66-70 | 44 | 2,68 | |||
| 46-50 | 405 | 24,65 | 71 и старше | 2 | 0,12 | |||
| Всего | 1643 | 100 | ||||||
Таблица 2
Распределение больных РМЖ по стадии опухолевого процесса
| Стадия | Число больных (n) | % | Стадия | Число больных (n) | % |
| II | 658 | 40,051 | III | 985 | 59,951 |
| В том числе: | В том числе: | ||||
| IIA | 29 | 4,413 | IIIA | 681 | 69,142 |
| IIB | 629 | 95,593 | IIIB | 304 | 30,862 |
Инструментальные методы на скрининговом визите в обязательном порядке включали маммографию пораженной и здоровой молочной железы и/или ультразвуковое исследование (УЗИ) молочных желез и регионарных лимфатических узлов, УЗИ органов брюшной полости (в комплексе), почек, малого таза; рентгенографию легких, остеосцинтиграфию. У ряда пациентов была выполнена компьютерная томография органов грудной и брюшной полости.
Диагноз РМЖ на момент включения был подтвержден данными морфологического исследования. В послеоперационном периоде в обязательном порядке осуществлялся анализ операционного материала. Для установления стадии опухолевого процесса использовалась международная классификация злокачественных опухолей TNM (T – Tumor, N – Node, M – Metastasis (5 редакция)). В исследование включались только те больные, у которых удалось ретроспективно оценить HER2-статус (трансмембранный белок с рецепторными функциями, аффинный к эпидермальному фактору роста и герцептину по сохранившимся парафиновым блокам). HER2-отрицательная модель выбрана ввиду лучшего прогноза и большей выживаемости, что дает возможность у большего числа больных оценить позднюю токсичность.
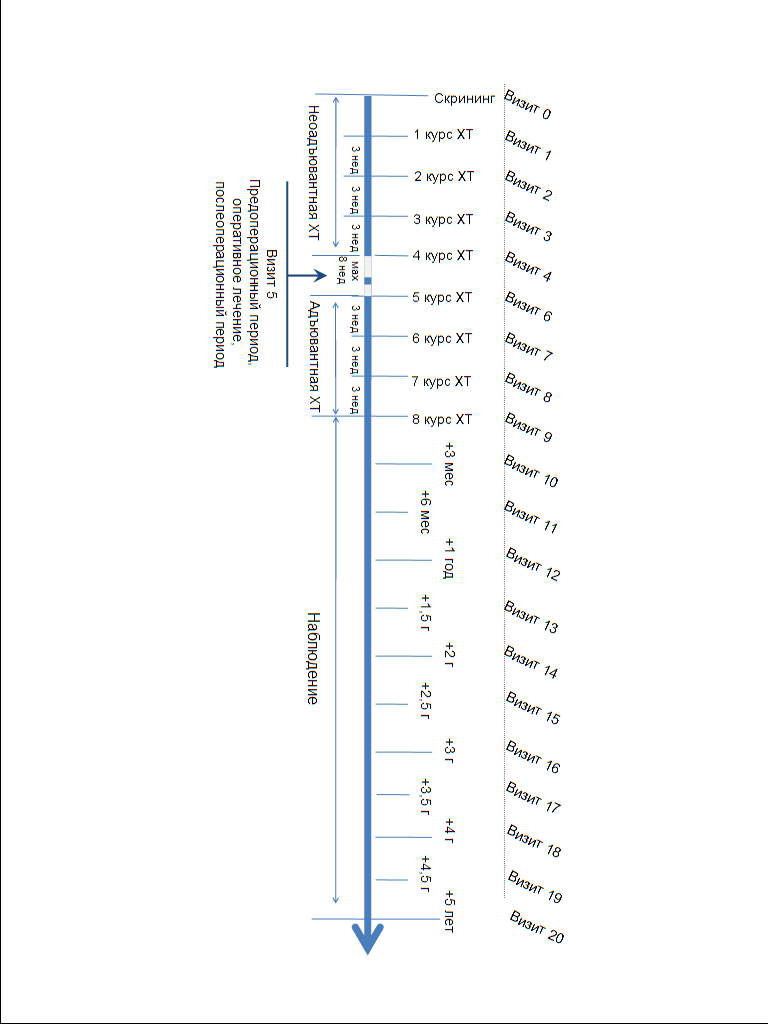
Рис. 1. Схема протокола исследования
До включения в исследование всем больным проведено полноценное физикальное обследование. На каждом последующем визите оценивались витальные функции, состояние кожи и слизистой оболочки полости рта. У всех пациенток по данным лабораторных исследований оценивалось состояние кроветворной системы, функции печени и почек. У части больных оценивалось состояние слизистой оболочки пищевода, желудка, двенадцатиперстной и толстой кишки до начала химиотерапии, в процессе и после лечения по данным эндоскопии. Всем женщинам проводилось УЗИ органов брюшной полости, забрюшинного пространства, органов малого таза. Ряду пациенток была выполнена эхокардиография (ЭХО-КГ). Все больные на момент начала исследования, находились в удовлетворительном состоянии (0-1 степень по 5-степенной системе ВОЗ (Всемирная Организация Здравоохранения - Eastern Cooperative Oncology Group; ECOG–WHO). Схемы лечения представлены на рис. 2.
Оценка побочных эффектов со стороны желудочно-кишечного тракта проводилась согласно стандартной шкале токсичности Центра клинических исследований Национального института рака Канады (Clinical Trial Centre National Cancer Institute Canada, CTC-NCIC) версия 2.0. Оценка побочных эффектов со стороны печени устанавливалась в соответствии с критериями Национального Ракового Института США (CTCAE, 2003). Учитывая известную сложность верификации патологии ПЖ, отсутствие маркеров панкреатоксичности в шкале CTC-NCIC и недостаточную информативность шкалы CTCAE, мы разработали критерии оценки ранней и поздней панкреатоксичности. Ранняя панкреатоксичность оценивалась по следующим критериям: 1. типичный для поражения ПЖ болевой абдоминальный синдром; 2. повышение амилазы в сочетании с липазой крови и/или повышение панкреатической амилазы в сыворотке крови более 2-х норм; 3. УЗИ признаки острых интерстициальных изменений в ПЖ (увеличение размеров в сочетании с размытостью контуров и гипоэхогенностью паренхимы ПЖ и др.). Степень повышения уровня панкреатических ферментов в крови оценивалась по стандартной шкале CTCAE.
Поздняя панкреатоксичность оценивалась по следующим критериям: 1. типичный для поражения ПЖ болевой абдоминальный синдром; 2. клинические признаки экзокринной недостаточности (диарея, метеоризм, стеаторея) в сочетании с изменениями в копрограмме; 3. усугубление течения имевшего место ранее сахарного диабета или его манифестация после завершения лечения; 4. признаки хронического панкреатита (ХП) по данным УЗИ и КТ (размытость и нечеткость контуров, гиперэхогенность паренхимы ПЖ, кальцификация, уплотнение стенок вирсунгова протока). Оценка ранних побочных эффектов со стороны сердечно-сосудистой системы (острой кардиотоксичности) проводилась согласно шкале токсичности CTC-NCIC, версия 2.0 (1996). Критериями поздней кардиотоксичности являлось наличие ряда признаков, не обусловленные усугублением или появлением артериальной гипертонии и ишемическая болезнь сердца (ИБС) (Jensen B.V., 2006): нарушения ритма сердца; хроническая сердечная недостаточность (ХСН); повышение конечно диастолического объема (КДО); снижение ФВ, СИ, УИ.
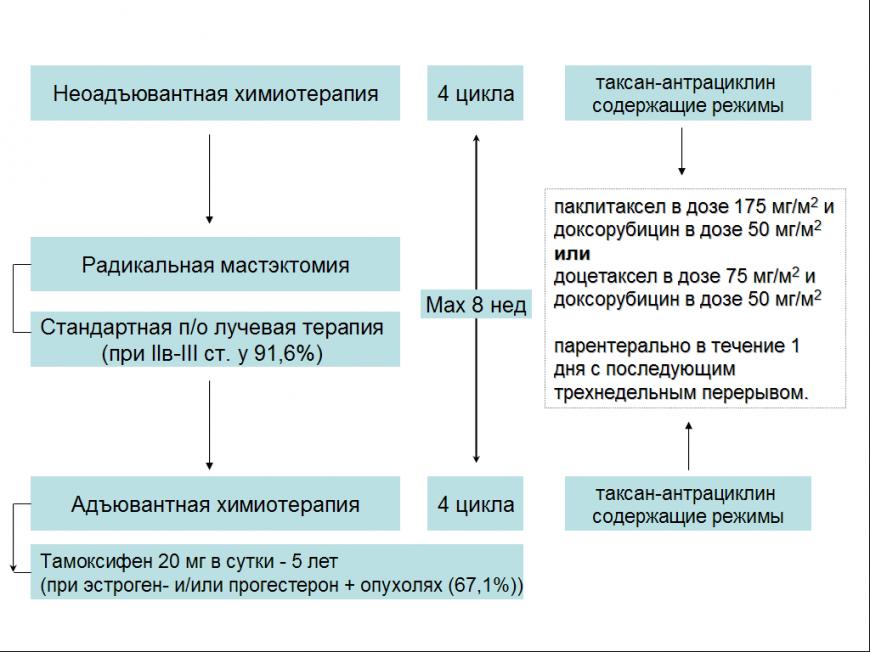
Рис. 2. Схемы комбинированного / комплексного лечения
У 1643 пациенток, включенных в исследование, в установленные сроки были выполнены общие анализы крови. Снижение уровня гемоглобина ниже 110 г/л в ходе неоадъювантного лечения было зарегистрировано у 67,93% больных, начиная со 2 визита. Частота гематологической токсичности нарастала к 4 визиту до 69,45%. 1 степень токсичности по уровню гемоглобина регистрировалась достоверно чаще, чем 0 и 2 степени (p<0,05). На 5 визите достоверно уменьшилось число больных с токсичностью (p<0,05) по сравнению с 4 визитом. По всей видимости, данный эффект объясняется тем, что период между 4 и 5 курсом был дольше, чем предшествующий интервал, и у большей части больных картина крови успела восстановиться. Дальнейшее снижение токсичности к 6 визиту, видимо, связано с длительным периодом (от 7 до 11 недель) между 4 и 6 визитами, когда функция костного мозга успела частично восстановиться. Объемы интраоперационной кровопотери были минимальными, свидетельствуя о том, что низкие значения гемоглобина у 32,9% больных РМЖ к 6 курсу химиотерапии связаны с предшествующей химиотерапией. После 5 курса полихимиотерапии отмечен прирост случаев со сниженными показателями значений гемоглобина с 32,9 до 52,8% на 6 и 7 визитах, соответственно (p<0,05). К 8 визиту число больных с нормальным уровнем гемоглобина едва превышало четверть от всех случаев.
Дополнительно к плановым визитам, у 1315 (80%) больных выполнены динамические клинические анализы крови в связи с развитием токсических реакций и наличием соматической патологии. Частота токсичности по уровню гемоглобина во время этих визитов превысила 87% против 68,3% на стандартных визитах (p<0,05) (Рис. 3). Более тяжелые токсические реакции (3-4 степени), редуцировались к моменту очередного планового визита.

Рис. 3. Частота гематологической токсичности
Снижение уровня лейкоцитов крови ниже 4х103/мм3 в ходе неоадъювантного лечения было зарегистрировано у 70,4% больных, начиная со 2 визита, и достоверно нарастало к 4 визиту до 77,9% (p<0,05). Частота регистрации токсичности достоверно нарастала от 2 к 4 визиту с 61,1 до 63,0% (1 степень), и с 9,3 до 14,9% (2 степень). После 5 курса полихимиотерапии 1 степень токсичности стала регистрироваться в 3 раза чаще, увеличилось число случаев токсических реакций 2 степени (p<0,05). К 8 визиту число больных с нормальным уровнем лейкоцитов крови едва превышало 17,5%; нарастало число случаев токсичности 2 степени (p<0,05). Увеличение частоты регистрации токсичности было достоверным – на 82,5% на 8 визите и 87,9% на 9 визите (p<0,05). Средняя частота регистрации лейкопении на визитах 2-4 и 7-9 составила 77,9%. На внеплановых визитах частота регистрации токсичности превысила 90% против 77,9% на стандартных визитах (p<0,05).
Снижение уровня нейтрофилов крови ниже 2х103/мм3 в ходе неоадъювантного лечения было зарегистрировано в среднем у 83,0% больных. Начиная со 2 визита (75,3%) отмечено достоверное увеличение частоты нейтропении до 85% к 4 визиту (p<0,05), 1 степень токсичности по уровню нейтрофилов на всех визитах регистрировалась в 60,1-62,1%. Частота токсичности 2 степени достоверно нарастала от визита к визиту – с 13,2 до 24,9% на 2 и 4 визитах, соответственно (p<0,05). На 5 и 6 визитах степень токсичности существенно снизилась. На 6 визите отмечено минимальное за весь период наблюдения число случаев токсичности 1 и 2 степени. После 5 курса полихимиотерапии 1 степень токсичности регистрировалась в 2,3 раза чаще. Более чем в 10 раз увеличилось число случаев токсических реакций 2 степени (p<0,05), к 8 визиту частота регистрации случаев токсичности 2 степени увеличилась еще более чем в 2 раза (p<0,05). Увеличение частоты регистрации токсичности была достоверной - 91,5% на 9 визите (p<0,05). Частота регистрации нейтропении на внеплановых визитах превысила 90% против 83% на стандартных визитах (p<0,05). На неплановых визитах между курсами химиотерапии регистрировались и токсические реакции 3-4 степени (рис. 3).
Снижение уровня тромбоцитов ниже 100х103/мм3 в ходе неоадъювантного лечения было у 24,5%, в ходе адъювантного лечения - у 27,8% (рис. 3).
Тошнота в ходе неоадъювантного лечения была зарегистрирована у 53,6% больных, начиная со 2 визита, ее частота умеренно нарастала к 4 визиту до 63,4% (рис. 4). 1 степень токсичности регистрировалась достоверно чаще, чем 2 степень (p<0,05), нарастая от 2 к 4 визиту с 51,2 до 61,3%, соответственно (p<0,05). Частота регистрации 2 степени колебалась в пределах 2,1-3,4% на визитах 2-4. На 5 визите случаев тошноты 2 степени отмечено не было. Высокая частота тошноты 1 степени, по всей видимости, связана с наличием сопутствующей патологии, влиянием наркоза, сопутствующей терапии. 6 визит характеризовался отсутствием случаев тошноты 2 степени, высокой частотой (56,7%) токсичности 1 степени. Частота регистрации 1 и 2 степени токсичности статистически достоверно нарастала от курса к курсу (p<0,05). На последнем курсе адъювантного лечения число больных с тошнотой достоверно (p<0,05) увеличивалось по сравнению с предшествующими визитами. Этот эффект, возможно, обусловлен кумулятивным эффектом химиотерапии и увеличением частоты преждевременной тошноты.
Рвота в ходе неоадъювантного лечения была зарегистрирована у 5,4% больных, начиная со 2 визита. Ее частота нарастала (p<0,05) к 4 визиту до 7,3%. На 5 визите статистически достоверно уменьшилось число больных с 1 степенью рвоты (p<0,05) по сравнению с 4 визитом, случаев 2 степени тошноты отмечено не было. На 6 визите отмечен существенный прирост ее частоты. В дальнейшем частота регистрации токсичности нарастала в большей степени, чем при неоадъювантном лечении.
Зарегистрировано 1410 дополнительных визитов, где фигурировал симптом тошноты, при этом частота регистрации тошноты была 85,6% против 61,5% на стандартных визитах (p<0,05). На 281 дополнительном визите фигурировал симптом рвоты, при этом ее частота была намного выше, чем на стандартных визитах (p<0,05) – 17,1 против 8,8% (рис.4).
Диарея 1 и 2 степени в ходе неоадъювантного лечения была зарегистрирована у 13,2% больных, начиная со 2 визита, ее частота умеренно нарастала к 4 визиту до 28,9%. На 5 и 6 визитах статистически достоверно (p<0,05) уменьшилось число больных с 1 степенью диареи (p<0,05) по сравнению с 4 визитом, случаев диареи 2 степени не было. При проведении адъювантной терапии частота регистрации токсичности существенно нарастала от курса к курсу. Число больных с диареей 1 и 2 степени было максимальным на последних визитах – 32,4 и 7,6%, соответственно. Средняя частота регистрации диареи на протяжении визитов 2-4 и 7-9 составила 26,4% преимущественно за счет 1 степени. Дополнительно к плановым визитам, зарегистрировано 602 дополнительных визита, где фигурировал симптом диареи. Таким образом, реальная частота регистрации диареи была достоверно выше – 36,6% против 26,4% (p<0,05). Кроме того, регистрировались и случаи токсические реакции 3 степени, редуцировавшиеся к моменту очередного планового визита (рис.4).

Рис. 4. Частота регистрации тошноты, рвоты, диареи

Рис. 5. Частота гастроинтестинальной токсичности: болевой абдоминальный синдром; плановые визиты
Разнообразные боли в животе в процессе проведения химиотерапевтического лечения отмечали 756 больных из 1643 (46,0%) (рис. 5). Уже в ходе 1 визита частота регистрации болей в животе увеличилась почти на 60%, особенностью визита явился факт существенного преобладания висцеральных болей над панкреатическими (почти в 7 раз; p<0,05). Частота их регистрации существенно нарастала к 4 визиту с 2,9% до 12,6% (p<0,05). От визита к визиту частота регистрации боли 1 и 2 степени нарастала в 2 раза и более (p<0,05). На 6 визите отмечено существенное снижение частоты регистрации болевого абдоминального синдрома относительно 4 визита. Достоверно чаще регистрировались «панкреатические» боли 1 степени (p<0,05). В целом, на фоне адъювантной терапии частота регистрации токсичности статистически достоверно нарастала от курса к курсу (p<0,05) с достижением максимальных за весь период наблюдения значений на 9 визите. Средняя частота регистрации болевого абдоминального синдрома на протяжении визитов 2-4 и 7-9 составила 11,4%. Дополнительно к плановым визитам, зарегистрировано 756 дополнительных визитов, частота регистрации болевого абдоминального синдрома была в 4 раза выше, чем при плановых визитах – 46% (p<0,05). Более 20% больных характеризовались «панкреатическими» болями.

Рис. 6. Болевой абдоминальный синдром: плановые и дополнительные визиты. Частота регистрации боли в зависимости от типа
В основном наблюдалась легкая степень стоматита, в большей степени после 4-го и 6-8 курсов, которые были купированы или редуцированы на 4-7 сутки. Всего явления стоматита в ходе неоадъювантного лечения были зарегистрированы у 5,6% больных, начиная со 2 визита, на 4 визите отмечено существенное (в 1,5 и 3,5 раза для 1 и 2 степени, соответственно) и достоверное (p<0,05) нарастание его частоты. Существенный прирост частоты стоматита (p<0,05) отмечен на 7 визите. На последнем курсе адъювантного лечения число больных со стоматитом 1 и 2 степени увеличивалось максимально по сравнению со всеми предшествующими визитами (p<0,05) с доминированием токсичности 1 степени. Дополнительно к плановым визитам, было 365 дополнительных визита, во время которых выявлялись признаки стоматита. Таким образом, частота регистрации стоматита была намного выше, чем при плановых визитах – 22,2% (p<0,05). Регистрировались и токсические реакции 3-4 степени, редуцировавшиеся к моменту очередного планового визита.
Отмечены отрицательные корреляционные взаимосвязи между уровнем лейкоцитов и нейтрофилов и степенью тяжести стоматита (r=-0,597 и r=-0,711; p<0,05; соответственно). Мы проследили взаимосвязь между тяжестью стоматита и болевого синдромом и диареи (r=0,645 и r=0,708; p<0,05; соответственно), в меньшей степени – тошноты и рвоты (r=0,553 и r=0,519; p<0,05; соответственно). Наибольшее число случаев развития стоматита отмечалось при сочетании сахарного диабета и возраста старше 50 лет, что выделяет данную группу больных как потенциально наиболее восприимчивую к цитотоксическому действию химиопрепаратов.
Эзофагогастродуоденоскопия (ЭГДС) в процессе химиотерапевтического лечения выполнялась у 493 больных (30%) (рис.7). Острые изменения гастродуоденальной слизистой выявлены у 311 больных (63,1% из числа обследованных и 18,9% из общего числа больных). Частота их более чем в 3 раза превышала регистрацию данных изменений в общей выборке, что, вероятно, обусловлено тем, что у большинства имелись показания к проведению ЭГДС.
Частота воспалительных изменений в гастродуоденальной слизистой у больных с анамнестическими данными за язвенную болезнь (ЯБ), достигала 91,2%, превышая частоту признака в общей выборке и в подгруппе обследованных (p<0,05). Полученные данные свидетельствуют о крайне высоком риске развития повреждения слизистой желудка и двенадцатиперстной кишки у больных ЯБ. Результаты, полученные нами в подгруппах больных, не имеющих ЯБ в анамнезе, в расчете от общего числа больных и от числа обследованных больных имели существенный разброс частот - 15,2 и 58,6%, соответственно (p<0,05), что определяет необходимость проведения профилактики развития острой гастропатии на фоне химиотерапевтического лечения, в качестве которой наиболее эффективным являлось применение ингибиторы протонной помпы (ИПП) в виде монотерапии или в комбинации с другими средствами (рис. 8).

Рис. 7. Частота токсичности по данным ЭГДС
Частота изменений на ЭГДС выросла в 3 раза от неоадъювантных курсов к адъювантным, при этом данная достоверная динамика прослеживалась при расчетах, как от общего числа больных, так и от числа обследованных в объеме ЭГДС (p<0,05). Возможно, это связано с кумулятивным эффектом цитостатиков, а также с оперативным вмешательством. Достоверная динамика отмечена и в подгруппе больных ЯБ (57,4±6,0 и 86,7±5,0, соответственно; p<0,05). В подгруппе без анамнестических указаний на ЯБ, частота токсичности по данным ЭГДС увеличилась в процессе адъювантного лечения практически в 4 раза.
Из 493 больных, обследованных в объеме ЭГДС, однократно исследование было проведено у 137. Из последних у 33 пациенток признаков повреждения слизистой гастродуоденальной зоны выявлено не было. У 31 больной были обнаружены острые эрозии желудка и/или двенадцатиперстной кишки, у 50 – картина острого гастрита, в том числе у 17 – с наличием подслизистых геморрагий, у 15 – с наличием контактной кровоточивости слизистой. Таким образом, у 59,1% однократно обследованных при ЭГДС были выявлены разнообразные явления гастроинтестинальной токсичности. Гастропротективная терапия в сроки от 2 до 3 недель была назначена всем больным, а поддерживающая - только в 37 случаях из 81 (45,7%). Во всех случаях, вне зависимости от того, назначалась какая-либо терапия или нет, контрольной ЭГДС проведено не было.

Рис. 8. Частота регистрации токсичности по данным динамической ЭГДС при использовании профилактических режимов гастропротекции
Согласно протоколу исследования явления гепатотоксичности не должны были превышать степень 2. Таким образом, суммарная частота явлений гепатотоксичности в группе пациентов, получающих подобное лечение, находится, вероятно, на более высоких уровнях, чем 26,7% в нашем исследовании. Анализ поиска маркеров поздней гепатологической токсичности свидетельствует о нерезко выраженных изменениях по результатам биохимического исследования крови, которые носят нестойкий характер. Данные исследования в отношении поздней гепатотоксичности (7,6%) могут быть несколько завышенными по сравнению с тем, что наблюдается в клинической практике, вследствие невозможности проведения дифференцированного анализа в отношении сопутствующих факторов риска отклонений биохимических маркеров крови. Кроме того, те из больных, которые регулярно посещали лечащего врача до окончания периода наблюдения, могли иметь более выраженные изменения самочувствия.
 Рис. 9. Факторы риска гепатологической токсичности
Рис. 9. Факторы риска гепатологической токсичности
Исходное повышение уровней биохимических маркеров – АЛТ, АСТ, ЩФ и ГГТ, которое в основном было обусловлено наличием неалкогольного стеатогепатита (НАСГ) и сопутствующей инфекцией вирусами гепатитов В и С (рис. 9) не является неожиданным, поскольку при имеющемся фоновом течении соответствующего процесса могут быть существенно понижены компенсаторные резервы паренхимы органа. Кроме того, уменьшение интенсивности метаболизма затронутых воспалительными изменениями гепатоцитов может способствовать уменьшению клиренса химиотерапевтических средств, и увеличению их концентрации в ткани печени и сыворотке крови, что в свою очередь, может приводить к усилению их повреждающего действия. В связи с этим выявленные нами риски гепатологической токсичности могут являться сигналом к более тщательному мониторированию состояния больных в процессе проведения курсов химиотерапии. Полученные данные свидетельствуют о целесообразности назначения в этих случаях препаратов т.н. «гепатопротекторного ряда», и, учитывая более высокий риск развития синдрома внутрипеченочного холестаза, средств, обладающих способностью уменьшать вязкость и улучшать реологические свойства желчи.
В нашем исследовании относительно специфичные боли для поражения ПЖ (в левом подреберье или опоясывающие с постпрандиальным усилением, иррадиацией в спину) отмечены у 388 больных из 1643 (23,6%). Уровень панкреатических ферментов анализировался у 1017 больных (61,9%), в их числе у 93,6% больных с болями в животе (708 из 756) и у 98,5% больных с более типичными болями (382 из 388). У 309 пациентов оценивался уровень панкреатических ферментов при отсутствии болевого абдоминального синдрома. Повышение уровня панкреатических ферментов (амилазы+липазы и и/или панкреатической амилазы) более чем в 2 раза отмечено у 158 больных (15,5% из числа обследованных и 9,6% из общего числа больных) (рис. 10). Чрезвычайно высокая частота панкреатической гиперферментемии по сравнению с общей выборкой (р<0,05) отмечена в подгруппе больных с фоновым ХП (41,41 и 48,81% случаев от общего числа больных с ХП и от числа обследованных из них, соответственно). У 117 больных без исходных признаков ХП регистрировалась панкреатическая гиперферментемия (7,6% от общего числа больных и 11,5% от числа обследованных), что ниже, чем в общей выборке.
У больных с наличием болевого абдоминального синдрома без фонового ХП панкреатическая гиперферментемия регистрировалась достоверно чаще, чем в общей популяции (p<0,05), еще выше была частота повышения панкреатических ферментов у больных ХП с болевым абдоминальным синдромом (p<0,05). У больных ХП со «специфичными» болями в 100% случаев регистрировалось повышение панкреатических ферментов в крови. Таким образом, наличие боли в сочетании с двукратным и более сочетанным повышением амилазы и липазы и/или повышением панкреатической амилазы является высокоспецифичным признаком поражения ПЖ в процессе химиотерапии.

Рис. 10. Частота повышения панкреатических ферментов в процессе полихимиотерапии у больных РМЖ
Бессимптомное повышение уровня панкреатических ферментов в крови у 14,2% больных также может быть расценено как лекарственный острый панкреатит (ОП), поскольку лекарственные панкреатиты в легкой форме нередко протекают субклинически (И.В.Маев и соавт., 2005). Сопоставимая частота в 15% в подгруппах, обследованных на панкреатическую гиперферментемию, и у больных с болевым абдоминальным синдромом косвенно подтверждает факт возможного лекарственного ОП с подобной частотой. С сопоставимой частотой (14,2%) регистрировалась панкреатическая гиперферментемия без каких-либо клинических проявлений ОП, что свидетельствует о том, что у части больных на фоне полихимиотерапии возможно латентное течение лекарственного ОП. У больных с более типичными симптомами частота панкреатической гиперферментемии составляла 26,5-26,9%.
Острые интерстициальные изменения в паренхиме ПЖ по данным УЗИ и компьютерной томографии в процессе проведения химиотерапевтического лечения отмечены у 12,4% из 1643 пациенток, которым они проводились (рис. 11). Частота осложненного лекарственного ОП на фоне выбранной схемы терапии колебалась в пределах 0,6-0,7%. Если учитывать в качестве диагностических признаков ОП данные лучевых методов исследования в сочетании с панкреатической гиперферментемией, ретроспективно диагноз неосложненного интерстициального панкреатита можно установить у 9,1%.
В анализируемых историях болезни диагноз лекарственный ОП фигурировал только в 4 случаях из 149 (2,7%), 3 из которых были осложненными; в 26 случаях имелся диагноз «реактивный панкреатит» (17,5%), в 6 - имелись признаки деструкции паренхимы ПЖ (парапанкреатический выпот, образование псевдокист). В 25% случаев в схему терапии вводились ИПП, полиферментные препараты, антипротеазы, спазмолитики, прокинетики, октреотид. В остальных 55% случаев выявленные изменения не привели к изменениям тактики ведения больных.
Ни в одном из случаев выявленные изменения со стороны ПЖ не привели к существенному изменению протокола химиотерапии. Причинами соблюдения схемы химиотерапии, несмотря на явления панкреатоксичности могут являться: быстрая обратная динамика отечно-интерстициальных изменений в ПЖ за период между курсами химиотерапии, преобладание легких форм, токсической этиологией ОП, как правило, наиболее быстро разрешающейся после элиминации провоцирующего фактора. Так почти половина случаев ретроспективно установленного острого панкреатита – 64 случая (43%) характеризовалась латентным и легким течением.
Корреляционный анализ продемонстрировал наличие обратных корреляционных связей между числом нейтрофилов, лейкоцитов, эритроцитов и тромбоцитов в периферической крови и значениями панкреатической амилазы крови (r=-0,75; r=-0,71; r=-0,63; r=-0,54, соответственно, р<0,05 для всех). Выявлено наличие прямых корреляционных связей между плазменными концентрациями общего билирубина, АСТ и АЛТ и уровнем панкреатической амилазы в сыворотке крови (r=0,62; r=0,69; r=0,72, соответственно, р<0,05 для всех).

Рисунок 11. Частота выявления острых интерстициальных изменений паренхимы поджелудочной железы
Клинические признаки экзокринной панкреатической недостаточности регистрировались у 393 больных из 1144 (34,4%). Копрологическое исследование за весь период наблюдения было назначено только 206 больным из 1144 (18%), при этом у 174 из них (15,2% от общего числа и 84,5% от числа обследованных) регистрировалось наличие нейтрального жира в стуле. Среди 174 больных с доказанной панкреатической недостаточностью менее, чем в половине случаев (43,1%) регистрировались «панкреатические» боли в животе при проведении химиотерапии. С несколько большей частотой в этой группе были отмечены УЗИ признаки ОП и панкреатическая гиперферментемия (49,4% и 52,9%, соответственно). Таким образом, развитие экзокринной панкреатической недостаточности отмечено, по крайней мере, у 15% больных, перенесших полный курс химиотерапии РМЖ. У половины из них не отмечалось явной картины ОП в процессе химиотерапевтического лечения. Данные результаты имеют весьма относительный характер. У части из этих пациентов имелись диффузные изменения в печени, обусловленные гепатотоксичностью химиотерапии, регулярным приемом алкоголя (у 3 больных), наличием хронической инфекции HCV и HBV, что могло повлиять на результаты копрологического исследования. У 24 больных (2,1%) отмечено развитие сахарного диабета, при этом у 20 (83,3%) из них регистрировалась стеаторея, у 18 (75%) – картина ОП при проведении химиотерапии. При этом у 22 из них (91,7%) сахарный диабет был установлен в течение первого года наблюдения.
Ультразвуковые и/или томографические признаки ХП отмечены у 236 больных (20,6%), при этом у них в 80,1% случаев при проведении химиотерапии регистрировались УЗИ признаки ОП. Сочетание признаков ХП с наличием рецидивирующего болевого абдоминального синдрома и/или признаками панкреатической недостаточности были отмечены во всех 236 случаях. Несмотря на убедительность клинико-инструментальных данных диагноз ХП был установлен только у 18,6% больных.
Таким образом, все случаи диагностированного ХП в течение периода от 6 месяцев до 5 лет характеризовались наличием клинических проявлений заболевания разной выраженности. По всей видимости, только половина случаев ХП после химиотерапии может быть обусловлена перенесенным ранее ОП. Ранняя панкреатоксичность в виде лекарственного ОП более чем в половине случаев не повлекла за собой какой-либо реакции лечащих врачей. ХП был вынесен в клинический диагноз только в 18,6% случаев, лечение было назначено 16,5% больным.
В соответствии с классификацией некоронарогенныых заболеваний миокарда, разработанной Н.Р. Палевым и М.А. Гуревичем (1997; 1998), кардиотоксичность при полихимиотерапии РМЖ можно, на первый взгляд, отнести только к токсической миокардиодистрофии. В то же время, анализ ассоциации риска развития и глубины кардиотоксичности позволяет предположить также анемический, дисвегетативный, дисметаболический генез данного нежелательного явления. Отмечена отчетливая ассоциация риска и степени острой кардиотоксичности в целом и ее отдельных проявлений и кумулятивной дозы. К визиту 9 частота кардиотоксичности, по сравнению с визитом 2, увеличилась на 20,1% (р<0,05), частота регистрации кардиотоксичности 2 степени за этот период увеличилась в значительно большей степени - на 70,9% (р<0,05). Таким образом острая кардиотоксичность является вторичной, в основном, в отношении полихимиотерапии, а не РМЖ.
Мы выявили тесную ассоциацию частоты и глубины с гематологической токсичностью в целом (r=0,767 и r=0,715; р<0,05, соответственно), различными ее проявлениями: с анемией (r=0,798 и r=0,728; р<0,05, соответственно); лейкоцитопенией (r=0,777 и 0,704; р<0,05, соответственно); нейтропенией (r=0,756 и r=0,698; р<0,05, соответственно); тромбоцитопенией (r=0,549 и r=0,538; р<0,05, соответственно). Мы отметили тесную ассоциацию риска и глубины кардиотоксичности с развитием и глубиной гепатотоксичности (r=0,715 и r=0,676; р<0,05, соответственно). Корреляционная связь была выявлена с такими маркерами гепатотоксичности, как уровень ЩФ (r=0,702 и r=0,678; р<0,05, соответственно); АЛТ (r=0,654 и r=0,614; р<0,05, соответственно); ГГТ (r=0, 723 и r=0,691; р<0,05, соответственно). Ассоциация была зарегистрирована с наличием и глубиной гастроинтестинальной токсичности (r=0, 612 и r=0,602; р<0,05, соответственно). Выявлена ассоциация выраженности и частоты острой кардиотоксичности и степени болевого абдоминального синдрома (r=0,645 и 0,616; р<0,05), тошноты и рвоты (r=0,618 и 0,623; p<0,05), диарейного синдрома (r=0,592 и 0,579; p<0,05). Все случаи острой язвы ассоциировались с наличием острой кардиотоксичности. Среди пациенток с гастроинтестинальной токсичностью и острыми эрозиями и язвами желудка острая кардиотоксичность выявлялась у 72,7% против 33,4% случаев среди лиц с гастроинтестинальной токсичностью без эрозивно-язвенных поражений (р<0,05). В группе с диареей и воспалительными изменениями слизистой толстого кишечника острая кардиотоксичность выявлялась в 48,0%, а при их отсутствии – в 19,5% случаев (р<0,05).
Корреляционная связь риска и глубины острой кардиотоксичности с выраженностью анемического синдрома и уровнем гликозилированного гемоглобина до начала полихимиотерапии (r=0,617; р<0,05) и во время полихимиотерпии (r=0,673; р<0,05) позволяют сделать вывод о значительной роли нарушения снабжения тканей кислородом и, в частности миокарда, в патогенезе кардиотоксичности. На возможную связь поражения миокарда и анемии указывал Von Hoff D.D (1979). Связь кардиотоксичности и сахарного диабета также описана в ряде работ (Сычева Е.А. 2003; Гершанович М.Л., 2004). В нашем исследовании фактором риска развития кардиотоксичности было наличие у больных сахарного диабета II типа, что, видимо, объясняется тем, что сахарный диабет у значительного числа больных закономерно сочетался с кардиальной патологией. Так из 112 женщин с нарушением углеводного обмена у 73 (65,2%) развитие сахарного диабета предшествовало установлению диагноза ИБС.
С поражением миокарда и вегетативной дисфункцией связана электрическая нестабильность миокарда у пациенток с кардиотоксичностью, проявляющаяся суправентрикулярной и желудочковой экстрасистолией, нарушениями проводимости, синусовой тахикардией. Данные нарушения имеют отчетливую связь с кумулятивной дозой химиотерапевтических препаратов. Частота регистрации синусовой тахикардии от визита 2 к визиту 9 увеличилась на 31,3% (р<0,05), прирост частоты синусовой тахикардии, соответствующей кардиотоксичности 2 степени, составляла 66% (р<0,05). Для экстрасистолии прирост составлял 28,0 и 67,8%, соответственно, нарушений функции проводимости – 27,9 и 67,7%, соответственно.
Высокая частота гиперкинетического синдрома гемодинамики, связанная с преобладанием симпатикотонии, выявленная у больных с острой кардиотоксичностью, демонстрирует возможность перегрузки сердца за счет высокого сердечного выброса (Казюлин А.Н., 2000). Поскольку кривая давление-объем имеет экспоненциальный характер, при увеличении преднагрузки связь давление-объем сместится вдоль кривой вправо, т.е. к более крутой ее порции и при увеличении растяжения ЛЖ он становится менее податливым (Овчинников А.Г., 2000). Тенденция к снижению величины ФВ, описанная в ряде исследований (Malhotra V., 2004; Magn N., 2005; Kelly H., 2006) выявлялась и в нашем исследовании. Степень снижения коррелировала как с кумулятивной дозой, так и с уровнем маркеров гемато-, гастроинтестинальной токсичности и гепатотоксичности, определяя связь данного изменения гемодинамики и с влиянием полихимиотерапии. Но наиболее последовательным маркером острой кардиотоксичности являлось развитие диастолической дисфункции со снижением коэффициента Ve/Va.
Полученные факторы позволяют включить в маркеры острой кардиотоксичности наличие кардиалгии, изменений конечной части желудочкового комплекса и синусовую тахикардию, суправентрикулярную и желудочковую экстрасистолию и различные нарушения проводимости, повышение артериального давления, снижение ФВ, увеличение КДОИ и СИ, развитие диастолической дисфункции, повышение давления в легочной артерии. Данные проявления нежелательных побочных эффектов ассоциируют с наличием исходной кардиальной патологии, сахарным диабетом, кумулятивной дозой, возрастом, глубиной гемато-, гепато- и гастроинтестинальной токсичности. Частота ранней кардиотоксичности у больных с наиболее значимыми факторами риска представлена на рис. 12.
В первые три года наблюдения отмечено выраженное (р<0,05) снижение частоты кардиалгии, экстрасистолии и регистрации диффузных изменений миокарда у больных перенесших острую кардиотоксичность с достоверным (р<0,05) увеличением представленности данных маркеров поздней кардиотоксичности к 4-5 году. Частота кардиалгии к 5 году наблюдения по сравнению с 3 годом увеличилась в 2,2 раза, частота выявления диффузных изменений миокарда – в 1,53 раза, экстрасистолии – в 2,4 раза. У больных, не перенесших острую кардиотоксичность, отмечено появление данных маркеров со 2 года наблюдения с постепенным увеличение частоты их регистрации к 5 году в 1,79; 1,4 и 4,3 раза. Сохранялось достоверное (р<0,05) преобладание встречаемости данных маркеров у больных, перенесших острую кардиотоксичность (в 2,5; 1,95 и 1,41 раза, соответственно). К 5 году данные маркеры встречались у 34,6% больных РМЖ, перенесших курс полихимиотерапии.
В то же время ХСН начала регистрироваться у пациенток со 2 года, с постепенным увеличением частоты ее регистрации. Также как и в отношении других маркеров поздней кардиотоксичности, начиная со 2 года, ХСН достоверно (р<0,05) чаще регистрировалась у пациенток, перенесших острую кардиотоксичность. К 5 году наблюдения ХСН I функционального класса (по NYHA (Нью-Йоркская кардиологогическая ассоциация)) выявлялась у 25,5% из всех больных с сердечной недостаточностью (у перенесших острую кардиотоксичность она выявлялась в 44,6% случаев, у не перенесших она регистрировалась в 65% случаев). ХСН II функционального класса определялась в 17,0 и 14,9% случаев, соответственно. ХСН III функционального класса была только у лиц, перенесших острую кардиотоксичность - в 14,9% случаев от общего числа лиц с сердечной недостаточностью. В целом к 5 году она регистрировалась у 7,7% пациенток, пришедших на итоговый визит. Соответственно, частота поздней токсичности составляет 34,6% по клинико-электрокардиографическим данным.

Рисунок 12. Частота общей ранней кардиотоксичности у больных с наиболее значимыми факторами риска (критерии CTC-NCTC, версия 2,0)
ЭХО-КГ проводилась у лиц с исходной кардиальной патологией в рамках программы амбулаторного наблюдения, а также у пациенток, перенесших острую кардиотоксичность полихимиотерапии РМЖ с сохранением кардиалгии и диффузных изменений миокарда, без исходной кардиальной патологией, но перенесших острую кардиотоксичность, а также у пациенток имевших или не имевших острую кардиотоксичность при появлении кардиалгии и/или диффузных изменений миокарда
Ремодуляция левого желудочка с усугублением изменений уровней КДОИ и ФВ у пациенток начинается со 2 года. В то же время следует отметить, что величина коэффициента Ve/Va последовательно снижалась с 1 года наблюдения. Данный эффект позволяет расценивать изменения коэффициента как ранний маркер поздней кардиотоксичности, превышающий по своей информативности снижение уровня ФВ. Так, снижение коэффициента Ve/Va отмечалось у 100% больных перенесших острую кардиотоксичность со 2 года наблюдения, и у больных с, не перенесших данный нежелательный эффект - с 4 года. Снижение уровня ФВ выявлялось у 100% пациенток, перенесших острую кардиотоксичность, только к 5 году, в то время как среди пациенток, не перенесших ее даже к 5 году, снижение уровня ФВ определялось только в 66,7% случаев. Полученный эффект позволил нам расценить эти изменения как проявления поздней кардиотоксичности у лиц с наличием исходной кардиальной патологии и у пациенток без исходной кардиальной патологии, перенесших или не перенесших острую кардиотоксичность, характеризующихся сохранением или появлением кардиалгии и диффузных изменений миокарда (рис. 13).
Можно сделать вывод, что частота поздней токсичности составляет 100% по данным ЭХО-КГ у лиц с факторами риска и маркерами кардиотоксичности; у значительной части пациенток, перенесших полихимиотерапию по поводу РМЖ, поздняя кардиотоксичность протекает асимптомно и не распознается при плановых осмотрах. Предикторами риска поздней кардиотоксичности являются перенесение острой кардиотоксичности, наличие исходной кардиальной патологии, пожилой возраст, перенесение острой гастроинтестинальной токсичности и гепатотоксичности полихимиотерапии РМЖ. Наиболее ранним эхокардиографическим предиктором поздней кардиотоксичности является снижение коэффициента Ve/Va.

а 
б
Рисунок 13. Оценка поздней кардиотоксичности: динамика ФВ (а) и Ve/Va (б) в зависимости от наличия острой кардиотоксичности (ОКТ) в процессе полихимиотерапии.
На основании вышеизложенного можно сделать вывод, что даже в отсутствии выраженной токсичности полихимиотерапии РМЖ, позволившей провести полный курс полихимиотерапии по протоколу, отмечается токсическое поражение значительного числа органов-мишеней. Наиболее часто на фоне полихимиотерапии таксанами и доксорубицином манифестируют острые проявления гематологической, гастроинтестинальной токсичности, кардио-, панкреа- и гепатотоксичности. Проявлениями поздней токсичности являются кардио-, панкреа- и гепатотоксичность. У значительной части больных данные нежелательные побочные эффекты не диагностируются и/или не корригируются, что оказывает существенное влияние на прогноз заболевания. Тщательный анализ предикторов и маркеров острой и поздней токсичности полихимиотерапии РМЖ позволит своевременно назначать профилактическую и корригирующую терапию, улучшающую переносимость лечения РМЖ, общий прогноз заболевания. В соответствии с этим мы предлагаем алгоритм ведения данных больных (рис. 14, таблица 5).

Рис. 14. Алгоритм прогнозирования и скрининга токсичности полихимиотерапии РМЖ
Таблица 4
Алгоритм ведения больных РМЖ с наличием токсичности полихимиотерапии таксанами и доксорубицином
| Вид острой токсичности | Дополнительные диагностические мероприятия | Корригирующее и поддерживающее лечение | Вероятное развитие другого вида острой токсичности | Вероятное развитие отсроченной токсичности |
| Анемия | Дополнительный анализ крови на 7-14 день цикла химиотерапии | При 1 ст. не требуется. При более тяжелой токсичности – коррегирующая терапия (препараты железа, витамин В12, фолиевая кислота, эритропоэтины, при анемии 3 степени – заместительная терапия) | Кардиотоксичность Гастроинтестинальная токсичность Панкреатоксичность | Отсроченная анемия не развивается |
| Нейтропения | Дополнительный анализ крови на 7-14 день цикла химиотерапии | При 1 ст. не требуется. При более тяжелой токсичности – контроль температуры тела, дополнительный анализ крови, профилактическое назначение колониестимулирующих факторов | Кардиотоксичность Гастроинтестинальная токсичность Панкреатоксичность | Отсроченная нейтропения не развивается |
| Гастроинтестинальная | Эндоскопические методы исследования, УЗИ, консультация гастроэнтеролога, стоматолога | Антиэметические препараты, ингибиторы протонной помпы, гастропротекторы, антидиарейные препараты | Кардиотоксичность Гепатотоксичность | Отсроченная гастроинтестинальная токсичность не развивается |
| Гепатотоксичностность | Исследование маркеров клинико-лабораторных печеночных синдромов, УЗИ, консультация гастроэнтеролога | Гепатопротекторы (препараты урсодезоксихолевой кислоты и эссенциальные фосфолипиды) | Кардиотоксичность Панкреатоксичность Гастроинтестинальная токсичность | Обратимые проявления гепатотоксичности При переходе пациента в фазу наблюдения необходимо информирование лечащего врача (терапевта), назначение гепатопротекторов, мониторинг (УЗИ, бохимические показатели) |
| Панкреатоксичность | УЗИ и КТ органов брюшной полости, оценка степени панкреатической гиперферментемии, наблюдение гастроэнтеролога, хирурга | При острой – ведение больной в соответствии со стандартами лечения ОП. При хронической – ведение больной в соответствии со стандартами лечения ХП (заместительная ферментная терапия, ингибиторы протонной помпы, селективные миотропные спазмолитики, при необходимости ненаркотиечские и наркотические анальгетики) | Гепатотоксичность | Прогрессирующие проявления панкреатоксичности При переходе пациента в фазу наблюдения необходимо информирование лечащего врача (терапевта) назначение терапии ХП, мониторинг (УЗИ, биохимические показатели) |
| Кардиотоксичность | Суточное мониторирование ЭКГ, динамическое исследование ЭКГ покоя, ЭХО-КГ, наблюдение кардиолога | Миокардиальные цитопротекторы, ингибиторы АПФ, бета-адреноблокаторы | Первые 2 года редукция проявлений, затем прогрессирующее нарастание кардиотоксичности При переходе пациента в фазу наблюдения необходимо информирование лечащего врача (терапевта), продолжение терапии, мониторинг (ЭКГ, ЭхоКГ) |
* при 1 и более степени тяжести общего состояния больного по 5-степенной системе ВОЗ (ECOG–WHO) при наличии кровотечения или высоком риске его рецидива или развития.
ВЫВОДЫ:
1. Общая частота регистрации гематологической токсичности по уровню гемоглобина составляет 68,3% во время плановых визитов и 87% на внеплановых визитах; по уровню лейкоцитов – 77,9% во время плановых визитов и 97,3% на внеплановых визитах; по уровню нейтрофилов – 83,0% на плановых визитах и 81,1% на внеплановых визитах; по уровню тромбоцитов – 27,8% на плановых визитах и 26,4% - на внеплановых визитах.
2. Регистрация гастроинтестинальной токсичности по наличию тошноты составляет 61,5% во время плановых визитов и 85,6% на внеплановых визитах; по наличию рвоты – 8,7% во время плановых визитов и 17,1% на внеплановых визитах; по наличию болевого абдоминального синдрома – 11,4% на плановых визитах и 46,0% на внеплановых визитах; по наличию диареи 26,4% на плановых визитах и 36,6% - на внеплановых визитах; по наличию стоматита - 7,8% на плановых визитах и 22,2% - на внеплановых визитах; острые изменения гастродуоденальной слизистой по данным ЭГДС были отмечены у 63,1% из числа обследованных и 18,9% из общего числа больных. Предиктором острой гастроинтестинальной токсичности является предшествующая патология органов пищеварения и нарастание кумулятивной дозы цитостатиков.
3. Общая частота гепатотоксичности при применении полихимиотерапии таксанами и доксорубицином в ходе неоадъювантного и адъювантного лечения составляет 30%, при этом большая часть явлений гепатотоксичности соответствует степени 1; частота явлений поздней гепатотоксичности, оцениваемая на основании возникновения нежелательных побочных действий в ходе периода наблюдения является невысокой, составляет в целом 7,6% по данным биохимических исследований крови.
4. Риск возникновения гепатотоксичности при применении полихимиотерапии таксанами в сочетании с доксорубицином не зависит от возраста и массы тела пациенток, страдающих РМЖ; риск развития гепатотоксичности зависит от наличия исходной патологии печени: стеатогепатит, хронические инфекции вирусами гепатитов В и С.
5. Общая частота острой панкреатоксичности по уровню относительно специфичных болей отмечена у 23,6% больных; по частоте панкреатической гиперферментемии – 9,6% от общего числа пациенток, 15,5% от общего числа обследованных, 12,4% по данным лучевых методов исследования. При учете в качестве диагностических признаков ОП данных лучевых методов исследования в сочетании с панкреатической гиперферментемией, ретроспективно диагноз неосложненного интерстициального панкреатита можно установить у 9,1% пациенток. Предикторами острой панкреатоксичности являются наличие исходного ХП, наличие острой гематологической токсичности и гепатотоксичности.
6. Частота развития ХП в течение периода от 6 месяцев до 5 лет после проведения курса полихимиотерапии достигает 20,6%. Все случаи диагностированного ХП в течение периода от 6 месяцев до 5 лет характеризовались наличием клинических проявлений заболевания разной выраженности. По всей видимости, только половина случаев ХП после химиотерапии может быть обусловлена перенесенным ранее ОП.
7. Общая частота острой кардиотоксичности составляет 39,3% во время плановых визитов и 75,2% во время внеплановых визитов. Предикторами острой кардиотоксичности являются: наличие исходной кардиальной патологии, сахарный диабет, высокая кумулятивная доза цитостатиков, пожилой возраст, гематологическая токсичность, гепатотоксичность и гастроинтестинальная токсичность. Маркерами острой кардиотоксичности являются: кардиалгия, изменения конечной части желудочкового комплекса, синусовая тахикардия, экстрасистолия, нарушения проводимости, повышение артериального давления, снижение ФВ, увеличение КДОИ и СИ, развитие диастолической дисфункции, повышение давления в легочной артерии.
8. Частота поздней кардиотоксичности составляет 34,6% по клинико-электрокардиографическим данным и 100% по данным эхокардиографического обследования лиц с факторами риска и маркерами кардиотоксичности. Предикторами риска поздней кардиотоксичности являются перенесение острой кардиотоксичности, наличие исходной кардиальной патологии, пожилой возраст, перенесение острой гастроинтестинальной токсичности и гепатотоксичности полихимиотерапии РМЖ. Наиболее ранним эхокардиографическим предиктором поздней кардиотоксичности является снижение коэффициента Ve/Va, наряду с этим к ним относятся кардиалгия, диффузные изменения миокарда, экстрасистолия, развитие ХСН, увеличение КДОИ, снижение ФВ и СИ.
9. На основании вышеизложенного можно сделать вывод, что даже в отсутствии выраженной токсичности полихимиотерапии РМЖ, позволившей провести полный курс полихимиотерапии по протоколу, отмечается токсическое поражение значительного числа тканей и органов- мишеней. Наиболее часто на фоне полихимиотерапии таксанами и доксорубицином манифестируют острые проявления гематологической, гастроинтестинальной токсичности, кардио-, панкреа- и гепатотоксичности. Проявлениями поздней токсичности являются кардиотоксичность, панкреатоксичность и гепатотоксичность. У значительной части больных данные нежелательные побочные эффекты не диагностируются и/или не корригируются, что оказывает существенное влияние на прогноз заболевания. Тщательный анализ предикторов и маркеров острой и поздней токсичности полихимиотерапии РМЖ позволит своевременно назначать профилактическую и корригирующую терапию, улучшающую переносимость лечения РМЖ, общий прогноз заболевания.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. С целью отработки профилактических мероприятий в отношении развития токсических реакций для обеспечения завершения полного курса полихимиотерапии РМЖ таксанами и доксорубицином необходим прицельный сбор анамнеза для выявления предикторов токсического поражения тканей и органов-мишеней. Гематологическую токсичность следует рассматривать как предиктор для других видов токсичности.
2. Имеется отчетливая зависимость наличия и степени гематологической токсичности и кумулятивной дозы таксанов и доксорубицина. Наиболее последовательными маркерами гематологической токсичности являются анемия по уровню гемоглобина, миелосупрессия. Для более раннего обнаружения гематологической токсичности целесообразно проведение анализов крови не только перед очередным курсом химиотерапии, но и между курсами.
3. Частота и выраженность гастроинтестинальной токсичности диктуют необходимость большего контроля, чем принято в проколах ведения больных, за болевым абдоминальным синдромом, тошнотой, рвотой, характером болевого абдоминального синдрома, стоматита, диареи у больных, получающих полихимиотерапию таксанами и доксорубицином. Все больные с наличием болевого абдоминального синдрома, диспепсическими жалобами, наличием в анамнезе заболеваний органов пищеварения требуют динамического проведения эндоскопических исследований.
4. Риск развития острой и хронической гепатотоксичности при полихимиотерапии таксанами и доксорубицином зависит от возраста и массы тела пациенток, от наличия исходной патологии печени: стеатогепатит, хронические инфекции вирусами гепатитов В и С.
5. Частота и тяжесть гепатотоксичности диктуют необходимость большего контроля, чем принято в стандартных проколах ведения больных, за функциональными биохимическими пробами печени. Все больные с наличием факторов риска гепатотоксичности и изменением печеночных проб в процессе полихимиотерапии требуют динамического проведения УЗИ печени и биохимических маркеров печеночных синдромов.
6. Наличие исходного ХП, острой гематологической токсичности и гепатотоксичности являются факторами риска острой панкреатоксичности, которую можно рассматривать как проявления ОП. Наличие боли в сочетании с двукратным и более сочетанным повышением амилазы и липазы и/или повышением панкреатической амилазы является высокоспецифичным признаком поражения ПЖ в процессе химиотерапии. УЗИ и компьютерная томография органов брюшной полости (с обязательным осмотром ПЖ и парапанкреатической зоны) в динамике необходимо ввести в протокол обязательного исследования у больных с факторами риска ОП, относительно специфичным болевым абдоминальным синдромом, панкреатической гиперферментемией.
7. Наличие острой панкреатоксичности является фактором риска поздней панкреатоксичности. С целью раннего и полного выявления случаев хронической панкреатоксичности необходимо включить в протокол наблюдения за больными, получавшими терапию таксанами и доксорубицином, перенесших острую панкреатоксичность, имеющих клинические признаки внешнесекреторной недостаточности ПЖ, специфический болевой абдоминальный синдром УЗИ и компьютерную томографию органов брюшной полости, исследование уровня панкреатических ферментов в сыворотке, исследование маркеров экскреторной недостаточности.
8. Наличие исходной кардиальной патологии, сахарного диабета, пожилой возраст, гематологическая токсичность, гепатотоксичность и гастроинтестинальная токсичность, высокая кумулятивная доза являются факторами риска развития острой кардиотоксичности. Маркеры острой кардиотоксичности включают наличие кардиалгии, изменений конечной части желудочкового комплекса, синусовую тахикардию, суправентрикулярную и желудочковую экстрасистолию, нарушения проводимости, повышение артериального давления, снижение ФВ, увеличение КДОИ и СИ, развитие диастолической дисфункции, повышение давления в легочной артерии. Данные больные нуждаются в мониторировании жалоб, ЭКГ, артериального давления, проведения динамической ЭХО-КГ с исследованием центральной гемодинамики и диастолической функции левого желудочка.
9. Острая кардио-, гепато- и гастроинтестинальная токсичность полихимиотерапии РМЖ, исходная кардиальная патология, пожилой возраст, являются факторами риска развития поздней кардиотоксичности. Наиболее ранним и последовательным эхокардиографическим признаком поздней кардиотоксичности является снижение коэффициента Ve/Va. Для установления наличия данного поражения миокарда необходимо мониторирование динамики кардиалгии, диффузных изменений миокарда и экстрасистолии по данным ЭКГ, признаков ХСН, увеличения КДОИ, снижения ФВ и СИ.
СПИСОК ПЕЧАТНЫХ РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Королева И.А. Способ лечения распространенных форм злокачественных опухолей. Карев И.Д. Патент Российской федерации на изобретение №2077348 от 20 апр. 1997 г. с приоритетом от 26 июля 1995 г.
2. Koroleva I. Preliminary data of a phase II randomized trial of taxotere (TXT) and doxorubicin (DOX) given simultaneously or sequentially as 1st line chemotherapy (CT) for metastatic breast cancer (MBC) (Предварительные данные фазы II рандомизированного исследования эффекта таксотера (TXT) и доксорубицина (DOX), назначаемых одновременно или последовательно в качестве 1-ой линии химиотерапии (CT) метастатического рака молочной железы)// Koroleva I., Wojtukiewicz M., Zaluski J. et al. - The European Cancer Conference (Vienna, 12-16 September 1999). – Poster 1272. - P.317.
3. Koroleva I. Results of a phase II randomized trial of taxotere (txt) and doxorubicin (dox) given simultaneously or sequentially as 1st line chemotherapy (ct) for metastatic breast cancer (MBC) Результаты фазы II рандомизированного исследования таксотера (txt) и доксорубицина (dox), назначаемых одновременно или последовательно в качестве 1-ой линии химиотерапии (сt) метастатического рака молочной железы (MBC).// Koroleva I., Zaluski J., Wojtukiewicz M. et al. - 10th International Congress on Anti-cancer Treatment (Paris, Jan 31st – Feb 3rd 2000). – Poster PO45. - P.152.
4. Koroleva I.Preliminary Results of a Phase II Randomized Trial of Taxotere (T) and Doxorubicin (A) Given in Combination or Sequentially as Fist line chemotherapy (CT) for Metastatic Breast Cancer (MBC) (Предварительные результаты Фазы II рандомизированного исследования эффекта Таксотера (t) и Доксорубицина (А), назначаемых в комбинации или последовательно в качестве первой линии химиотерапии (CT) метастатического рака молочной железы (MBC).// Koroleva I., Wojtukiewicz M., Zaluski J. et al. - 37th Annual Meeting of the American Society of Clinical Oncology (San Francisco, California, 12-15 May 2001). – Poster 117. - P.30a.
5. Королева И.А. Эффективность комбинации доцетаксела с доксорубицином при лечении больных диссеминированным раком молочной железы.// Королева И.А., Петров А.Б., Болквадзе Г.Т., Матросова М.П., Овчинникова Е.Г., Шульпина Л.И. - Материалы докладов VIII Российского национального конгресса «Человек и Лекарство» (2-6 апреля 2001 г., Москва) – С.308.
6. Королева И.А. Общая слабость у больных раком молочной железы во время проведения адьювантной химиотерапии.// Материалы докладов IХ Российского национального конгресса «Человек и Лекарство» (8-12 апреля 2002 г., Москва) – С.227.
7. Королева И.А. Комбинация навельбина и доксорубицина в химиотерапии первой линии распространенного рака молочной железы.// Возный Э.К., Поддубная И.В., Королева И.А., Константинова М.М., Копп М.В., Добровольская Н.Ю., Баранникова Т.В., Беленогов А.В. - Русский медицинский журнал. - Том 10, № 24. - 2002. –С.1126-1132.
8. Koroleva I.A. Fatigue and quality of life (QoL) impairment in advanced cancer (Повышение утомляемости и ухудшение качества жизни (QoL) при распространенном раке)// Ionova T.I., Novik A.A., Koroleva I. et al. - J. Clinic. Oncol. – 2005. – Vol. 23. – P.780.
9. Koroleva I. Symptom interference with quality of life (QOL) in advanced cancer (Ассоциация симптомов с качеством жизни при распространенном раке)// Fedorenko D., Novik A., Koroleva I. et al. - Ann. Oncol. – 2005. – Vol. 16. – P. 305.
10. Королева И.А. Оценка кардиотоксичности химиотерапии у больных раком молочной железы.// Королева И.А., Копп М.В., Козлов С.В., Девяткина А.В. - «Дни Российского Онкологического Научного Центра им. Н.Н.Блохина в Самарской области (материалы 2-ой конференции)» Самара, - 2006. – С. 98-100.
11. Королева И.А. Неоадъювантная и адъювантная химиотерапия солидных злокачественных опухолей.// Копп М.В., Королева И.А. - Информационное письмо. - Самара, - 2006. - 45 с.
12. Королева И.А. Неоадъювантная и адъювантная лекарственная терапия рака молочной железы и женских половых органов.// Копп М.В., Королева И.А. - Информационное письмо. - Самара, - 2006. - 21 с.
13. Королева И.А. Кардиотоксичность антрациклинов как лимитирующий фактор проведения первой линии химиотерапии диссеминированного рака молочной железы.// Королева И.А., Копп М.В., Девяткина А.В. - «Современные методы лечения онкологических больных: достижения и неудачи (мат. Российской научно-практической конференции с международным участием 4-5 июля 2006 года)» - Барнаул, - 2006. – С. 83-84.
14.Королева И.А. Оценка кардиотоксичносим антрациклин-содержащей химиотерапии у больных раком молочной железы.// Королева И.А., Копп М.В., Веревкина Ю.В. - III Российская научно-практическая онкологическая конференция «Модниковские чтения» (мат. конф.) - Ульяновск, - 2006. - С. 81-82.
15.Королева И.А. Частота гепатотоксичности при проведении противоопухолевой химиотерапии по поводу рака молочной железы.// Казюлин А.Н., Козлов С.В., Королева И.А., Кучерявый Ю.А. - Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2007. - № 1. – С. 64.
16. Королева И.А. Факторы риска гепатотоксичности при проведении противоопухолевой химиотерапии по поводу рака молочной железы.// Королева И.А., Казюлин А.Н., Козлов С.В., Кучерявый Ю.А. - Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2007. - № 1. - С. 66.
17. Королева И.А. Частота поражения желудочно-кишечного тракта при проведении противоопухолевой химиотерапии рака молочной железы.// Казюлин А.Н., Козлов С.В., Королева И.А., Кучерявый Ю.А. - Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2007. - №5. - С. 173.
18. Королева И.А. Факторы риска поражения желудочно-кишечного тракта при проведении противоопухолевой химиотерапии рака молочной железы.// Королева И.А., Казюлин А.Н., Козлов С.В., Кучерявый Ю.А. - Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2007. - № 5. – С. 174.
19. Королева И.А. Факторы риска и частота токсического поражения желудочно-кишечного тракта при проведении противоопухолевой химиотерапии рака молочной железы.// Казюлин А.Н., Кучерявый Ю.А., Королева И.А., Козлов С.В., Гайдамако Е.В. - Новости медицины и фармации (Украина). - 2007. - № 226. – С. 1-7.
20. Королева И.А Панкреатоксичность при проведении неоадъювантной и адъювантной химиотерапии HER-негативного рака молочной железы.// Казюлин А.Н., Бяхов М.Ю., Королева И.А., Козлов С.В., Кучерявый Ю.А. - Экспериментальная и клиническая гастроэнтерология. – 2007. - № 6. - С. 38–41.
21. Королева И.А. Применение препарата «Эменд» (Апрепитант) в комплексной антиэметической терапии.// Копп М.В., Королева И.А., Веревкина Ю.В., Лебедева Л.М., Девяткина А.В. - Дни Российского онкологического научного центра в Самарской области (мат. конф.). - Самара, 2007. - С. 92–94.
22. Королева И.А. Ранняя и поздняя панкреатоксичность при неоадъювантной и адъювантной химиотерапии Her–негативного рака молочной железы: ретроспективное мультицентровое исследование.// Казюлин А.Н., Бяхов М.Ю., Королева И.А., Козлов С.В., Кучерявый Ю.А. - Клинические перспективы гастроэнтерологии, гепатологии. – 2008. - № 1. – С.11-16.
23. Королева И.А. Антиэметическая терапия препаратом «Эменд» (Апрепитант).// Копп М.В., Королева И.А., Веревкина Ю.В., Лебедева Л.М., Девяткина А.В., Липаева Е.М., Нижегородцева А.А. - Дни Российского онкологического научного центра в Самарской области (мат. конф.). - Самара, 2008. - С. 64-65.
24. Королева И.А. Суточное мониторирование ЭКГ в диагностике кардиотоксического влияния адъювантной химиотерапии у больных раком молочной железы.// Родионова В.А., Королева И.А., Никитина Т.В., Липатова Е.М., Денисова А.С. - Дни Российского онкологического научного центра в Самарской области (мат. конф.). - Самара, 2008. - С.118-119.
25. Королева И.А. Поражения желудочно-кишечного тракта как осложнение химиотерапии у онкологических больных.// Казюлин А.Н., Королева И.А., Кучерявый Ю.А. - Клинико-эпидемиологические и этно-экологические проблемы заболеваний органов пищеварения (Мат. VIII Восточно-Сибирской гастроэнтерологической конф. с международным участием и Красноярской краевой гастроэнтерологической конф.). – Красноярск, 2008. – С.404-412.
26. Королева И.А. Назначение своевременной адекватной терапии уменьшает частоту поздней панкреатоксичности полихимиотерапии.// Казюлин А.Н., Кучерявый Ю.А., Королева И.А. - Гастроэнтерология Санкт-Петербурга. - 2008. - №2-3. – 161.
27. Королева И.А. Частота гепатотоксичности при проведении противоопухолевой химиотерапии рака молочной железы.// Казюлин А.Н., Козлов С.В., Королева И.А. - Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2008. - № 1. – С.73.
28. Королева И.А. Ассоциация гастроинтестинальной токсичности и кардиотоксичности у женщин, перенесших противоопухолевое лечение рака молочной железы.// Казюлин А.Н., Вельшер Л.З., Королева И.А., Кучерявый Ю.А. - Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2008. - №5. - С.188.
29. Королева И.А. Гастроинтестинальная токсичность как фактор риска кардиотоксичности у женщин, перенесших химиотерапию рака молочной железы.// Королева И.А., Казюлин А.Н., Вельшер Л.З., Кучерявый Ю.А. - Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2008. - №5. - С.188.
30.Королева И.А. Гепатотоксичность при проведении противоопухолевой лекарственной терапии рака молочной железы.// Вельшер Л.З., Маев И.В., Гайдамака Е.В., Казюлин А.Н., Бяхов М.Ю., Королева И.А., Коробкова Л.Н., Генс Г.П. Паллиативная медицина и реабилитация. -2008г. -№3. –С. 46-51.
31.Koroleva I. Pancreatic toxicity in patients with breast cancer during and after taxan-anthracycline-based neoadjuvant and adjuvant chemotherapy (Панкреатоксичность у пациентов с раком молочной железы во время и после неоадъювантной и адъювантной химиотерапии таксанами и доксорубицином).// Koroleva I., Kasulin A., Kucheryavyy J., Byahov M. - 20th International Congress On Anti-Cancer Treatment (Raris, 3 – 6 February 2009). – Poster AB206. - P.319.
32. oroleva I. Pancreatik toxicity during and after neoadjuvant and adjuvant chemotherapy in patients with breast cancer (Панкреатотоксичность во время и после неоадъювантной и адъювантной химиотерапии пациентов с раком молочной железы) Kazulin A., Koroleva I., Kucheryavyy J., Byahov M. - Pancreatology. – 2009. № 9. – 41 st European Pancreatic Club (EPC) Meeting (Julay 1 – 4, 2009, Szeged, Hungary). Poster P – 168.
33.Королева И.А. Факторы риска острой и поздней кардиотоксичности противоопухолевой терапии рака молочной железы по данным 5-летних наблюдений.// Королева И.А., Казюлин А.Н., Вельшер Л.З., Кучерявый Ю.А., Оганесян Т.С. - Паллиативная медицина и реабилитация. -2010г. -№1. –С. 34-39.
34. Королева И.А. Кардиотоксичность при проведении химиотерапии онкологических заболеваний.// Казюлин А.Н., Вельшер Л.З., Королева И.А., Кучерявый Ю.А. - Медицина критических состояний. -2010г. №1. –С. 62-70.
35. Королева И.А. Изменения слизистой оболочки желудка и двенадцатипертсной кишки у больных раком молочной железы в процессе адъювантного и неоадъювантного лечения таксанами и доксорубицином.//Королева И.А., Казюлин А.Н., Вельшер Л.З., Кучерявый Ю.А., Оганесян Т.С. - Сибирский онкологический журнал. – 2010г. -№2 (38). –С. 6-11.
36. Королева И.А. Оценка гастроинтестинальной токсичности по частоте повреждения слизистой толстой кишки у больных раком молочной железы получающих полихимиотерапию таксанами и доксорубицином. // Королева И.А., Вельшер Л.З., Казюлин А.Н., Кучерявый Ю.А., Оганесян Т.С. - Вопросы онкологии. – 2010г. –том.56 -№2 –С. 206-209.
37.Koroleva I. “Hepatotoxicity in patients with breast cancer during and after taxan-antracyclin-based neoadjuvant chemotherapy”//Koroleva I., Kasulin A., kucheryavyy J., Byahov M. - 21st International Congress on Anti-Cancer Treatment. Paris, France. 1St - 5th February 2010. -C.- 198-199.
38.Королева И.А. «Эметогенный эффект химиотерапии онкологических заболваний»// Казюлин А.Н., Вельшер Л.З., Кучерявый Ю.А. – Медицина критических состояний. – 2010г. №2 –С.60-69

