Синтез и свойства аннелированных и сопряженных азагетероциклов на основе вицинальных бензимидазолил(карбамоил-, циано-)тиениламинов
На правах рукописи
Мохамед Абдель-Монейм Махмуд
СИНТЕЗ И СВОЙСТВА АННЕЛИРОВАННЫХ И СОПРЯЖЕННЫХ АЗАГЕТЕРОЦИКЛОВ НА ОСНОВЕ ВИЦИНАЛЬНЫХ
БЕНЗИМИДАЗОЛИЛ(КАРБАМОИЛ-, ЦИАНО-)ТИЕНИЛАМИНОВ
Специальность 02.00.03 – органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Краснодар – 2006
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования "Кубанский государственный технологический университет"
Научный руководитель: доктор химических наук, профессор
Крапивин Геннадий Дмитриевич
Официальные оппоненты: доктор химических наук, профессор
Посконин Владимир Владимирович
кандидат химических наук, доцент
Андреев Алексей Алексеевич
Ведущая организация: Ставропольский государственный
университет
Защита состоится 12 декабря 2006 г. в 9 часов на заседании диссертационного совета Д 212.100.01 Кубанского государственного технологического университета по адресу: г. Краснодар, ул. Красная, 135, КубГТУ, ауд. 174. (Адрес для переписки: 350072, г. Краснодар, ул. Московская, 2, КубГТУ)
С диссертацией можно ознакомиться в библиотеке Кубанского государственного технологического университета по адресу: 350072, г. Краснодар, ул. Московская, 2.
Автореферат разослан « 10 » ноября 2006 г.
Ученый секретарь
диссертационного совета
кандидат химических наук, доцент Кожина Н.Д.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Химия аннелированных производных тиофена является одной из перспективных и интенсивно развивающихся областей современной химии гетероциклических соединений. Во-первых, это обусловлено разнообразием методов получения соответствующих прекурсоров: известны и распространены реакции Торпа-Циглера и Гевальда и их многочисленные модификации, позволяющие получать функционализированный тиофеновый цикл, в частности, производные 2- и 3-аминотиофена. Во-вторых, многие производные аннелированных тиофенов обладают широким спектром биологического действия, фотохромными свойствами и часто используются в органическом синтезе. В этом плане наиболее перспективны ди- и тетрагидротиенопиримидиноны и родственные им триазиноны, интенсивно изучаемые несколькими группами российских (ИОХ РАН, КубГТУ), арабских (Египет, Саудовская Аравия) и других исследователей:
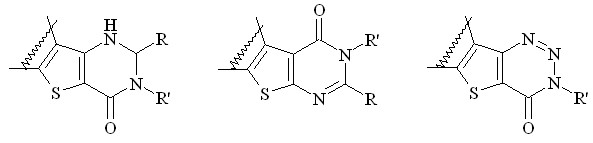
В частности, в ряду этих соединений обнаружены вещества с антимикробной, антиаллергической, нейротропной, седативной и другими видами активности. Поэтому синтез новых соединений этих рядов, поиск оригинальных путей гетероаннелирования с целью получения неописанных ранее перспективных БАВ, прекурсоров для тонкого органического синтеза и других веществ с ценными свойствами предопределил необходимость и целесообразность проведения данного исследования.
Диссертационная работа является составной частью госбюджетной НИР кафедры органической химии КубГТУ "Химический дизайн новых конденсированных гетероциклических систем с целью создания потенциальных физиологически активных веществ с направленным биологическим действием" (№ госрегистрации 01200509784).
Целью данной работы является исследование 3-амино-2- и 2-амино-3-карбамоил(бензимидазолил-, циано-)тиофенов в реакциях аннелирования ди- и тетрагидропиримидинонового и триазинонового колец и изучение спектральных характеристик получаемых веществ, в том числе:
- разработка методов синтеза 2-незамещенных и 2-метил-тетрагидропиридотиенопиримидинонов, а также новых 2-арил(гетарил)- и 8-бромпроизводных; синтез новых 9-фурил- и 8-бромзамещенных пиридотиенотриазинонов; синтез новых полициклических соединений на основе неописанных ранее производных 11-тиа-4b,6,10,12-тетраазаиндено[2,1-a]флуорена;
- изучение реакций аннелирования с участием 2-(3-аминотиено[2,3-b]пиридин-2-илкарбоксамидо)алкановых кислот и производных 2-амино-3-цианотиофена;;
- определение характеристических особенностей масс-спектро-метрической фрагментации каждого из рядов синтезированных соединений.
Научная новизна и практическая ценность. Разработаны методы синтеза ранее неизвестных 2-незамещенных и 2-метил(изопропил, изобутил)замещенных производных 1,2,3,4-тетрагидропиридо[3',2':4,5]тиено[3,2-d]пиримидин-4-онов. Синтезирован широкий ряд новых 2-алкил(арил,гет-арил)пиримидинонов и показано, что именно возникновение асимметрического центра (а не объём заместителя!) у атома С2 гетероциклической системы обуславливает появление диастереотопности у прохиральных метиленовых групп в положениях 3 и 9 гетероцикла.
Синтезирован ряд новых производных 3,4-дигидропиридо-[3',2':4,5]-тиено[3,2-d][1,2,3]триазин-4-она, в том числе, 8-бром- и 9-фурилзамещенных. Установлено, что молекулы последних существуют исключительно в s-транс-конформации взаимного расположения фуранового и пиридотиенотриазинового колец с внутримолекулярным контактом между 3'-Н атомом фуранового кольца и N1-атомом азота триазинового фрагмента.
Изучена внутримолекулярная циклизация 2-(3-аминотиено[2,3-b]пиридин-2-илкарбоксамидо)алкановых кислот. Показано, что производные 3-метилбутановой и 4-метилпентановой кислот в кислой среде гладко превращаются в соответствующие производные 3-алкил-2,3,4,5-тетрагидро-1Н-пиридо[3',2':4,5]тиено[3,2-d][1,4]диазепин-2,5-диона. В полифосфорной кислоте циклизация протекает иначе: производное 4-метилпентановой кислоты циклизуется в 2-изобутил-1,2,3,4-тетрагидропиридо[3',2':4,5]тиено[3,2-d]пи-римидин-4-он, а производное 3-метилбутановой кислоты превращается в два продукта – соответствующий 3-изопропилпиримидинон и 3-амино-2-(5,5-ди-метил-4,5-дигидро-1,3-оксазол-2-ил)тиено[2,3-b]пиридин. Предложен механизм протекающих превращений.
Разработан метод полного синтеза новой гетероциклической системы - изоиндоло[1',2':2,3]пиридо[3'',2'':4',5']тиено[3'2':4,5]пиримидо[1,6-а]бензимид-азол-8(12bH)-она.
Предложен удобный метод получения производных 4,6,7,8-тетра-гидропирроло[1,2-a]тиено[2,3-d]пиримидин-4-она.
Исследовано взаимодействие производных 2-амино-4-бромметил-3-цианотиофена и 2-хлорацетиламино-3-цианотиофена с производными 3-цианопиридин-2(1Н)-тиона. Показано, что метиленовое звено в молекулах впервые полученных 2-(5-амино-5-циано-3-тиенилметилсульфанил)нико-тиннитрилов неактивно в реакции Торпа-Циглера, в то время как производные N1-(4-метил-3-циано-2-тиенил)-2-(3-циано-2-пиридилсульфанил)ацет-амида гладко циклизуются по Торпу-Циглеру в N2-(4-метил-3-циано-2-тиенил)-3-аминотиено-[2,3-b]пиридин-2-карбокамиды. Последние в кислой среде изомеризуются в 2-(3-аминотиено[2,3-d]пиридин-2-ил)-3,4-дигидро-тиено[2,3-d]пиридин-4-оны – прекурсоры для дальнейших реакций гетероаннелирования.
Определены характеристические пути масс-спектрометрической фрагментации молекулярных ионов для каждого ряда синтезированных соединений. Для производных тетрагидропиридотиенопиримидинонов основным направлением фрагментации является последовательность реакций [M – H2 – OH], для пиридотиенотриазинонов – [M – N2 – HNCO]. Для серии 2-ацил-амино-4-метил-3-циано-5-этоксикарбонилтиофенов обнаружена уникальная последовательность реакций фрагментации [M – кетен – CH2CH2 – OH – HCN – CO – CS] при полном отсутствии параллельных процессов.
В ходе выполнения диссертационной работы синтезировано и охарактеризовано более 150 новых химических соединений[1].
Публикации и апробация работы. По теме диссертации опубликованы 2 статьи и тезисы 4 докладов. Материалы диссертационного исследования представлены на Международной конференции "Фундаментальные и прикладные проблемы современной химии в исследованиях молодых ученых" (10 – 12 сентября 2006 г. Астрахань) и Международной конференции по химии азотсодержащих гетероциклов (МГУ, Москва, 2005 г.).
Структура и объем диссертации. Содержание диссертации изложено на 190 страницах машинописного текста, содержит 37 таблиц, 65 схем и 23 рисунка. Диссертация состоит из введения, литературного обзора, обсуждения полученных результатов, экспериментальной части, выводов, списка цитированной литературы (139 наименований) и приложения.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Синтез и свойства новых тетрагидропиридо[3’,2’:4,5]тиено[3,2-d]-
пиримидин-4-онов
Взаимодействием сухого параформа (трехкратный избыток) с соответствующими 3-аминотиено[2,3-b]пиридин-2-карбоксамидами в присутствии каталитических количеств пара-толуолсульфокислоты (TsOH) при 80 – 100оС с выходом 65 – 80% впервые получены 2-незамещенные пиридотиенопиримидиноны 1а-к (схема 1):
Схема 1
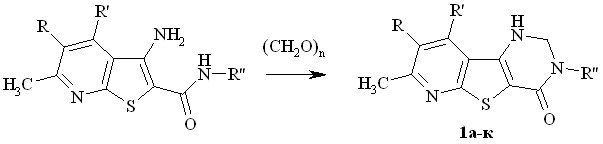
а-и R = H; к R = Br; а,и R' = CH3; б-з,к R' = CH2OCH3; a R'' = CH2Ph; б R'' = фурфурил-2; в,к R'' = Ph; г R'' = o-толил; д R'' = п-толил; e R'' = м-трифторметилфенил; ж R'' = м-метоксифенил; з,и R'' = п-хлорфенил
Отличительной особенностью спектров ЯМР 1Н соединений 1а-к является, помимо сигналов заместителей в пиридиновом кольце и у атома азота N3, наличие двухпротонного дублета атомов водорода N1CH2N2 метиленового звена в области 4,7 - 5,2 м.д. и однопротонного триплета N1-H -группы, связанных общей константой спин-спинового взаимодействия величиной 7 Гц. Сигналы протонов прохиральных метиленовых звеньев метоксиметильных (соединения 1б-з, к), фурфурильной (1б) и бензильной (1а) групп: во всех случаях синглеты в области 4,80 - 4,97 м.д. Такой вид сигналов свидетельствует об энантиотопности атомов водорода у этих прохиральных центров.
Схема 2
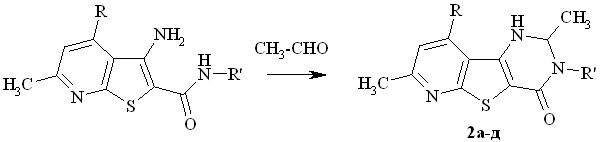
а R = CH3; б-д R = CH2OCH3; а,б R'= бензил; в R' = фурфурил-2; г R' = Ph;
д R' = п-толил
Введение в положение 2 конденсированной системы метильного заместителя (трехкратный избыток этаналя, толуол, каталитические количества ТsOH, 50-60оС, 15 – 30 мин, выход 60 – 75 %) приводит к рацемической смеси энантиомеров (схема 2). Появление хирального центра приводит к диастереотопности протонов прохиральных метиленовых групп в положениях 3 и 9 гетероциклической системы.
Диастереотопные протоны метиленовых звеньев метоксиметильных (соединения 2б-д), бензильной (соединения 2а,б) и фурфурильной (соединение 2в) групп резонируют в спектре в виде АВ-квартета (пары дублетов АВ-спиновой системы протонов) с геминальной 2J константой величиной 12-13 Гц.
 а R = C6H4-OH(п); б R = C6H4-NO2(п); в R = 5-(2-нитрофенил)фурил-2 а R = C6H4-OH(п); б R = C6H4-NO2(п); в R = 5-(2-нитрофенил)фурил-2 | 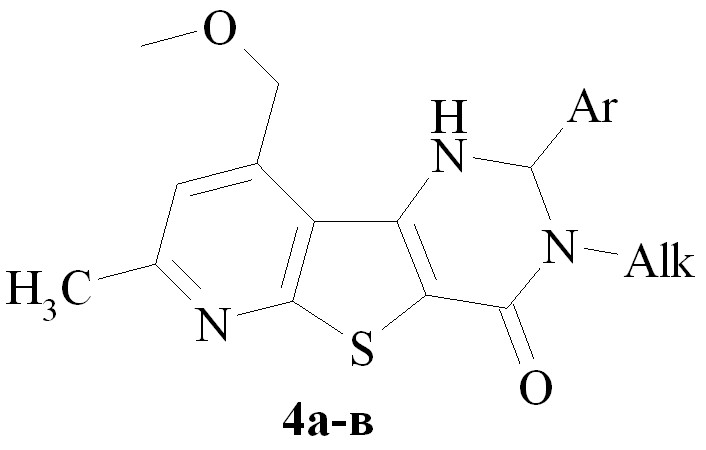 а Alk = бензил, Ar = C6H4-4-(NO2); б Alk = фурфурил-2, Ar = Ph; б Alk = фурфурил-2, Ar = C6H4-4-(OH) а Alk = бензил, Ar = C6H4-4-(NO2); б Alk = фурфурил-2, Ar = Ph; б Alk = фурфурил-2, Ar = C6H4-4-(OH) |
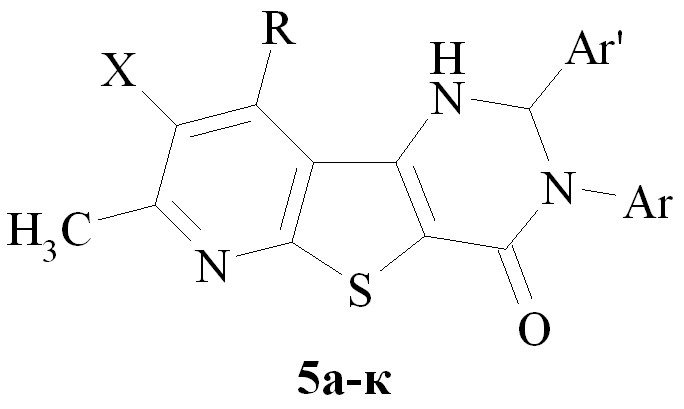 | а-д, ж-к Х = Н; е Х = Br; a R = CH3; б-к R= CH2OCH3; а-в Ar = Ph; г-е Ar = п-толил; ж-и Ar = п-C6H4(ОCH3); к Ar = м-C6H4(CF3); а Ar' = o-C6H4(ОCH3); б,е Ar' = фурил-2; в Ar' = C6H3-4-(ОН)-3-(OCH3); д,ж Ar' = п-C6H4(ОН); з,к Ar' = o- C6H4(COOH); и Ar' = п-C6H4(NО2) |
Точно также появление хирального центра проявляется и в спектрах ЯМР 1Н соединений рядов 3–5 (получены с выходом 65 – 90% при кипячении эквимолярной смеси реагентов в толуоле в присутствии ТsOH с азеотропной отгонкой воды), имеющих прохиральные метиленовые группы: протоны этих групп резонируют в спектрах в виде пары дублетов АВ-спиновой системы. Сигналы диастеретопных протонов метиленовых звеньев легко различимы по величинам геминальных 2J констант: для протонов метиленового звена метоксиметильной группы в положении 9 гетероцикла 2J константа равна 12 Гц, для метиленовых протонов бензильной и фурфурильной групп в положении 3 – 13 Гц. Пары дублетов сильно различаются по величине АВ = В – А. Для метиленовых протонов метоксиметильных групп эта разность составляет 0,05 - 0,12 м.д., для бензильной и фурфурильной групп - примерно на порядок больше: 0,7 – 1,2 м.д. Возможно, такая разница в раздвижении дублетов связана с удаленностью прохиральных центров от хирального.
Характеристичной особенностью масс-спектрометрической фрагментации молекулярных ионов соединений 1–5 является, 1) достаточная устойчивость самого молекулярного иона, 2) наличие нескольких типичных параллельных реакций распада молекулярного иона: [M – H2], [M – H2 – OH] и [M – CH3OH] – перегруппировочный процесс, характерный только для метоксиметилпроизводных.
2. Синтез и свойства новых производных 7,9-диалкил(арил-, гетарил)-3-(Н-, алкил-, арил-, гетарил)-3,4-дигидропиридо[3’2’:4,5]тиено-[3,2-d][1,2,3]триазин-4-онов
С целью поиска новых БАВ и изучения особенностей их спектральных и масс-спектрометрических характеристик синтезирована серия новых производных пиридотиенодигидротриазинонов 7-11:
Для создания триазинового кольца использована методика диазотирования (схема 3) соответствующих 3-аминотиено[2,3-b]пиридин-2-карб-оксамидов нитритом натрия в смеси ледяной уксусной и серной кислот при температуре, не превышающей +5 оС (выходы 70 – 95 %):
Схема 3

 а R = о-толил; б R = п-C6H4(COO-нBu); в R = п-C6H4(COOEt); г R = м-C6H4(COOEt); д R = CH2CH2Ph; е R = фурфурил-2 а R = о-толил; б R = п-C6H4(COO-нBu); в R = п-C6H4(COOEt); г R = м-C6H4(COOEt); д R = CH2CH2Ph; е R = фурфурил-2 |  a R = H; б R = Ph; в R = м-толил; г R = п-толил д R = м-C6H4(CF3); е R = C6H3-2,6-(СН3)2; ж R = C6H3-2,3-(СН3)2; з R = C6H3-2,5-(СН3)2; и R = o-C6H4Et; к R = п-C6H4Et; л R= o-C6H4(OCH3); м R= м-C6H4(OCH3); н R = п-C6H4(OCH3); о R = м-C6H4(COOEt); п R = п-C6H4Ac; р R = п-C6H4(COOнBu); с R = o-C6H4Br; т R = п-C6H4Br a R = H; б R = Ph; в R = м-толил; г R = п-толил д R = м-C6H4(CF3); е R = C6H3-2,6-(СН3)2; ж R = C6H3-2,3-(СН3)2; з R = C6H3-2,5-(СН3)2; и R = o-C6H4Et; к R = п-C6H4Et; л R= o-C6H4(OCH3); м R= м-C6H4(OCH3); н R = п-C6H4(OCH3); о R = м-C6H4(COOEt); п R = п-C6H4Ac; р R = п-C6H4(COOнBu); с R = o-C6H4Br; т R = п-C6H4Br |
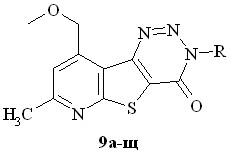 а R = CH2CH2Ph; б R = o-толил; в R = м-толил; г R = п-толил; д R = C6H3-2,6-(СН3)2; e R = C6H3-2,3-(СН3)2; ж R = C6H3-2,5-(СН3)2; з R = o-C6H4Et; и R = п-C6H4Et; к R = C6H3-2,6-(Et)2; л R = o-C6H4(OCH3); м R = м-C6H4(OCH3); н R = п-C6H4(OEt); о R = o-C6H4(COOEt); п R = м-C6H4(COOEt); р R = п-C6H4(CООEt); с R = п-C6H4(COOнBu); т R = o-C6H4Cl; у R = м-C6H4Cl; ф R = п-C6H4Cl; х R = п-C6H4Br; ц R = м-C6H4Br; ч R = м-C6H4Br; ш R = o-C6H4(NO2); щ R = м -C6H4(NO2) а R = CH2CH2Ph; б R = o-толил; в R = м-толил; г R = п-толил; д R = C6H3-2,6-(СН3)2; e R = C6H3-2,3-(СН3)2; ж R = C6H3-2,5-(СН3)2; з R = o-C6H4Et; и R = п-C6H4Et; к R = C6H3-2,6-(Et)2; л R = o-C6H4(OCH3); м R = м-C6H4(OCH3); н R = п-C6H4(OEt); о R = o-C6H4(COOEt); п R = м-C6H4(COOEt); р R = п-C6H4(CООEt); с R = п-C6H4(COOнBu); т R = o-C6H4Cl; у R = м-C6H4Cl; ф R = п-C6H4Cl; х R = п-C6H4Br; ц R = м-C6H4Br; ч R = м-C6H4Br; ш R = o-C6H4(NO2); щ R = м -C6H4(NO2) |  a R= H; б R = СH2Ph; в R = CH2CH2Ph; г R = Ph; д R = o-толил; e R = м-толил; ж R = п-толил; з R = C6H3-2,6-(СН3)2;и R = C6H3-2,5-(СН3)2; к R = o-C6H4Et; л R = п-C6H4Et; м R = o-C6H4(OCH3); н R = м-C6H4(OCH3); о R = п-C6H4(OCH3); п R = o-C6H4(COOСН3); р R = п-C6H4(COOEt); с R = п-C6H4(COCH3); т R = м-C6H4Br a R= H; б R = СH2Ph; в R = CH2CH2Ph; г R = Ph; д R = o-толил; e R = м-толил; ж R = п-толил; з R = C6H3-2,6-(СН3)2;и R = C6H3-2,5-(СН3)2; к R = o-C6H4Et; л R = п-C6H4Et; м R = o-C6H4(OCH3); н R = м-C6H4(OCH3); о R = п-C6H4(OCH3); п R = o-C6H4(COOСН3); р R = п-C6H4(COOEt); с R = п-C6H4(COCH3); т R = м-C6H4Br |
Замыкание триазинового цикла в соединениях 7-10 приводит к бесцветным кристаллическим веществам, в то время как исходные аминоамиды и соответствующие пиримидиноны 1-6 окрашены в желтый цвет.
Триазиноновый цикл обладает электроноакцепторным действие в сравнении с пиримидиноновым, что особенно ярко проявляется при сравнении спектров ЯМР 1Н дигидротриазинонов 7-10 и соответствующих им тетрагидрапиримидинонов 1-5. Так, при «замене» пиримидинонового цикла в соединениях 1а, 1и, 2а и 5а на триазиноновый (соединения 7а-е) сигнал пиридинового протона 8-Н смещается в слабое поле примерно на +0,4 м.д. (среднее положение сигнала в молекулах пиридинонов 7,08±0,01 м.д., в молекулах 7а-е – 7,48±0,07 м.д).
Введение брома в 8 положение гетероцикла (соединения ряда 10) также оказывает дезэкранирующее действие, примерно такое же, как и в случае 8-бром-7,9-диметилпроизводных 8. Оба синглетных сигнала 7-СН3 и –CH2О- групп смещаются в слабое поле на +0,1 м.д. до средних значение 2,86±0,06 м.д. и 5,37±0,05 м.д. соответственно.
Сигналы протонов прохиральных метиленовых групп соединений 7с, 9 и 10 – чёткие синглеты. Это подтверждает сделанный выше вывод о том, что причиной появления диастереотопности метиленовых протонов в 2-монозамещенных производных тетрагидропиримидинона является появление ассиметрического атома углерода (С2).
7,9-Дифенил(фенилфурил)производные 11а-з получены из соответствующих халконов в результате следующей последовательности реакций, приведенных на схеме 4.
Схема 4.
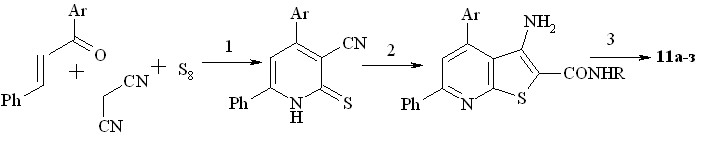
1. этанол / морфолин, 60оC, 2-3 часа (65-75 %)
2. Cl-CH2CONR, этанол (ДМФА), 2КОН, 25оC, 1-1,5 часа (85 - 90 %)
3. NО2/AсOH/H2SO4, +5оC, 20 мин (75 - 95 %)
а Ar = Ph; б-з Ar = фурил-2; а,б R = H; в R = бензил; г R = о-толил;
д R = м-толил; e R = п-толил; ж R = п-C6H4(COCH3); з R = о-C6H4(NO2)
Анализ спектров ЯМР 1Н 9-фурилзамещенных соединений 11б–з позволяет сделать однозначный выбор между двумя возможными конформациями взаимного расположения фуранового и пиридотиенотриазинонового фрагментов: сигнал протона 3'-Н фуранового кольца располагается в аномально слабом поле 8,1–8,4 м.д., в более слабом поле, чем сигнал протона 5'-Н. Такое положение сигнала 3'-Н протона обусловлено возникающим внутримолекулярным контактом между атомами водорода 3'-Н и азота N1 в s-транс-конформации взаимного расположения фуранового кольца и пиридотиенотриазинонового остова молекулы:

Квантово-механические расчеты (полуэмпирический метод АМ1) конформационных s-цис- и s-транс изомеров на примере молекулы 11б показали: во-первых, обе модели практически плоские, во-вторых, обе модели близки по энергий образования, в-третьих, межатомное расстояние в s-транс изомере между 3-Н атомом водорода и 1-N атомом азота составляет 2,174 (рис. 1). Стерическое напряжение приводит к увеличению валентного угла у sp2-гибридизованного пиридинового атома углерода 2-СFu – 9-C – 9a-C до 125о в оптимизированной модели молекулы.
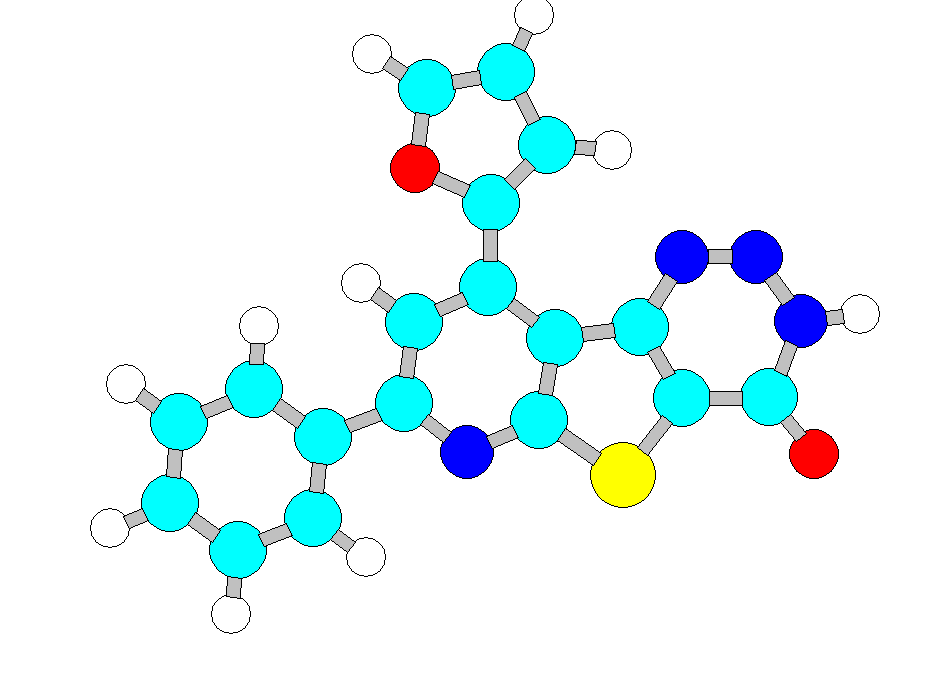
Рис. 1. Оптимальная геометрия молекулы 11б, рассчитанная методом АМ1
Масс-спектрометрическая фрагментация триазинонов 7-11 имеет свои отличительные особенности в сравнении с фрагментацией пиримидинонов 16. Молекулярные ионы 7,9-диметилпроизводных 7 претерпевают единственный процесс разложения [M – 28 - 44] = [M – N2 - HNCO]. Введение атома брома в 8 положение гетероцикла практически не сказывается на направленности фрагментации молекулярного иона. Для соединений, имеющих в своем составе метоксиметильную группу, появляется новое направление фрагментации молекулярного иона – процесс [M - .CH3], но не [M – CH3OH], что наблюдалось у соответствующих пиримидинонов.
Наличие фурильной гуппы, способной к локализации заряда и спина, вносит свои особенности во фрагментацию молекулярных ионов соединения 11б-з. В этом случае М+ также разлагается двумя путями: а) характеристичным для всех триазинонов элиминированием молекулы азота N2 и б) специфичным, видимо, только для фурилзамещенных производных процессом с потерей массы 26 дальтон. Анализ структуры 11 показывает, что частицей с массой 26 дальтон является молекула ацетилена, экстузируемая фурановым циклом заместителя.
3. Синтез гетероциклических соединений на основе 2-(3-аминотиено-[2,3-b]пиридин-2-илкарбоксамидо)алкановых кислот.
Взаимодействием хлорацетильных производных валина (12а) и лейцина (12б) с метил-4-метоксиметил-3-цианопиридин-2-тионом в щелочной среде получены N-замещенные аминокислоты 13а,б (выходы 83 и 87 % соответственно).
Схема 5

Спектры ЯМР 1Н подтверждают аминокислотное, но не цвиттер-ионное, строение соединений 13а,б: в спектрах присутствуют уширенные однопротонные синглеты СООН в области 12,5 -12,6 м.д. и узкие двухпротонные синглеты NH2 групп в диапазоне 6,88 - 6,90 м.д. Соединения 13а,б, несмотря на наличие «лабильной» карбоксильной группы, достаточно устойчивы к электронному удару: в масс-спектрах имеются достаточно интенсивные пики молекулярных ионов.
Ранее [Федоров А.Е., Шестопалов А.М., Белков П.А. Изв. АН, 2003, 10, с. 2081] сообщалось о синтезе производных диазепиндиона в ходе термолиза подобных аминотиенопиридинкарбокамидоалкановых кислот, что побудило нас изучить превращения аминокислот 13а,б, происходящие при умеренных температурах под действием сильных кислот. Оказалось, что соединения 13а,б в ледяной уксусной кислоте в присутствии 63 %-ной H3PO4 после непродолжительного кипячения гладко превращаются в соответствующие производные 2,3,4,5-тетрагидро-1Н-пиридо[3’,2’:4,5]тиено[3,2-e][1,4]диазепин-2,5-диона 14а,б с выходами более 70 % (схема 6).
Схема 6

Характеристичной особенностью ЯМР 1Н спектров диазепиндионов 14 является наличие двух сигналов амидных протонов CONH групп: синглетный однопротонный сигнал в области 10,15 - 10,17 м.д. принадлежит N1-H протону, не имеющему «протонов-соседей», в то время как дублетный однопротонный сигнал в области 8,4 – 8,6 м.д. принадлежит N3-H протону, спиново связанному с С2-H протоном. Еще одна особенность спектров соединений 14 – сигнал протонов Py-CH2-O-звена представляет собой пару дублетов в области 4,6 - 5,2 м.д. с типичной геминальной КССВ, равной 13 - 14 Гц. Расщепление синглетного сигнала протонов прохирального метиленового звена CH2OCH3 группы при переходе от исходных аминокислот 13 к диазепиндионам 14, очевидно, связано с пространственным сближением хирального и прохирального центров в молекулах диазепиндионов.
Диазипиндионы 14 более устойчивы к электронному удару, чем исходные аминокислоты 13: молекулярные ионы диазепиндионов 14 имеют интенсивность более 50 % от максимального.
Циклизация аминокислот 13 в полифосфорной кислоте привела к неожиданным результатам. Так, при нагревании (90 – 95оС) производного валина 13а в полифосфорной кислоте (15-20 мин) образуются три продукта реакции, которые выделены колоночной хроматографией:
Схема 7

Выходы: 14a 42 %; 15a 22 %; 16 19%
Структуры соединений 15а и 16 однозначно доказаны данными элементного анализа, ИКС, ЯМР 1Н и масс-спектрометрии.
Проведенные структурные исследования соединений 14а, 15а и 16, продуктов трансформации аминокислоты 13а в полифосфорной кислоте, позволяют предложить непротиворечивый механизм происходящих превращений (схема 8). Внутримолекулярная нуклеофильная атака неподелённой парой электронов аминогруппы электрофильного центра катиона А приводит к замыканию диазепиндионового цикла и образованию 14а. Возможно, ацильный катион А претерпевает декарбонилирование, превращаясь в устойчивый вторичный катион Б, стабилизированный р,р-взаимодействием с соседней аминогруппой.
Схема 8
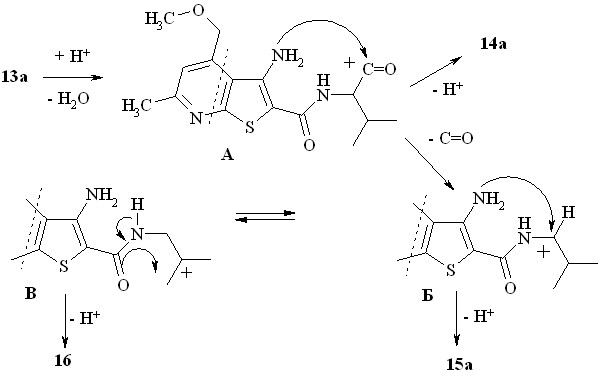
Изомеризация катиона Б (1,2-гидридный сдвиг) приводит к возникновению не менее стабильного третичного катиона В, что, в свою очередь, приводит к замыканию пятичленного оксазолонового кольца, в результате депротонирования которого возникает структура 16.
Производное лейцина 13б в полифосфорной кислоте образует только два продукта, один из которых диазепиндион 14б, второй – гомолог соединения 15а – 2-изобутилпиримидинон 15б (схема 9).
Схема 9

Выходы: 14б 44 %, 15б 32 %
Отсутствие в этом случае соответствующего оксазолона, очевидно, связано с тем, что в данном случае равновесие между аминоалкильным катион типа Б и изомерным ему вторичным карбокатионом типа В (схема 8) сдвинуто в сторону катиона Б вследствие его большей стабильности.
Диазотирование соединений 13а и 13в действием NaNO2 в смеси ледяной уксусной кислоты и H2SO4 при 0 оС приводит к соответствующим триазинонам 17а,б (схема 10) с выходом более 80 %. Других продуктов типа 14, 15 или 16 в реакционной смеси не обнаружено.
Схема 10
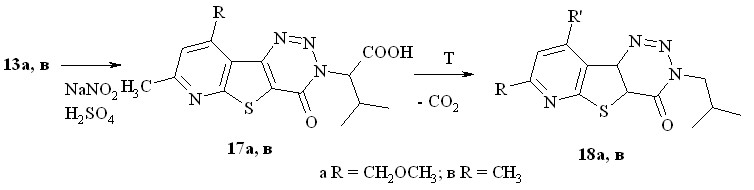
Кислоты 17а,в, в отличие от исходных аминокислот 13а,в исключительно легко декарбоксилируются даже при кратковременном нагревании в высококипящих растворителях, давая с практически количественным выходом соединения 18а,б.
Молекулярные ионы соединений 17 крайне неустойчивы, единственным направлением распада молекулярных ионов кислот 17 является экструзия молекулы СО2, и далее масс-спектры соединений 17а,в и 18а,в практически идентичны в каждой паре. Характерным процессом фрагментации М+ триазинонов 18 является последовательность реакций [M – N2 - HNCO].
4. Новая гетероциклическая система – изоиндоло[1’,2’:2,3]-пиридо[3’’,2’’:4’,5’]тиено-[3’,2’:4,5]пиримидо[1,6-a]бензимидазол-8(12bН)-он
Известно, что производные 3-амино-2-(бензимидазолил-2)тиено[2,3-b]пиридина в реакциях с андгидридами или ортоэфирами карбоновых кислот образуют пентациклические гетероароматические системы - бензо[4,5]имидазо[1,2-c]пиридо[3',2':4,5]тиено[2,3-e]пири-мидины, а в реакциях с альдегидами - 5,6-дигидробензо-[4,5]имидазо-[1,2-c]пиридо[3',2':4,5]ти-ено[2,3-e]пиримидины. Представляло интерес исследовать взаимодействие 3-амино-2-(бензимидазолил-2)тиено[2,3-b]пиридинов с соединениями, содержащими в одной молекуле альдегидную и карбоксильную группы. В частности, на примере 3-амино-2-(бензимидазолил-2)-4,6-дифенилтиено-[2,3-b]пиридина исследована направленность реакции с производными орто-формилбензойной кислоты и, для сравнения, с алифатическими и ароматическими альдегидами.
Реакция в толуоле в присутствии TsOH протекает с образованием только соответствующих 1,2-дигидропиримидинонов 20. Соединение 20г легко дегидратируется в полифосфорной кислоте, давая новую семициклическую конденсированную систему 22 (70%). Как показывает квантово-механический расчет (АМ1) геометрии соединения 22, его гептациклический остов состоит из двух плоскостей, пересекающихся по связи N7 – C12b под углом 120о, что обеспечивает оптимальную конфигурацию единственного в молекуле sp3-гибридизованного атома C12b.

Соединение 22 обладает устойчивостью к электронному удару: в его масс-спектре имеются только два значимых интенсивных пика – молекулярного иона (I = 84 %) и [M – 28] = [M – CO] (I = 100 %).
5. Синтезы гетероциклов на основе 2-амино-3-цианотиофенов
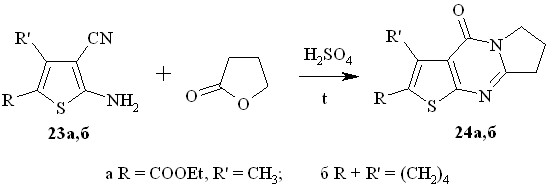
Известен способ получения 3,4,5,7,8,9-гексагидро-1Н-пирроло[1,2-a]тиопирано[4’,3’:4,5]тиено[2,3-d]пиримидин-5-она взаимодействием соответствующего 2-амино-3-этоксикарбонилтиофена с пирролидоном при кипячении в дихлорэтане в присутствии хлороксида фосфора. Мы получили ту же пирролотиенопиримидиноновую структуру (гетероаналоги алкалоида деоксивазицинона) иным способом – взаимодействием производных 2-амино-3-цианотиофенов 23а,б с бутиролактоном в присутствии серной кислоты (схема 11).
Реакция проводится в пятикратном избытоке бутиролактона при добавлении нескольких капель конц. H2SO4 при 200оС и заканчивается за 2 часа. Выходы соединений 24 составляют 52 - 57 %.
Схема 11
3,4-Дигидротиено[2,3-d]пиримидин-4-оновая система 27, аналогичная той, что имеется в молекулах соединений 24, получена взаимодействием 2-хлорацетиламино-3-цианотиофена 25 двумя путями (схема 12): первый путь - нагревание хлорацетиламинотиофена 26 в смеси уксусной и серной кмслот приводит к образованию (выход до 15 %) 2-хлорметилтиенопиримидин-4-она 26, который в ДМФА в присутствии двух эквивалентов КОН реагирует с пиридин-2-тионом А, давая целевой продукт 27 с выходом до 80 %.
Альтернативный путь синтеза соединения 27 заключается в иной последовательности проведения реакций: хлорацетиламинотиофен 26 вводили в реакцию с пиридинтионом А (этанол, 1 моль КОН, 40 - 50оС, 1 час), получая с выходом более 80 % продукт 29, который при нагревании в присутствии щелочи в ДМФА практически количественно изомеризуется по Торпу-Циглеру в тиенопиридин 28.
Схема 12
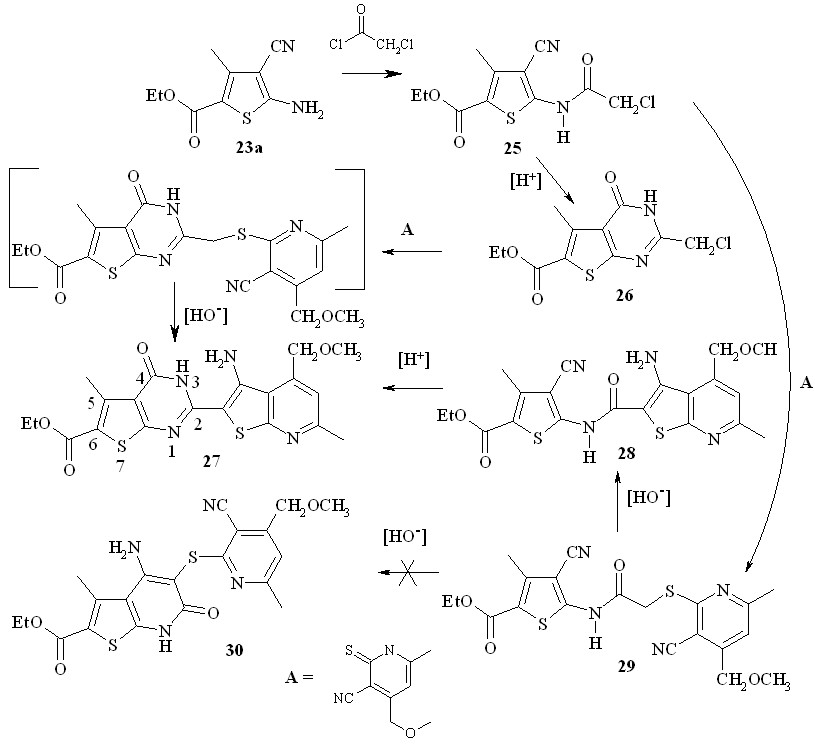
Других продуктов изомеризации типа 30 не обнаружено. Нагревание в течение получаса соединения 29 в смеси уксусной серной кислот дает тот же продукт 27 с выходом 20-25 %. Таким образом, альтернативный путь, хотя и имеет на одну стадию больше, позволяет получить целевой продукт 27 с более высоким выходом, считая на исходный хлорацетиламинотиофен 25.
Бромметилпроизводное 31 взаимодействует с пиридинтионом А (схема 13) в этаноле в присутствии одного эквивалента КОН (и даже без него) при небольшом нагревании, давая продукт замещения 32 с выходом 60-70 %. Попытки проведения циклизации Торпа-Циглера при добавлении второго эквивалента КОН оказались безуспешными.
Схема 13

Попытки циклизации по Торпу-Циглеру никотинитрила 34 в тиенопиридин 35 также оказались безуспешными. Возможно, это обусловлено низкой СН-кислотностью метиленовой группировки в соединениях 32 и 34. Нагревание соединения 34 в смеси уксусной и серной кислот в течение 2 час приводит к новому продукту 36, в ИК спектре которого имеется одна полоса поглощения CN (2198 см-1), а в спектре ЯМР 1Н - двухпротонный синглет S-CH2 группировки (4,52 м.д.) и иное положение сигналов амидной N-CO-CH3 группы и амидного NH протона (2,39 м.д. и 12,56 м.д. соответственно)
Анализ масс-спектра 2-амино-3-цианотиофена 23а показывает отсутствие каких-либо параллельных реакций распада его молекулярного иона: распад происходит строго последовательно и возникает характеристичная серия пиков ионов 210, 182, 165, 138, 110, 68, что соответствует последовательности реакций [M – этилен – ОН – HCN – CO – CS].
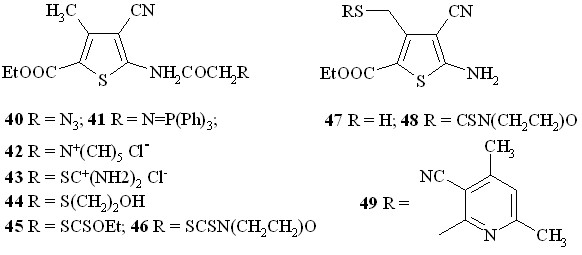
Эта серия, как оказалось, присутствует в масс-спектрах его N-ацилзамещенных производных 26, 39 – 46, а также S-метилзамещенных 25, 27 – 29, 47 – 49. Исключением являются иминофосфоран 41, имеющий "тяжелый" трифенилиминофосфорановый заместитель, и тиол 47, не способный элиминировать атом серы непосредственно из молекулярного иона.
Выводы
1. Проведено систематическое исследование реакций аннелирования ди- и тетрагидропиримидинового, 1,2,3-триазинового, 1,4-диазепинового циклов с участием 3-амино-2-карбамоил(бензимидазолил)тиенопиридинов и 2-амино-3-цианотиофенов.
2. Разработаны методики синтеза ранее неизвестных 2-незамещенных и 2-метилзамещенных тетрагидропиридотиенопиримидинонов взаимодействием соответственно параформа и уксусного альдегида с 3-амино-2-карбамоил-тиенопиридинами в толуоле при умеренных температурах и катализе толуолсульфокислотой.
3. Показано, что причиной возникновения диастереотопности атомов водорода прохиральных метиленовых звеньев в положениях 3 и 9 пиридотиенопиримидиноновой системы является появление хирального центра у атома углерода С2, что четко проявляется в спектрах ЯМР 1Н.
4. Разработаны методы синтеза 9-фурилпиридотиенотриазинонов исходя из 1-(2-фурил)-3-фенил-2-пропен-1-она. Установлено, что молекулы последних имеют s-транс-конформационное взаиморасположение фуранового и пиридотиено-триазинонового колец с внутримолекулярным контактом 3'-Н атомом водорода фуранового кольца и атомом N1 азота триазинонового цикла.
5. Установлено, что орто-формилбензойные кислоты взаимодействуют с 3-амино-2-карбамоил(бензимидазолил)тиенопиридинами как ароматические альдегиды, что позволило в дальнейшем синтезировать новую гептациклическую конденсированную систему - изоиндоло[1',2':2,3]пиридо[3'',2'':4',5']тие-но[3',2':4,5]-пиримидо[1,6-а]бензимидазол-8(12bH)-он.
6. Разработан простой и удобный метод синтеза гетероаналогов алкалоида деоксивазицинона – производных 4,6,7,8-тетрагидропирроло[1,2-а]тиено[2,3-d]-пиримидин-4-она из соответствующих 2-амино-3-цианотиофенов и бутиролактона в кислой среде.
7. Разработан метод синтеза новой сопряженной гетероциклической системы - 2-(3-амино-6-метил-4-метоксиметилтиено[2,3-b]пиридин-2-ил)-5-метил-4-оксо-6-этоксикарбонил-3,4-дигидротиено[2,3-d]пиримидина, исходя из 2-амино-4-метил-3-циано-5-этоксикарбонилтиофена и 6-метил-4-метоксиметил-3-цианопиридин-2(1Н)-тиона.
8. Показано, что атом брома в молекулах 2-амино-4-бромметил-3-циано-5-этоксикарбонилтиофена легко замещается в реакциях с S-нуклеофилами и, в частности, с 3-цианопиридин-2(1Н)-тионами, но возникающее метиленовое звено в S-СН2-линкере между тиофеновым и пиридиновым циклами не активно в изомеризации Торпа-Циглера.
9. Масс-спектрометрически обнаружены характеристические пути фрагментации молекулярных ионов: для тетрагидропиридотиенопиримидинонов это процессы [M – H2 – OH], для пиридотиенотриазинонов – [M – N2 – HNCO], для N-ацилпроизводных 2-амино-4-метил-3-циано-5-этоксикарбонилтиофена – уникальная последовательность реакций [M – кетен (или RS–H2) – этилен – ОН – HCN – CO – CS].
Основное содержание диссертации изложено в следующих работах:
1. Мохамед Абдель-Монейм Махмуд, Василин В.К., Крапивин Г.Д. Новая поликонденсированная гетероциклическая система – изоиндоло[1',2': 2,3]пиридо-[3'',2'':4',5']-тиено[3'2':4,5]пиримидо[1,6-а]бензимидазол-8(12bH)-он. Химия гетероциклических соединений, 2006, № 11, с. 1742 – 1744.
2. Василин В.К., Мохамед Абдель-Монейм Махмуд, Крапивин Г.Д. Удобный метод синтеза производных 4,6,7,8-тетрагидропирроло[1,2-а]тиено[2,3-d]пиримидин-4-она. Химия гетероциклических соединений, 2006, № 11, с. 1745 – 1746.
3. Василин В.К., Мохамед Абдель-Монейм М., Милич А.А., Кайгородова Е.А., Стрелков В.Д., Крапивин Г.Д. Тетрагидропиридо[3',2':4,5]тиено[3,2-d]- и дигидробензо[4,5]имидазо-[1,2-c]пиридо[3',2':4,5]тиено[2,3-e]пиримидины: синтез, особенности масс-спектро-метрической фрагментации и биологической активности. Фундаментальные и прикладные проблемы современной химии в исследованиях молодых ученых. Материалы Международной научной конференции. Астрахань 10-12 сентября 2006 г. Изд. дом "Астраханский университет", с. 43 – 44.
4. Василин В.К., Строганова Т.А., Мохамед Абдель-Монейм М., Щербинин В.А., Крапивин Г.Д. Межмолекулярные циклизации 2-(3-аминотиено[2,3-b]пиридин-2-илкарбок-самидо)алкановых кислот. Фундаментальные и прикладные проблемы современной химии в исследованиях молодых ученых. Материалы Международной научной конференции. Астрахань 10-12 сентября 2006 г. Изд. дом "Астраханский университет", с. 40 – 41.
5. Василин В.К., Мохамед Абдель-Монейм М., Сбитнева Е.А., Кайгородова Е.А., Стрелков В.Д., Крапивин Г.Д. Дигидропиридо[3',2':4,5]тиено[3,2-d]- и бензо-[4,5]имидазо[1,2-c]пиридо[3',2':4,5]тиено[2,3-e][1,2,3]триазины: синтез, масс-спектрометрическая фрагментация и антидотное действие. Фундаментальные и прикладные проблемы современной химии в исследованиях молодых ученых. Материалы Международной научной конференции. Астрахань 10-12 сентября 2006 г. Изд. дом "Астраханский университет", с. 42 – 43.
6. Василин В.К., Абдель-Монейм Махмуд М., Крапивин Г.Д. Взаимодействие производных тиофена Гевальда с пиридинтионами: синтез три- и пентациклических систем. Международная конференция по химии гетероциклических соединений, посвящённая 90-летию со дня рождения проф. А.Н. Коста, Москва, 17-21 октября 2005 г, с. 400.
Подписано в печать _______________ Зак. № _________ Тираж ______
Лиц. ПД № 10-47020 от 11.09.2000
Типография КубГТУ, 350058, Краснодар, ул. Старокубанская, 88/4
[1] Автор выражает свою глубокую признательность доценту кафедры органической химии КубГТУ к.х.н. В.К. Василину за помощь в проведении данного исследования и многочисленные предложения при подготовке рукописи диссертационной работы

