Физико-химическое взаимодействие в системах с участием фторидов и иодидов щелочных мета л лов
На правах рукописи
Дворянова Екатерина Михайловна
физико-химическое взаимодействие
В СИСТЕМАХ с участием фторидов и иодидов
ЩЕЛОЧНЫХ МЕТАЛЛОВ
02.00.04 – физическая химия
02.00.01 – неорганическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
САМАРА 2008 г.
Работа выполнена в ГОУ ВПО «Самарский государственный технический университет»
Научный руководитель: кандидат химических наук,
И.М. Кондратюк
Научный консультант: заслуженный деятель науки РФ, доктор химических
наук, профессор И.К. Гаркушин
Официальные оппоненты: доктор химических наук, профессор
О.В. Михайлов;
доктор химических наук, профессор
Л.М. Васильченко
Ведущая организация: ГОУ ВПО «Башкирский государственный университет»
Защита диссертации состоится 13 мая 2008 г. в 12 час. на заседании диссертационного совета Д 212.217.05 при ГОУ ВПО «Самарский государственный технический университет» по адресу 443100, г. Самара, ул. Молодогвардейская, 244, главный корпус, ауд. 200, e-mail: [email protected]
С диссертацией можно ознакомиться в научно-технической библиотеке
Самарского государственного технического университета.
Автореферат разослан «9» апреля 2008 г.
Ученый секретарь диссертационного совета,
к.х.н., доцент  Саркисова В.С.
Саркисова В.С.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Составы на основе галогенидов щелочных металлов (ЩМ) используются в качестве расплавляемых электролитов химических источников тока и теплоаккумулирующих материалов. Они представляют интерес как среды для электролитического выделения металлов из расплавов, перспективные флюсы для сварки и пайки металлов, среды для синтеза монокристаллов. Систематическое изучение многокомпонентных систем из галогенидов щелочных металлов позволяет получить набор электролитов, необходимых для практического применения и создания новых технологических процессов, основанных на применении ионных расплавов. Фторид-галогенидные системы из щелочных металлов являются недостаточно изученными, и поэтому перспективны в плане получения новых солевых композиций. Большой интерес представляет фундаментальная направленность изучения фторид-иодидных систем щелочных металлов для выявления закономерностей в строении диаграмм состояния.
Исследования систем из галогенидов щелочных металлов проводились в рамках тематического плана Самарского государственного технического университета (рег. № 01.2.00307529; № 01.2.00307530), а также в рамках проекта, выполняемого по Ведомственной научно-технической программе «Развитие научного потенциала высшей школы (2006-2008 гг)».
Целью работы является поиск закономерностей в строении поверхностей ликвидусов систем с присутствием фторид-галогенидного обмена и изучение физико-химического взаимодействия в системах из фторидов и иодидов щелочных металлов.
Основные задачи исследования:
- выявление закономерностей изменения поверхностей ликвидусов двух-, трех- и трехкомпонентных взаимных систем;
- расчет характеристик точек нонвариантного равновесия в неизученных трехкомпонентных взаимных системах;
- экспериментальное исследование физико-химического взаимодействия в системах М||Г1,Г2; М||Г1,Г2,Г3; М1,М2||F,I; М1,М2,М3||F,I (М – Li, Na, K, Rb, Cs; Г – F, Cl, Br, I);
- определение составов низкоплавких смесей для использования в качестве расплавляемых электролитов разогревных химических источников тока (ХИТ).
Научная новизна работы:
Выявлены закономерности трансформации ликвидусов в рядах систем М||Г1,Г2; М||Г1,Г2,Г3; М1,М2||F,Г (М – Li, Na, K, Rb, Cs; Г – F, Cl, Br, I), характеризующихся наличием фторид-галогенидного обмена.
Построены модели поверхностей ликвидусов неисследованных трехкомпонентных взаимных систем М1,М2||F,I.
Предложена методика определения характеристик тройных эвтектических точек, модифицированная для трехкомпонентных взаимных систем с присутствием фторид-галогенидного обмена и областей расслаивания жидких фаз.
Проведено систематическое исследование систем различной мерности из галогенидов щелочных металлов с использованием дифференциального термического анализа (ДТА) и рентгенофазового анализа (РФА).
Экспериментально исследованы 2 двухкомпонентные, 3 трехкомпонентные, 8 трехкомпонентных взаимных и 4 четырехкомпонентные взаимные системы. Из них впервые исследованы 8 трехкомпонентных взаимных и 4 четырехкомпонентные взаимные системы.
Проведено разбиение четырехкомпонентных взаимных систем М1,М2,М3||F,I на симплексы, для линий конверсии описано химическое взаимодействие. Установлены соотношения фаз, которые подтверждены данными РФА.
Практическая значимость работы:
- Рассчитаны характеристики эвтектик в тройных взаимных системах, содержащих иодид лития.
- Экспериментально получены характеристики (состав, температура плавления) смесей, отвечающих точкам нонвариантных равновесий в 2 двухкомпонентных, 2 трехкомпонентных, 6 трехкомпонентных взаимных системах, в 3 стабильных треугольниках и 3 стабильных тетраэдрах четырехкомпонентных взаимных систем, которые представляют интерес как справочный материал.
- Выявленные низкоплавкие составы рекомендуются к использованию в качестве расплавляемых электролитов ХИТ.
На защиту выносятся:
- Результаты прогнозирования характера диаграмм плавкости неисследованных двухкомпонентных М||Г1,Г2, трехкомпонентных М||Г1,Г2,Г3 и трехкомпонентных взаимных систем М1,М2||F,Г.
- Результаты разбиения на симплексы фазового комплекса четырехкомпонентных взаимных систем М1,М2,М3||F,I и его экспериментальное подтверждение.
- Экспериментально полученные данные по фазовым равновесиям в 2 двухкомпонентных, 3 трехкомпонентных, 8 трехкомпонентных взаимных и 4 четырехкомпонентных взаимных системах.
- Составы низкоплавких смесей из галогенидов ЩМ, рекомендованные к использованию в качестве электролитов ХИТ.
Апробация работы. Результаты работы докладывались на: Международной научной конференции «Молодежь и химия» (Красноярск, 2004); IX Международной конференции «Физико-химические процессы в неорганических материалах» (Кемерово, 2004 г.); Международной конференции «Фундаментальные проблемы электрохимической энергетики» (Саратов, 2005 г.); II Международной научно-практической конференции «Разработка и применение высоких технологий в промышленности» (Санкт-Петербург, 2006 г); Международной научной конференции «Инновационный потенциал естественных наук» (Пермь, 2006); XIV Международной конференции студентов, аспирантов и молодых ученых по фундаментальным наукам «Ломоносов – 2007» (Москва, 2007); XIV Всероссийской конференции «Физическая химия и электрохимия расплавленных электролитов» (Екатеринбург, 2007); XVIII Менделеевском съезде по общей и прикладной химии (Москва, 2007).
Публикации. Основное содержание диссертации изложено в 1 монографии, 9 статьях, из которых 4 статьи в журналах перечня ВАК, 4 тезисах докладов.
Структура и объем работы. Диссертационная работа включает введение, 4 главы, выводы, список литературы из 133 наименований и 1 приложение. Работа изложена на 164 страницах машинописного текста, включающих 25 таблиц, 112 рисунков.
Содержание работы
Во введении обоснована актуальность исследования физико-химического взаимодействия в системах из галогенидов щелочных металлов и разработки метода прогнозирования диаграмм плавкости в рядах систем, на основании чего сформулированы цель и задачи диссертационной работы.
В 1 главе приведен аналитический обзор по применению ионных расплавов, методам прогнозирования и экспериментального изучения многокомпонентных систем, а также анализ данных литературы по исследованным системам М||Г1,Г2; М||Г1,Г2,Г3; М1,М2||F,I; М1,М2,М3||F,I (М – Li, Na, K, Rb, Cs; Г – F, Cl, Br, I).
В первом и втором разделах главы 2 предложен метод прогнозирования характера поверхности ликвидусов неисследованных систем М||Г1,Г2, М||Г1,Г2,Г3 и М1,М2||F,Г. Для получения первичной информации и планирования экспериментальных исследований проведено прогнозирование характера поверхности ликвидуса неисследованных систем. Для этого применялось два подхода:
- статистический анализ типов диаграмм плавкости изученных систем с использованием соотношения, включающего ионные радиусы компонентов системы, являющегося определяющим параметром. Такой анализ входит в классификацию методов анализа массивов данных применительно к многокомпонентным системам, предложенную В.М. Воздвиженским, и является весьма эффективным. В качестве определяющего параметра использована относительная разница радиусов анионов элементов, составляющих систему;
- сопоставление систем и анализ изменения поверхности ликвидусов систем, возникающего в рядах при замене элементов, образующих одну группу в Периодической системе.
Величины относительных ионных радиусов, рассчитанные по формуле (1), дали возможность построить статистический график зависимости типа диаграмм плавкости бинарных систем из галогенидов щелочных металлов от ионного радиуса щелочного металла (рис. 1). На этот график были нанесены уже имеющиеся данные по изученным системам, при этом системы с разными типами диаграмм плавкости разделились на области, между которыми была проведена граница раздела. Т.е. на статистическом графике (рис. 1) системы распределяются по двум областям – системы с образованием непрерывных рядов твердых растворов (НРТР) и системы с образованием эвтектик.
![]() , R1 > R2 (1)
, R1 > R2 (1)
где R1 и R2 – ионные радиусы щелочных металлов.
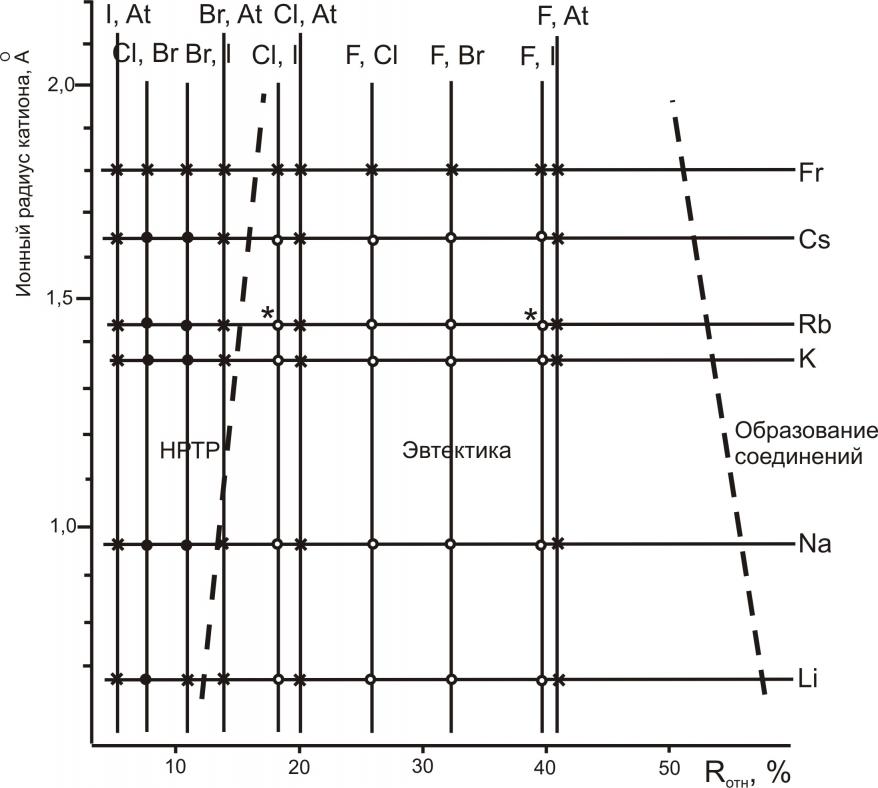
Рис. 1. Зависимость типа диаграмм плавкости бинарных систем из галогенидов щелочных металлов от ионного радиуса щелочного металла: • - системы с образованием НРТР; - системы с образованием эвтектики; - неисследованные системы; * - системы, исследованные автором
Таким образом, установлены значения Rотн, определяющего тип систем: для Rотн < 17 – системы с образованием НРТР, для Rотн > 17 – системы с образованием эвтектики.
Полученные результаты прогноза позволили сделать вывод о характере поверхности ликвидусов неисследованных систем и проанализировать данные литературы по исследованным системам. Например, систему RbCl-RbI одни исследователи относят к системам с образованием твердых растворов, другие – к системам эвтектического типа. Система RbF-RbI не исследована. Статистический график позволяет отнести системы RbF-RbI, RbCl-RbI к эвтектическим.
Ранее для двухкомпонентных систем из галогенидов ЩМ с общим анионом было установлено значение Rотн>50, при котором в системах образуются соединения. Важным выводом из анализа графика на рис. 1 является то, что никакие химические соединения в двухкомпонентных системах с общим катионом не образуются, т.к. рассмотренные системы имеют значения Rотн не больше 50.
Аналогично проведено прогнозирование поверхностей ликвидусов трехкомпонентных систем с общим катионом. Рассчитаны значения относительного ионного радиуса для трехкомпонентных систем (табл. 1). Полученные значения, а также тип систем нанесены на статистический график. Данные распределились по трем областям: область 1 – системы, в которых присутствуют тройные твердые растворы; область 2 – системы, в которых образуется поле двойных твердых растворов и поле чистого компонента; область 3 – системы с образованием эвтектик (в том числе при распаде твердых растворов). По результатам прогноза в системе RbF-RbCl-RbBr образуются твердые растворы, в системе RbF-RbCl-RbI – эвтектика (рис. 2).

Рис. 2. Зависимость типа диаграмм плавкости трехкомпонентных систем из галогенидов щелочных металлов от ионного радиуса катиона: • - системы с образованием НРТР; - системы с образованием эвтектики; - неисследованные системы; * - системы, исследованные автором (порядковые номера систем см. в таблице 1)
Таблица 1
Значения параметра Rотн и тип трехкомпонентных систем из галогенидов щелочных металлов с общим катионом
| Катионы | Анионы | ||||
| F-–Cl-–Br- | F-–Cl-–J- | F-–Br-–J- | Cl-–Br-–J- | ||
| Li+ | № | 1 | 2 | 3 | 4 |
| Rотн | 19 | 26 | 23 | 12 | |
| Тип взаимодействия | НРТР | – | – | – | |
| Na+ | № | 5 | 6 | 7 | 8 |
| Rотн | 19 | 26 | 23 | 13 | |
| Тип взаимодействия | НРТР | Е | НРТР | НРТР | |
| K+ | № | 9 | 10 | 11 | 12 |
| Rотн | 21 | 27 | 25 | 11 | |
| Тип взаимодействия | НРТР | Е | НРТР | НРТР | |
| Rb+ | № | 13 | 14 | 15 | 16 |
| Rотн | 22 | 25 | 26 | 12 | |
| Тип взаимодействия | – | – | Е | НРТР | |
| Cs+ | № | 17 | 18 | 19 | 20 |
| Rотн | 22 | 27 | 27 | 12 | |
| Тип взаимодействия | НРТР | Е | НРТР | НРТР |
Проведен анализ изменения поверхности ликвидусов в рядах систем M||Г1,Г2,Г3 и М1,М2||F,Г, где М = Li, Na, K, Rb, Cs; Г= F, Cl, Br, I. Выявлены закономерности изменения поверхности ликвидусов, на основе которых проведен прогноз неисследованных систем, среди которых в основном не исследованы трехкомпонентные взаимные системы из фторидов и иодидов щелочных металлов. На рис. 3-5 представлены проекции ликвидусов трехкомпонентных взаимных систем М1,М2||F,Г. В системах с участием солей лития предполагалось наличие областей расслаивания в жидкой фазе. В исследованных тройных взаимных системах Li,M||F,Br, где M = K, Rb, Cs присутствуют области расслаивания двух жидкостей вдоль стабильной диагонали LiF-MBr. Системы Li,M||F,I по элементам огранения и по разбиению схожи с системами Li,M||F,Br (M = Li, Na, K, Rb, Cs), поэтому были сделаны предположения о том, что и поверхности ликвидусов для систем обоих рядов будут подобны. Таким образом, в системе Li,Na||F,I прогнозируется образование двух тройных эвтектик, в системах Li,K(Rb,Cs)||F,I – наличие области расслаивания вдоль стабильной диагонали LiF-MI (рис. 3).
Из анализа рядов тройных взаимных систем следует, что в системах Li,M||F,I (M = Na, K, Rb, Cs) стабильной диагональю является LiF-MI; в системах Na,M||F,I (M = K, Rb, Cs) стабильная диагональ NaF-MI (рис. 4). Это предположение подтвердилось дальнейшими термодинамическими расчетами, которые показали наличие стабильных пар солей в тройных взаимных системах. Подтвердилось также предположение о том, что системы K,Rb||F,I и Rb,Cs||F,I относятся к обратимо-взаимным системам и характеризуются наличием в них НРТР (рис. 5).
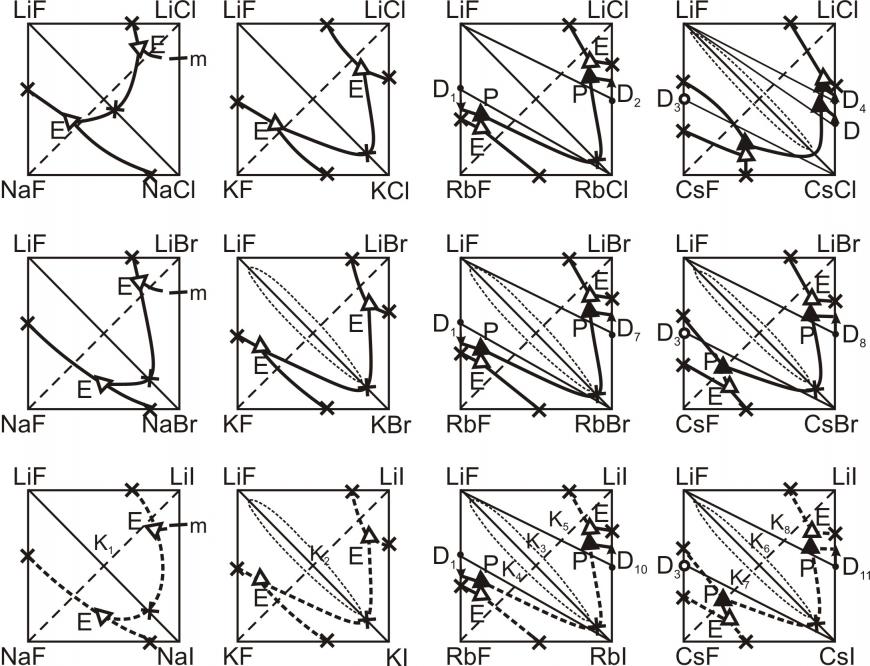
Рис. 3. Трехкомпонентные взаимные системы Li,M||F,Г
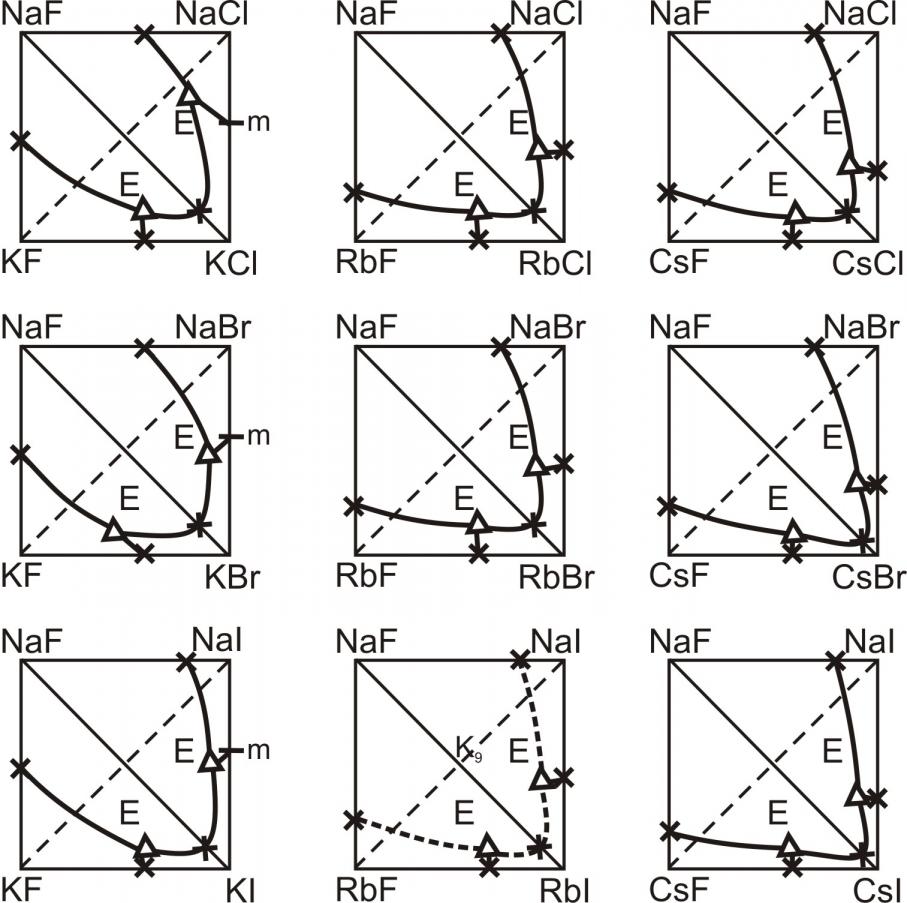
Рис. 4. Трехкомпонентные взаимные системы Na,M||F,Г

Рис. 5. Трехкомпонентные взаимные системы K,M||F,Г и Rb,Cs||F,Г
В третьем разделе главы 2 проведено прогнозирование характеристик тройных эвтектических точек в системах с иодидом лития, вследствие того, что экспериментальное исследование этих систем затруднено. Прогнозирование осуществлялось в два этапа.
Таблица 2
Результаты прогноза температур плавления и составов тройных эвтектик в системах LiF-LiI-МI (M = Na, K, Rb, Cs)
| Система | Характер точки | Содержание компонентов, мол. % | Температура плавления, оC | ||
| 1-ый | 2-ой | 3-ий | |||
| LiF-LiI-NaI | E | 16 | 71 | 13 | 409 |
| LiF-LiI-KI | E | 5 | 62 | 33 | 272 |
| LiF-LiI-RbI | E | 8 | 59 | 33 | 222 |
| LiF-LiI-CsI | E | 2 | 62 | 36 | 249 |
Таблица 3
Сравнение данных прогноза и экспериментальных данных по тройным эвтектикам в системах М1,М2||F,I (M = Li, Na, K, Rb, Cs)
| Система | Характер точки | Содержание компонентов, мол. % | Температура плавления, оC | ||||||
| прогноз | эксперимент | ||||||||
| 1-ый | 2-ой | 3-ий | 1-ый | 2-ой | 3-ий | прогноз | эксперимент | ||
| LiF-NaF-NaI | E | 12 | 10 | 78 | 5 | 20 | 75 | 581 | 583 |
| LiF-KF-KI | E | 50 | 40 | 10 | 47,5 | 50 | 2,5 | 479 | 482 |
| LiF-RbF-RbI | E | 39 | 56 | 5 | 45 | 52 | 3 | 451 | 461 |
| LiF-CsF-CsI | E | 12 | 50 | 38 | 16 | 52 | 32 | 426 | 437 |
| NaF-RbF-RbI | E | 9 | 29 | 62 | 5 | 35 | 60 | 482 | 485 |
| NaF-NaI-RbI | E | 7 | 43 | 50 | 4 | 46 | 50 | 461 | 465 |
| KF-CsF-CsI | E | 12 | 38 | 50 | 9 | 41 | 50 | 428 | 433 |
| KF-KI-CsI | E | 20 | 32 | 48 | 21 | 30,5 | 48,5 | 485 | 490 |
Первый этап. Прогнозирование температуры плавления тройных эвтектик. Для этого строились графики зависимости температуры плавления двойных эвтектик в системах LiF-LiГ (Г = Cl, Br, I) от температуры плавления тройных эвтектик в системах LiF-LiCl(Br)-MCl(Br) (M = Na, K, Rb, Cs). Зависимости строились в логарифмических координатах, температуры плавления приведены в кельвинах. Прогноз проводился, исходя из известных температур плавления эвтектик в двойных и тройных взаимных системах из галогенидов ЩМ. Исходя из построенных зависимостей, был сделан прогноз температуры плавления тройных эвтектик для фторид-иодидных взаимных систем.
Второй этап. Прогнозирование составов тройных эвтектических точек. Для этого строились графики «температура-состав». Исходной информацией служили данные по двойным системам LiI-MI (M = Na, K, Rb, Cs), а также температуры плавления индивидуальных солей, входящих в двойную систему LiI-MI. На одном графике строились две логарифмические линии. Каждая линия выходит из значения логарифма температуры плавления индивидуального вещества, эти линии на графике пересекаются в точке, соответствующей характеристикам точки нонвариантного равновесия двойной системы. Отсечение горизонтальной линией, нанесенной в соответствии с температурой плавления тройной эвтектики, полученной на первом этапе, дает прогноз состава тройной эвтектической точки.
Данные, полученные в результате прогнозирования (табл. 2), дают хорошие результаты. Метод расчета апробирован на экспериментально изученных симплексах, входящих в тройные взаимные системы Li,M||F,I (табл. 3). Средняя относительная погрешность определения температуры плавления эвтектик составила 2,5 %, а определения составов эвтектик – 7 %, что говорит о возможности применения такого подхода для прогнозирования характеристик точек нонвариантного равновесия.
В четвертом разделе главы 2 для систем М1,М2||F,I (M = Li, Na, K, Rb, Cs) приведены результаты расчета тепловых эффектов и изобарно-изотермических потенциалов реакций обмена, а также вывод о типах систем, согласно классификации, предложенной А.Г. Бергманом: обратимо-взаимная (ов), необратимо-взаимная (нв) или сингулярная необратимо-взаимная (снв). Результаты приведены в таблице 4.
В пятом разделе главы 2 приведены результаты разбиения четырехкомпонентных взаимных систем Li,K,Cs||F,I; Na,K,Rb||F,I; Na,K,Cs||F,I; Na,Rb,Cs||F,I, с применением теории графов. Исходной информацией являлось положение стабильных диагоналей в трехкомпонентных взаимных системах. Для каждой системы построены матрицы смежности и составлены логические выражения, представляющие собой произведения сумм индексов несмежных вершин. В системе Na,K,Cs||F,I соединений не образуется. Древо фаз этой системы линейное, состоит из трех стабильных тетраэдров, связанных между собой двумя стабильными секущими треугольниками. Древо фаз системы Li,K,Cs||F,I также линейное, но вследствие образования соединений LiCsF2 и LiCsI2 состоит из пяти стабильных тетраэдров, связанных между собой четырьмя секущими треугольниками. Древа фаз систем Na,K,Rb||F,I и Na,Rb,Cs||F,I сходны по строению. Они состоят из двух симплексов, в которых присутствуют НРТР, поэтому количество фаз в рассматриваемых симплексах меньше, чем количество компонентов. В симплексах NaF-NaI-K(Rb)I-Rb(Cs)I и NaF-K(Rb)F-Rb(Cs)F-K(Rb)I-Rb(Cs)I количество фаз на единицу меньше количества компонентов. В рассматриваемых симплексах NaF-NaI-K(Rb)I-Rb(Cs)I и NaF-K(Rb)F-Rb(Cs)F-K(Rb)I-Rb(Cs)I нонвариантные точки мерностью равной количеству компонентов системы отсутствуют.
В качестве примера приводятся результаты разбиения для системы Na,K,Cs||F,I, схема призмы составов и схема развертки которой изображены на рис. 6. В результате разбиения получена совокупность симплексов:
- NaF-NaI-KI-CsI
- NaF-KF-KI-CsI
- NaF-KF-CsF-CsI
Общие элементы смежных симплексов образуют стабильные секущие элементы: NaF-KI-CsI; NaF-KF-CsI
Древо фаз системы Na,K,Cs||F,I представлено на рис. 7. Фазовый состав в стабильных секущих треугольниках подтвержден результатами ДТА и РФА.
Таблица 4
Тепловые эффекты и изобарно-изотермические потенциалы реакций обмена в тройных взаимных системах
| Система | Реакция обмена | Тепловой эффект - H, кДж/моль | Изобарно-изотермический потенциал - G, кДж/моль | Классификация системы |
| Li,Na||F,I | K1: LiI + NaF LiF + NaI | 59,62 | 61,03 | снв |
| Li,K||F,I | К2: LiI + KF LiF + KI | 106,09 | 102,65 | снв |
| Li,Rb||F,I | К3: LiI + RbF LiF + RbI | 120,58 | 117,57 | снв |
| К4: LiI + 2RbF LiRbF2 + RbI | - | - | ||
| К5: 2LiI + RbF LiRbI2 + LiF | - | - | ||
| Li,Cs||F,I | K6: LiI + CsF LiF + CsI | 137,47 | 130,92 | снв |
| K7: LiI + 2CsF LiCsF2 + CsI | - | - | ||
| К8: 2LiI + CsF LiCsI2 + LiF | - | - | ||
| Na,Rb||F,I | K9: NaI + RbF NaF + RbI | 60,96 | 59,05 | снв |
| K,Rb||F,I | K10: KI + RbF KF + RbI | 14,48 | 14,92 | ов |
| K,Cs||F,I | K11: KI + CsF KF + CsI | 31,37 | 28,28 | нв |
| Rb,Cs||F,I | K12: RbI + CsF RbF + CsI | 16,89 | 13,36 | ов |
Примечание: номера точек конверсии приведены на рис. 10-14

Рис. 6. Схема призмы составов и схема развертки четырехкомпонентной взаимной системы Na,K,Cs||F,I

Рис. 7. Древо фаз системы Na,K,Cs||F,I
В шестом разделе главы 2 описано химическое взаимодействие в четырехкомпонентных взаимных системах Li,K,Cs||F,I, Na,K,Rb||F,I, Na,K,Cs||F,I, Na,Rb,Cs||F,I конверсионным методом, построены фигуры конверсии и определены стабильные продукты (фазы), получающиеся в результате реакций обмена.
В 3 главе приводятся результаты экспериментального изучения фазовых равновесий в двух- и трехкомпонентных системах с общим катионом щелочным металлом и трех- и четырехкомпонентных взаимных системах из фторидов и иодидов щелочных металлов.
Экспериментальные исследования проводились с использованием дифференциального термического анализа (ДТА) и рентгенофазового анализа (РФА). Кривые нагревания и охлаждения образцов снимали на установке ДТА на базе многоточечных автоматических потенциометров КСП – 4. В качестве усилителя термо-э.д.с. дифференциальной термопары использован фотоусилитель микровольтамперметра Ф – 116/1. Термоаналитические исследования проводились в стандартных платиновых микротиглях (изделия № 108-1, № 108-2, № 108-3 по ГОСТ 13498-68) с использованием платина-платинородиевых термопар, изготовленных из термоэлектродной проволоки ГОСТ 10821-64. Холодные спаи термопар термостатировались при 0 °С в сосудах Дьюара с тающим льдом. Скорость нагрева (охлаждения) образцов составляла 5…15 град/мин. Индифферентным веществом служил свежепрокаленный оксид алюминия квалификации "ч.д.а.".
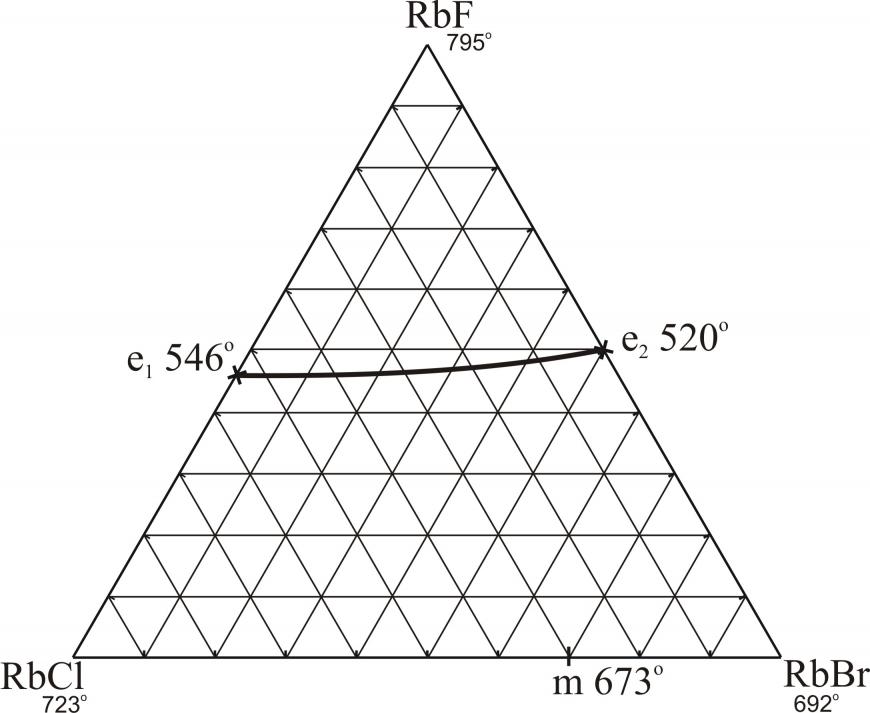
В результате экспериментальных исследований найдены характеристики эвтектических точек в двухкомпонентных RbF-RbI, RbCl-RbI; трехкомпонентных RbF-RbCl-RbI, NaF-KF-CsF; трехкомпонентных взаимных системах Li,Na||F,I, Li,K||F,I, Li,Rb||F,I, Li,Cs||F,I, Na,Rb||F,I, K,Cs||F,I; в стабильных треугольниках LiF-KF-CsI, NaF-KF-CsI, NaF-KI-CsI; в стабильных тетраэдрах LiF-KF-CsF-CsI, NaF-KF-CsF-CsI, NaF-KF-KI-CsI. Трехкомпонентная система RbF-RbCl-RbBr и трехкомпонентные взаимные системы K,Rb||F,I, Rb,Cs||F,I относятся к системам с образованием НРТР.
 |  | ||
| Рис. 8. Проекция поверхности кристаллизации системы RbF-RbCl-RbBr на треугольник состава | Рис. 9. Проекция поверхности кристаллизации системы RbF-RbCl-RbI на треугольник состава | ||
 |  | ||
 |  | ||
| Рис. 10. Проекции поверхностей кристаллизации систем Li,M||F,I на квадраты составов | |||
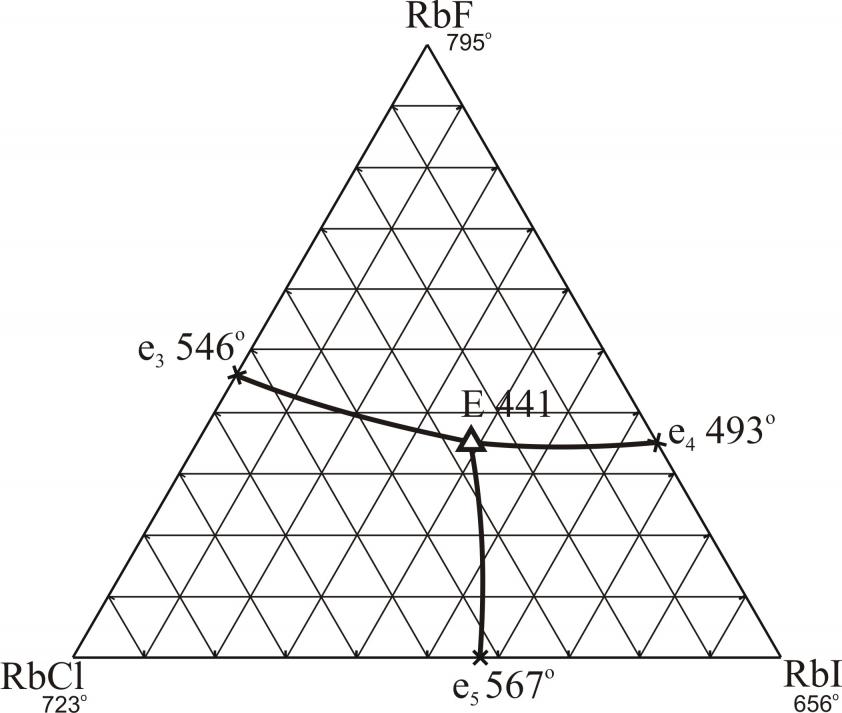
На рис. 8 и 9 приведены проекции ликвидусов на треугольники составов трехкомпонентных систем RbF-RbCl-RbBr и RbF-RbCl-RbI. Результаты прогноза по системам с галогенидами рубидия подтверждаются экспериментальными исследованиями: поверхность кристаллизации системы RbF-RbCl-RbBr представлена двумя полями – фторида рубидия и твердых растворов на основе хлорида и бромида рубидия (рис. 8); в системе RbF-RbCl-RbI (рис. 9) определены характеристики тройной эвтектической точки: Е 441 оС, RbF – 35 %, RbCl – 25,5 %, RbI – 39,5 % (мол.).
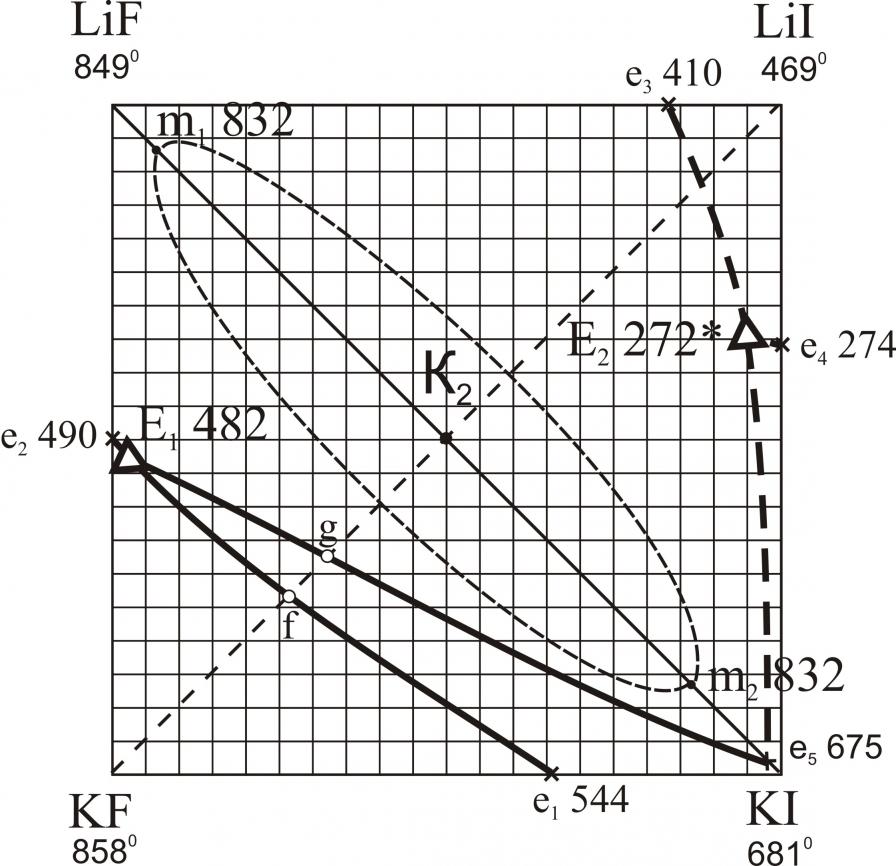
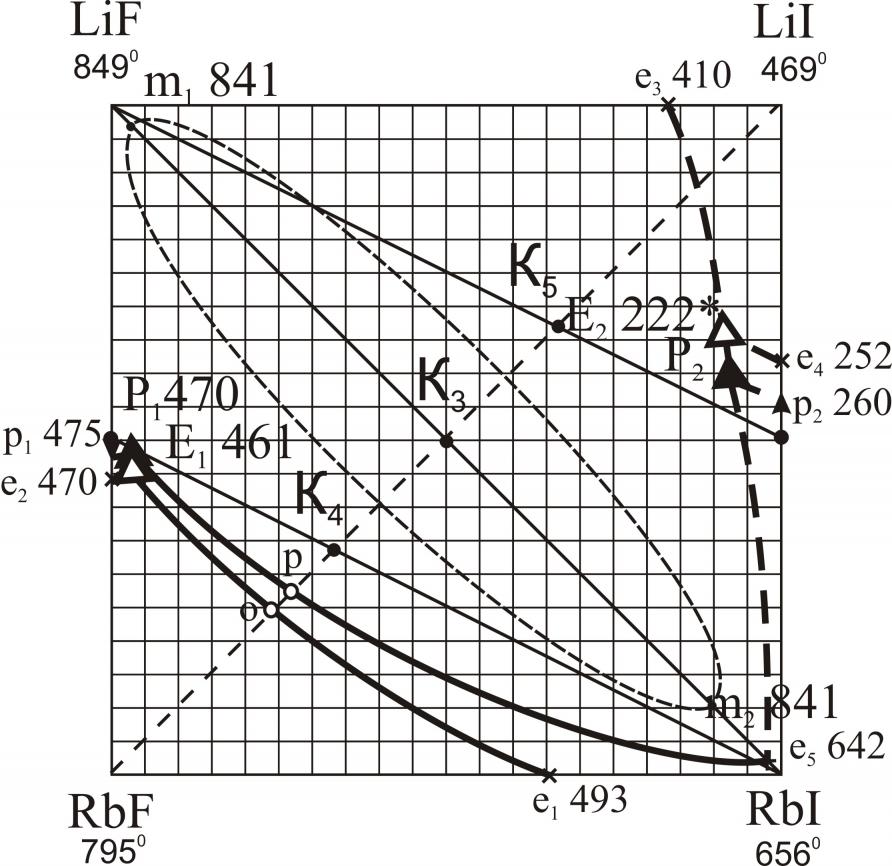
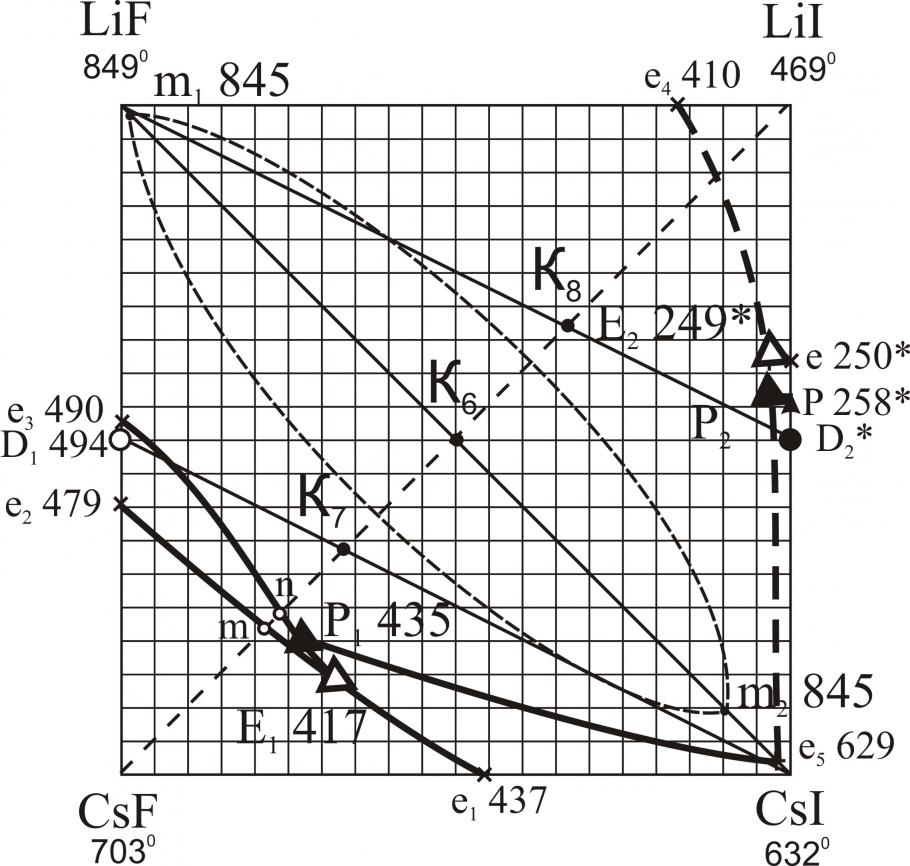
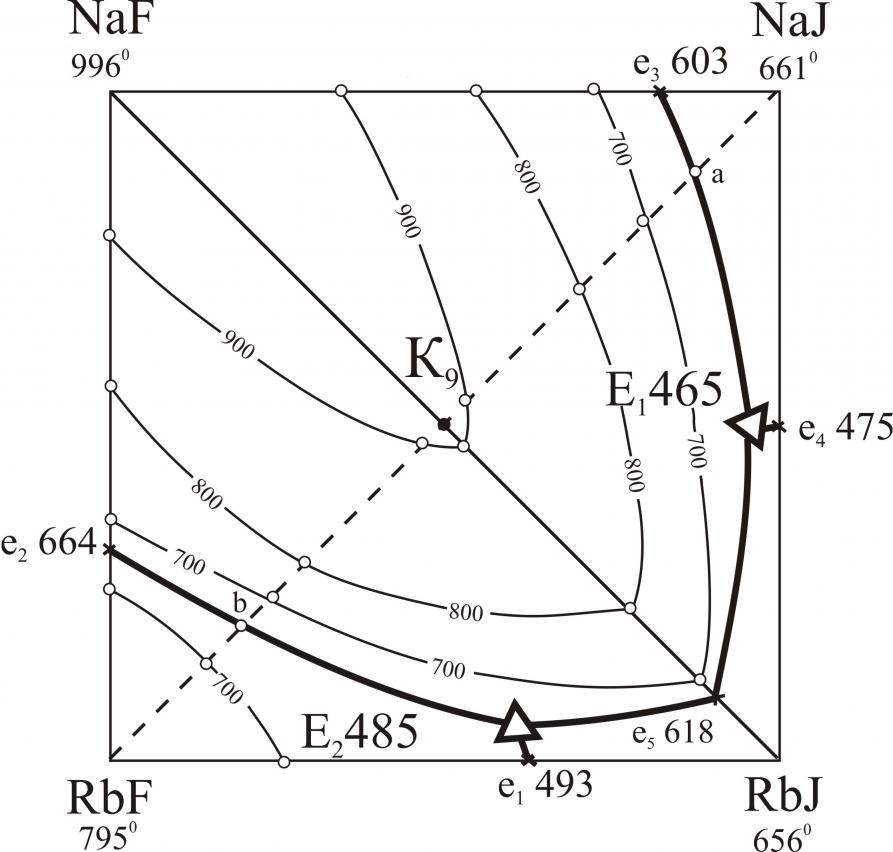
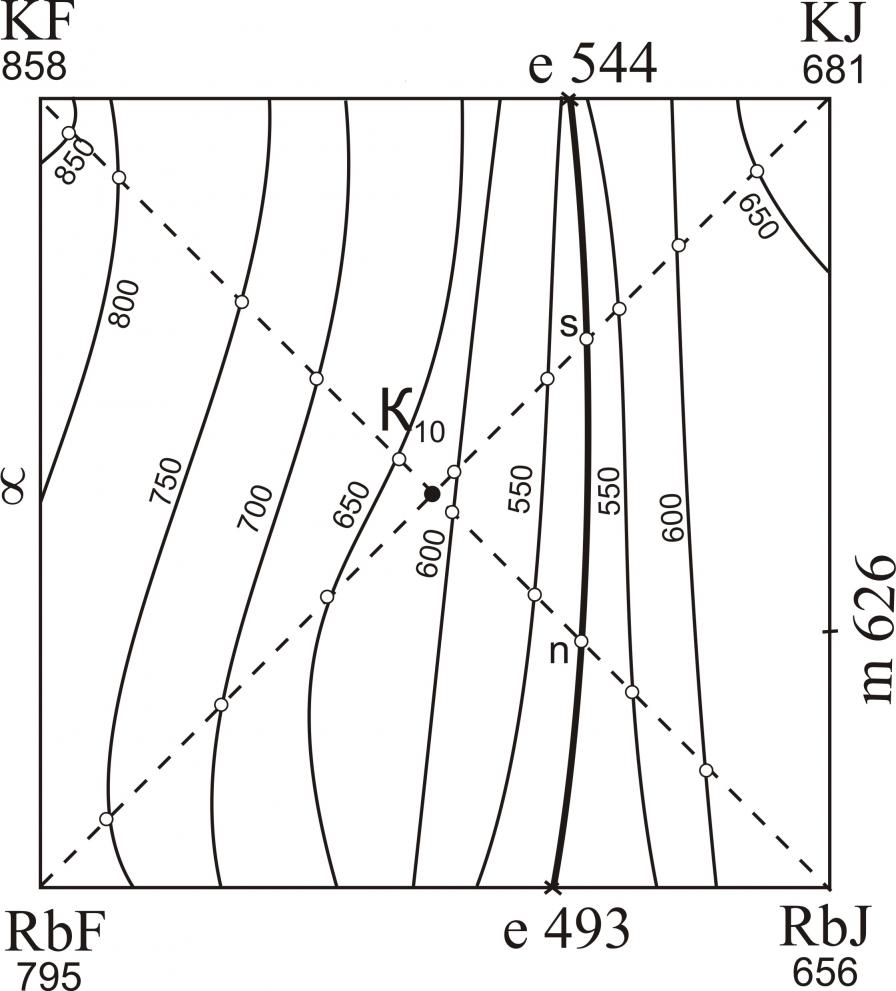
Исследованы трехкомпонентные взаимные системы Li,M||F,I; Na,Rb||F,I; K,Rb||F,I; K,Cs||F,I; Rb,Cs||F,I. В системах Li,M||F,I (M – Na, K, Rb, Cs) исследованы треугольники, не содержащие иодид лития. В треугольниках LiF-NaF-NaI, LiF-KF-KI, LiF-RbF-RbI, LiF-CsF-CsI определены характеристики тройных точек нонвариантных равновесий (рис. 10). В системах Li,K||F,I, Li,Rb||F,I, Li,Cs||F,I установлены области расслаивания компонентов в жидкой фазе (на рис. 10 нанесены пунктиром). Системы Na,Rb||F,I (рис. 11), K,Cs||F,I (рис. 13) характеризуются наличием тройных эвтектик в каждом стабильном треугольнике. Системы K,Rb||F,I (рис. 12), Rb,Cs||F,I (рис. 14) – наличием бинарных НРТР.
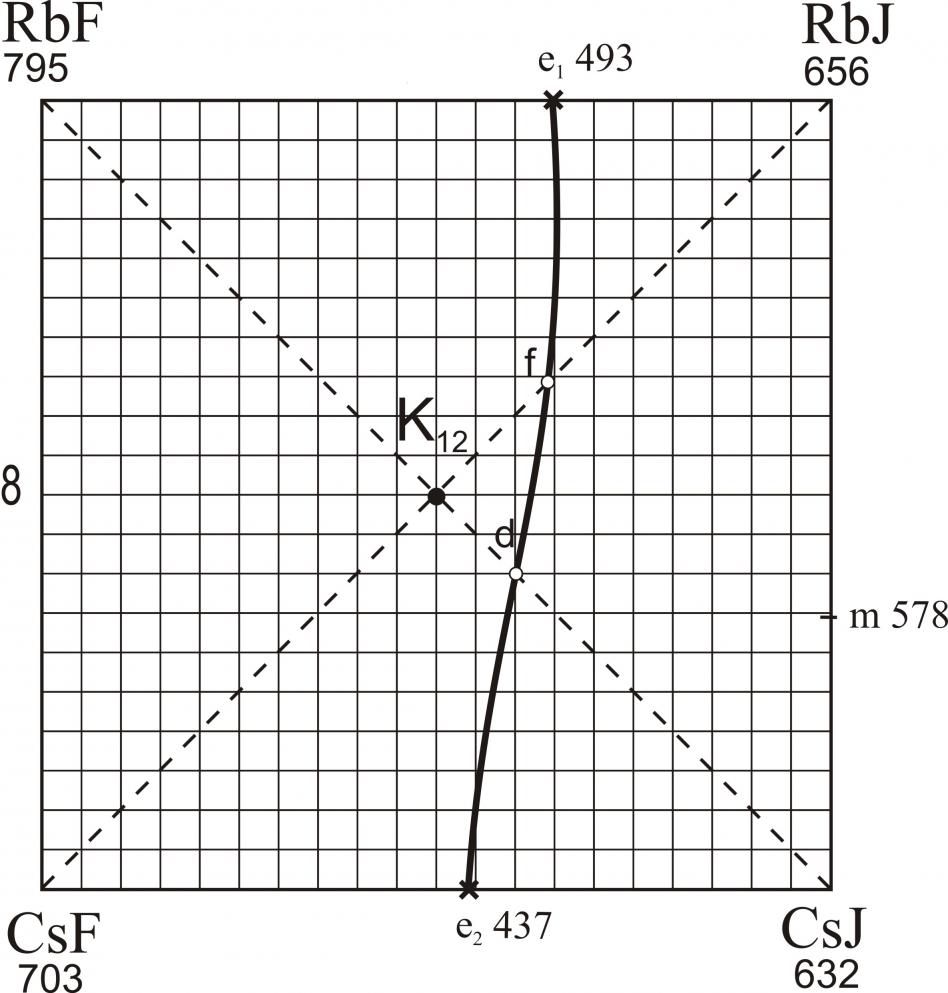
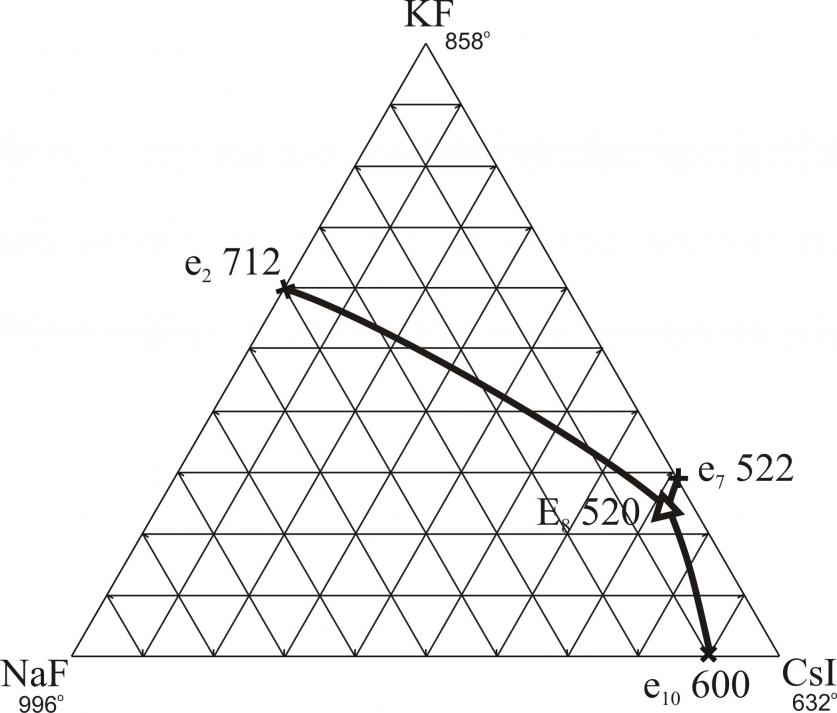
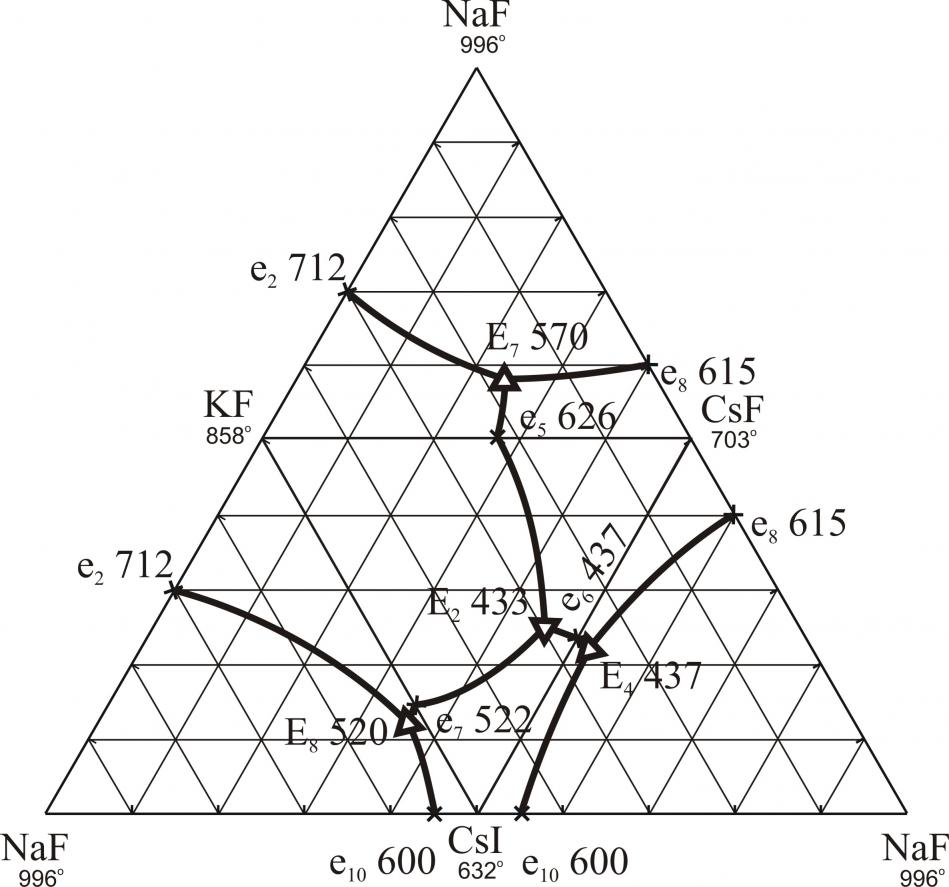
На рис. 15 представлена развертка четырехкомпонентной взаимной системы Na,K,Cs||F,I. В ней экспериментально исследованы стабильные треугольники NaF-KF-CsI и NaF-KI-CsI (рис. 16 и 17) и стабильные тетраэдры NaF-KF-CsF-CsI и NaF-KF-KI-CsI, для которых найдены характеристики точек нонвариантного равновесия. На рис. 18, 19 представлены развертки стабильных тетраэдров NaF-KF-CsF-CsI и NaF-KF-KI-CsI. В четырехкомпонентной взаимной системе Li,K,Cs||F,I экспериментально исследованы стабильный треугольник LiF-KF-CsI (рис. 20) и стабильный тетраэдр LiF-KF-CsF-CsI (рис. 21).
В четырехкомпонентных взаимных системах Na,K,Rb||F,I; Na,Rb,Cs||F,I предполагалось наличие полей непрерывных твердых растворов во всем объеме, поэтому исследование проведено конверсионным методом: исследованы линии конверсии, изучение которых позволило выявить отсутствие четверных эвтектических точек в системах.
Характеристики точек нонвариантных равновесий экспериментально исследованных систем приведены в таблице 5.
В 4 главе представлено обсуждение результатов работы. Проведено сравнение результатов прогнозирования поверхности ликвидусов неисследованных систем с результатами экспериментальных исследований, сделан вывод о хорошей сходимости прогноза и эксперимента.
Анализируя данные, полученные в результате экспериментальных исследований тройных взаимных систем Li,M||F,I (M = Na, K, Rb, Cs), можно сделать ряд выводов, касающихся сходства в фазовом поведении квазибинарных систем, являющихся стабильными диагоналями тройных взаимных систем.
Из экспериментальных данных по стабильным диагональным сечениям LiF-MI установлено, что область расслаивания присутствует на всех диагоналях кроме LF-NaI. В системах LiF-KI, LiF-RbI, LiF-CsI с заменой KI на RbI, а затем на CsI температуры плавления квазибинарных эвтектик понижаются: в системе с иодидом калия е1 675 oC, в системе с иодидом рубидия е2 642 oC, в системе с иодидом цезия е3 629 oC. Это понижение связано с понижением температуры плавления второго компонента. Каждая эвтектика содержит 99 % фторида лития и 1 % KI, RbI и CsI соответственно. С переходом от KI к CsI температура монотектического равновесия (m: Ж1+Ж2Ж+LiF) повышается: m 832 oC, m 841 oC, m 845 oC в квазибинарных системах соответственно. Также наблюдается увеличение области расслаивания на стабильных диагоналях: в системе LiF-KI она занимает от 7,5 % до 85 % KI; в системе LiF-RbI – от 3 % до 90 % RbI; в системе LiF-CsI – от 1-90 % CsI. Из этого наблюдения можно сделать вывод, что увеличение области расслаивания связано с увеличением разницы в размерах ионных радиусов ЩМ, т.е. RK+ < RRb+ < RCs+.
 |  |
| Рис. 11. Проекция поверхности кристаллизации системы Na,Rb||F,I на квадрат состава | Рис. 12. Проекция поверхности кристаллизации системы K,Rb||F,I на квадрат состава |
 |  |
| Рис. 13. Проекция поверхности кристаллизации системы K,Cs||F,I на квадрат состава | Рис. 14. Проекция поверхности кристаллизации системы Rb,Cs||F,I на квадрат состава |

Рис. 15. Развертка четырехкомпонентной взаимной системы Na,K,Cs||F,I
 |  | ||
| Рис. 16. Стабильный треугольник NaF-KF-CsI системы Na,K,Cs||F,I | Рис. 17. Стабильный треугольник NaF-KI-CsI системы Na,K,Cs||F,I | ||
 |  | ||
| Рис. 18. Развертка стабильного тетраэдра NaF-KF-CsF-CsI системы Na,K,Cs||F,I | Рис. 19. Развертка стабильного тетраэдра NaF-KF-KI-CsI системы Na,K,Cs||F,I | ||
 |  |
| Рис. 20. Стабильный треугольник LiF-KF-CsI системы Li,K,Cs||F,I | Рис. 21. Развертка стабильного тетраэдра LiF-KF-CsF-CsI системы Li,K,Cs||F,I |
Таблица 5
Характеристики точек нонвариантного равновесия в исследованных системах
| Система | Характер точки | Содержание компонентов, мол. % | Температура плавления, оC | |||
| 1-ый | 2-ой | 3-ий | 4-ий | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Двухкомпонентные системы | ||||||
| RbF-RbI | e | 35 | 65 | – | – | 493 |
| RbCl-RbI | e | 42 | 58 | – | – | 567 |
Продолжение таблицы 5
| Система | Характер точки | Содержание компонентов, мол. % | Температура плавления, оC | |||
| 1-ый | 2-ой | 3-ий | 4-ий | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Трехкомпонентные системы | ||||||
| RbF-RbCl-RbBr | НРТР | – | – | – | – | – |
| RbF-RbCl-RbI | E | 35,0 | 25,5 | 39,5 | – | 441 |
| NaF-KF-CsF | E | 22,0 | 30,8 | 47,2 | – | 570 |
| Трехкомпонентные взаимные системы | ||||||
| Li,Na||F,I | E | 5 | – | 20 | 75 | 583 |
| e | 7,5 | – | – | 92,5 | 635 | |
| Li,K||F,I | E | 47,5 | – | 50,0 | 2,5 | 482 |
| e | 1 | – | – | 99 | 675 | |
| область расслаивания 7,5-85 % KI | 832 | |||||
| Li,Rb||F,I | E | 45 | – | 52 | 3 | 461 |
| e | 1 | – | – | 99 | 642 | |
| область расслаивания 3-90 % RbI | 841 | |||||
| Li,Cs||F,I | E | 16 | – | 52 | 32 | 417 |
| P | 21,5 | – | 50,5 | 28 | 435 | |
| e | 1 | – | – | 99 | 629 | |
| Область расслаивания 1-90 % CsI | 845 | |||||
| Na,Rb||F,I | E1 | 4 | 46 | – | 50 | 465 |
| E2 | 5 | – | 35 | 60 | 485 | |
| e | 9 | – | – | 91 | 618 | |
| K,Rb||F,I | п.т. | 33 | – | – | 67 | 517 |
| п.т. | – | 67 | 33 | – | 531 | |
| K,Cs||F,I | Е1 | 9 | – | 41 | 50 | 433 |
| Е2 | 21,0 | 30,5 | – | 48,5 | 490 | |
| е | 29 | – | – | 71 | 522 | |
| Rb,Cs||F,I | п.т. | 40 | – | – | 60 | 458 |
| п.т. | – | 65 | 35 | – | 457 | |
| Четырехкомпонентные взаимные системы | ||||||
| Li,K,Cs||F,I | ||||||
| LiF-KF-CsI | E | 49,5 | 49,5 | 1,0 | – | 482 |
| LiF-KF-CsF-CsI | E | 44,7 | 29,0 | 25,6 | 0,7 | 400 |
| Na,K,Rb||F,I | ||||||
| НРТР | – | – | – | – | – | |
| Na,K,Cs||F,I | ||||||
| NaF-KF-CsI | E | 4 | 24 | 72 | – | 520 |
| NaF-KI-CsI | E | 4 | 30 | 66 | – | 544 |
| NaF-KF-CsF-CsI | E | 4,0 | 8,6 | 39,4 | 48,0 | 432 |
| NaF-KF-KI-CsI | E | 2 | 18 | 32 | 48 | 488 |
| Na,Rb,Cs||F,I | ||||||
| НРТР | – | – | – | – | – | |

Рис. 22. Зависимость температуры монотектики на стабильных диагоналях LiF-MГ (M = K, Rb, Cs; Г = Cl, Br, I) от относительного ионного радиуса ЩМ

Рис. 23. Зависимость содержания LiF в монотектике m1 на стабильных диагоналях LiF-MГ (M = K, Rb, Cs; Г = Br, I) от относительного ионного радиуса ЩМ
На наличие области расслаивания, а также на изменения ее границ в совокупности оказывает влияние разница ионных радиусов и катионов и анионов. Имеющиеся экспериментальные данные по тройным взаимным системам из фторидов и хлоридов ЩМ и из фторидов и бромидов ЩМ позволили рассмотреть весь массив систем Li,M||F,Г (M = Na, K, Rb, Cs; Г = Cl, Br, I). В ряду систем Li,М||F,Br и Li,М||F,I расслаивание наблюдается во всех системах, кроме систем с участием галогенидов натрия. В ряду систем Li,М||F,Cl расслаивание обнаружено только в системе, содержащей галогениды цезия.
С использованием экспериментальных данных, а также данных литературы, построен график зависимости температуры монотектического равновесия на стабильных диагоналях LiF-MГ (M = K, Rb, Cs; Г = Cl, Br, I) от относительного ионного радиуса ЩМ (рис. 22). Для анализа взяты системы, в которых присутствуют области расслаивания. Из графика видно (рис. 22), что температура монотектического равновесия в системах из фторидов и иодидов ЩМ выше, чем в системах, содержащих фториды и бромиды ЩМ. Температура монотектического равновесия на стабильной диагонали LiF-CsCl составляет 824 оС. Повышение температуры монотектического равновесия также наблюдается при смене второго катиона: K+ Rb+ Cs+, причем это характерно и для фторид-бромидных, и для фторид-иодидных систем (рис. 22).
Из графика на рис. 23 видно увеличение содержания LiF в монотектике m1 при смене второго катиона: K+ Rb+ Cs+. На графике линии для фторид-бромидных и фторид-иодидных систем практически сливаются.
Анализ стабильных диагоналей систем с наличием областей расслаивания показал, что они сходны, как по строению ликвидуса, так и по своим свойствам.
ВЫВОДЫ
- Выявлено, что влияние на тип диаграммы плавкости оказывают не только величины относительных ионных радиусов галогенов, но и абсолютные значения ионных радиусов щелочных металлов: чем больше величина ионного радиуса ЩМ и разница между ионными радиусами галогенов, тем более высока вероятность образования в системе эвтектики. Химические соединения MГ1,Г2 в двух- и трехкомпонентных галогенидных системах с общим катионом (ЩМ) не образуются.
- Проведен расчет характеристик тройных эвтектических точек в симплексах, содержащих иодид лития, а также во всех экспериментально исследованных тройных взаимных системах. Средняя относительная погрешность определения температуры плавления эвтектик составила 2,5 %, а определения составов эвтектик – 7 %, что говорит о возможности применения такого подхода для прогнозирования характеристик точек нонвариантного равновесия.
- Экспериментально установлено наличие областей расслаивания в трехкомпонентных взаимных системах Li,K||F,I, Li,Rb||F,I, Li,Cs||F,I. Сделан вывод о том, что с увеличением разницы в размерах ионных радиусов ЩМ, т.е. RK+ < RRb+ < RCs+ область расслаивания увеличивается, температура монотектик повышается.
- Проведено разбиение четырехкомпонентных взаимных систем Li,K,Cs||F,I; Na,K,Rb||F,I; Na,K,Cs||F,I; Na,Rb,Cs||F,I с применением теории графов. Древо фаз системы Na,K,Cs||F,I линейное, состоит из трех стабильных тетраэдров, связанных между собой двумя секущими треугольниками. Древо фаз системы Li,K,Cs||F,I также линейное, состоит из пяти стабильных тетраэдров, связанных между собой четырьмя секущими треугольниками. Древа фаз систем Na,K,Rb||F,I и Na,Rb,Cs||F,I сходны по строению и состоят из двух симплексов.
- Экспериментально получены данные о фазовых равновесиях в 2 двухкомпонентных, 3 трехкомпонентных, 8 трехкомпонентных взаимных, 4 четырехкомпонентных взаимных системах. Из них являются эвтектическими: двухкомпонентные RbF-RbI, RbCl-RbI; трехкомпонентные RbF-RbCl-RbI, NaF-KF-CsF; трехкомпонентные взаимные Li,Na||F,I, Li,K||F,I, Li,Rb||F,I, Li,Cs||F,I, Na,Rb||F,I, K,Cs||F,I; стабильные треугольники LiF-KF-CsI, NaF-KF-CsI, NaF-KI-CsI; стабильные тетраэдры LiF-KF-CsF-CsI, NaF-KF-CsF-CsI, NaF-KF-KI-CsI. Системы с образованием НРТР: трехкомпонентная RbF-RbCl-RbBr; трехкомпонентные взаимные K,Rb||F,I, Rb,Cs||F,I; четырехкомпонентные взаимные Na,K,Rb||F,I, Na,Rb,Cs||F,I. Выявленные низкоплавкие эвтектические составы в системах Li,Cs||F,I (417°C), K,Cs||F,I (433°C) и NaF-KF-CsF-CsI (432°C) могут быть использованы в качестве расплавляемых электролитов в средне- и высокотемпературных химических источниках тока.
Основное содержание диссертации изложено в работах:
- Е.М. Дворянова, И.М. Кондратюк, И.К. Гаркушин. Прогнозирование характера физико-химического взаимодействия в двухкомпонентных системах с общим катионом – щелочным металлом // Материалы международной научной конференции «Молодежь и химия» / Красноярский гос. ун-т. – Красноярск, 2004. – С. 308-310.
- И.М. Кондратюк, Е.М. Дворянова, И.К. Гаркушин. Прогнозирование характера физико-химического взаимодействия в двух- и трехкомпонентных системах с общим катионом – щелочным металлом // Известия СНЦ РАН. «Химия и химическая технология». – 2004. – С. 12-17.
- Е.М. Дворянова, И.М. Кондратюк, И.К. Гаркушин. Анализ рядов трехкомпонентных галогенидных систем с общим катионом – щелочным металлом // Известия СНЦ РАН. «Химия и химическая технология». – 2004. – С. 158-162.
- Е.М. Дворянова, И.М. Кондратюк, И.К. Гаркушин. Прогнозирование физико-химического взаимодействия в системах из галогенидов щелочных металлов // Материалы VI Международной конференции «Фундаментальные проблемы электрохимической энергетики». – Саратов, 2005. – С. 111-114.
- И.М. Кондратюк, Е.М. Дворянова, И.К. Гаркушин. Взаимодействие фторида рубидия и иодида натрия в трехкомпонентной взаимной системе Na, Rb||F, I // Известия ВУЗов. Химия и хим. технология. – 2005.– Т. 48. – Вып. 10. – С.97-99.
- Е.М. Дворянова, И.М. Кондратюк, И.К. Гаркушин. Прогнозирование физико-химического взаимодействия в трехкомпонентных взаимных системах из галогенидов щелочных металлов // Известия ВУЗов. Химия и хим. технология. 2005. – Т.48. – Вып. 10. – С.94-96.
- Е.М. Дворянова, И.М. Кондратюк, И.К. Гаркушин. Исследование трехкомпонентных взаимных систем Na,Rb||F,I, Na,Rb||Br,I и K,Rb||F,Br // Сборник трудов II Международной научно-практической конференции «Исследование, разработка и применение высоких технологий в промышленности». – Т. 4. – Санкт-Петербург: Изд-во Политехн. ун-та, 2006. – С. 94-95.
- И.М. Кондратюк, И.К. Гаркушин, Г.И. Замалдинова, Е.М. Дворянова, А.И. Гаркушин. Анализ рядов систем Na, Me||Г (Me – K, Rb, Cs, Fr; Г – F, Cl, Br, I) [Текст] // Сборник научных трудов «Химические науки – 2006». – Вып. 3. – Саратов: Изд-во «Научная книга», 2006. – С. 75-78.
- И.М. Кондратюк, Е.М. Дворянова, И.К. Гаркушин. Трехкомпонентная взаимная система Na, Rb||F, I // Сборник научных трудов «Химические науки – 2006». – Вып. 3. – Саратов: Изд-во «Научная книга», 2006. – С. 79-82.
- Е.М. Дворянова, И.М. Кондратюк. Анализ ряда систем Li,M||Г (М – Na, K, Rb, Cs, Fr; Г – F, Cl, Br, I, At) и исследование двухкомпонентной системы Li,Cs//Cl [Текст] // Труды международной научной конференции «Инновационный потенциал естественных наук». – Т.1. «Новые материалы и химические технологии». – Пермь, 2006. – С. 122-124.
- И.К. Гаркушин, И.М. Кондратюк, Е.М. Дворянова, Е.Г. Данилушкина. Анализ, прогнозирование и экспериментальное исследование рядов систем из галогенидов щелочных и щелочноземельных элементов. Екатеринбург: УрО РАН, 2006. – 148 с. – ISBN – 5-7691-1775-3.
- Е.М. Дворянова. Анализ систем ряда M1, M2, M3 || Г (M1, M2 – Li, Na, K, Rb, Cs; M3 – Ca, Sr, Ba, Ra; Г – F, Cl, Br, I, At) // Материалы XIV Международной конференции студентов, аспирантов и молодых ученых по фундаментальным наукам «Ломоносов – 2007». – М.: Химия, 2007. – С. 436.
- Е.М. Дворянова, И.М. Кондратюк, И.К. Гаркушин. Трехкомпонентные системы Rb||F,Cl,Br и Rb||F,Cl,I // XIV Российская конференция «Физическая химия и электрохимия расплавленных электролитов». Тезисы докладов. – Т.1. – Екатеринбург, 2007. – С. 50-51.
- Е.М. Дворянова, И.М. Кондратюк, И.К. Гаркушин. Прогнозирование диаграмм плавкости трехкомпонентных систем из галогенидов щелочных металлов с общим катионом // Тезисы доклада XVIII Менделеевского съезда по общей и прикладной химии: в 5 т. – Т. 2 – М.: Граница, 2007. – С. 212.
Отпечатано с разрешения диссертационного совета Д 212.217.05
ГОУ ВПО «Самарский государственный технический университет»
Протокол № 3 от 1 апреля 2008 г.
Заказ № 181. Объём 1 п.л. Тираж 100 экз.
Форм. лист. 60х84/16. Отпечатано на ризографе.
_________________________________________
ГОУ ВПО Самарский государственный технический университет
Отдел типографии и оперативной полиграфии
443100, г. Самара, ул. Молодогвардейская, 244

