Синтез и модификация 3a,4,5,9b-тетрагидро-3 н -циклопента[ c ]хинолинов
ИНСТИТУТ ТЕХНИЧЕСКОЙ ХИМИИ УрО РАН
На правах рукописи
Крайнова Гульназ Фаизовна
СИНТЕЗ И МОДИФИКАЦИЯ
3a,4,5,9b-ТЕТРАГИДРО-3Н-ЦИКЛОПЕНТА[c]ХИНОЛИНОВ
Специальность 02.00.03. – Органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Пермь - 2010
Работа выполнена в лаборатории химии биологически активных соединений ИТХ УрО РАН.
Научный руководитель: Глушков Владимир Александрович
доктор химических наук
Официальные оппоненты: Гейн Владимир Леонидович
доктор химических наук, профессор
ГОУ ВПО Минздрава РФ «Пермская государственная фармацевтическая
академия»
Машевская Ирина Владимировна
доктор химических наук, доцент
ФГОУ ВПО «Пермская государственная
сельскохозяйственная академия им. Д.Н.Прянишникова»
Ведущая организация: ГОУ ВПО «Пермский государственный
Университет», г. Пермь
Защита диссертации состоится 24 декабря 2010 г. в 13 часов на заседании диссертационного совета Д 004.016.01 в Институте технической химии УрО РАН по адресу: 614013, г. Пермь, ул. Академика Королёва, 3.
С диссертацией можно ознакомиться в библиотеке ИТХ УрО РАН.
Отзывы на автореферат просим направлять по адресу:
614013, г. Пермь, ул. Академика Королёва, 3, ИТХ УрО РАН.
Факс: +7(342) 237-82-62; e-mail: [email protected]
Автореферат разослан 24 ноября 2010 г.
Автореферат размещен на сайте ИТХ УрО РАН http://itch.perm.ru/
23 ноября 2010 г.
Ученый секретарь
диссертационного совета
к.х.н. Горбунов А. А.
ВВЕДЕНИЕ
Актуальность темы.
Кислотно-катализируемая конденсация электронообогащенных олефинов с основаниями Шиффа, открытая Л.С.Поваровым и Б.М.Михайловым в середине двадцатого века, претерпевает в настоящее время второе рождение. Это связано с гибкостью данного метода, позволяющего получать разнообразно замещенные тетрагидрохинолины. Образование в реакции Поварова трех асимметричных центров в одну стадию делает эту реакцию весьма привлекательной для построения гетероциклических асимметрических матриц и «скаффолдов» хинолинового типа.
В последние годы реакция Поварова нашла применение для получения лекарственных препаратов: мартинеллина, селективного агониста эстрогенного рецептора, связанного с G-белком, и ингибитора одной из стадий синтеза холестерина, так называемого, «torcetrapib».
Несмотря на разнообразную биологическую активность производных циклопента[c]хинолина, cравнительно мало работ посвящено функционализации данной гетероциклической системы.
Цель и задачи работы.
Цель: синтез и модификация замещенных 3а,4,5,9b-тетрагидро-3H-циклопента[c]хинолинов.
В соответствии с целью поставлены следующие задачи:
- Разработать удобные методы функционализации гетероциклической системы циклопента[c]хинолина по двойной связи (эпоксидирование, озонолиз), в ароматическом ядре (введение брома и фтора), а также по атомам С(2) и N(1) (ацилирование, получение диалкиламиноацетильных производных);
- Изучить возможность введения бензо[b]фурана и бензо[b]тиофена в реакцию Поварова;
- Осуществить последовательную реакцию Поварова;
- Изучить реакцию конденсации оснований Шиффа с енаминами ряда 3,4-дигидроизохинолина и спиро[нафталин-1,3'-пиррол]-4-она;
- Оценить биологическую активность синтезированных соединений.
Научная новизна.
Получен ряд новых оснований Шиффа из метилового эфира 12-аминодегидроабиетиновой кислоты и 2-, 3-, 4-пиридилкарбальдегидов.
Изучено окисление 3а,4,5,9b-тетрагидро-3H-циклопента[c]хинолинов, получены соответствующие эпоксиды, диолы и продукты озонолиза. Методом рентгеноструктурного анализа подтверждено пространственное строение эпоксида как цис-изомера по атомам С(9b), C(3a), С(4) с анти-расположением оксиранового цикла.
Аминированием замещенных 5-хлорацетил-3а,4,5,9b-тетрагидро-3H-циклопента[c]хинолинов впервые получены 5-диалкиламиноацетил-3а,4,5,9b-тетрагидро-3Н-циклопента[c]хинолины.
Впервые осуществлена реакция Поварова с бензо[b]фураном.
Осуществлена последовательная реакция Поварова с циклопентадиеном и инденом.
Изучена конденсация оснований Шиффа с енаминами ряда 3,4-дигидроизохинолина и 2',5',5'-триметил-4',5'-дигидро-4Н-спиро[нафталин-1,3'-пиррол]-4-она. В последнем случае показана возможность отрыва остатка ароматического амина от продуктов конденсации с образованием 2'-стирил-5',5'-триметил-4',5'-дигидро-4Н-спиро[нафталин-1,3'-пиррол]-4-она, структура которого подтверждена данными рентгеноструктурного анализа.
Практическая значимость.
Разработаны общие способы функционализации гетероциклической системы 3а,4,5,9b-тетрагидро-3Н-циклопента[c]хинолина: реакции эпоксидирования, дигидроксилирования, ацилирования, синтеза N-диалкиламинопроизводных.
Синтезированы циклические аналоги известных местноанестезирующих средств тримекаина и ксикаина.
Разработан препаративный способ синтеза этил (11bR,6aR,6*RS)-2-бром-5,6,6а,11b-тетрагидробензофуро[2,3-c]хинолин-6-карбоксилата с выходом 89%.
Разработан препаративный метод получения 2'-стирил-5',5'-триметил-4',5'-дигидро-4Н-спиро[нафталин-1,3'-пиррол]-4-онов.
Показано, что введение атома фтора в эпоксидированные 3а,4,5,9b-тетрагидро-3Н-циклопента[c]хинолины приводит к появлению биологической активности у 8-фтор- и 7,8-дифтор-1,2-эпокси-5-ацетил-4-фенил-3а,4,5,9b-тетрагидро-3Н-циклопента[c]хинолинов.
Апробация работы.
Полученные результаты диссертационной работы представлялись на российских и международных научных конференциях: III Всероссийская конференция «Химия и технология растительных веществ» (Саратов, 2004 г.); I и II Международные конференции «Техническая химия. От теории к практике» (Пермь, 2008 г., 2010 г.); X, XI, XII Молодежные школы-конференции по органической химии (Уфа, 2007 г.; Екатеринбург, 2008 г.; Суздаль 2009 г.); Всероссийская молодежная конференция-школа «Идеи и наследие А.Е. Фаворского в органической и металлоорганической химии XXI века» (Санкт-Петербург, 2010 г.).
Публикации.
Результаты диссертационной работы опубликованы в 3 статьях, 8 тезисах и материалах докладов на всероссийских и международных конференциях.
Структура и объем диссертации.
Диссертация изложена на 170 страницах, содержит 101 схему, 13 таблиц, 16 рисунков; список литературы - 288 источников.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
- Литературный обзор
- Обсуждение результатов
II.1. Синтез замещенных 1,2,3,4-тетрагидрохинолинов
Исходные основания Шиффа 1а-н,2а-з,3,4а-и были получены путем конденсации замещенных анилинов с альдегидами в абсолютном этаноле, в ряде случаев - в присутствии молекулярных сит 4 (схема 1).
Схема 1
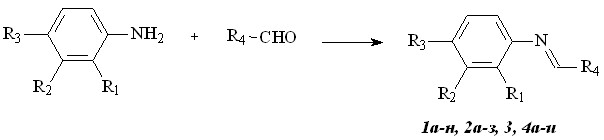
1: (неуказанные R = H) а R4 = Ph (90%); б R4 = 4-BrC6H4 (76%); в R4 = 4-ClC6H4 (97%); г R4 = 4-NO2C6H4 (70%); д R4 = 4-Me2NC6H4 (82%); е R4 = 3-NO2C6H4 (83%); ж R3 = Br, R4 = Ph (64%); з R3 = F, R4 = Ph (95%); и R2 = R3 = F, R4 = Ph (92%); к R2 = R3 = Me, R4 = Ph (94%); л R3 = NO2, R4 = 4-NO2C6H4 (97%); м R3 = NO2, R4 = 4-MeOC6H4 (98%); н R3 = MeC(O), R4 = Ph (65%); 2 (для 2 везде R4 = COOEt) а (41%); б R1 = Me (23%); в R1 = Br (40%); г R3 = Br (88%); д R3 = Me (41%); е R1 = R3 = Me (76%); ж R1 = COOEt (95%); з R3 = Br (88%); 3 R4 = ферроценил;
4: а R4 = PhCO (80%); б R3 = F, R4 =4-MeC6H4CO (67%); в R3 = F, R4 = 4-ClC6H4CO (90%); г R3 = F, R4 = 4-MeOC6H4CO (86%); д R2 = R3 =F, R4 = 4-ClC6H4CO (98%); е R3 = F, R4 = 4-BrC6H4CO (92%); ж R2 = R3 = F, R4 = 4-MeOC6H4CO (95%); з R1 = Br, R4 = 4-ClC6H4CO (90%); и R1 = R3 = Me, R4 = PhCO (83%).
С целью расширения ряда оснований Шиффа с электроноакцепторным заместителем у атома углерода (2а-з) в качестве альдегида использовали этилглиоксилат.
Взаимодействие анилинов с арилглиоксалями приводит к соответствующим основаниям Шиффа 4а-и.
Взаимодействие метилового эфира 12-аминодигидроабиетиновой кислоты с альдегидами протекает с образованием оснований Шиффа 5а-г (схема 2).
Схема 2

Характерным сигналом в ЯМР 1Н спектрах соединений 1-5 является синглет протона имино-группы HC=N в области 7.8-8.4 м.д.. Их ИК-спектры содержат полосы группы C=N (1583-1615 cм-1), полосу сложного эфира О-С=О (1728-1754 cм-1) у соединений 2а-з и полосу карбонильной группы 1668-1686 cм-1 у соединений 4а-и.
Азометины 1а-в,е-и,л,м,н были введены в реакцию с циклопентадиеном в присутствии 15 мол. % эфирата трехфтористого бора в среде абсолютного ацетонитрила (схема 3, табл.1).
Схема 3

Таблица 1. Аддукты Поварова из циклопентадиена (6а-л)
| Соединение | R1 | R2 | R3 | R4 | Выход, % |
| 6а | H | H | H | H | 79 |
| 6б | H | H | H | Br | 56 |
| 6в | H | H | H | Cl | 76 |
| 6г | H | H | NO2 | H | 71 |
| 6д | COOEt | H | H | H | 10 |
| 6е | Br | H | H | H | 50 |
| 6ж | F | H | H | H | 30 |
| 6з | CH3CO | H | H | H | 45 |
| 6и | F | F | H | H | 50 |
| 6к | CH3O | H | H | NO2 | 66 |
| 6л | NO2 | H | H | CH3O | 50 |
Аналогично азометинам 1а-м в реакцию Поварова были введены азометины 2в,г,е-з, полученные при взаимодействии анилинов с этилглиоксилатом, а также азометины из арилглиоксалей 4в-ж (схема 4, табл. 2).
Схема 4
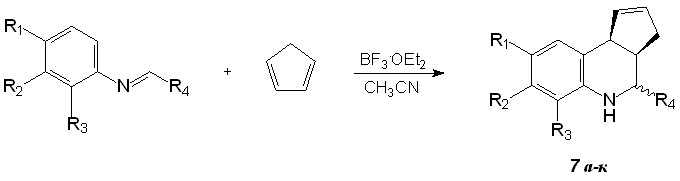
Таблица 2. Аддукты из этилглиоксилата и арилглиоксалей (7а-к)
| Соединение | R1 | R2 | R3 | R4 | Выход,% |
| 7а | COOEt | H | H | COOEt | 55 |
| 7б | CH3 | H | CH3 | COOEt | 37 |
| 7в | H | H | Br | COOEt | 40 |
| 7г | F | F | H | COOEt | 53 |
| 7д | Br | H | H | COOEt | 73 |
| 7е | F | H | H | CO-C6H4-Br-п | 55 |
| 7ж | F | H | H | CO-C6H4-Cl-п | 80 |
| 7з | F | F | H | CO-C6H4-Cl-п | 54 |
| 7и | F | F | H | CO-C6H4-OCH3-п | 68 |
| 7к | F | H | H | CO-C6H4-OCH3-п | 82 |
Строение соединений 6а-л и 7а-к было подтверждено данными спектров ЯМР 1Н, масс-спектрами и данными элементного анализа. ИК-спектры соединений 6а-л и 7а-к имеют характеристические полосы поглощения NH группы в области 3331-3385 см-1; кроме того, у соединений 7а-д в ИК-спектрах имеются полосы поглощения сложноэфирных карбонильных групп О-С=О при 1710-1750 см-1, а у соединений 7е-к – кетонных групп С=О 1664-1677 см-1.
В ЯМР 1Н спектре аддукта 6а присутствуют характерные мультиплеты (ддд) диастереотопных протонов С(3)Накс. и С(3)Нэкв. при 1.74 и 2.58 м.д. соответственно, мультиплет (ддд) протона С(3а)Н 2.97 м.д., сигнал протона С(9b)Н в виде дублета 4.05 м.д. (J = 8.1 Гц) и С(4)Н также в виде дублета 4.58 м.д (J = 3.3 Гц); мультиплеты протонов С(1)Н и С(2)Н расположены соответственно при 5.58 и 5.78 м.д.. Характер спин-спинового взаимодействия характерен для эндо-цис- формы (экзо-изомеры образуются в минимальном количестве; на схемах показаны преобладающие эндо-диастереомеры). Так, протон С(3а)Н расщепляется на протоне С(3)Накс с J3,3a = 9 Гц; на протоне С(4)Н с J3а,4 = 3.3 Гц; а протон С(3)Нэкв расщепляется на геминальном протоне С(3)Накс с J3а,3э = 16.5 Гц. КССВ J3а,4 = 3.3 Гц указывает на цис-форму, согласно уравнению Карплуса. Вероятно, для транс-формы КССВ J3а,4 близка к нулю (диэдральный угол около 90°), поэтому эта форма не проявляется в ЯМР 1Н спектре, хотя нулевое удельное вращение говорит о том, что образуется смесь диастереомеров по атому С(4).
Из анализа совокупных данных поляриметрии, рентгеноструктурного анализа (с привлечением литературных примеров) и ЯМР 1Н спектров можно сделать вывод о том, что в результате реакции Поварова образуется преимущественно смесь эндо-цис- и эндо-транс- изомеров соединений 6а-л и 7а-к в равных количествах.
Далее было изучено взаимодействие азометина 2г с дигидрофураном, бензо[b]тиофеном, бензо[b]фураном и азометина 4а с инденом (схема 5). Реакцию проводили в присутствии 15 мол. % эфирата трехфтористого бора в среде абсолютного ацетонитрила.
Реакция Поварова с бензо[b]тиофеном (тионафтеном) в данных условиях не идет.
Схема 5
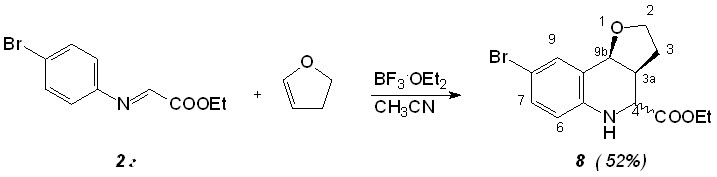

 Как и в случае циклопентадиена, взаимодействие оснований Шиффа с 2,3-дигидрофураном протекает с преимущественным образованием эндо-изомера этил (3aS,9bS)-8-бром-2,3,3а,4,5,9b-гексагидрофуро[3,2-c]хинолин-4-карбоксилата 8, как показано на схеме 5. ИК-спектр аддукта 8 в вазелиновом масле содержит широкую полосу NH группы при 3430 см-1 и сложноэфирную карбонильную группу при 1727 см-1. В ЯМР 1Н спектре аддукта 8 присутствуют мультиплет (ддд) протона С(3а)Н 2.35 м.д., характерные мультиплеты диастереотопных протонов С(3)Накс. и С(3)Нэкв. при 2.60 и 2.71 м.д. соответственно, сигнал протона С(4)Н в виде дублета 3.67 м.д. (J = 11.7 Гц) и С(9b)Н также в виде дублета 4.50 м.д (J = 4.5 Гц).
Как и в случае циклопентадиена, взаимодействие оснований Шиффа с 2,3-дигидрофураном протекает с преимущественным образованием эндо-изомера этил (3aS,9bS)-8-бром-2,3,3а,4,5,9b-гексагидрофуро[3,2-c]хинолин-4-карбоксилата 8, как показано на схеме 5. ИК-спектр аддукта 8 в вазелиновом масле содержит широкую полосу NH группы при 3430 см-1 и сложноэфирную карбонильную группу при 1727 см-1. В ЯМР 1Н спектре аддукта 8 присутствуют мультиплет (ддд) протона С(3а)Н 2.35 м.д., характерные мультиплеты диастереотопных протонов С(3)Накс. и С(3)Нэкв. при 2.60 и 2.71 м.д. соответственно, сигнал протона С(4)Н в виде дублета 3.67 м.д. (J = 11.7 Гц) и С(9b)Н также в виде дублета 4.50 м.д (J = 4.5 Гц).
Взаимодействие азометина 4а с инденом (схема 5) протекает с образованием аддукта 9, строение которого доказывается данными ЯМР 1Н спектров. Региоселективность присоединения индена обусловлена первоначальной атакой на С(2) атом, поскольку при этом образуется более стабильный бензильный карбкатион.
Бензо[b]фуран вступает в реакции электрофильного присоединения по положению С(2) и этим отличается от 2,3-дигидрофурана, который вступает в реакцию Поварова с первоначальной электрофильной атакой по С(3). В ИК-спектре соединения 10 имеются полосы NH (3375 см-1) и СООEt группы (1715 см-1). В ЯМР 1Н спектре аддукта 10 присутствуют дублет дублетов протона С(6а)Н 5.62 (J = 9.6 Гц, J = 2.4 Гц), дублет протона С(6)Накс. 3.98 м.д. (J = 2.4 Гц) и дублет протона НС(12b). при 4.65 м.д. (J = 9.6 Гц), что соответствует предполагаемой структуре.
Аддукт реакции Поварова с циклопентадиеном из ферроценсодержащего основания Шиффа 3 оказался неустойчивым; аддукты из пиридилзамещенных анилов 5а-в в данных условиях не образуются.
II.2. Реакционная способность 3а,4,5,9b-тетрагидро-3H-циклопента[c]хинолинов
II.2.1. Окисление N-ацильных производных 4-R-3a,4,5,9b-тетрагидро-3H-циклопента[c]хинолинов
В последние годы возрос интерес к химии и фармакологии эпоксидов, получаемых синтетическим путем. Так, например, был запатентован 4-фенил-8-трифторметил-4-R-3a,4,5,9b-тетрагидро-1,2-эпокси-3H-циклопента[c]хинолин, применяемый в терапии ангиогенеза, атеросклероза, артрита, воспалительных заболеваний, а также для лечения и профилактики онкологических заболеваний. Представляло интерес выяснить, как влияет на биологическую активность эпоксидов введение в молекулу атомов фтора.
Для проведения окислительных превращений защищали атом азота ацилированием исходных аддуктов 6а,ж,и действием ацетангидрида или трифторацетангидрида в толуоле при катализе 4-диметиламинопиридином (схема 6). Ацильные производные 11а-г представлены в табл. 3.
Схема 6
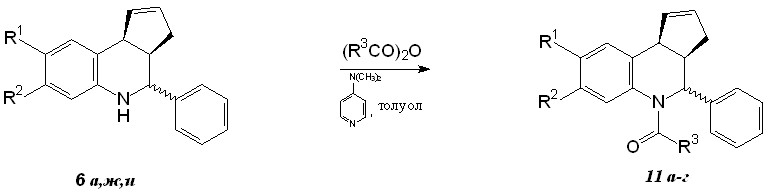
Таблица 3. Ацильные производные 11а-г
| Соединение | R1 | R2 | R3 | Выход, % |
| 11а | H | H | CH3 | 82 |
| 11б | H | H | CF3 | 82 |
| 11в | F | H | CF3 | 85 |
| 11г | F | F | CF3 | 78 |
| 11д | Br | Н | СН3 | 60 |
Последующие превращения образующихся ацилированных аддуктов 11а-г приводят к образованию эпоксидов 12 и диолов 13 ацетильных производных 4-R-3a,4,5,9b-тетрагидро-3H-циклопента[c]хинолинов (схема 7, табл. 4).
Схема 7
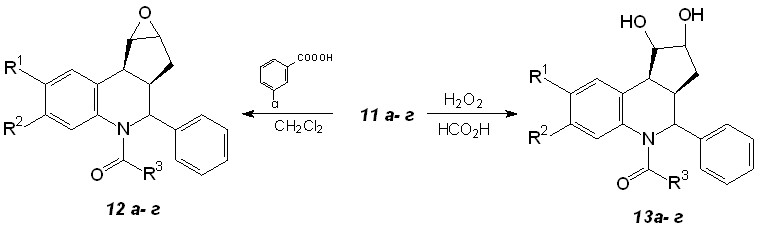
Таблица 4. Эпоксиды 12 и диолы 13
| Соединение | R1 | R2 | R3 | Выход, % | |
| 12 | 13 | ||||
| а | H | H | CH3 | 80 | 10 |
| б | H | H | CF3 | 76 | 11 |
| в | F | H | CF3 | 78 | 20 |
| г | F | F | CF3 | 50 | 22 |
Эпоксиды 12a-г получены взаимодейстсием соответствующих ацетильных производных с м-хлорнадбензойной кислотой. Перекристаллизацией из смеси гексан-этилацетат был выращен кристалл

Рисунок 1. Молекулярная структура эпоксида 12а в кристалле. Показаны тепловые эллипсоиды 50%-ной вероятности.
соединения 12а, рентгеноструктурное исследование которого позволило установить абсолютную конфигурацию эпоксида (рис.1). Как видно из рисунка, тетрагидрохинолиновый цикл имеет форму искаженной ванны, наблюдается цис-ориентация циклопентанового цикла и фенильной группы, а сам эпоксидный цикл ориентирован в противоположную сторону.
Диолы 13a-г получены эпоксидированием соответствующих ацетильных производных пероксидом водорода в муравьиной кислоте и раскрытием оксиранового кольца путем нуклеофильного замещения с последующим гидролизом частично образовавшегося эфира муравьиной кислоты. Структура полученных диолов подтверждена наличием в ИК-спектрах широкой полосы поглощения в области 3200-3500 см-1.
II.2.1.1. Озонолиз
В литературе встречается много данных о повышенном интересе к химии и фармакологии синтетических пероксидов. С целью синтеза озонидов азотсодержащих гетероциклических соединений исследован озонолиз ацетильных производных 4-R-3a,4,5,9b-тетрагидро-3H-циклопента[c]хинолинов 11а,б.[1]
Озонолизом соединения 11а в дихлорметане при -10 С получен озонид 15 (схема 8). О трансформации двойной связи алкена 11а в 1,2,4-триоксолановый цикл свидетельствует появление в спектре ЯМР С13 соединения 14 сигналов в характерной для озонидов области 99.37 (С(1)) и 99.45 (С(4)) м.д. вместо сигналов олефиновых протонов при 131.29 (С(1)) и 132.00 (С(2)) м.д. в спектре исходного соединения.
Схема 8

Структура соединения 14 была установлена благодаря результатам рентгеноструктурного исследования кристаллов озонида (рис. 2). Из данных РСА следует, что фенильная группа при атоме С(6) занимает псевдоаксиальное положение в тетрагидропиридиновом цикле, тогда как N-ацетильная группа является экваториальной, а эпоксидный атом О озонидного цикла экзо-ориентирован относительно остова молекулы. Значение КССВ вицинальных протонов при атомах С(5а) и С(11b) (JH(11b),H(5a) = 10 Гц) свидетельствует о взаимном цис-расположении указанных атомов и цис-сочленении тетрагидрохинолинового и диоксепанового циклов.

Рисунок 2. Молекулярная структура озонида 14 в кристалле. Показаны тепловые эллипсоиды 50%-ной вероятности.
Озониды 15а,б были получены при аналогичных условиях из трифторацетильного производного 11б согласно схеме 8. В спектрах ЯМР 1Н и С13 продукта озонирования N-трифторацетилпроизводного 11б наблюдается двойной набор сигналов. Это свидетельствует об образовании в данном случае смеси двух конформационных изомеров (озонидов 15а и 15б) в соотношении 70:30.
II.2.2. Синтез замещенных 5-диалкиламиноацетил-3a,4,5,9b-тетрагидро-3H-циклопента[c]хинолинов
В целях подхода к получению потенциально физиологически активных соединений произведено ацилирование хинолинов 6а и 7а,б хлорацетилхлоридом в толуоле при комнатной температуре в присутствии 15 мол. % 4-диметиламинопиридина в качестве катализатора (схема 9, табл. 5).
Схема 9

Таблица 5. Хлорацетильные производные 16а-в
| Соединение | R1 | R2 | R3 | Выход, % |
| 16а | H | H | Ph | 81 |
| 16б | COOEt | H | COOEt | 80 |
| 16в | CH3 | CH3 | COOEt | 40 |
Хлорацетильные производные 16а-в ввели в реакцию с аминами (схема 10, табл. 6). Показано, что аминирование идет как с первичными, так и со вторичными алифатическими аминами при нагревании в толуоле либо без растворителя. Получен ряд N-диалкиламинопроизводных 3а,4,5,9б-тетрагидро-3Н-циклопента[c]хинолина 17а-у. Данные вещества формально можно рассматривать как циклические аналоги известных местноанестезирующих средств тримекаина и ксикаина.
Схема 10
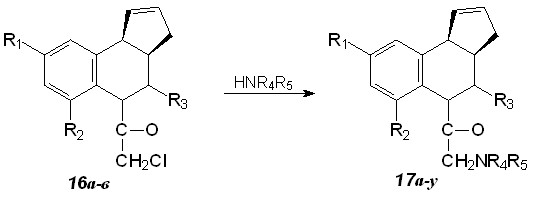
Интересно отметить, что в случае соединений 20е-у сложноэфирные группы остаются инертными в условиях реакции (образования соответствующих амидов не наблюдается).
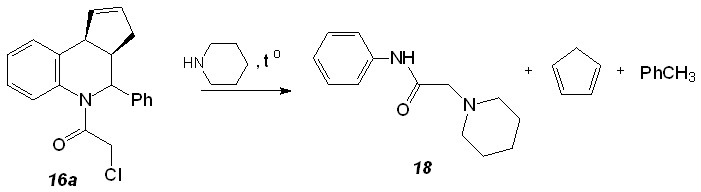
В ряде случаев замещенные тетрагидрохинолины претерпевают ретро-диеновый распад с образованием продукта 18 (схема 11). Следует отметить, что подобное поведение аддуктов реакции Поварова наблюдается впервые.
Таблица 6. Диалкиламиноацетильные произволные 17а-у
| Соединение | R1 | R2 | R3 | R4R5 | Выход,% |
| 17а | H | H | Ph | NR4R5=морфолил | 74 |
| 17б | H | H | Ph | NR4R5=N-метилпиперазино | 40 |
| 17в | H | H | Ph | NR4R5=пирролидил | 10 |
| 17г | H | H | Ph | R4=H, R5=t-Bu | 20 |
| 17д | H | H | Ph | R4=H, R5=2,4-ксилидил | 10 |
| 17е | COOEt | H | COOEt | NR4R5= морфолил | 50 |
| 17ж | COOEt | H | COOEt | NR4R5= N-метилпиперазино | 58 |
| 17з | COOEt | H | COOEt | NR4R5= N-фенилпиперазино | 70 |
| 17и | COOEt | H | COOEt | NR4R5=пиперидил | 63 |
| 17к | COOEt | H | COOEt | NR4R5= пирролидил | 50 |
| 17л | COOEt | H | COOEt | R4=H, R5=t-Bu | 47 |
| 17м | COOEt | H | COOEt | R4=H, R5=i-Pr | 45 |
| 17н | CH3 | CH3 | COOEt | NR4R5= морфолил | 10 |
| 17о | CH3 | CH3 | COOEt | NR4R5= N-метилпиперазино | 5 |
| 17п | CH3 | CH3 | COOEt | NR4R5= пиперидил | 15 |
| 17р | CH3 | CH3 | COOEt | NR4R5= пирролидил | 5 |
| 17с | CH3 | CH3 | COOEt | R4=H, R5=t-Bu | 2 |
| 17т | CH3 | CH3 | COOEt | R4=H, R5=i-Pr | 6 |
| 17у | CH3 | CH3 | COOEt | R4=H, R5=Cy | 2 |
Схема 11
II.2.2.1. Гидрохлориды замещенных 5-диалкиламиноацетил-3a,4, 5,9b-тетрагидро-3H-циклопента[c]хинолинов
Пропусканием сухого хлороводорода в толуольный раствор диалкиламинопроизводных 17а,ж-и,л,п были получены соответствующие гидрохлориды (схема 12, табл. 7).
Схема 12
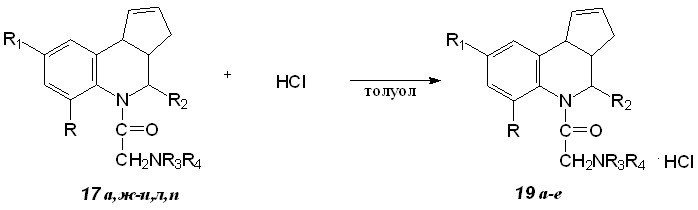
Таблица 7. Гидрохлориды 19а-д диалкиламинопроизводных
| Соединение | R | R1 | R2 | R3R4 | Выход, % |
| 19а | H | H | Ph | морфолил | 60 |
| 19б | H | COOEt | COOEt | N-фенилпиперазино | 94 |
| 19в | H | COOEt | COOEt | N-метилпиперазино | 76 |
| 19г | H | COOEt | COOEt | пиперидил | 65 |
| 19д | H | COOEt | COOEt | R3=H; R4=трет-Bu | 82 |
| 19е | CH3 | CH3 | COOEt | пиперидил | 79 |
II.2.3. Повторная реакция Поварова
Недавно В.В. Кузнецов опубликовал работу, посвященную так называемой двойной реакции Поварова. Независимо от него мы предложили синтетический путь, приводящий к наращиванию цепи гетероциклов, путем повторной реакции Поварова (схема 13).
Схема 13

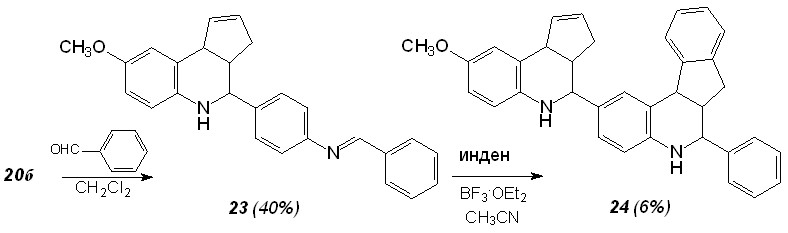
Анилины 23, необходимые для «воспроизводства» оснований Шиффа, были получены восстановлением нитропроизводных гидразин-гидратом в присутствии активного никеля Ренея (схема 14).
Схема 14

20а R1 = R3 = H, R2 = NO2 (69%); 20б R1 = OMe, R2 = H, R3 = NO2 (15%).
II.2.4. Взаимодействие оснований Шиффа с енаминами ряда 3,3-диметил-3,4-дигидроизохинолина
Особый интерес представляют реакции оснований Шиффа с енаминами, поскольку приводят к физиологически активным алкалоидам ряда мартинеллина. Поведение енаминов ряда 3,4-дигидроизохинолина 25 ранее в реакции Поварова не изучалось; хотя можно было предположить образование в этой реакции спиросоединений 26 (схема 15). Наши исследования показали, что реакция останавливается на стадии присоединения оснований Шиффа к енамину с образованием соединений 27 (схема 15).
Схема 15
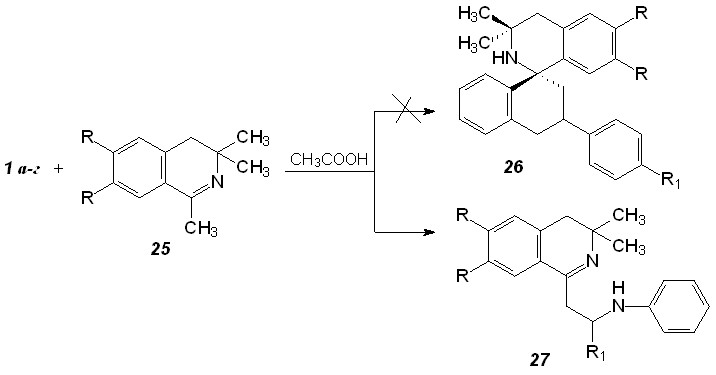
Таблица 8. Продукты взаимодействия оснований Шиффа с енаминами ряда 3,3-диметил-3,4-дигидроизохинолина (27а-е)
| Соединение | R | R1 | Выход, % |
| 27а | 2R=O(CH2)2O | -C6H5 | 45 |
| 27б | 2R=O(CH2)2O | -C6H4-NO2-n | 12 |
| 27в | OCH3 | -C6H5 | 20 |
| 27г | OCH3 | -C6H4-Br-n | 12 |
| 27д | OCH3 | -C6H4-Cl-n | 14 |
| 27е | OCH3 | 22 |
Реакцию проводили в ледяной уксусной кислоте при комнатной температуре в течение 12 часов. Роль уксусной кислоты заключается в протонировании атома азота с образованием положительно заряженного иона иммония, который атакуется енамином по атому углерода.
ИК спектры cоединений 27а-е содержат полосы колебаний групп NH 3320-3370, C-O-Cas 1270 и C-O-Cs 1050-1070 см-1. В спектрах ЯМР Н имеются характеристические дублеты дублетов диастереотопных протонов CH2 группы в области 2.7 и 3.2 м.д. Группы CHN проявляются как мультиплет в области 4.4 – 4.5 м.д.; группа N-H – в области 5.2–5.4 м.д. в виде уширенного синглета.
II.2.5. Взаимодействие оснований Шиффа с енамином ряда 2-азаспиро[4,5]дека-1,6,9-триен-8-она
Изучение реакции оснований Шиффа с енамином ряда 2-азаспиро[4,5]дека-1,6,9-триен-8-она (схема 16) показало, что происходит присоединение енамина по электрофильному атому углерода без замыкания цикла. Следует отметить, что в этой реакции наряду с продуктами присоединения 28 с выходом от 60 до 90% образуется продукт отщепления анилинового фрагмента с образованием соединения 29.
Схема 16

В ИК спектрах соединений 28а-в наблюдается широкая полоса группы NH около 3400 см-1, имеются также полосы валентных колебаний групп С=О 1710-1720 см-1 и С=С 1597-1601 см-1. В спектрах ЯМР 1Н у них имеются характеристические дублеты дублетов диастереотопных протонов СН2-С=N в области 2.6-2.8 м.д.; сигнал группы ArNHCH

Рисунок 3. Молекулярная структура соединения 29 в кристалле. Показаны тепловые эллипсоиды 50%-ной вероятности.
проявляется в виде мультиплета при 4.08-4.14 м.д.; диастереотопные метильные группы дают два синглета в области ~1.5 м.д., а геминальные протоны группы СН2 пиррольного кольца проявляются в виде двух дублетов с КССВ 14.1-14.5 Гц.
Структура соединения 29 была подтверждена благодаря результатам рентгеноструктурного исследования (рис. 3). Из данных РСА следует, что пиррольный цикл находится в плоскости нафталинового кольца, а стирольный фрагмент находится в транс-конфигурации.
II.2.6. Исследование биологической активности новых соединений
Изучена биологическая активность эпоксидов 12б-г. Все соединения относятся к группе малотоксичных веществ, так как имеют (ЛД50 > 500 мг/кг). Соединения не обладают центральной анальгетической активностью и не влияют на исследовательское поведение мышей. Для всех соединений примерно в одинаковой степени характерно угнетающее влияние на двигательную активность мышей. Соединения 12в и 12г оказывают выраженный анксиолитический эффект в тесте «приподнятый крестообразный лабиринт», увеличивая время нахождения в открытых рукавах лабиринта в 3 и 2 раза соответственно по сравнению с данными контрольной группы, причем введение второго атома фтора (12г) увеличивает эффект.
Была изучена также биологическая активность аминов 17а,ж,з,и,л. Эти соединения относятся к группе малотоксичных веществ (ЛД50 > 500 мг/кг). Соединение 17з проявляет центральные анальгетические свойства в тесте «горячей пластинки», развивая максимальное действие через 2 часа после введения. Эффект является дозозависимым, в дозе 50 мг/кг время наступления оборонительного рефлекса увеличивается на 39%, в дозе 100 мг/кг – на 51% и в дозе 200 мг/кг – на 53%. Соединения 17л и 17ж оказывают некоторое угнетающее действие на центральную нервную систему, что проявляется снижением исследовательской активности мышей в тесте «открытое поле».
В III главе приводится экспериментальная часть выполненной работы.
Выводы
- В результате реакции Поварова получен широкий спектр 3а,4,5,9b-тетрагидро-3Н-циклопента[c]хинолинов.
- Показано, что использование различных окислительных систем приводит к соответствующим эпоксидам, диолам и озонидам 3а,4,5,9b-тетрагидро-3H-циклопента[c]хинолинов. Методом рентгеноструктурного анализа подтверждено пространственное строение эпоксида как цис-изомера по атомам С(9b),C(3a),С(4) с анти-расположением оксиранового цикла.
- Предложен перспективный путь синтеза циклических аналогов тримекаина и ксикаина – биологически активных 5-диалкиламиноацетил-3а,4,5,9b-тетрагидро-3Н-циклопента[c]хинолинов.
- Впервые в процессе циклоконденсации по Поварову исследована реакционная способность бензо[b]фурана.
- Установлено, что последовательная конденсация анилов с циклопентадиеном и инденом приводит к образованию бихинолиновых структур.
- Изучена конденсация оснований Шиффа с енаминами ряда 3,4-дигидроизохинолина. Установлено, что аналогичная реакция 2',5',5'-триметил-4',5'-дигидро-4Н-спиро[нафталин-1,3'-пиррол]-4-она сопровождается отщеплением фрагмента анилина с образованием 2'-стирил-5',5'-триметил-4',5'-дигидро-4Н-спиро[нафталин-1,3'-пиррол]-4-она.
Основное содержание работы отображено в следующих
публикациях:
- Tolstikov A.G., Glushkov V.A., Tarantin A.V., Kazanbaeva (Kraynova) G.F., Shashkov A.S., Suponitsky K.Yu., Dembitsky V.M. The Povarov Reaction of Cyclopentadiene with Imines from Methyl 12-Amino-Dehydroabietate // Heteroatom Chemistry. – 2005. – Vol. 16. – No 7. - p. 605-612.
- Толстиков А.Г., Халилов Л.М., Савченко Р.Г, Недопекин Д.В., Глушков В.А., Крайнова Г.Ф., Одиноков В.Н. Озониды N-ацилпроизводных 4-фенил-3а,4,5,9b-тетрагидро-3Н-циклопента[c]хинолина // Известия Академии наук. Сер. хим. -2009. - № 9. – С. 1929-1933.
- Крайнова Г.Ф., Вихарев Ю.Б., Аникина Л.В., Сивцева Е.В., Глушков В.А. Синтез и нейротропная активность замещенных 5-диалкиламиноацетил-4-R-3а,4,5,9b-тетрагидро-3Н-циклопента[C]хинолинов // Химико-фармацевтический журнал. – 2009. – Т. 43. - № 11. – С. 16-19.
- Толстиков А.Г., Глушков В.А., Казанбаева (Крайнова) Г.Ф. Дегидроабиетиновая кислота как объект целенаправленных химических трансформаций // III Всероссийская конференция «Химия и технология растительных веществ». Тезисы докладов. Саратов. - 2004. - С. 52-54.
- Казанбаева (Крайнова) Г.Ф., Глушков В.А. Синтез оснований Шиффа на основе метил-12-амино-дегидроабиетата // III Всероссийская конференция «Химия и технология растительных веществ». Тезисы докладов. Саратов. - 2004. - С. 82.
- Казанбаева (Крайнова) Г.Ф., Глушков В.А., Толстиков А.Г. Синтез функционально замещенных 1,2,3,4-тетрагидрохинолинов реакцией Поварова // X Молодежная школа-конференция по органической химии. Тезисы докладов. Уфа. – 2007. - С. 172.
- Крайнова Г.Ф., Сивцева Е.В., Майорова О.А., Глушков В.А. Синтез 2,6-дизамещенных 1-диалкиламиноацетил-4,3-(1-пропенилен)-1,2,3,4-тетрагидрохинолинов // I Международная конференция «Техническая химия. От теории к практике». Материалы докладов. Пермь. – 2008. - Т. 1. - С. 249-252.
- Крайнова Г.Ф., Глушков В.А., Майорова О.А., Аникина Л.В., Вихарев Ю.Б. Синтез и биологическая активность 5-диалкиламиноацетил-4-R-3а,4,5,9b-тетрагидро-3Н-циклопента[C]хинолинов // XI Молодежная школа-конференция по органической химии. Материалы докладов. Екатеринбург. – 2008. - С. 393-395.
- Крайнова Г.Ф., Глушков В.А., Аникина Л.В., Вихарев Ю.Б. Окислительные превращения 4-R-3a,4,5,9b-тетрагидро-3Н-циклопента[c]хинолинов // XII Молодежная школа-конференция по органической химии. Материалы докладов. Cуздаль. – 2009. - С. 283-286.
- Крайнова Г.Ф., Каракулова В.Л., Глушков В.А. Взаимодействие оснований Шиффа с енаминами ряда 3,3-диметил-3,4-дигидроизохинолина // Всероссийская молодежная конференция-школа «Идеи и наследие А.Е. Фаворского в органической и металлоорганической химии XXI века». Тезисы докладов. Санкт-Петербург. - 2010. – С. 77.
- Крайнова Г.Ф., Глушков В.А. Взаимодействие оснований Шиффа с енаминами ряда 2-азаспиро[4,5]дека-1,6,9-триен-8-она // II Международная конференция «Техническая химия. От теории к практике». Материалы докладов. Пермь. – 2010. - Т.1. - С. 279-281.
[1] Работы по озонолизу соединений 11а,б проводили сотрудники Института нефтехимии и катализа УрО РАН (г. Уфа) под руководством профессора В.Н. Одинокова, за что автор выражает им глубокую благодарность.

