Разработка научных основ регулирования селективности кобальтовых катализаторов синтеза углеводородов из со и н2
На правах рукописи
Будцов Владимир Сергеевич
Разработка научных основ регулирования
селективности кобальтовых катализаторов
синтеза углеводородов из СО и Н2
Специальность 02.00.13 - Нефтехимия
Автореферат
диссертации на соискание ученой степени
доктора технических наук
Москва - 2008 г.
Работа выполнена в Российском государственном университете нефти
и газа им. И.М. Губкина
Научный консультант:
Член корр. РАН, доктор химических наук: Лапидус Альберт Львович
Официальные оппоненты:
Член корр. РАН, доктор химических наук: Стороженко Павел Аркадьевич
Доктор технических наук, профессор: Шпирт Михаил Яковлевич
Доктор технических наук, профессор: Лыков Олег Петрович.
Ведущая организация: ООО “ВНИИГАЗ”
Защита состоится ………….. 2008г. в……. часов в аудитории №… на заседании Диссертационного совета Д 212.200.04 при Российском государственном университете нефти и газа им. И.М.Губкина по адресу: 119991, Москва, ГСП-1, Ленинский проспект 65.
С диссертацией можно ознакомиться в научно-технической библиотеке Российского государственного университета нефти и газа им. И.М. Губкина
Автореферат разослан: « » …………. 2008 г.
Ученый секретарь диссертационного
совета, д.т.н. Р.З. Сафиева
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Современное состояние сырьевой и энергетической базы производства жидких углеводородов характеризуется повышением их стоимости и снижением объема добычи традиционного источника – нефти. В то же время запасы природного газа и твердых горючих ископаемых весьма значительны и превосходят по объему разведанные нефтяные ресурсы.
Наиболее перспективными процессами переработки природного газа и твердых горючих ископаемых c целью получения жидких и твердых углеводородов является их предварительное превращения в синтез-газ и последующий синтез из него углеводородов либо кислородсодержащих соединений. Наиболее изучены и освоены синтезы углеводородов (Фишера- Тропша) и метанола. Синтез Фишера - Тропша (Ф-Т синтез) - процесс, который характеризуется высокой экзотермичностью и недостаточно высокой селективностью.
В Ф-Т синтезе углеводородов из СО и Н2 весьма эффективны кобальтовые катализаторы, в присутствии которых образуются смеси парафинов в основном линейного строения. Их использование особенно актуально для приготовления высококачественного дизельного топлива и растворителей для химической, нефтехимической, пищевой, медицинской и парфюмерной промышленностей, так как получаемые смеси углеводородов не содержат ароматических, серу - и азотсодержащих соединений.
Практический интерес к этому процессу в течение длительного времени испытывал подъемы и спады в зависимости от цен на мировом рынке энергоресурсов (в первую очередь нефти).
Анализ имеющихся работ показывает, что:
1. Определены общие закономерности влияния способа приготовления и эксплуатации Со - катализаторов на синтез углеводородов из СО и Н2. Подтверждено, что синтез углеводородов из СО и Н2 протекает на центрах, имеющих вид Со + - СоО*МxOy, где М ( металл Mg, Zr, Al и др). По мнению А.Л. Лапидуса (*) на Со-системах в синтезе жидких и твердых углеводородов участвует только СО, адсорбированный в слабосвязанной ассоциативной форме.
Развивая эту точку зрения, мы считаем, что формирование активных центров Со-катализаторов происходит на всех этапах приготовления и активации катализатора и обуславливается многими факторами. На дисперсное состояние активного компонента в катализаторе и, соответственно, состояние адсорбированного оксида углерода (II) оказывают влияние природа носителя и промотора, состав газовой среды при предварительном восстановлении и применении катализатора.
2. Для сложных гетерогенных каталитических процессов, к которым относится Ф-Т синтез, диффузионные ограничения оказывают существенное влияние не только на скорость превращения реагентов, но и на селективность процесса, вследствие углубления превращений промежуточно образующихся интермедиатов. В реакционной зоне катализатора создается трехфазная система: «газ» (исходные реагенты и продукты реакции) – «жидкость» (продукты реакции) – «твердое тело» (катализатор и продукты реакции - твердые высокомолекулярные парафины) и возникает сложный механизм массо- и теплопереноса, диффузионных и реадсорбционных факторов, определяемый характером пористой структуры катализатора, распределением его активных центров, режимом синтеза, составом получаемых продуктов и т.д.
* Лапидус А.Л. Научные основы синтеза жидких углеводородов из СО и Н2 в присутствии кобальтовых катализаторов // Изв. АН СССР. Сер.хим.-1991.-№12.-С.2681-2699.
3. Ключевым моментом в понимании механизма и основ технологии Ф-Т синтеза остается развитие теоретических представлений о действии катализаторов и создание систем с заданными свойствами.
4. ФТ- синтез отличается не стационарностью активности и селективности катализаторов во времени. Для «активации» катализаторов и «вывода» на стационарный режим работы, требуется от 20-50 до 100-200 часов. Условия вывода на режим (температура, среда, длительность,…) влияют на показатели процесса. Возможно, в этом также проявляется влияние диспергирования активного компонента, которое развивается и во время каталитической реакции.
В связи с этим актуально:
- разработка научно обоснованных методов приготовления Со-катализаторов и изучение их влияния на активность и селективность этих контактов,
- создание высокоэффективных, высокопроизводительных катализаторов с управляемыми активностью и селективностью,
- регулирование параметров пористой структуры катализаторов путем подбора носителей разной природы и регулирования их физико-химических свойств,
- определение оптимальных технологических параметров высокопроизводительного синтеза углеводородов,
- разработка математической модели процесса, учитывающей массо- и теплоперенос на микро – (гранулы катализатора) и макроуровнях (объем катализатора, геометрические размеры реактора).
Цель работы - научное обоснование и разработка технических решений для осуществления высокопроизводительного с управляемой селективностью процесса синтеза углеводородов из СО и Н2 на кобальтовых катализаторах.
Основные задачи:
- изучение макрокинетических характеристик процесса синтеза углеводородов из CO и H2, оценка их влияния на его селективность по жидким и твёрдым углеводородам;
- накопление экспериментального материала и определение закономерностей влияния условий формирования активного компонента при приготовлении кобальтовых катализаторов на синтез углеводородов из СО и Н2;
- создание методов и технологий синтеза высокопроизводительных кобальтовых катализаторов с регулируемой активностью и селективностью по жидким и твёрдым углеводородам;
- систематическое изучение процесса «разработки» (предварительной активации) кобальтовых катализаторов на ранних стадиях процесса синтеза углеводородов;
- разработка математической модели процесса, учитывающей стационарный и нестационарный режимы работы катализатора;
- определение оптимальных технологических параметров селективного синтеза жидких и твердых углеводородов топливного направления.
Научная новизна: 1. На основании изучения динамики процесса синтеза углеводородов из СО и Н2 на кобальтовом катализаторе впервые определено, что получение жидких и твердых (церезина) углеводородов связано с наличием различных диффузионных стадий процесса. Образование жидких углеводородов лимитируется внешнедиффузионными, а твёрдых углеводородов – внутридиффузионными ограничениями. Таким образом теоретически и экспериментально обоснована зависимость селективности и производительности Со-катализаторов синтеза углеводородов по жидким и твёрдым углеводородам от параметров пористой структуры катализаторов и технологических (давление, температура и скорость синтез-газа) параметров процесса.
2. Показано, что формирование активных центров Со-катализаторов продолжается и в период их активации (начальном периоде работы катализаторов после их восстановления и начала процесса синтеза). Предположено, что продолжение формирования активных центров Со-катализаторов в период их активации обусловлено взаимным влиянием активных компонентов катализатора и его пористой структуры, воздействующей на формирование и регулирование процессов массо- и теплопередачи.
3. Систематически изучен синтез углеводородов из СО и Н2 при давлениях до 3,0 МПа и объёмных скоростях до 2500 ч-1 синтез-газа в присутствии высокопроизводительных Со-катализаторов. Определены оптимальные технологические параметры синтеза жидких углеводородов топливного направления из СО и Н2.
4. Предложена математическая модель процесса синтеза углеводородов из СО и Н2, учитывающая массо- и теплоперенос в зерне катализатора и в реакционном объёме. Модель позволяет прогнозировать характеристики процесса как в стационарном, так и в нестационарном состояниях.
Практическая ценность: 1. Предложены Со- катализаторы, определены физико-химические характеристики и разработаны условия их производства, обеспечивающие высокую производительность (150 кг С5+/м3*час) и селективность по углеводородам, в частности по дизельному топливу (58 %) или бензину (85 %), в сочетании с повышенными эксплуатационными качествами (стабильность, прочность).
Приготовлены, прошли апробацию в лабораторных и, в ряде случаев, пилотных и промышленных условиях Со-катализаторы:
- с использованием природных носителей, селективные по твердым углеводородам (церезину);
- с использованием цеолитов, высокоселективный в производстве бензинов с октановым числом 85-92;
- промотированный рением, высокопроизводительный и селективный в синтезе дизельных фракций;
2. Разработаны технические решения и предложены катализаторы для малогабаритных мобильных установок по переработке природного газа в моторное топливо.
3. На основе предложенной математической модели процесса синтеза углеводородов из СО и Н2, разработано программное обеспечение для оптимизации технологических параметров процесса в стационарном и нестационарном состояниях.
4. Разработаны рекомендации и предложена методика прогнозирования продолжительности активной работы кобальтовых катализаторов.
Апробация работы. Результаты работы доложены на: 3-й Всесоюзной конференции «Химические синтезы на основе одноуглеродных молекул» (Москва, 1991); Международной научной конференции «Химия и природосберегающие технологии использования угля» (Звенигород, 1999); Международной научной конференции и школе-семинаре ЮНЕСКО «Химия угля на рубеже тысячелетий» (Клязьма, 2000); Международной научно-технической конференции «Современные проблемы химической технологии неорганических веществ» (Одесса, 2001); Заседании Расширенного Научного совета РАН по химии ископаемого твердого топлива «Перспективы развития углехимии и химии углеродных материалов в 21 веке» (Звенигород, 2003); Конференции России и стран СНГ «Перспективы развития углехимии химии углеродных материалов в 21 веке.» (Звенигород, 2005), Конференции «Перспективы развития химической переработки горючих ископаемых» (Санкт-Петербург, 2006 г.)
Публикации. По теме диссертации опубликовано 16 статей, 8 тезисов и докладов, получено авторское свидетельство и патент на изобретения, опубликована 1 монография.
Объём и структура работы. Диссертационная работа состоит из введения, 5-ти глав, выводов, списка литературы и приложений. Работа изложена на 296 страницах текста, включает 53 таблицы, 92 рисунка. Библиографический список содержит 151 работy отечественных и зарубежных авторов.
Принятые сокращения:
Т – температура синтеза, С.
Т восст. – температура восстановления, С.
Т прокал. – температура предварительной окислительной обработки
катализатора, С
Р – давление синтез-газа, МПа
О.С. – объемная скорость газа, ч-1.
W – производительность катализатора, кг. углеводородов/м3 кат.*ч.
V – линейная скорость синтез-газа, м/с.
Vпр – объем пор, см3/г.
K – контракция – изменение объема газа в ходе синтеза, %.
Sуд – удельная площадь поверхности, м2/г.
Kco – конверсия СО, %.
D – диаметр кристаллитов Со, нм.
Ds – дисперсность Со, %.
С5+ -количество жидких и твердых углеводородов, полученных из 1 м3 синтез-газа, приведенного к нормальным условиям.
С1-С4 – количество газообразных углеводородов, полученных из 1 м3 синтез-газа, приведенного к нормальным условиям.
С5-С10 – фракция углеводородов, получаемых из СО и Н2, соответствующая бензину.
С11-С18 - фракция углеводородов, получаемых из СО и Н2, соответствующая дизельному топливу.
С19+ - фракция углеводородов, получаемых из СО и Н2, соответствующая твердым парафинам.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ.
Во введении рассмотрено современное состояние проблем каталитического синтеза углеводородов из СО и Н2, создания теоретических основ приготовления кобальтовых катализаторов синтеза жидких и твёрдых продуктов; обоснована актуальность работы, сформулированы цель и задачи исследований.
В первой главе, посвященной литературному обзору, приведен анализ современных представлений о синтезе углеводородов из СО и Н2 по методу Фишера- Тропша (ФТ-синтез), катализаторах процесса, механизме и особенностях протекания процесса ФТ-синтеза. Анализ литературных источников показал принципиальные возможности регулирования селективности ФТ - синтеза путем подбора катализаторов отличающихся физико-химическими характеристиками и путем регулирования технологических параметров синтеза.
Во второй главе описаны методики экспериментов и приведены принятые сокращения. Исследования процесса, активности и селективности катализаторов ФТ-синтеза проводили на лабораторных – ИОХ РАН ( с давлением синтез-газа от 0,1 до 3,0 МПа), пилотных и опытно- промышленных установках – Новочеркасский завод синтетических продуктов. Для изучения физико-химических характеристик катализаторов использовались методы: ртутной порометрии, импульсной газохроматографии, кислородного и аммиачного титрования.
В главах три – пять приведены экспериментальные данные.
В главе три изучено влияние диффузионных стадий на селективность процесса в присутствии соосаждённых катализаторов, полученных по промышленной технологии, предложен способ регулирования селективности по высокомолекулярным углеводородам путём изменения параметров пористой структуры катализатора. Исследованы кобальтовые катализаторы, осажденные на природные и синтетические алюмосиликаты.
Для определения области протекания процесса использовали катализатор с размером гранул 3-5 мм, состава (вес.ч): 100 Со- 6 MgО- 10 ZrО2-200 диатомитовый носитель. Синтез осуществляли в пилотной установке с реактором диаметром 0,22 м под давлением 0,9 МПа с использованием промышленного синтез –газа состава (об.%): СО 27-30; Н2 58-63; СО2 5-7; СН4 1,5-4,5; N2 1,0-2,5. Производительность катализатора по С5+ поддерживали на уровне 11,3-12,5 кг/ч*м3кат., сохраняя контракцию (К) синтез-газа, близкой к 50%. Продолжительность непрерывных испытаний катализатора в одном режиме достигала 1200 часов.
Увеличение линейной скорости синтез-газа оказывает значительное воздействие на образование различных групп углеводородов. При сохранении практически постоянной производительности по углеводородам С5+ производительность катализатора по жидким углеводородам С11- С18 возрастает на 60%, а по С19+, включая церезин•, уменьшается в несколько раз (рис.1).
- Церезин – смесь твердых синтетических высокомолекулярных алифатических углеводородов, преимущественно линейного строения, с температурой кипения выше 450 С и температурой каплепадения выше 100 С.
Предварительными исследованиями было установлено, что в области температур синтеза 170-200 С энергия активации процесса составляет 60-85 кДж/ моль. Таким образом, относительно низкие значения энергии активации, при большом избытке реагентов обусловлены существенным воздействием диффузионных факторов на скорость процесса. С учётом данных по энергии активации процесса и влиянию линейной скорости газа на производительность катализаторов можно сделать вывод, что синтез различных фракций углеводородов обусловлен наличием разных диффузионных лимитирующих стадий процесса: для углеводородов С11- С18 - внешнедиффузионной, а для С19+, включая церезин, внутридиффузионной.
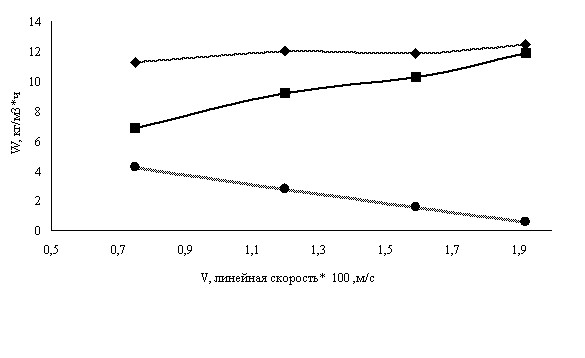
- углеводороды С5+ - углеводороды С11- С18 - углеводороды С19+
Рис.1. Зависимость производительности (W) катализатора по группам
углеводородов от линейной скорости (V) газа.
Данные, полученные на катализаторе (вес. ч.): 100 Co – 6 MgO – 10 ZrO2 – 200 носитель ( АС-37 + диатомит 1:1), показывают влияние размера гранул катализатора на селективность процесса (табл. 1).
Катализатор с меньшим размером гранул проявил большую активность в отношении превращения синтез-газа в углеводороды и обеспечил по-
вышенный выход С5+. Уменьшение среднего диаметра гранул способствует ускорению транспортировки исходных реагентов в зону реакции и отвода продуктов в поток реагентов. Последнее сказывается на пониженном в 1,3 раза содержании церезина в продуктах синтеза.
Таблица 1.
Влияние размера гранул катализатора на показатели процесса
(Р= 0,95 МПа, О.С.= 90-94 час-1, Т= 160-163 С)
| Размер гранул, мм | К, % | Выход С5+, г/нм3 | Содержание, С19+,% |
| 3-5 | 51-53 | 135,4 | 47,6 |
| 1-3 | 54-55 | 148,5 | 37,3 |
Таким образом, установлено:
- синтез различных фракций углеводородов обусловлен наличием разных лимитирующих стадий процесса;
- в пределах технологических параметров (давление синтез-газа до 1,0 МПа, температура синтеза 150-180 0С, объемная скорость синтез-газа до 1000 ч-1) промышленного синтеза углеводородов на кобальтовых осажденных катализаторах для увеличения селективности по С19+, включая церезин, необходимо обеспечить перевод процесса во внутридиффузионную область.
- регулирование селективности катализаторов по различным группам углеводородов возможно: подбором параметров их пористой структуры и изменением технологических параметров процесса синтеза: давления, температуры и объемной скорости синтез-газа.
Перевод процесса во внутридиффузионную область приводит к увеличению выхода твердых парафинов - церезина. Достичь этого можно путем регулирования пористой структуры катализаторов. Однако в этом случае, возможно, снижение скорости диффузии исходных реагентов и, как следствие, уменьшение производительности катализатора. Поэтому необходимо создание пористой структуры, имеющей полидисперсный характер распределения пор по радиусам.
Традиционным носителем осажденных катализаторов является диатомит (кизельгур). Кроме этого носителя для приготовления катализаторов использовали природные носители: каолин, гумбрин, клиноптиллолит, бентонит; синтетические алюмосиликаты марок: АС -37, АШНЦ 3, Цеокар 2.
Природные материалы в основном содержат оксиды кремния и алюминия с включением примесей оксидов таких металлов как магний, железо, натрий, калий, кальций. Кроме этого клиноптиллолит является представителем группы природных высококремнезёмных цеолитов с мольным соотношением SiO2/Al2O3 – 7-10. Эти носители имеют небольшую (10-70 м2/г) удельную поверхность, суммарный объем пор 0,7-1,2 см3/г с преобладанием (до 90%) макропор диаметром 100-400 нм.
Синтетические алюмосиликаты относятся к высокопористым материалам с удельной поверхностью 150-400 м2/г и порами разного диаметра.
Катализаторы испытывали в синтезе углеводородов при параметрах, аналогичных промышленным и описанным выше. При этом температуру синтеза поддерживали в узких ( 160-175 0С) пределах.
Катализаторы, приготовленные с использованием синтетических носителей, отличаются большей активностью и селективностью по сравнению с образцами на основе природных носителей (табл.2).
При оптимальных для катализаторов на синтетических носителях технологических параметрах их активность и селективность по церезину выше. Катализаторы, приготовленные на бентоните и клиноптиллолите, активность в данных условиях практически не проявили.
Таблица 2
Активность и селективность Со-катализаторов состава (вес. ч):
100 Со- 10 MgO- 200 носитель.
| Носитель | Sуд, м2/г | Vпр, см3/г | Т, С | К, % | Выход С5+, г/нм3 | Содержание церезина, % |
| Диатомит | 110 | 0,5 | 160 | 50,5 | 113,0 | 16,4 |
| Каолин | 75 | 0,4 | 162 | 7,3 | Не активен | - |
| Гумбрин | 83 | 0,45 | 172 | 54,4 | 122,4 | 9,2 |
| Клиноптил-лолит | 90 | 0,5 | 174 | 14.0 | Не активен | - |
| Бентонит | 95 | 0,45 | 175 | 5.5 | Не активен | - |
| АС-37 | 450 | 1,43 | 170 | 55,2 | 155,0 | 38,0 |
| АШНЦ-3 | 400 | 1.4 | 168 | 54,8 | 135,0 | 37,2 |
| Цеокар 2 | 460 | 1,22 | 172 | 56,4 | 117,0 | 22.0 |
Таким образом, более развитая поверхность Со-систем на основе синтетических алюмосиликатов обуславливает и большую активность, а переход процесса, вследствие более высокой пористости, во внутридиффузионную область приводит к повышенному образованию высокомолекулярных углеводородов. Одной из важных характеристик катализатора является их механическая прочность. Прочность катализаторов определяли методом истирания (табл. 3).
Таблица 3.
Прочность (истираемость) катализаторов состава: (вес.ч.) (100Со-10MgO-200 носитель), на различных осажденных на природные или синтетические носителях.
| Носитель | Диато- мит | Као-лин | Гумб-рин | Бенто-нит | Клино-птиллолит | АС-37 | Цео-кар 2 | АШНЦ 3 |
| Истираемость, % | 4,4 | 1,8 | 13,1 | 1,2 | 4,9 | 15,0 | 17,6 | 16,1 |
Катализаторы на природных носителях, за исключением гумбрина, по прочности превосходят катализаторы на синтетических носителях. Наиболее прочные катализаторы получены с использованием каолина и бентонита. Но, как отмечалась выше (табл.2), именно на этих носителях катализаторы проявляли меньшую активность. Более простым решением явилось сочетание высокой пористости, а следовательно активности и селективности, свойственной катализаторам на синтетических носителях, и высокой прочности, характерной для природных носителей путем приготовления катализаторов на смешанном носителе: синтетическом и природном алюмосиликатах. Это позволило регулировать активность, селективность и прочность катализаторов не изменяя химического состава активных компонентов и, что особенно важно, метода приготовления катализаторов. Комбинируя различные сочетания носителей, можно добиться высоких прочностных характеристик катализаторов (табл. 4).
Таблица 4.
Прочность (истираемость) Со-катализаторов на смешанных носителях.
| Носи-тель/ Соотно-шение, вес.ч. | Диато-мит/ AC 37. 1:1/ 3:1 | Каолин/ AC 37. 1:1 | Каолин/ Диатомит/АС 37. 1:1:2 | Гумб-рин/ АС37 1:1 | Диатомит/Гумб- рин/АС 37 1:1:2 | Клино-птил- лолит/ АС 37 1:1 | Цеокар/ Гумб-рин 1:1 | Цео-кар/ Бенто-нит 1:1 |
| Истира-емость,% | 10,1/5,4 | 4,5 | 5,7 | 39,0 | 8,0 | 4,6 | 7,7 | 2,9 |
Все катализаторы, за исключением катализатора на носителе диатомит + АС- 37 (3:1), проявили высокую активность и селективность по церезину (табл. 5). Таким образом, лучшее сочетание характеристик: прочность, активность, селективность по высокомолекулярным углеводородам, продемонстрировали катализаторы, осажденные на смешанные (1:1) носители с использованием синтетических алюмосиликатов: АС и Цеокар- 2 и природных алюмосиликатов: диатомита, бентонита и каолина. Данные по изучению пористой структуры катализаторов, приготовленных на природных, синтетических и смешанных носителях (табл. 6 и рис. 2) показали, что удельная поверхность образцов различна и составляет 400-450 м2/г для катализаторов с АС 37, АШНЦ 3 и 110, 120 м2/ г для образцов с диатомитом.
Таблица 5.
Активность и селективность Со-катализаторов (100Со-10MgO-200 носитель), осажденных на смешанные носители.
| Состав носителя | Т, С | К, % | Выход С5+,г/м3 | Содержание церезина, % |
| Кизельгур + АС-37, 1:1 3:1 | 170 170 | 55,2 27.8 | 182,0 63,2 | 29.9 - |
| Каолин + АС-37, 1:1 | 175 | 57,0 | 139,1 | 33,3 |
| Каолин + Кизельгур + АС-37, 1:1:2 | 164 | 54,0 | 136,0 | 23,2 |
| Гумбрин + АС-37, 1:1 | 169 | 57,1 | 142,0 | 34,0 |
| Гумбрин + Кизельгур + АС-37, 1:1:2 | 173 | 56,5 | 130,0 | 25,8 |
| Клиноптило- лит + АС-37, 1:1 | 172 | 55,3 | 144,0 | 37,1 |
| Гумбрин + Цеокар 2, 1:1 | 171 | 53,2 | 141,0 | 28,2 |
| Цеокар 2 + Бентонит, 1:1 | 166 | 57,0 | 143,0 | 33,0 |
Таблица 6.
Удельная поверхность и распределение объема пор по радиусам
Со- катализаторов.
| Носитель | Sуд, м2/г | Vпр, см3/г | Содержание (%) пор с радиусом (нм) | ||||||
| <25 | 25-50 | 50-100 | 100-190 | 190-250 | 250-1000 | >1000 | |||
| AC-37 | 450 | 1,43 | 37,1 | 9,8 | 5,6 | 8,4 | 7,7 | 9,8 | 21,6 |
| АШНЦ - 3 | 400 | 1,40 | 40,3 | 8,5 | 8,5 | 12,1 | 7,8 | 8,5 | 14,3 |
| Диатомит | 110 | 0,45 | 4,5 | 13,3 | 6,6 | 17,8 | 37,8 | 20,0 | 0 |
| Диатомит * | 120 | 0,50 | 6,0 | 12,0 | 8,0 | 12,0 | 52,0 | 10,0 | 0 |
| АС 37 +Диатомит, 1:1 | 190 | 0,64 | 0 | 0 | 43,8 | 10,9 | 28,1 | 17,2 | 0 |
- - Катализатор с добавлением ZrO2 (10.0 вес.ч.)

Рис. 2. Распределение объема пор по радиусам
катализаторов на различных носителях.
Все катализаторы характеризуются полидисперсным распределением пор по радиусам. Однако образцы, содержащие диатомит в качестве носителя, содержат в основном крупные поры размером более 190 нм, а в случае образцов с алюмосиликатами преимущественными являются мелкие поры (37-40%). Катализатор на смешанном носителе (АС 37 + диатомит, 1:1) по характеру распределения пор и удельной поверхности имеет промежуточные значения. Максимум мелких пор (около 40%) несколько смещен в сторону больших (50-100 нм) радиусов, широкие транспортные поры (190 нм и выше) составляют 45 %, удельная поверхность 190 м2/г.
Полученные катализаторы различаются характером пористой структуры и величиной удельной поверхности, а также активностью и селективностью по церезину. Эти различия наблюдали при постоянном составе активного компонента и применении близких по химической природе носителей. Таким образом, можно считать установленным, что на процесс синтеза углеводородов из СО и Н2 на осажденных Со-катализаторах значительное воздействие оказывают их структурные характеристики. Предпочтительным для синтеза высокомолекулярных углеводородов являются катализаторы с развитой удельной поверхностью и полидисперсным распределением пор, при котором наряду с порами малых радиусов, способствующих переводу процесса синтеза во внутридиффузионную область, имеется значительная доля широких транспортных пор с радиусами от 100 до 1000 нм. Известно (*), что образование углеводородов происходит с участием активных центров, адсорбирующих СО в слабосвязанных формах. Активные центры, в свою очередь, характеризуются и размерами кристаллитов кобальта. Изучение этих факторов для осажденных на различные носители Со-катализаторов позволило нам оценить влияние природы носителя на активность и селективность этих каталитических систем (табл. 7 и 8).
Таблица 7.
Влияние природы носителя на адсорбцию СО и дисперсность Со.
| Носитель | Адсорбция СО | Sуд. Со, м2/г. | D, нм. | Ds, % | |
| ммоль/г кат 10-2 | ммоль/г Со 10-2 | ||||
| Диатомит | 3,80 | 0,12 | 4,6 | 33,0 | 0,7 |
| АС-37 | 6,05 | 0,19 | 7,2 | 27,0 | 1.1 |
| Ас-37 + Диатомит1:1. | 5,15 | 0,17 | 6,1 | 30,0 | 0,9 |
Из данных, приведенных в табл. 8 видно, что природа выбранного носителя оказывает существенное влияние на дисперсность кобальта в катализаторе и, следовательно, на адсорбцию СО, что вместе с характером пористой структуры оказывает воздействие на активность и селективность катализатора.
* Лапидус А.Л. Научные основы синтеза жидких углеводородов из СО и Н2 в присутствии кобальтовых катализаторов // Изв. АН СССР. Сер.хим.-1991.-№12.-С.2681-2699.
Таблица 8.
Термодесорбция СО с Со- катализаторов на различных носителях.
| Носитель | Температура максимума десорбции СО, 0С Количество десорбирующегося СО, % |
| Диатомит | 205/45 340/29 475/26 |
| AC-37 | 185/62 290/27 475/11 |
| AC-37 + Диатомит, 1:1. | 205/53 340/28 475/19 |
Катализатор на диатомите характеризуется при Т = 185-205 С, близких к температурам синтеза углеводородов из СО и Н2, минимальными показателями адсорбции СО. Он менее дисперсен и содержит кристаллиты кобальта более крупных размеров. Использование в качестве носителя только синтетического алюмосиликата, либо алюмосиликата в смеси с диатомитом, позволяет, судя по количеству десорбированного СО (6,0510-2 и 5,1510-2 ммоль/г катализатора), синтезировать высокодисперсные каталитические системы со средним диаметром кристаллитов кобальта от 27 до 30 нм. Отличия в количестве СО, адсорбированного на поверхности катализаторов в слабосвязанной форме и десорбирующегося при температурах синтеза достаточно велики и хорошо коррелируются с выявленной ранее активностью и селективностью.
Таким образом, на процесс синтеза углеводородов из СО и Н2 на осажденных кобальтовых катализаторах значительное воздействие оказывают:
- характеристики пористой структуры катализаторов;
- адсорбционные свойства катализаторов.
Предпочтительными для синтеза высокомолекулярных углеводородов являются катализаторы с удельной поверхностью более 200 м2/г, полидисперсным распределением пор носителя, обеспечивающим достаточную дисперсность кобальта и хемосорбцию СО в слабосвязанных формах. С целью обеспечить продолжительной срок промышленной эксплуатации катализаторов при высокой активности по жидким углеводородам, селективности по церезину и прочности, рекомендовано применение смешанных носителей (природные материалы и синтетические алюмосиликаты) в соотношении 1:1.
Для промышленного испытания на Новочеркасском заводе синтетических продуктов был выбран катализатор, приготовленный с использованием смеси носителей Цеокара-2 и бентонита. Объем катализатора составил 10 тонн и был достаточен для загрузки 3-х промышленных реакторов синтеза. Составы синтез-газа и схема опытно-промышленной установки приведены в табл. 9 и рис. 3.
Промышленный реактор синтеза углеводородов представляет собой одноходовой трубчатый теплообменник. Катализатор находится в трубном пространстве реактора. Тепло реакции снимается пароводяной смесью циркулирующей по межтрубному пространству реактора и специальному пароводяному контуру.
Характеристика реактора синтеза:
Высота - 6,8 м.
Диаметр - 2,75 м.
Высота трубного пучка - 4,55 м.
Диаметр трубки - 26Х2 мм.
Число трубок - 6200 шт.
Рабочее давление
в трубном пространстве - до 1,0 МПа.
Рабочая температура - до 200 С.
Таблица 9.
Состав синтез-газа ( Н2S не более 0,5 мг/м3)
| Наименование компонента | Состав синтез-газа, об %. | ||
| Вариант 1(I ступень синтеза) | Вариант 2(II степень синтеза) | Вариант 3(III ступень синтеза) | |
| Н2 | 58-63 | 45-50 | 35-40 |
| СО | 27-30 | 22-27 | 15-20 |
| СО2 | 5-7 | 12-15 | 20-25 |
| СН4 | 1,5-4,5 | 8-13 | 25-30 |
| N2 | 1,0-2,5 | 3-7 | 5-10 |
С использованием этой установки производились испытания активности, селективности по различным группам углеводородов и производительности катализаторов. Синтез-газ, сжатый до 1,0 МПа и подогретый до 90-130 С, поступает в реактор синтеза (1), где при температуре до 200 С происходит процесс синтеза углеводородов. Полученные углеводороды и не прореагировавшие компоненты синтез-газа поступают в сепаратор - отделитель парафина (2), где отделяются жидкие и твердые продукты синтеза, а газообразные углеводороды вместе с не прореагировавшими компонентами синтез-газа поступают в холодильник (3) с циркулирующей водой для конденсации продуктов синтеза, а затем в сепаратор-отделитель легких углеводородов (4). Оставшийся газ сбрасывается в систему остаточного газа. Продукты синтеза из сепараторов (2 и 4) направляются в емкости сбора продуктов (5 и 6) через клапаны-регуляторы уровня жидкости в сепараторах.

1 – реактор синтеза; 2 – парафиноотделитель ; 3, 3а – холодильники; 4 – сепаратор легких углеводородов; 5,6 – емкости сбора продуктов; 7 – насос для откачки продуктов; 8а, 8б – расходомерные устройства.
Рис. 3. Опытно-промышленная установка синтеза углеводородов из
СО и Н2.
Параллельно испытаны другие катализаторы: один реактор - осажденный на диатомит и один реактор на смешанный носитель - диатомит + Цеокар 2, 1:1 (табл.10).
Таблица 10.
Промышленные испытания Со-катализаторов.
| Носитель | Продолжите-льность испытаний, ч. | Т синтеза, 0С | К, % | Содержание церезина, вес. % |
| Диатомит | 528 3884 4992 | 182 186 189 | 52 49 46 | 12,8 13,0 10,8 |
| Диатомит +Цеокар-2, 1:1 | 480 3460 5120 | 178 184 186 | 45 51 48 | 23,1 17,1 13,7 |
| Бентонит +Цеокар-2, 1:1 (ср. для 3-х реакторов) | 628 3167 4748 | 173 181 185 | 54 56 50 | 24,8 21,8 16,1 |
Содержание церезина в продуктах синтеза составило на первом этапе активации катализатора для 3-х опытных образцов 29,7; 28,5 и 32,8 % в отличие от катализаторов на диатомите (12,8 %) и диатомите и Цеокаре-2 (23,1 %). В процессе эксплуатации эти катализаторы сохраняли более высокую селективность по церезину. Таким образом установлено, что Со- катализатор с бентонитом и Цеокаром -2 (1:1) не уступает промышленным образцам по таким показателям как оптимальная температура синтеза, степень переработки синтез-газа, продолжительность активной работы и превосходит их по селективности в отношении образования высокомолекулярных парафиновых углеводородов.
В главе четыре рассмотрена возможность использования синтетических и природных носителей для высокопроизводительного синтеза из СО и Н2 жидких углеводородов, проведены испытания по предварительному прокаливанию катализаторов с целью оценки влияния температуры обработки на продолжительность их активной работы (стабильности во времени), проведены систематические исследования Со- катализаторов, приготовленных методом пропитки носителя (-Al2O3).
Основываясь на выводах, приведенных в главе 3 о том, что синтез жидких углеводородов протекает во внешнедиффузионой области, можно предположить, что для синтеза таких углеводородов целесообразно использовать высокие объемные скорости синтез-газа с целью снятия диффузионных ограничений. При этом мы учитывали, что повышение скорости газа приведет к снижению контракции (степени переработки) и потребует повышения температуры синтеза, что может привести к увеличению возможности зауглероживания катализатора и быстрого прекращения его активной работы. Использование повышенного (до 3,0 МПа) давления, по сравнению с применявшимся ранее давлением синтез- газа 1,0 МПа, может позволить снизить температуру синтеза. Но это приведет также к возникновению дополнительных диффузионных ограничений. Таким образом поиск оптимальных значений технологических параметров (давление, температура, объемная скорость синтез-газа) позволяет наряду с подбором оптимальной пористой структуры катализатора регулировать степень воздействия диффузионных факторов на процесс и регулировать активность и селективность катализаторов.
В качестве образцов для синтеза при повышенных давлениях, объемных скоростях синтез-газа и температурах были выбраны катализаторы осажденные на традиционном носителе –диатомите и перспективном -бентоните в смеси с алюмосиликатом.
Производительность катализаторов при объемной скорости синтез-газа, равной 1200 ч-1, резко возрастала и достигала 207,4 кг/м3 кат. ч для Со-катализатора на диатомите при 220 0С и конверсии СО 88% и 189,8 кг/м3 кат.ч для катализатора на носителе диатомит +алюмосиликат (аморфный алюмосиликат с отношением SiO2/Al2O3, равном 10,4) (табл. 11). Отметим, что при давлении 0,1 МПа и объёмной скорости синтез-газа 100 ч-1 производительность катализатора Со-диатомит составляет лишь 10-15 кг/м3 кат.ч. т.е. в 15-20 раз меньше. Использование давления, равного 2,0 МПа, позволило избежать более интенсивного метанообразования, обычно сопровождающего синтез углеводородов из СО и Н2 при повышении температуры.
Таблица 11.
Активность катализаторов при высокопроизводительном
синтезе углеводородов. (Vоб = 1200 ч-1, Р = 2,0 МПа).
| Носитель | Т,С | Ксо,% | W,С5+ /м3 кат. ч | Выход углеводородов, г/м3 | ||
| СН4 | С2-С4 | С5+ | ||||
| Диатомит Бентонит + Алюмоси- ликат, 1:1. | 210 215 220 230 200 210 215 220 | 11,0 43,0 88,0 93,0 16,0 59,0 86,0 91,0 | 10,2 102,4 207,4 192,0 24,4 142,4 189,8 179,2 | < 1 7 17 26 2,0 8,0 20,0 25,0 | <1 5 6 7 <1 5,0 8,0 12,0 | 8,0 79,0 161,0 150,0 19,0 113,0 150,0 142,0 |
Выход метана, несмотря на существенный рост температуры синтеза (на 40-50 0С), оставался на уровне до 15-20 г/м3 при конверсии СО, равной 86-88%. Увеличение объемной скорости синтез-газа привело к изменению состава получаемых углеводородов.
Для Со- катализатора на диатомите повышение давления и объемной скорости синтез-газа привело к незначительному увеличению выхода изо-парафинов и олефинов и, соответственно, снижению выхода н-парафинов. Для катализатора на смешанном носителе наблюдали снижение выхода изо-парафинов и увеличение выхода олефинов и н-парафинов. Значительно большее влияние изменение параметров синтеза оказывает на фракционный состав жидких продуктов.
Увеличение О.С. до 1200 ч-1 и давления синтез-газа до 2,0 МПа привело к резкому изменению фракционного состава получаемых углеводородов (табл.12). Содержание фракций углеводородов, соответствующих жидким моторным топливам (С5-С10 - бензин и С11-С18- дизельное топливо), значительно увеличилось. Содержание же высокомолекулярных углеводородов, включая фракцию углеводородов С19-С60 и выше существенно (в десятки раз) уменьшилось ( см. табл. 2, 5 и 12). Это подтверждает наши выводы о влиянии диффузионных факторов на процесс. При этом использование синтетического алюмосиликата с более развитой внутренней поверхностью и в данных условиях способствует получению более высокомолекулярных продуктов, по сравнению с применением в качестве носителя Со-катализаторов природных материалов.
Таблица 12.
Состав жидких (С5+) продуктов синтеза углеводородов из СО и Н2
(Т= 220 С; Р= 2,0 МПа; О.С.= 1200 ч-1)
| Носитель | Химический состав, вес.% | Фракционный состав, вес.% | ||||
| Олефины | Н-парафины | Изо- парафины | С5-С10 | С11-С18 | С19+ | |
| Диатомит | 7 | 81 | 12 | 58 | 39 | 3 |
| Бентонит + Алюмосиликат | 4 | 88 | 8 | 48 | 46 | 6 |
Применение для синтеза углеводородов высоких давления, объемной скорости синтез-газа и температуры осложняет применение катализаторов, приготовленных методом осаждения. Требования к прочности контактов возрастают, а возникающая в процессе осаждения так называемая «вторичная» пористость снижает общую прочность катализаторов. Поэтому, в дальнейшем для осуществления высокопроизводительного синтеза углеводородов мы применяли катализаторы, приготовленные методом пропитки носителя солями кобальта. Из носителей был выбран гранулированный -Al2O3. Известно, что катализаторы на этом носителе характеризуются высокой прочностью и развитой поверхностью.
Влияние технологических параметров высокопроизводительного синтеза углеводородов из СО и Н2 на активность и селективность Со-катализаторов было изучено для катализатора состава (вес.%): 20% Со- 0,5% ReO2- носитель. Испытания активности и селективности катализатора проводили в два этапа. На первом, при практически постоянной степени конверсии СО (55-65 об. %) изменяли давление и объемную скорость синтез-газа для поиска оптимальных значений этих параметров. На втором определяли оптимальную температуру и степень переработки СО при выбранных давлении и объемной скорости. Изменение давления и объемной скорости синтез-газа оказывает существенное влияние на показатели синтеза (табл. 13). Повышение давления до 3,0 МПа и увеличение объемной скорости до 2000-2500 ч-1 оказывают негативное влияние на выходы жидких углеводородов и селективность по дизельной фракции (С11-С18). Выход жидких углеводородов уменьшается в 2-3 раза, а выход высокомолекулярных углеводородов (церезинов) возрастает. Возможно при таких значениях технологических параметров процесс синтеза оказывается в пределах внутридиффузионной области. В пределах давлений 1,0-2,0 МПа просматривается прогнозируемая зависимость производительности катализатора от объемной скорости синтез-газа. Соотношение н-парафины/ олефины + изо-парафины остается практически неизменным при увеличении давления в два раз ( с 1,0 до 2,0 МПа) и объемной скорости синтез-газа в три раза ( с 500 до 1500 ч-1). При давлении 2,0 МПа селективность по группам углеводородов С5-С10 и С11-С18 становится более зависимой от объемной скорости синтез -газа. Вследствие влияния диффузионных факторов увеличение давления синтез-газа смещает равновесный выход продуктов синтеза в сторону образования высокомолекулярных углеводородов, а увеличение
объемной скорости синтез-газа способствует повышению выхода легкокипящих углеводородов С5-С10.
Таблица 13.
Производительность и селективность и Со-Re катализатора в зависимости от технологических параметров синтеза.
| Vоб., Ч-1 | Р, МПа | Выход углево- дородов, нм3/ч | Состав С5+, вес.% | Селективность С5+, вес.% | W, кг С5+/ м3 кат. ч | |||||
| СН4 | С2-С4 | С5+ | Н-пара- фины | Оле-фины и изо-па рафины | С5- С10 | С11-С18 | С19+ | |||
| 500 | 10 | 23 | 20 | 70 | 80,1 | 19,9 | 43,5 | 44,3 | 12,2 | 34,8 |
| 1000 | 10 | 15 | 6 | 114 | 84,7 | 15,3 | 43,4 | 47,6 | 9,0 | 112,0 |
| 1500 | 10 | 43 | 20 | 82 | 84,1 | 15,9 | 47,8 | 41,8 | 10,4 | 123,4 |
| 500 | 20 | 15 | 5 | 80 | 86,2 | 13,8 | 49,4 | 47,6 | 3,0 | 54,2 |
| 1000 | 20 | 22 | 7 | 96 | 92,3 | 7,5 | 35,3 | 46,4 | 18,3 | 79,1 |
| 1500 | 20 | 10 | 7 | 102 | 85,5 | 14,5 | 29,7 | 58,3 | 12,0 | 152,9 |
| 2000 | 30 | 40 | 40 | 52 | 92,0 | 8,0 | 32,1 | 44,9 | 23,0 | 104,0 |
| 2500 | 30 | 65 | 26 | 39 | 91,9 | 8,1 | 38,0 | 43,1 | 18,9 | 96,9 |
На втором этапе испытаний был произведен поиск оптимальной температуры и степени переработки СО при давлении 2,0 МПа и объемной скорости синтез-газа 1500 ч-1 (рис. 4). Повышение температуры синтеза с 190 до 220 С изменяет степень переработки СО с 30 до 75 об.%. При этом возрастают выходы жидких углеводородов, метана и фракции С2-С4. Оптимальной температурой синтеза является 200 – 210 С, при которой выход жидких углеводородов достигает 100 г/м3, а выходы углеводородов С1-С4 незначительны и составляют около 10 г/м3.
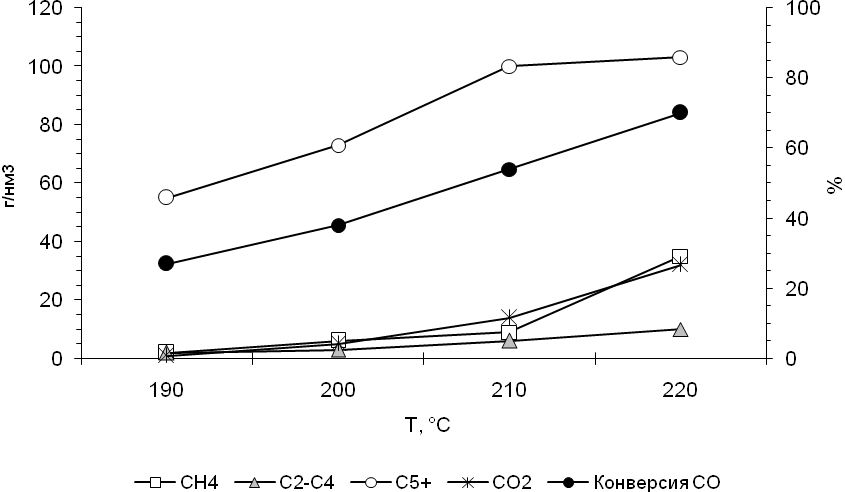
Рис.4. Влияние температуры синтеза на выходы продуктов и конверсию СО на катализаторе Со-Re (Р=2,0МПа, О.С.= 1500 ч-1).
Таким образом оптимальными параметрами для высопроизводительного селективного синтеза из СО и Н2 углеводородов дизельной фракции являются: температура 200- 210 0С, давление 2,0 МПа, объемная скорость синтез-газа 1500 ч-1, конверсия СО 50-60 %.
ФТ-синтез отличается нестационарностью активности и селективности катализаторов во времени. Для «активации» катализаторов – вывода на стационарный режим работы, требуется от 10-20 до 100-250 часов. Условия вывода на режим (температура, давление, среда, длительность,…) влияют на активность и селективность катализатора. Это обусловлено взаимным влиянием сформировавшихся в процессе приготовления катализатора активных центров и параметров пористой структуры. По нашему мнению - постепенное накопление синтезируемых углеводородов в порах стабилизирует процессы массо- и теплопереноса в зерне катализатора. Возможно, в этом также проявляется влияние диспергирования активного компонента - кобальта, которое развивается в ту или иную сторону в ходе каталитической реакции.
Для изучения процессов, происходящих в период активации Со-катализаторов, нами были проведены их испытания в следующих режимах работы:
1. Стандартный - с постепенным подъёмом температуры синтеза и контролем степени переработки синтез-газа до определенной оптимальной температуры и температуры, соответствующей оптимальной степени переработки синтез-газа (около 60%);
2. С предварительной, после восстановления, пропиткой (в соотношении 5 мл на 20 см3 катализатора) продуктами синтеза. Состав синтетических углеводородов (вес.%): С5-С10 33,3; С11-С18 54,1; С19+ 12,6. Пропитку катализаторов жидкими углеводородами проводили с среде инертного газа. Для испытаний были использованы Со-катализаторы высокопроизводительного синтеза углеводородов: Сo-Al2O3 и Co-Re-Al2O3.
Анализ полученных данных (табл. 14) показывает, что предварительная пропитка катализатора жидкими продуктами синтеза оказывает влияние на их свойства. При этом оптимальная температура синтеза снижается, а выход углеводородов С5+ возрастает. Наблюдается увеличение степени конверсии СО при достижении оптимальной температуры. Оба катализатора демонстрируют устойчивый (при 10 и 20 часах испытаний) переход к стабильным параметрам работы.
Рост выхода жидких и твердых углеводородов, стабилизация температуры синтеза и степени переработки синтез-газа обуславливаются, по видимому, взаимным влиянием формирующихся в процессе приготовления активных центров катализатора и параметров его пористой структуры.
Таблица 14.
Результаты испытаний Со-катализаторов
| Катали-затор | Пропитка парафинами. | Т, С | Ксо, % | Выход углеводородов, г/м3 | S CH4, мол.% | S C5+, мол.% | ||
| СН4 | С2-С4 | С5+ | ||||||
| Со-Аl2O3 | Нет Да | 200 210 220 190 200* 210 200** 220** | 47 74 82 35 62 82 55 54 | 11 19 45 5 17 52 18 11 | 6 13 25 1 6 28 10 6 | 92 109 80 64 97 70 78 89 | 9 12 25 6 13 29 15 9 | 84 77 51 93 81 43 73 83 |
| Со-Re- Al2O3 | Нет Да | 170 180* 190 170 180* 190** 190** | 54 67 80 51 75 82 83 | 5 13 39 5 9 27 19 | 2 8 20 2 6 19 11 | 97 107 86 92 129 107 128 | 4 9 32 5 5 15 10 | 93 82 56 93 92 67 80 |
* - Оптимальная температура.
** - Стабильная работа катализатора (при 10 и 20 часах работы соответственно).
Формирование активных центров, содержащих мелкие кристаллиты кобальта, часто наноразмера, продолжается в ходе синтеза в зависимости от температуры и осложняется возможными местными перегревами в трубках реактора. Характер пористой структуры катализатора формирует потоки: 1) поток в трубке реактора – газообразные реагенты – активная поверхность катализатора; 2) активная поверхность катализатора – продукты синтеза – поток в трубке реактора; 3) тепловой обмен: активная зона катализатора – поток в трубке реактора. Когда эти процессы: окончательного формирования размеров кристаллитов кобальта и формирование потоков массо- и теплопереносов заканчиваются, тогда и стабилизируются технологические параметры синтеза (температура, степень переработки синтез-газа, активность, селективность и производительность катализатора). На примере катализатора Со-Al2O3 можно наблюдать, что в начальный период активации на катализаторе, пропитанном жидкими углеводородами, происходит повышенное образование легких ( С1-С4) углеводородов ( рис. 5 и 6).
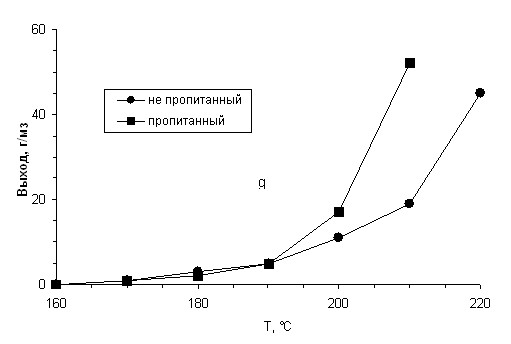
Рис.5. Зависимость выхода СН4 от температуры синтеза
(Со- Al2O3 – катализатор).

Рис. 6. Зависимость выхода углеводородов С2-С4
от температуры синтеза (Со-Аl2O3 – катализатор).
Это происходит из-за того, что в период формирования потоков массо- и теплопереноса и стабилизации работы активных центров, преимущественно образуются углеводороды с короткой цепью. На катализаторе, не пропитанном жидкими углеводородами, они образуются для формирования потоков массо- и теплопереносов. Катализатор предварительно обработанный жидкими углеводородами, начинает раньше стабилизировать работу своих активных центров и активнее синтезирует газообразные углеводороды в начальный период.
Кристаллиты кобальта способны агломерироваться на поверхности носителей при высокой температуре и при этом площадь их поверхности уменьшается. Способность кристаллитов кобальта к агломерации, температура при которой этот процесс начинается, в значительной мере определяется составом катализатора, например наличием промоторов и методом его приготовления. Однако уменьшение поверхности активного компонента катализатора вследствие агломерации частиц кобальта, может происходить и в результате локальных перегревов катализатора в процессах его приготовления (особенно восстановления) и в период активации. Анализ влияния температуры термообработки на состояние активных центров и основные показатели синтеза углеводородов был проведен для пропиточных катализаторов, выбранных ранее для высокопроизводительного синтеза: Со- Al2O3 и Co- Re- Al2O3. Предварительное прокаливание катализаторов при температурах 400, 450 и 500 0С привело к изменению дисперсности кобальта, хотя для катализатора, промотированного рением, повышение температуры прокаливания с 400 до 500 0С не оказало такого же воздействия как для катализатора Co-Al2O3 (табл. 15).
Таблица 15.
Изменение физико-химических характеристик Со- катализаторов
при их прокаливании в токе Не.
| Катали-затор. | Тпрокал. | RCo, %. | S Co, м2/г. | Ds, % | D, нм. |
| Сo-Al2O3 Co-Re- Al2O3 | - 400 450 500 - 400 450 500 | 98,6 68,0 67,0 60,0 96,8 85,0 88,0 93,0 | 9,4 6,0 5,2 4,3 9,9 12,2 12,0 12,0 | 7,6 7,0 6,2 5,7 8,1 11,4 10,7 10,2 | 13,2 14,2 16,1 17,6 12,4 8,8 9,3 9,8 |
Предварительное прокаливание оказало большое влияние на основные показатели высокопроизводительного ( давление 2,0 МПа, объемная скорость синтез-газа 1500 ч-1) синтеза ( табл. 16).
Таким образом установлено, что анализ зависимости дисперсности кобальта в Со- катализаторах от температуры предварительного прокаливания может позволить прогнозировать стабильность их работы во времени.
Таблица 16.
Показатели синтеза в зависимости от температуры прокаливания
Со- катализаторов.
| Катализатор | Т прокал, С | Т, С | Ксо, % | Выход углеводородов, г/нм3 | S CH4, Мол.% | SC5+, Мол.% | |||
| СН4 | С2-С4 | С5+ | |||||||
| Со- Al2O3 Co-Re- Al2O3 | - 400 450 500 - 400 450 500 | 210 220 260 270 260 270 240 250 200 210 210 220 210 220 230 200 210 | 55 65 62 77 54 63 35 100 46 61 30 99 20 31 100 8 100 | 18 42 42 57 37 54 14 95 7 12 35 114 9 23 129 4 125 | 10 15 8 12 7 11 3 14 4 11 13 15 1 3 7 2 8 | 87 81 80 86 71 62 58 74 81 105 18 55 32 40 47 13 52 | 14 27 28 31 28 36 17 39 6 8 49 49 19 31 55 21 53 | 77 61 61 53 62 46 78 35 85 81 29 27 78 63 23 79 25 | |
Для обоих катализаторов с повышением температуры прокаливания уменьшается выход и селективность по жидким углеводородам (С5+) и, соответственно, возрастает образование газообразных углеводородов, повышается температура синтеза (рис. 7 и 8). В низкотемпературном процессе (180–220°С) на обычных кобальтовых катализаторах может быть получена широкая углеводородная фракция, преимущественно парафины нормального строения и небольшое количество олефинов. Применение бифункциональных Co-цеолитных катализаторов позволяет существенно увеличить выход изопарафинов. Важной особенностью рассматриваемых катализаторов является практически полное отсутствие в продуктах синтеза углеводородной фракции С11+ и преобладание бензиновой фракции С5–С10 (табл.17 ). По нашему мнению это объясняется эффектом формоселективности цеолитных носителей.
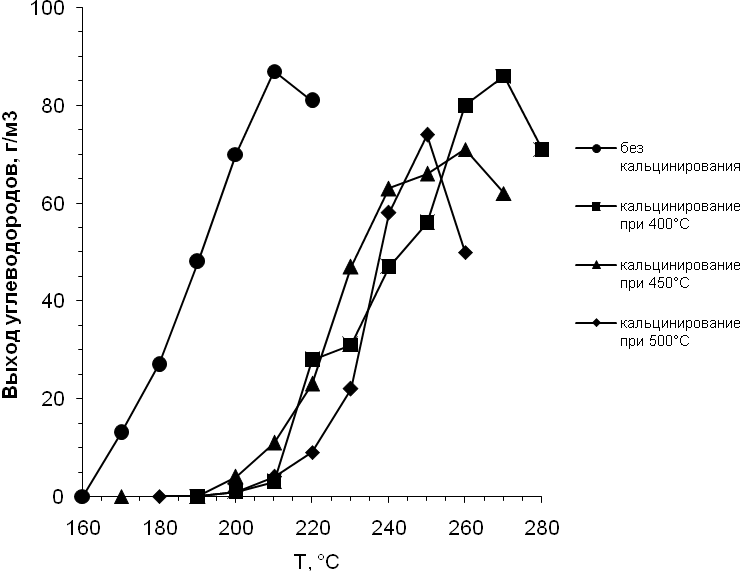
Рис. 7. Выход углеводородов С5+ в зависимости от температуры
синтеза (Co-Al2O3 - катализатор).

Рис. 8. Выход углеводородов С5+ в зависимости от температуры
синтеза (Co-Re-Al2O3 - катализатор).
Таблица 17.
Каталитическая активность образцов Co/цеолит
(Р=0,1 МПа, Т=190°, О.С. 100 ч–1).
| Цеолит | Tопт, °C | К СО, % | Выходы, г/м3 | |||
| CH4 | C2–C4 | C5+ | C11+ | |||
| ZL5100 | 200 | 42 | 18 | 8 | 66 | 1 |
| ZL5150 | 200 | 50 | 20 | 10 | 79 | 3 |
| ZL 5200 | 210 | 45 | 30 | 18 | 54 | 2 |
На аналогичных по приготовлению контактах на традиционных носителях, например -Al2O3 и SiO2, в тех же условиях (Р=0.1 МПа, Т=190–220°С) получаются углеводороды со значительным содержанием дизельной фракции и твердых парафинов. Для сравнения нами был приготовлен и испытан в тех же условиях контакт Co/-Al2O3. Содержание фракции С5–С10 в жидких продуктах синтеза составило для него 39%. Изученные контакты обладают исключительно высокой изомеризующей способностью. Содержание изопарафинов в жидких углеводородах синтеза увеличивается в ряду Co/-Al2O3 (12%) << Co/ZL5150 (65%) < Co/ZL5200 (69%) < Co/ZL5100 (81%). Содержание изопарафинов максимально во фракции С8–С12 и несколько снижается с ростом длины цепи (рис.9)

Рис. 9. Массовая доля изопарафинов в синтетических углеводородах на катализаторах Co/ZL5100 (1), Co/ZL5150 (2) и Co/ZL5200 (3).
Изомеризующая способность контактов оказалась пропорциональна их общей кислотности, определенной по объему хемосорбированного аммиака (рис. 10).

Рис.10. Зависимость содержания изопарафинов в продуктах синтеза
от общей кислотности образцов Co/цеолит.
Нетипичный вид молекулярно-массового распределения продуктов объясняется распадом нестабильных ненасыщенных интермедиатов на кислотных центрах цеолитов.
Изменение давления и объемной скорости синтез-газа оказало большое влияние на содержание изопарафинов в продуктах синтеза и выходы разных групп углеводородов (рис.11 и 12)
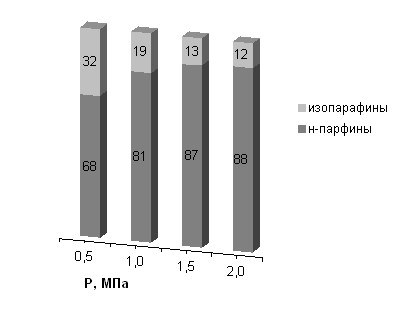
Рис.11. Зависимость содержание изопарафинов в продуктах синтеза (О.С. 1500 ч-1, Со-ZL5150 - катализатор).

Рис.12. Зависимость выходов углеводородов (г/м3) С5+ и СН4 от давления (Со-ZL5150 – катализатор).
По нашему мнению и в этом случае наблюдается влияние диффузионных факторов. Изменение значений технологических параметров синтеза (давление, температура и объемная скорость синтез-газа) при определенных характеристиках пористой структуры (объем и диаметр пор) приводит к изменению диффузионной области процесса синтеза, а это, в свою очередь, изменяет активность и селективность. Изменение селективности подтверждается и составом получаемых углеводородов. С повышением давления резко уменьшается доля изопарафинов в получаемых продуктах.
Используя выявленные закономерности влияния диффузионных факторов на активность и селективность Со-катализаторов, нами была создана малостадийная технология переработки природного газа в синтетические дизельные, бензиновые и реактивные топлива на малогабаритных установках. Разработанный процесс включает в себя последовательно две основные стадии:
1. Получение синтез-газа, осуществляемое комбинированной (Н2О/СО2) конверсией метана (Р »1 МПа, Т = 750 – 850С), обеспечивающей высокую степень конверсии и тонкую регулировку состава синтез-газа.
2. Высокоселективный синтез Фишера-Тропша (Р»1 МПа, Т = 180–200С), позволяющий непосредственно в однопроходном процессе получать высокие выходы фракций углеводородов С7-С20.
Промышленные испытания предлагаемой технологии и катализатора были проведены на Новочеркасском заводе синтетических продуктов (НЗСП) на опытно-промышленной установке (ОПУ) (рис.3). Для синтеза использовался синтез-газ, полученный на ОПУ конверсии (состав синтез-газа см. таб.18). Для испытаний использовался катализатор состава (вес.части): 100 Со- 10,0 MgO- 200 носитель ( бентонит + цеокар 2, 1:1)
Длительные (720 часов) испытания при О.С.= 300 ч-1, Р = 1,0 МПа, Т = 180-185 С показали эффективность данной технологии и катализатора. Анализ жидких углеводородов из емкости сбора продуктов продемонстрировал высокое содержание фракции жидких углеводородов, соответствующей дизельному топливу (рис. 13)

Рис. 13. Хроматографический анализ жидких углеводородов.
Определено (табл.18), что содержание в жидких углеводородах фракции, соответствующих дизельному топливу, составило 78,4 %.
При использовании данной технологии:
- не требуются традиционные блоки гидрооблагораживания дизтоплива (гидрокрекинг, гидростабилизация, гидроизомеризация и т.д.),
- возможно исключение блока ректификации.
Таблица 18.
Материальный баланс процесса синтеза углеводородов.
ПРИХОД
| Компоненты | нм3/ч | об.% | кг/ч |
| Синтез-газ: СО Н2 СН4 N2 CO2 | 2500 785,0 1610,0 5,0 25.0 75,0 | 100,0 31,4 64,4 0,2 1,0 3,0 | 1307,1 981,3 143,6 3,6 31,3 147,3 |
| ВСЕГО, кг | 1307,1 | ||
РАСХОД
| Газ | Жидкие продукты | |||||
| Компоненты | нм3/ч | об.% | кг/ч | Наименование | масс.% | кг/ч |
| 1.Остаточ-ный газ: СО Н2 СН4 N2 CO2 2.Газообраз-ные углеводоро-ды (С2-С5) | 413,1 75,9 159,5 63,4 9,5 87,5 17,3 | 100,0 18,37 38,61 15,35 2,30 21,18 4,19 | 372,78 94,93 14,24 45,26 11,88 171,84 34,63 | 1.Жидкие углеводороды в т.ч.: - дизтопливо - бензин - высокомо-лекулярные углеводороды. 2.Реакционная вода. | 100 78,4 19,6 2,0 | 381,75 305,40 76,35 7,79 546,77 |
| ИТОГО, кг | 372,78 | 936,31 | ||||
| ВСЕГО, кг 1309,09 | ||||||
Получаемое топливо характеризуется по сравнению с нефтяным дизельным топливом ( показатели по ГОСТ 305-82) высокими экологическими характеристиками : содержание меркаптановой серы (масс.%) – 0,002 ( нефтяное не более 0,01), содержание смол (мг/100 см3) – 0,5 (нефтяное не более 30-40).
В главе пять для оптимизации технологических параметров синтеза и оценки активности и селективности катализаторов представлены данные по разработанной математической модели процесса синтеза углеводородов из СО и Н2 в трубчатом реакторе с неподвижным слоем катализатора.
Математическая модель кинетики процесса состоит из двух уравнений:
- скорости химической реакции rx (1)
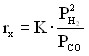 (1),
(1),
где K – константа скорости суммарной реакции; ![]() парциальные давления Н2 и СО соответственно;
парциальные давления Н2 и СО соответственно;
- распределения образующихся в синтезе углеводородов по молекулярным массам (распределение Андерсона-Шульца-Флори – АШФ) (2)
![]() , (2),
, (2),
где Cn – массовая доля углеводорода с числом углеродных атомов n; – коэффициент АШФ, зависящий от природы катализатора и условий проведения процесса.
Процесс на зерне катализатора описывается следующей системой дифференциальных уравнений (3):
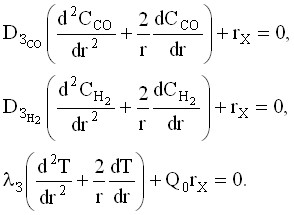 (3),
(3),
где ![]() и
и ![]() - эффективные коэффициенты диффузии СО и Н2; З – эффективный коэффициент теплопроводности зерна; r –радиус зерна; rX – скорость химической реакции;
- эффективные коэффициенты диффузии СО и Н2; З – эффективный коэффициент теплопроводности зерна; r –радиус зерна; rX – скорость химической реакции; ![]() ,
, ![]() - концентрации СО и Н2; Т – температура; Q0 – тепловой эффект реакции.
- концентрации СО и Н2; Т – температура; Q0 – тепловой эффект реакции.
Допустив, что коэффициенты диффузии и теплопроводности, скорость потока и теплоемкость меняются по слою незначительно, и перейдя к безразмерным координатам  и
и ![]() , где R0, L – радиус и длина слоя, получили систему уравнений (4), описывающих слой катализатора:
, где R0, L – радиус и длина слоя, получили систему уравнений (4), описывающих слой катализатора:
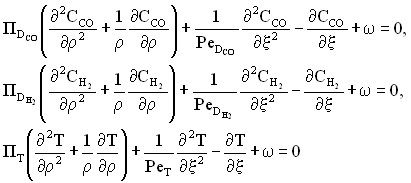 , (4)
, (4)
где 

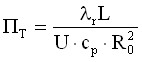 - параметры радиального массо- и теплопереноса;
- параметры радиального массо- и теплопереноса; 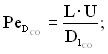
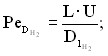
 - параметры продольного массо- и теплопереноса;
- параметры продольного массо- и теплопереноса; 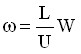 .
.
Для решения полученной системы дифференциальных уравнений (1-4) использовался сеточный метод. Алгоритм решения был реализован на ЭВМ с помощью среды визуального программирования Delphi 6.
Нами была произведена оценка адекватности математической модели синтеза углеводородов из СО и Н2 по экспериментальным данным (К синтез-газа и состав углеводородов), полученным в лабораторном реакторе (табл.19 и рис.14).
Таким образом показано, что результаты, рассчитанные на основе модели с высокой степенью точности (значение функции корреляции превышает 0,97) соответствуют полученным экспериментальным данным.
Таблица 19.
Оценка адекватности модели по распределению углеводородов - значению уравнения Андерсона-Шульца-Флори
| Давление,МПа | Температура, 0С | Корреляция. | |||||
| 190 | 200 | 210 | 220 | 230 | 240 | ||
| P=1,0 | 0,85 | 0,84 | 0,84 | 0,82 | 0,81 | 0,80 | 0,994 |
| PМ=1,0 | 0,85 | 0,84 | 0,83 | 0,81 | 0,80 | 0,78 | |
| P=1,5 | 0,87 | 0,86 | 0,85 | 0,84 | 0,84 | 0,83 | 0,988 |
| PМ=1,5 | 0,87 | 0,86 | 0,85 | 0,84 | 0,83 | 0,82 | |
| P=2,0 | 0,90 | 0,89 | 0,87 | 0,86 | 0,85 | 0,84 | 0,996 |
| PМ=2,0 | 0,89 | 0,88 | 0,87 | 0,86 | 0,85 | 0,84 | |
Индекс «м» - данные, полученные при моделировании.

Рис. 14. Оценка адекватности по степени переработки синтез-газа (К)
при объемной скорости V=1500 ч-1
Заключение и выводы.
- На основании изучения процесса синтеза углеводородов из СО и Н2 на кобальтовых катализаторах впервые определено, что получение жидких и твердых углеводородов связано с наличием различных диффузионных стадий процесса.
- Образование жидких углеводородов лимитируется внешнедиффузионными, а твёрдых углеводородов (церезина) – внутридиффузионными ограничениями. Таким образом теоретически и экспериментально обоснована зависимость селективности и производительности катализаторов синтеза углеводородов по жидким и твёрдым углеводородам от параметров их пористой структуры и технологических (давление, температура и скорость синтез-газа) параметров процесса. Регулирование параметров пористой структуры катализаторов путем подбора носителей и использования различных методов приготовления, а также изменение технологических параметров синтеза позволит создавать условия для снятия диффузионных ограничений и будет способствовать увеличению активности и селективности катализаторов.
- Предположено, что продолжение формирования активных центров Со- катализаторов в начальный период их активации обусловлено взаимным влиянием компонентов катализатора и его пористой структуры, влияющей на формирование и регулирование процессов массо- и теплопередачи.
- Систематически изучен синтез углеводородов из СО и Н2 при давлении (до 3,0 МПа) и объемной скорости ( до 2500 ч-1) синтез- газа в присутствии высокопроизводительных Со-Al2O3 катализаторов, приготовленных с использованием различных промоторов.
- Разработана математическая модель процесса синтеза углеводородов, учитывающая массо- и теплоперенос на микро ( гранулы катализатора) и макроуровнях ( объем катализатора, размеры реактора синтеза). Модель позволяет прогнозировать характеристики процесса как в стационарном, так и в нестационарном состояниях.
- Разработаны составы, определены физико-химические характеристики кобальтовых катализаторов, обеспечивающих высокую производительность (153 кг жидких углеводородов/ м3 катализатора в час) и селективность по фракции углеводородов, соответствующей дизельному топливу (58 %) или бензину (85%), в сочетании с повышенными эксплуатационными (стабильность, прочность) и экономическими показателями, в том числе:
- катализатор с использованием природных носителей, селективный по твердым углеводородам ( церезину);
- катализатор, приготовленный с использованием цеолитов, высокоселектовный в производстве бензинов;
- катализатор, промотированный рением, высокопроизводительный и селективный в синтезе фракции жидких углеводородов, соответствующей дизельному топливу;
- катализаторы, промотированные Pt и Re, Pd и Re, высокопроизводительные и селективные в синтезе фракции жидких углеводородов, соответствующей дизельному топливу.
- На основе полученной математической модели процесса синтеза углеводородов, разработано программное обеспечение для оптимизации технологических параметров процесса в стационарном и нестационарном состояниях.
- Разработаны рекомендации и предложена методика прогнозирования продолжительности активной работы кобальтовых катализаторов.
- Разработаны технические решения и предложены катализаторы для малогабаритных мобильных установок по переработке природного газа в моторное топливо.
Cписок публикаций.
- А.С. 1785125 СССР, МКИ ВО1 23/78. Катализатор синтеза углеводородов из оксида углерода и водорода / Савостьянов А.П., Бакун В.Г., Миклухина О.В., Межов В.Д., Лопаткина С.А., Будцов В.С., Овчинников В.А. № 4853207/04; Заявл. 17.07.90. Опубли 12.92.. Бюл. №48.
- Лапидус А.Л., Будцов В.С.. Савостьянов А.П., Крылова А.Ю., Межов В.Д., Бакун В.Г. Влияние физико-химических характерискик на свойства Со-катализаторов синтеза углеводородов из СО и Н2 // Нефтехимия. – 1991. – Т.31, №5. –С. 626-629.
- Лапидус А.Л., Межов В.Д., Будцов В.С., Крылова А.Ю., Савостьянов А.П. Катализаторы синтеза углеводородов из СО и Н2 с использованием природных носителей // Химические синтезы на основе одноуглеродных молекул. Тез. Докл. III Всесоюзной. Конф.: М.. 1991. –С73.
- Лапидус А.Л., Будцов В.С., Савостьянов А.П., Крылова А.Ю. Использование природных носителей для катализаторов синтеза углеводородов // Нефтехимия. -1991.-№10. –С87-91.
- Лапидус А.Л.. Будцов В.С., Крылова А.Ю., Овчинников В.А., Савостьянов А.П., Межлв В.Д. Влияние природы носителя Со-катализатора на синтез углеводородов из СО и Н2 // ХTT. -1994. – №4,5. –С. 81-84.
- Батенин В.М., Будцов В.С., Каган Д.Н., Крылова А.Ю., Лапидус А.Л., Пехота Ф.Н., Радченко М.Н., Седых А.Д., Щпильрайн Э.Э. Малостадийная технология производства синтетического моторного топлива из синтез-газа полученного газификацией угля или конверсией шахтного метана // Химия и природосберегающие технологии использования угля: Сб. Тр. Межнунар. науч. конфер. – Звенигород, - 1999 –С.36-39.
- Крылова А.Ю., Будцов В.С., Цапкина М.В., Лапидус А.Л. Влияние состава синтез-газа на процесс получения углеводородов из СО и Н2 на Со- катализаторе // ХTT. -2000. -№1. –С3-7.
- Батенин В.М., Будцов В.С., Каган Д.Н., Крылова А.Ю., Лапидус А.Л., Пехота Ф.Н., Радченко М.Н., Седых А.Д., Шпильрайн Э.Э. Результаты испытаний и экономические оценки малостадийной технологии по лучения синтетического дизельного топлива из синтез-газа // Химия угля на рубеже тысячелетий: Сб. Тр. Междунар. Науч. конфер. И шк.- семин. ЮНЕСКО. – Клязьма. – 2000 –С59-62.
- Савостьянов А.П., Бакун В.Г., Будцов В.С., Таранушич В.А. Влияние диффузии на протекание процесса синтеза углеводородов из СО и Н2 // ХTT. -2001. -№3. –С. 78-84.
10. Савостьянов А.П., Будцов В.С., Таранушич В.А. Определение области протекания процесса синтеза Фишера-Тропша // Современные проблемы химической технологии неорганических веществ: Сб. Науч. тр. Междунар. науч.-техн.конфер.- Одесса, - 2001 – С. 137-140.
- Будцов В.С., Каган Д.Н., Кречетова Г.А., Крылова А.Ю., Лапидус А.Л. Материальный баланс процесса синтеза жидких углеводородов из синтез-газа как продукта газификации углей или конверсии природного газа // Перспективы развития углехимии и химии углеродных материалов в 21 веке. Тез. Докл. Расширенного заседания Научного совета РАН. – Звенигород, - 2003 –С 22.
- Савостьянов А.П., Бакун В.Г., Будцов В.С., Высочин Н.В. Селективный синтез жидких и твердых углеводородов из оксида углерода и водорода. – Юж.-Рос.гос.техн.ун-т (НПИ).-Новочеркасск, 2005.- 164 с.
- Каган Д.Н., Будцов В.С., Кречетова Г.А., Лапидус А.Л., Шпильрайн Э.Э. Оценка экономической эффективности процесса синтеза жидких углеводородов из синтез-газа как продукта газификации угля или конверсии природного газа. Перспективы развития углехимии химии углеродных материалов в 21 веке. Сб. Тезисов Конф. России и стран СНГ. – Звенигород, - 2005 –С89.
- Лапидус А.Л., Будцов В.С. Применение промотированных кобальтовых катализаторов для синтеза углеводородов из СО и Н2.// ХTT. – 2005. -№6. – С.12-14.
- Будцов В.С., Кули Т.Е., Лапидус А.Л., Елисеев О.Л. Высокопроизводительный синтез углеводородов из СО и Н2 на Со-катализаторах с природными носителями.// ХTT. – 2006. -№1. – С 65-69.
- Лапидус А.Л., Будцов В.С., Кули Т.Е., Елисеев О.Л., Казанцев Р.В. Оптимальные параметры селективного синтеза углеводородов дизельной фракции из СО и Н2 на Со-Re-Al2O3-катализаторе.// ХТТ.- 2006.- №6.-С.37-42.
- Савостьянов А.П., Бакун В.Г., Будцов В.С., Высочин Н.В. Синтез жидких и твёрдых углеводородов из оксида углерода и водорода./ Материалы международной науч.-практ. конф. «Современные проблемы органического синтеза, электрохимии и катализа», - Караганда. – 2006 г. – С. 121-124.
- Савостьянов А.П., Будцов В.С., Высочин Н.В. Влияние технологических параметров на селективность синтеза углеводородов из СО и Н2./ Материалы конференции « Перспективы развития химической переработки горючих ископаемых». Санкт-Петербург. - 2006. - С.59.
- Лапидус А.Л., Будцов В.С., Кули Т.Е., Елисеев О.Л., Тишкова Л.А. Промотирование благородными металлами Со-Al2O3 катализаторов синтеза углеводородов из СО и Н2.// ХТТ.-2007.- №1. - С.31-32.
- Лапидус А.Л., Будцов В.С. Патент № 2297879 «Способ получения катализатора для синтеза алифатических углеводородов С5-С10 из СО и Н2.» Бюл.№12, 27.04.2007.
- Лапидус А.Л., Елисеев О.Л., Волков А.С., Будцов В.С., Кули Т.Е., Давыдов П.Е. Высокоселективные Со-цеолитные катализаторы синтеза изопарафинов. // ХТТ.- 2007.- №3.- С.16-20.
- Савостьянов А.П., Будцов В.С., Высочин Н.В., Лапидус А.Л. Оптимальное управление селективностью и производительностью синтеза углеводородов из СО и Н2. // ХТТ. – 2007.- №6. - С.60-66.
- Лапидус А.Л., Будцов В.С., Елисеев О.Л., Ерофеев Прогнозирование стабильности Со-катализаторов синтеза углеводородов из СО и Н2 путем изучения устойчивости кристаллитов кобальта к агломеризации. // ХТТ. – 2007. -№6. – С.15-18.
- Елисеев О.Л., Волков А.С., Будцов В.С., Лапидус А.Л. Высокоселективные Со-цеолитные катализаторы синтеза изопарафинов из СО и Н2. // Докл. РАН. – 2007. Т. 413, №4. – С.1-3.
- Лапидус А.Л., Будцов В.С., Елисеев О.Л., Цапкина М.В.
Предварительная обработка Со-катализаторов синтеза углеводородов из СО и Н2.// XTT. – 2008. - №1. – С.19-22.
26. Лапидус А.Л., Будцов В.С., Елисеев О.Л., Волков А.С. "Влияние давления на активность и селективность Со-цеолитных катализаторов синтеза углеводородов из СО и Н2.// XTT.- 2008. - №. – С.
27. Лапидус А.Л., Будцов В.С., Савостьянов А.П., Высочин Н.В. Оценка адекватности математической модели синтеза Фишера-Тропша в трубчатом реакторе с неподвижным слоем кобальтового катализатора. // ХТТ. – 2008. - №5. – С.

