Взаимодействие пентахлорида молибдена с ацетиленом – новый способ синтеза наноразмерных композиционных материалов
На правах рукописи
Паршаков АРТЕМИЙ СТЕПАНОВИЧ
ВЗАИМОДЕЙСТВИЕ ПЕНТАХЛОРИДА МОЛИБДЕНА
С АЦЕТИЛЕНОМ – НОВЫЙ СПОСОБ СИНТЕЗА
НАНОРАЗМЕРНЫХ КОМПОЗИЦИОННЫХ МАТЕРИАЛОВ
02.00.01 - неорганическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Москва - 2010 г.
Работа выполнена в Учреждении Российской Академии Наук
Институте общей и неорганической химии им. Н.С. Курнакова
Научный руководитель: доктор химических наук, профессор
Ильин Евгений Григорьевич
Официальные оппоненты: доктор химических наук, профессор
Губин Сергей Павлович
доктор химических наук
Кобрянский Валерий Михайлович
Ведущая организация: Московский государственная
академия тонкой химической
технологии им. М.В. Ломоносова
Защита диссертации состоится «22» декабря 2010 г. в 11.00 часов на заседании диссертационного совета Д 002.021.01 при Институте общей и неорганической химии им. Н.С. Курнакова РАН по адресу: 119991, г. Москва, Ленинский проспект, д. 31.
С диссертацией можно ознакомиться в библиотеке Института общей и неорганической химии им. Н.С Курнакова РАН.
Автореферат разослан «22» ноября 2010 г.
Ученый секретарь
диссертационного совета Д 002.021.01
кандидат химических наук
 Н.Б. Генералова
Н.Б. Генералова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. В настоящее время интерес исследователей проявляется к новому типу материалов – органо-неорганическим композитам, в которых полимерная матрица содержит включения наноразмерных частиц металла, диэлектрика или полупроводника. Такие материалы могут сочетать уникальные электрические, магнитные и каталитические свойства неорганических веществ с физико-химическими характеристиками органических материалов.
Существуют различные способы получения полимерных нанокомпозитов:
термическое разложение комплексных соединений в растворе-расплаве полимера; конденсация паров металла или комплекса на полимерную подложку;
капсулирование наночастиц тетрафторэтиленом; электрохимическое осаждение наночастиц на полимерах и др. Эти методы являются энергоёмкими, требуют специального оборудования и, как правило, многостадийны.
В настоящем исследовании сделана попытка разработки метода синтеза органо-неорганических композитов на основе реакций соединений переходных металлов высших степеней окисления с мономерами, которые на первой стадии выступают в качестве восстановителя, а образующиеся при этом соединения металлов в низших степенях окисления, имеющие обычно кластерное строение, являются катализаторами полимеризации мономера с образованием полимерной органической матрицы. Метод не требует затрат энергии, дорогостоящей аппаратуры и может позволить достичь равномерное распределение частиц по объёму полимерной матрицы.
В качестве объекта исследования была выбрана реакция пентахлорида молибдена с ацетиленом. Выбор MoCl5 связан с его каталитическими свойствами в процессе линейной полимеризации ацетилена с образованием транс-полиацетилена – интенсивно изучаемого материала, благодаря уникальным магнитным и электрическим свойствам. Каталитически активные комплексы в этой реакции не изучались. Считают, что катализатором является MoCl5. Мы полагали, что при взаимодействии MoCl5 с ацетиленом на первой стадии будут образовываться металлоорганические кластеры Mo низших степеней окисления, катализирующих полимеризацию ацетилена. Результатом этих реакций может быть органо-неорганический композит, содержащий кластеры Мо в полиацетиленовой матрице.
Работа выполнена в рамках Программы Президиума РАН «Разработка методов получения химических веществ и новых материалов», Подпрограмма «Создание новых конструкционных и функциональных материалов на базе нанотехнологий».
Цель работы – разработка метода синтеза органо-неорганических композитов на основе реакций высших галогенидов переходных металлов с ацетиленом на примере изучения продуктов его реакции с MoCl5. Проверка возможности применения этого метода для переходных металлов других групп на примере NbCl5.
Научная новизна
1.Предложен новый метод синтеза органо-неорганических композитов -наноразмерные кластеры переходных металлов в органической матрице - путём реакций соединений переходных металлов высших степеней окисления с мономерами, которые на первой стадии выступают в качестве восстановителя, а образующиеся при этом кластеры металлов низших степеней окисления катализируют полимеризацию мономера с образованием органической матрицы.
2.Впервые современными методами химического и физико-химического анализа проведено систематическое исследование продуктов реакции пентахлорида молибдена с ацетиленом. Установлено, что при взаимодействии MoCl5 с ацетиленом в неполярных средах происходит выделение HCl, понижение степени окисления молибдена и образование металлоорганических наноразмерных кластеров, в которых методом EXAFS-спектроскопии обнаружены два расстояния Mo-Mo. В координационной сфере Мо имеются два неэквивалентных атома хлора и атом углерода. На основании результатов MALDI-TOF масс-спектрометрии сделано заключение, что кластер молибдена имеет 12 или 13-атомный металлический остов и его состав может быть выражен формулами [Mo12Cl24(C20H21)] или [Mo13Cl24(C13H8)].
4. Совокупность результатов ИК-, Raman-, MAS ЯМР-13С- и РФЭС позволила сделать вывод что органическая часть композита представляет собой полиацетилен транс-трансоидальной структуры. Полимерные цепи сшиты, а наряду с сопряжёнными двойными связями, присутствуют линейные фрагменты кумулированных двойных -HC=C=CH- и тройных -CC- связей.
5. Впервые изучены продукты реакции NbCl5 с ацетиленом и показана возможность применения предложенного метода для синтеза органо-неорганических композитов, содержащих в органической матрице кластеры переходных элементов не только VI, но других групп периодической системы.
Практическая значимость
Предложен метод синтеза органо-неорганических композитов – кластеров переходных металлов в полиацетиленовой матрице, которые могут быть использованы как прекурсоры для создания функциональных материалов, химических сенсоров и катализаторов. Процесс термического разложения Мо композита может служить альтернативой алкоксидному способу получения наноразмерных оксидов молибдена на мелкодисперсной углеродной матрице.
На защиту выносятся:
- Результаты изучения продуктов взаимодействия MoCl5 и NbCl5 с ацетиленом в неполярных растворителях и, в случае NbCl5, при непосредственном взаимодействии компонентов, их морфология, размерность, состав и строение по данным сканирующей и просвечивающей электронной микроскопии, элементного анализа, РФА, РФЭС, ИК- и Raman-спектроскопии, MAS ЯМР-13C, ПМР, ЭПР, EXAFS-спектроскопии и MALDI-TOF масс-спектрометрии.
- Результаты изучения продуктов термического разложения Мо-композита методами MALDI-TOF масс-спектрометрии и ГЖХ.
- Результаты исследования физических и магнитных свойств продуктов реакций.
Апробация работы. Материалы исследований докладывались на XXIV Международной Чугаевской конференции по координационной химии (Санкт-Петербург, 2009 г.), XVI Всероссийской конференции «Структура и динамика молекулярных систем (Яльчик, 2009 г., Республика Марий-Эл), Всероссийской молодёжной конференции – школе «Идеи и наследие А.Е.Фаворского в органической и металлоорганической химии XXI века» (Санкт-Петербург, 2010г.).
Публикации. По теме диссертации опубликованы 2 научные статьи в российских журналах, определенных требованиями ВАК и 3 тезиса докладов на российских и международных конференциях.
Структура и объем диссертации. Текст диссертации состоит из введения, литературного обзора, экспериментальной части, обсуждения полученных результатов, выводов и библиографии (144 наименования). Общий объем диссертации 152 страниц, в том числе 74 рисунка и 11 таблиц.
СОДЕРЖАНИЕ РАБОТЫ
Во введении обосновывается актуальность выбранной темы, выбор объектов и цели исследований.
Глава 1. Обзор литературы
В литературном обзоре приведены способы получения и строение хлоридов молибдена и ниобия различных степеней окисления, рассмотрены свойства ацетилена как лиганда в реакциях с соединениями d-переходных металлов, обсуждаются реакции MoCl5, NbCl5 и комплексов галогенидов молибдена и ниобия с замещёнными алкинами.
Глава 2.Экспериментальная часть
В этой главе приведены методики очистки и осушки использованных в работе растворителей, методики синтеза и методы исследования продуктов взаимодействия пентахлоридов молибдена и ниобия с ацетиленом в неводных средах. Все операции, связанные с синтезом и выделением веществ, проводились в сухом боксе, в атмосфере аргона и в абсолютированных растворителях, при комнатной температуре.
Глава 3. Результаты и обсуждение
3.1. Исследование продуктов реакции MoCl5 с ацетиленом
3.1.1. Взаимодействие MoCl5 с ацетиленом в бензоле и толуоле
Непосредственного взаимодействия MoCl5 с ацетиленом при пропускании в стеклянной трубке и нагреве до 100оС не наблюдалось. Дальнейший нагрев приводил к возгонке и перекристаллизации MoCl5 в холодной части трубки.
Для получения органо-неорганических композитов с достаточно высокой концентрацией металла, в качестве исходных использовали насыщенные при комнатной температуре растворы MoCl5 в бензоле или толуоле. Через эти растворы в течение 4-6 ч пропускали ацетилен, предварительно очищенный и осушенный от воды и возможных примесей. По мере пропускания ацетилена цвет раствора менялся от тёмно-жёлто-зелёного до чёрного, раствор нагревался, превращался в гель чёрного цвета и через некоторое время температура снижалась до комнатной. Реакция сопровождалась выделением HCl. О полноте взаимодействия пентахлорида с ацетиленом судили по прекращению его выделения.
По окончании пропускания ацетилена осаждался гелеобразный осадок, его отфильтровывали в атмосфере аргона, промывали сухим растворителем и высушивали под вакуумом.
Полученные вещества – мелкодисперсные порошки чёрного цвета, нерастворимые в воде и в обычных органических растворителях.
По данным ПМР, растворы после отделения осадка представляли собой чистый растворитель, т.е. образующиеся соединения молибдена и продукты олигомеризации ацетилена соосаждались полностью.
3.1.2. Исследование состава, строение и свойства продуктов взаимодействия MoCl5 с ацетиленом
3.1.2.1. Элементный анализ, РФА, морфология, размер частиц и термическая устойчивость в вакууме
В зависимости от скорости и времени пропускания ацетилена состав продуктов несколько отличался по содержанию углерода, при этом отношение C:H сохранялось близким к единице, а Cl:Mo – близким к двум. Состав продуктов реакции в бензоле и толуоле отличался незначительно (табл.1) и был близок к MoCl1,9±0,1(C30±1H30±1).
Таблица 1. Данные элементного анализа продуктов реакции MoCl5 с ацетиленом в бензоле и толуоле.
| Раство- ритель | Содержание, масс. % | |||||||
| C | H | Cl | Mo | |||||
| Получ. | Рассч. | Получ. | Рассч. | Получ. | Рассч. | Получ. | Рассч. | |
| бензол | 65,94 | 64,67 | 5,38 | 5,38 | 11,70 | 12,73 | 16,98 | 17,22 |
| толуол | 66,23 | 5,24 | 11,87 | 16,66 | ||||
Наличие на дифрактограммах выделенных продуктов широкого максимума на малых углах позволяло предполагать рентгеноаморфное или нанокристаллическое строение полученных веществ. Методом сканирующей электронной микроскопии (СЭМ) было обнаружено, что вещества имеют низкую кристалличность и нефибриллярную морфологию (рис.1а).
а б
б
Рис.1. Микрофотографии MoCl1,9±0,1(C30±1H30±1) по данным СЭМ (а) и АСМ (б).
По результатам атомно-силовой микроскопии (АСМ) размер частиц можно оценить в пределах 1015 нм (рис.1б). С помощью просвечивающей электронной микроскопии было установлено, что минимальный размер морфологического элемента MoCl1,9±0,1(C30±1H30±1) составляет 12 нм.
По данным ДТГ вещества устойчивы и не летят в высоком вакууме и инертной атмосфере до 300оС.
3.1.2.2. Рентгеновские фотоэлектроные спектры MoCl1,9±0,1(C30±1H30±1)
С целью установления степени окисления атомов молибдена в продуктах и определения относительных концентрации и числа неэквивалентных состояний входящих в него элементов на поверхности и в объеме образца был применён метод рентгеновской фотоэлектронной спектроскопии (РФЭС). Оказалось, что вещества устойчивы в высоком вакууме и не заряжаются под пучком рентгеновского излучения, что характеризует их как слабые диэлектрики.
Найденная величина энергии связи 3d-электронов Mo на поверхности составляла 232,4 эВ и сравнима со значениями для соединений пяти- или шестивалентного молибдена (табл.2, рис.2а). Это могло быть следствием высокой дисперсности - наноразмерности вещества (рис.1) и активного взаимодействия с кислородом и влагой воздуха, в результате чего атомы молибдена поверхностного слоя за время пробоподготовки образцов окислялись до оксидов и оксохлоридов молибдена степени окисления +5 или +6. О присутствии кислорода свидетельствовала широкая линия O1s-электронов при ~ 532 эВ, соответствующая энергии связи молибден-кислород (табл.2).
Таблица 2.
Энергии связи электронов Eb (эВ) образцов MoCl1,9±0,1(C30±1H30±1)
| № | Образец | МО | Mo3d5/2 | Cl2p3/2 | O1s | C1s |
| 1 | cинтез I (в бензоле) | 5,5 12,2 17,9 24,8 | 232,4 | 198,1 199,7 | 532,0 | 284,0 285,4 286,5 288,0 |
| 2 | синтез II (в толуоле) | 5,5 12,3 18,1 – | 232,3 | 198,2 199,7 | 531,4 532,7 534,5 | 284,0 285,4 286,4 287,7 |
| 3 | образец 2, травление Ar+ - 5 мин | 16,4 | 228,5 | 198,0 199,5 | 532,0 | 284,0 |
| 4 | Mo | 228,0 | ||||
| 5 | MoO2 | 229,9 | 531,3 | |||
| 5 | MoO3 | 233,2 | 531,8 | |||
| 7 | MoOCl3(Ph3P)2 | 232,5 | 198,3 |
Для установления степени окисления молибдена в объеме образца, его поверхность была подвергнута травлению катионами аргона. В спектре поверхности после травления интенсивность линии 3d-Мо при 232,4 эВ резко уменьшалась (рис.2б), и появлялась линия 3d-электронов молибдена при 228,5 эВ, что несколько выше, чем для металлического молибдена, но существенно ниже, чем в МоO2 (табл.2). На основании этого было сделано заключение, что в продукте реакции молибден находятся в низшей степени окисления +3.
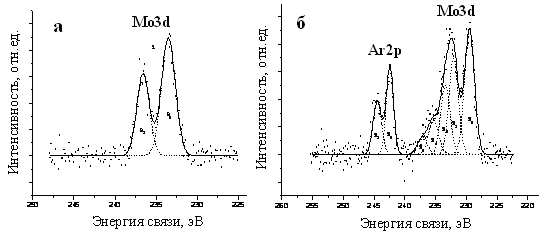
Рис. 2. РФЭС - спектры в области Mo3d-электронов: а – до травления Ar+; б – после травления Ar+.
В спектре поверхности образца после травления (рис.2 б) появлялась линия при 241,5 эВ 2p-электронов аргона. Внедрение аргона в поверхность вещества может быть связано с адсорбцией вследствие его высокой дисперсности или хемосорбцией на поверхности углеводородной матрицы. Это особенно интересно, поскольку съемка образца осуществляется в высоком вакууме.
В области энергий Cl2p-электронов (рис.3а) при 198,2 и 199,7 эВ наблюдались два перекрывающихся дублета, что свидетельствовало о наличии в продукте двух химически неэквивалентных атомов хлора (мостиковые и концевых, связанные с молибденом или углеродом). Обе линии сохранялись и после травления катионами аргона поверхности.

Рис.3. РФЭС - спектры в области Cl2p-электронов (а) и С1s-электронов (б).
Спектр C1s-электронов представлял собой интенсивную линию, на которую со стороны больших энергий связи накладывался ряд менее интенсивных, что отражает наличие химически неэквивалентных атомов углерода (рис.3б). Наиболее интенсивную линию при 284,0 эВ можно отнести к группам -СН=CH- ненасыщенных углеводородов.
Сравнение структуры спектров С2s-электронов внутренних валентных МО полученных продуктов и структуры спектра электронов углерода C2g и С2u* ВВМО карбина[1] (рис.4) позволило заключить, что углеводородная часть вещества содержит линейные карбиновые –HС=С=СH– и –СС– фрагменты.

Рис.4. РФЭС-спектр в области C2S-электронов: MoCl1,9±0,1(C30±1H30±1) (а) и карбина (б).
Действительно, в области C2S-электронов карбина и исследованных образцов MoCl1,9±0,1(C30±1H30±1) наблюдаются два явно выраженных максимума. Разность в интенсивностях этих двух линий свидетельствует о различном вкладе электронов С2g и С2u* орбиталей в образование химической связи.
3.1.2.3. ИК- и Раман-спектроскопия, 13C и 1H ЯМР
В ИК-спектрах полученных продуктов отсутствовала полоса поглощения координированной тройной связи ацетилена (2040-2050 см-1) и наблюдались 3 характерные линии при 1012, 1287 и 3015 см-1, которые отнесены к деформационным и валентным колебаниям C-H транс-полиацетилена[2] (табл.3).
Интенсивные полосы поглощения в области 1400, 2846 и 2923см-1 отнесены к деформационным и валентным колебаниям –CH2– групп, а линия при 720 см-1 - к маятниковым колебаниям –CH2– групп, либо колебаниям связи C-Cl. Узкая полоса поглощения при 464 см-1 может свидетельствовать о наличии связи металл-углерод.
Полосы при 437, 344, 293 и 268 см-1 могут быть связаны с колебаниями связей молибден-хлор и молибден-молибден соответственно.
При хранении веществ и контакте с воздухом в ИК-спектрах наблюдалось появление полос поглощения в области 1670 и 1725 см-1, которые могут соответствовать валентным колебаниям C=O групп.
Табл.3. Полосы поглощения, наблюдаемые в ИК-спектрах полученных веществ.
| частота, см-1 | интенсивность линии | отнесение |
| 3015 | небольшая | валентные колебания С-Н транс-ПА2 |
| 1287 и 1012 | средняя | деформационные колебания С-Н транс-ПА (в плоскости и вне плоскости молекулы)2 |
| 2846 и 2923 | средняя | валентные колебания С-Н метиленовой группы |
| 1400 | большая | деформационные колебания С-Н метиленовых групп |
| 720 | небольшая | маятниковые колебания С-Н метиленовой группы или связи C-Cl |
| 1175 | небольшая | валентные колебания С-С2 |
| 464 | небольшая | деформационные колебания связи Mo-C |
| 437, 344, 293 и 268 | небольшая | колебания связи Mo-Cl |
В спектре комбинационного рассеяния MoCl1,9±0,1(C30±1H30±1) (рис.5) наиболее интенсивные линии при 1480 см-1 и 1100 см-1 были отнесены к валентным колебаниям сопряжённых двойных и одинарных углеродных связей транс-полиацетилена[3].

Рис.5. Raman-спектр MoCl1,9±0,1(C30±1H30±1).
Поскольку увеличение длины сопряжённых участков отражается в уменьшении частоты колебаний двойных связей в диапазоне 14001500 см-1, наблюдаемый сдвиг в высокочастотную область может указывать на небольшое число блоков сопряжения. Широкая полоса поглощения при 2200 см-1 может быть связана с присутствием тройных –CC– или кумулированных связей =С=С=, что согласуется с результатами, полученными методом РФЭС.
Линии в области 2900-3000 см-1 отнесены к валентными колебаниями C-H метиленовых групп и валентными колебаниями C-H транс-полиацетилена, а широкая линия при 2600 см-1 - к группам RC-OH в результате частичного гидролиза продуктов.
Поскольку химические сдвиги 13С цис- (126129 м.д.) и транс-изомеров полиацетилена (136139 м.д.) существенно различаются[4], наблюдаемый в спектре MAS ЯМР-13С полученных продуктов сигнал при 137,9 м.д. (рис.6а) подтверждает, что углеводородная часть MoCl1,9±0,1(C30±1H30±1) представляет собой транс-полиацетилен.
а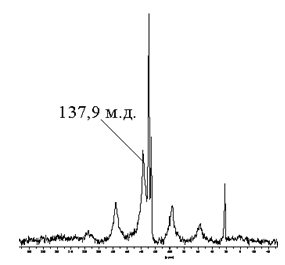 б
б 
Рис.6. Спектры MAS ЯМР-13С (а) и ЯМР-1H (б) MoCl1,9±0,1(C30±1H30±1).
Методом ПМР (рис. 6 б) было установлено наличие нескольких типов протонов в полученных продуктах. Основная часть протонов (в спектре им отвечает широкая линия) отнесена к атомам водорода полиацетиленовой матрицы. Два узких сигнала при 8,76 и 1,82 м.д. могут быть отнесены к “кислым” протонам, например, в группах -CCH и к атомам водорода метиленовых групп, присутствие которых в структуре полимера подтверждено методом ИК-спектроскопии.
3.1.2.4. EXAFS-спектры MoCl1,9±0,1(C30±1H30±1)
Доказательства присутствия в продуктах реакции MoCl5 с ацетиленом кластеров были получены методом EXAFS-спектроскопии. Установлены два значения межатомных расстояния Mo-Mo, равные 2,58 и 2,83 (табл.4).
Основной вклад в экспериментальный EXAFS-спектр (рис.7) дают два расстояния – молибден-углерод и молибден-хлор. В координационной сфере атомов молибдена находится атом углерода на расстоянии 1,71, что может свидетельствовать об образовании связи повышенной кратности, и атомы хлора на расстоянии 2,37. Наблюдаемое более низкое, по сравнению с предполагаемым на основании химического анализа продукта, число атомов хлора на атом молибдена, можно объяснить предположением о том, что расстояния Мо-Cl различаются незначительно, в пределах 0,1 и их сигналы интерферируют и частично гасят друг друга. Действительно, наличие в веществе химически неэквивалентных состояний ионов хлора было также установлено при изучении РФЭС MoCl1,9±0,1(C30±1H30±1). Нельзя также исключить, что этой области расстояний могут отвечать и длины ординарных связей молибден-углерод.

Рис.7. EXAFS–спектр MoCl1,9±0,1(C30±1H30±1).
Табл.4.
Результаты исследования MoCl1,9±0,1(C30±1H30±1) методом EXAFS-спектроскопии
| Координационная сфера | расстояние R, | КЧ | фактор Дебая- У Уоллера, 2х104 | E0, эВ | R-фак-.. тор, % |
| Mo=C | 1.71 | 1.14 | 24.1 | 1.29 | 30.2 |
| Mo-Cl | 2.37 | 1.32 | 24.1 | ||
| Mo-Mo | 2.58 | 2.74 | 12.1 | ||
| Mo-Mo | 2.83 | 1.49 | 12.1 |
3.1.2.5. MALDI-TOF-MS – масс-спектры MoCl1,9±0,1(C30±1H30±1)
Попытка применить для изучения полученных продуктов масс-спектрометр для высокотемпературных термодинамических исследований была безуспешной, поскольку вещества устойчивы и не летят в высоком вакууме до 300оС. Поэтому, для их изучения был применен метод времяпролётной масс-спектрометрии с лазерной десорбцией-ионизацией MALDI-TOF-MS.
В MALDI-TOF масс-спектре, снятом в режиме детектирования отрицательных ионов (рис.8) наиболее интенсивные линии отвечали отрицательным ионам с отношением m/z = 2158 и 2271. Большая масса фрагментов и полученные методом EXAFS-спектроскопии доказательства присутствия в веществе связей молибден-молибден позволили прийти к заключению, что они отвечают кластерам молибдена. Симметричный изотопный состав этих линий свидетельствовал о симметричном строении отвечающим им фрагментам (рис.9а). Присутствие в масс-спектре двух основных, близких по массе крупных частиц позволяло предполагать, что они содержат одинаковый или близкий по составу и строению неорганический остов и различаются либо на фрагмент, содержащий атом молибдена, либо только углеводородными радикалами и Cl-. Принимая во внимание найденное в продуктах, близкое к двум, отношение Cl:Mo и тенденцию низших хлоридов молибдена к образованию кластеров, мы полагали, что металлсодержащая часть продуктов реакции представляет собой кластер (MoCl2)n(Cm±1Hq±1). Поскольку самая интенсивная линия в масс-спектре отвечала аниону с m/z = 2271, то, учитывая молекулярную массу MoCl2 = 167, число атомов молибдена в кластере может быть равным 12 либо 13. В первом случае на органическую составляющую анионного осколка приходится 267 единиц массы, во втором – 171, и им могут быть приписаны формулы [Mo12Cl24(C20H21)] или [Mo13Cl24(C13H8)] соответственно.

Рис.8. Масс-спектр MALDI-TOF-MS MoCl1,9±0,1(C30±1H30±1), зарегистрированный в режиме детектирования отрицательных ионов.
Учитывая магическое для кластеров число 13, второй вариант – Mo13 –более предпочтителен, поскольку и теоретический изотопный состав осколка [Mo13Cl24(C13H8)] лучше совпадает с экспериментальным (рис.9).

Рис.9. Экспериментальный (а) и теоретические (б, в) изотопные составы фрагмента при m/z=2271.
Аналогичным образом, для анионного осколка более чем в два раза меньшей интенсивности с m/z = 2157,73, число фрагментов MoCl2 в неорганическом остове кластерного аниона также можно предполагать равным 13 или 12. В первом случае на органическую часть приходится 58 единиц массы, а во втором – 154 и предполагаемые формулы анионного фрагмента с m/z=2157,73 - [Mo13Cl24(C4H4)] или [Mo12Cl24(C11H14)]. Как и в предыдущем случае, для 13-атомного молибденового фрагмента наблюдалось наиболее удовлетворительное соответствие теоретического изотопного состава с экспериментальным. Различие в массе образующихся осколков [Mo13Cl24(C13H8)] и [Mo13Cl24(C4H4)] может быть обусловлено отщеплением органического радикала – C9H4 – молекулярный вес которой равен 112 а.е.м., что соответствует разнице в экспериментальном спектре (2271 - 2158 = 113 а.е.м.).
Таким образом, на основании изучения масс-спектров MALDI MoCl1,9±0,1(C30±1H30±1) было сделано заключение, что основными фрагментами вещества являются 13-атомные кластеры молибдена состава [Mo13Cl24(C13H8)] и [Mo13Cl24(C4H4)].
Относительно возможной конфигурации 13 атомных кластеров молибдена, имеются теоретические расчеты металлического кластера Мо13 в предположении икосаэдрической и менее симметричной бипланарной конфигурации. Известен двухплоскостной 13 атомный кластер молибдена (+3) с кислородным окружением Мо13, охарактеризованный РСА в монокристалле Pr4Mo9O18[5]. Расстояния Мо-Мо в этом 13-атомном кластере варьируются от 2,52 до 2,96, т.е. близки к наблюдаемым нами длинам связей.
Что касается строения предполагаемого 13-атомного кластера хлорида молибдена, то симметричная форма изотопных линий основного фрагмента в масс-спектрах MALDI позволяет предполагать кубооктаэдр или икосаэдр (рис. 10).


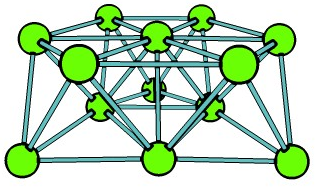
А. Кубооктаэдр Б. Икосаэдр Г. Бипланарная структура
Рис.10. Предполагаемое строение металлического остова 13-атомного кластера молибдена: А, Б – гипотетические структуры, В – наблюдаемая для кластера Mo13 с кислородным окружением5.
На основании результатов, полученными вышеприведёнными методами, было сделано заключение, что полученные продукты состава MoCl1,9±0,1(C30±1H30±1) представляют собой органо-неорганические композиты – металлоорганические кластеры хлоридов молибдена (+3) в транс-полиацетиленовой матрице.
3.1.2.6.ЭПР, магнитная восприимчивость и проводимость MoCl1,9±0,1(C30±1H30±1)
Спектр ЭПР композита MoCl1,9±0,1(C30±1H30±1) при 300°К (рис.11а) состоял из двух изотропных линий. Интенсивная линия g = 1,935 отнесена к неспаренным электронам атомов молибдена. Наблюдаемая величина g-фактора сравнима со значениями для некоторых соединений трёхвалентного молибдена, например, в K3[InCl6]·2H2O, где ион молибдена Mo(+3) изоморфно замещает In(+3), значение g-фактора составляет 1,93±0,06[6].
Линия незначительной интенсивности с g = 2,003, близким к g-фактору свободного электрона - 2,0023, была отнесена к неспаренным электронам атомов углерода полиацетиленовой матрицы. Поскольку интенсивность сигнала электронов атомов молибдена существенно выше, чем электронов атомов углерода матрицы, можно заключить, что основной вклад в парамагнитные свойства композита вносят неспаренные электроны атомов молибдена.
а б
б 
Рис.11. Спектр ЭПР композита MoCl1,9±0,1(C30±1H30±1) при 300°К, снятый в непрерывном режиме в X- (а) и W-диапазоне (б).
При переходе от X- к высокочастотному W-диапазону спектр ЭПР, снятый в непрерывном режиме при 30 °K, (рис.11б) несколько изменился. Наблюдаемые три широкие линии неспаренных электронов атомов молибдена были отнесены к трём осевым компонентам с g1=1,9528, g2=1,9696 и g3=2,0156 соответственно. Неспаренным электронам атомов углерода полиацетиленовой матрицы отвечал узкий сигнал g = 2,0033. В импульсном режиме съёмки спектров ЭПР при 30 °K (рис.12) эта линия расщеплялась на два сигнала с g1 = 2,033 и g2 = 2,035. Наличие двух сигналов ЭПР свидетельствовало о существовании в полиацетиленовой матрице двух типов парамагнитных центров различной природы, которые могут быть отнесены к различию в их геометрическом окружении или к локализованным и делокализованным неспаренным электронам атомов углерода полиацетиленой цепи.

Рис.12. Спектр поглощения ЭПР композита MoCl1,9±0,1(C30±1H30±1), снятый в импульсном режиме в W-диапазоне при 30K (а) и его первая производная (б).
Измерение температурной зависимости магнитной восприимчивости г в области температур 77300 К (рис. 13) показало, что при снижении температуры от комнатной до 108 K величина магнитной восприимчивости образцов находится в пределах чувствительности прибора или практически отсутствует. Ниже этой температуры образец начинал проявлять магнитную восприимчивость, которая при дальнейшем снижении температуры резко возрастала.
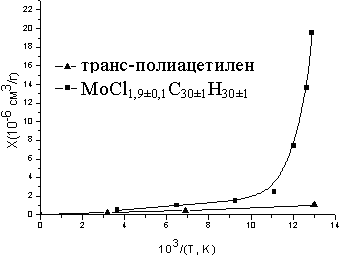
Рис.13. Температурная зависимость магнитной восприимчивости MoCl1,9±0,1(C30±1H30±1) и транс-полиацетилена7.
Известно, что магнитная восприимчивость транс-полиацетилена подчиняется закону Кюри и очень мала по абсолютной величине[7]. Сопоставление температурного хода г композита и чистого транс-полиацетилена позволяет заключить, что основной вклад в магнитную восприимчивость исследованных образцов вносят неспаренные электроны атомов молибдена в кластере. Резкое возрастание магнитной восприимчивости ниже 108 К может быть связано с уменьшением обменных взаимодействий между атомами металла.
Величина электропроводности прессованных образцов MoCl1,9±0,1(C30±1H30±1), измеренная при постоянном токе при комнатной температуре - (1,3 3,3)·10-7Ом-1·см-1 находится в диапазоне значений для транс-полиацетилена и характеризует композит как слабый диэлектрик или полупроводник. Установленная величина проводимости образцов при переменном токе = (3,1 4,7)·10-3Ом-1·см-1 может отвечать наличию ионной (протонной) проводимости, что может быть связано с присутствием подвижных атомов водорода в структуре полимера.
3.1.2.7.Термическое разложение MoCl1,9±0,1(C30±1H30±1)
При нагревании до 1000 °С в атмосфере аргона обнаружено, что композит устойчив до 300 °С, выше 400°С начинает разлагаться с образованием твёрдого остатка (оксидов молибдена и сажи) и жидкой фазы. Общая потеря веса в ходе эксперимента составляет 8,4 %, что свидетельствует о его высокой термической устойчивости. По результатам исследования продуктов разложения методом ГЖХ и MALDI-TOF-MS масс-спектрометрии установлено, что основными компонентами жидкой фазы является смесь алкилзамещенных антраценов (фенантренов) и других полиядерных ароматических систем с алкильными заместителями и без них, например, 1-метилфенантрен, 2-метилантрацен и 1-метилхризен, а также полициклические углеводороды с насыщенными и ароматическими кольцами, например, 4, 5 – дигидропирен и 11H-бензофлюорен. В соответствии с полученными данными было предположено, что структура полимера в полиацетиленовой матрице композита характеризуется наличием поперечных сшивок между цепями. Следствием этого является сокращение длины сопряжения полиацетиленовой цепи, что подтверждается данными Raman-спектроскопии - смещением частоты валентных колебаний связи –CH=CH– в высокочастотную область, а также его высокая термическая устойчивость и нерастворимость в основных органических растворителях.
4.1. Исследование продуктов реакции NbCl5 с ацетиленом
4.1.1. Взаимодействие NbCl5 с ацетиленом
С целью проверки возможности использования предложенного метода для синтеза композитов, содержащих в органической матрице кластеры переходных элементов других групп, были изучены продукты взаимодействия ацетилена с NbCl5. Последний катализирует стереоселективную тримеризацию алкинов, однако данные по изучению каталитически-активного комплекса отсутствуют.
Для получения композитов с достаточно высокой концентрацией металла, в качестве исходных использовали насыщенные при комнатной температуре растворы NbCl5 в бензоле. По мере пропускания ацетилена первоначально красный раствор обесцвечивался, становился зелёным, темнел, начиналось выделение HCl, появлялась мелкодисперсная тёмно-синяя взвесь, благодаря чему раствор приобретал тёмно-синюю окраску. При дальнейшем пропускании ацетилена содержимое колбы разогревалось (начиналась циклотримеризация), бензол закипал и образовался гель. Кипение продолжалось по мере пропускания газа. После его прекращения раствор охлаждался, однако его возобновление вновь приводило к разогреванию, т.е. каталитическая активность сохранялась. О полноте реакции судили по прекращению выделения HCl. При охлаждении геля образовывался тёмно-синий мелкодисперсный осадок, который отфильтровывали в атмосфере аргона, промывали бензолом и высушивали в вакууме. Раствор после его отделения представлял собой чистый растворитель. Полученное вещество – мелкодисперсный порошок тёмно-синего цвета, нерастворимый в воде и органических растворителях.
Для проведения непосредственного взаимодействия с ацетиленом кварцевую лодочку с 3,5 г пентахлорида помещали в заполненную сухим азотом стеклянную трубку и затем пропускали ацетилен, постепенно нагревая в трубчатой печи. Около 100оС жёлтый NbCl5 по поверхности синел и бурно взаимодействовал со вспышкой и образованием густого белого дыма – HCl. В результате на стенках трубки образовалась чёрная блестящая плёнка, а по мере пропускания ацетилена, в охлаждаемом на выходе газообразных продуктов жидким азотом приёмнике конденсировалось твёрдое белое вещество, которое было идентифицировано как бензол, т.е. вещество на стенках трубки катализировало циклотримеризацию ацетилена. При хранении в атмосфере инертного газа в течение нескольких дней каталитическая активность вещества сохранялась, и пропускание через трубку ацетилена вновь приводило к образованию бензола.
Полученное вещество не растворимо в воде и обычных органических растворителях.
4.1.2. Исследование состава, строение и свойства продуктов взаимодействия NbCl5 с ацетиленом
4.1.2.1. Элементный анализ, РФА, морфология, размер частиц и термическая устойчивость в вакууме
Оказалось, что составы продуктов реакции в бензольном растворе и при непосредственном взаимодействии компонентов близки и несколько различаются содержанием углерода (табл. 5).
Таблица 5. Данные элементного анализа продуктов взаимодействия NbCl5 с ацетиленом в растворе и при непосредственном взаимодействии.
| Содержание, масс. % | |||||||||||
| С | H | Cl | Nb | ||||||||
| Получ. | Рассч. | Получ. | Рассч. | Получ. | Рассч. | Получ. | Рассч. | ||||
| В растворе | |||||||||||
| 45,00 | 45,20 | 3,60 | 3,76 | 20,50 | 22,20 | 26,50 | 28,80 | ||||
| При непосредственном взаимодействии | |||||||||||
| 41,60 | 45,20 | 4,02 | 3,76 | 22,81 | 22,20 | 27,78 | 28,80 | ||||
На основании полученных данных веществам может быть приписана формула NbCl2±0,1(C12±1H12±0,1), а взаимодействие описано уравнением:
NbCl5(solv/solid) + nC2H2 NbCl2±0,1(C12±1H12±1) + (n-12)C6H6+ 3HCl +Q
На дифрактограмме NbCl2±0,1(C12±1H12±1) наблюдалась широкая линия при 2 = 23-24°, что позволяло предполагать нанокристаллическое строение полученных продуктов.
Изучение морфологии поверхности NbCl2±0,1(C12±1H12±1), полученного путем непосредственного взаимодействия, методом СЭМ показало, что частицы имеют преимущественно сферическую форму, и их размеры составляют менее 100 нм (рис.14).

Рис.14. Микрофотография частиц NbCl2±0,1(C12±1H12±1), полученная методом СЭМ.
Глобулярная форма частиц и их небольшой размер свидетельствуют о большой величине их удельной поверхности, что согласуется с высокой каталитической активностью NbCl2±0,1(C12±1H12±1).
По данным ДТГ вещества неустойчивы в вакууме и начинают разлагаться уже при t> 100оС.
4.1.2.2. Рентгеновские фотоэлектроные спектры NbCl2±0,1(C12±1H12±1)
Методом РФЭС были изучены продукты непосредственного взаимодействия NbCl5 с ацетиленом. Найденная величина энергии 3p- и 3d-Nb на поверхности (рис.15а, табл.6) соответствует высшей степени окисления Nb+5, тогда как после травления ионами аргона значения отвечают степени окисления +3. Это является следствием высокой дисперсности (рис. 14) и активного взаимодействия с кислородом и влагой воздуха. Последнее проявляется в появлении широкой линии в области 530,6530,8 эВ O1s-электронов (рис.16а).
а б
б 
Рис. 15. РФЭС-спектр NbCl2±0,1(C12±1H12±1) в области Nb3d- и Cl2p-электронов: а – до травления Ar+; б – после травления Ar+.
Таблица 6. Энергии связи электронов Eb (эВ) элементов поверхности пленки NbCl2±0,1(C12±1H12±1).
| № | Поверхность пленки | ВМО | Nb3d5/2 | Nb3p3/2, 4p3/2 | Cl2p3/2 | O1s | C1s |
| 1 | зеркальная сторона - А | 5,2 | 207,7 | 365,9 35,3 | 198,7 | 530,7 | 284,0 |
| 2 | А - после травления Аr+ - 2 мин. | 5,1 | 204,2 206,9 | 362,9 33,4 | 198,4 | 530,6 | 284,0 |
| 3 | А - после травления Ar+ - 7мин. | 5,7 | 204,0 206,7 | 362,2 33,6 | 198,8 | 530,6 | 284,0 |
| 4 | Б- матовая сторона | 5,3 | 207,3 | 365,6 35,2 | 199,1 | 530,8 | 284,0 |
| 5 | Б - после травления Ar+ - 7 мин. | 5,9 | 203,8 206,6 | 362,0 33,1 | 198,2 | 530,7 | 284,2 |
| 6 | -Nb2O5 | 6,8 | 207,6 | 365,8 36,1 | 530,7 | ||
| 7 | LaNbO4 | 5,7 | 207,0 | 364,7 35,3 | 530,2 | ||
| 8 | Графит | 284,4 | |||||
| 9 | Nb | 202,4 | |||||
| 10 | NbC | 203,7 |
Линия Cl2p электронов хлора (рис.15б) состоит из двух перекрывающихся дублетов, энергии состояний которых равны 198,7 и 200,1 эВ, что может быть обусловлено наличием химически неэквивалентных атомов хлора, например, мостиковых и концевых. После травления катионами аргона положение и форма этих линий сохранялась.
Спектр C1s-электронов (рис.16б) представлял собой интенсивную, узкую симметричную линию, что может указывать на эквивалентность атомов углерода, а её положение в области 284,0 эВ - на наличие сопряженных связей
–СН=СН–СН=СН–.
а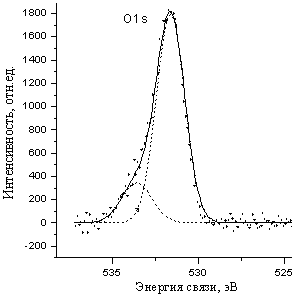 б
б
Рис.16. РФЭС NbCl2±0,1(C12±1H12±1) в области O1s-(а) и C1s-электронов (б).
Следует отметить, что установленная величина энергии связи C1s-электронов в NbCl2±0,1(C12±1H12±1) совпадает со значением энергий основной линии связей C1s-электронов в MoCl1,9±0,1(C30±1H30±1), что может свидетельствовать о присутствии в структуре органической части одинаковых фрагментов - сопряженных двойных связей.
По физическим свойствам вещество устойчиво в высоком вакууме и слабо заряжается под пучком рентгеновского излучения, что позволяет характеризовать его как слабый диэлектрик.
4.1.2.3. ИК- и Raman- спектроскопия, 13C ЯМР
ИК-спектры продуктов реакции NbCl5 с ацетиленом в бензоле и при непосредственном взаимодействии практически совпадали, что, наряду с результатами элементного анализа, указывало на идентичность веществ.
Во всех ИК-спектрах NbCl2±0,1(C12±1H12±1) отсутствовала полоса поглощения координированной тройной связи СС (20402050 см-1). Линии в области 1610 и 1650 см-1 небольшой были отнесены к валентным колебаниям сопряжённых двойных углеродных связей, а линии при 3031 и 3061 см-1- к валентным колебаниям групп C-H при двойной углеродной связи (табл.7). Полосы поглощения при 1450 и 12871290 см-1 связаны с деформационными колебаниями C-H. На основании этого было сделано предположение, что в полученных продуктах органическая часть состоит из системы сопряженных связей –CH=CH–CH=CH–.
Полосы поглощения при 324 и 243 см-1 были отнесены к колебаниям связи Nb-Cl и Nb-Nb соответственно.
Табл.7. Полосы поглощения, наблюдаемые в ИК-спектрах полученных веществ.
| частота, см-1 | интенсивность линии | отнесение |
| 3031 и 3061 | небольшая | валентные колебания =С-Н |
| 1290, 1450 | средняя | деформационные колебания С-Н |
| 1610 и 1650 | небольшая | валентные колебания сопряжённых углеродных связей –CH=CH– |
| 1100 | небольшая | валентные колебания С-С |
| 324 и 243 | небольшая | колебания связи Nb-Cl/Nb-Nb |
В спектре комбинационного рассеяния NbCl2±0,1(C12±1H12±1) (рис. 17) наблюдаются две характерные линии большой интенсивности, отнесённые к валентным колебаниям сопряжённых двойных (14801500 см-1) и одинарных (1100 см-1) углеродных связей. Смещение в длинноволновую область (ближе к 1500 см-1), по сравнению с Мо продуктом, может свидетельствовать о меньшей длине сопряжения в углеводородной цепи в NbCl2±0,1(C12±1H12±1).
Величина химического сдвига в спектре MAS ЯМР-13C (в области 130 м.д.) подтверждает наличие сопряжённых двойных углеродных связей в полученных продуктах, и согласуется с результатами ИК- и Raman- спектроскопии.
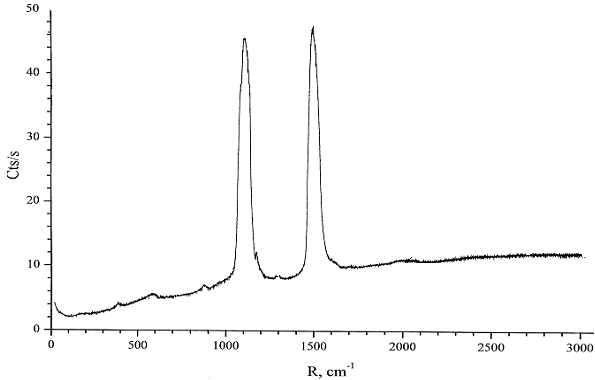
Рис.17. Raman-спектр NbCl2±0,1(C12±1H12±1).
4.1.2.4. MALDI-TOF-MS – масс-спектры NbCl2±0,1(C12±1H12±1)
Подтверждение окисления поверхности полученных продуктов было получено методом масс-спектрометрии. В масс-спектре MALDI (рис.18) продуктов присутствовали группы линий, отличающиеся между на 160 а.е.м. – массу NbО2Cl. В результате были идентифицированы в газовой фазе неизвестные ранее полиядерные оксохлоридные анионы ниобия [NbO2Cl2]- (195), [Nb2O4Cl3]- (356), [Nb3O6Cl4]- (516) и [Nb4O8Cl5]- (677,5) [NbOCl4]- (250), [Nb2O3Cl5]- (411,5), [Nb3O5Cl6]- (572) и [Nb4O7Cl7]- (732,5).
Высокая дисперсность частиц NbCl2±0,1(C12±1H12±1) (рис. 14) приводит к быстрому окислению на воздухе и образованию на поверхности оксохлоридов ниобия, регистрируемых в масс-спектре MALDI.

Рис.18. Масс-спектр MALDI-TOF-MS NbCl2±0,1(C12±1H12±1), в режиме детектирования отрицательных ионов.
Подтверждением того, что углеводородная часть полученных продуктов представляет собой полимерную матрицу, было получено при регистрации масс-спектров MALDI в режиме детектирования положительных ионов (рис. 19а).


а б
Рис.19. Масс-спектры MALDI-TOF-MS NbCl2±0,1(C12±1H12±1) (а) и MoCl1,9±0,1(C30±1H30±1) (б) в режиме детектирования положительных ионов.
Спектр представлял собой широкий сигнал - совокупность линий различной интенсивности, отличающихся друг от друга на одну и ту же массу – 13 а.е.м., на основании чего был сделан вывод о том, что при положительной ионизации в газовую фазу переходят и молекулы полимерной матрицы, и оксохлоридные анионы ниобия. В спектре MALDI молибденового композита (рис. 19б) были обнаружены только фрагменты углеводородной матрицы.
4.1.2.5. Магнитная восприимчивость NbCl2±0,1(C12±1H12±1)
Измерение температурной зависимости магнитной восприимчивости NbCl2±0,1(C12±1H12±1), в области температур 80295 К (рис. 20) показало, что интервале 300 и до 150 K магнитная восприимчивость образцов практически не меняется, а ниже 150K резко возрастает.

Рис.20. Температурная зависимость магнитной восприимчивости NbCl2±0,1(C12±1H12±1) и транс-полиацетилена.
Похожая картина наблюдалась и для Мо-композита и может отвечать уменьшению при снижении температуры обменных взаимодействий между атомами металла. Сравнение температурного хода г NbCl2±0,1(C12±1H12±1) и чистого транс-полиацетилена позволило заключить, что вклад в магнитную восприимчивость исследованных образцов обусловлен неспаренными электронами атомов ниобия.
ВЫВОДЫ
1.Предложен новый метод синтеза органо-неорганических композитов -наноразмерные кластеры переходных металлов в органической матрице - путём реакций соединений переходных металлов высших степеней окисления с мономерами, которые на первой стадии выступают в качестве восстановителя, а образующиеся при этом кластеры металлов низших степеней окисления, катализируют полимеризацию мономера с образованием органической матрицы.
2.Впервые современными методами химического и физико-химического анализа проведено систематическое исследование продуктов реакции MoCl5 с ацетиленом и сделан вывод том, что они являются органо-неорганическими композитами состава MoCl2±0,1(C30±1H30±1). Установлено, что при взаимодействии MoCl5 с ацетиленом в неполярных средах происходит выделение HCl, понижение степени окисления молибдена и образование металлоорганических наноразмерных кластеров. Методом EXAFS-спектроскопии обнаружены два расстояния Mo-Mo, в координационной сфере Мо имеются два неэквивалентных атома хлора и атом углерода. По данным РФЭС степень окисления Мо в кластере (+3).
3.На основании данных MALDI-TOF масс-спектрометрии сделано заключение, что кластер молибдена имеет 12 или 13-атомный металлический остов и его состав может быть выражен формулами [Mo12Cl24(C20H21)] или [Mo13Cl24(C13H8)].
4. Методами ИК-, Raman-, MAS ЯМР-13С- и РФЭС показано, что органическая часть композита представляет собой полиацетилен транс-трансоидальной структуры. Полимерные цепи сшиты, а наряду с сопряжёнными двойными связями, присутствуют линейные фрагменты кумулированных двойных -HC=C=CH- и тройных -CC- связей.
4. По результатам ЭПР Мо-композит парамагнитен и парамагнитные свойства определяются неспаренными электронами атомов углерода матрицы и атомов молибдена, причем вклад последних преимущественный. В полиацетиленовой матрице найдены два типа парамагнитных центров, отнесенных к различному геометрическому окружению атомов углерода. Предположено, что резкое возрастание магнитной восприимчивости ниже 108 К обусловлено уменьшением обменных взаимодействий между атомами металла в кластере. Найдено, что Мо-композит обладает ионной проводимостью, что связано с присутствием в полиацетиленовой матрице, по данным ПМР, подвижных протонов.
5. Установлено, что Мо-композит устойчив в вакууме и инертной атмосфере до 300°C. При более высоких температурах разлагается с выделением жидких смесей полициклических ароматических углеводородов (С10-С30), а также твердого остатка оксидов и оксихлоридов Мо на низкомолекулярной саже.
6. На примере изучения продуктов реакции NbCl5 с ацетиленом показана возможность применения предложенного метода для синтеза органо-неорганических композитов, содержащих в органической матрице кластеры переходных элементов не только VI, но других групп периодической системы.
Основные результаты диссертации изложены в следующих публикациях:
- Е.Г.Ильин, А.С. Паршаков, А.К. Буряк, Д.И. Кочубей, Д.В. Дробот, В.И. Нефёдов. Наноразмерные кластеры хлоридов молибдена - активные центры в каталитических процессах олигомеризации ацетилена.//ДАН, 2009, Т.427, №5, С.641-645.
- Норов Ю.В., Паршаков А. С., Буряк А. К., Яржемский В. Г., Ильин Е. Г. Изомерия наноразмерных полиядерных и кластерных комплексов оксида молибдена//Вестник МГПУ, Серия Естественных наук, 2010, №9, С.33-36.
- Е.Г. Ильин, А.С. Паршаков, А.К. Буряк, Д.И. Кочубей. Наноразмерные металлорганические кластеры хлоридов молибдена в реакции пентахлорида молибдена с ацетиленом. XXIV Международная Чугаевская конференция по координационной химии, Санкт-Петербург, 2009, С.283.
- Е.Г. Ильин, А.С. Паршаков, А.К. Буряк, Д.И. Кочубей. Строение наноразмерного кластера молибдена по данным MALDI-TOF-MS – масс-спектрометрии и EXAFS-спектроскопии. XVI Всероссийская конференция «Структура и динамика молекулярных систем», Яльчик, 2009, Республика Марий-Эл, С. 82.
- Е.Г. Ильин, А.С. Паршаков, А.В. Ротов, В.В. Минин, А.К. Буряк, Д.И. Кочубей. Наноразмерные металлорганические кластеры хлоридов молибдена – активные центры олигомеризации ацетилена. Всероссийская молодёжная конференция – школа «Идеи и наследие А.Е. Фаворского в органической и металлоорганической химии XXI века», Санкт-Петербург, 2010, С. 191.
Автор выражает искреннюю благодарность Е.Г. Ильину, А.Г. Бейрахову, А.В. Ротову, В.В. Минину, О.Н. Гилярову, Л.И. Дёминой, И.П. Столярову, В.Г. Яржемскому, О.Г. Эллерт, Н.Ю. Козициной, В.И. Привалову, Н.А. Абрамову, А.К. Буряку, Ю.А. Тетерину, Д.И. Кочубею за ценные советы и замечания, а также за помощь при выполнении данной работы.
[1] Коршак В.В., Байтингер Е.М., Кугеев Ф.Ф., Кудрявцев Ю.П., Евсюков С.Е., Коршак Ю.В., Ю.А.Тетерин. Изменение электронного строения цепи в процессе синтеза карбина//ДАН СССР, 1988, Т.303, №4, С.894-897.
[2] Shirakawa H., Ikeda S. Infrared Spectra of Poly(acetylene)// Polym. J., 1971, V. 2, №. 2, P. 231-244.
[3] Shirakawa H., Ito T., Ikeda S. Raman Scattering and Electronic Spectra of Polyacetylene// Polymer J., 1973, V.4, №4, P.460-462.
[4] Mehring M., Weber H., Mller W., Wegner G. High resolution 13C NMR in undoped cis- and trans-polyacetylene//Solid St. Comm., 1983, V. 45, № 12, P. 1079-1082.
[5] Tortelier J., Gougeon P. //Inorg. Chem., 1998, V.37, № 24, P.6229.
[6] Альтшуллер С.А., Козырев Б.М. Электронный парамагнитный резонанс соединений элементов промежуточных групп. изд. 2-е, переработанное. Главная редакция физико-математической литературы издательства “Наука”, 1972, 672 с.
[7] Weinberger B.R., Kaufer J., Heeger A.J., Pron A., MacDiarmid A. G. Magnetic susceptibility of doped polyacetylene// Phys. Rev. B, 1979, V.20, P.223-230.

