Синтез и свойства 2,3,6,7,12,12b-гексагидропиримидо[6,1- а ]- -карболин-4(1 н )-тионов(онов) и 1,2,3,6,7,11b-гексагидро-4 н -пиримидо[6,1- а ] изохинолин-4-тио нов(онов)
На правах рукописи
МУКАНОВ Алексей Юрьевич
СИНТЕЗ И СВОЙСТВА 2,3,6,7,12,12b-ГЕКСАГИДРОПИРИМИДО[6,1-а]--КАРБОЛИН-4(1Н)-ТИОНОВ(ОНОВ) И 1,2,3,6,7,11b-ГЕКСАГИДРО-4Н-ПИРИМИДО[6,1-а]ИЗОХИНОЛИН-4-ТИОНОВ(ОНОВ)
Специальность 02.00.03 – органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Омск – 2004
Работа выполнена на кафедре органической химии Омского государственного университета.
Научный руководитель:
доктор химических наук, профессор Фисюк Александр Семенович
Официальные оппоненты:
доктор химических наук Богза Сергей Леонидович
кандидат химических наук, доцент Плотникова Ольга Михайловна
Ведущая организация: Новосибирский институт органической
химии им. Н. Н. Ворожцова СО РАН
Защита состоится 1 июля 2004 года в 1400 на заседании диссертационного совета К 212.274.04 в Тюменском государственном университете по адресу: 625003, г. Тюмень, ул. Перекопская 15а, ауд. 118.
С диссертацией можно ознакомиться в научной библиотеке Тюменского государственного университета.
Отзыв на автореферат высылать по адресу:
625003, г. Тюмень, ул. Семакова 10, ТюмГУ, химический факультет.
Автореферат разослан «29» мая 2004 г.
Ученый секретарь

диссертационного совета
кандидат химических наук Котова Т.П.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Гетероциклические системы изохинолина и индоло[2,3-с]пиридина (-карболина) входят в структуры большого числа алкалоидов, лекарственных средств и других физиологически активных соединений. Структурный поиск, проведенный по базе данных Derwent Information Ltd 1999, выявил 804 лекарственных препарата и алкалоида с различными видами биологической активности, содержащих изохинолиновый фрагмент.
Подавляющее большинство изохинолинов и -карболинов получено хорошо известными реакциями. Вместе с тем современные задачи химии гетероциклических соединений и прикладных областей органической химии требуют создания новых методов, которые позволили бы существенно расширить возможности конструирования новых производных изохинолина и -карболина посредством их аннелирования с другими гетероциклами. В силу своей биологической активности аннелированные изохинолины и -карболины, в том числе и производные пиримидина, занимают особое место. Например, к ним относятся такие алкалоиды как buquiterine и trequinsin. Пиримидо--карболиновый фрагмент составляет структурную основу алкалоида elaeocapridine.
Известные методы построения таких структур часто не эффективны и многостадийны. Поэтому разработка новых простых методов синтеза производных пиримидоизохинолина и пиримидо--карболина является актуальной задачей.
Данная работа является частью исследований, проводимых лабораторией органического синтеза и кафедрой органической химии Омского государственного университета, выполняемых по теме "Синтез азотсодержащих гетероциклов на основе 1,3-бифункциональных соединений" (номер государственной регистрации 01.98.0004900). Работа выполнена при финансовой поддержке РФФИ (грант 01-03-32167) и Министерства образования РФ (грант Е02-5.0-12 и УР.05.01.039).
Цель работы. Разработка новых методов синтеза 1,2,3,6,7,11b-гексагидро-4Н-пиримидо[6,1-а]изохинолин-4-тионов(онов) и 2,3,6,7,12,12b-гексагидропиримидо[6,1-а]--карболин-4(1Н)-тионов(онов), исследование строения и свойств синтезированных соединений, а также закономерностей протекания изучаемых реакций.
Научная новизна. Найдены новые подходы и разработаны методы синтеза 1,2,3,6,7,11b-гексагидро-4Н-пиримидо[6,1-а]изохинолин-4-тионов(онов) и 2,3,6, 7,12,12b-гексагидропиримидо[6,1-а]--карболин-4(1Н)-тионов(онов). Выявлено влияние электронных и структурных факторов на процесс их образования. Впервые изучены реакции этих соединений, протекающие по тиоуреидному фрагменту молекулы. Исследованы реакции 1,1-диэтокси-3-изотиоцианатобутана с азотистыми нуклеофилами и разработаны методы синтеза N(1)-замещенных 6-этокситетрагидро-2(1Н)-пиримидинтионов на его основе.
Практическая значимость. Разработаны препаративные методы синтеза 1,1-диэтокси-3-изотиоцианатобутана и N-замещенных-4-метил-6-этокситетрагидро-2(1Н)-пиримидинтионов на его основе. Разработаны простые методы синтеза труднодоступных 1,2,3,6,7,11b-гексагидро-4Н-пиримидо[6,1а]изохинолин-4-тионов(онов) и 2,3,6,7,12,12b-гексагидропиримидо[6,1-а]--карболин-4(1Н)-тионов(онов), в том числе однореакторные методы, основанные на каскадных циклизациях, позволяющие в одну-две стадии получать сложные конденсированные гетероциклические системы на основе коммерчески доступных продуктов.
Апробация работы и публикации. Материалы работы докладывались на 3х международных конференциях. Основное содержание работы изложено в 4-х статьях и тезисах 4-х докладов.
Структура и объем диссертации. Диссертация изложена на 134 страницах машинописного текста, содержит 30 таблиц, 69 схем, 18 рисунков, состоит из введения, литературного обзора, посвященного методам синтеза 1,3-изотиоцианатокарбонильных соединений и их химическим свойствам, обсуждения результатов, экспериментальной части, выводов, списка цитируемой литературы.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Для синтеза изохинолинов и -карболинов, аннелированных гетероциклами, достаточно часто используется внутримолекулярное амидоалкилирование N-этиларил- и N-этил-3-индолил- замещенных гетероциклических ацилиминиевых ионов. В то же время, 3,4-дигидро-2(1Н)-пиримидинтионы(оны) и 6-гидрокситетрагидро-2(1Н)-пиримидинтионы(оны), являющиеся тиоуреидо(уреидо)алкилирующими агентами, для этого ранее не применялись. С целью изучения этой реакции нами были синтезированы некоторые представители этого класса соединений и их предшественники.
1. Синтез исходных соединений
- Получение 1,3-изотиоцианатокарбонильных соединений из ,-непредельных альдегидов и кетонов
Один из наиболее распространенных методов синтеза 6-гидрокситетрагидро-2(1Н)-пиримидинтионов основан на взаимодействии аминов с 1,3-изотиоцианатокарбонильными соединениями 2, которые были синтезированы нами известным методом — присоединением роданистоводородной кислоты к,-непредельным альдегидам и кетонам 1.
| Соед. | R1 | R3 | R4 | Выход,% |  |
| 2а | H | H | H | 25 | |
| 2б | H | Me | H | 30 | |
| 2в | Me | Me | Me | 70 | |
| 2г | Me | Me | H | 52 | |
Использование 1,3-изотиоцианатокарбонильных соединений в синтезе не лишено ряда ограничений. Например, 1,3-изотиоцианатоальдегиды образуются с низкими выходами, они неустойчивы при хранении и в основных средах. Кроме того, реакции 1,3-изотиоцианатоальдегидов с некоторыми нуклеофилами протекают не селективно, как по изотиоцианатной, так и по карбонильной группе. -Изотиоцианатоацетали 3, в отличие от соответствующих -изотиоцианатоальдегидов 2, лишены этих ограничений. Единственный ранее известный представитель этого класса соединений — 1,1-диэтокси-3-изотиоцианатобутан (3б) был получен ацетализацией альдегидной группы соединения 2б триэтилортоформиатом. Выход продукта 3б, из расчета на кротоновый альдегид 1б, не превышал 30 %.
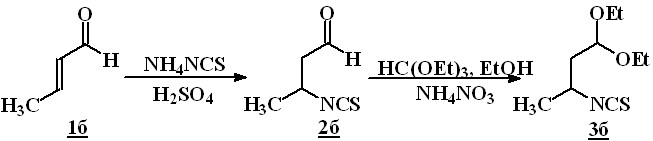
Нами разработан однореакторный синтез 3-изотиоцианатоацеталей 3а,б из соответствующих,-непредельных соединений 2а,б без выделения промежуточных 1,3-изотиоцианатоальдегидов, который заключается в последовательном добавлении к суспензии роданида калия и,-непредельного альдегида в абсолютном спирте триметилхлорсилана, а затем триэтилортоформиата. Это позволило существенно упростить получение 1,1-диэтокси-3-изотиоцианатобутан 3б и повысить выход до 56 %.
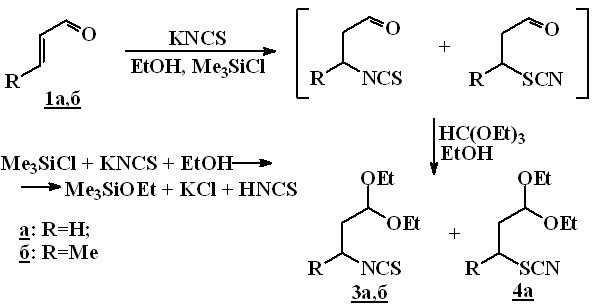
При использовании в этой реакции акролеина образуется смесь 1,1-диэтокси-3-изотиоцианатопропана 3а и 1,1-диэтокси-3-тиоцианатопропана 4а в соотношении 2:1 с суммарным выходом 63 %. Строение соединений 3а,б и 4а подтверждено данными ИК-спектров и спектроскопии ЯМР 1Н и 13С.
- Синтез 6-гидрокситетрагидро-2(1Н)-пиримидинтионов
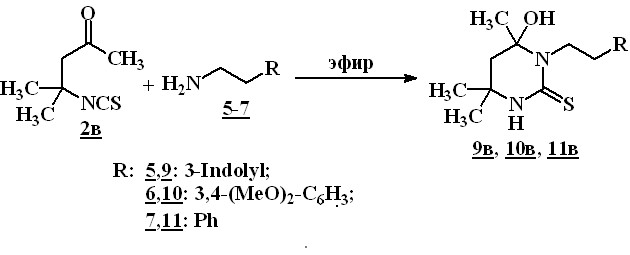
6-Гидрокситетрагидро-2(1Н)-пиримидинтионы 9-11в синтезированы взаимодействием 4-метил-4-изотиоцианатопентан-2-она (2в) и этиламинов 5-6. Соединения 9-11в получены с выходами 83–89 %.
- Синтез 6-этокситетрагидро-2(1Н)-пиримидинтионов на основе 1,1-диэтокси-3- изотиоцианатобутана
Располагая удобным методом синтеза ацеталей 3, нам представлялось необходимым изучить возможность их использования для синтеза гексагидропиримидин-2-тионов. Изучение взаимодействия соединения 3б с аминами 12а-г,и,к, гидразидами карбоновых кислот 12д,е, гидразином 12з и замещенным гидразином 12ж показало, что реакция протекает по NCS-группе и приводит к соединениям 13а-к с выходами 52–98 %.

Последующей обработкой соединений 13в-ж насыщенным водным раствором щавелевой кислоты или их кипячением в спирте с каталитическими количествами п-толуолсульфокислоты были получены 6-этокситетрагидро-2(1Н)-пиримидинтионы 14в-ж с выходами 37–76 %.
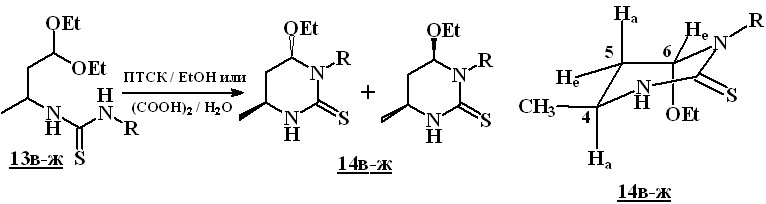
Значение констант ССВ 3J5He6He и 3J5Hа6Hе лежит в интервале 2,4–2,6 Гц, что указывает на экваториальное расположение протона при С(6). В то же время, мультиплетность сигнала аксиально расположенного протона при С(5) обусловлена тремя КССВ со значениями 2J=13,2–13,4 Гц; 3J5Ha4Ha=13,0–13,2 Гц и 3J5Hа6Hе=2,4–2,6 Гц, что указывает на аксиальное расположение протона при С(4). Таким образом, образование соединений 14в-ж протекает диастереоспецифично, приводя к диастереомерам с аксиально расположенной этокси-группой и экваториально расположенной метильной группой при С(4). Аксиальное расположение этокси-группы является достаточно характерным для подобного типа соединений и объясняется аномерным эффектом.
Таким образом, нами показано, что 1,1-диэтокси-3-изотиоцианатобутан (3б) является удобным исходным соединением для получения 6-этокситетрагидро-2(1Н)-пиримидинтионов 14. Также разработан метод синтеза этих соединений, изучена стереонаправленность реакции.
- Синтез пиримидинов Биджинелли
1-(3,4-Диметоксифенилэтил)-5-карбэтокси-6-метил-4-фенил-3,4-дигидро-2(1Н)-пиримидинтион (16) был получен по методу Биджинелли взаимодействием ацетоуксусного эфира, бензальдегида и замещенной тиомочевины 15 с выходом 30 %.

При использовании алифатических альдегидов в этой реакции соответствующие 3,4-дигидро-2(1Н)-пиримидинтион из реакционной среды выделить не удалось – реакция приводит к образованию трудноразделимой смеси продуктов. Поэтому для синтеза пиримидинов Биджинелли 16-19, содержащих различные заместители при С(6), нами была использована конденсация легко доступного енамина ацетоуксусного эфира 20 с триметилсилилизотиоцианатом и альдегидами. Выходы пиримидинов Биджинелли 16-19, синтезированных этим методом, низкие и составляют 11-31 %, однако продукт легко выделяется.

- Синтез 2,3,6,7,12,12b-гексагидропиримидо[6,1-а]--карболин-4(1Н)-тионов и 1,2,3,6,7,11b-гексагидро-4Н-пиримидо[6,1а]изохинолин-4-тионов
Изучение циклизации 6-гидрокситетрагидро-2(1Н)-пиримидинтионов 9в, 10в показало, что они способны к внутримолекулярному замыканию цикла с образованием соответствующих производных пиримидоизохинолинтиона 22в и пиримидо--карболинтиона 21в.
6-Гидрокситетрагидро-2(1Н)-пиримидинтионы, содержащие при атоме азота N(1) 3-индолилэтильный (9в) и 3,4-диметоксифениэтильный (10в) заместители, при кипячении в уксусной кислоте в течение 3 часов превращаются в 2,2,12b-триметил-2,3,6,7,12,12b-гексагидропиримидо[6,1-а]--карболин-4(1Н)-тион (21в) и 2,2,11b-триметил-9,10-диметокси-1,2,3,6,7,11b-гексагидро-4Н-пиримидо[6,1а]изохинолин-4-тион (22в) с выходами 52 и 73 % соответственно. 6Гидрокситетрагидро-2(1Н)-пиримидинтионы 9а,б, полученные взаимодействием 2а,б с триптамином 5, без предварительной очистки мы вводили в реакцию с уксусной кислотой. Выходы, полученных таким образом пиримидо--карболинов 21а,б составили 45–49 % (Метод А).
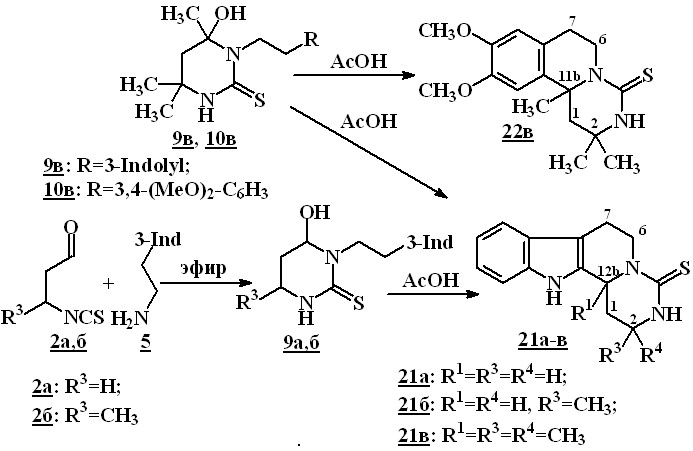
6-Этокси(6-гидрокси)пиримидины-2-тионы, не содержащие в положениях С(5) и С(6) заместителей, циклизации подвергаются легче. При попытке удалить ацетальную защиту в соединениях 13а,б обработкой насыщенным раствором щавелевой кислоты нами были получены 2-метил-2,3,6,7,12,12b-гексагидропиримидо[6,1-а]--карболин–4(1Н)-тион (21б) и 9,10-диметокси-2-метил-1,2,3,6,7,11b-гексагидро-4Н-пиримидо[6,1а]изохинолин-4-тион (22б) с выходами 44 и 53 %. При действии кислоты на соединения 13а,б протекает каскадная циклизация, первой стадией которой, по-видимому, является образование 6-этоксипирмидинов 14а,б.

В то же время, циклизация N-фенилэтилзамещенных пиримидинов 11в и 14в в аналогичных условиях не протекает. В результате нагревания соединений 11в и 14в в уксусной кислоте в течение 3 часов из реакционной смеси были выделены лишь соответствующие 1-фенилэтил-3,4-дигидропиримидин-2(1Н)-тионы 25б,в с выходами 83 и 40 %. Осуществить циклизацию соединений 11а-в,14в и 25б,в удалось только при нагревании в фосфорной кислоте в течение 1-2 часов. Выходы пиримидоизохинолинов 23а-в лежат в пределах 19–38 %.
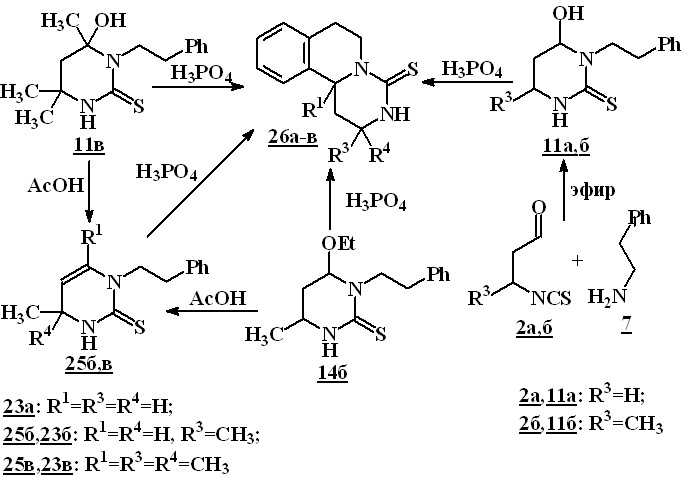
Известно, что реакция 1,3-изотиоцианатокарбонильных соединений с некоторыми аминами в кислой среде приводит к образованию 3,4-дигидропиримидин-2(1Н)-тионов. Поскольку внутримолекулярное замыкание цикла 1арилэтил- или 1-[(индолил-3)этил]-3,4-дигидропиримидин-2(1Н)-тионов с образованием соединений 21-24 протекает в аналогичных условиях, представлялось необходимым изучить возможность их прямого синтеза, минуя стадию выделения пиримидинтионов. Было показано, что кипячение в уксусной кислоте соответствующих 1,3-изотиоцианатокарбонильных соединений 2б,в и аминов 5,6,8 действительно приводит к образованию пиримидо--карболинтионов 21б,в, и пиримидоизохинолинтионов 22б,в, 24в (метод B) с выходами 44–93 %.
С целью упрощения этого метода, нами была изучена возможность получения 1,3-изотиоцианатокарбонильных соединений из,-непредельных альдегидов и кетонов в реакционной среде. В уксусной кислоте последовательным действием на,-непредельные карбонильные соединения 1а-д роданистоводородной кислотой, которую генерировали в реакционной среде из KNCS и H2SO4, а затем аминов 5,6, были синтезированы соединения 21б,в, 22а-д с выходами 21–64 % (метод С).

Сравнение методов А, В и С показывает, что выходы соединения 21б (в пересчете на гомовератриламин 6), полученного методами А (суммарный выход на двух стадиях), B и С составляют 73, 65 и 64 % соответственно. Несмотря на то, что выходы соединений 21,22, полученных методом С несколько ниже, чем в методах А и В, простота его проведения, возможность использования товарных продуктов для получения в одну стадию сложных гетероциклических структур, делают его весьма привлекательным.
На циклизацию N(1)-арилэтил замещенных пиримидин-2-тионов оказывают влияние электронные факторы. Замыкание примидоизохинолинового цикла протекает легче для соединений содержащих в ароматическом ядре арилэтильного заместителя электронодонорные группы.
В то же время заместители в пиримидиновом цикле также оказывают влияние на циклизацию. В частности, заместители в положениях С(5) и С(6) с одной стороны должны стабилизировать дигидропиримидиновую систему, а с другой – создавать стерические препятствия при формировании примидоизохинолинового или пиримидо--карболинового циклов. Действительно, при взаимодействии на,-непредельного кетона 1ж с роданистоводородной кислотой, а затем гомовератриламином 6 в среде уксусной кислоты (метод С), образуется лишь 1(3,4-диметоксифенилэтил)-4,4,5,6-тетраметил-3,4-дигидро-2(1Н)-пиримидинтион (26ж). Получить из этого соединения соответствующий пиримидоизохинолинтион не удалось ни при более длительном нагревании в AcOH (10 ч), ни заменой кислоты на трифторуксусную или фосфорную.

Неудачной оказалась попытка циклизации пиримидинов Биджинелли 16,18. Кипячение и в уксусной, и в более сильных кислотах (трифторуксусной и фосфорной) привело лишь к осмолению реакционной смеси и образованию трудноразделимой смеси продуктов.

Строение полученных продуктов подтверждено данными спектроскопии ЯМР (1Н и 13С), ИК и элементным анализом.
Образование соединений, имеющих два и более хиральных центра в пиримидиновом фрагменте, лишено региоспецифичности. Циклизация, как правило, приводит к образованию смесей диастереомеров с преобладанием одного из них.
Особенностью спектров ПМР соединений 21-24 является аномально высокое значение химического сдвига экваториально расположенного протона в 6-м положении С(6)Не – 5,30-5,74 м.д., что объясняется попаданием этого протона в конус дезэкранирования тиоуреидной группы.
3. Реакции 2,3,6,7,12,12b-гексагидропиримидо[6,1-а]--карболин-4(1Н)-тионов и 1,2,3,6,7,11b-гексагидро-4Н-пиримидо[6,1а]изохинолин-4-тионов
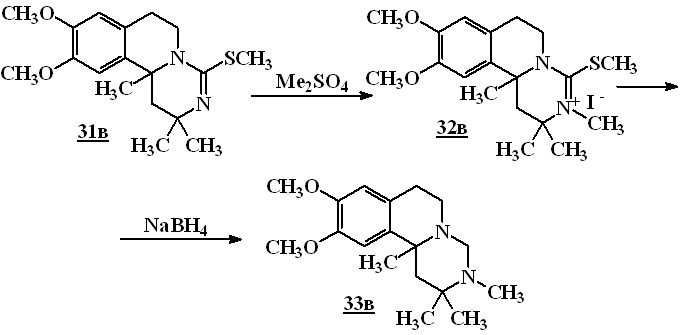
Пиримидо--карболинтионы и пиримидоизохинолинтионы 21-24 легко алкилируются по атому серы йодистым метилом в растворе ацетонитрила с образованием 1,2,6,7,12,12b-гексагидропиримидо[6,1-а]--карболин-3-ий йодидов 27 и 1,6,7,11b-тетрагидро-2Н-пиримидо[6,1-а]изохинолин-3-ий йодидов 28-30 с выходами 87–93 %. Из соединения 28в под действием спиртового раствора щелочи было выделено S-метильное производное 31в.

Дальнейшее алкилирование соединения 31в протекает при действии более сильного алкилирующего агента — диметилсульфата. После обработки реакционной смеси насыщенным водным раствором KI был выделен 9,10-диметокси-2,2,3,11b-тетраметил-4-метилсульфанил-1,6,7,11b-тетрагидро-2Н-пиримидо[6,1а]изохинолин-3-ий йодид (32в). Восстановление соединения 32в боргидридом натрия привело к образованию 9,10-диметокси-2,2,3,11b-тетраметил-1,3,4,6,7,11b-гексагидро-2Н-пиримидо[6,1-а]изохинолина (33в) с выходом 79 %.
При действии перекиси водорода в щелочной среде соединения 21-23 превращаются в 2,3,6,7,12,12b-гексагидропиримидо[6,1-а]--карболин-4(1Н)-оны 34 и 1,2,3,6,7,11b-гексагидро-4Н-пиримидо[6,1-а]изохинолин-4-оны 35,36. Выходы продуктов составляют 42–90 %.
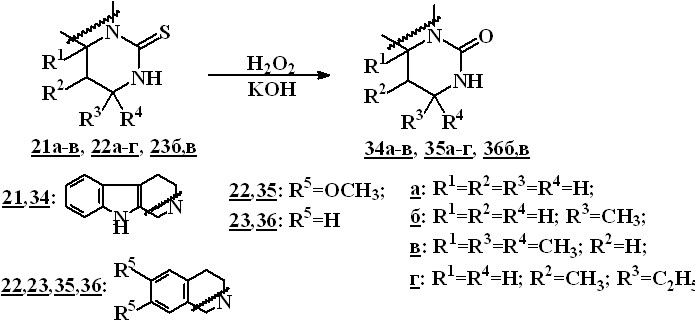
Исключение составляет соединение 24в, содержащее фенольные гидроксильные группы. Реакция в аналогичных условиях приводит к трудноразделимой смеси продуктов.
Соотношения диастереомеров 2,12b-транс- / 2,12b-цис- пиримидо[6,1а]--карболин-4-она 34б и 2,11b-транс- / 2,11b-цис- пиримидо[6,1а]изохинолин-4-онов 35б и 36б, полученных из пиримидо--карболи-4-тиона 21б и пиримидоизохинолин-4-тионов 22б, 23б, составляют 3:1, 1:5 и 1:10 соответственно.
- Синтез 2,3,6,7,12,12b-гексагидропиримидо[6,1-а]--карболин-4(1Н)-онов и 1,2,3,6,7,11b-гексагидро-4Н-пиримидо[6,1а]изохинолин-4-онов на основе ,-непредельных карбонильных соединений
и замещенных мочевин
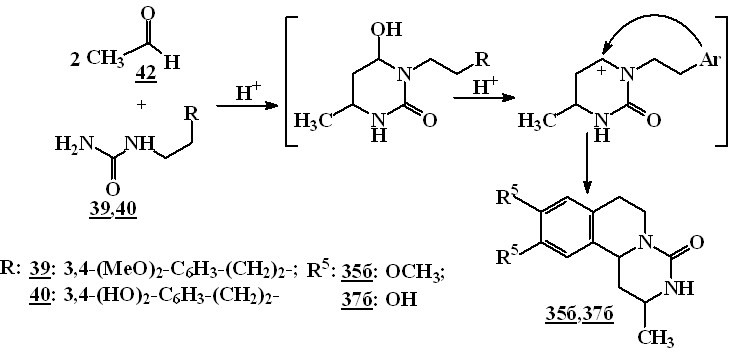
Известно, что взаимодействие,-непредельных альдегидов с замещенными мочевинами в условиях кислотного катализа приводит к образованию 6-гидрокситетрагидро-2(1Н)-пиримидинонов. N-Арилэтилмочевины в этой реакции ранее не использовались.
Нами было показано, что нагревание окиси мезитила 1в или кротонового альдегида 1б с мочевинами 38,39,40 в спирте в присутствии каталитических количеств соляной кислоты приводит к образованию 2,3,6,7,12,12b-гексагидропиримидо[6,1-а]--карболин-4(1Н)-онов 34б,в и 1,2,3,6,7,11b-гексагидро-4Н-пиримидо[6,1а]изохинолин-4-онов 35б-г, 37б,в с выходами 63–94 %. По-видимому, соединения 34б,в, 35б-г и 37б,в образуются в результате каскадной циклизации N-(3-оксоалкил)мочевин 41, получающихся в реакционной среде в результате присоединения соединений 38-40 к кротоновому альдегиду или окиси мезитила.

Поскольку в кислой среде возможно протекание кротоновой конденсации, мы изучили возможность получения пиримидоизохинолинонов 35, 37 взаимодействием мочевин 39, 40 и ацетальдегида 42. Было показано, что нагревание ацетальдегида 42 и мочевин 39, 40 в присутствии каталитического количества соляной кислоты образуются соединения 35б, 37б. Выходы продуктов в пересчете на мочевину составляют 12 и 15 % соответственно.
Строение всех синтезированных соединений доказано совокупностью данных спектроскопии ЯМР (1Н и 13С), ИК и элементного анализа.
Соединения 34б и 35б, полученные взаимодействием кротонового альдегида 1б с замещенными мочевинами 38 и 40, образуются в виде смеси диастереомеров в соотношениях 2,12b-транс / 2,12b-цис 34б и 2,11b-транс / 2,11b-цис 35б 3:2 и 5:8 соответственно.
ВЫВОДЫ
- Разработан новый однореакторный метод синтеза 1,1-диэтокси-3-изотиоцианатобутана, позволяющий существенно упростить приготовление и увеличить выход целевого продукта. Впервые изучены его реакции с азотистыми нуклеофилами и разработан способ получения N(1)-замещенных 6-этокситетрагидро-2(1Н)-пиримидинтионов на его основе.
- Обнаружено, что под действием кислот N(1)-этиларил-6-гидрокситетрагидро-2(1Н)-пиримидинтионы способны к внутримолекулярной циклизации с образованием 1,2,3,6,7,11b-гексагидро-4Н-пиримидо[6,1а]изохинолин-4-тионов и 2,3,6,7,12,12b-гексагидропиримидо[6,1-а]--карболин-4(1Н)-тионов. Разработаны способы получения этих соединений, основанные на кислотно катализируемой каскадной циклизации N-(3,3-диэтоксипропил)-N’-арилэтилтиомочевин, конденсации фенилэтиламинов или триптамина с 1,3-изотиоцианатокарбонильными соединениями, а также однореакторный способ получения, позволяющий синтезировать эти соединения из коммерчески доступных,-непредельных карбонильных альдегидов или кетонов и фенилэтиламинов или триптамина.
- Выявлено влияние заместителей на формирование 1,2,3,6,7,11b-гексагидро-4Н-пиримидо[6,1а]изохинолин-4-тионов и 2,3,6,7,12,12b-гексагидропиримидо[6,1-а]--карболин-4(1Н)-тионов. Показано, что в случае введения донорных заместителей в ароматическое ядро фенилэтильного фрагмента предшественника циклизация протекает легче. Введение заместителей в положения С(5) и С(6) пиримидинового цикла затрудняет циклизацию.
- Изучены реакции 1,2,3,6,7,11b-гексагидро-4Н-пиримидо[6,1а]изохинолин-4-тионов и 2,3,6,7,12,12b-гексагидропиримидо[6,1-а]--карболин-4(1Н)-тионов с алкилирующими реагентами, а также превращения тиоуреидного фрагмента в уреидный и метилендиаминовый.
- Впервые установлено, что взаимодействие,-непредельных карбонильных соединений с N-арилэтилмочевинами приводит к образованию 1,2,3,6,7,11b-гексагидро-4Н-пиримидо[6,1а]изохинолин-4-онов и 2,3,6,7,12, 12b-гексагидропиримидо[6,1-а]--карболин-4(1Н)-онов в результате каскадных циклизаций.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ ДИССЕРТАЦИИ ОПУБЛИКОВАНЫ В РАБОТАХ:
- Фисюк А. С., Рыжова Е. А., Шаталин Ю. В., Муканов А. Ю. Синтез 1,2,3,6,7,11b-гексагидро-4Н-пирмидо[6,1-а]изохинолин-4-тионов и 2,3,6,7,12, 12b-гексагидропиримидо[6,1-а]--карболин-4(1Н)-тионов // Тез. докл. Международной конференции «Современные проблемы органической химии» (Новосибирск, 2001). - С. 133.
- Фисюк А. С., Муканов А. Ю., Рабинович В. Б. Реакции 1,3-изотиоцианатокарбонильных соединений с азотистыми бинуклеофилами // Тез. докл. Второго Евроазиатского съезда «Гетероциклы в органической и комбинаторной химии» (Великий Новгород, 2002). - С. 19.
- Фисюк А. С., Муканов А. Ю. Новый метод синтеза 1,2,3,6,7,11b-гексагидро-4Н-пиримидо[6,1-а]изохинолин-4-тионов и 2,3,6,7,12,12b-гексагидропиримидо[6,1-а]--карболин-4(1Н)-тионов // ХГС. - 2003. - 428(2). - С. 307-309.
- Фисюк А. С., Муканов А. Ю. Новый метод получения аннелированных пиримидинтионов // Вестник Омского университета. - 2003. - № 2. - С. 28-30.
- Фисюк А. С., Муканов А. Ю. Синтез производных 1,2,3,6,7,12b-гексагидро-4Н-пиримидо[6,1-а]изохинолина и 2,3,6,7,12,12b-гексагидропиримидо[6,1-а]--карболина // Вестник Омского университета. - 2003. - № 3. - С. 42-44.
- Фисюк А. С., Муканов А. Ю., Рабинович В. Б. 1,1-Диэтокси-3-изотиоцианатобутан – новый синтон в синтезе гетероциклов // Тез. докл. Четвертого Всероссийского симпозиума по органической химии «Органическая химия – упадок или возрождение?» (Теплоход Москва – Углич, 2003). - С. 175.
- Фисюк А. С., Муканов А. Ю., Терентьева О. В., Рабинович В. Б. Синтез 1,1-диэтокси-3-изотиоцианатобутана и реакции на его основе // Тез. докл. Молодежной научной школы-конференции «Актуальные проблемы органической химии» (Новосибирск, 2003). - С. 151.
- Fisyuk A. S., Novikova E. Yu., Mukanov A. Yu. New Synthesis of 1,2,3,6,7,12b-hexahydro-4H-pyrimido[6,1-a]isoquinolin-4-ones and 2,3,6,7,12,12b-hexahydropyrimido[1’,6’:1,2]pyrido[3,4-b]indol-4(1H)-ones // Mendeleev. Comm. - 2003. – N 6. - P. 278-280.

