Синтез структурных аналогов гидрированных 1,4-бенздиазепинов
На правах рукописи
АВЕРЬЯНОВА ЕЛЕНА ВИТАЛЬЕВНА
СИНТЕЗ СТРУКТУРНЫХ АНАЛОГОВ
ГИДРИРОВАННЫХ 1,4-БЕНЗДИАЗЕПИНОВ
Специальность 02.00.03 – органическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Барнаул 2006
Работа выполнена на кафедре биотехнологии Бийского технологического института (филиала) Алтайского государственного технического университета им. И.И. Ползунова
Научный руководитель: кандидат химических наук,
доцент
Севодин Валерий Павлович
Официальные оппоненты: доктор химических наук,
профессор
Гареев Гегель Амирович
кандидат химических наук,
доцент
Сиянко Петр Иванович
Ведущая организация: Институт проблем химико-энергетических
технологий СО РАН, г. Бийск
Защита состоится 27 октября 2006 года в 12.00 часов в ауд. № 304 на заседании диссертационного совета К 212.004.06 в Алтайском государственном техническом университете им. И.И. Ползунова по адресу: 656038, г. Барнаул, пер. Некрасова 64 (химический корпус).
С диссертацией можно ознакомиться в библиотеке Алтайского государственного технического университета им. И.И. Ползунова.
Автореферат разослан « 27 » сентября 2006 года
Учёный секретарь
диссертационного совета
к.х.н., доцент Напилкова О.А.
1 ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Производные 1,4-бенздиазепинов до настоящего времени занимают ведущее место, в первую очередь, среди транквилизирующих лекарственных средств. Структурной основой углеродного фрагмента молекулы бенздиазепинов служит, как правило, бензгидрильный, или, в более общем случае, диарилметиновый фрагмент. Вероятно, наличием такого фрагмента объясняется побочное транквилизирующее действие таких лекарственных средств, как димедрол, фенкарол, тавегил и др.
Для производных бенздиазепинов детально изучено влияние заместителей на их биологическую активность. Результатом такого планомерного изучения явилось создание лекарственных средств нового поколения, таких как флунитразепам, темазепам, флуразепам. В тоже время в литературе недостаточно представлены работы по синтезу в ряду гидрированных производных 1,4-бенздиазепинов, а также их нециклических аналогов.
В этой связи поиск общих препаративных методов синтеза подобных структур является актуальной задачей, так как открывает новые пути для целенаправленного поиска соединений 1,4-бенздиазепинового ряда с ценными практическими свойствами.
Целью работы является разработка простых препаративных методов получения гидрированных бенздиазепинов, а также их циклических и нециклических аналогов.
Для достижения поставленной цели решались следующие задачи:
– синтез на основе доступного 2-хлор-5-нитробензофенона бензгидрильных производных аминов;
– синтез бензоксазинов с последующим их аминированием до диалкиламинобензгидрилов;
– синтез моноарилированных бифункциональных аминов;
– разработка на основе водного раствора этилендиамина способа получения 2,3-дигидро-7-нитро-5-фенил-1Н-1,4-бенздиазепина – исходного соединения в синтезе гидрированных 1,4-бенздиазепинов, а также ключевого промежуточного продукта в синтезе нитразепама.
– синтез N-алкилированных и N-ацилированных производных гидрированных 1,4-бенздиазепинов.
Научная новизна:
– изучено поведение производных 2-амино-5-нитробензофенона в реакциях восстановления;
– впервые показана возможность окислительного деалкилирования N-алкилзамещенных 2-амино-5-нитробензофенонов;
– разработан новый одностадийный метод синтеза фенилбензоксазинов;
– на примере синтеза 2-амино-5-нитробензгидрилморфолина показана принципиальная возможность получения диалкиламинобензгидрилов при аминировании фенилбензоксазинов;
– разработан простой способ получения N-алкил- и N-ацилзамещенных производных гидрированных 1,4-бенздиазепинов.
Практическая значимость. Разработан препаративный метод синтеза N-моно-(2-замещенных-4-нитрофенил)пиперазинов, который позволяет получать нециклические аналоги 1,4-бенздиазепинов.
Предложен простой способ получения диалкиламинобензгид-рилов, дающий возможность получать подобные соединения из фенилбензоксазинов в одну стадию с удовлетворительным выходом.
Показана возможность замены безводного этилендиамина на его 70%-ный раствор в процессе получения 2,3-дигидро-7-нитро-5-фенил-1Н-1,4-бенздиазепина – промежуточного продукта в синтезе нитразепама и ниметазепама.
Разработан общий метод синтеза 1-ацил- и 4-алкилзамещенных 1,4-бенздиазепинов, среди которых могут быть найдены вещества, обладающие биологической активностью.
Положения, выносимые на защиту.
1. Разработка подходов к синтезу орто-диалкиламино-5-нитробензофенонов и орто-диалкиламино-5-нитробензгидролов.
2. Синтез N-замещенных 2-аминобензгидриламинов и их циклических аналогов.
Апробация работы. Результаты работы представлены в докладах Всероссийских научно-практических конференций “Прикладные аспекты совершенствования химических технологий и материалов” г. Бийск, 1997, 1998; Региональной научно-практической конференции “Наука и технологии: реконструкция и конверсия предприятий” г. Бийск, 1999; Всероссийской научно-технической конференции “Лекарственные средства и пищевые добавки на основе растительного сырья” г. Бийск, 2001; Всероссийской научно-технической конференции “Наука-производство-технология-экология” г. Киров, 2006; IX международной научно-практической конференции “Химия – XXI век: новые технологии, новые продукты” г. Кемерово, 2006; VIII Международной научно-практической конференции “Новые химические технологии: производство и применение” г. Пенза, 2006; Международной научной конференции “Химия, химическая технология и биотехнология на рубеже тысячелетий” г. Томск, 2006.
Публикации. Основные положения диссертации опубликованы в 11 работах, из них статей в изданиях, рекомендованных ВАК – 3.
Объем и структура работы. Диссертация состоит из введения, трёх глав, выводов и изложена на 129 страницах, включающих 15 таблиц, списка литературы из 130 наименований и приложения.
Достоверность результатов подтверждается применением современных химических и физико-химических методов исследования, выполненных на оборудовании с высоким классом точности.
2 КРАТКОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении кратко сформулирована актуальность, цель, задачи исследования и научная новизна работы.
В первой главе представлено обобщение результатов исследований по методам синтеза и химическим свойствам 2-аминобензгидролов, 2-аминобензгидриламинов и тетрагидробенздиазе-пинов, выполненных как зарубежными, так и отечественными авторами.
Во второй главе представлены результаты собственных исследований, их обсуждение и анализ.
В третьей главе приведены характеристики используемых в работе веществ, описаны методики синтезов и исследования свойств бензгидрильных производных аминов и 1,4-бенздиазепинов.
В приложении приведены ИК-, УФ-спектры, ЯМР синтезированных соединений.
3 ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
3.1 Постановка задачи
Так как 1,4-бенздиазепины представляют собой конденсированные гетероциклические системы, состоящие из бензгидрильного фрагмента и 1,4-диазепинового ядра, присутствие в их молекуле иминной и аминной (а в случае бенздиазепин-2-онов амидной) связей позволяет предположить, что полученные в результате N1-C2 и N4-C5 расчленения вещества (схема 3.1) могут оказаться перспективными в качестве исходных соединений для синтеза циклических и нециклических аналогов 1,4-бенздиазепинов.

Схема 3.1
3.2 Синтез N-замещённых 2-амино-5-нитробензофенонов
Для синтеза структур B, C, D, E, полученных в результате ретросинтетического анализа, в качестве исходного реагента был выбран 2-хлор-5-нитробензофенон, который является доступным соединением, и вступает в реакцию нуклеофильного замещения с первичными и вторичными аминами.
Синтез соединений ряда N-моно- и N,N-дизамещённых 2-амино-5-нитробензофенонов 3а-н осуществлен реакцией арилирования аминов согласно схеме 3.2.

Схема 3.2
Реакция арилирования проводилась в типичных для подобных превращений условиях: полярный растворитель, продолжительность реакции от 0,5 до 8 часов при температуре от 55 до 130 °С в зависимости от исходного амина. Высокие выходы полученных аминов хорошо согласуются с наличием в бензольном кольце электроноакцепторной нитрогруппы.
В результате реакции арилирования получены N-моно- и N,N-дизамещённые 2-амино-5-нитробензофеноны, выходы и температуры плавления которых, а также условия реакции (температура процесса – Т, продолжительность –, растворитель) приведены в таблице 3.1.
Таблица 3.1 – Зависимость выхода N-замещенных 2-амино-5-нитробензофенонов от условий реакции арилирования аминов
| 3 | R1 | R2 | Т, °С | , ч | Раствори-тель, выход, % | Тпл., °С |
| а | Н | Н | 130 | 4 | ЭГ 75 | 166-168 |
| б | СН3 | СН3 | 60 | 0,5 | ДМФА 100 | 133-134 |
| в | Н | СН3 | 80 | 0,5 | ДМФА 95 | 168-170 |
| г | Н | С2Н5 | 80 | 0,5 | ДМФА 97 | 170-172 |
| д | Н | 90 | 4 | ДМСО 97 | 100-101 | |
| е | Н | Ph | 60 | 1 | ДМСО 83 | 145 |
| ж | Н | Bz | 80 | 0,5 | ДМСО 94 | 117 |
| з | Н | 90 | 0,5 | ДМСО 80 | 101-102 | |
| и | Н | (СН2)2ОН | 65 | 7 | ИПС 78 | 126,5-127,5 |
| к | (СН2)2ОН | (СН2)2ОН | 65 | 8 | ИПС 96 | 146,5-147 |
| л | -(СН2)2-О-(СН2)2- | 55 | 4 | ИПС 93 | 130-131 | |
| м | -(СН2)2-NH-(СН2)2- | 65 | 3 | ИПС 90 | 141-142 | |
| н | 100 | 8 | ДМСО 90 | 118-120 | ||
Строение полученных соединений подтверждено спектральными методами. В ИК-спектрах синтезированных кетонов 3а-н в области 3200-3460 см-1 имеются полосы поглощения свободных и водородносвязанных групп N-Н, карбонильной группы при 1628-1640 см-1 и другие полосы, обычно регистрируемые для ароматических систем, подтверждающие структуру полученных соединений. В УФ-спектрах имеются три полосы поглощения: первая характеризует бензольные кольца (202-205 нм), вторая – сопряженную с бензольным кольцом аминогруппу (226-258 нм), третья – нитрогруппу (360-388 нм).
Для N-алкилзамещенных 2-амино-5-нитробензофенонов показана возможность удаления алкильной группы. Расщепление связи С-N проведено по реакции окислительного деалкилирования хромовым ангидридом в уксусной кислоте по схеме 3.3. Отмечено, что продуктами реакции являются карбонильные соединения и 2-амино-5-нитробензофенон, который оказался стабилен в условиях реакции и выделен из реакционной массы с выходом 75 %:
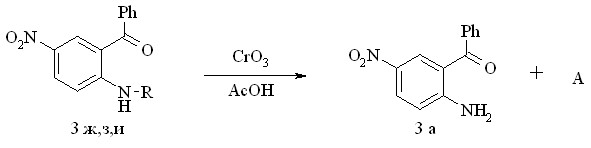
где R – бензил; -фенилэтиламин; циклогексил;
А – бензальдегид; ацетофенон; адипиновая кислота.
Схема 3.3
Среди синтезированных N-замещенных орто-аминобензофенонов имеются как моно-, так и бифункциональные соединения – диэтаноламино-, морфолино-, пиперазинобензофеноны. Наибольшую сложность в реакциях нуклеофильного замещения представляют соединения, в структуру которых входит этилендиаминовый фрагмент, в частности пиперазин, который в условиях реакции дает продукты как моно-, так и бис-арилирования. Моноарилированные пиперазины являются нециклическими аналогами 1,4-бенздиазепина, но получить их известными способами не представляется возможным из-за наличия в молекуле пиперазина двух равноценных реакционных центров.
Нами показано, что для получения продукта моноарилирования (схема 3.4) целесообразно постепенно прибавлять кетон к раствору амина и установлено, что на соотношение продуктов реакции существенное влияние оказывают температура и выбор растворителя.
 ,
,
где 1, 3, 8: R= -Ph; 4, 6: R= -OH; 5, 7: R= -OСН3.
Схема 3.4
Строение продукта моноарилирования 3м подтверждено встречным синтезом, а именно, циклизацией 2-N,N-(-галоген)диэтиламино-5-нитробензофенонов тозиламидом, с последующим удалением защитной группы в жестких условиях. (Схема 3.5).

Схема 3.5
По этой же методике продукты моноарилирования были получены для 2-хлор-5-нитробензойной кислоты и её метилового эфира. При арилировании пиперазина метиловым эфиром 2-хлор-5-нитробензойной кислоты можно было ожидать протекания конкурирующей реакции ацилирования. Для выяснения направления реакции были получены в качестве свидетелей замещенные N-бензоил- и N,N/-дибензоилпиперазины в водно-ацетоновом буфере. Однако продукты реакции ацилирования при арилировании не обнаружены. Наличие в молекуле N,N/-дибензоилпиперазина атома хлора в орто-положении к карбонильной группе подтверждено реакцией аминирования диметиламином.
Таким образом, можно утверждать, что разработанный нами метод моноарилирования пиперазина является общим и достаточно простым.
Молекула пиперазина содержит в своей структуре этилендиаминовый фрагмент, однако, этилендиамин, имеющий первичные аминогруппы, в отличие от пиперазина, в условиях реакции арилирования, в зависимости от соотношения реагентов, дает различные соединения, согласно схемам 3.6 и 3.7. Так, в случае избытка этилендиамина образуется основание Шиффа 9, а при избытке кетона наблюдается арилирование этилендиамина по обеим аминогруппам:

Схема 3.6
При эквимолярном соотношении реагентов образуется продукт циклизации 2,3-дигидро-7-нитро-5-фенил-1Н-1,4-бенздиазепин 11:
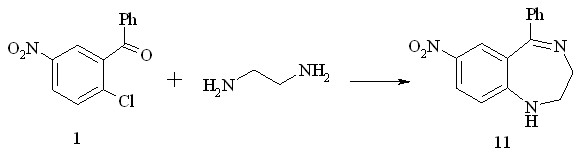
Схема 3.7
Кроме того, показано, что при использовании в качестве растворителя этиленгликоля продуктом реакции аминирования по данным ТСХ является исключительно 11 в независимости от соотношения реагентов. В ходе работы установлено влияние соотношения реагентов на продолжительность реакции (), выход и качество целевого продукта 11. Данные проведенных экспериментов представлены в таблице 3.2.
Таблица 3.2 – Зависимость выхода 2,3-дигидро-7-нитро-5-фенил-1Н-1,4-бенздиазепина от условий реакции
| Соотношение реагентов ХНБФ : этилендиамин | реакции, мин. | Концентрация этилендиамина, % | Выход, % | Т пл., °С |
| 1 : 5 | 240 | 70 | 63,3 | 205-208 |
| 1 : 2 | 240 | 100 | 99,1 | 209-211 |
| 1 : 2 | 120 | 100 | 97,1 | 209-211 |
| 1 : 1,2 | 240 | 100 | 90,6 | 211-211,5 |
| 1 : 1,5 | 180 | 100 | 99,5 | 207,5-209 |
| 1 : 1,5 | 90 | 70 | 91,8 | 201-206 |
| 1 : 1,5 | 120 | 70 | 96,8 | 205-207 |
На основании полученных результатов показана возможность замены безводного этилендиамина на коммерческий реактив, с содержанием основного вещества 70 %, при этом качество и выход получаемого продукта различаются несущественно.
3.3 Исследование закономерностей восстановления N-замещенных 2-амино-5-нитробензофенонов
Для получения функциональных производных по атому углерода карбонильной группы проведено восстановление N-замещенных 2-амино-5-нитробензофенонов.
Несмотря на легкость восстановления исходного 2-хлор-5-нитробензофенона изопропилатом алюминия в изопропиловом спирте по реакции Меервейна-Понндорфа-Верлея, получить производные 2-амино-5-нитробензгидрола этим методом не удалось даже при большом избытке восстанавливающего агента, что связано со стерео-эффектом заместителя в орто-положении к карбонильной группе и возможностью образования комплексов аминогруппы с солями алюминия.
Общим методом восстановления бензофенонов, содержащих в положении 5 бензольного кольца нитрогруппу, по-видимому, можно считать восстановление комплексными гидридами металлов, такими как боргидрид натрия. Преимуществом этого метода восстановления являются высокие выходы бензгидролов, протекание реакции в мягких условиях за непродолжительное время и селективность восстановления карбонильной группы. Реакцию проводили в изопропиловом спирте при температуре кипения растворителя в течение 3 часов.

Схема 3.8
Таким образом, был получен ряд замещенных бензгидролов, приведенных в таблице 3.3.
Таблица 3.3 – Некоторые характеристики синтезированных бензгидролов
| 12 | R1 | R2 | Выход, % | Тпл., °С | , см-1 (ОН) |
| а | Н | Н | количественный | 116-117 | 3377 |
| б | СН3 | СН3 | количественный | 85-86 | 3472 |
| к | (СН2)2ОН | (СН2)2ОН | 73 | 119-120 | 3380 |
| о | (СН2)2Cl | (СН2)2Cl | 65 | 94-96 | – |
| л | -(СН2)2-О-(СН2)2- | количественный | 116-117 | 3363 | |
| м | -(СН2)2-NH-(СН2)2- | количественный | 189-190 | 3406 | |
В ИК-спектрах синтезированных бензгидролов 12 отсутствует полоса в области 1700 см-1, характерная для карбонильной группы, а в УФ-спектрах имеется две полосы поглощения, имеющие близкие значения длин волн.
При восстановлении карбонильной группы амино- и ацетамидобензофенона гидразингидратом по Кижнеру-Вольфу в жестких условиях происходит осмоление продуктов реакции, а в мягких условиях получены производные гидразона 13 и бензотриазоцина 14, соответственно, согласно схеме 3.9.

Схема 3.9
3.4 Синтез бензоксазинов
В ряде работ показана возможность получения орто-амино-бензгидриламинов восстановлением диарилметилиденаминов, полученных из орто-аминобензофенонов. Определенный практический интерес могут представлять орто-аминобензгидрилдиалкиламины как средства, улучшающие мозговое кровообращение, антигистаминные препараты и др., однако, в литературе отсутствуют надежные способы их получения. Нами показано, что для синтеза диалкиламинобензгидрилов, являющихся структурными аналогами 1,4-бенздиазепинов, могут быть использованы в качестве исходных соединений бензоксазины.
Бензоксазины 15 получены из замещенных 2-амино-бензгидролов 12 двумя методами (см. схему 3.10): циклизацией фосгеном (метод А) и из трихлорацетамида 16 с последующей циклизацией в присутствии оснований (метод Б).

где Х = NO2 или Сl
Схема 3.10
Оказалось, что второй метод не дает каких-либо преимуществ, так как выходы в пересчете на исходный бензгидрол различаются несущественно, кроме того, отмечена необходимость подбора растворителя на стадии циклизации по методу Б. Так, при замене заместителя в соединении 12 с электронодонорного хлора на электроноакцепторную нитрогруппу в метаноле происходит гидролиз амидной связи, а в присутствии этилового спирта образуется бензоксазин, что связано с различной основностью реагента в спиртах.
ИК-, УФ- и ЯМР-спектры бензоксазинов, полученных разными методами идентичны.
Наличие в орто-аминобензгидролах 12 гидроксильной и аминогруппы подтверждено реакцией конденсации с бензальдегидом, которая показана на примере 2-(N--фенилэтил)амино-5-нитробензгидрола по схеме 3.11.

Схема 3.11
Исходя из структуры бензоксазинов и способности к расщеплению их гетероциклов, следует, что соединения этого класса могут вступать в реакции аминирования. Расщепление оксазинового цикла осуществлено путем аминирования морфолином в жестких условиях. Через 6 часов нагревания в диэтиленгликоле при 210 °С выделен 2-амино-5-нитробензгидрилморфолин 17 с выходом 30 % по схеме 3.12:

Схема 3.12
Строение полученного соединения 18 подтверждено спектральными методами и данными элементного анализа.
3.5 N-Алкилирование и N-ацилирование 2,3-дигидро-7-нитро-5-фенил-1Н-1,4-бенздиазепина
Известно, что 1,4-бенздиазепины при кипячении с метилиодидом в ацетоне кватернизуются согласно схеме 3.13.
 | X=-Hal R=-CH3, -CH2-CH=CH2, -CH2-COOC2H5. |
Схема 3.13
Этим методом получены соли 1,4-бенздиазепина 19, различающиеся характером заместителя R у атома N4 диазепинового кольца. Существенное влияние на условия проведения реакции и выходы солей оказывает характер заместителя R и степень чистоты растворителя. Так, отмечено, что соли образуются только в абсолютном ацетоне, присутствие «следовых» количеств воды приводит к их гидролизу. Показано, что хлорпроизводные алкилирующих агентов в реакцию не вступают, йодпроизводные реагируют с высоким выходом, а из бромпроизводных в реакцию вступил только бромистый аллил.
Для восстановления азометиновой связи полученных солей был выбран боргидрид натрия в изопропиловом спирте. В ходе проведенных экспериментов отмечено, что восстановление солей легко и с хорошими выходами проходит при добавлении к реакционной массе каталитических количеств воды. В водно-спиртовых растворах, при концентрации изопропилового спирта 98 % и ниже соли гидролизуются до 11, а в абсолютном спирте реакция не идет. В результате восстановления были получены 1,2,3,4-тетрагидробенздиазепины 20.
 Схема 3.14
Схема 3.14
В условиях реакции возможен гидролиз солей до 2-амино-5-нитробензофенонов. Для определения направления реакции проведен гидролиз соли 19 (R=СН3, Х=I). Отмечено, что щелочной гидролиз приводит к 11, а кислотный гидролиз возможен лишь в жестких условиях при длительном кипячении в концентрированной соляной кислоте с образованием 2-N(N’-метиламино)этиламино-5-нитро-бензофенона 21:

Схема 3.15
При ацилировании 1,4-бенздиазепина 11 по атому азота в положении 1 возможно протекание побочной реакции по атому азота в положении 4. Для предотвращения протекания побочной реакции атом N4 блокировали посредством иодметилирования. Однако получить амид 22 удалось лишь с выходом 35 % даже при четырехкратном избытке ацетилхлорида.

Схема 3.16
В случае отсутствия блокировки у N4, при ацилировании был получен амид 23 с выходом 20 %, который при кватернизации с метилиодидом дает соль 24. Выход соли составил 9 %. При попытке восстановления соли предложенным методом была получена смесь четырех веществ, которая согласно данным ТСХ состоит из соли 24, 2-амино-5-нитробензофенона 3а, 7-нитро-1-ацетил-1,2-дигидро-3[Н]-1,4-бенздиазепина 23 и не идентифицированного вещества.

Схема 16
Таким образом, можно утверждать, что структурные аналоги 1,4-бенздиазепина и его производные являются интересными и перспективными исходными соединениями, которые могут быть использованы в различных направлениях органического синтеза.
Богатые возможности, связанные с наличием в их структуре, как минимум двух, реакционноспособных центров, обеспечивают подходы к получению многочисленных органических, в том числе и гетероциклических производных, представляющих интерес для последующего биологического изучения.
ВЫВОДЫ
1. Синтезированы структурные аналоги 1,4-бенздиазепина: 2-пиперазино-5-нитробензгидрол, 2-амино-5-нитробензгидрилморфолин, 2-N(N/-метиламино)этиламино-5-нитробензофенон, N-алкил- и N-ацил-производные гидрированных 1,4-бенздиазепинов.
2. Изучены условия реакции восстановления N-замещенных 2-амино-5-нитробензофенонов; полученные N-замещенные 2-амино-5-нитробензгидролы, являются исходными соединениями в синтезе лекарственных препаратов, структурную основу которых составляет бензгидрильный фрагмент – оксатамид, циннаризин, нитразепам, клоназепам, мезапам и др.
3. Впервые показана возможность получения 2-амино-5-нитробензофенона путем окислительного деалкилирования N-алкилированных 2-амино-5-нитробензофенонов.
4. Разработан новый одностадийный метод синтеза бензоксазинов циклизацией 5-замещенных 2-аминобензгидролов с фосгеном, позволяющий получать целевые продукты как с электронодонорными, так и с электроноакцепторными заместителями в бензольном кольце.
5. Впервые синтезирован 2-амино-5-нитробензгидрилморфо-лин аминированием 4-фенил-6-нитро-1,4-дигидро-2Н-3,1-бензоксазин-2-она в жестких условиях.
6. Разработан общий препаративный метод синтеза N-моно-(2-замещенных 4-нитрофенил)пиперазинов, позволяющий получать моноарилированные пиперазины без применения защитной группы у одного из атомов азота.
7. Показана возможность использования водного 70%-ного этилендиамина для синтеза 2,3-дигидро-7-нитро-5-фенил-1Н-1,4-бенздиазепина – исходного соединения в синтезе гидрированных 1,4-бенздиазепинов, а так же лекарственного препарата «Нитразепам».
8. Изучены условия реакций получения N4-алкил- и N1-ацетил-2,3-дигидро-7-нитро-5-фенил-1Н-1,4-бенздиазепина, позволяю-щие синтезировать N-акил- и N-ацилдигидро-1,4-бенздиазепины, а также труднодоступные другими методами 2-N(N/-алкиламино)этиламино-5-нитробензофеноны.
Основное содержание работы изложено в следующих публикациях:
- Севодин В.П. Постадийное исследование процесса производства 2-амино-5-нитробензофенона и его N-замещенных / В.П. Севодин, Р.Ю. Митрофанов, В.М. Буров, Е.В. Аверьянова // Материалы региональной научно-практической конференции «Прикладные аспекты совершенствования химических технологий и материалов» – Бийск, 1997. – С. 47-55.
- Аверьянова Е.В. Окислительное дебензилирование N-замещенных 2-амино-5-нитробензофенонов / Е.В. Аверьянова, Р.Ю. Митрофанов, В.П. Севодин // Материалы Всероссийской научно-практической конференции «Прикладные аспекты совершенствования химических технологий и материалов». – Ч.1. – Бийск, 1998. – С. 21-23.
- Аверьянова Е.В. Синтез N-замещенных пиперазинов / Е.В. Аверьянова, В.П. Севодин, Т.С. Мамутина // Материалы региональной научно-практической конференции «Наука и технологии: реконструкция и конверсия предприятий». – Бийск, 2000. – С. 121-127.
- Аверьянова Е.В. Способ получения N,N-дизамещенных 2-амино-5-нитробензгидролов и их физико-химические характеристики / Е.В. Аверьянова, В.П. Севодин, Т.А. Чучина // Материалы Всероссийской научно-технической конференции «Лекарственные средства и пищевые добавки на основе растительного сырья». – Бийск, 2001. – С. 87-89.
- Аверьянова Е.В. Синтез 2-хлор-5-нитробензгидрилхлорида / Е.В. Аверьянова, В.П. Севодин // Материалы Всероссийской научно-технической конференции «Наука – производство – технология – экология». – Киров, 2006. – Т. 3. – С. 187-188.
- Аверьянова Е.В. Оптимизация условий синтеза феназепама / Е.В. Аверьянова, О.О. Писаренко, В.П. Севодин // Труды IX международной научно-практической конференции «Химия – ХХI век: новые технологии, новые продукты». – Кемерово, 2006. – С. 55-56.
- Аверьянова Е.В. Синтез 2-пиперазино-5-нитробензгидрола / Е.В. Аверьянова, В.П. Севодин // Ползуновский вестник. – 2006. – Вып. 2. –Ч.2. – С.4-6.
- Аверьянова Е.В. Арилирование пиперазина 2-замещенными 4-хлорнитробензофенонами / Е.В. Аверьянова, В.П. Севодин // Известия ВУЗов. Химия и хим. технол. – 2006. – Т. 49. – Вып. 8. – С. 102-106.
- Аверьянова Е.В. Изучение условий кватернизации 2,3-дигидро-7-нитро-5-фенил-1Н-1,4-бенздиазепина // Материалы VIII Международной научно-практической конференции «Новые химические технологии: производство и применение». – Пенза, 2006. – С. 3-5.
- Аверьянова Е.В. Изучение условий кватернизации 2,3-дигидро-7-нитро-5-фенил-1Н-1,4-бенздиазепина / Е.В. Аверьянова, Е.М. Панова, В.П. Севодин // Материалы IV Международной научной конференции «Химия, химическая технология и биотехнология на рубеже тысячелетий». – Томск, 2006. – Т. 1. – С. 185-186.
- Аверьянова Е.В. Новый синтез бензгидриламинов / Е.В. Аверьянова, В.П. Севодин // Ж. орган. химии. – 2006. – Т.42. – № 9. – С. 1430-1431.

