Синтез полигетероциклических соединений на основе реакций 3-арилметилиден-3н- фуран(пиррол)-2-онов с с-, n-, s-нуклеофилами
На правах рукописи
АНИСЬКОВА ТАТЬЯНА ВЛАДИМИРОВНА
СИНТЕЗ ПОЛИГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ НА ОСНОВЕ РЕАКЦИЙ 3-АРИЛМЕТИЛИДЕН-3Н-
ФУРАН(ПИРРОЛ)-2-ОНОВ С С-, N-, S-НУКЛЕОФИЛАМИ
02.00.03 – органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Саратов - 2009
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Саратовском государственном университете имени Н.Г. Чернышевского»
| Научный руководитель : | доктор химических наук, профессор Егорова Алевтина Юрьевна |
| Официальные оппоненты: | доктор химических наук, профессор Юровская М.А. (Московский государственный университет им. М.В. Ломоносова) доктор химических наук, доцент Пчелинцева Н.В. (Саратовский государственный университет им. Н.Г. Чернышевского) |
| Ведущая организация: | Воронежский государственный университет |
Защита состоится 1 октября 2009 года в 14.00 часов на заседании диссертационного совета Д 212.243.07 при Саратовском государственном университете имени Н.Г. Чернышевского по адресу:
410012, г. Саратов, ул. Астраханская, 83, корпус № I.
С диссертацией можно ознакомиться в Научной библиотеке
Саратовского государственного университета имени Н.Г. Чернышевского
Автореферат разослан 21 августа 2009 года
Ученый секретарь диссертационного совета,
доктор химических наук,
профессор Сорокин В.В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Важным классом гетероциклических соединений, представляющих значительный интерес вследствие разнообразия химических превращений и возможностей практического применения являются - 5R-3-арилметилиден-3Н-фуран(пиррол)-2-оны.
Постоянный интерес к гетероциклическим системам связан с их разнообразными биологическими и фармакологическими свойствами, возможностью использования в синтезе многих биологически важных веществ и лекарственных средств, перспективных для применения в медицине и сельском хозяйстве. С этой точки зрения удобными и доступными синтонами для получения различных сложнопостроенных гетероциклических систем являются 5-R-3-арилметилиден-3Н-фуран(пиррол)-2-оны.
Немаловажным фактором, стимулирующим развитие химии фуран(пиррол)-2-онов, является близость по строению рассматриваемых соединений к природным субстратам. Высокий синтетический потенциал исследуемых соединений и перспективность их использования при получении различных, в том числе труднодоступных соединений, обладающих широким спектром полезных свойств, делает их подходящими субстратами для тонкого органического синтеза.
До настоящего времени 3-арилметилиден-3Н-фуран(пиррол)-2-оны остаются не до конца исследованными соединениями. Ранее подобные структуры изучали в реакциях гидролиза, алкоголиза, с 1,3-диполями, в конденсации Михаэля с ацетилацетоном и циклогексаноном.
В связи с этим исследование химического поведения 3-арилметилиден-3Н-фуран(пиррол)-2-онов в реакциях с различными С,N, S – нуклеофильными реагентами, содержащими в своем составе в том числе и гетероциклический фрагмент, является актуальной задачей.
Настоящая работа является продолжением исследований в данной области, создает перспективу выявления новых аспектов химии этого класса соединений, синтеза новых полигетероциклических систем.
Работа является частью плановых научных исследований, проводимых на кафедре органической и биоорганической химии Саратовского государственного университета имени Н.Г.Чернышевского по теме «Теоретическое и экспериментальное исследование новых материалов и систем с заданными физико-химическими и биологическими свойствами» (рег. № 3.4.03) и гранта РФФИ «Пятичленные 2-карбонилсодержащие S, O,N-гетероциклы. Получение, избирательная реакционная способность, направленный синтез сложных гетероциклических соединений с фармакофорными фрагментами» (№05-03-32196).
Цель работы Изучение реакционной способности 5R-3-арилметилиден-3Н-фуран-2-онов и их N-содержащих гетероаналогов в реакциях с различными C-,N-,S-бинуклеофильными регентами; решение вопросов образования продуктов реакции на основании комплексного исследования методами ИК-, ЯМР1Н и 13С спектроскопии и квантово-химических расчетов; возможности практического использования впервые синтезированных соединений.
Научная новизна Изучена реакционная способность 3-арилметилиден-3Н-фуран(пиррол)-2-онов в качестве участников реакции Михаэля. Показано, что изучаемые соединения могут выступать в качестве акцептора с метиленактивными соединениями (ацетоуксуcный эфир, динитрил малоновой кислоты). Выявлены факторы, определяющие направление реакции и структуры образующихся продуктов.
Впервые проведены реакции синтезированных фуропиран-5-карбонитрилов с ацетоуксусным эфиром и алкоголятом натрия. Использование ацетоуксусного эфира приводит к образованию замещенных эфиров диоксоазациклопентанафталин-6-карбоновых кислот, рециклизация под действием алкоголята натрия осуществляется с образованием фуропиран-5-карбонитрилов.
Выявлены закономерности протекания взаимодействия исследуемых соединений с N,N- и N,S-бинуклеофильными регентами гетероциклических рядов. Показано, что направление взаимодействия определяется соотношением используемых реагентов.
Создан широкий ассортимент не имеющих аналогов азот-, кислородсодержащих гетероциклических соединений - перспективных объектов биоскрининговых исследований, стартовых веществ для тонкого органического синтеза и полупродуктов для создания новых лекарственных и сельскохозяйственных препаратов.
Практическая значимость Разработаны условия и предложены эффективные способы получения сложнопостроенных соединений с различной комбинацией гетероатомов линеарного (этил-4-арил-6-оксо-2R-4,5,6,7-тетрагидробензофуран(тетрагидро-1Н-индол)-5-карбоксилаты, замещенные фуро(1Н-пиррол)[2,3-b]пиридин-5-карбонитрилы, 6-амино-4-арил-2R-4Н-фуро[2,3-b]пиран-5-карбонитрилы, 2-амино-4-арил-4,7-дигидро-6R-пирано[2,3-b]пиррол-3-карбонитрилы, этиловые эфиры 5-амино-4-арил-7-метил-2R-4Н-1,9-диоксо-8-аза-циклопента[b]нафталин-6-карбоновых кислот, 7-арилметилиден-5R-7Н[1,2,4]триазол[4,3-а][1,3]диазепин-8(9Н)-оны, 2-(2-арил)-5-R-N-(4H-1,2,4-триазол-3-ил)-1H-пиррол-3-карбоксамиды, 2-арил-3(2-оксо-2R-этил)-2,3-дигидротиазино[3,2-а]бенз[d]имидазолы) и ангулярного (оксо(аза)циклопента[c]фенантрены) строения на основе реакций 3-арилметилиден-3Н-фуран(пиррол)-2-онов с С-,N-,S–бинуклеофильными реагентами.
Анализ компьютерных прогнозов биоактивности с использованием программы PASS показал, что для ряда исследуемых структур предсказывается ярко выраженная антикоагулянтная, дерматологическая, психотропная, обезболивающая, антиартрическая активность.
На защиту выносятся результаты исследования по:
- систематическому изучению синтетических возможностей 5R-3-арилметилиден-3Н-фуран(пиррол)-2-онов в реакциях с С-нуклеофилами (ацетоуксусный эфир, динитрил малоновой кислоты) с целью получения различных сложнопостроенных гетероциклических систем;
- изучению химического поведения впервые синтезированных 4-(хлорфенил)-2R-фуро[2,3-b]пиридин-5-карбонитрилов в реакции с ацетоуксусным эфиром и рециклизации под действием алкоголята натрия;
- изучению химических превращений 5R-3-арилметилиден-3Н-фуран(пиррол)-2-онов в реакциях с N-, N- и N-, S-бинуклеофильными реагентами (3-амино-1,2,4-триазол, 2-меркаптобензимидазол);
- установлению строения образующихся соединений на основании комплексного исследования синтезированных соединений методами ИК-, ЯМР 1Н и 13С спектроскопии и квантово-химических расчетов;
- изучению возможностей практического использования полученных соединений методом компьютерного моделирования.
Апробация работы. Основные результаты работы представлялись на XI Всероссийской научной конференции «Карбонильные соединения в синтезе гетероциклов» (Саратов, 2008), VI Всероссийской конференции молодых ученых «Современные проблемы теоретической и экспериментальной химии» (Саратов, 2007), XI Международной научно-технической конференции «Перспективы развития химии и правтического алициклических соединений» (Волгоград, 2008), Международной конференции студентов и аспирантов по фундаментальным наукам «Ломоносов-2008», «Ломоносов-2009» (Москва, 2008, 2009), Международной конференции по органической химии «Химия соединений с кратными углерод-углеродными связями» (Санкт-Петербург, 2008), XIX Международной научно-технической конференции «Химические реактивы, реагенты и процессы малотоннажной химии» (Уфа, 2006), Международной научной конференции «Фундаментальные и прикладные проблемы современной химии в исследованиях молодых ученых» (Астрахань, 2006), X Молодежной конференции по органической химии (Уфа, 2007), IX Научной школе-конференции по органической химии (Москва, 2006), III Всероссийской научно-методической конференции «Интеграция науки и образовательного процесса. Создание новых физиологически активных веществ» (Воронеж, 2007), 5-ая Международная конференция молодых ученых по органической химии (InterYCOS 2009) “Вклад университетов в развитие органической химии” (Санкт-Петербург, 2009).
Публикации. По теме диссертации опубликовано 20 научных работ, из них 13 статей, 4 статьи в центральной печати, в том числе 2 статьи в журналах, рекомендованных ВАК, 9 статей в сборниках научных трудов, 7 тезисов докладов.
Объем и структура работы. Диссертация изложена на 137 страницах машинописного текста, включая введение, четыре главы, выводы, список использованных источников из 175 наименований, 24 таблицы, 22 рисунка. Приложение содержит 29 страниц.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
- Конденсация Михаэля в ряду 5-R-3-арилметилиден-3Н-
фуран(пиррол)-2-онов.
Синтетические возможности 3-арилметилиден-3Н-фуран(пиррол)-2-онов определены наличием в структуре указанных соединений двух электрофильных центров, которые фиксированы в S-цис конфигурации, что делает возможным использование изучаемых соединений в реакции Михаэля.
Присоединение СН-кислот типа XCH2Y к,-непредельным соединениям в присутствии оснований имеет большое синтетическое значение, так как позволяет в одну стадию удлинять углеродную цепь и вводить разнообразные заместители в структуру соединения.
1,3 – Дикарбонильные соединения вследствие своего огромного разнообразия и высокой реакционной способности являются наиболее удобными строительными блоками для регио- и стереонаправленного синтеза труднодоступных соединений гетероциклических рядов. Нами в качестве 1,3 – дикарбонильного соединения использован ацетоуксусный эфир.
1.1. Взаимодействие 5-R-3-арилметилиден-3Н-фуран(пиррол)-2-онов с ацетоуксусным эфиром
Взаимодействие с ацетоуксусным эфиром изучено в различных условиях: классических условиях - нагреванием реагентов в спиртовом растворе и с использованием условий микроволнового нагрева. В результате выделены продукты реакции, которые по данным элементного анализа и спектральным характеристикам охарактеризованы как этил-4-арил-6-оксо-2R-4,5,6,7-тетрагидробензофуран-5-карбоксилаты (10-14) и этил-4-арил-6-оксо-2R-4,5,6,7-тетрагидро-1Н-индол-5-карбоксилаты (15-18).
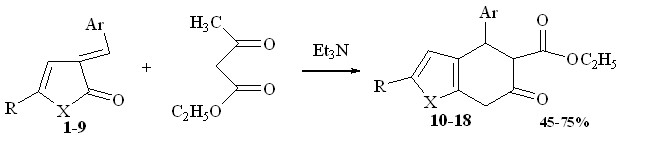
1, 10 R = p-Tol, Ar = C6H4-NO2-2, X = O; 2, 11 R = p-Tol, Ar = C6H4-Cl-2, X=O; 3, 12 R = p-Tol, Ar = C6H4-OCH3-3, X = O; 4, 13 R = p-Tol, Ar = C6H3-OH-OCH3-3,4, X = O; 5, 14 R = C6H4 -OCH3-4, Ar = C6H4-NO2-2, X = O; 6, 15 R = Ph, Ar = C6H3-OH-OCH3-3,4, X=NH; 7, 16 R = p-Tol, Ar = C6H4-Cl-2, X=NH; 8, 17 R = Ph, Ar = C6H4-N(CH3)2-3, X=NH; 9, 18 R = Ph, Ar = C6H4-OCH3-4, X=NH
В ЯМР 1Н спектрах отмечены: синглет метиленовых протонов при 3.80-3.90 м.д., дублет протона при третичном атоме углерода в области 4.83-4.91 м.д., сигнал протона атома углерода С-5 при 3.95-4.00 м.д. (J=3.53-4.04 Гц), сигналы протонов сложноэфирной группы при 1,28-1,40 м.д. и 4,09-4,15 м.д.
При использовании в качестве аддента ацетоуксусного эфира можно было ожидать неоднозначного протекания реакции. Ацетоуксусный эфир, легко депротонируются при действии триэтиламина с последующим присоединением по экзоциклической двойной связи фуран-2-онового кольца с образованием 1,5 – дикарбонильных соединений. Показано, что реакция не останавливается на этой стадии, протекает более глубоко и приводит к образованию продуктов внутримолекулярной карбоциклизации.
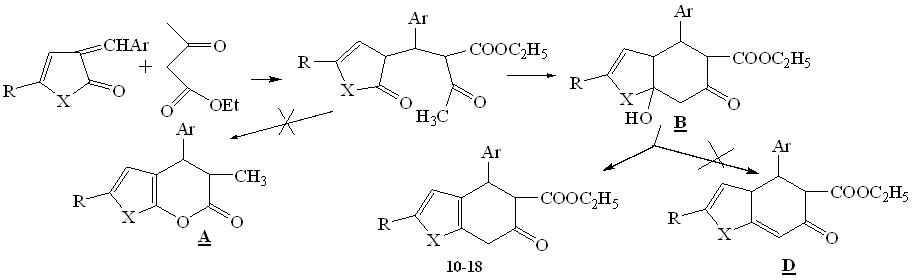
Не исключалась возможность образования соединений A, В, D, однако спектральные характеристики показывают, что данные направления не реализуются.
В последнее время возрос интерес исследователей к проведению реакции с использованием микроволновой активации. С целью повышения выхода продуктов, изменения хода протекания процесса нами были разработаны условия конденсации с использованием микроволнового нагрева. В микроволновой синтез были введены 3-арилметилиден-3Н-фуран(пиррол)-2-оны 2-4 и 7-9 с двукратным избытком ацетоуксусного эфира. Проведение синтеза в СВЧ – печи позволило сократить продолжительность процесса в среднем в 15 раз по сравнению с обычным способом осуществления реакции в спиртовом растворе и значительно повысить выход конечных продуктов реакции до 90%.
1.2 Взаимодействие 5-арил-3-арилметилиден-3Н-фуран(пиррол)-2-онов с динитрилом малоновой кислоты.
В последнее время интенсивно развивается химия функционально замещенных пиридинов. Это обусловлено как теоретическим интересом к указанному классу органических соединений, так и чрезвычайно широким диапазоном практического использования производных пиридинового ряда. Высокий практический потенциал производных пиридина стимулировал разработку таких методов их синтеза, которые позволили бы обойти инертность пиридинового ядра, получать замещенные пиридины. Одним из возможных классов для получения пиридиновых систем явились достаточно доступные 5-арил-3-арилметилиден-3Н-фуран(пиррол)-2-оны. Известно, что наиболее простые и удобные методы синтеза функционально замещенных пиридинов основаны на использовании в качестве реагента малононитрила.
Взаимодействие 5-арил-3-арилметилиден-3Н-фуран(пиррол)-2-онов с малононитрилом было изучено в различных условиях, показано что в зависимости от условий проведения реакции, используемого растворителя, характера заместителя в арилметилиденовом фрагменте фуран-2-она были получены различные продукты реакции.
Взаимодействие 5-арил-3-арилметилиден-3Н-фуран(пиррол)-2-онов 2,7,19,20 с малононитрилом при нагревании реагентов в растворе абсолютного спирта, в присутствии триэтиламина, приводит к образованию 4-арил-2R-фуро[2,3-b]пиридин-5-карбонитрилов (21, 23) и 4-арил-2R-пиррол[2,3-b]пиридин-5-карбонитрилов (22, 24).
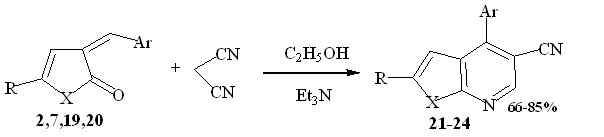
2, 21 R = p-Tol, X = O, Ar=C6H4-Cl-2; 7, 22 R = p-Tol, X=NH, Ar=C6H4-Cl-2.
19, 23 R = Ph, X = O, Ar=C6H4-Cl-2; 20, 24 R = Ph, X=NH, Ar=C6H4-Cl-2;
В спектрах ЯМР1Н отмечены: синглет протона фуранового (пиррольного) кольца при 5.63-6.43 м.д., серия сигналов протонов ароматического заместителя при 6.53-7.82 м.д. Отсутствие в сильном поле сигналов протонов характерных для этоксигруппы, также подтверждает предложенную структуру. Количество и положение сигналов в спектрах ЯМР13С полностью соответствуют структуре соединений 21-24.
Под действием органического основания происходит генерация карбаниона малононитрила с присоединением его по экзоциклической двойной связи С=С, с образованием аддукта Михаэля.
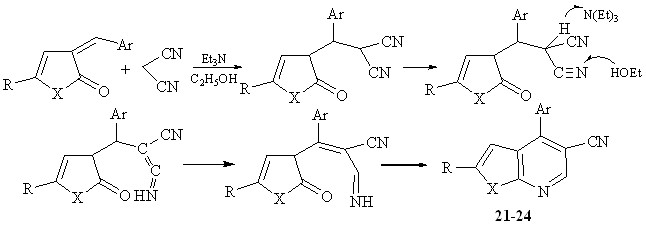
Дальнейшая активация интермедиата под действием основания способствует реакции по типу Торпа-Циглера, последующая гетероциклизация приводит к образованию фуро(пиррол)пиридинов.
С целью сохранения функциональных групп и более полного изучения данного взаимодействия, нами был заменен растворитель протонный полярный и реакционноспособный этанол на апротонный полярный диметилсульфоксид.
Взаимодействие 5-арил-3-арилметилиден-3Н-фуран(пиррол)-2-онов с малононитрилом осуществляли в растворе диметилсульфоксида в присутствии триэтиламина. По данным ИК, ЯМР1Н-спектроскопии продукты реакции охарактеризованы как 6-амино-4-арил-2R-4Н-фуро[2,3-b]пиран-5-карбонитрилы (27,29,31) и 2-амино-4-арил-4,7-дигидро-6R-пирано[2,3-b]пиррол-3-карбонитрилы (28, 30,32), которые выделены с выходом до 88%.
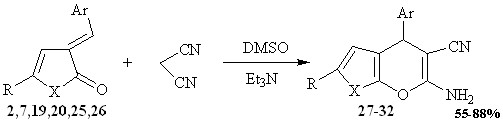
2, 27 R=p-Tol, Ar=C6H4-Cl-2, X=O; 7, 28 R=p-Tol, Ar=C6H4-Cl-2, X=NH;
19, 29 R=Ph, Ar=C6H4-Cl-2, X=O; 20, 30 R=Ph, Ar=C6H4-Cl-2, X=NH;
25, 31 R=С6Н4-ОСН3-3, Ar=C6H4-Cl-2, X=O; 26, 32 R=С6Н4-ОСН3-3, Ar=C6H4-Cl-2, X=NH.
ЯМР1Н спектры соединений 27-32 содержат: сигнал протонов аминогруппы в сильном поле при 1,64-2,20 м.д. (2Н, с), сигнал протона при третичном атоме углерода при 4,80-5.20 м.д., а также сигналы протонов ароматических заместителей в слабом поле.
Взаимодействие 5-арил-3-арилметилиден-3Н-фуран(пиррол)-2-онов с малононитрилом в присутствии триэтиламина протекает по схеме каскадной гетероциклизации. Первоначально происходит присоединение карбаниона малононитрила по активированной С=С связи еноновой системы исследуемых соединений с образованием продуктов присоединения. Далее происходит нуклеофильная атака атома кислорода по атому углерода цианогруппы с образованием продукта О-гетероциклизации (интермедиата А), образующийся имин стабилизируется в форме енамина 27-32.
Впервые синтезированные фуропираны 27, 29, 31 в свою очередь являются полифункциональными соединениями, обладающие высокой химической активностью и разнообразным биологическим действием, что обуславливает интерес к поиску эффективных методов синтеза соединений этого ряда. В связи с этим нами разработаны методы синтеза данных соединений, основанные на использовании в качестве аддентов конденсации Михаэля 5-R-3Н-фуран-2-онов.
5-R-3H-Фуран-2-оны являются многоцентровыми соединениями, что делает перспективным использование их в различного рода реакциях, в том числе в тандемных реакциях, которые могут служить основой для направленного органического синтеза. Наиболее простыми и удобными синтонами для данного типа взаимодействий являются непредельные нитрилы. Наличие в молекулах этих соединений нескольких реакционных центров обуславливает разнообразие их химических превращений.
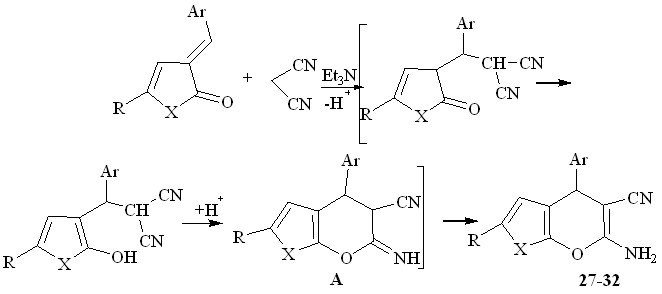
Нами было изучено взаимодействие незамещенных 5-R-3Н-фуран-2-онов (32 - 34) с непредельными нитрилами.
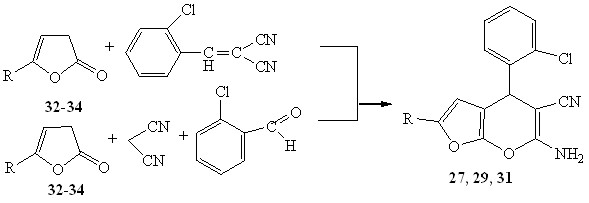
27, 32 R= p-Tol; 29, 33 R=Ph; 31, 34 R=С6Н4-ОСН3-3
Взаимодействие проводилось в среде диметилсульфоксида в присутствии органического основания (триэтиламин). Вероятно, первоначально происходит присоединение по Михаэлю к активированной двойной связи непредельного нитрила, после чего следует нуклеофильная атака на атом углерода цианогруппы, что приводит к формированию пиранового кольца, с образованием соединений 27, 29, 31.
Особый интерес представляют многокомпонентные каскадные реакции, как методы синтеза полифункциональных карбо- и гетероциклических соединений, потенциально обладающих биологической активностью. С целью увеличения выходов продуктов реакции нами был осуществлен трехкомпонентный синтез. Субстраты, используемые в трехкомпонентной конденсации, содержат несколько реакционных центров, что делает возможным различные комбинации попарных реакций всех компонентов. Однако выделить интермедиат нам не удалось, что затрудняет выбор первоначального направления реакции.
Вероятно, на начальной стадии происходит конденсация Кневенагеля ароматического альдегида с динитрилом малоновой кислоты с последующей реакцией фуран-2-она с непредельным нитрилом. Дальнейшая циклизация приводит к 6-амино-4-арил-2R-4Н-фуро[2,3-b]пиран-5-карбонитрилам 27, 29, 31.
Возможен и другой путь, по которому первоначально происходит взаимодействие альдегида с фуран-2-онам, с образованием 3-арилметилен-3Н-фуран-2-онов, дальнейшее присоединение к нему динитрила малоновой кислоты и гетероциклизация. Физико-химические характеристики соединений полученных на основе (арилметилиден)фуран-2-онов и с использованием мультикомпонентных реакций полностью совпадают.
В реакцию с малононитрилом были введены 5-R-3-(2-гидроксифенилметилиден)-3Н-фуран(пиррол)-2-оны. Условия реакции аналогичны выше описанным. На основании данных физико-химических методов исследования продукты реакции охарактеризованы как 5-имино-6-амино-2R-11bH-3,4,7-триоксоциклопента[c]фенантрены 37, 38 и 5-имино-6-амино-2R-3,11b-дигидро-4,7-диоксо-3- азациклопента[c] фенантрены 39,40.
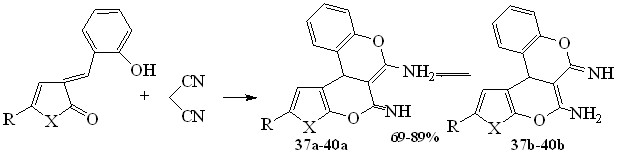
33, 37 R=Ph, X=O; 34, 38 R=p-Tol, X=O; 35, 39 R=Ph, X=NH; 36, 40 R=p-Tol, X=NH
ЯМР1Н спектры соединений 37-40 содержат: синглет протона при третичном атоме углерода в области 4.22-4.40 м.д., а также синглеты протонов амино- и иминогрупп при 7.93-8.92 м.д. и 7.67-7.92 м.д. соответственно. В спектрах ЯМР13С (для соединений 37, 40) отмечены: сигнал третичного атома углерода в области 25.91-37.34 м.д., в слабом поле отмечена серия сигналов sp2-гибридных атомов углерода в области 116.55-137.69 м.д., также в слабом поле отмечены сигналы sp2-гибридных атомов углерода иминогруппы в области 168.95-179.56 м.д. и атома углерода при аминогруппе в области 144.76 - 157.99 м.д.
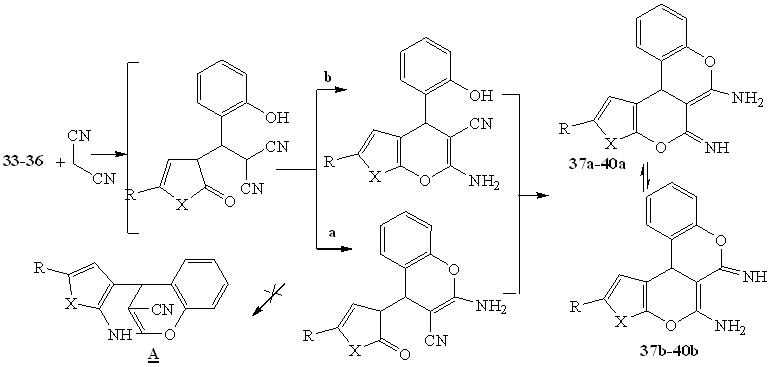
Соединения 37-40 могут существовать в различных таутомерных формах (а, b), однако, сделать заключение о преобладании одной из них на основании спектральных данных и данных квантово-химических расчетов не представляется возможным.
Вероятно на первой стадии протекает присоединение динитрила малоновой кислоты по активированной С=С связи замещенного фуран(пиррол)-2-она, с образованием аддукта Михаэля. Дальнейшая стабилизация которого может осуществляться по нескольким направлениям: либо с участием гидроксильной группы ароматического заместителя, что приводит к образованию замещенных хроменов (путь a), однако на этой стадии реакция не останавливается и дальнейшее взаимодействие цианогруппы и карбонильной группы гетерокольца (путь b) приводит к образованию конечного продукта реакции. Не исключалось первоначальное взаимодействие цианогруппы с карбонильной группой гетерокольца, с образованием фуропирановых систем, однако стабилизация последних также приводит к образованию конечных продуктов реакции.
2 Изучение химических свойств вновь синтезированных соединений.
Впервые полученные 6-амино-4-арил-2R-4Н-фуро[2,3-b]пиран-5-карбонитрилы 37-40 являются важным классом гетероциклических соединений, представляющим значительный интерес вследствие разнообразных химических превращений и возможности практического применения.
Эти бифункциональные соединения, содержащие в вицинальном положении нитрильную и аминогруппы являются перспективными исходными соединениями для получения труднодоступных аннелированных гетероциклических систем.
2.1 Взаимодействие 6-амино-4-арил-2R-4Н-фуро[2,3-b]пиран-5-карбонитрилов с ацетоуксусным эфиром
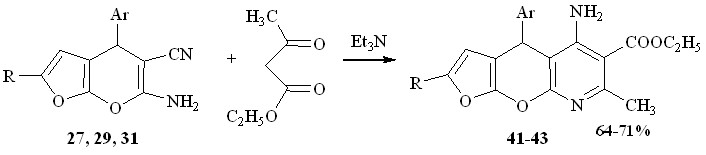
Реакция 6-амино-4-арил-2R-4Н-фуро[2,3-b]пиран-5-карбонитрилов с ацетоуксусным эфиром при нагревании в этаноле приводит к образованию этиловых эфиров 5-амино-4-арил-7-метил-2R-4Н-1,9-диоксо-8-аза-циклопента[b]нафталин–6-карбоновых кислот 41-43.
27, 41 R=C6H4-CH3-3, Ar =C6H4-Cl-2; 29, 42 R=C6H5, Ar =C6H4-Cl-2;
31, 43 R=C6H4-ОCH3-3, Ar=C6H4-Cl-2;
В ЯМР1Н спектрах соединений 41-43 отмечено появление новых сигналов: синглет протонов метильной группы сложноэфирного заместителя проявляется при 1.30-1.35 м.д., мультиплет протонов метиленовой группы сложноэфирного фрагмента расположен при 4.40-4.47 м.д., синглет протонов метильной группы отмечены 2.58-2.62 м.д. В спектрах ЯМР13С число и положение сигналов соответствует предложенной структуре.
Учитывая наличие нескольких реакционных центров в исходных соединениях, можно было ожидать образование различных продуктов. В условиях основного катализа происходит генерация карбаниона ацетоуксусного эфира и дальнейшее его присоединение по атому углерода нитрильной группы с образованием -енаминового фрагмента инермедиата А, который претерпевает внутримолекулярную гетероциклизацию за счет атаки аминогруппой карбонильного атома углерода ацетоуксусного эфира с образованием пиридинового кольца – структура 41-43 (путь а).
Не исключалась первоначальная атака по аминогруппе субстрата с участием оксогруппы ацетоуксусного эфира и образованием аминокротоната В, с последующей циклизацией с участием цианогруппы субстрата, однако, и этот путь реакции (путь b) приводит к соединениям 41-43.
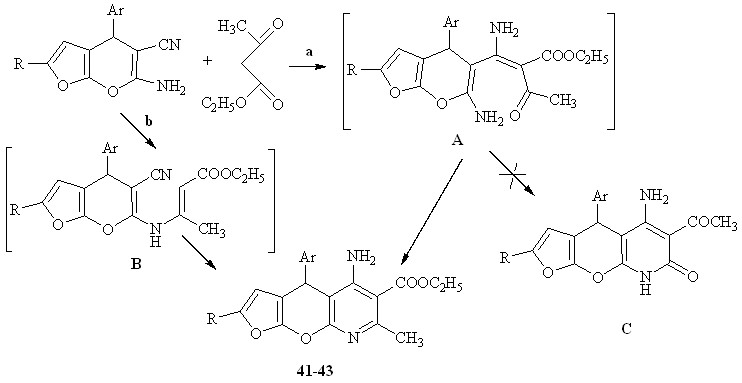 Альтернативный путь – атака аминогруппой в положении 2 пиранового фрагмента с образованием пиридиновой структуры С в изученных условиях не реализуется.
Альтернативный путь – атака аминогруппой в положении 2 пиранового фрагмента с образованием пиридиновой структуры С в изученных условиях не реализуется.
2.2 Рециклизация 6-амино-4-арил-2R-4Н-фуро[2,3-b]пиран-5-карбонитрилов под действием алкоголята натрия.
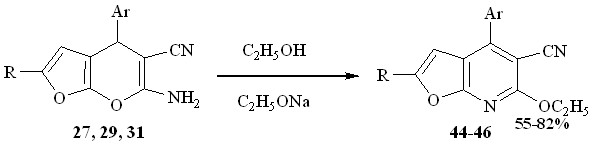
Изучено поведение фуропиранов под действием сильного нуклеофильного реагента – алкоголята натрия. Реакция алкоголята натрия и фуропиранов, при нагревании в растворе этанола приводит к 4-арил-6-этокси-2R-фуро[2,3-b]пиридин – 5-карбонитрилам 44-46.
27, 44 R=C6H4-CH3-4, Ar =C6H4-Cl-2; 29, 45 R=C6H5, Ar =C6H4-Cl-2;
31, 46 R=C6H4-ОCH3-4, Ar =C6H4-Cl-2;
В спектрах ЯМР1Н соединений 44-46 наблюдается появление серии сигналов протонов этоксигруппы при 1.42-1.47 м.д. и 4.20-4.30 м.д. Спектр ЯМР13С (соединения 45) содержит два сигнала sp3-гибридизованных атомов углерода в сильном поле при 13.53 м.д. и 66.15 м.д., в слабом поле отмечена серия сигналов sp2-гибридных атомов углерода, в области 100.08-135.45 м.д., также в слабом поле отмечен сигнал sp2-гибридного атома углерода, находящегося в -положении пиридинового кольца при 161.75 м.д..
Образование пиранового цикла соединений 27, 29, 31 за счет внутримолекулярного взаимодействия гидроксильной и цианогрупп является обратимым процессом. При определенных условиях, под действием нуклеофильных реагентов пирановый цикл может раскрываться с последующей циклизацией и ароматизацией в пиридиновую структуру за счет атаки атома азота аминогруппы. По-видимому, первоначально происходит нуклеофильное присоединение алкоголят-аниона по -углеродному атому пиранового цикла, что сопровождается раскрытием пиранового кольца.
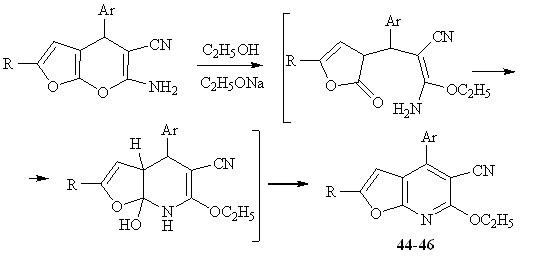
Дальнейшая атака неподеленной электронной пары атома азота по электронодефицитному атому углерода лактонной системы, циклизация и ароматизация приводит к образованию фуропиридиновых структур 44-46.
3 Взаимодействие 5-R-3-арилметилиден-3Н-фуран(пиррол)-2-онов с N,N- и N,S-бинуклеофильными реагентами
Арилметилиденовые производные 3Н-фуран(пиррол)-2-онов представляют интерес, главным образом, как промежуточные продукты, которые сочетают в себе свойства сложных эфиров и непредельных карбонильных соединений и способны реагировать с веществами, имеющими подвижные атомы водорода.
Известно, что соединения, имеющие в своем составе триазольное и бензимидазольное кольца, обладают широким диапазоном практического использования. Введение данных фрагментов в структуру синтезируемых соединений значительно расширяет области применения впервые полученных соединений на их основе.
3.1 Взаимодействие 5-R-3-арилметилиден-3Н-фуран(пиррол)-2-онов с 3-амино-1,2,4-триазолом
Введение в структуру гетероциклов триазольного кольца позволяет получать широкий набор различных сложнопостроенных систем, которые могут рассматриваться как перспективные объекты для биологического скрининга.
Взаимодействие 3-арилметилиден-3Н-фуран-2-онов с избытком 3-амино-1,2,4-триазола, путем перемешивания в спиртовом растворе при комнатной температуре приводит к 2-арилметилен-4(1,2,4-триазол-3-илимино)-4R-N-(1,2,4-триазол-3-ил) бутанамидам 49-51.
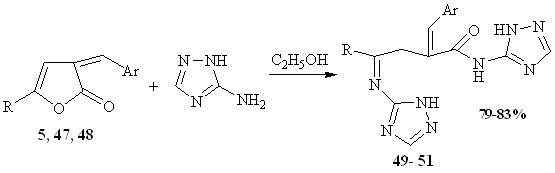
5, 49 R= C6H4-OCH3-3, Ar= C6H4-NO2-2; 47, 50 R=p-Tol, Ar=C6H3-OCH3-3,4
48, 51 R=Ph, Ar=C6H3-OCH3-3,4
Спектральные характеристики соединений 49-51 полностью подтверждают предложенную структуру.
Вероятно, одновременно происходит раскрытие лактонного кольца с образованием амида кислоты и присоединение второй молекулы триазола по свободной оксогруппе, что приводит к образованию соединений 49-51.
Вследствие низкой реакционной способности функциональных групп, стерических затруднений реакция останавливается на стадии образования соединений 49-51, и ни одно из возможных направлений циклизации не реализуется.
С целью получения N-содержащих гетероциклических систем нами были изменены условия проведения реакции.
Взаимодействие 3-арилметилиден-3Н-фуран-2-онов с 3-амино-1,2,4-триазолом было осуществлено при эквимолярном соотношении реагентов, в более жестких условиях. Реакция проводилась при кипячении в растворе этанола в течение 2-3 часов. 3-Амино-1,2,4-триазол вводился в реакцию постепенно.
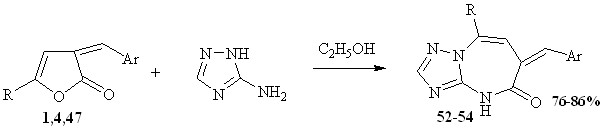
1, 52 R=p-Tol, Ar= С6Н4- NO2-2; 4, 53 R=p-Tol, Ar= C6H3-ОН,OCH3-3,4
47, 54 R= p-Tol, Ar=C6H3-OCH3-3,4
При эквимолярном соотношении реагентов взаимодействие приводит к образованию 7-арилметилиден-5R-7Н[1,2,4]триазол[4,3-а] [1,3]диазепин-8(9Н)-ононов 52-54.
Спектры ЯМР1Н соединений 52-54 содержат набор сигналов: синглет протона при шестом атоме углерода диазепинонового кольца расположен при 6.74-6.86 м.д., синглет протона экзоциклического sp2-гибридизованного атома углерода отмечен при 7.31-7.40 м.д., протон NH группы наблюдается при 8.46-8.64 м.д., протоны ароматических колец лежат при 6.95-8.24 м.д. В спектрах ЯМР13С соединения 52 отмечены: сигнал атома углерода карбонильной группы при 168.64 м.д., сигнал sp2-гибридизованного атома углерода диазепинонового кольца при 99.14 м.д., сигнал sp2-гибридизованного атома углерода триазольного кольца при 159.13 м.д.
Полифункциональность исходных соединений позволяет ожидать неоднозначного протекания реакции, получение различных, порой неожиданных, продуктов реакции. Вероятно, на первой стадии происходит атака наиболее основного центра аминотриазола по атому углерода карбонильной группы, что приводит к раскрытию лактонного кольца. Из возможных путей стабилизации образующегося интермедиата реализуется атака пары электронов атома азота по атому углерода карбонильной группы с последующей гетероциклизацией, приводит к образованию диазепиноновых структур 52-54.
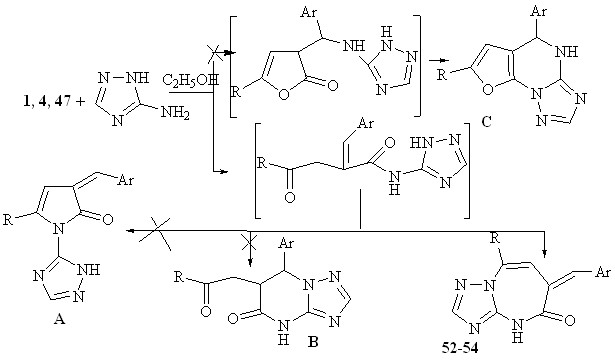
Также, нами не исключалось первоначальное присоединение триазольного кольца по кратной С=С связи с последующей гетероциклизацией и приводящей к образованию структуры С, однако, и данное направление реакции также не реализуется.
Иначе протекает взаимодействие с 3-амино-1,2,4-триазолом N-содержащих гетероаналогов - 3-арилметилиден-3Н-пиррол-2-онов (7, 20). Условия проведения реакции аналогичны вышеописанным. Выделенные продукты охарактеризованы, по совокупности данных физико-химических методов исследования, как 2-(2-арил)-5-R-N-(1,2,4-триазол-3-ил)-1H-пиррол-3-карбоксамиды 55, 56.
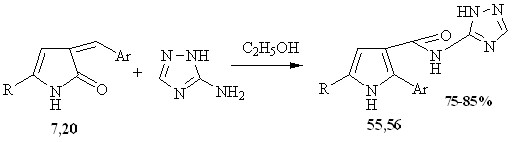
7, 55 R=Tol, Ar=C6H4-Cl-2; 20, 56 R=Ph, Ar=C6H4-Cl-2
В спектрах ЯМР1Н соединений 55, 56 присутствуют сигналы: синглет протона пиррольного кольца отмечен при 6.42-6.49 м.д., уширенный синглет протона NH группы пиррольного кольца расположен при 4.93- 4.97 м.д., синглет протона NH группы амидного фрагмента лежит при 8.47-9.05 м.д., синглет протона NH группы триазольного кольца при 1.26-1.28 м.д., серия сигналов протонов ароматических заместителей отмечена при 7.13-7.75 м.д.. В спектре ЯМР13С (для соединения 56) отмечены сигналы sp2-гибридных атомов углерода триазольного кольца в области 155.72-164.37 м.д., сигнал амидного атома углерода при 171.01 м.д.
Вероятно, атака наиболее основного центра аминотриазола по атому углерода карбонильной группы приводит к раскрытию пирролонового кольца. Стабилизация образующегося интермедиата возможна по нескольким направлениям. Основным направлением является атака иминного атома азота по экзоциклической С=С связи, с образованием структур 55, 56.
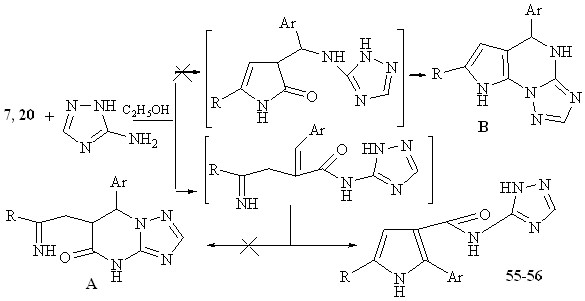
Атака атома азота триазольного кольца по атому углерода кратной С=С с образованием структуры А, не реализуется. Также, нами не исключалось первоначальное присоединение триазольного кольца по кратной С=С связи и последующая гетероциклизация приводящая к образованию структуры В. Выделить альтернативные продукты не удалось.
3.2 Взаимодействие 5-R-3-арилметилиден-3Н-фуран-2-онов с 2-меркаптобензмидазолом
Проведение реакции 5-R-3-арилметилиден-3Н-фуран(пиррол)-2-онов с 2-меркаптобензимидазом при нагревании в растворе этанола, в присутствии каталитических количеств триэтиламина, поташа, алкоголята натрия не привело к ожидаемым результатам, выделить продукты реакции не удалось.
Взаимодействие 5-R-3-арилметилиден-3Н-фуран-2-онов с 2-меркаптобензимидазом нагреванием реагентов в растворе ледяной уксусной кислоты, в присутствии каталитических количеств концентрированной серной кислоты приводит к 4-арил-3(2-оксо-2R-этил)-3,4-дигидротиазино[3,2-а]бенз[d]имидазол-2-онам 58-60.

2, 58 R=p-Tol, Ar= С6Н4- Cl-2; 19, 59 R=Ph, Ar= С6Н4- Cl-2
57, 60 R= Ph, Ar=C6H4-N(CH3)2-4
Спектры ЯМР1Н соединений 58-60 содержат дублет протонов метиленовой группы при 2.78-2.83 м.д., дублет протона третичного атома углерода С-4 проявляется при 4.10-4.14 м.д., мультиплет протона при третичном атоме углерода С-3 отмечен при 3.59-3.63 м.д. В спектре ЯМР13С соединения 59 в сильном поле отмечена серия сигналов sp3-гибридных атомов углерода в области 33.01-46.09 м.д., сигналы карбонильных групп отмечены при 196.29 – 213.01 м.д., серия сигналов ароматических атомов углерода находятся при 128.54-135.87 м.д.
Схема реакции предполагает первоначальную, в условиях кислотного катализа, атаку сульфогидрильного центра 2-меркаптобензимидазола по карбонильной группе фуран-2-онового фрагмента, что сопровождается раскрытием гетероцикла.
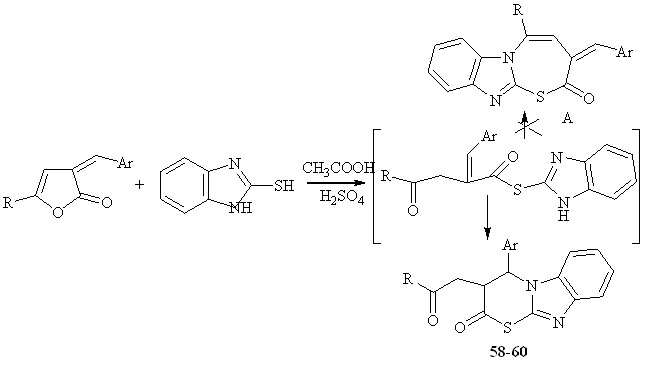
Стабилизация образующегося интермедиата осуществляется за счет атаки NH группы бензимидазольного кольца по этиленовой связи, что приводит к образованию шестичленных гетероциклических структур 58-60. Альтернативное направление реакции с образованием семичленных гетероциклов не наблюдается.
4. Возможные направления практического использования полученных соединений.
Результаты виртуального скрининга
Проанализированы результаты компьютерного скрининга биологической активности для всех синтезированных соединений с помощью программы компьютерного прогноза PASS. Выявлено, что наиболее перспективными веществами для изучения биологической активности (антиартрической, психотропной, антисеборейной, противоаллергенной, противовоспалительной, обезболевающей, анти-ВИЧ активности) являются этиловые эфиры 5-амино-4-арил-7-метил-2R-4Н-1,9-диоксо-8-аза-циклопента[b]нафталин–6-карбоновых кислот.
ВЫВОДЫ
- Выявлены закономерности и особенности взаимодействия 3-арилметилиден-3Н-фуран(пиррол)-2-онов с С-нуклеофильными реагентами (ацетоуксусный эфир, динитрил малоновой кислоты), показано, что реакции протекают через образование аддуктов конденсации Михаэля, с последующей карбо- или гетероциклизацией. Предположены и обоснованы направления и вероятные схемы реакций.
- Разработаны эффективные методы синтеза тетрагидробензофуран- (1Н-индол)-5-карбоксилатов, основанные на конденсации 5-R-3-арилметилиден-3Н-фуран(пиррол)-2-онов с ацетоуксусным эфиром в классических условиях и с использованием метода микроволновой активации.
- Систематически изучено взаимодействие 3-арилметилиден-3Н-фуран(пиррол)-2-онов с динитрилом малоновой кислоты, в том числе с использованием мультикомпонентных реакций, выявлены факторы определяющие направления гетероциклизации: условия взаимодействия, полярность растворителя, строение субстрата.
- Установлено, что при наличие гидроксигруппы в о-положении арилметилиденового фрагмента исследуемых соединений имеет место одновременная внутримолекулярная О-гетероциклизация как с участием фуран(пиррол)-2-онового цикла, так и арилметилиденового фрагмента, с образованием ангулярно построенных оксо(аза)циклопента[c]фенантренов.
- Проведено сравнительное изучение 3-арилметилиден-3Н-фуран-2-онов и их N-гетероаналогов в реакции с аминотриазолом в различных условиях. Установлено, что реакция осуществляется с раскрытием исходного гетероцикла и в зависимости от природы гетероатома приводит к 7-арилметилиден-триазол[4,3-а][1,3]диазепин-8(9Н)-онам, либо замещенным пирролам.
- Предложен эффективный метод синтеза функционально замещенных тиазино[3,2-a]бенз[d]имидазолонов на основе реакции исследуемых соединений с 2-меркаптобензимидазолом, показано, что взаимодействие протекает региоселективно по сопряженной еноновой системе связей 3-арилметилиден-3Н-фуран-2-онов.
- Изучены синтетические возможности фуропиран-5-карбонитрилов в реакции с ацетоуксусным эфиром, а также рециклизация под действием алкоголята натрия, что позволяет получать линеарно конденсированные этиловые эфиры 5-амино-4-арил-7-метил-2R-4Н-1,9-диоксо-8-аза-циклопента[b]нафталин–6-карбоновых кислот, 4-арил-6-этокси-2R-фуро[2,3-b]пиридин–5-карбонитирилы.
- По результатам компьютерного прогноза биологической активности проведенного с помощью программы PASS среди впервые синтезированных соединений определены направления по потенциальной активности и возможности практического применения.
Основное содержание диссертации изложено в следующих работах:
- Anis'kova T. V., Yegorova A.Yu., and Chadina V.V. Interaction of 3-arylmethylene-3H-furan(pirrol)-2-ones with acetoacetic ester // Mendeleev Communications. 2008. Vol. 18. №3. P.167-168.
- Аниськова Т.В., Егорова А.Ю. Синтез 6-амино-4-арил-2R-4Н-фуро[2,3-b]пиран-5-карбонитрилов на основе реакции конденсации 3-арилметилен-3Н-фуран-2-онов с малононитрилом // ХГС. 2009. №6. С.836-841.
- Anis'kova T. V., Yegorova A.Yu, Timofeyeva Z.Yu. Recyclization of 6-amino-5-carbonitrilefuropiranes under the action of nucleophils // European Journal of Natural History. 2008. №4. 92. P. 92-93.
- Нечаева (Аниськова) Т.В, Чадина В.В., Тимофеева З.Ю., Егорова А.Ю. Арилметиленовые производные пиррол-2-онов и их О-гетероаналоги в реакциях Фриделя-Крафтса // Фундаментальные исследования.2007.№5 С.78-79.
- Егорова А.Ю., Тимофеева З.Ю., Чадина В.В., Нечаева (Аниськова) Т.В. Синтезы на основе 3-арилметилен-3Н-фуран-2-онов//Материалы XIX Международной научно-технической конференции «Реактив – 2006» -Уфа: 2006. Т1. С.62-63.
- Нечаева Т.В., Тимофеева З.Ю., Егорова А.Ю. Внутримолекулярное ацилирование 3-арилметилен-3Н-фуран-2-онов// Материалы Международной научной конференции «Фундаментальные и прикладные проблемы современной химии в исследованиях молодых ученых» Астрахань: 2006.С.45-46.
- Аниськова Т.В., Чадина В.В. Конденсация 3-арилметилен-3Н-фуран-2-онов с ацетоуксусным эфиром // Сб. материалов VI Всероссийской конференции молодых ученых «Современные проблемы теоретической и экспериментальной химии». Саратов: 2007. С.60-61.
- Егорова А.Ю., Тимофеева З.Ю., Нечаева (Аниськова)Т.В. Антимикробная активность фуран(тиофен)-2-онов и их арилметиленовых производных // Сб. материалов 3-й Всероссийской научно-методической конференции «Пути и формы совершенствования фармацевтического образования. Создание новых физиологически активных веществ», Воронеж: 2007.С.130
- Чадина В.В., Нечаева (Аниськова) Т.В. Взаимодействие 3-арилиден-3Н-фуран-2-онов с гидроксиламином // Сб. статей молодых ученых посвященный 75-летию химического факультета СГУ «Современные проблемы теоретической и экспериментальной химии». Саратов: 2004. С.81-84.
- Нечаева (Аниськова)Т.В., Чадина В.В., Егорова А.Ю. Гидразинолиз 3-арилметилен-3Н-фуран-2-онов//Тез. докл. IX Научная школа-конференция по органической химии-М: 2006.С.261.
- Нечаева (Аниськова) Т.В, Тимофеева З.Ю., Егорова А.Ю. Внутримолекулярное ацилирование 3-арилметилен-3Н-фуран-2-онов // Тез. док. Международной научной конференции «Фундаментальные и прикладные проблемы современной химии в исследованиях молодых ученых» Астрахань:2006. С.45-46.
- Егорова А.Ю., Тимофеева З.Ю., Аниськова Т.В. Замещенные 3Н-фуран(пиррол)-2-оны. Синтез и реакции с N,N- и C,N- бинуклеофилами // Тез. докл. XVIII Менделеевского съезда по общей и прикладной химии, М: 2007.С.212.
- Нечаева (Аниськова) Т.В, Тимофеева З.Ю., Егорова А.Ю. 3-Арилметилен-3Н-пиррол-2-оны в реакции Фриделя-Крафтса // Тез. докл. IX Научной школы-конференции по органической химии- М.: 2006.С.357.
- Аниськова Т.В, Тимофеева З.Ю., Егорова А.Ю. Реакции 3-арилметилен-3Н-фуран-2-онов с малононитрилом, метод построения фуропирановых систем // Сб. науч. тр. XI всероссийской конференции «Карбонильные соединения в синтезе гетероциклов». Саратов: 2008. С.36-38.
- Чадина В.В., Аниськова Т.В., Егорова А.Ю. 6-Амино-4Н-фуро[2,3-b]пиран-5-карбонитрилы в реакции с ацетоуксусным эфиром и алкоголиза // Сб. науч. тр. XI всероссийской конференции «Карбонильные соединения в синтезе гетероциклов». Саратов: 2008. С.302-303.
- Егорова А.Ю., Аниськова Т.В., Тимофеева З.Ю. Присоединение С-нуклеофилов к 3-арилметилен-3Н-фуран-2-онам по сопряженной еноновой системе // Сб. материалов международной конференции по органической химии «Химия соединений с кратными углерод-углеродными связями». С.-Петербург: 2008. С.195
- Аниськова Т.В, Тимофеева З.Ю., Егорова А.Ю. Карбоциклизация продуктов конденсации Михаэля в ряду 5-R-3-арилметилен-3Н-пиррол(фуран)-2-онов // Тез. док. XI Международной научно-технической конференции «Перспективы развития химии и практического применения алициклических соединений» Волгоград: 2008. С.90
- Аниськова Т.В., Тимофеева З.Ю., Нагаев В.Д. Специфическое протекание реакции 5-R-3-арилметилен-3Н-фуран(пиррол)-2-онов с динитрилом малоновой кислоты // Тез. док. XV Международной научной конференции студентов, аспирантов и молодых учёных "Ломоносов-2008". М.:2008.С.436.
- Аниськова Т.В. Взаимодействие 5R-3-арилметилен-3Н-фуран-2-онов с полинуклеофильными реагентами // Тез. док. XVI Международной научной конференции студентов, аспирантов и молодых учёных "Ломоносов-2009".Секция «Органическая химия». М.: 2009. С.8.
- Anis'kova T.V., Yegorova A.Yu., and Chadina V.V. The synthetic capabilities of 3-arylmethelene-3H-furan-2-ones in the reaction with N,-C-,S-nucleophilic reagents// 5th International Conference on Organic Chemistry for Young Scientists (Abstract of Reports.), 2009. Saint-Petersburg: 2009. P.92

