Электрофильные и нуклеофильные реакции непредельных 1,5-дикетонов тетрагидронафталинонового ряда
На правах рукописи

БУРОВ АНДРЕЙ МИХАЙЛОВИЧ
ЭЛЕКТРОФИЛЬНЫЕ И НУКЛЕОФИЛЬНЫЕ РЕАКЦИИ НЕПРЕДЕЛЬНЫХ 1,5-ДИКЕТОНОВ ТЕТРАГИДРОНАФТАЛИНОНОВОГО РЯДА
02.00.03 – ОРГАНИЧЕСКАЯ ХИМИЯ
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Саратов – 2008
Работа выполнена на кафедре органической и биоорганической химии ГОУ ВПО «Саратовский государственный университет имени Н.Г. Чернышевского»
Научный руководитель:
доктор химических наук, профессор Федотова Ольга Васильевна
Официальные оппоненты:
доктор химических наук, профессор Аксенов Александр Викторович
доктор химических наук, профессор Маркова Людмила Ивановна
Ведущая организация: Астраханский государственный технический университет
Защита диссертации состоится «25» _декабря_ 2008 г. в _14_ часов на заседании Диссертационного совета Д 212.243.07 по химическим наукам при Саратовском государственном университете им. Н.Г. Чернышевского по адресу: 410012, г. Саратов, ул. Астраханская, 83, I корп., химический факультет.
С диссертацией можно ознакомиться в Научной библиотеке Саратовского государственного университета им. Н.Г. Чернышевского.
Автореферат разослан 17 ноября 2008 г.

Ученый секретарь диссертационного совета В.В. Сорокин
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность и цель работы. Интерес к химии непредельных 1,5-дикетонов определяется их высоким химическим потенциалом. Разнообразие в способах получения и структурные особенности делают этот класс соединений перспективным для изучения с позиций экспериментальной и теоретической химии.
Наличие таких реакционных центров, как карбонильные группы, активированная кратная связь и подвижных атомов водорода в -положении к карбонилу предполагают электрофильные и нуклеофильные реакции, сопровождающиеся функционализацией и, в ряде случаев, гетероциклизацией в азот-, кислородсодержащие пяти-, шестичленные гетероциклические соединения.
Анализ литературных данных свидетельствует, что к настоящему времени осуществлен синтез и изучена химия большого ряда ациклических непредельных 1,5-дикетонов. Сведения, касающиеся получения полуциклических конденсированных 1,5-диоксосоединений, имеются лишь в единственной публикации, описывающей выделение непредельного 1,5-дикетона тетрагидронафталинонового ряда при щелочном гидролизе 1,3-диарил-7,8-бензо-5,6-дигидрохроменилия. При этом остаются незатронутыми вопросы их реакционной способности в нуклеофильных, электрофильных реакциях, в частности, с галогенирующими реагентами, хотя введение галогена в молекулу открывает широкие препаративные возможности.
Представлялось необходимым восполнить имеющиеся пробелы в синтезе пропилиденонилтетрагидронафталинонов, а также установить стереохимическую направленность процессов галогенирования в зависимости от характера реагента (хлора, брома), возможность их азагетероциклизации. Это определяло актуальность исследования.
Настоящая работа выполнена в русле обозначенных проблем и является частью плановых научно-исследовательских работ, проводимых на кафедре органической и биоорганической химии Саратовского государственного университета им. Н.Г. Чернышевского по теме: «Теоретическое и экспериментальное исследование новых материалов и систем с заданными физико-химическими свойствами (рег. № 3.4.03)», а также выполняемых при финансовой поддержке гранта РФФИ 06-03-32667а.
Цель настоящего исследования заключалась в разработке подходов к синтезу полуциклических,-непредельных 1,5-дикетонов пропилиденонилтетрагидронафталинонового ряда, выявлении закономерностей, специфики стереонаправленности реакций их галогенирования, изучении гетероциклизации с азареагентами (гидразингидратом).
Научная новизна. Получены новые данные о синтетических возможностях 1,3-диарилпропилиденонилтетрагидронафталинонов в электрофильных и нуклеофильных реакциях.
Найдены условия препаративного синтеза последних гидролизом солей бензодигидрохроменилия в присутствии ацетата натрия на оксиде алюминия. Методом УФ спектроскопии и квантовохимическими расчетами подтверждено наличие внутримолекулярного переноса заряда с арильных заместителей при С-4(С-2) на катион бензодигидрохроменилия.
Обнаружена принципиальная возможность получении ди-, трихлорзамещенных пропанонилтетрагидронафталинонов, в том числе прямым переходом из солей бензодигидрохроменилия при одновременном действии ацетата натрия и хлора.
Показано, что отличительной особенностью бромирования пропилиденонилтетрагидронафталинонов является преимущественное солеобразование, протекающее одновременно с превращением субстратов в недоступные ранее конденсированные бензоилфураны. При этом солеобразование имеет место через полукетализацию, подтвержденную квантовохимическими расчетами.
Найдено, что пропилиденонилтетрагидронафталиноны при действии гидразингидрата способны в зависимости от характера радикала при С-1 алифатической цепи дикетона к переходу к труднодоступным иными путями замещенным пиразолинам, индазолам и диазепинам.
Практическая значимость работы. Предложен новый препаративный подход к синтезу непредельных 1,5-дикетонов тетрагидронафталинонового ряда. Разработаны способы получения ди-, трихлорзамещенных пропанонилтетрагидронафталинонов, замещенных пиразолинов, индазолов, диазепинов. Выявлена проводимость солей 2,4-R-7,8-бензо-5,6-дигидрохроменилия, предполагающая использование их в виде катодных материалов в ХИТ высокоудельной энергии, но малой мощности.
На защиту выносятся результаты исследований по:
- разработке препаративного метода получения пропилиденонил-тетрагидронафталинонов гидролизом солей бензодигидрохроменилия в присутствии ацетата натрия на оксиде алюминия;
- изучению реакционной способности полуциклических бензаннелированных,-непредельных 1,5-дикетонов с галогенирующими реагентами; выявленным общим закономерностям, вероятным путям образования ди-, трихлорзамещенных диоксосоединений, бензоилфуранов;
- спектральному анализу (ИК, УФ, ЯМР 1Н,13С),-непредельных 1,5-дикетонов, и продуктов их превращений – ди-, тригалогензамещенных диоксосоединений, замещенных пиразолинов, индазолов, диазепинов, солей бензодигидрохроменилия, позволившему выявить возможность внутримолекулярного переноса заряда (ВПЗ) от арильного заместителя на катион пирилия, подтвержденную квантовохимическими расчетами, и провести конформационные и конфигурационные отнесения в рядах изученных 1,5-дикетонов.
Апробация работы. Результаты диссертационной работы представлены на Международной научной конференции «Фундаментальные и прикладные проблемы современной химии в исследованиях молодых ученых» (Астрахань, 2006); XIX Международной научно-технической конференции «Химические реактивы, реагенты и процессы малотоннажной химии «Реактив-2006» (Уфа, 2006); IX научной школе-конференции по органической химии (Москва, 2006), XI Всероссийской научной конференции «Карбонильные соединения в синтезе гетероциклов» (Саратов, 2008).
Публикации. По теме диссертационной работы опубликовано 8 печатных работ, в том числе 2 публикации, входящие в перечень ведущих рецензируемых журналов, рекомендуемых ВАК, 4 статьи в сборниках научных трудов и 2 тезиса докладов.
Объем и структура работы. Диссертация изложена на 130 страницах машинописного текста, включая введение, три главы, выводы, список использованных источников из 105 наименований (14 таблиц, 25 рисунков).
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Пропилиденонилтетрагидронафталиноны. Синтез и строение
1.1. О характере превращений 2-(1-R-3-фенилпропан-3-он-1-ил)-1,2,3,4-тетрагидронафталин-1-онов в протонных и апротонных средах
Многоцентровость диоксосоединений пропилиденонилтетрагидро-нафталинонового ряда позволяет рассматривать их в качестве ценных субстратов в синтезе замещенных аналогов известных O-, N- содержащих практически важных пяти-, шестичленных гетероциклов, а также решать вопросы фундаментальной и сравнительной химии, определяющиеся особенностями строения.
В связи с этим целью данной работы явилась разработка путей синтеза пропилиденонилтетрагидронафталинонов и изучение их поведения в электрофильных и нуклеофильных реакциях; вероятных механизмов их превращений, особенностей тонкой структуры.
Удобными в препаративном отношении субстратами для реализации задачи синтеза пропилиденонилтетрагидронафталинонов могли служить соли бензодигидрохроменилия. Поэтому, учитывая, что последние могут давать в условиях основного гидролиза,-непредельные 1,5-дикетоны, нами была предпринята попытка по их синтезу.
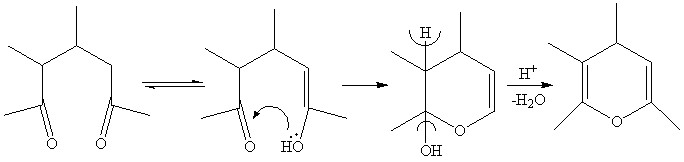
Известно, что наиболее характерным свойством 1,5-дикетонов всех известных рядов является гетероциклизация под действием кислот протонного и апротонного характера с образованием солей пирилия и их конденсированных аналогов.
В связи с этим нами были проведены реакции солеобразования 2-(1-R-3-фенилпропан-3-он-1-ил)-1,2,3,4-тетрагидронафталин-1-онов 1а-г в средах различного характера (протонные, апротонные) под действием эфирата трехфтористого бора, хлорной кислоты, брома.
Показано, что полуциклические 1,5-дикетоны 1а-в под действием эфирата трехфтористого бора, как кислоты Льюиса, при 200С в уксусной кислоте превращаются в борфтораты 2,4-дифенил-7,8-бензо-5,6- дигидрохроменилия 2а, 4-(4-метоксифенил)-2-фенил-7,8-бензо-5,6-дигидрохроменилия 2б и 4-(4-диметиламмонийфенил)-2-фенил-7,8-бензо-5,6-дигидрохроменилия 2в с выходом 52-57%.
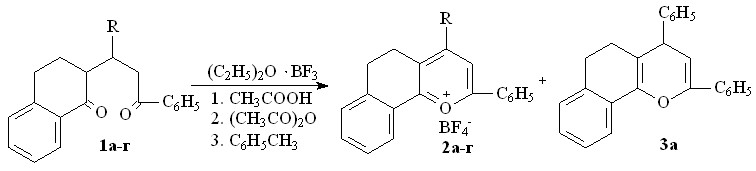
1,2 R= C6H5 (а), C6H4OCH3-4 (б), C6H4N+H(CH3)2-4 BF4- (в), C6H4Сl-4 (г)
В уксусном ангидриде при одновременном повышении температуры реакции до 1400С выход борфторатов 2 возрастает до 65–67%.
При этом наряду с солью 2a обнаружен 2,4-дифенил-7,8-бензо-5,6-дигидрохромен 3а (таблица 1), что, вероятно, связано с конкурентно протекающей легкой дегидратацией в выбранных условиях продукта полукетализации дикетона 1a.
Препаративно из смеси удалось выделить только соединение 3а, в то время как другие бензодигидрохромены были зафиксированы нами в смеси с помощью метода ЯМР.
В спектре ЯМР1Н соединения 3а наблюдается дублет винильного протона при С-3 - 5,5 м.д. (КССВ 13,2), дублет третичного протона при С-4 - 4,2 м.д. (КССВ 13,2), при 2,2 м.д. отмечен триплет двух протонов при С-5(КССВ 17,4), сигнал при 2,8 м.д. отвечает триплету двух протонов при С-6 (КССВ 17,4), в области 7,2-7,8 м.д. регистрируется мультиплет ароматических протонов. Отсутствие сигналов в интервале 6-7 м.д. говорит о существовании полученного бензодигидрохромена в 4Н-форме, а не в 2Н, кроме того наличие спин-спинового взаимодействия между винильным водородом (С-3) и третичным при С-4 исключает возможную 6Н-форму конденсированного гидрохромена 3а, в противном случае, наличие последнего дало бы два синглетных сигнала протонов.
Получить бензогексагидрохромены как продукты диспропорционирования ни в одном из случаев не удается, что позволяет связать солеобразование с окислительной ароматизацией бензодигидрохроменов 3 под действием кислорода воздуха. При этом, вероятно, промежуточно образуются перекисные соединения, которые затем распадаются с дальнейшей гетероароматизацией пиранолов в соли бензодигидрохроменилия.
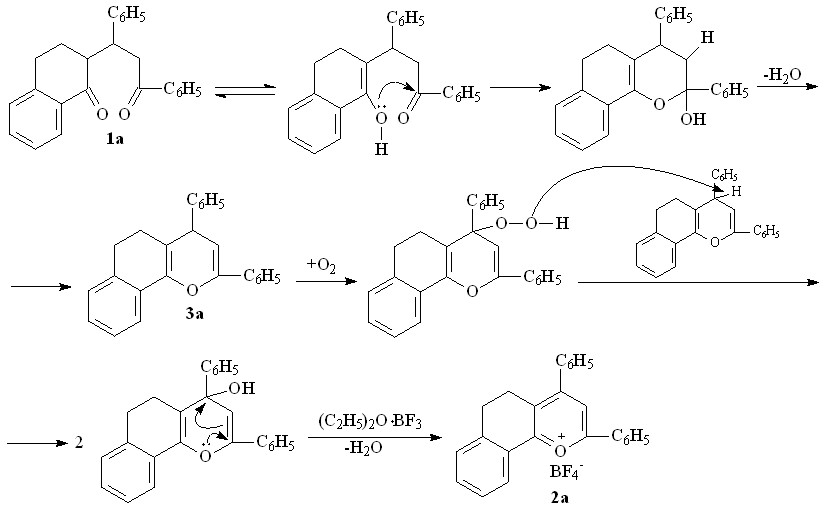
Подтверждением возможности такого превращения является образование борфторатов 2а-г (таблица 1) в толуоле при 1100С. Впервые в указанных условиях из смеси удается выделить интермедиат реакции - бензодигидрохромен 3а с выходом 13%.
Наблюдаемые превращения демонстрируют отличительные особенности бензаннелированных 1,5-дикетонов по сравнению с известными полу- и ациклическими аналогами и определяются, на наш взгляд, устойчивостью образующихся конечных продуктов.
В присутствии хлорной кислоты, выступающей в роли протонирующего агента, пропанонилтетрагидронафталиноны 1а,б в среде уксусной кислоты образуют соответствующие перхлораты бензодигидрохроменилия 4а,б. Бромирование в уксусной кислоте приводит к бромидам бензодигидрохроменилия 5а-в.
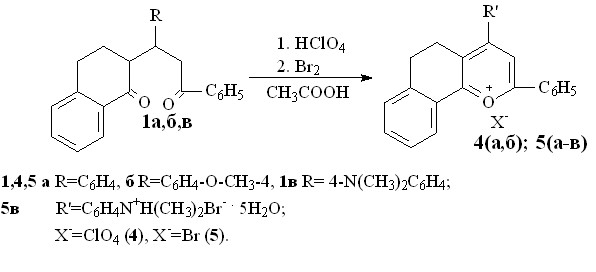
Существование соли 5в в гидратированной форме подтверждается данными термогравиметрического анализа.
Таким образом, в результате исследований выявлено новое направление реакции солеобразования пропанонилтетрагидронафталинонов в кислых протонных и апротонных средах, как результат окислительной ароматизации интермедиатов – бензодигидрохроменов.
Таблица 1
Выходы продуктов взаимодействия дикетонов 1a–г с эфиратом
трехфтористого бора и бромом
| Дикетон, 1а-г | Растворитель | Реагент | Температура реакции, С | Соль бензодигидро-хроменилия 2,5а-г, выход, % |
| a a a* a а б б б б в в в г | AcOH Ac2O Ac2O PhMe AcOH AcOH Ac2O PhMe AcOH AcOH PhMe AcOH PhMe | Et2O.BF3 Et2O.BF3 Et2O.BF3 Et2O.BF3 Br2 Et2O.BF3 Et2O.BF3 Et2O.BF3 Br2 Et2O.BF3 Et2O.BF3 Br2 Et2O.BF3 | 20 20 140 110 118 20 20 110 118 20 110 20 110 | 54 67 7 51 40 57 65 55 47 52 55 76 61 |
* Из реакционной смеси выделен также бензодигидрохромен 3а с выходом 59%
- Электронные спектры поглощения солей тетрагидро- и бензодигидрохроменилия
Изучение спектральных характеристик солей пирилия и их гетероаналогов, в частности, электронных спектров поглощения, открывает широкие возможности по установлению структуры и нахождению практического применения в различных областях науки и техники.
В связи с этим в качестве исследуемых объектов, не изученных ранее, были выбраны борфтораты, перхлораты и бромиды бензодигидрохроменилия 2, 4, 5. Спектры электронного поглощения регистрировались в протонном (уксусная кислота) и апротонном (хлористый метилен) растворителях.
При сравнении спектра поглощения перхлората 2,4-дифенил-7,8-бензо-5,6-дигидрохроменилия 4а и известного ранее 2-фенил-7,8-бензо-5,6-дигидрохроменилия 6, имеющего в длинноволновой части лишь одну полосу с max 437 нм, обнаружено, что введение фенильного заместителя в положение С-4 не оказывает существенного влияния на параметры указанной полосы, но при max 356 нм появляется новая. При переходе к электронному спектру перхлората 4-(4-метоксифенил)-2-фенил-7,8-бензо-5,6-дигидрохроменилия 4б последняя исчезает и интенсивное поглощение отмечается только при max 430 нм. Аналогичная картина наблюдается для борфторатов 2а,б (таблица 2). Таким образом, полосы поглощения при max 356–358 нм в солях 2а,4а можно интерпретировать как полосы внутримолекулярного переноса заряда от -системы фенила в положении С-4 на катион. Отсутствие таковых в спектрах соединений 2б,4б свидетельствует о некопланарности метоксифенильного фрагмента относительно плоскости катиона. Аналогичные зависимости, наблюдаемые в электронных спектрах бромидов 2-фенил-4-R-7,8-бензо-5,6-дигидрохроменилия 5a,б, указывают на малое влияние противоиона.
Для корреляции зарегистрированных спектральных характеристик с таковыми, полученными методами квантовой химии, проведены теоретические расчеты спектров всех рассматриваемых солей. В качестве стандарта при выполнении расчетных задач (метод AM1 в программном пакете HyperСhem) использовали данные РСА диэдральных углов поворота заместителей к плоскости катиона в перхлорате 2,4,6-трифенилпирилия. Проведенные расчеты полос поглощения для исследуемых соединений подтверждают обнаруженные нами закономерности (таблица 2).
Отмечено, что разрешенная полоса при max 374 нм в газовой фазе для соединения 2б в экспериментальных условиях в уксусной кислоте и хлористом метилене исчезает. Этот факт объяснен влиянием растворителя.
Таблица 2
Электронные спектры поглощения солей 2a–в, 4a,б, 5a–в, 6, 8a,б
| № | CH2Cl2 | AcOH | Квантовохимический расчет | ||||
| Длина волны, max, нм | Оптическая плотность | Длина волны, max, нм | Оптическая плотность | Длина волны, max, нм | Оптическая плотность | ||
| 2a | 437 358 291 233 | 1.458 1.001 0.897 1.120 | 430 347 287 235 | 1.001 0.599 0.560 0.978 | 402 344 288 239 | 0.634 0.653 0.292 0.109 | |
| 2б | 443 287 236 | 1.776 0.990 1.229 | 425 285 238 | 1.083 0.455 1.068 | 397 374 285 241 | 0.657 0.671 0.350 0.169 | |
| 2в | 566 413 293 247 | 1.019 0.495 0.662 1.503 | - | - | 429 306 257 | 0.663 0.503 0.123 | |
| 4a* | 434 356 287 231 | 0.695 1.200 0.789 0.993 | 431 355 283 229 | 0.725 1.240 0.580 0.887 | 402 344 288 239 | 0.634 0.653 0.292 0.109 | |
| 4б* | 430 290 241 | 2.525 1.112 1.301 | 427 287 239 | 2.130 1.245 1.310 | 397 374 285 241 | 0.657 0.671 0.350 0.169 | |
| 5a* | 438 356 292 232 | 0.905 0.687 0.978 1.755 | - | - | 402 344 288 239 | 0.634 0.653 0.292 0.109 | |
| 5б* | 435 288 236 | 1.031 0.479 0.555 | - | - | 397 374 285 241 | 0.657 0.671 0.350 0.169 | |
| 5в* | 569 416 295 240 | 1.020 0.557 0.756 1.480 | 554 412 287 236 | 1.017 0.705 0.930 1.615 | 429 306 257 | 0.663 0.503 0.123 | |
| 6 | 437 269 219 | 1.625 | - | - | 405 296 250 | 0.675 0.477 0.237 | |
| 8a | 365 256 | 1.738 0.845 | 360 250 | 1.913 1.088 | 372 333 266 | 0.816 0.359 0.314 | |
| 8б | 416 370 258 | 1.413 1.423 1.206 | 395 365 252 | 1.137 1.286 0.964 | 392 344 262 | 0.876 0.394 0.296 | |
* Рассчитанные квантовохимическим методом длины волн солей с различными анионами одинаковы.
Отличительной особенностью спектров поглощения диборфтората и дибромида 4-(4-диметиламмонийфенил)-2-фенил-7,8-бензо-5,6-дигидрохро-менилия 2в,5в является наличие двух полос поглощения в длинноволновой области (569 нм и 416 нм, соответственно), которые можно отнести к полосам переноса заряда, отражающих их строение как бикатионов.
Для прослеживания влияния бензаннелирования на характер электронных спектров поглощения солей бензодигидрохроменилия синтезированы соли 2-фенил-4-R-5,6,7,8-тетрагидрохроменилия 8а,б взаимодействием 1-R-3-фенилпропанонилциклогексан-1-онов 7а,б (а. R=C6H4, б. R=C6H4-O-CH3-4) с хлорной кислотой в смеси уксусной кислоты и уксусного ангидрида.
Изменение топологии системы от выплощенной в солях 2, 4, 5 к более лабильной в таковых тетрагидрохроменилиевого ряда может вносить свои особенности в их спектры поглощения.
В записанных нами спектрах перхлоратов 8а,б длинноволновые полосы наблюдаются при 365–370 нм, но в спектре последнего появляется новая полоса при 416 нм. Учитывая, что в спектре перхлората 2-фенил-5,6,7,8-тетрагидрохроменилия имеется лишь одна полоса при 376 нм, полосу в низкочастотной части спектра соли 8б можно отнести к внутримолекулярному переносу заряда с заместителя при атоме С-4. Отсутствие таковой в спектре 8а предполагает некопланарность фенильного заместителя в положении С-4.
Таким образом, введение в гетеросистему лабильного алициклического фрагмента изменяет, на наш взгляд, пространственную геометрию молекулы, нарушая распределение электронной плотности в системе катиона, и оказывает существенное влияние на вид спектров.
Проведенное нами впервые систематическое изучение электронных спектров поглощения солей бензодигидрохроменилия, тетрагидрохроменилия позволило показать возможность внутримолекулярного переноса заряда в зависимости от характера: арильных заместителей с С-4 или С-2 гетерокольца на катион тетра-, бензодигидрохроменилия и геометрии конденсированного алицикла. Полученные результаты подтверждены квантовохимическими расчетами.
- Гидролиз солей 2,4-R-7,8-бензо-5,6-дигидрохроменилия в условиях основного катализа
Анализ данных периодической печати свидетельствует, что синтез и реакционная способность ациклических,- непредельных 1,5-дикетонов изучены достаточно полно, полуциклических аналогов – на единичных примерах. Это весьма не оправдано, учитывая их химический потенциал, возможность синтеза конденсированных, в том числе бензаннелированных алифатическоциклических и гетероциклических соединений, и требует восполнения имеющихся пробелов. Кроме того, единственный способ, описанный в литературе, по получению 2-(1,3-дифенилпропилиден-3-он)-3,4-дигидронафталин-1-она, не является воспроизводимым.
Поэтому, с целью синтеза,-непредельных дикетонов тетрагидронафталинонового ряда, нами осуществлен поиск условий проведения основного гидролиза солей бензодигидрохроменилия 2,5.
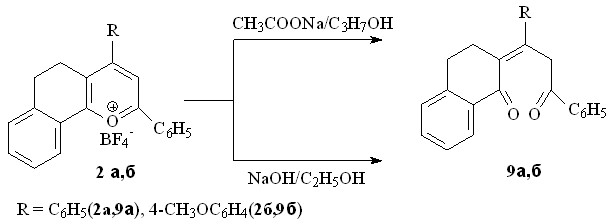
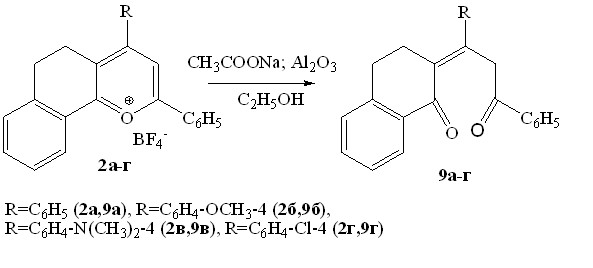
Установлено, что как в присутствии ацетата натрия (при pH~8), так и при использовании раствора щелочи (pH>11), как и в случае солей пирилия, продуктами реакции борфторатов 2а,б являются 2-(1,3-дифенилпропилиден-3-он)-3,4-дигидронафталин-1-он 9а и 2-(1-(4-метоксифенил)-3-фенилпропилиден-3-он)-3,4-дигидронафталин-1-он 9б с выходами не превышающими 29-52%.
При хромато-масс-спектрометрическом анализе соединения 9б обнаружено присутствие на хроматограмме двух сигналов с близким временем удерживания 31.91 и 32.27, имеющих соответственно М+ 382 и М+-1 381 свидетельствующих о том, что непредельный дикетон 9б образуется в виде смеси изомеров. Для выяснения конформации дикетонов 9 проведен анализ положения и соотношения интенсивностей полос поглощения С=С и С=О связей в ИК спектре.
Обнаружено, что в ИК спектре дикетона 9б присутствует набор двух пар полос, которые дают 1=108 см-1, 2=75 см-1, что соответствует s-цис-конформации и согласуется с литературными данными для ациклических аналогов (=С=О - С=С, в цисоидной конформации более 72 см-1, в трансоидной менее 70 см-1). Они относятся соответственно к Z- и E-конфигурационным изомерам, так как в спектре присутствует как низкочастотная полоса С=С при 1573 см-1, так и высокочастотная при 1620 см-1.
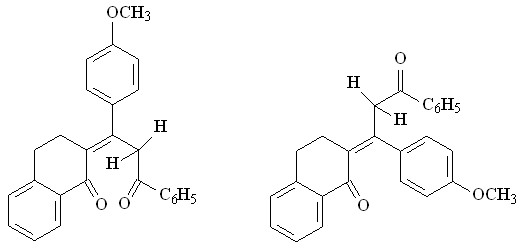
9б, Е-изомер 9б, Z-изомер
В случае дикетона 9а разница составляет 28 см-1, С=С фиксируется при 1654см-1 что говорит о его трансоидной конформации (Е-форма).
В ЯМР1Н спектре дикетона 9б наблюдаются сигналы метиленовых протонов при С-3, С-4 алицикла в области 2,8-2,9 м.д., синглет эквивалентных протонов С-2 алифатической цепи при 4,6 м.д., сигнал в виде синглета метильных протонов метоксигруппы отмечается при 3,8 м.д., мультиплет ароматических протонов резонирует в интервале 6,9-8,0 м.д. В ЯМР13С дикетона 9б наблюдаются сигналы атомов С-3, С-4 конденсированного циклогексанонового кольца при 30,1 м.д. и 30,4 м.д., при 46,9 м.д. фиксируется сигнал атома С-2 алифатики, значению пика 55,3 м.д. отвечает углерод метоксильной группы, карбонильным атомам С-1 и С-3 соответственно алицикла и алифатической цепочки отвечают значения сигналов при 189,7 и 196,6 м.д. соответственно, атомы углерода при двойной связи проявляются при 129,3м.д. и 143,5 м.д.
Гидролиз дибромида 5в с использованием раствора гидроксида натрия сопровождается глубокими превращениями с образованием смеси изомерных бромидов 4-диметиламмонийфенил-2-фенил-7,8-бензо-5,6-дигидрохромен-2(4)-олов 10а,б с суммарным выходом 68%.
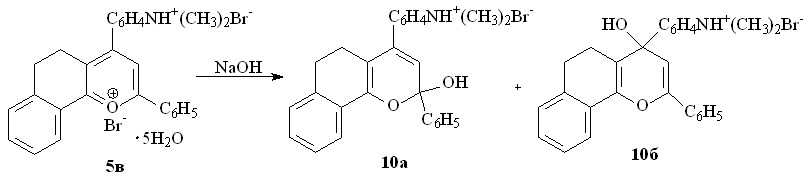
Их обнаружение согласуется с общетеоретическими представлениями о механизме гидролиза солей пирилия.
6Н- Структура дигидрохроменола исключена из рассмотрения вследствие ее меньшей устойчивости – отсутствия сопряжения гетерокольца с конденсированным ароматическим циклом.
В ЯМР1Н спектре изомерной смеси соединений 10а,б присутствуют
характеристические сигналы винильных протонов с 5,3 м.д.(с.) и 6,4 м.д.(с.) и два сигнала протонов гидроксильных групп с 5,8 м. д. (с.) и 6,2 м.д.(с).
Принимая во внимание относительно невысокие выходы получаемых пропилиденонилтетрагидронафталинонов, нами была предпринята попытка подбора оптимальных условий для проведения гидролиза.
Из литературы известно, что при тонкослойной хроматографии пирилиевых солей на адсорбенте - оксиде алюминия происходит раскрытие лабильного пирилиевого кольца, сопровождающееся образованием непредельных 1,5-дикетонов. Исходя из выше сказанного, нами были модифицированы условия проведения гидролиза: использован ацетат натрия в 6-ти кратном избытке, при этом реакция проводилась с добавлением порошкообразного оксида алюминия. С использованием данного метода был проведен гидролиз ряда солей бензодигидрохроменилия 2а-г. Единственными продуктами реакции явились,-непредельные 1,5-дикетоны 9а-г с выходами 63-76 % в трансоидной конформации.
Спектры ЯМР1Н и ЯМР13С дикетонов 9а,в,г соответствуют таковым для соединения 9б.
Роль Al2O3, на наш взгляд, заключается в поляризации С-О связи гетероцикла и инициации раскрытия хроменилиевого цикла, приводящего к получению конечных продуктов – непредельных 1,5-дикетонов.
Таблица 3
Выходы пропилиденонилтетрагидронафталинонов 9а-г при различных условиях проведения реакции
| Борфтораты 2а-г | Растворитель | Реагент | Непредельные дикетоны 9а-г, выход, % |
| a a a б б б в г | C2H5OH C3H7OH C2H5OH C2H5OH C3H7OH C2H5OH C2H5OH C2H5OH | NaOH CH3COONa CH3COONa;Al2O3 NaOH CH3COONa CH3COONa;Al2O3 CH3COONa;Al2O3 CH3COONa;Al2O3 | 33 52 76 29 48 75 63 65 |
Таким образом, нами впервые разработан препаративно доступный оригинальный способ получения бензаннелированных непредельных 1,5-дикетонов полуциклического ряда. Подтвержден общий характер превращений солей бензодигидрохроменилия, пирилия в условиях основного гидролиза; выделены интермедиаты превращений солей бензодигидрохроменилия на пути к указанным дикетонам; проведены конформационные и конфигурационные отнесения для синтезированных пропилиденонилтетрагидронафталинонов.
2. Электрофильные и нуклеофильные реакции пропилиденонилтетрагидронафталинонов
- Бромирование пропилиденонилтетрагидронафталинонов
Реакции галогенирования непредельных 1,5-дикарбонильных соединений в литературе представлены в основном на примере дикетонов нециклического ряда и ведут к продуктам присоединения по кратной связи, замещения по -положению к карбонильной функции и гетероциклизации в соли пирилия и бензоилфураны.
Изучение реакций непредельных полуциклических 1,5-дикетонов, содержащих тетрагидронафталиноновый фрагмент, входящий в состав природных и биологически активных веществ, с галогенами позволяет обогатить химию непредельных дикетонов новыми представителями указанных соединений.
Из анализа литературных данных следует, что в реакцию бромирования непредельные 1,5-дикетоны тетрагидронафталинонового ряда не вводились, поэтому нами были проведены реакции дикетонов 9а-г с бромом, позволяющие оценить влияние строения непредельного дикетона на характер электрофильных превращений.
Принимая во внимание высокую реакционную способность диоксосоединений пропилиденонилтетрагидронафталинонового ряда и их склонность к гетероароматизации, бромирование проводилось в мягких условиях – в хлороформе при 200С.
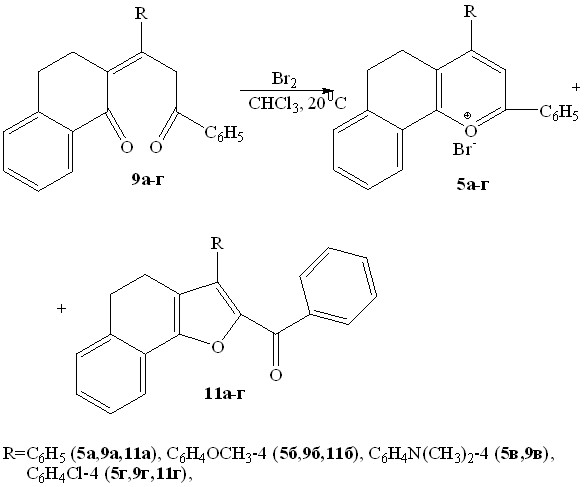
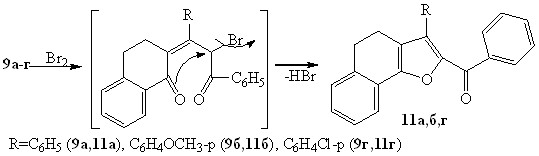
Впервые показано, что наряду с бромидами 5а-г в результате внутримолекулярной гетероциклизации промежуточно образующихся бромпентендионов возникают 2-бензоил-3-R-4,5-дигидронафтофураны 11а,б,г с выходами 6-31%. Нуклеофильное замещение подвижного атома брома имеет место по механизму:
В ЯМР1Н спектре полученного ароилфурана 11а наблюдаются сигналы ароматических протонов при 7,3-8,0 м.д. При 2,8 м.д. и 3,1 м.д выявлены два триплета с КССВ 10 Гц и 10,8 Гц. ЯМР1Н спектры соединений 11б-г аналогичны по своему характеру со спектром соединения 11а.
Ароматизация, как показал эксперимент, превалирует над бромированием благодаря наличию конденсированного ароматического кольца и протекает через дегидратацию полукеталя под действием бромоводорода, выделяющегося при бромировании субстрата по вышеприведенной схеме.
ПУТЬ А
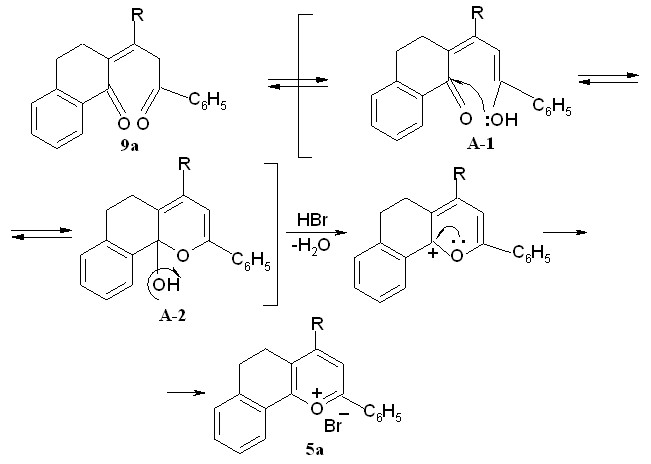
Солеобразование может также реализовываться по альтернативному пути - через стадию электрофильного присоединения молекулы брома по двойной связи, с последующей полукетализацией и отщеплением HOBr.
ПУТЬ Б
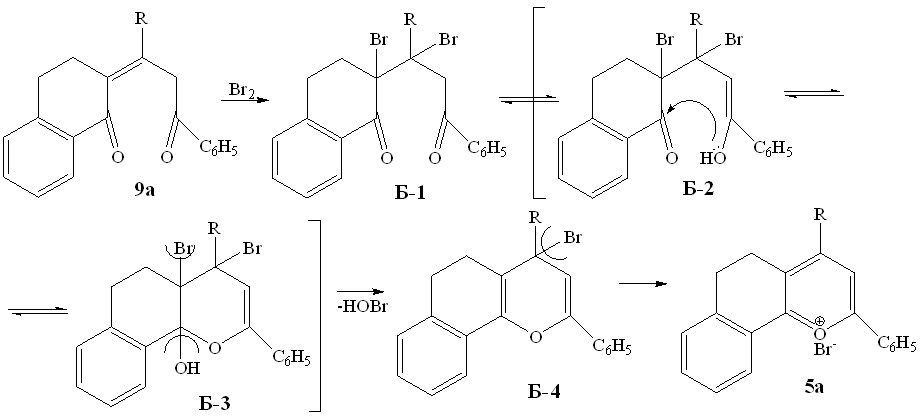
Для выяснения по какой из двух схем (путь А или Б) происходит солеобразование в результате бромирования пропилиденонилтетрагидронафталинонов нами были проведены квантовохимические расчеты полных энергий молекул - интермедиатов реакций на примере превращения диоксосоединения 9а в соль бензодигидрохроменилия 5а. Расчеты проводились методом Ab Initio c базисным набором 3-21G в программном пакете HyperСhem.
Исходя из графической зависимости и полученных данных можно полагать, что процесс ароматизации непредельных дикетонов в соли бензодигидрохроменилия при бромировании последних протекает по пути А – через полукетализацию и дальнейшую гетероароматизацию. При этом термодинамический эффект при образовании полукеталя А-2 составляет 4 ккал/моль, для аналогичных превращений до бромзамещенного полукеталя Б-3 - 9 ккал/моль. Это объясняет легкость протекания солеобразования даже при комнатной температуре.
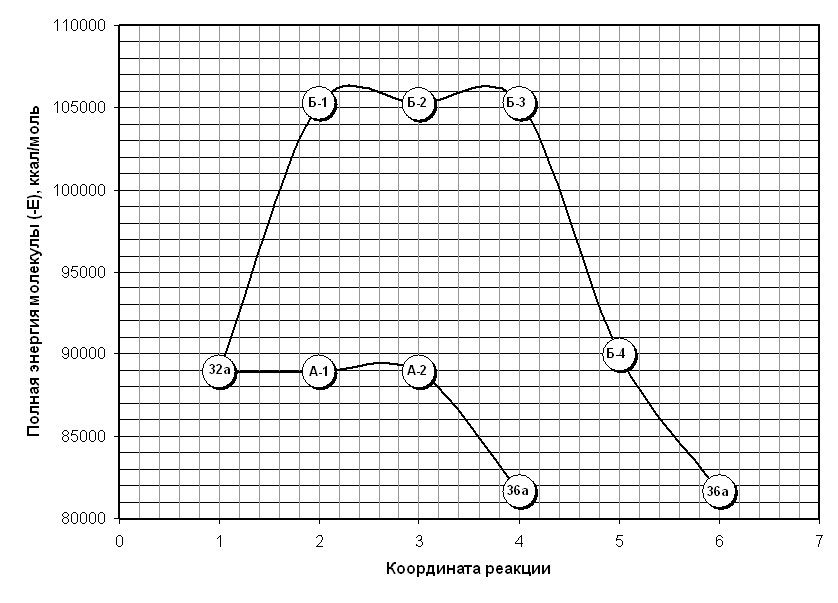
Таким образом, впервые показано, что бромирование пропилиденонилтетрагидро-нафталинонов протекает по двум направлениям с образованием бензоилфуранов и бромидов бензодигидрохроменилия. Последние согласно данным квантовохимических расчетов методом Ab initio возникают через стадию образования полукеталей.
- Хлорирование пропилиденонилтетрагидронафталинонов
Вопрос о взаимодействии непредельных полуциклических 1,5-дикетонов тетрагидронафталинонового ряда с хлором до настоящего времени оставался открытым. Поэтому в рамках настоящей работы нами было проведено систематическое изучение реакции хлорирования непредельных оксосоединений пропилиденонилтетрагидронафталинонового ряда. Взаимодействие дикетонов 9a,б с хлором проводились в среде тетрахлорметана в присутствии ацетата натрия при 200С. Выбор тетрахлорметана в качестве растворителя определялся хорошей растворимостью субстрата в нем и литературными аналогиями - для получения информации в сравнительном плане химии ациклических и семициклических диоксосоединений.
Найдено, что пропилиденонилтетрагидронафталинон 9а в выбранных условиях дает 2-(1,3-дифенил-1-хлорпропан-3-он-1-ил)-2-хлор-1,2,3,4-тетрагидронафталин-1-он 12 с выходом 89%, дикетон 9б - преобразуется в 2-(1-(4-метоксифенил)-3-фенил-1,2-дихлорпропан-3-он-1-ил)-2-хлор-1,2,3,4-тетрагидронафталин-1-он 13 с выходом 60%.
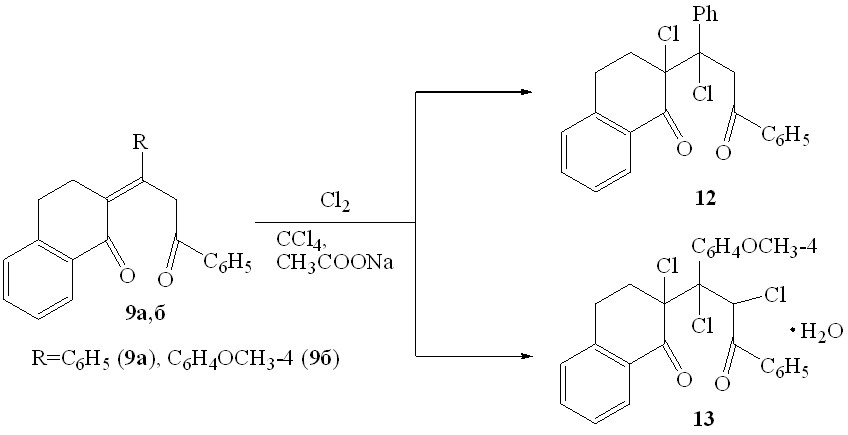
В ИК спектре полученного соединения 12 полос в области колебаний С=С связей не наблюдается. По сравнению с С=О для пропанонилтетрагидронафталинона 32а (1674 см-1) имеет место увеличение частоты С=О группы, которая проявляется при 1686 см-1; это говорит о введении атома хлора в -положение к одной из карбонильных групп и сохранении сопряжения другой (1674 см-1) с ароматическим заместителем.
В ЯМР 1Н спектре дихлордикетона 12 отмечены два синглета метиленовых протонов при 3,5 и 3,6 м.д., метиленовые мультиплеты алицикла проявляются в области 2,2-3,2 м.д., области ароматических протонов отвечает интервал 6,9-8,1м.д.
Согласно данным геометрической оптимизации, методами квантовой механики, объемный заместитель (хлор) к алициклическому фрагменту в соединении 12 располагается псевдоаксиально. Два соседних хлора находятся в скошенной конформации, с диэдральным углом 54,20 между ними. Также псевдоаксиально расположен хлор в положении С-2 алицикла в трихлорзамещенном дикетоне 13, подтверждая общий характер электрофильного присоединения реагента по кратной связи.
Атом хлора при С-2 (алицикла) и хлор при С-1 (алифатической цепочки) находятся в скошенной конформации, при этом диэдральный угол между ними составляет 69,20, атомы галогенов при С-1 и С-2 алифатического фрагмента составляют между собой угол 73,10.
В случае трихлорзамещеного дикетона 13 третий атом хлора вступает в -положение по отношению к С=О группе при С-3 алифатической цепи в соответствии с общетеоретическими представлениями по механизму электрофильного присоединения к енольной форме оксосоединения.
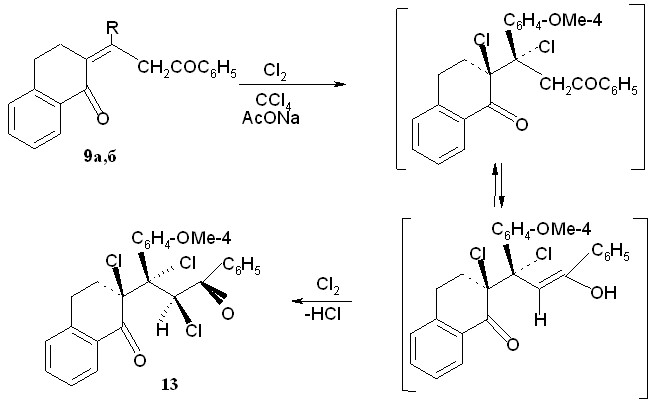
В ЯМР 1Н спектре трихлордикетона 13 отсутствует сигнал метиленовых протонов алифатического фрагмента как это имеет место в исходном непредельном дикетоне 9а ( 4,6 м.д.), но имеется синглет третичного протона при 6,6 м.д в слабом поле, в результате замещения одного из протонов ациклического фрагмента атомом хлора. Синглет метильной группы наблюдается при 3,9 м.д., протоны (4Н) алициклического фрагмента отмечены в области 2,6-3,4 м.д., мультиплет арильных заместителей – в интервале 6,9-8,1 м.д.
Впервые осуществлен прямой переход от соли бензодигидрохроменилия к хлорзамещенным диоксосоединениям. При взаимодействии тетрафторбората 2,4-дифенил-7,8-бензо-5,6-дигидрохроменилия 2а с хлором в среде тетрахлорметана в присутствии ацетата натрия возникают два трихлорзамещенных продукта 14а,15а в виде смеси стереоизомеров в соотношении 1:1, которую удалось разделить с помощью колоночной хроматографии (суммарный выход 36%). В масс-спектрах полученных соединений наблюдаются массы молекулярных ионов (M+-HCl 420 (14а), M+ 456 (15а)).
Отсутствие бензоилфуранов в составе продуктов реакций хлорирования может быть объяснено большей прочностью связи С-Cl в галогензамещенных дикетонах по сравнению с С-Br в таковых. В то же время, газообразный хлор как электрофильный реагент более активен, чем бром, что позволяет наблюдать многовариантность при хлорировании.
Следует отметить также, что в отличие от ациклических аналогов в пропилиденонилтетрагидронафталинонах при хлорировании кратная связь не сохраняется.
Таким образом, в результате проведенных исследований реакций хлорирования непредельных 1,5-дикетонов пропилиденонилтетрагидро-
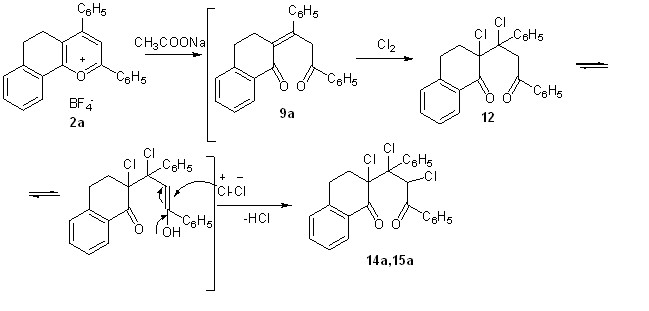 нафталинонового ряда и их субстрата – соли бензодигидрохроменилия впервые получены ди-, трихлорзамещенные пропанонилтетрагидро-нафталиноны, высказаны соображения относительно конфигурации полученных замещенных диоксосоединений; разработан прямой переход от солей бензодигидрохроменилия в галогензамещенные диоксосоединения алифатическо-циклического ряда.
нафталинонового ряда и их субстрата – соли бензодигидрохроменилия впервые получены ди-, трихлорзамещенные пропанонилтетрагидро-нафталиноны, высказаны соображения относительно конфигурации полученных замещенных диоксосоединений; разработан прямой переход от солей бензодигидрохроменилия в галогензамещенные диоксосоединения алифатическо-циклического ряда.
2.3. Взаимодействие пропилиденонилтетрагидронафталинонов с гидразингидратом
Одним из основных свойств непредельных 1,5 – дикетонов является их легкая гетероциклизация под действием нуклеофильных реагентов. Реакционными центрами при этом являются, преимущественно, карбонильная группа, несопряженная с двойной связью дикетона, и кратная связь.
Учитывая отсутствие данных о реакционной способности пропилиденонилтетрагидронафталинонов в нуклеофильных превращениях, представлялось важным осуществить их взаимодействие с гидразином, а также изучить состав получаемых продуктов.
Реакции пропилиденонилтетрагидронафталинонов 9a,б с гидразином осуществлены нами при соотношении субстрат : реагент = 1 : 4 в пропан-2-оле при кипячении. Расчет эффективных зарядов на атомах углерода С-1 тетрагидронафталинонового фрагмента и С-3 алифатической цепи дикетона - 9a, соответственно +0,337 и +0,307, показал равновероятное направление атаки азануклеофила по карбонильной функции тетрагидронафталинонового субстрата и подтвержден нами экспериментально.
Установлено, что дикетон 9a в указанных выше условиях способен образовывать смесь продуктов, одним из которых является 2-(3,3а,4,5-тетрагидро-3-фенил-2Н-бензоиндазол-3-ил)-1-фенилэтанон 16 с выходом 30%.
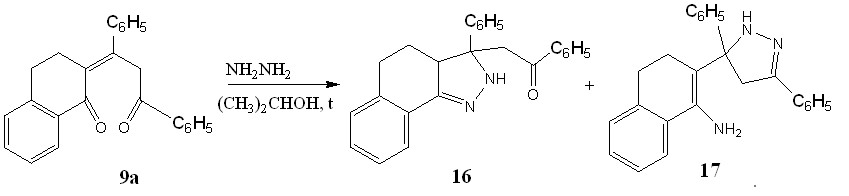
Его образование можно объяснить первоначальной нуклеофильной атакой гидразина по еноновому фрагменту непредельного дикетона 9а, что приводит, на наш взгляд, к промежуточно образующемуся гидразону, который в дальнейшей внутримолекулярной гетероциклизации превращается в индазол 16.
Подробное рассмотрение ЯМР1Н спектра полученного соединения 16 позволило выявить наличие неэквивалентных протонов алифатической цепи (Н1, Н2), вследствие различного пространственного окружения, что графически можно представить проекционной формулой Ньюмена:
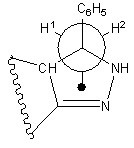
Об этом факте говорит присутствие в спектре двух дублетов рассматриваемых геминальных протонов Н1 при 3,6 м.д. (КССВ = 18 Гц) и Н2 - 4,5 м.д. (ККСВ = 18 Гц). Сигналы метиленовых протонов (мультиплеты) алицикла обнаруживаются в интервалах 1,8-1,9 и 2,7-2,9 м.д. Сигнал метинового протона в виде квадруплета проявляется при 3,2 м.д (КССВ 4,8 Гц); синглет протона вторичной аминогруппы при 7,0м.д.; мультиплет протонов арильных заместителей - в области 7,1-7,9 м.д. Полученный продукт 16 доказан также с применением ЯМР13С спектроскопии.
В меньшем количестве с выходом 15% впервые получен 2-(3,5-дифенил-3,4-дигидро-1Н-пиразол-5-ил)-3,4-дигидронафтален-1-амин 17.
Образование последнего протекает по нижеследующей схеме и сопровождается внутримолекулярной нуклеофильной атакой аминогруппы по кратной связи промежуточно образующегося гидразона.
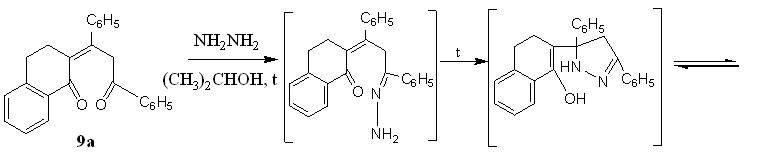
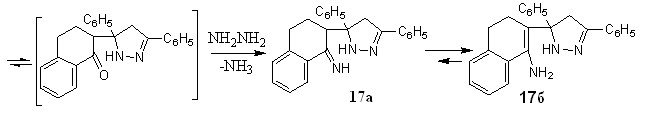
В ИК спектре пиразола 17 присутствуют полосы поглощения первичной аминогруппы в области 3133 см-1, двойной С=С связи в области 1571 см-1. Поглощение С=N- проявляется в области 1683 см-1, ароматических колец - в интервале 1589-1607см-1, метиленовых звеньев при 2927-2831 см-1, 1384-1316 см-1 и 705 см-1. В ЯМР1Н спектре соединения 17 отмечен мультиплет протонов алицикла в интервале 2,9-3,3 м.д., при 2,0 и 2,1 м.д. - два синглета метиленовых протонов пиразольного цикла, при 4,0 м.д. наблюдается синглет двух протонов аминогруппы, протону пиразольного кольца отвечает синглет при 4,2 м.д.. Присутствие в ЯМР1Н спектре слабоинтенсивного сигнала протона третичного атома углерода формы 17а при 3,6 м.д. говорит о смещении имин – енаминого равновесия в сторону формы 17б.
В случае пропилиденонилтетрагидронафталинона 9б, реакция гидразинирования проходит по иному, отличному от вышеуказанного пути превращения, что связано, вероятно, с меньшей реакционной способностью,–непредельного фрагмента дикетона вследствие электронодонорного влияния метоксифенильного заместителя, находящегося при С-1 алифатической цепи диоксосоединения. В этой реакции получен 5-(4-метоксифенил)-3-фенил-6,7-дигидро-4Н-нафто[1,2-с][1,2]диазепин 18 с выходом 22%. Ранее такого рода превращения в ряду известных,-непредельных дикетонов не наблюдались и отмечаются в виду, возможно, равновероятной атаки нуклеофила по карбонильным функциям рассматриваемого диоксосоединения.
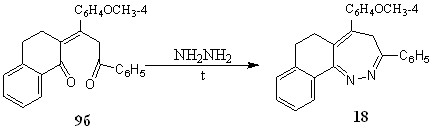
При рассмотрении ЯМР1Н спектра диазепина 18 выявлены протоны метильной группы при 3,9 м.д., мультиплет протонов алицикла в интервале 2,5-2,8 м.д., мультиплет ароматических протонов, резонирующих в области 6,9-7,6 м.д., дублет двух неэквивалентных протонов при С-4 - 4 м.д..
Таким образом, показано, что в зависимости от характера заместителя при С-1 алифатической цепи дикетона имеет место внутримолекулярная гетероциклизация с участием,-непредельной кратной связи субстрата, либо обеих карбонильных функций молекулы, что позволяет переходить к нового типа замещенным пиразолинам, индазолам и конденсированным гетеросистемам диазепинового ряда.
2.4. Направления практического применения
синтезированных соединений.
По результатам виртуального скрининга биологической активности, проведенного по программе PASS среди вновь синтезированных соединений – пропилиденонилтетрагидронафталинонов, бензодигидрохроменолов, солей бензодигидрохроменилия, бензоилфуранов, ди-, трихлорзамещенных дикетонов и азагетероциклов – конденсированных пиразолов, индазолов и диазепинов определены направления их потенциальной активности и возможности практического применения.
Учитывая установленную возможность переноса заряда в солях бензодигидрохроменилия, в рамках данной работы, бромиды бензодигидрохроменилия 5б-г были исследованы нами на электропроводность. Измерения проводились на никелевых электродах с амплитудой переменного сигнала 20мВ. Полученные значения электропроводности для всех измеренных образцов лежат в интервале 8,6-8,8·10-3 Ом-1см-1. Таким образом, данные вещества могут быть использованы для изготовления катодных материалов в источниках тока малой мощности.
ВЫВОДЫ
- Выявлено новое направление реакции солеобразования пропанонилтетрагидронафталинонов в кислых протонных и апротонных средах, как окислительной ароматизации интермедиатов –бензодигидрохроменов.
- Впервые проведено систематическое изучение электронных спектров поглощения солей бензодигидрохроменилия, тетрагидрохроменилия и показана возможность внутримолекулярного переноса заряда от арильного заместителя при С-4 или С-2 гетерокольца, определяющаяся его характером и геометрией конденсированного алицикла. Полученные результаты подтверждены квантовохимическими расчетами.
- Разработан препаративно доступный способ получения пропилиденонилтетрагидронафталинонов гидролизом солей бензодигидрохроменилия в присутствии ацетата натрия на оксиде алюминия. Проведены их конформационные и конфигурационные отнесения.
- Впервые показано, что бромирование пропилиденонилтетрагидро-нафталинонов протекает по двум направлениям с образованием бензоилфуранов и бромидов бензодигидрохроменилия. Последние согласно данным квантовохимических расчетов методом Ab initio возникают через стадию образования полукеталей.
- Установлено, что хлорирование непредельных 1,5-дикетонов пропилиденонилтетрагидронафталинонового ряда протекает с образованием ди- и трихлорзамещенных пропанонилтетрагидро-нафталинонов. Осуществлен прямой переход солей бензодигидрохроменилия в трихлорзамещенные 1,5-диоксосоединения.
- Впервые изучены реакции пропилиденонилтетрагидронафталинонов с гидразингидратом. Показано, что в зависимости от характера заместителя при С-1 алифатической цепи дикетона имеет место внутримолекулярная гетероциклизация с образованием нового типа замещенных пиразолинов, индазолов или конденсированных гетеросистем диазепинового ряда.
Основное содержание диссертации изложено в следующих работах:
1. Панов М.А., Буров А.М., Полубояров Е.М., Федотова О.В. Бромирование R-бисдимедонилметанов // Сб. научн. статей IV Всероссийской конференции молодых ученых «Современные проблемы теоретической и экспериментальной химии», Саратов: СГУ. 2004. С. 67-70.
2. Панов М.А., Буров А.М., Федотова О.В. Синтез замещенных оксооктагидроксантенов на основе R-бисдимедонилметанов // Сб. научн. статей V Всероссийской конференции молодых «Современные проблемы теоретической и экспериментальной химии», Саратов: СГУ. 2005. С. 76-79.
3. Буров А.М., Пчелинцева Н.В., Федотова О.В. Щелочной гидролиз солей бензогидрохромилия – эффективный метод синтеза конденсированных дигидрохроменолов // Тез. докл. IX научной школы-конференции по органической химии, Москва: Эльзавир. 2006. С. 94.
4. Колеватова Я.Г., Буров А.М., Пчелинцева Н.В., Федотова О.В. Функционально замещенные соли пирилия и их конденсированные аналоги – перспективные реагенты в синтезе красителей // Тез. докл. XIX Международной научно-технической конференции «Химические реактивы, реагенты и процессы малотоннажной химии «Реактив-2006», Уфа: Реактив. 2006. С. 33-34.
5. Буров А.М., Колеватова Я.Г., Пчелинцева Н.В., Федотова О.В., Внутримолекулярный перенос заряда в солях бензогидрохромилия // Сб. научн. статей «Фундаментальные и прикладные проблемы современной химии в исследованиях молодых ученых», Астрахань. 2006. С.134-136.
6. Буров А.М., Пчелинцева Н.В., Федотова О.В. Галогенирование непредельных 1,5-дикетонов тетрагидронафталинонового ряда // Сб. научн. статей XI Всероссийской конференции «Карбонильные соединения в синтезе гетероциклов», Саратов: СГУ. 2008. С. 53-55.
7. Буров А.М., Пчелинцева Н.В., Федотова О.В. Электронные спектры поглощения солей пирилия и бензогидрохроменилия // ХГС. 2008. №8. С. 1152-1160.
8. Пчелинцева Н.В., Федотова О.В., Колеватова Я.Г., Буров А.М., Меньшова М.А. Химия 1,5-дикетонов. III. Новый подход к синтезу непредельных 1,5-дикетонов // ЖОрХ. 2008. Т. 44. №8. С. 1263-1264.

