Поликарбонилзамещенные циклогексанолоны в реакциях с полинуклеофильными реагентами
На правах рукописи
ЩЕЛОЧКОВА Оксана Анатольевна
Поликарбонилзамещенные циклогексанолоны в реакциях с полинуклеофильными реагентами
02.00.03 – органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Саратов - 2006
Работа выполнена в Саратовском государственном университете
имени Н.Г. Чернышевского на кафедре органической и биоорганической химии
Научный руководитель : доктор химических наук,
профессор Кривенько Адель Павловна
Официальные оппоненты: доктор химических наук, профессор
Масливец Андрей Николаевич
кандидат химических наук
Григорьев Александр Викторович
Ведущая организация: Воронежский государственный университет
Защита состоится 14 декабря 2006 года в 1400 часов на заседании диссертационного совета Д 212.243.07 при Саратовском государственном университете имени Н.Г. Чернышевского по адресу: 410012, г. Саратов, ул. Астраханская, 83, корп. I, химический факультет СГУ.
С диссертацией можно ознакомиться в Научной библиотеке
Саратовского государственного университета имени Н.Г. Чернышевского
Автореферат разослан 14 ноября 2006г.
Ученый секретарь диссертационного совета,
доктор химических наук,
профессор Штыков С.Н.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Химия поликарбонильных соединений алифатикоалициклического ряда всегда привлекала внимание исследователей как в теоретическом отношении, так и в направлении практического использования. В этом плане особое значение имеют поликарбонилзамещенные циклогексанолоны (3–Ar–2,4–диацетил–5–гидрокси–5–метилциклогексаноны и 2–Ar–4–гидрокси–4–метил–6–оксоциклогексан–1,3–диалкилдикарбоксилаты) в силу доступности, высокой реакционной способности, возможности получения на их основе различных карбо- и гетероциклических соединений в том числе и практически значимых.
К настоящему времени в химии оксосоединений указанного ряда достигнуты успехи в области стереохимии, таутомерии, изучены реакции с N,O-содержащими моно-, бинуклеофильными реагентами – ароматическими аминами, гидразинами, гидроксиламином, алканоламинами, позволившие перейти к циклогексенил(диенил)аминам, гетероциклическим соединениям; представлены аспекты возможного практического использования полученных веществ (антифаговая, антиоксидантная, антимикробная активность, криопротекторное, анальгетическое и жаропонижающее действие, интермедиаты в синтезе антигельминтных препаратов). Однако неизученными до настоящего времени оставались реакции с участием алифатических диаминов, мало представлены реакции с N,S-полинуклеофильными реагентами, что создает перспективу выявления новых аспектов химии этого класса соединений, синтеза новых полигетероатомных систем.
Работа является частью плановых научных исследований, проводимых на кафедре органической и биоорганической химии Саратовского государственного университета имени Н.Г.Чернышевского по теме «Теоретическое и экспериментальное исследование новых материалов и систем с заданными физико-химическими и биологическими свойствами» (рег. № 3.4.03), работ, выполненных при финансовой поддержке научной программы Министерства образования РФ «Университеты России» (05.01.019).
Цель работы заключалась в синтезе и изучении реакций поликарбонилзамещенных циклогексанолонов (3–Ar–2,4–диацетил–5–гидрокси–5–метилциклогексанонов и 2–Ar–4–гидрокси–4–метил–6–оксоциклогексан–1,3–диалкилдикарбоксилатов), содержащих карбонильные группы различного типа, с ароматическими, алифатическими диаминами, N-, S-содержащими полинуклеофильными реагентами для выявления их избирательной реакционной способности, синтеза новых карбо-, гетероциклических соединений на их основе, установления строения полученных соединений, изучения биологической активности.
Научная новизна. Осуществлен синтез ранее неизвестных ацетил(метоксикарбонил)замещенных циклогексанолонов. На примере 2,4-диацетил-5-гидрокси-5-метил-3-(2-метилфенил)циклогексанона с привлечением известных данных по кето-енольным превращениям орто-R(F,Cl,OMe,NO2)-арилзамещенных аналогов показано, что введение метильного заместителя в орто-положение ароматического ядра не способствует енолизации. При взаимодействии вновь полученного циклогексанолона с ацетатом меди (катализатор енолизации и реагент) образуется комплексное соединение – бис-2,4-диацетил-3-(2-метилфенил)-5-гидрокси-5-метил-1-циклогексенолат меди.
При изучении реакций 3–Ar–2,4–диацетил–5–гидрокси–5–метилциклогексанонов и 2–Ar–4–гидрокси–4–метил–6–оксоциклогексан–1,3–диалкилдикарбоксилатов с N,S-содержащими полинуклеофильными реагентами (диаминами алифатического ряда, бензидином, тиомочевинной, тиосемикарбазидом, 2,4-динитрофенилгидразином) показано, что независимо от природы азотсодержащего нуклеофила реакции протекают региоселективно по наиболее активной карбонильной группе алицикла с участием одного либо двух нуклеофильных центров реагента и приводят к образованию N– циклогексениламинов, N,N–бисциклогексенилдиаминов, гидразонов, азаспиранов, замещенных тиомочевин.
Так, реакции с бензидином и 1,2-диаминоциклогексаном приводят к продуктам моноаминирования карбонильной группы алицикла субстрата – N-бензидил(2-аминоциклогексил)циклогексениламинам. Под действием диаминов алифатического ряда (этилен-, тетраметилен-, гексаметилендиамины) образуются N,N–бисциклогексенилполиметилендиамины, причем соединения, содержащие ацетильные заместители существуют в виде двухводного гидрата (данные термогравиметрического анализа) независимо от длины полиметиленовой цепочки. Особенностью реакций с алифатическими диаминами является их проведение в отсутствии катализатора.
Реакции с 2,4-динитрофенилгидразином протекают как нуклеофильное замещение карбонильной группы алицикла с образованием гидразонов.
Под действием тиосемикарбазида в зависимости от кислотности катализатора возникают триазаспиродекантионы, либо продукты их дегидратации-декарбоксилирования – триазаспиродецентионы.
Реакции с тиомочевиной требуют использования основного катализа (этилат натрия) и приводят к N-циклогексенилтиомочевинам.
Аминирование циклогексанолонов в условиях СВЧ-активации позволяет отказаться от использования катализатора, в некоторых случаях от растворителя, значительно сократить время реакций и повысить выходы продуктов.
Практическая значимость работы заключается в синтезе на основе доступных 3–Ar–2,4–диацетил–5–гидрокси–5–метилциклогексанонов и 2–Ar–4–гидрокси–4–метил–6–оксоциклогексан–1,3–диалкилдикарбоксилатов N–циклогексениламинов, N,N–бисциклогексенилполиметилендиаминов, N-циклогексенилтиомочевин, триазаспиродекантионов и иных соединений с фармакофорными фрагментами и группами. Среди синтезированных веществ выделены соединения, обладающие антифаговым действием в отношении кишечного фага Т-4, ростостимулирующей, антимикробной активностью.
На защиту выносятся результаты исследований по:
- синтезу ранее неизвестных ацетил(метоксикарбонил)замещенных циклогексанолонов и выявлению влияния орто-заместителя в ароматическом ядре на их способность к енолизации;
- выявлению избирательной реакционной способности алкоксикарбонил(ацетил)замещенных циклогексанолонов в реакциях с азотсодержащими полинуклеофильными реагентами – ароматическими, алифатическими диаминами, тиомочевинной, тиосемикарбазидом, 2,4-динитрофенилгидразином;
- построению новых карбо- и гетероциклических систем на основе алкоксикарбонил(ацетил)замещенных циклогексанолонов;
- результатам аминирования алкоксикарбонил(ацетил)замещенных циклогексанолонов с использованием микроволновой активации (СВЧ);
- изучению (стерео)строения полученных веществ и их биологической активности.
Апробация работы. Основные результаты работы представлялись на III, IV, V Всероссийских конференциях молодых ученых “Современные проблемы теоретической и экспериментальной химии” (Саратов, 2001, 2003, 2005), 3-й Международной конференции молодых учёных и студентов “Актуальные проблемы современной науки” (Самара, 2002), I Международном форуме (6 Международная конференция молодых ученых и студентов) “Актуальные проблемы современной науки” (Самара, 2005), X Всероссийской научной конференции “Карбонильные соединения в синтезе гетероциклов” (Саратов, 2004), VII Научной школе-конференции по органической химии (Екатеринбург, 2004), XV Российской студенческой научной конференции “Проблемы теоретической и экспериментальной химии” (Екатеринбург, 2005), VIII Молодежной научной школе-конференции по органической химии (Казань, 2005), VI Международной конференции молодых ученых “Современные тенденции в органическом синтезе и проблемы химического образования”, (Санкт-Петербург, 2005).
Публикации. По теме диссертации опубликовано 16 работ: из них 10 статей, в том числе 2 статьи в реферируемых журналах, 8 статей в сборниках научных трудов, 6 тезисов докладов.
Объём и структура работы. Диссертация изложена на 167 страницах машинописного текста, включая введение, четыре главы, выводы, список использованных источников из 168 наименований, 23 таблицы, 7 рисунков. Приложение содержит 40 стр.
Благодарность. Автор выражает глубокую благодарность научному руководителю, Заслуженному работнику высшей школы РФ, доктору химических наук, профессору Кривенько Адель Павловне.
Доктору химических наук, заведующей кафедрой общей и неорганической химии Муштаковой С.П., к.х.н. Кабловой О.Е. и сотрудникам за научные консультации, проведение термогравиметрического анализа и запись УФ-спектров (Саратовский Государственный Университет им. Н.Г. Чернышевского).
Доктору медицинских наук Плотникову О.П. и сотрудникам за проведение испытаний антифаговой активности (Российский научно-исследовательский противочумный институт «Микроб», г.Саратов).
Доктору биологических наук Моторе Л.Ю. и сотрудникам за проведение испытаний ростостимулирующей активности (ИБФРМ РАН, г.Саратов).
Доктору медицинских наук, профессору Шубу Г.М., к.б.н. Нечаевой О.В. за проведение испытаний антимикробной активности (кафедра вирусологии и иммунологии Саратовского Государственного медицинского Университета).
Кандидату химических наук, доценту кафедры органической и биоорганической химии СГУ Голикову А.Г. за помощь в интерпретации спектральных данных.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
- Синтез алкоксикарбонил(ацетил)замещенных циклогексанолонов и их строение
В качестве ключевых соединений для дальнейших исследований были выбраны известные 3–Ar–2,4–диацетил–5–гидрокси–5–метилциклогексаноны 1,4,7,9,10,12, 2–Ar–4–гидрокси–4–метил–6–оксоциклогексан–1,3–диалкилди-карбоксилаты 2,3,5,6,8,11,13 и не описанные ранее циклогексанолоны 14-16.
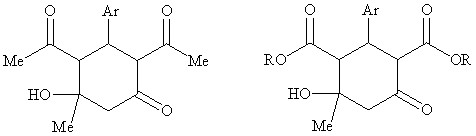
1,4,7,9,10,12,16 2,3,5,6,8,11,13-15
Ar = Ph (1-3), C6H4-4-OMe (4-6), C6H3-3,4-(OМе)2 (7,8,14), Fu (9,15),
C6H4-3-NO2 (10,11), C6H4-4-N(Ме)2 (12,13), C6H4-2-Me (16)
R = OEt (2,5,8,11,13), OMe (3,6,14,15)
Синтез осуществлялся посредством дикетонной конденсации соответствующих альдегидов с ацетилацетоном, метиловым (этиловым) эфирами ацетоуксусной кислоты (в мольном соотношении 1:2) в условиях основного катализа (пиперидин), в растворе этилового спирта.
При синтезе циклогександиметилдикарбоксилата 15 в качестве минорного продукта (29%) был выделен 2-метил-4-оксо-6-(2-фурил)циклогекс-2-енметилкарбоксилат 17, как результат дегидратации-декарбоксилирования.
Возникновение последнего, на основе собственных и литературных данных можно объяснить образованием лактонного интермедиата А и его распадом, которому способствует сближение метиленовой группы с фурановым циклом:
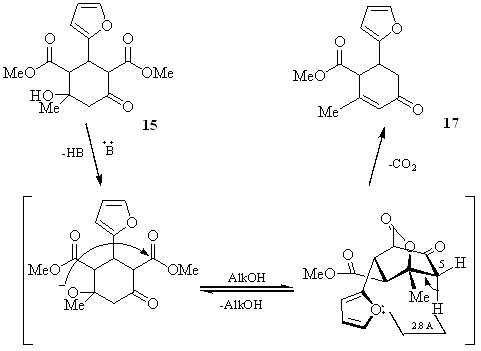
А
Полученные данные являются еще одним примером влияния фурильного заместителя на направление дикетонной конденсации альдегидов с 1,3-диоксосоединениями.
При выдерживании смеси исходных реагентов (метилового эфира ацетоуксусной кислоты и фурфурола) в течение 30 дней в присутствии основного катализатора (пиперидин) в качестве основного продукта был выделен циклогексенкарбоксилат 17 (58%); выход дикарбоксилата 15 составил 30%.
Одним из центральных вопросов химии диоксосоединений изучаемого типа является кето-енольная таутомерия.
Ранее установлено влияние орто-заместителя (ОМе, NO2, Cl, F) в ароматическом кольце 3-Ar-2,4-диацетил-5-гидрокси-5-метилциклогексанонов на их способность к енолизации. В продолжение этих исследований с целью оценки влияния природы орто-заместителя на енолизацию нами осуществлен синтез неизвестного ранее о-метилфенилзамещенного циклогексанолона – 2,4-диацетил-5-гидрокси-5-метил-3-(2-метилфенил)циклогексанона 16 посредством альдольной конденсации о-метилбензальдегида с ацетилацетоном.
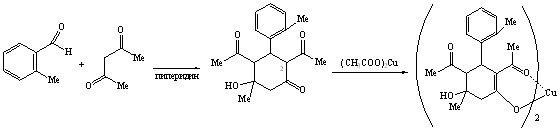
16 86% 18 41%
Спектральными методами (ИК, ЯМР1Н) установлена кетоформа соединения 16, енольная форма не была обнаружена вероятно из-за отсутствия влияния о-метильной группы на подвижность атома водорода при атоме С2 алицикла, ответственного за енолизацию (отсутствие ВВС или эффекта поля). При взаимодействии циклогексанолона 16 с ацетатом меди, выступающим в качестве реагента и катализатора процесса енолизации, было получено комплексное соединение бис-2,4-диацетил-3-(2-метилфенил)-5-гидрокси-5-метил-1-циклогексенолат меди 18.
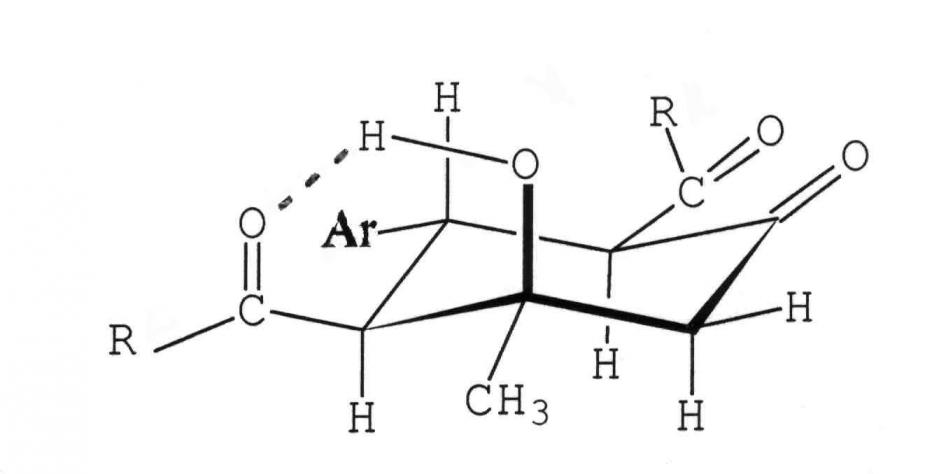
Синтезированные нами оксосоединения 14-16 построены аналогично описанным 1-13 и существуют в конформации кресла с экваториальным расположением заместителей кроме гидроксильной группы, имеющей аксиальную ориентацию (данные ЯМР1Н):
- Реакции алкоксикарбонил(ацетил)замещенных циклогексанолонов с диаминами
В качестве нуклеофильных реагентов в реакциях с алкоксикарбонил(ацетил)замещенными циклогексанолонами нами впервые были использованы диамины ароматического, алифатического и алициклического рядов – бензидин, этилендиамин, тетраметилендиамин, гексаметилендиамин и 1,2-диаминоциклогексан. При этом можно было ожидать образования N–циклогексениламинов, N,N–бисциклогексенилдиаминов, гетероциклических систем.
- Реакции с бензидином
Известно, что реакции 3–Ar–2,4–диацетил–5–гидрокси–5–метилциклогексанонов и 2–Ar–4–гидрокси–4–метил–6–оксоциклогексан–1,3–диалкилдикарбоксилатов с ароматическими моноаминами протекают по карбонильной группе алицикла с образованием соответствующих циклогексенилариламинов.
Нами впервые на примере субстратов 1,3,4,9 осуществлены реакции с ароматическим диамином – бензидином.
Реакция осуществлялась при кипячении реагентов в бензоле в условиях кислотного катализа (2% уксусная кислота) при соотношении субстрат:реагент =1:1, 2:1.
Во всех рассмотренных случаях, независимо от соотношения реагентов, реакция протекала как моноаминирование с образованием продуктов енаминного строения – 3R-2,4-диацетил-5-гидрокси-5-метил-N-бензидилциклогексениламинов 19-21 (40-59%) и 6-гидрокси-6-метил-2-фенил-4-бензидиламино-3-циклогексен-1,3-диметилдикарбоксилата 22 (76%).

1,3,4,9 19-22
R=Ph (1,3,19,22); C6H4-4-OMe (4,20); Fu (9,21)
R1= Me (1,4,9,19-21); OMe (3,22)
Введение в реакцию с циклогексанолоном 1 енамина 19 в качестве аминирующего реагента не привело к положительному результату. Вероятно, первичная аминогруппа в енаминах 19-22 теряет активность вследствие делокализации электронной пары по протяженной системе -связей.
- Реакции с полиметилендиаминами
Нами впервые изучено взаимодействие диэтоксикарбонил(ацетил)замещенных циклогексанолонов с алифатическими диаминами с различным расстоянием между атомами азота (1,2; 1,4; 1,6): этилендиамином, тетраметилендиамином и гексаметилендиамином. Мы полагали, что использование более сильных нуклеофилов по сравнению с ароматическими диаминами может вовлечь в реакцию несколько реакционных центров субстратов и реагентов.
Реакция проводилась при кипячении в безводном бензоле при варьировании соотношений субстрат:реагент-1:1, 2:1 в отсутствии катализатора, т.к. при использовании 2% уксусной кислоты (стандартные условия для ариламинирования) из-за высокой основности реагентов имело место солеобразование. Во всех рассмотренных случаях реакция протекала региоселективно с участием обеих аминогрупп диамина и карбонильных групп алицикла двух молекул субстрата с образованием диаминов N,N–бис(2,4-диацетил-5-гидрокси-5-метил-3-фенил(4-метоксифенил)-1-циклогексенил)эти-лен(тетра-, гексаметилен)диаминов 23-28 и N,N–бис(6-гидрокси-6-метил-2-фенил-4-циклогексен-1,3-диэтоксикарбонил)этилен(тетра-, гексаметилен)ди-аминов 29-31.
Следует отметить, что соотношение регентов оказывает влияние на выходы продуктов, которые составляют 40-97% при соотношении 2:1, а при эквимольных количествах – 10-20%.
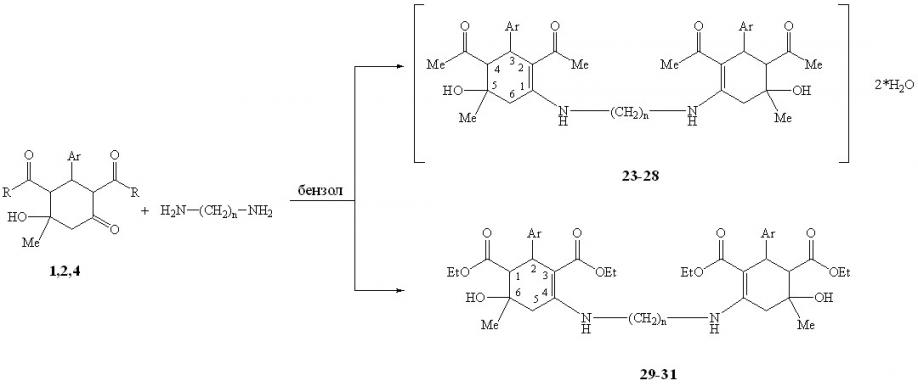
n = 2, 4, 6; Ar = Ph (1,2,23,25,27,29,30,31); C6H4-4-OМе (4,24,26,28); R = Ме (1,4,23-28); OEt (2,29-31)
Диамины 23-28, содержащие ацетильные заместители, в отличие от аналогично построенных соединений со сложноэфирными заместителями 29-31, существуют в виде двухводного гидрата, что было подтверждено термогравиметрическим и элементным анализами.
На рис. 1 и 2 представлены кривые ТГА для дигидрата N,N–бис(2,4-диацетил-5-гидрокси-5-метил-3-фенил-1-циклогексенил)гексаметилендиамина 27 и N,N–бис(6-гидрокси-6-метил-2-фенил-4-циклогексенил-1,3-диэтоксикарбонил)гексаметилендиамина 31. Характер кривых для соединений 23-26,28 и 29,30 аналогичен.
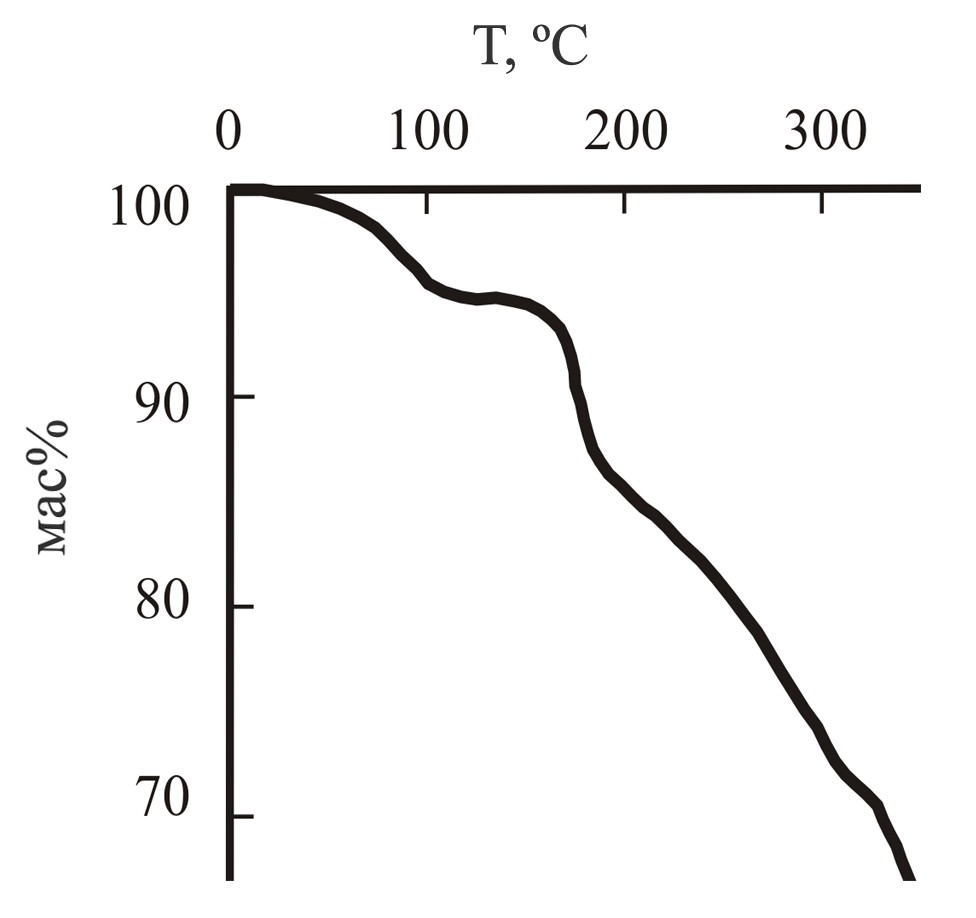
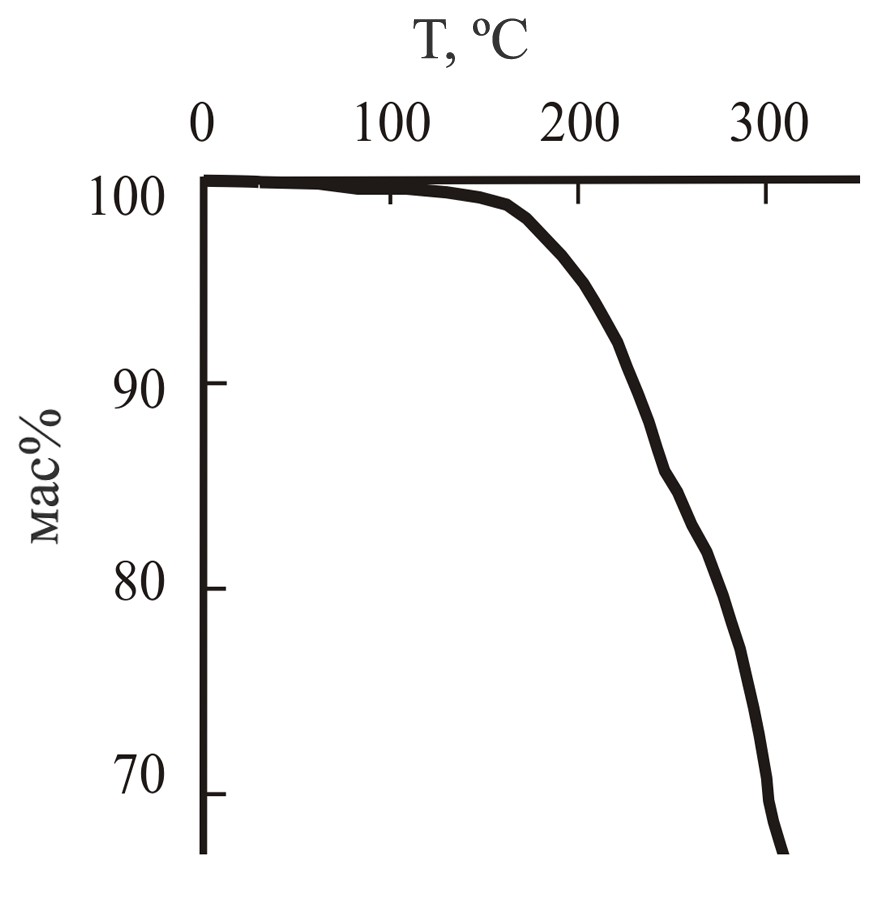
Рис. 1: Кривая ТГА для дигидрата N,N–бис–(2,4-диацетил-5-гидрокси-5-метил-3-фенил-1-циклогексенил)гексаметилендиамина 27
Рис. 2: Кривая ТГА для N,N–бис(6-гид-рокси-6-метил-2-фенил-4-циклогексенил-1,3-диэтоксикарбонил)гексаметиленди-амина 31
Кривая ТГА дигидрата 27 содержит область падения массы при температуре 100С, которая составляет ~ 5 %, что соответствует двум молекулам воды.
ИК спектры соединений 23–28,30,31 соответствуют предложенной структуре.
В спектрах ЯМР1Н дигидратов диаминов 23,25-28 сигналы протонов вторичных аминогрупп наблюдаются в слабом поле (11.55-11.49 м.д.), в спектрах диаминов 29-31 эти сигналы находятся при 9.01-8.88 м.д.. Смещение сигналов протонов при азоте в сильное поле по сравнению с соответствующими сигналами, характерными для циклогексенилбензидиламинов 19,20 (13.28-13.26 м.д.) свидетельствует об уменьшении цепи сопряжения. Геминальные протоны Н6(5) алицикла имеют сигналы, отличающиеся расположением в зависимости от длины полиметиленовой цепочки между атомами азота: для этилендиаминов – 2.62-2.54 м.д. (с), для тетраметилендиаминов – 1.64-1.60 м.д. (с), для гексаметилендиаминов – 1.41-1.39 (На) (с), 1.56-1.54 (Не) (с). Отсутствие сигнала протона при С2(3) свидетельствует о енаминном строении полученных веществ.
- Реакции с 1,2-диаминоциклогексаном
Нами впервые изучена реакция диэтоксикарбонил(ацетил)замещенных циклогексанолонов 1,2 с алициклическими диамином – 1,2-диаминоциклогексаном, в котором этилендиаминный фрагмент закреплен.
При кипячении реагентов в бензоле реакция протекала как моноаминирование с образованием енаминов – 2,4-диацетил-5-гидрокси-5-метил-3-фенил-N(2-аминоциклогексил)циклогексениламина 32 и 6-гидрокси-6-метил-2-фенил-4-(2-аминоциклогексиламино)-3-циклогексен-1,3-диэтилдикар-боксилата 33.
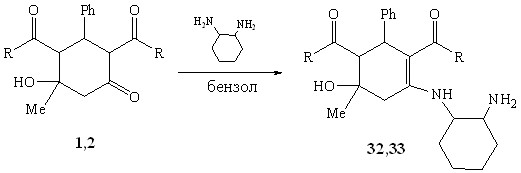
R= Me (1,32); OEt (2,33) 40-50%
Аминирование с участием двух нуклеофильных центров реагента не наблюдалось, вероятно, из-за стерических факторов.
- Взаимодействие алкоксикарбонил(ацетил)замещенных циклогексанолонов с N,S–содержащими реагентами
- Реакции с тиомочевинной
Реакции ацетилзамещенных циклогексанолонов с тиомочевинной ранее не исследовались.
Наличие в молекуле тиомочевины трех нуклеофильных центров позволяло ожидать нескольких направлений реакции: традиционного с образованием циклогексенилзамещенных тиомочевин А, мало представленной в литературе на примере наших субстратов гетероциклизации с образованием диазинтионов Б, или тиазинов В в зависимости от используемого кислотного или основного катализатора.
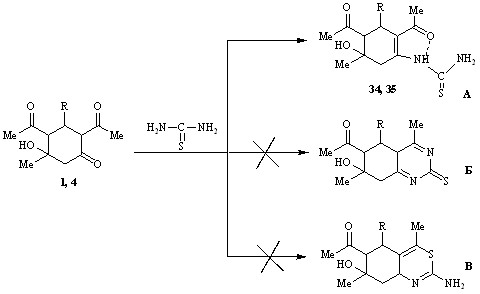
R= Ph (1, 34), C6H4-4-OMe (4, 35)
Проведенная нами реакция субстратов 1,4 с тиомочевинной в условиях кислотного катализа не имела места и лишь при использовании этилата натрия, активирующего реагент, с выходами ~55% были выделены продукты аминирования оксогруппы алицикла – N-(2,4-диацетил-5-гидрокси-5-метил-3-фенил(п-метоксифенил)-1-циклогексенил)тиомочевины 34,35.
Гетероциклизация не происходит, вероятно, из-за стабилизации продуктов за счет образования квазиароматического кольца с участием внутримолекулярной водородной связи С=О…HN между атомом кислорода карбонильной группы ацетильного заместителя и атомом водорода аминогруппы тиоамидного фрагмента.
- Взаимодействие с тиосемикарбазидом
Тиосемикарбазид как полинуклеофильный реагент может реагировать с поликарбонильными соединениями с образованием карбо- и гетероциклических систем.
При взаимодействии циклогександикарбоксилатов 2,3,5,6,8,13,14 с тиосемикарбазидом (кипячение реагентов в этаноле или бензоле в отсутствии и при наличии катализатора (2% уксусная кислота)) реакция протекала по карбонильной группе алицикла как спироциклизация с образованием гетероспиранов – 6,8-диалкоксикарбонил-9-гидрокси-9-метил-7-Ar-1,2,4-триазаспиро[4,5]декан-3-тионов 36-42, представляющих собой по данным ТСХ индивидуальные соединения.
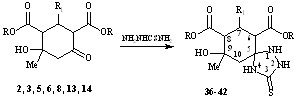 58-86%
58-86%
R1= Ph (2,3,36,37), C6H4-4-OMe (5,6,38,39), C6H4-3,4-(OMe)2 (8,14,40,41), C6H4-4-N(Me)2 (13,42);
R = Me (3,6,14,36,38,40), Et (2,5,8,13,36,38,40,42)
В ИК-спектрах соединений 36-42 присутствуют валентные колебания аминогрупп (3464-3268 см-1), гидроксильной группы (3547-3480 см-1), несопряженных карбонильных групп (1747-1701 см-1), исчезают валентные колебания карбонильных групп алицикла и появляются полосы валентных колебаний фрагмента N-CS-N (1393-1360 см-1), С=S связи (1597-1570 см-1).
В спектрах ЯМР1Н присутствуют сигналы N-H протонов (Н4 – 8.02-8.09 м.д. (с); Н2 – 10.24-10.27 м.д. (с); Н1 – 6.72-6.71 м.д. (с)); протона гидроксильной группы (4.44-4.46 м.д.); протоны Н6 (3.30-3.28 м.д.) и Н8 (3.08-2.99 м.д.) резонируют дублетами с J67 и J78 =12-14 Гц, сигнал протона Н7 проявляется в области 3.88-3.61 м.д.. Геминальные протоны Н10а, Н10е алицикла находятся при 2.24-2.21 и 2.31-2.29 м.д. соответственно.
Отсутствие в ИК спектрах валентных колебаний сопряженной карбонильной группы, связи С=С и наличие в спектрах ЯМР1Н сигналов N-H протонов и протона Н6 подтверждает предложенную структуру азаспирана и исключает возможные альтернативные структуры енаминную и иминную.
При кипячении дикарбоксилата 5 с тиосемикарбазидом в бензоле в присутствии трифторуксусной кислоты реакция протекает по иному неожиданному направлению как спироциклизация-дегидратация-декарбоксилирование с образованием 7-метил-9-(4-метоксифенил)-8-этоксикарбонил-1,2,4-триазаспиро[4,5]дец-7-ен-3-тиона 44.
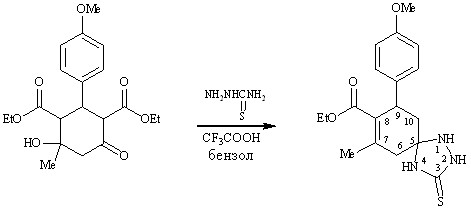
5 44
Вероятно возникающий в этих условиях азаспиран претерпевает дегидратацию с образованием сопряженной системы связей С=С–С=О, далее следует гидролиз сложноэфирной группы за счет выделяющейся воды и декарбоксилирование.
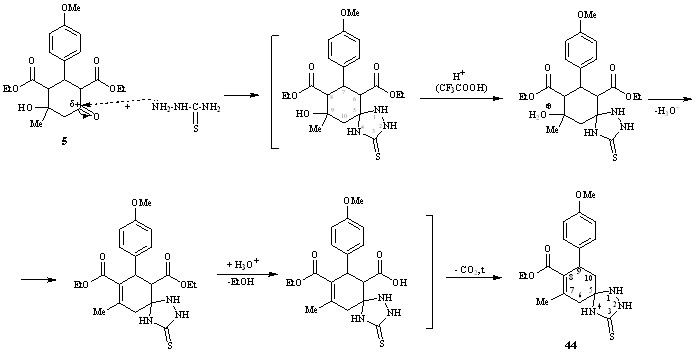
В спектрах ЯМР1Н присутствуют сигналы протонов трех NH протонов (Н4 – 10.19 м.д.; Н2 – 11.62 м.д.; Н1 – 9.37 м.д.), протона Н9 (3.97 м.д.), геминальных протонов Н10а,е и Н6а,е (2.56 и 2.69 м.д.) соответственно. Наличие одного триплета, соответствующего метильной группе сложноэфирного заместителя при С8, подтверждает декарбоксилирование, а отсутствие сигналов от протонов Н8 направление дегидратации.
- Взаимодействие алкоксикарбонилзамещенных
циклогексанолонов с 2,4-динитрофенилгидразином
Известно, что реакции гидразингидрата и фенилгидразина с алкоксикарбонилзамещенными циклогексанолонами протекают успешно по 1,3-диоксофрагменту как гетероциклизация с образованием тетрагидроиндазолов.
Нами впервые изучены реакции 1,3-диалкилдикарбоксилатов 2,3,5,6,8,11,13-15 с 2,4-динитрофенилгидразином.
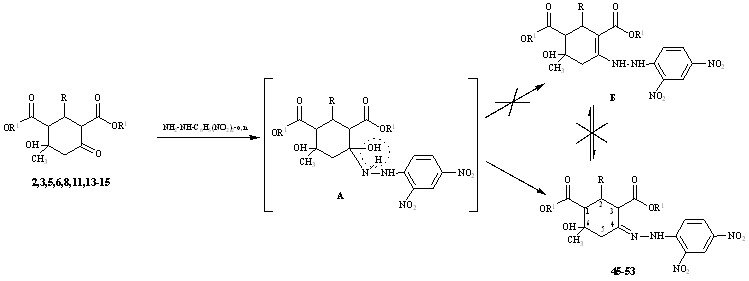
R = Ph (2,3,45,46); C6H4-4-(OМе) (5,6,47,48); C6H3-3,4-(OМе)2 (8,9,49,50);
C6H4-4-N(Me)2 (13,51); C6H4-3-(NO2) (11,52); Fu (15,53);
R1= Et (2,5,8,11,13,45,47,49,51,52); Ме (3,6,14,15,46,48,50,53)
При проведении реакции по ранее разработанной методике (кипячение этанольного раствора реагентов в течении 30 минут) были получены 2,4-динитрофенилгидразоны 2–Ar–4–гидрокси–4–метилциклогексан–1,3–диметил(диэтил)дикарбоксилатов 45-53 с невысокими выходами. Ужесточение условий реакции (кипячение в этаноле в условиях кислотного катализа в течении 1,5-2 часов) не изменило результатов реакции, но позволило повысить выходы до 79-98%.
Образование продуктов, содержащих семициклическую двойную связь (гидразоны), а не циклическую (енамины) обусловлено, вероятно, сильным электроноакцепторным влиянием динитрофенильного заместителя, способствующего отщеплению протона (при дегидратации интермедиата А) от атома азота, а не атома углерода алицикла. Гетероциклизация не протекает из-за низкой нуклеофильности реагента.
В ИК-спектрах соединений 45-53 валентные колебания несопряженных карбонильных групп сложноэфирных заместителей находятся в области 1732-1702 см-1, гидроксильной группы при 3641-3466 см-1, исчезают валентные колебания карбонильной группы алицикла и появляются полосы валентных колебаний NH группы (3568-3298 см-1), краевой С=N связи (1620-1616 см-1).
В спектрах ЯМР1Н сигнал протона аминогруппы (11.25-11.05 м.д.) смещен в слабое поле, что свидетельствует о сопряжении. Протоны Н2 ( 4.01-3.63 м.д.), Н3 (3.19-2.96 м.д.) и Н1 (2.71-2.25 м.д.) резонируют дублетами с константой спин-спинового взаимодействия J32,24=10-14,5 Гц. Геминальные протоны Н5е,а алицикла проявляются в области 2.96-2.50 м.д.. Наличие сигнала протона Н3 алицикла подтверждает предложенную структуру гидразона и исключает возможную альтернативную структуру енаминогидразинного таутомера Б.
Гетероциклизация 2,4-динитрофенилгидразона 45 не происходит даже при кипячении в ледяной уксусной кислоте в течение 1,5 часов. Однако в этом случае имеет место дегидратация с образованием 2,4-динитрофенилгидразона 6-метил-2-фенил-5-циклогексен-1,3-диэтилдикарбоксилата 55.
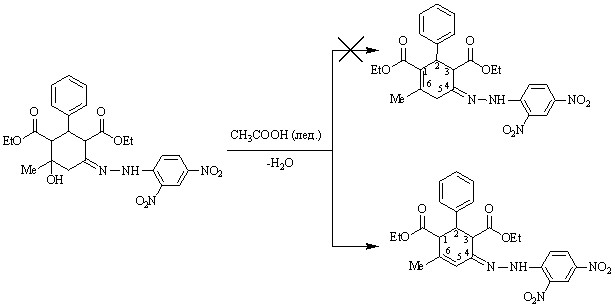
45 55
Следует отметить, что из возможных направлений дегидратации (, или,) реализуется путь с образованием продукта, содержащего наиболее длинную цепь сопряжения (,-относительно гидразонного фрагмента).
- Алкоксикарбонил(ацетил)замещенные циклогексанолоны в синтезах N-содержащих производных с использованием микроволновой активации
Пытаясь вовлечь в реакцию иные активные центры субстратов и реагентов и повысить выходы продуктов, мы осуществили взаимодействие ацетил(этоксикарбонил)замещенных циклогексанолонов с анилином, бензидином и тиосемикарбазидом в условиях микроволнового воздействия в отсутствии катализатора и растворителя (DAEWOO KOR-6167 2,45ГГц, 800 Вт).
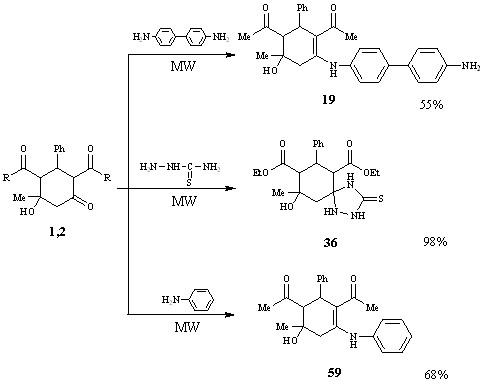
Установлено, что при использовании микроволновой активации направление реакций не изменилось. Однако преимуществом данного метода является значительное сокращение времени реакции (с 4 часов до 30 минут), возможность проведения синтеза в отсутствии катализатора при сохранении или увеличении выходов продуктов реакции (55-98%), что позволяет рассматривать этот метод как перспективный.
Соединения, полученные в стандартных условиях и при синтезе в СВЧ-печи, имели одинаковые физико-химические константы.
- Направления возможного практического использования полученных соединений
Синтезированные нами соединения были испытаны на антифаговую (РосНИПЧИ “Микроб”, г.Саратов), ростостимулирующую (ИБФРМ РАН, г.Саратов) и антимикробную (СГМУ, г.Саратов) активности.
Установлено, что соединения 19,20,23,25,27,28,31,47–49,51,52 проявляют ингибирующую активность в отношении бактериофага кишечной группы Т4. Появление в молекуле енаминокетонного и особенно 2,4-динитрофенильного фрагментов приводит к усилению антифаговой активности. Так наибольшую активность показал 2,4-динитрофенилгидразон 6-гидрокси-6-метил-2-(3-нитрофенил)циклогексан-1,3-диэтилдикарбоксилата 52 – выживаемость бактериофага Т4 составила 5,5% к контролю. В ряду N,N–бисциклогексенилполиметилендиаминов 23,25,27,28,31 замена сложноэфирных заместителей на ацетильные приводит к росту антифаговой активности (выживаемость бактериофага Т4 31– 22%, 27– 12% к контролю).
N,N–Бисциклогексенилполиметилендиамины 29-31 являются стимуляторами роста бактериальных культур Pseudomonas aeruginosa 105b, Bacillus subtilis spp. и Escherichia coli K-12.
Соединения 47–49,51,52 в концентрации 100 мкг/мл проявляют слабую и среднюю антимикробную активность на бактериальные клетки грамотрицательной E.coli штамм М 17.
Выводы
- Осуществлен синтез ранее неизвестных ацетил(метоксикарбонил)замещенных циклогексанолонов. На примере 2,4-диацетил-5-гидрокси-5-метил-3-(2-метилфенил)циклогексанона с привлечением известных данных по кето-енольной таутомерии орто-R-фенилзамещенных оксосоединений указанного ряда, установлено, что наличие в орто-положении бензольного ядра метильного заместителя не способствует енолизации.
- Впервые изучены реакции поликарбонилзамещенных циклогексанолонов (3–Ar–2,4–диацетил–5–гидрокси–5–метилциклогексанонов и 2–Ar–4–гидрокси–4–метил–6–оксоциклогексан–1,3–диалкилдикарбоксилатов) с азотсодержащими полинуклеофильными реагентами и установлено, что в зависимости от природы реагента и условий, реакции протекают с участием одного либо двух нуклеофильных центров реагента как аминирование, спироциклизация, аминирование-дегидратация-декарбоксилирование и в иных направлениях.
- При использовании в качестве реагентов диаминов, отличающихся расстоянием между атомами азота (1,2; 1,4; 1,6; 1,8), нуклеофильной силой (алифатические, ароматические алициклические) реакции циклогексанолонов указанных рядов протекают как нуклеофильное замещение региоселективно по карбонильной группе алицикла, но в различных направлениях:
- под действием бензидина и 1,2-диаминоциклогексана как аминирование с участием одного нуклеофильного центра реагента с образованием N-бензидил(2-аминоциклогексил)циклогексениламинов;
- при использовании алифатических диаминов (этилен-, тетраметилен-, гексаметилендиамины) как аминирование с участием двух нуклеофильных центров реагентов с образованием N,N–бисциклогексенилполиметилендиаминов.
- Оксоциклогексан–1,3–диалкилдикарбоксилаты взаимодействуют с тиосемикарбазидом по карбонильной группе алицикла с образованием азаспиранов (в отсутствии катализатора), либо продуктов их дегидратации-декарбоксилирования (в присутствии СF3COOH).
- Реакции оксоциклогексан–1,3–диалкилдикарбоксилатов со слабыми нуклеофильными реагентами (тиомочевина, 2,4-динитрофенилгидразин) приводят к образованию продуктов енаминного (циклогексенилтиомочевины), иминного строения (гидразоны).
- Аминирование полизамещенных циклогексанолонов в условиях микроволновой активации позволяет значительно сократить время синтеза, исключить присутствие катализатора, увеличить выходы продуктов.
- Среди вновь синтезированных соединений, содержащих в своем составе фармакофорные фрагменты и группы, выявлены вещества, обладающие антифаговым, ростостимулирующим и антимикробным действием.
Основное содержание диссертации изложено в следующих работах:
.
- Щелочкова О.А., Сорокин В.В., Кривенько А.П. Реакции -циклокетолов с бензидином // Химия и компьютерное моделирование. Бутлеровские сообщения.-2003.-№1.-С.20-21.
- Щелочкова О.А., Григорьева Э.А., Кривенько А.П. Реакции поликарбонилзамещенных циклогексанолонов c тиосемикарбазидом // Изв. Высш. уч. зав. Химия и химическая технология.-2006.-Т.49, вып.11.-С.139-141.
- Щелочкова О.А., Баклан А.В. Взаимодействие 2,4–диацетил(диметоксикарбонил)–3R–5–гидрокси–5–метилциклогексанонов с бензидином // Сб. научн. статей молодых ученых, посв. 75-летию химического ф-та СГУ «Современные проблемы теоретической и экспериментальной химии». Саратов: «Научная книга».-2004.-С.88-90.
- Щелочкова О.А., Барабанов С.В. Реакции –циклогексанолонов с тиосемикарбазидом // Там же. Саратов.-2004.-С.91-94.
- Щелочкова О.А., Мышкина В.И. Синтез 2,4-диацетил-5-гидрокси-5-метил-3-фенилциклогексенилфениламина // Там же. Саратов.-2004.-С.95-97.
- Щелочкова О.А., Абрамов А. Ю. Синтез 3,6-дигидрокси-6-метил-4-фенил-5-этоксикарбонил-1-(2--хлорэтоксиэтил)-4,5,6,7-тетрагидроиндазола // Там же. Саратов.-2004.-С.85-87.
- Щелочкова О.А., Барабанов С., Кривенько А.П. Взаимодействие –циклогексанолонов с тиосемикарбазидом // Сб. научн. трудов «Карбонильные соединения в синтезе гетероциклов». Под ред. проф. А.П. Кривенько. Саратов: «Научная книга».-2004.-С.317-319.
- Щелочкова О.А., Сорокин В.В., Поплевина Н.В. Синтез 2,4-динитрофенилгидразонов полизамещенных –циклогексанолонов // Сб. научн. трудов Саратовского военного института РХБЗ. Саратов: СВИРРХБЗ.-2005.-С.59-61.
- Щелочкова О.А., Поплевина Н.В., Кривенько А.П. Полизамещенные –циклогексанолоны в синтезе 2,4-динитрофенилгидразонов // Сб. научн. трудов I Международного форума (VI Международной конференции молодых учёных и студентов) «Актуальные проблемы современной науки». Самара.-2005.-С.104-107.
- Поплевина Н.В., Скребцова Е.П., Щелочкова О.А. Синтез и строение 2,4-диацетил-5-гидрокси-5-метил-3-(2-метилфенил)циклогексанона.// Межвуз. сб. научн. трудов V Всероссийской конф. молодых ученых «Современные проблемы теоретической и экспериментальной химии». Саратов: «Научная книга».-2005.-С.88-89.
- Иноземцева О.А., Чукалина О.А. (Щелочкова О.А.), Сорокин В.В. Синтез полиароматических енаминокарбонильных соединений // Тези. докл. III Всерос. конф. молодых учёных «Современные проблемы теоретической и экспериментальной химии». Саратов: Изд-во Сарат. ун-та.-2001.-С.107.
- Щелочкова О.А. Полизамещенные циклогексанолоны в реакциях с диаминами ароматического ряда // Тез. докл. III Междунар. конф. молодых учёных и студентов «Актуальные проблемы современной науки». Самара.-2002.-С.95.
- Щелочкова О.А., Сорокин В.В. Реакции циклогексанолонов с полинуклеофильными реагентами // Тез. докл. IV Междунар. конф.и молодых учёных «Современные проблемы теоретической и экспериментальной химии». Саратов: «Юл».-2003.-С.129.
- Щелочкова О.А. Синтез новых полизамещенных циклогексанонов // Тез. докл. VII научной школы-конференции по органической химии. Екатеринбург.-2004.-С.202.
- Щелочкова О.А., Кривенько А.П. Cинтез гидразонов полизамещенных циклогексанолонов // Тез. докл. VIII Молодежной научной школы-конференции по органической химии. Казань.-2005.-С.95.
- Щелочкова О.А., Сорокин В.В. О направлениях реакций –циклогексанолонов с азотсодержащими нуклеофильными реагентами // Материалы конференции «Современные тенденции в органическом синтезе и проблемы химического образования». Санкт-Петербург.-2005.-С.258.
ЩЕЛОЧКОВА Оксана Анатольевна
Поликарбонилзамещенные циклогексанолоны в реакциях с полинуклеофильными реагентами
Автореферат
Ответственный за выпуск
д.х.н., профессор Клочкова И.Н.

