Синтез, особенности строения и свойства макрогетероциклических соединений на основе замещенных пирролинов
На правах рукописи
СТРЯПАН
Михаил Григорьевич
СИНТЕЗ, ОСОБЕННОСТИ СТРОЕНИЯ И СВОЙСТВА
МАКРОГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ НА ОСНОВЕ ЗАМЕЩЕННЫХ ПИРРОЛИНОВ
02.00.03 – органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Иваново 2009
Работа выполнена на кафедре технологии тонкого органического синтеза Государственного образовательного учреждения высшего профессионального образования «Ивановский государственный химико-технологический университет»
Научный руководитель: доктор химических наук, профессор
Исляйкин Михаил Константинович
Официальные оппоненты: доктор химических наук, профессор
Орлов Владимир Юрьевич
доктор химических наук, профессор
Мамардашвили Нугзар Жораевич
Ведущая организация: Институт физиологически активных веществ РАН, г.Черноголовка
Защита состоится «30» ноября 2009 г. в часов на заседании совета по защите докторских и кандидатских диссертаций Д 212.063.01 в ГОУВПО «Ивановский государственный химико-технологический университет» по адресу: 153000, г. Иваново, пр. Ф.Энгельса, д. 7.
С диссертацией и авторефератом можно ознакомиться в библиотеке ГОУВПО «Ивановский государственный химико-технологический университет» по адресу: 153000, г. Иваново, пр. Ф.Энгельса, д. 10.
Автореферат разослан «30» октября 2009 г.
Ученый секретарь Кувшинова Е.М.
диссертационного совета Д 212.063.01
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Макрогетероциклические соединения симметричного строения АВАВ-типа (Мс) являются структурными аналогами фталоцианина. Их молекулы содержат четыре последовательно чередующихся фрагмента: остатки ароматического диамина (А) и изоиндола (В), которые связаны между собой атомами азота. Отличительной особенностью этих соединений является способность формировать динамичную координационную полость, различающуюся размерами, пространственной конфигурацией, а также количеством и составом входящих в нее атомов, что, несомненно, важно с точки зрения получения веществ, обладающих практически ценными свойствами. Установлено, что замещенные Мс проявляют каталитические, жидкокристаллические, флуоресцентные и нелинейно-оптические свойства.
Вместе с тем Мс АВАВ-типа, содержащие пиразиновые фрагменты и шестичленные ароматические диамины, изучены в значительно меньшей степени, а макроциклы на основе малеонитрила или его замещенных к моменту постановки данной работы получены не были.
Макрогетероциклические соединения АВАВ-типа представляют также значительный теоретический интерес ввиду того, что они обладают многоконтурной системой сопряжения. Строение отдельных представителей Мс, содержащих изоиндольные фрагменты, было изучено с помощью рентгеноструктурного анализа и квантово-химических методов. Однако ароматичность различных контуров сопряжения, а также особенности электронного и пространственного строения макроциклов на основе малеонитрила и 2,3-дицианопиразина оставались неизученными.
Таким образом, синтез, исследование особенностей строения и физико-химических свойств Мс АВАВ–типа, содержащих в своем составе фрагменты пирролинов или пирролпиразинов, а также шестичленных ароматических диаминов, являются важной и актуальной задачей.
Цель работы: синтез, особенности строения и свойства макрогетероциклических соединений АВАВ-типа на основе замещенных пирролинов, содержащих в своем составе остатки шестичленных ароматических диаминов.
Для достижения поставленной цели в работе предполагалось решить следующие задачи:
- Синтезировать новые Мс АВАВ-типа на основе дифенилфумаронитрила, 5,6-диметил-, 5-метил-6-этил- и 5,6-диэтил-2,3-дицианопиразина, 5-трет-бутил-2,3-дицианопиразина, содержащих остатки ароматических диаминов: 2,6-диаминопиридина или м-фенилендиамина;
- Установить строение и изучить свойства полученных соединений с применением комплекса физико-химических методов: масс-спектрометрии, электронной, колебательной, 1Н ЯМР спектроскопии, элементного анализа;
- Изучить особенности пространственного и электронного строения молекул макрогетероциклических соединений АВАВ-типа и их сольватов с помощью квантово-химических методов высокого уровня (DFT B3LYP 6-31G(d,p), 6-31G+(d,p), cc-pVTZ);
- Оценить ароматичность различных контуров сопряжения в молекулах Мс с помощью критериев HOMA (Harmonic Oscillator Model of Aromaticity) и NICS (Nucleus-Independent Chemical Shifts), с применением TD DFT изучить ЭСП Мс.
Научная новизна. Впервые получены замещенные макрогетероциклические соединения АВАВ – типа на основе дифенилфумаронитрила, 5,6-диметил-,
5-метил-6-этил- и 5,6-диэтил-2,3-дицианопиразина, 5-трет-бутил-2,3-дицианопиразина.
С применением квантово-химических методов (DFT B3LYP, базисные наборы 6-31G(d,p) и 6-31G+(d,p); пакет программ PC GAMESS) изучено электронное и геометрическое строение пиррольных, изоиндольных и пирролпиразиновых макроциклов АВАВ-типа, а также сольватов дибензолдиизоиндолмакроцикла. Особенности строения таутомеров гемипорфиразина и его моногидрата изучены методом DFT B3LYP/cc-pVTZ. Впервые рассмотрена применимость геометрического НОМА и магнитного NICS критериев ароматичности для оценки различных контуров сопряжения макрогетероциклических соединений.
Научная и практическая значимость. Впервые получены макрогетероциклические соединения симметричного строения на основе дифенилфумаронитрила и алкил-2,3-дицианопиразинов.
С помощью квантово-химических методов на уровне теории функционала плотности получены данные о влиянии бензольного и пиразинового аннелирования на строение пиррольных макроциклов АВАВ-типа. Удовлетворительное совпадение геометрических параметров, рассчитанных для изоиндольных макроциклов, с литературными данными было использовано для подтверждения достоверности вычисленных характеристик для пиррол- и пирролпиразиновых Мс.
Показано, что геометрические параметры, полученные с помощью квантово-химических расчетов, могут быть использованы для объяснения свойств макроциклов, таких как структурная нежесткость, ароматичность, способность координировать молекулы растворителя, поглощать световую энергию и т.д. На основании изучения ароматичности различных контуров сопряжения показано, что магнитный критерии NICS удачно воспроизводит неароматичный характер Мс.
Личный вклад автора состоит в непосредственном участии на всех этапах работы – в постановке цели и задач работы, планировании и проведении экспериментов, квантово-химических расчетов, обсуждении полученных результатов.
Настоящая работа выполнена при частичной поддержке гранта Российского фонда фундаментальных исследований № 05-03-33003а.
Апробация работы. Материалы диссертационной работы докладывались и обсуждались на Международных конференциях: «V International Conference of Porphyrins and Phthalocyanines» (Москва, Россия, 2008г.); «10 Международной конференций по физической и координационной химии порфиринов и их аналогов» (Иваново, Россия, 2009г.); III и IV школах-семинарах «Квантово-химические расчеты: структура и реакционная способность органических и неорганических молекул» (г. Иваново, 2007 и 2009г.); «IV International Symposium on Computational Methods in Toxicology and Pharmacology Integrating Internet Resources» (Москва, Россия, 2007г.); XVI Российском национальном конгрессе «Человек и лекарство» (Москва, 2009г.); XXIX Научной сессии Российского семинара по химии порфиринов и их аналогов «Достижения и перспективы развития координационной химии порфиринов. Итоги 50-летних исследований» (Иваново, 2006г.); Всероссийской научной конференции «Природные макроциклические соединения и их синтетические аналоги» (Сыктывкар, 2007г.); Научной конференции фестиваля студентов, аспирантов и молодых ученых «Молодая наука в классическом университете» (Иваново, 2009г.).
Публикации. По материалам диссертации опубликовано 6 статей, в том числе 3 статьи в журналах, рекомендованных ВАК, и 3 статьи в виде материалов конференций, а также 7 тезисов докладов.
Объем и структура диссертации. Диссертация изложена на страницах машинописного текста и состоит из введения, литературного обзора, экспериментальной части, обсуждения результатов и выводов. Работа содержит схем, рисунков, таблиц, список литературы, включающий наименований.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении дано обоснование актуальности работы, сформулирована ее цель, отмечена научная новизна и практическая значимость.
1. Литературный обзор
В литературном обзоре рассмотрены методы получения замещенных малеонитрилов, 2,3-дицианопиразинов и Мс АВАВ-типа, а также перспективы их практического использования. Обсуждены опубликованные данные по изучению строения Мс с помощью РСА и методов квантовой химии. На основании анализа литературы сформулированы цель и основные задачи работы.
2. Экспериментальная часть
В этой части описаны методики синтеза исходных соединений, трехзвенных продуктов и макрогетероциклических соединений, а также способы их очистки.
Приведены результаты изучения строения полученных соединений с помощью ИК, электронной, 1Н ЯМР спектроскопии, масс-спектрометрии и элементного анализа, характеристики приборов, использованных для изучения строения и физико-химических свойств (элементный анализ, ИК, 1Н ЯМР и электронная спектроскопии, масс-спектрометрия, исследование растворимости), а также особенности проведения квантово-химических расчетов.
3. Обсуждение результатов
3.1. Синтез трехзвенных продуктов
На первом этапе было показано, что взаимодействием малео- и фенилмалеонитрила с ароматическими диаминами в условиях эксперимента получить Мс АВАВ-типа не удалось, что связано, по всей видимости, с легкостью образования соединений полимерного характера. Однако, используя
1,2-дизамещенные прекурсоры, например, дифенилмалеонитрил 1, конденсацией с м-фенилендиамином или 2,6-диаминопиридином в бутаноле были получены трехзвенные продукты 2 и 3 (схема 1).
Схема 1.
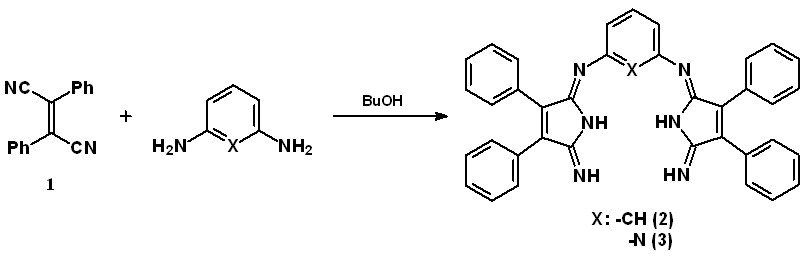
Строение 2, 3 было установлено с привлечением данных электронной- и ИК-спектроскопии, масс-спектрометрии и элементного анализа.
3.2. Синтез макрогетероциклических соединений
Макрогетероциклические соединения 8-17 получали конденсацией м-фенилендиамина или 2,6-диаминопиридина с продуктами взаимодействия дифенилфумаронитрила 1, 5,6-диметил-, 5-метил-6-этил-, и 5,6-диэтил-2,3-дицианопиразинов 4-6 или 5-трет-бутил-2,3-дицианопиразина 7 с алкоголятами натрия в смеси бутанол – метанол (схема 2).
Схема 2.
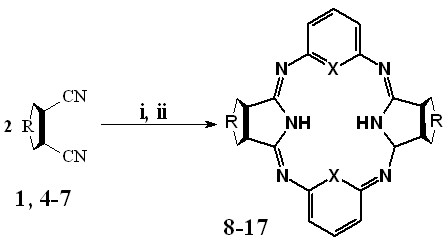 | R: | 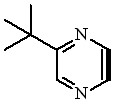 | |||||
| X: | CH | 1,8 | 4,10 | 5,12 | 6,14 | 7,16 | |
| N | 1,9 | 4,11 | 5,13 | 6,15 | 7,17 | ||
i - MeONa, BuONa, MeOH, BuOH;
ii - ароматический диамин, 6 часов (80 оС), 22 часа (Ткип).
Контроль за ходом реакции осуществлялся с помощью тонкослойной хроматографии, а окончание процесса фиксировалось по прекращению выделения аммиака. После отгонки растворителя сухие остатки подвергали комплексной очистке в зависимости от свойств соединений. Так, бензольные Мс 10, 12, 14 очищали экстракцией примесей органическими растворителями, в то время как для остальных макроциклов дополнительная очистка проводилась с использованием колоночной хроматографии.
Соединения охарактеризованы данными ИК, Н1 ЯМР и электронной спектроскопии, масс-спектрометрии, а также элементного анализа. Основные характеристики полученных соединений приведены в таблице 1.
Таблица 1. Характеристики соединений 7-16
| Мс | Выход, % | Данные элементного анализа найдено/вычислено, % | max, нм (lg ), СHCl3 | ИК-спектр, см-1 | ||
| С | Н | N | ||||
| 7 | 17 | 81.63 82.22 | 4.77 4.70 | 12.11 13.07 | 367 (4.08) | 3364, 1721, 1663, 1486, 1444, 694 |
| 8 | 11 | 77.13 78.24 | 4.50 4.38 | 17.01 17.38 | 391 (4.11) | 3345, 1716, 1637, 1485, 1443, 697 |
| 9 | 36 | 67.12 67.46 | 4.59 4.45 | 26.84 28.09 | 331 (3.62) | 3422, 2924, 2853, 1749, 1662, 1574, 1476, 1128, 995, 793 |
| 10 | 17 | 61.13 62.39 | 3.77 4.03 | 33.11 33.58 | 350 (3.78) | 3413, 2962, 2924, 1727, 1636, 1439, 973 |
| 11 | 22 | 67.42 68.43 | 4.94 4.98 | 26.03 26.60 | 333 (3.63) | 3423, 2923, 2853, 1658, 1518, 1456, 1000, 798 |
| 12 | 19 | 63.11 63.62 | 4.34 4.58 | 29.88 31.80 | 354 (3.80) | 3406, 2924, 1634, 1595, 1528, 1404, 1091, 803 |
| 13 | 35 | 68.94 69.30 | 5.73 5.45 | 24.34 25.25 | 334 (3.64) | 3415, 3059, 2928, 1656, 1577, 1442, 1051, 882 |
| 14 | 9 | 64.53 64.72 | 4.77 5.03 | 30.11 30.21 | 355 (3.81) | 3342, 2956, 2923, 2852, 1740, 1639, 1466, 1118, 803. |
| 15 | 26 | 68.51 69.30 | 5.34 5.45 | 25.17 25.25 | 361 (3.82) 383 (3.82) | 3324, 2922, 2852, 1636, 1464, 1254, 1157. |
| 16 | 9 | 64.41 64.72 | 4.89 5.03 | 29.63 30.21 | 379 (3.96) 425 (3.96) | 3327, 2927, 2856, 1746, 1640, 1465, 1250, 1165. |
Масс-спектры соединений 12-17 характеризуются присутствием пиков, соответствующих молекулярным ионам [М+Н]+. Совпадение молекулярных масс, а также характеристичных изотопных распределений молекулярных ионов с расчетными значениями, подтверждает строение этих соединений, как макроциклических систем АВАВ-типа.
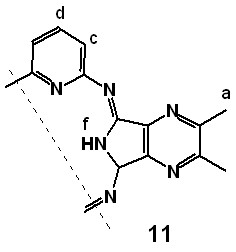
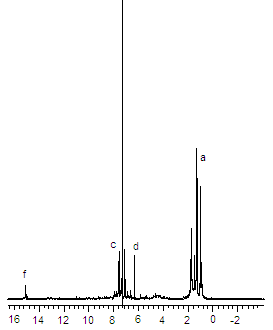
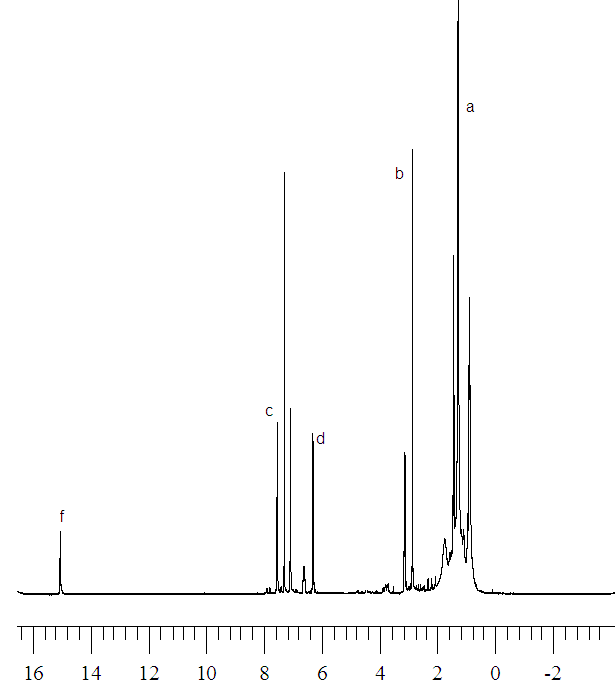
Спектры протонного магнитного резонанса 1Н ЯМР соединений имеют схожий характер (рис.1). Так, для диалкилзамещенных макроциклов 11 и 13 сигналы в районе 1.2-1.5 и 3.0-3.2 (для 13) м.д. соответствуют протонам этильной группы, а сигналы, обнаруженные в области 6.9-7.5 м.д., вызваны резонансом протонов пиридинового фрагмента макроцикла. Синглет, находящийся в слабом поле при 14.9 м.д., соответствует протонам циклических иминогрупп. Наличие сигнала в этой области указывает на неароматический характер полученных Мс.
Рис. 1. 1Н ЯМР соединений 11 и 13 (CDCl3)
  |  |
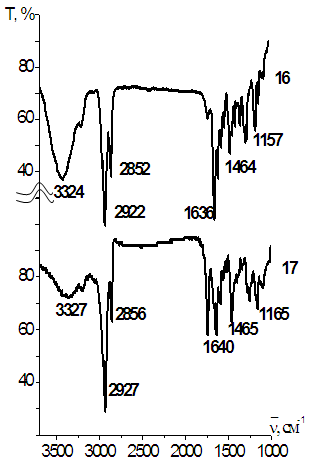
ИК-спектры синтезированных бензольных и пиридиновых макроциклов 8-17 содержат ряд идентичных полос поглощения. Так, в спектрах ди-трет-бутилзамещенных Мс 16 и 17 (рис. 2) отсутствует полоса поглощения группы CN исходного нитрила (~2230 см-1) и присутствуют полосы поглощения в области 3300-3400 см-1, вызванные валентными колебаниями N-H иминогрупп, а полосы в области 2850-2920 см-1 могут быть поставлены в соответствии валентным колебаниям связей С-Н трет-бутильных групп.
Рис.2. ИК спектр соединений 16,17
 |
В электронных спектрах синтезированных соединений (рис. 3) наблюдается длинноволновый сдвиг интенсивной полосы поглощения при переходе от бензольных 10, 12, 14 к пиридиновым 11, 13, 15 Мс.
Рис.3. ЭСП растворов соединений 10-15 в хлороформе
 | 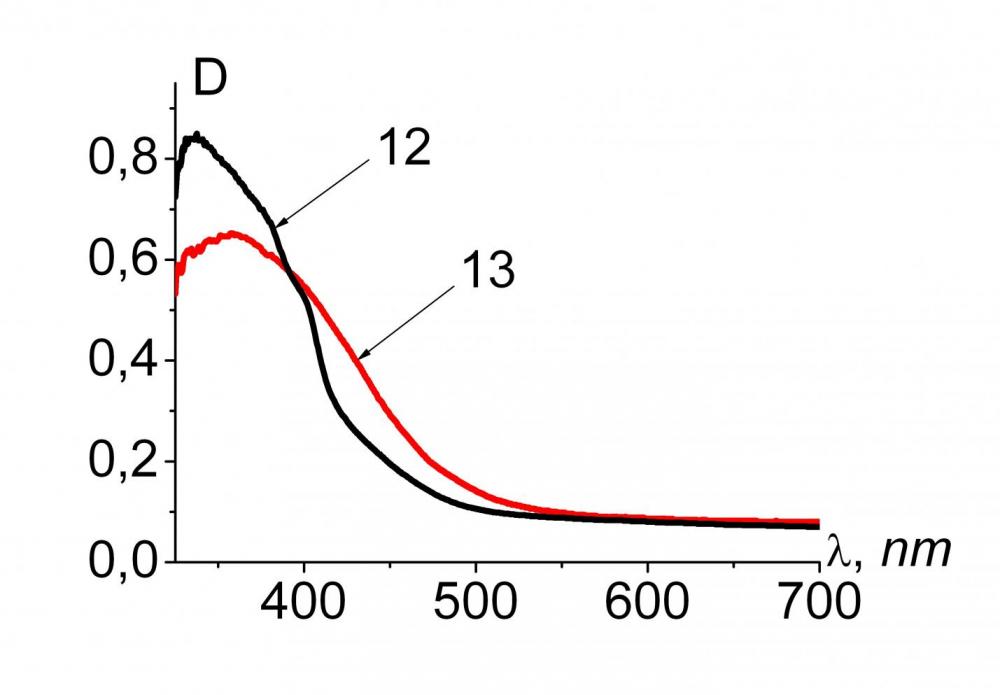 | 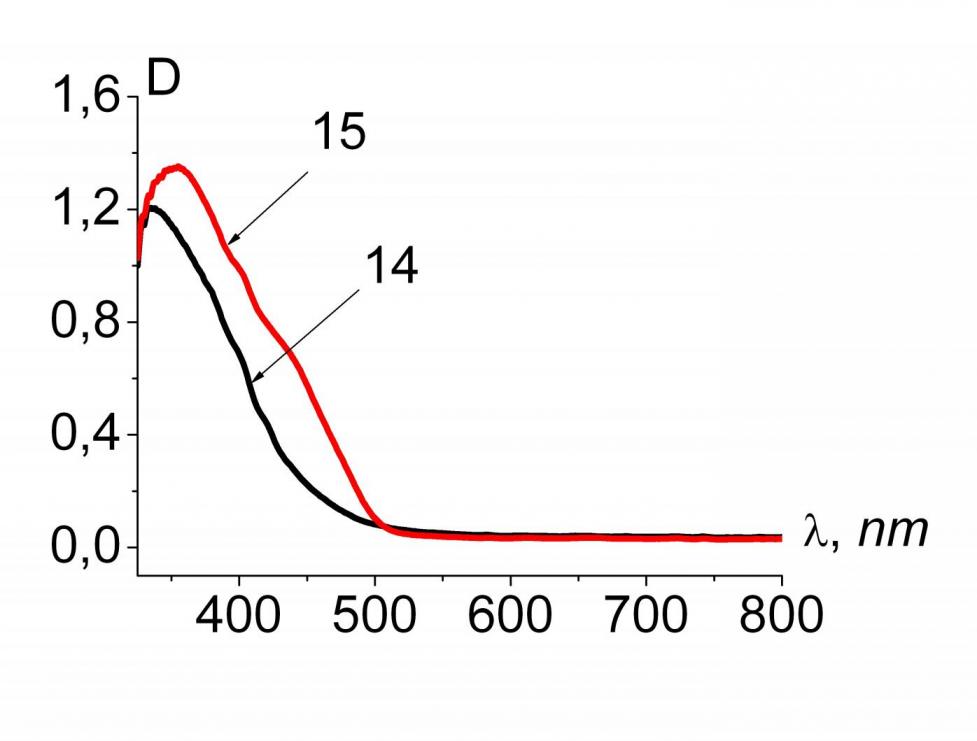 |
| C10=8.67*10-5 моль/л C11=8.14*10-5 моль/л | C12=6.11*10-5 моль/л C13=5.73*10-5 моль/л | C14=8.93*10-5 моль/л C15=9.25*10-5 моль/л |
Наблюдаемые сдвиги объясняются тем, что бензольные макроциклы за счет внутреннего напряжения в координационной полости, создаваемого атомами водорода пиррольных и бензольных фрагментов, имеют более искаженную по сравнению с пиридиновыми Мс конфигурацию, что подтверждается квантово-химическими расчетами.
3.3. Исследование растворимости макрогетероциклических соединений
Известно, что введением в молекулу различных заместителей можно увеличить растворимость макрогетероциклического соединения в органических растворителях, что существенно облегчает очистку и расширяет возможные области практического применения. Исследование растворимости (равновесной концентрации при 298 К) синтезированных макроциклов в хлороформе показало, что замена бензольного фрагмента на пиридиновый в Мс существенно увеличивает растворимость соединения (табл. 2). Показано, что с удлинением алкильной цепочки растворимость замещенных макроциклов в органическом растворителе повышается.
Таблица 2. Равновесная растворимость (S) алкилзамещенных Мс в хлороформе
| Соединение | S298К 103, |
| моль/л | |
| 12 (MeEt, Bz) | 0.063±0.006 |
| 13 (MeEt, Py) | 0.28±0.03 |
| 15 (2Et, Py) | 0.62±0.06 |
| 16 (t-Bu, Bz) | 0.18±0.02 |
| 17 (t-Bu, Py) | 1.12±0.11 |
Введение трет-бутильных группировок существенно увеличивают растворимость макроцикла. Так наибольшую растворимость имеет трет-бутильный пиридиновый макроцикл 17 (1.12*10-3 моль/л), в то время как метилэтилзамещенное соединение 12 имеет растворимость, равную 0.063*10-3 моль/л.
3.4. Особенности геометрического и электронного строения макрогетероциклических соединений
Для выявления зависимости “структура-свойство” в ряду макрогетероциклических соединений требуются надежные данные о строении молекул. Для получения таких характеристик, а также для оценки свойств Мс в последнее время успешно применяются квантово-химические методы, основанные на теории функционала плотности (DFT).
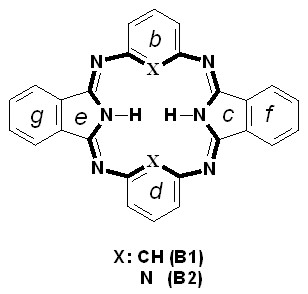
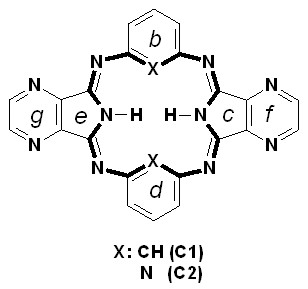
В качестве объектов исследовании были использованы пиррол- (А1, А2), изоиндол- (B1, B2) и пирролпиразинсодержащие (С1, С2) макроциклы:
Квантово-химические расчеты проводились методом DFT с использованием гибридного функционала B3LYP и базисных наборов 6-31G(d,p) и 6-31G+(d,p) (пакет программ РС GAMESS). Расчеты выполнялись с полной оптимизацией геометрических параметров. Оптимизированные конфигурации далее проверялись на соответствие критическим точкам поверхности потенциальной энергии.
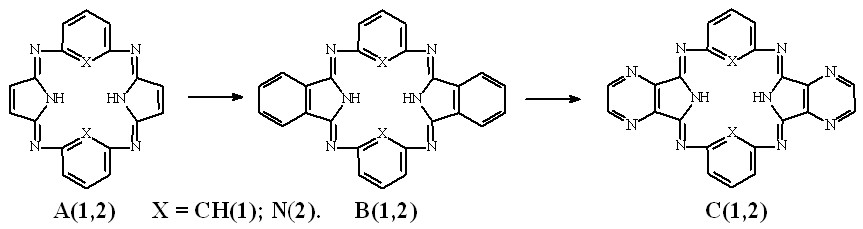
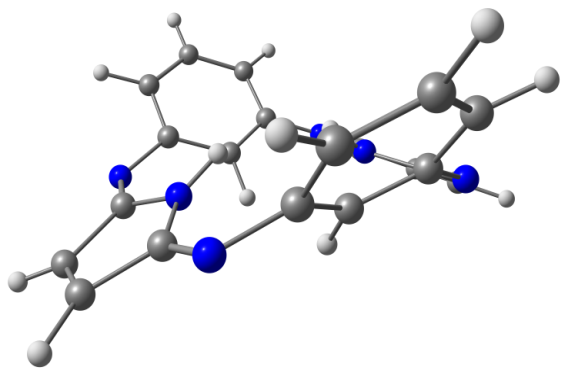
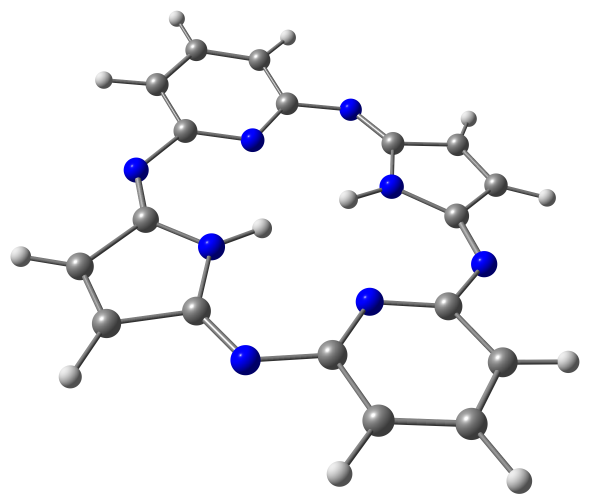
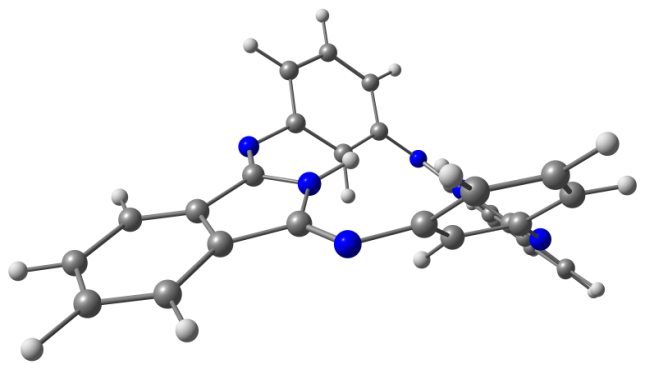
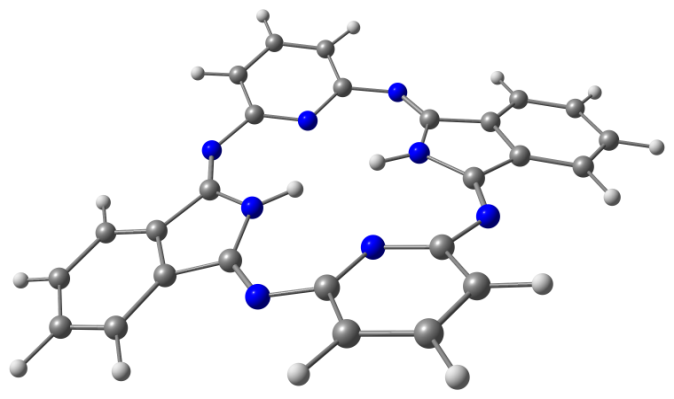
Модели оптимизированных молекул представлены на рисунке 4.
Рис. 4. Модели оптимизированных молекул A(1, 2), В(1, 2) и С(1, 2)
 |  |
 |  |
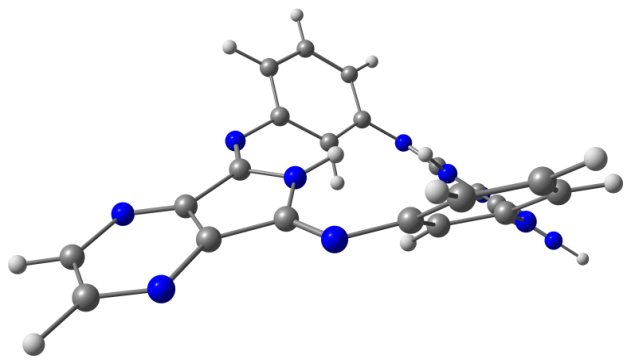 | 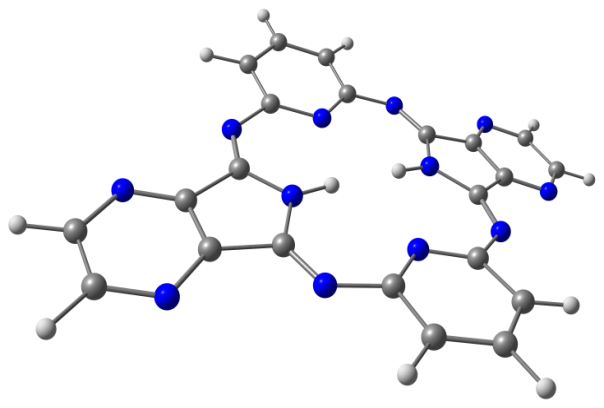 |
Результаты квантово-химических расчетов показали, что исследуемые макроциклы имеют неплоскостное строение симметрии С2v. Фрагменты молекул вследствие существенного отталкивания атомов водорода, расположенных внутри координационной полости, отклоняются от средней плоскости макроцикла в противоположные стороны (таблица 3).
Таблица 3. Углы между фрагментами Мс и плоскостью, задаваемой
экзоциклическими атомами азота, град
| Фрагмент | Оптимизированная конфигурация | |||||
| A1 | A2 | B1 | B2 | C1 | C2 | |
| Пиррольный | 29.6 | 7.0 | - | - | - | - |
| Изоиндольный | - | - | 26.4 | 15.4 | - | - |
| Пирролпиразиновый | - | - | - | - | 25.2 | 2.8 |
| Бензольный | 49.0 | - | 48.0 | - | 40.9 | - |
| Пиридиновый | - | 9.1 | - | 9.3 | - | 4.8 |
Как следует из данных, приведенных в таблице 3, для бензольных макроциклов характерно более существенное нарушение копланарности по сравнению с пиридиновыми, что связано с напряжениями в координационной полости, создаваемыми четырьмя атомами водорода иминогрупп и фенилена. Ввиду этого данные макроциклы принимают форму “седла”. Наибольшее отклонение пиррольных фрагментов от средней плоскости молекулы в ряду бензольных Мс наблюдается в случае соединения А1.
Макрогетероциклы являются соединениями с многоконтурными системами сопряжения. Длины связей, найденные методом DFT для оптимизированных конфигурации А-С, послужили основанием для оценки ароматичности различных контуров сопряжения с использованием геометрического критерия HOMA и его составляющих: EN и GEO (таблица 4).
Таблица 4. Критерии EN, GEO, HOMA для структур A-C
 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Как следует из таблицы 4, рассматриваемые молекулы характеризуются довольно высоким индексом общей ароматичности (НОМА = 0.62![]() 0.69), однако меньшим, чем в случае фталоцианина (НОМА = 0.77). Отметим, что для пиридиновых макроциклов A2, B2 и C2 величины HOMA, рассчитанные для внутреннего макрокольца молекул, на 0.09 единицы выше, чем в случае бензольных соединений А1, B1 и C1, что является следствием более уплощенной структуры пиридиновых Мс. Следует отметить, что бензольные и пиридиновые ядра макроциклов (НОМА=0.94 единицы) практически сохраняют ароматичность, рассчитанную для изолированных молекул бензола и пиридина и, тем самым, вносят значительный вклад в индекс, характеризующий общую ароматичность. Несмотря на достаточно высокое значение индекса общей ароматичности, данные Мс по сравнению с фталоцианином содержат низко сопряженный внутренний макроцикл (0.66-0.69 для бензольных А1, В1, С1 и 0.75-0.79 для пиридиновых A2, В2, С2 против 0.93 для PcH2).
0.69), однако меньшим, чем в случае фталоцианина (НОМА = 0.77). Отметим, что для пиридиновых макроциклов A2, B2 и C2 величины HOMA, рассчитанные для внутреннего макрокольца молекул, на 0.09 единицы выше, чем в случае бензольных соединений А1, B1 и C1, что является следствием более уплощенной структуры пиридиновых Мс. Следует отметить, что бензольные и пиридиновые ядра макроциклов (НОМА=0.94 единицы) практически сохраняют ароматичность, рассчитанную для изолированных молекул бензола и пиридина и, тем самым, вносят значительный вклад в индекс, характеризующий общую ароматичность. Несмотря на достаточно высокое значение индекса общей ароматичности, данные Мс по сравнению с фталоцианином содержат низко сопряженный внутренний макроцикл (0.66-0.69 для бензольных А1, В1, С1 и 0.75-0.79 для пиридиновых A2, В2, С2 против 0.93 для PcH2).
Анализ ароматичности-неароматичности макроциклов был проведен также с помощью критерия NICS, основанного на магнитных свойствах молекул (Табл. 5).
Таблица 5. Значения критерия NICS (м.д.), рассчитанные для
оптимизированных молекул
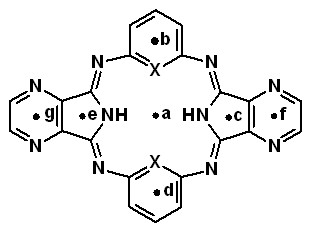 X: CH (C1); N (C2) X: CH (C1); N (C2) | Центр | A1 | A2 | B1 | B2 | C1 | C2 |
| a | +0.97 | +4.13 | +1.06 | +2.91 | +1.15 | +4.05 | |
| b,d | -8.72 | -4.58 | -8.77 | -5.56 | -8.54 | -5.0 | |
| c,e | -1.96 | -1,05 | -0.63 | +0.25 | +0.46 | +0.97 | |
| f,g | - | - | -8.95 | -8.60 | -5.63 | -5.29 |
Как видно из таблицы 5, положительные значения критерия в центре молекул, а именно в точке а, указывают на неароматический характер исследуемых макроциклов в целом.
Представляет интересным оценить влияние различных факторов, например, сольватации и таутомерии, на строение и свойства Мс.
Методом DFT B3LYP в базисе 6-31G(d,p) с полной оптимизацией геометрических параметров определено строение сольватов с одной и двумя молекулами ДМФА симметричного бензольного макроцикла. Показано, что в результате комплексообразования наблюдается увеличение угла вывода циклических фрагментов из плоскости, задаваемой экзоциклическими атомами азота, что находится в согласии с данными РСА. Расчет критериев HOMA и NICS показал, что геометрические деформации остова Мс не оказывают существенного влияния на ароматичность-неароматичность различных контуров сопряжения, что подтверждается совпадением значений этих индексов с соответствующими характеристиками, вычисленными для В1.
Влияние таутомерии на строение Мс изучено на примере гемипорфиразина В2 с использованием метода DFT B3LYP/cc-pVTZ. Отмечено, что значения углов вывода фрагментов из средней плоскости для таутомеров B2 и B3 приблизительно равны и составляют 18.1/15.2 град для пиридиновых и 12.7/13.6 град для изоиндольных фрагментов соединений В2/В3 соответственно, в то время как значения критериев НОМА и NICS для каждого из таутомеров заметно отличаются. Так, индекс HOMA, вычисленный для внутреннего 16-членного цикла В3, составляет 0.901, а для В2 0.765. В то же время 20-членный контур сопряжения в таутомере В3 характеризуется НОМА, равным 0.800. Учитывая то, что последний контур содержит 20 -электронов и является антиароматичным, предсказание высокой ароматичности с помощью критерия НОМА противоречит наблюдаемым фактам. Таким образом, критерий НОМА неверно описывает антиароматический характер Мс В3.
 |
|
В то же время критерии NICS, рассчитанный для центра молекулы, равен +5.50 м.д. и правильно отражает антиароматичный характер соединения В3. Отметим, что пиридиновые кольца Мс В3 (NICS=+0.09 м.д.), в отличие от В2 (NICS=-5.56 м.д.), полностью утрачивают ароматичность, что также может рассматриваться как подтверждение образования антиароматичной системы. Таким образом, критерий NICS адекватно передает неароматичный характер рассматриваемых соединений по сравнению с критерием HOMA.
Для отнесения полос в электронных спектрах поглощения проведен расчет теоретических спектров поглощения пиррольных макроциклов А1 и А2 с применением TD DFT. Показано, что электронный переход с ВЗМО на НСМО запрещен правилами отбора, а первые синглет-синглетные электронные переходы осуществляются с ВЗМО на НСМО+1 и соответствуют максимумам поглощения при 404 и 418 нм. Виды молекулярных орбиталей представлены в таблице 6.
Таблица 6. ВЗМО и НСМО+1 соединений А1 и А2
| ВЗМО | НСМО+1 | |
| А1 (=404 нм, 1B1) | 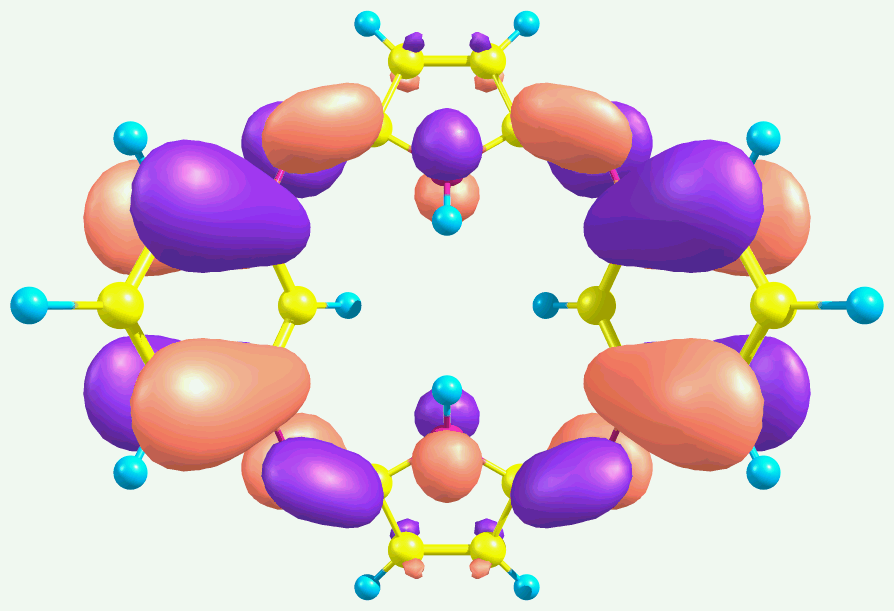 | 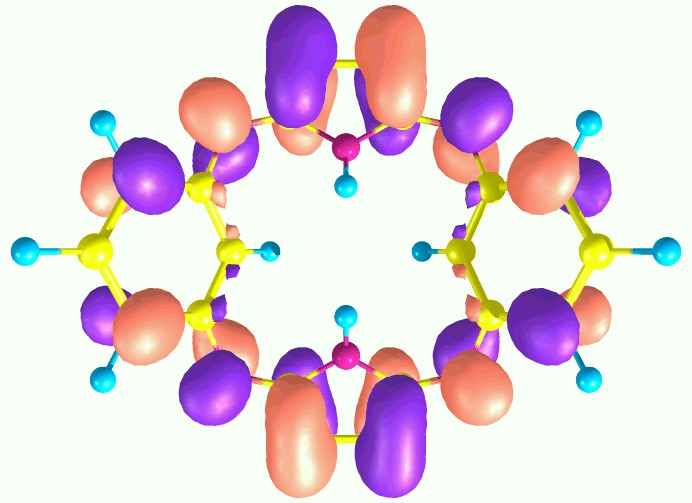 |
| А2 (=418 нм, 1A) |  | 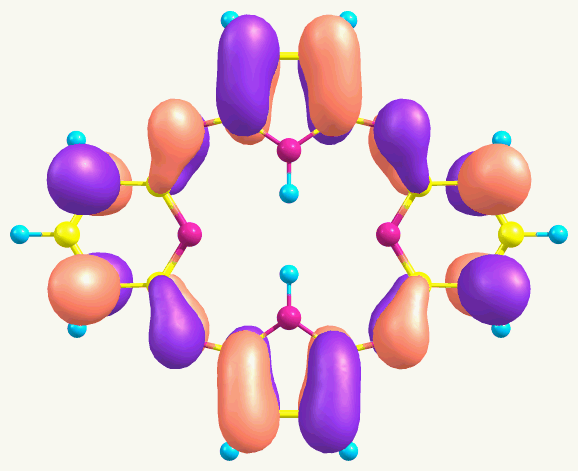 |
Как следует из рисунков, приведенных в таблице 6, ВЗМО состоят в основном из рz-орбиталей атомов углерода бензольных (пиридиновых) фрагментов и мезо-атомов азота, в то время как НСМО+1 – главным образом из рz-орбиталей атомов углерода пиррольных остатков и мезо-атомов азота.
Основные результаты и выводы
- Взаимодействием дифенилфумаронитрила с м-фенилендиамином или с 2,6-диаминопиридином в бутаноле впервые были синтезированы трехзвенные продукты: N1,N3-бис(1,5-дигидро-5-имино-3,4-дифенил-2H-пиррол-2-илиден) и N1,N3-бис(1,5-дигидро-5-имино-3,4-дифенил-2H-пиррол-2-илиден);
- Конденсацией м-фенилендиамина или 2,6-диаминопиридина с продуктами взаимодействия дифенилфумаронитрила, 5,6-диметил-, 5-метил-6-этил-, и 5,6-диэтил-2,3-дицианопиразина с алкоголятами натрия в смеси бутанол – метанол впервые получены фенил- и алкилзамещенные макрогетероциклические соединения АВАВ-типа. Взаимодействием 5-трет-бутил-2,3-дицианопиразина и м-фенилендиамина или 2,6-диаминопиридина в среде кипящего бутанола впервые получены трет-бутилпирролпиразиновые макрогетероциклические соединения;
- Очистка синтезированных соединений осуществлялась с использованием промывки органическими растворителями, экстракции и колоночной хроматографии. Строение продуктов установлено на основании данных элементного анализа, ИК, 1Н ЯМР, электронной спектроскопии, а также масс-спектрометрии;
- На количественном уровне определена растворимость в хлороформе макрогетероциклических соединений, полученных на основе алкилзамещенных 2,3-дицианопиразинов. Показано, что замена бензольного фрагмента пиридиновым существенно увеличивает растворимость Мс;
- С применением квантово-химических методов (DFT B3LYP, базисные наборы 6-31G(d, p) и 6-31G+(d, p), PC GAMESS) изучено геометрическое строение пиррольных, изоиндольных и пирролпиразиновых макрогетероциклических соединений АВАВ-типа, содержащих бензольные или пиридиновые фрагменты, а также моно- и дисольвата симметричного бензолизоиндольного макроцикла с ДМФА. Выявлено влияние бензольного и пиразинового аннелирования на геометрическое строение пиррольных Мс;
- Строение таутомеров гемипорфиразина, а также его моногидрата изучено методом DFT B3LYP/cc-pVTZ. Показано, что геометрические характеристики, полученные в ходе квантово-химических расчетов для сольватов гемипорфиразина и его бензольного аналога, хорошо согласуются с данными, полученными с помощью рентгеноструктурного анализа. ЭСП Мс изучены с помощью TD DFT. Показано, что максимумы поглощения пиридиновых макроциклов находятся в более длинноволновой области по сравнению с бензольными, что соответствует экспериментальным данным;
- Ароматичность и неароматичность макрогетероциклических соединений, а также влияние сольватации и таутомерии на эти свойства исследовано с помощью геометрического НОМА и магнитного NICS критериев. Показано, что критерий NICS адекватно передает неароматический характер Мс.
Основное содержание работы изложено в следующих публикациях:
- Стряпан М.Г., Исляйкин М.К. Особенности строения симметричного бензольного макрогетероциклического соединения по данным метода DFT / Изв. вузов. Химия и хим. технология. - 2008. - Т.51. Вып. 6. - С.11-15.
- Zaharov A.V., Stryapan M.G., Islyaikin M.K. Structure, electronic and vibrational spectra and aromaticity of hemiporphyrazine and its hydrates: a density functional theory study / J. Mol. Struct.: Theochem. - 2009. – V. 906, P.56-62.
- Стряпан М.Г., Исляйкин М.К. Синтез и свойства макрогетероциклических соединений АВАВ-типа с диэтилпиразиновыми фрагментами / Изв. вузов. Химия и хим. технология. - 2009. - Т.52. - Вып. 9. - С.77-80.
- Стряпан М.Г., Исляйкин М.К. Особенности пространственного и электронного строения дибензолдипиррол(диизоиндол)макроциклов по данным метода DFT / В сборнике трудов III школы-семинара “Квантово-химические расчеты: структура и реакционная способность органических и неорганических молекул”. Иваново. Март 2007. - С.199-203. ISBN 5-7807-0609-3.
- Mikhail Stryapan, Mikhail Islyaikin. Synthesis and structure peculiarities of hemiporphyrazines with substituted pyrrole subunits and their characterization by DFT method / J. Porphyrins and Phthalocyanines. 2008. - V.12. - №3-6. - P.553.
- Стряпан М.Г., Захаров А.В., Исляйкин М.К. Особенности пространственного и электронного строения макрогетероциклических соединений АВАВ-типа по данным метода DFT / В сборнике трудов IV школы-семинара “Квантово-химические расчеты: структура и реакционная способность органических и неорганических молекул”. Иваново. Май 2009. – С.53-57. ISBN 5-9616-0298-2.
- Исляйкин М.К., Стряпан М.Г. Изучение строения дибензолдиизоиндолмакроцикла и его сольватов с ДМФА / В сборнике трудов XXIX научной сессии Российского семинара по химии порфиринов и их аналогов “Достижения и перспективы развития координационной химии порфиринов. Итоги 50-летних исследований”. Иваново. Декабрь 2006. - C.56-58.
- Захаров А.В., Исляйкин М.К., Стряпан М.Г., Гиричев Г.В. Исследование строения молекулы гемипорфиразина с помощью квантовохимических расчетов / В сборнике трудов XXIX научной сессии Российского семинара по химии порфиринов и их аналогов “Достижения и перспективы развития координационной химии порфиринов. Итоги 50-летних исследований”. Иваново. Декабрь 2006. - C.51-52.
- Стряпан М.Г., Исляйкин М.К. Особенности строения пиррольного и изоиндольного дибензолмакроциклов по данным метода DFT / В сборнике тезисов докладов Всероссийской научной конференции “Природные макроциклические соединения и их синтетические аналоги”. Сыктывкар. Апрель 2007. - С.104-105.
- Stryapan M., Islyaikin M. Electron and spatial structure peculiarities of macroheterocyclic compounds / Abstract IV International Symposium on Computational Methods in Toxicology and Pharmacology Integrating Internet Resources. Moscow. September 2007. - P.156.
- Стряпан М.Г., Исляйкин М.К. Особенности пространственного и электронного строения макрогетероциклических соединений АВАВ-типа / В сборнике тезисов докладов XVI Российского национального конгресса “Человек и лекарство”. Москва. Апрель 2009. – С.559-560.
- Стряпан М.Г., Журавлева О.К. Синтез макрогетероциклических соединений на основе 5-трет-бутил-2,3-дицианопиразина / Тезисы докладов научной конференции фестиваля студентов, аспирантов и молодых ученых “Молодая наука в классическом университете”. Иваново. Апрель 2009. – С.43-44.
- Стряпан М.Г., Исляйкин М.К. Синтез азааналогов гемипорфиразина и особенности их строения по данным метода DFT / Тезисы докладов 10 Международной конференций по физической и координационной химии порфиринов и их аналогов (ICPC-10). Иваново. Июль 2009. – С.73-74.
Ответственный за выпуск Стряпан М.Г.
Подписано в печать _______2009 г. Усл. п. л. ____ Уч. изд. л. ____
Формат 6084 1/16. Тираж 80 экз. Заказ
Государственное образовательное учреждение высшего профессионального
образование «Ивановский государственный химико-технологический
университет». 153000 г. Иваново, пр-т Ф. Энгельса, 7.
Отпечатано на полиграфическом оборудовании кафедры экономики
и финансов ГОУ ВПО «ИГХТУ»