Парамагнитные интермедиаты в электрохимических реакциях и процессах деградации полимерных мембран топливных элементов
На правах рукописи
Кадиров Марсил Кахирович
Парамагнитные интермедиаты
в электрохимических реакциях и процессах деградации полимерных мембран топливных элементов
02.00.04 - Физическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора химических наук
Казань 2012
Работа выполнена в Федеральном государственном бюджетном учреждении науки Институте органической и физической химии им. А.Е. Арбузова
Казанского научного центра Российской академии наук
| Официальные оппоненты: Федюшкин Игорь Леонидович, д.х.н., чл.-корр. РАН, заведующий лабораторией органических производных непереходных металлов Федерального государственного бюджетного учреждения науки Института металлоорганической химии им. Г.А. Разуваева Российской академии наук, г. Нижний Новгород; Аганов Альберт Вартанович, д.х.н., профессор, директор Института физики Казанского (Приволжского) федерального университета, г. Казань; Таланов Юрий Иванович, д.ф.-м.н., ведущий научный сотрудник лаборатории физики перспективных материалов Федерального государственного бюджетного учреждения науки Казанского физико-технического института им. Е.К. Завойского Казанского научного центра Российской академии наук, г. Казань. | |
| Ведущая организация: Московский государственный университет им. М.В. Ломоносова, Химический факультет, г. Москва. | |
| Защита диссертации состоится 13 июня 2012 г. в 14:30 на заседании диссертационного совета Д 022.005.02 при Федеральном государственном бюджетном учреждении науки Институте органической и физической химии им. А.Е. Арбузова Казанского научного центра Российской академии наук по адресу: г. Казань, ул. ак. Арбузова, д.8, большой конференц-зал. С диссертацией можно ознакомиться в научной библиотеке Федерального государственного бюджетного учреждения науки Института органической и физической химии им. А.Е. Арбузова Казанского научного центра Российской академии наук. Отзывы на автореферат (в 2-х экз.) просим направлять по адресу: 420088, г. Казань, ул. ак. Арбузова, д. 8, ИОФХ им. А.Е. Арбузова КазНЦ РАН Автореферат разослан “____” мая 2012 г. Ученый секретарь диссертационного Совета, кандидат химических наук А.В. Торопчина |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Ограниченность запасов ископаемого топлива и глобальные экологические проблемы, связанные с его использованием, обусловили огромный интерес к использованию водорода - самого энергоемкого и экологичного топлива - в качестве универсального энергоносителя для стационарных и мобильных энергоустановок. Выступить с успехом в роли таких энергоустановок могут твердополимерные топливные элементы - экономичные и высокоэкологичные электрохимические источники тока. Но недолговечность применяемых дорогих катализаторов и полимерных электролитов, обусловленная действием образующихся активных радикальных частиц на аноде и катоде в жестких условиях работы топливного элемента, в значительной степени ограничивает развитие и внедрение водородной энергетики. В то же время эти свободные радикалы обладают парамагнетизмом, свойством, позволяющим осуществить их мониторинг методом электронного парамагнитного резонанса (ЭПР), что немаловажно для исследования условий их образования с целью создания модифицированных полимерных мембран и эффективного электрохимического окисления применяемого топлива. Высокая чувствительность метода и специфичность спектров ЭПР обеспечивают надежность результатов и при небольших концентрациях парамагнитных интермедиатов.
В последние годы зародилось и развивается новое направление в науке, связанное с созданием и конструированием перспективных магнитных материалов – молекулярных магнетиков. Парамагнитные частицы в этих системах являются не только интермедиатами в процессе синтеза, но и составной частью конечного продукта. Установление окислительно-восстановительных характеристик и магнитно-резонансных параметров исходных реагентов, их окисленных или восстановленных форм также требуют применения методов электрохимического анализа изучаемых систем с одновременной регистрацией сигналов ЭПР.
Однако имеются существенные преграды на пути исследования гетерогенных систем из жидкого или полимерного электролита и металлического электрода, связанные с проблемами настройки спектрометра ЭПР в связи с искажением силовых линий стоячих электромагнитных волн в резонаторе спектрометра из-за введения металлических образцов. Преодоление указанных проблем, развитие методов исследования гомогенных, гетерогенных и наноструктурированных систем с применением электронного парамагнитного резонанса и выяснение роли парамагнитных интермедиатов в изучаемых процессах позволяют решать актуальные задачи в области альтернативной энергетики, такие как механизмы распада топлива и деградации мембран, а также в создании новых полимерных композиций и перспективных магнитных материалов.
Целью настоящей работы является развитие и приложение методов исследования парамагнитных интермедиатов в гомогенных, гетерогенных и наноструктурированных системах для выяснения механизмов деградации полимерных мембран в топливных элементах и для создания новых функциональных материалов.
Научная новизна. Впервые выяснены детали восстановления и окисления цвиттер-иона - 4,4,5,5-тетраметил-2-оксоимидазолидин-3-оксид-1-олата и его анион-радикала в апротонных растворителях и предложены механизмы электрохимического и химического образования парамагнитных солей анион-радикала цвиттер-иона, интересных с точки зрения создания молекулярных магнетиков.
Впервые получены и идентифицированы анион-радикалы 2,6-диметиламинохлоранила и 2,6-диметиламиноброманила и катион-радикал 2-диметиламинометилфенола.
Впервые доказано, что основная часть генерированных в результате фотоионизации фенотиазина свободных электронов в жидких мицеллярных растворах анион-активных поверхностно-активных веществ (ПАВ) расходуется на восстановление молекулярного кислорода, растворенного в водной объемной фазе.
Сконструирован топливный элемент, приспособленный для работы в резонаторе спектрометра ЭПР, с возможностью параллельной записи поляризационных кривых и спектров ЭПР спин-аддуктов, позволяющий регистрировать интермедиаты электроокисления топлива и связать механизм распада топлива с эффективностью топливного элемента.
Впервые зарегистрированы и идентифицированы алкильные радикалы в боковой цепи перфторированных сульфокатионитовых иономеров и открыт механизм деградации по их боковой цепи.
Практическая значимость. Создан программно-аппаратный комплекс электрохимии-ЭПР со спиральной трехэлектродной ячейкой для исследования короткоживущих парамагнитных частиц, позволяющий получать качественную и количественную информацию о гетерогенном переносе электрона и последующих химических превращениях на основе четырех переменных, зависящих от времени, – тока, потенциала, интенсивности сигнала ЭПР и первой производной интенсивности сигнала ЭПР.
Созданный метод циклической вольтамперометрии, детектируемой электронным парамагнитным резонансом (ЦВА ДЭПР), является изящным инструментом для исследования сложных молекулярных систем с несколькими парамагнитными центрами и многостадийными переносами электрона.
Экспериментально определенные параметры редокс-процессов и спектров ЭПР широкой группы впервые синтезированных нитронил- и иминонитроксилов позволят идентифицировать их в ходе электрохимических и последующих химических превращений.
Установленные в ходе выполнения работы основные принципы электрохимического и химического синтеза различных парамагнитных солей цвиттер-иона 4,4,5,5-тетраметил-2-оксоимидазолидин-3-оксид-1-олата позволят получить ряд многоспиновых комплексных соединений, интересных с точки зрения создания молекулярных магнетиков.
Прямое доказательство образования специфичных радикальных фрагментов в боковой цепи перфторированных сульфокатионитовых иономеров и разработка способа исследования деградации мембран по боковым цепям методом ЭПР найдут широкое применение в работах по стабилизации полиэлектролитов и улучшению производственных характеристик топливных элементов на основе полимерных электролитов.
Результаты, полученные в рамках данной диссертационной работы, и сформулированные на их основе выводы, являются новым крупным научным достижением в физической химии, которое заключается в развитии и приложении методов исследования парамагнитных интермедиатов в гомогенных, гетерогенных и наноструктурированных системах для выяснения механизмов деградации полимерных мембран в топливных элементах и создания новых функциональных материалов.
Личный вклад автора. Результаты экспериментальных исследований и расчетов, включенных в работу, получены автором лично или при его непосредственном участии. Соискатель самостоятельно провел анализ литературы, поставил проблемы диссертации, выбрал объекты и методы исследования, обсудил и обобщил результаты диссертационной работы и сформулировал выводы. Руководил исследованиями студентов Казанского федерального университета и аспирантов Института органической и физической химии им. А.Е. Арбузова Казанского научного центра РАН. В ходе выполнения данной работы под научным руководством автора была подготовлена и успешно защищена К.В. Холиным диссертация на соискание ученой степени кандидата химических наук.
Апробация работы. Материалы диссертации докладывались и обсуждались на Международной конференции по каучуку, Москва, 1994; International Conference “Nanostructures and self-assemblies in polymer systems”, St.-Peterburg – Moscow, 1995; International Rubber Conference, Kobe (Japan), 1995; International Conference “Electron Spin Resonance in Electron Transfer and Organic Solids”, Dresden (Germany), 1995; III, VIII и XIV Всероссийских конференциях «Структура и динамика молекулярных систем», Й.-Ола, Казань, Москва, 1996, 2001 и 2007 гг.; IV-ой конференции по интенсификации нефтехимических процессов «Нефтехимия-96», Нижнекамск, 1996; III International Conference. Fundamental Problems of Physics, Kazan, 2005, 1st Russian-Japanese Workshop “Open Shell Compounds and Molecular Spin Devices”, Novosibirsk, 2007, IV Международной конференции «Высокоспиновые молекулы и молекулярные магнетики», Екатеринбург, 2008 г.; V Научно-практической конференции «НАНОТЕХНОЛОГИИ – ПРОИЗВОДСТВУ 2008», Фрязино, 2008 г., VI Всероссийской конференции по химии полиядерных соединений и кластеров, Казань, 2009 г., Международном конгрессе по органической химии, Казань, 2011 г. и итоговых научных конференциях Казанского научного центра Российской академии наук и Казанского национального исследовательского технологического университета.
Публикации. Основное содержание работы изложено в 27 публикациях, среди них 19 статей, опубликованных в 12 отечественных и 7 международных рецензируемых научных журналах, рекомендованных ВАК РФ; приоритетность разработок подтверждена 7 патентами. По материалам диссертации также опубликованы тезисы 15 устных докладов на 6 международных и 9 Всероссийских конференциях.
Объем и структура работы. Диссертационная работа изложена на 251 странице, содержит 15 таблиц, 112 рисунков, 252 библиографической ссылки. Диссертация состоит из введения, литературного обзора (глава 1), экспериментальной части (глава 2), обсуждения результатов (главы 3-5), основных результатов и выводов, списка использованных источников и списка сокращений.
Основное содержание работы
В литературном обзоре (глава 1) рассмотрены основные положения электронного парамагнитного резонанса и теории топливных элементов, методы, возможности и ограничения спектроскопии ЭПР в исследованиях интермедиатов в топливных элементах и некоторых перспективных полимерных материалах, критически проанализированы данные по электрохимическому генерированию парамагнитных частиц, одновременной регистрации электрохимических характеристик и сигнала ЭПР, деградации полимерно-электролитных мембран в твердополимерных топливных элементах.
В главе 2, именуемой «Экспериментальная часть, новые технические устройства и методы», в разделе «2.1. Постановка задачи, объекты исследования, оборудование, симуляция спектров ЭПР» обоснован выбор объектов исследования, перечислены применяемая научно-исследовательская аппаратура и использованные программы для симуляции спектров ЭПР.
В главе 2 рассмотрены также технические устройства, которые позволили получить принципиально новую информацию по теме, заявленной в названии диссертации.
Прежде всего, это - конструкции ячеек электрохимического генерирования парамагнитных частиц (раздел 2.2), отвечающих жестким требованиям как электрохимических методов, так и метода ЭПР, и позволяющих проводить одновременную регистрацию электрохимических характеристик и параметров сигнала ЭПР.
Разработан программно-аппаратный комплекс (раздел 2.3), который объединяет стандартные спектрометр ЭПР трехсантиметрового диапазона, программатор, потенциостат с компьютером через интерфейс и аналогово-цифровой преобразователь (АЦП). Результаты получаются и обрабатываются в цифровом виде (рис. 1).
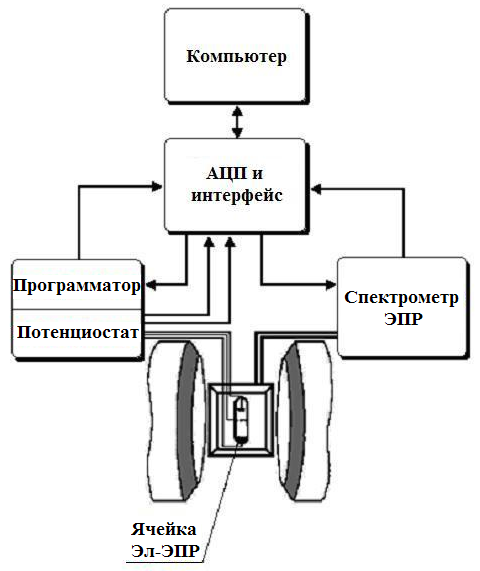
Рис. 1. Блок-схема аппаратного комплекса для электрохимии и ЭПР
Описываются возможности и преимущества метода циклической вольтамперометрии, детектируемой электронным парамагнитным резонансом (ЦВА ДЭПР), который объединяет два классических метода – циклическую вольтамперометрию (ЦВА) и ЭПР. Объединяющими звеньями являются трехэлектродная ячейка электрохимии – ЭПР (Эл-ЭПР) и компьютер с интерфейсом, подсоединенным к спектрометру ЭПР и электрохимической установке, состоящей из программатора с потенциостатом. Метод позволяет одновременно регистрировать обычные кривые ЦВА i(E) и, наряду с зависимостью интенсивности сигнала ЭПР от потенциала s(E), и ее первую производную s’(E). s(E) Пропорциональна переносимому заряду, а s’(E) - току через ячейку, поэтому отличительной особенностью регистрации s’(E) по сравнению с записью только s(E) является сопоставимость s’(E) с кривой i(E), получаемой в ходе ЦВА. Если первоначальное изменение s(E) будет связано с гетерогенным переносом первого электрона с образованием парамагнитного продукта, то s’(E) будет повторять i(E) лишь с той разницей, что является характеристикой, описывающей, главным образом, фарадеевские процессы, т.к. s’(E), в отличие от i(E), не подвержен влиянию токов заряжения двойного электрического слоя и токов примесей. Гетерогенный перенос второго электрона уменьшает s’(E), подтверждая тот факт, что в ходе вторичного процесса расходуется парамагнитный продукт первичного переноса электрона. Метод ЦВА ДЭПР позволяет более определенно идентифицировать пики ЦВА, следовательно, энергетические уровни деполяризатора, благодаря исключительной специфичности сигналов ЭПР парамагнитных соединений.
Еще одно техническое устройство, рассматриваемое в разделе 2.4 второй главы, - это топливный элемент, предназначенный для мониторинга образующихся парамагнитных частиц. Для изучения процессов, происходящих в реальном топливном элементе (ТЭ) с полимерным электролитом, сконструирован надежный и простой в работе in situ ТЭ, способный работать в резонаторе спектрометра ЭПР Х-диапазона. Разработанное устройство позволяет параллельно получать диагностические кривые и записывать спектры образующихся спиновых аддуктов, что дает возможность связать эффективность ТЭ с механизмом происходящих процессов электрохимического распада топлива c участием парамагнитных частиц.
Изучено влияние наноструктуры платинового катализатора на поляризационную кривую топливного элемента. На атомно-силовом и растровом электронном микроскопах изучены нано- и микроструктуры мембранно-электродных блоков из Нафиона и платиновой черни разной плотности, полученных путем отжига под высоким давлением и при высокой температуре. При плотности 1 мг/см2 достигается наиболее равномерное и достаточно плотное распределение частиц катализатора на поверхности мембраны, при этом достигаются и наиболее эффективные диагностические характеристики топливного элемента, работающего с этим мембранно-электродным блоком. Дальнейшее увеличение плотности покрытия (выше 1 мг/см2) приводит к образованию более крупных ассоциатов платиновых частиц и не ведет к повышению эффективности соответствующего ТЭ.
Оригинальные результаты, полученные с помощью предложенных методов и устройств, составляют содержание последующих трех глав.
В главе 3 описываются свободные радикалы в гомогенных средах. На взаимодействии донорно-акцепторных пар диалкиламинов с галогенхинонами (раздел 3.1) отрабатывается методика исследования их превращений методом ЭПР, проводится отнесение спектров ЭПР интермедиатов конкретным радикалам, в том числе до этого неизвестным, изучается механизм реакций.
3.1.1. Реакции галогенхинонов с диметиламином. На рис. 2 приведены спектры ЭПР продуктов реакции хлоранила (ХА) с диметиламином (Me2NH) в зависимости от времени после смешения компонентов. Для поддержания неизменной концентрации аминов в ходе реакции их вводили в избытке. Наблюдаются сигнал анион-радикала ХА.– – интенсивная центральная линия – и значительно менее интенсивный спектр диметилнитроксильного радикала Ме2NO.. Магнитно-резонансные параметры парамагнитных интермедиатов и продуктов приведены на схеме 1. Появление указанных сигналов свидетельствует о первоначальном превалирующем процессе переноса электрона от донора Me2NH к акцептору ХА. Наличие анион-радикала ХА.– наблюдается непосредственно на спектре ЭПР, а катион-радикалы Ме2N.+Н оказались короткоживущими в условиях данного эксперимента и их спектр ЭПР не регистрируется. Оценена константа скорости реакции 2,5-дизамещения анион-радикалов хлоранила диметиламинами: k = 2,6.10-3моль-1с-1л при 288 К. По той же схеме протекает реакция с броманилом.
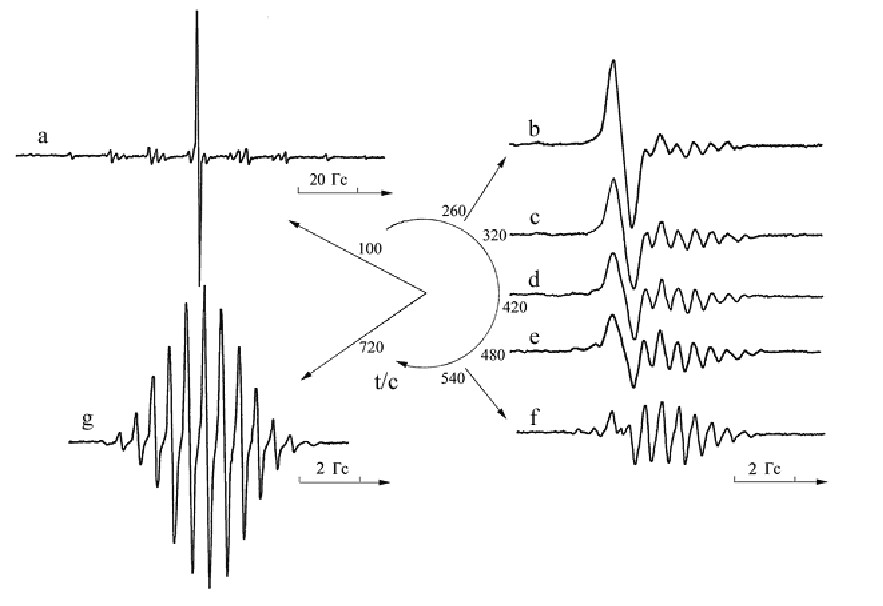
Рис. 2. Спектры ЭПР системы ХА-Me2NH в зависимости от времени в растворе ДМФА-H2O (5:1) при 298 К. Концентрация исходного ХА ~1.10-3 моль.л-1, Me2NH - ~7.3 моль.л-1. По окружности отмечено время, прошедшее после смешения компонентов
Как описывается в параграфе «3.1.2. Взаимодействие галогенхинонов с диэтиламином», после смешения хлоранила с диэтиламином в системе диметилформамид/вода (5:1) наблюдаются два стабильных сигнала - от анион-радикала хлоранила (интенсивная центральная линия) и диэтилнитроксильного радикала. В отличие от вышеописанных механизмов с применением в качестве донора электрона диметиламина, здесь не происходит присоединения к анион-радикалу хлоранила, что, вероятно, можно объяснить большими стерическими препятствиями со стороны этильных заместителей диэтиламина.
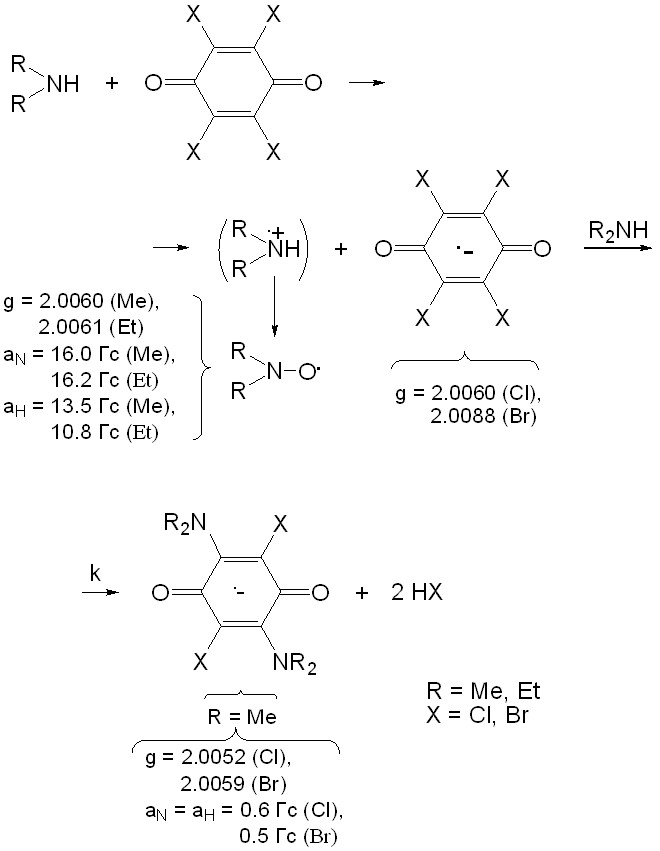
(Схема 1)
3.2. Бинарная система фенил-2,6-ди(трет-бутил)хинонимина с 2- диметиламинометилфенолом. Данная система использовалась в качестве модифицированной отверждающей системы эпоксидных и тиокол-эпоксидных композиций, и в этой системе с повышением температуры обнаруживается устойчивый в условиях проведения реакции первичный катион-радикал донора – 2-диметиламинометилфенола 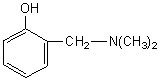 (ФОМ). Изменения его спектра ЭПР при высоких температурах объясняются обменом электроном между исходной молекулой и исследуемым катион-радикалом.
(ФОМ). Изменения его спектра ЭПР при высоких температурах объясняются обменом электроном между исходной молекулой и исследуемым катион-радикалом.
Отнесение спектров ЭПР парамагнитных интермедиатов данной системы позволило уточнить механизм отверждения эпоксидных и тиокол-эпоксидных олигомеров и модификации получаемых композиций.
Установлено («3.3. Роль радикальных процессов при отверждении эпоксидных олигомеров») улучшение целого комплекса эксплуатационных характеристик композиционных эпоксидных материалов в результате участия в их отверждении микродоз инициаторов радикальных процессов – хинониминов, хинонов, органических пероксидов. Хинонимины увеличивают на порядок интенсивность сигналов ЭПР ФОМ.+ при нагревании смеси отвердитель-модификатор до температуры 150оС.
Исходя из значений констант СТС ФОМ·+ установлено, что радикальным центром является атом азота. Кислород эпоксигруппы является нуклеофильным агентом, а ФОМ·+ электрофилен. Взаимодействие эпоксигруппы с ФОМ·+, очевидно, может привести к раскрытию эпоксидного кольца по радикальному механизму и образованию алкильного радикала с центром у одного из углеродов, принадлежавших эпоксидному кольцу.
Полученные в результате такого присоединения алкильные радикалы играют важную роль в модифицировании эпоксидных композиций. На первый взгляд, кажется, что должна иметь место радикальная полимеризация эпоксидных олигомеров путем рекомбинации алкильных радикалов двух эпоксиолигомеров. Однако оптимальные весовые соотношения эпоксиолигомеров и ФОМ предполагают примерную их эквимолярность, а концентрация ФОМ·+ в смеси отвердитель-модификатор составляет только ~104 моль/л при оптимальной температуре 700С. Таким образом, отверждение эпоксидных композиций происходит, главным образом, через хорошо известные нерадикальные механизмы, хотя при этом и остается небольшая вероятность радикального присоединения.
Оптимальное количество инициаторов радикальных процессов – 0,030.1 мас. ч. Оптимальность таких небольших доз можно объяснить, во-первых, тем, что дальнейший рост дозы модификатора приводит к росту концентрации ФОМ·+, что в свою очередь увеличивает вероятность их рекомбинации путем димеризации. Во-вторых, рост концентрации ФОМ·+ приводит к росту вероятности встречи ФОМ·+ с образовавшимися по вышеприведенной схеме алкильными радикалами, и таким образом, к ингибированию самих радикальных процессов.
Исследования методом спинового зонда позволяют условно выделить следующие этапы процесса сополимеризации тиокол-эпоксидных композитов («3.4. Изучение начальной стадии сополимеризации эпоксидного и полисульфидного олигомеров в присутствии фенольных оснований Манниха методом спинового зонда»). На начальном этапе катион-радикалы фенольного основания Манниха инициируют раскрытие эпоксидного кольца и образование алкильных радикалов. Часть их расходуется на формирование областей структурированного полимера, а другая часть – на активацию ~SH групп полисульфида. Стадия образования тиильных радикалов ~RS· - - самая длительная, что объясняется, по-видимому, диффузионными ограничениями и завершается формированием линейных цепей композита.
Аналогичное разделение стадий нельзя проследить в случае композитов, отверждаемых в присутствии модифицирующих добавок (например, хинонмоноимина - ХИ). Процесс отверждения композитов при этом протекает более равномерно: наблюдается непрерывное возрастание времени корреляции вращательного движения зондов.
В разделе 3.5 обсуждаются спектры ЭПР нитронилнитроксильных бирадикалов в жидких и замороженных растворах. Исследованы температурные зависимости спектров бирадикала с мостиком из четырех СН2 групп и двух бирадикалов с каналом обмена из ацетиленовой сопряженной цепи.
В главе 4 описаны парамагнитные частицы в наноструктурированных средах. К таким системам относятся рассматриваемые далее прямые мицеллы ПАВ, которые способны организовать в воде ассоциаты, полярные «головки» которых обращены к водной части, а неполярные «хвосты» образуют гидрофобные области. Мицеллы ПАВ служат как структурной, так и функциональной моделями сложных биоагрегатов и полимерных электролитов. ЭПР может дать обширную информацию в исследовании мицеллярных систем как с точки зрения механизмов реакций, так и с точки зрения структурных аспектов, что и показано в разделе «4.1. Фотоокисление фенотиазинов в водных мицеллярных растворах».
Другими наноструктурированными системами, нашедшими широкое применение в химической промышленности и топливных элементах, являются твердые полимерные электролиты, состоящие из гидрофобного полимерного остова и прикрепленных к нему боковых цепей, заканчивающихся кислотным остатком и образующих гидрофильные области.
4.2. Исследование деградации перфторсульфонированных мембран вне топливного элемента. Парамагнитные интермедиаты при фотооблучении. Методом ЭПР исследовались протонобменные мембраны (ПОМ) для топливных элементов, изготовленные из перфторированных сульфонокатионитовых иономеров общей формулы

Иономеры самоорганизованы во фторуглеродные остовы и гидрофильные области и позволяют транспортировку H+ только в одном направлении: от анода к катоду.
В табл. 1 приведены структурные числа, производители, торговая марка, эквивалентный вес (вес полимера, приходящийся на одну сульфоногруппу) и толщина изученных иономеров.
Для моделирования процессов в топливном элементе, в частности, для получения активных кислородсодержащих радикалов, использовалась реакция трехвалентного железа с водой с применением УФ-облучения
Fe3+ + H2O + h Fe2+ + HO. + H+
Табл.1.
Cтруктурные числа, производители, торговая марка, эквивалентный вес и толщина изученных иономеров
| Структурные числа | Производитель | Эквивалент-ный вес | Толщина/мкм | Принятое для данной работы обозначение |
| x = 6.5, n = 1, p = 2 | Du Pont | 1100 | 178 | Нафион-1100 |
| x = 5.2, n = 0, p = 2 | Dow Chemical | 800 | 50 | Дау-800 |
| x = 6.2, n = 0, p = 4 | 3M | 1000 | (35) | 3М-1000 |
| x = 4.7, n = 0, p = 4 | 3 M | 850 | (25) | 3М-850 |
Парамагнитные ионы Fe3+ попадают в гидрофильную часть мембраны путем частичной нейтрализации протонов группы -SO3H непосредственно трехвалентными ионами железа, либо получаются по реакции Фентона из ионов Fe2+, которыми также частично нейтрализованы группы -SO3H, во время обработки раствором перекиси водорода:
Fe2+ + H2O2 Fe3+ + HO. + HO-
Активные гидроксильные радикалы атакуют иономер и способствуют образованию фторуглеродных радикалов в полимерной цепи. Чтобы стабилизировать эти радикалы, получающиеся в иономерах, пришлось проводить измерения методом ЭПР при температурах 77–260 К и использовать предварительное вакуумирование образцов. Хотя эти меры и не являются приближением к реальным условиям работы топливного элемента, они позволили зарегистрировать некоторые возможные первичные элементарные акты деградации мембран, которые ранее не принимались во внимание. Более того, оказалось, что спектры ЭПР полученных таким способом макрорадикалов содержат богатую информацию о строении боковой цепи, о магнитных взаимодействиях в иономере и о состоянии молекул воды в субмикропорах мембран, что может быть ценным в применениях мембран не только в топливных элементах.
Результаты, представленные в этом разделе диссертации, являются первым прямым доказательством образования специфичных радикальных фрагментов в перфторсульфонированных мембранах.
На рис. 3 приведена зависимость спектра ЭПР при 160 К от времени УФ-облучения Нафиона. До начала облучения наличие Fe(III) заметно в полях, соответствующих g = 4.31 и 2.00, для четырёхгранной (тетраэдрической) и восьмигранной (октаэдрической) координации, соответственно. Уже после первой минуты УФ-облучения заметен новый сигнал в полях, соответствующих g 2. Этот сигнал растет со временем облучения, в то время как интенсивность сигналов Fe(III) уменьшается. Характерные «крылья» вновь возникшего сигнала, равноудаленные от центра примерно на 220 Гс, позволяют предположить, что мы имеем дело с анизотропным спектром ЭПР алкильного радикала с большим расщеплением от ядер фтора в -положении к радикальному центру.
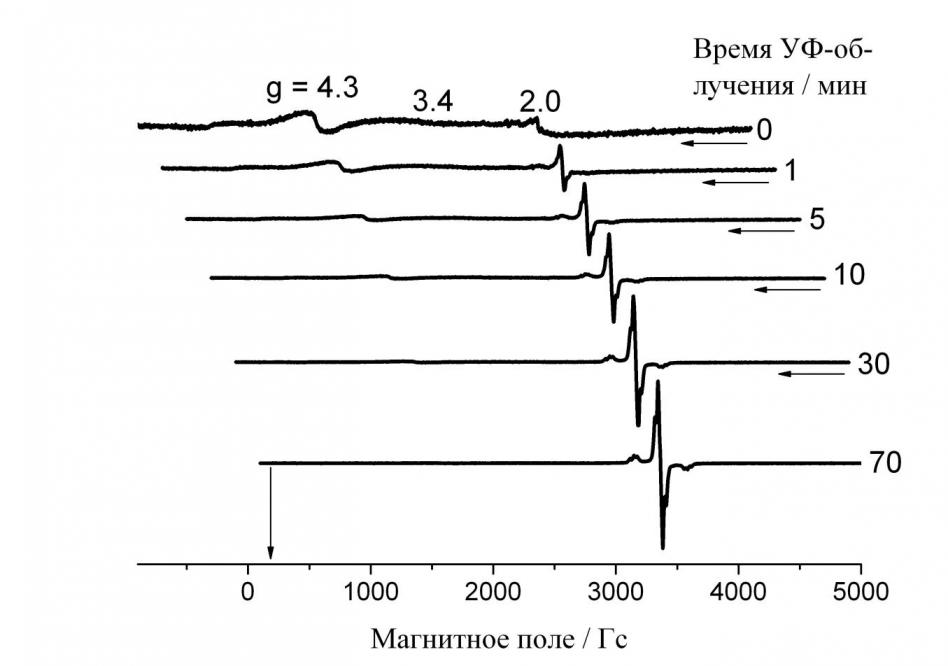
Рис. 3. Зависимость сигнала ЭПР при 160 К от времени УФ-облучения Нафиона светом ртутной лампы низкого давления. Часть -SO3H-групп Нафиона нейтрализована ионами Fe2+ в 20% -ом водном растворе FeSO4.7H2O в течение 1 часа c добавлением Н2О2/Н2О ([Н2О2]:[ Fe2+] = 1:1), вакуумированного до 10-4 Торр
В параграфе «4.3. Алкильные макрорадикалы в перфторсульфонированных мембранах» этот анизотропный спектр приписывается алкильным радикалам RCF2C.F2 конца боковой цепи Нафиона. Исследование иономера Дау при идентичных условиях обработки образца и проведения измерений привело к почти тем же спектрам ЭПР, но слегка различающимся степенью разрешения центральной компоненты.
Образование радикалов RCF2C.F2 конца боковой цепи Нафиона обусловлено УФ-индуцированным разрывом связи C–S. Механизм образования радикалов конца боковой цепи Нафиона можно представить следующим образом:
Fe3+ + H2O + RCF2CF2SO3- + h ( Fe2+ + HO. + H+ + RCF2C.F2 + .SO3- )
Fe2+ + H+ + RCF2C.F2 + HSO4-
(Схема 2)
На рис. 4 показаны спектры ЭПР Fe3+ и RCF2C.F2 при 120 К в зависимости от времени УФ-облучения Нафиона-1100. Видно, что с ростом времени облучения разрешение спектра улучшается, и это при том, что концентрация упомянутых радикалов растет со временем облучения. Можно заключить, что уширение спектра при данных условиях обусловлено скорее диполь-дипольным взаимодействием между свободными радикалами и парамагнитными ионами трехвалентного железа, чем взаимодействием между свободными радикалами RCF2C.F2.
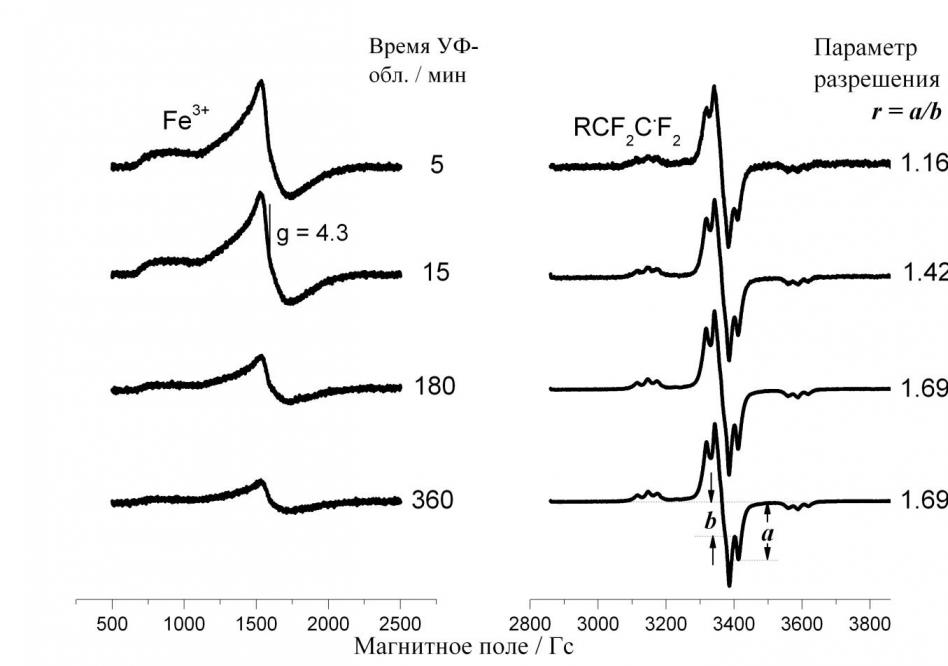
Рис. 4. Спектры ЭПР Fe3+ и RCF2C.F2 при 120 К в зависимости от времени УФ-облучения при 77 К Нафиона-1100, 10% групп -SO3H которого нейтрализовано ионами Fe2+. Затем иономер был выдержан в течение 1 часа в растворе Н2О2/Н2О ([Н2О2]:[ Fe2+] = 1:1) и вакуумирован до 10-4 Торр.
Для удобства обсуждения вводится параметр разрешения r, равный отношению амплитуды крайнего высокопольного минимума a к амплитуде крайнего высокопольного максимума b центрального триплета спектра ЭПР радикала RCF2C.F2. Начиная со времени облучения 180 минут, параметр r перестает меняться, также не меняется и форма спектра ЭПР, хотя концентрация радикалов RCF2C.F2 продолжает расти.
Спектры радикалов боковых цепей различных иономеров, представленные на рис. 5, схожи и расстояния между характерными пиками одинаковы для исследованных мембран попарно, для Нафиона-1100 и Дау-800 с одной стороны, для 3М-1000 и 3М-850, соответственно, - с другой. Такая схожесть внутри каждой пары иономеров обусловлена одинаковой структурой свободного радикала конца боковой цепи. Для Нафиона-1100 и Дау-800 это ~ОCF2C.F2, а для 3М-1000 и 3М-850 - ~CF2CF2C.F2, соответственно.
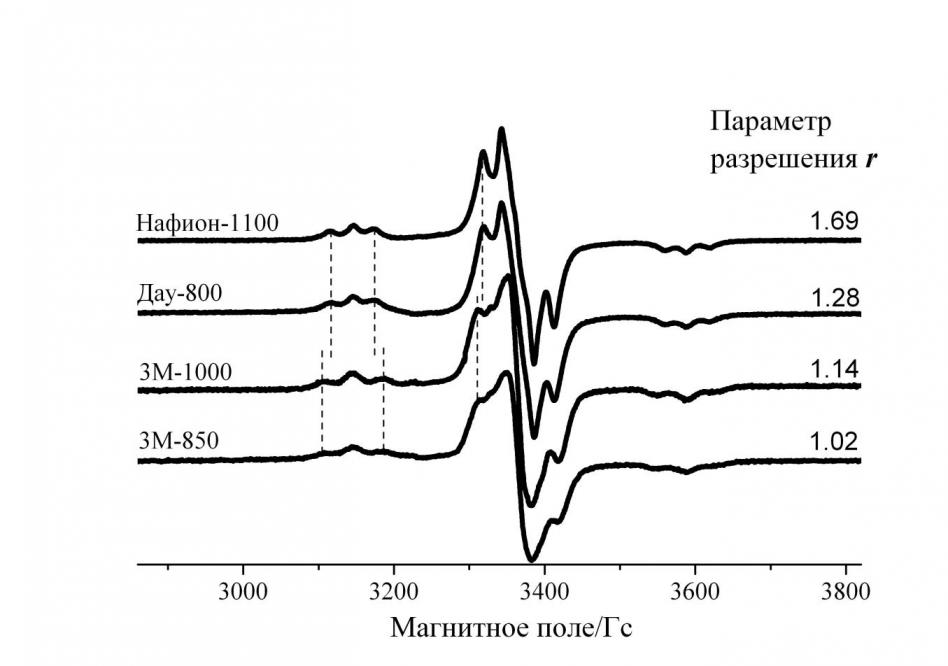
Рис. 5. Спектры ЭПР при 120 К радикалов конца боковой цепи различных перфторированных сульфокатионитовых иономеров
Отличающиеся структуры ближайшего окружения радикального фрагмента двух пар иономеров и наличие - фторов в свободных радикалах второй пары ответственны за различия спектров между парами. А внутри каждой пары спектры ЭПР отличаются параметром разрешения r: он больше для того иономера, который имеет больший эквивалентный вес. Как известно, эквивалентный вес равен весу полимера, приходящемуся на одну сульфоногруппу. Чем больше эквивалентный вес, тем больше –CF2– звеньев главной цепи располагается между соседними боковыми цепями, и соответственно, тем больше расстояние между последними. Разный характер разрешения спектров ЭПР внутри каждой пары определяется различающимися диполь-дипольными взаимодействиями между соседними свободными радикалами конца боковой цепи. Чем больше расстояние между соседними радикалами, тем меньше диполь-дипольное взаимодействие между ними, и, следовательно, тем меньше ширина индивидуальной линии спектра ЭПР. Таким образом, радикалы конца боковой цепи в исследованных перфторированных сульфокатионитовых мембранах могут служить своего рода спиновыми метками, чувствительными к ближайшему магнитному окружению.
В табл. 2 приведены магнитно-резонансные параметры алкильных радикалов конца боковой цепи исследованных перфторсульфонированных иономеров, которые получены симулированием в предположении аксиально-симметричных А- и g-тензоров. Для лучшего совпадения экспериментального и симулированного спектров при одинаковых ширинах линий для Нафиона-1100 и 3М-1000 пришлось ввести в расчеты параллельную и перпендикулярную составляющие константы сверхтонкого взаимодействия (СТВ) -фторов для иономера 3М-1000. Значения 10 и 13 Гс для параллельной и перпендикулярной составляющих константы СТВ, соответственно, являются существенными для -фторов и приводят к изотропной константе 12.0 Гс.
Табл. 2.
Магнитно-резонансные параметры алкильных макрорадикалов конца боковой цепи перфторсульфонированных мембран
| Иономер | Положение - атом | Константы СТВ / Гс | g-факторы | Ширина линии / Гс | Форма линии | |||||
| A | A | Aiso | g | g | giso | |||||
| Нафион-1100, Дау-800 [1] | -F | 222.0 | 18.0 | 86.0 | 2.0024 | 2.0038 | 2.0033 | 18.0 | 38.0 | лоренцева |
| -F | 30.0 | 38.0 | 35.3 | |||||||
| 3M-1000, 3M-850 | -F | 219.0 | 18.0 | 85.0 | 2.0035 | 2.0046 | 2.0042 | 18.0 | 38.0 | лоренцева |
| -F | 37.0 | 40.0 | 39.0 | |||||||
| -F | 10.0 | 13.0 | 12.0 | |||||||
Главные значения тензора сверхтонкой структуры ядер F в радикалах RCF2C.F2 конца боковой цепи в перфторированных сульфонокатионитовых мем-бранах Нафион-1100 и Дау-800 – 222, 18 и 18 Гс, изотропное расщепление - аiso = 86 Гс. А главные значения тензора СТВ для ядер F – 30, 38 и 38 Гс (аiso = 35.3 Гс) - отличны от соответствующих величин – 10, 17 и 17 Гс (аiso = 15 Гс), определенных для радикалов конца главной цепи в ПТФЭ.
4.4. Аллильные макрорадикалы. При определенных условиях изготовления и обработки в перфторсульфонированных мембранах образуются радикалы с изотропными квартетными спектрами ЭПР. Спектр ЭПР при 260 К в Нафионе-1100, часть -SO3H-групп которого нейтрализована ионами Fe2+, показан в верхней части рис. 6. А соответствующий спектр полностью дейтерированного Нафиона-1100 приведен ниже на том же рисунке. Последний спектр представляет собой квартет с соотношением интенсивностей линий 1:3:3:1.
В спектре системы Нафион/Fe(II)/H2O2/H2O видны дополнительные линии, которые выражены более четко в высокопольной половине спектра. Эти линии являются запрещенными спин-флип сателлитными линиями, возникающими из-за случайных взаимосвязанных параллельных спиновых перескоков электронов и соседних матричных протонов благодаря диполь-дипольному взаимодействию между ними.
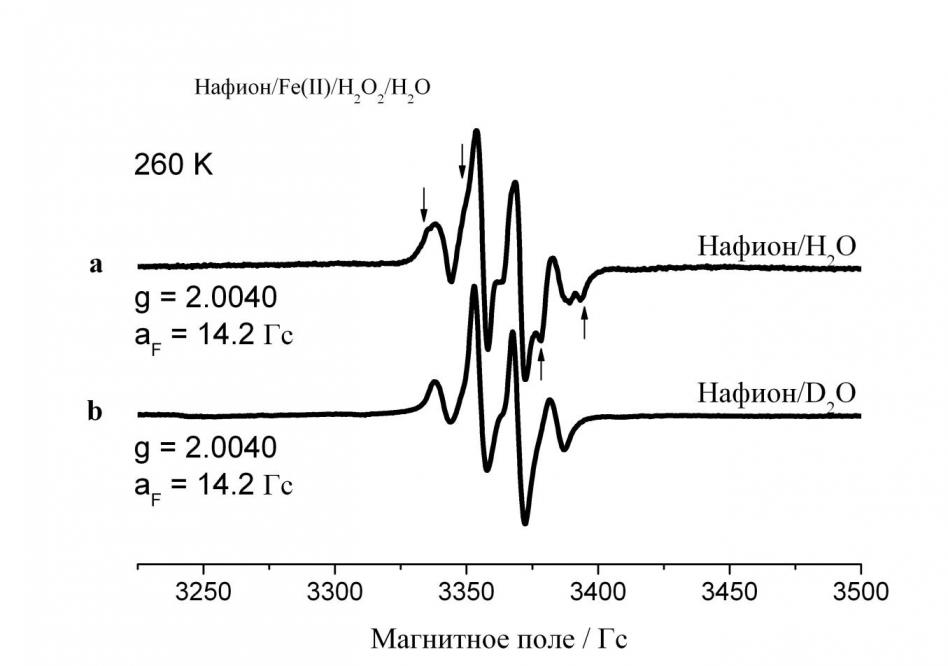
Рис. 6. а) Спектр ЭПР Нафиона-1100, часть -SO3H-групп которого нейтрализована ионами Fe2+ в 5% -ом водном растворе FeSO4.7H2O в течение 1 ч. c добавлением Н2О2/Н2О ([Н2О2]:[ Fe2+] = 200:1), вакуумированного до 10-4 Торр и облученного УФ-светом ртутной лампы низкого давления в течение 30 мин. при 77 К (стрелки указывают сателлитные линии); b) то же для системы Нафион/Fe(II)/D2O2/D2O
Вышеприведенные квартетные сигналы относительно стабильны и легко насыщаются при росте мощности СВЧ. Наиболее подходящей структурой для парамагнитных частиц, порождающих эти сигналы ЭПР, является нижеприведенная структура аллильного радикала в системе Нафион/H2O:
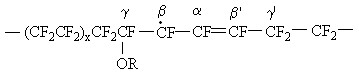
где R – остаток боковой цепи. Три -фтора радикального фрагмента ответственны за мультиплет с константой расщепления a = 14.2 Гс. Исследования других перфторированных сульфонокатионитовых мембран (Дау-800, 3М-1000 и 3М-850) показали, что характер спектра не зависит от структуры боковой цепи. Поэтому утверждение о том, что радикал образуется в главной цепи, является оправданным. Локализация аллильного радикала рядом с боковой цепью обусловлена фактом наличия в спектрах ЭПР исследованных систем сателлитных линий, вызванных диполь-дипольным взаимодействием неспаренного электрона с матричными протонами. Последние являются протонами молекул воды в гидрофобных аморфных частях мембран. При этом наличие мостикового кислорода в месте ответвления боковой цепи имеет немаловажное значение. Скорее всего, атомы водорода молекул воды, ответственные за сателлитные линии в спектрах ЭПР, образуют водородные связи с мостиковым кислородом у главной цепи и являются малоподвижными, поэтому диполь-дипольное взаимодействие неспаренного электрона с матричными протонами не усредняется до нуля движениями молекул воды в исследованном температурном диапазоне вплоть до 260 К, когда еще наблюдаются данные спектры.
Гетерогенные среды, которые часто являются каталитическими или электродно-электролитическими системами, все еще остаются весьма непростыми объектами для исследования резонансно-спектроскопическими методами. Новые технические устройства позволяют расширить границы возможных применений ЭПР в исследовании парамагнитных частиц в гетерогенных системах, о чем идет речь в главе 5. Раздел 5.1 посвящен свободным азотсодержащим радикалам.
5.1.1. Фенил-2,6-ди(трет-бутил)хинонимин и его анион-радикал. Методом Эл-ЭПР исследован фенил-2,6-ди(трет-бутил)хинонимин (ХИ). Первый пик восстановления на -0.5 В является частично обратимым в условиях ЦВА при скорости развертки потенциала 0.1 В/с: ia/ik 0.8; Еа – Ек > 60 мВ и приписывается анион-радикалу ХИ. Второй пик появляется на –1 В и соответствует полностью необратимому процессу, связанному с дальнейшим электрохимическим восстановлением (ЭХВ) продуктов первичной стадии. В ходе электрохимического генерирования анион-радикалов из свежеприготовленного раствора ХИ в ДМФА при потенциалах первого пика зарегистрированы их спектры ЭПР, имеющие четко разрешенную сверхтонкую структуру. Результаты, описанные в данном параграфе, использованы при обсуждении электронного переноса в донорно-акцепторной системе фенил-2,6-ди(трет-бутил)хинонимина с 2-диметиламинометилфенолом.
5.1.2. Нитронил- и иминонитроксильные радикалы. Нитронилнит-роксильные радикалы являются классическими объектами для создания молекулярных магнетиков. Методами ЦВА, ЭПР и ЦВА ДЭПР проведено исследование электрохимических свойств большой специально подобранной группы нитронилнитроксильных (NN) и иминонитроксильных радикалов (IN) (табл. 3).
Окислительно-восстановительные потенциалы NN или IN (табл. 4) были определены методом ЦВА. Материал вспомогательного электрода – платина, электрод сравнения – Ag/0.01 M AgNO3, рабочий электрод – стеклоуглерод. Электрохимические эксперименты проводили в CH3CN при 293 К, фоновым электролитом служил 0.1 М Et4NBF4, скорость развертки E(t) составляла 0.1 В/c. В табл. 4 также приведены магнитно-резонансные параметры нитроксилов, очищенных непосредственно перед проведением эксперимента. Для всех монорадикалов наблюдаются сателлитные линии сверхтонкого взаимодействия, интенсивность которых в среднем в 90 раз меньше основной крайней линии. Учитывая, что содержание 13C составляет 1.108 % относительно изотопа 12C, разумно предположить, что эти линии относятся к двум атомам углерода, соседним к атому азота радикального центра. Каждая линия основного спектра делится на две изотопные линии углерода.
Табл. 3.
Нитронил- (1) и иминонитроксильные (2) радикалы
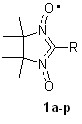
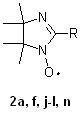
| 1 | 2 | –R | 1 | 2 | –R | 1 | 2 | –R |
| 1a | 2a | 1g | 1m | |||||
| 1b | 1h |  | 1n | 2n | ||||
| 1c | 1i | 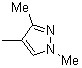 | 1o | |||||
| 1d | 1j | 2j | 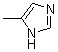 | 1p | ||||
| 1e | 1k | 2k | 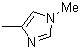 | |||||
| 1f | 2f | 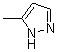 | 1l | 2l | 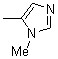 |
Спектры ЭПР NN представляют собой квинтет с соотношением интенсивностей линий 1:2:3:2:1. Однако, со временем, даже при хранении радикалов в холодильнике, этот чистый квинтет начинает терять симметрию как для отдельных линий, так и для мультиплета в целом. Так, в спектре ЭПР нитронилнитроксильного радикала 1n, который хранился в течение года при 5 oC, на фоне основного мультиплета видны дополнительные слабые сигналы соответствующего иминонитроксильного радикала 2n (рис. 7a). Раздельно наблюдать примесь 2n и основной компонент 1n удалось в комбинированных экспериментах ЦВА – ЦВА ДЭПР. Так, на кривых i(E), s(E) в ходе электрохимического окисления (ЭХО) наблюдается полупик при потенциале 0.65 В (в экспериментах по ЦВА ДЭПР применялся спиральный анод из золота); пик, обратимый как на ЦВА, так и на ЦВА ДЭПР (рис. 8); анодный и катодный пики первой производной интенсивности сигнала ЭПР запаздывают примерно на 0.5 с по сравнению с пиками соответствующей электрохимической кривой, что объясняется временем диффузии парамагнитного продукта переноса электрона в регистрируемый методом ЭПР объем ячейки. При дальнейшем увеличении потенциала до 1.2 В наблюдается частично обратимый пик примеси 2n, который за счет перекрывания спектров слабо влияет на интенсивность первой производной сигнала ЭПР 1n. Действительно, электролиз в течение 1 мин исходного раствора 1n, содержащий примесь 2n, при потенциале 1.2 В приводит по данным ЭПР спектроскопии к полному исчезновению 2n (рис. 7c).
Табл. 4.
Электрохимические характеристики и магнитно-резонансные параметры NN и IN
| Соединение | Окисление | Восстановление | Константы СТВ, Гс (±0.1) | g-фактор (± 10–4) | |||||||
| Еpa1, В | Epк1, В | I, мкА | Epк2, В | Epа2, В | I, мкА | aN1 | аN3 | а13C’ | а13C’’ | ||
| 1a | 0.46 2.41 | 0.29 – | 8.03 7.88 | –1.45 | –1.36 | 8.53 | 7.72 | 7.72 | 11.55 | 2.0066 | |
| 1b | 0.47 2.81 | 0.23 – | 6.11 9.01 | –1.36 | –1.17 | 9.03 | 7.72 | 7.72 | 11.50 | 2.0066 | |
| 1c | 0.48 2.88 | 0.27 – | 8.17 | –1.35 | –1.02 | 10.7 | 7.72 | 7.72 | 12.00 | 2.0068 | |
| 1d | 0.49 | 0.26 | 8.55 | –1.39 | –1.11 | 13.81 | 7.72 | 7.72 | 11.67 | 2.0066 | |
| 1e | 0.43 | 0.30 | 7.63 | –1.36 | –1.10 | 9.12 | 7.72 | 7.72 | 11.77 | 2.0066 | |
| 1f | 0.63 | 0.27 | 4.32 | –1.02 –1.49 | –0.82 –1.30 | 5.23 | 7.63 | 7.63 | 12.11 | 2.0065 | |
| 1g | 0.46 | 0.29 | 8.51 | –1.39 | –1.17 | 9.95 | 7.53 | 7.53 | 12.44 | 2.0066 | |
| 1h | 0.65 | 0.44 | 10.37 | –1.23 | –0.96 | 11.97 | 7.72 | 7.72 | 12.78 | 2.0066 | |
| 1i | 0.47 | 0.23 | 6.28 | –1.37 | –1.14 | 10.3 | 7.61 | 7.61 | 12.11 | 2.0065 | |
| 1j | 0.49 2.08 | 0.30 | 8.36 | –1.02 | –0.76 | 6.42 | 7.71 | 7.71 | 11.80 | 2.0064 | |
| 1k | 0.48 2.06 | 0.30 | 8.94 | –0.99 | –0.79 | 7.17 | 7.72 | 7.72 | 11.66 | 2.0065 | |
| 1l | 0.56 | 0.37 | 7.24 | –1.31 | –1.08 | 8.75 | 7.48 | 7.48 | 12.49 | 2.0071 | |
| 1m | 0.41 | 0.28 | 10.41 | –1.37 | –1.18 | 10.68 | 7.63 | 3.291 | 12.13 | 2.0064 | |
| 1n | 0.50 | 0.35 | 9.58 | –1.28 | –1.08 | 10.72 | 7.58 | 7.58 | 11.55 | 2.0065 | |
| 1o | 0.51 | 0.37 | 8.89 | –1.25 | –1.06 | 19.26 | 7.50 | 7.50 | 14.44 | 2.0064 | |
| 1p | 0.88 | 0.74 | 8.69 | –0.99 –2.49 | –0.82 | 7.06 8.96 | 7.14 | 7.14 | 12.80 | 2.0067 | |
| 2a | 0.94 2.37 | – | 5.43 | –0.95 –1.39 | –0.66 –1.07 | 6.34 5.79 | 9.46 | 4.22 | 9.11 | 5.04 | 2.0057 |
| 2f | 0.96 | – | 10.22 | –0.92 | –0.57 | 5.11 | 9.28 | 4.33 | 9.22 | 5.00 | 2.0059 |
| 2j | 0.88 1.22 | – 1.04 | 4.53 5.44 | –0.94 | –0.53 | 4.30 | 9.52 | 4.21 | 9.16 | 5.02 | 2.0059 |
| 2k | 0.88 1.21 | – 1.04 | 4.56 5.54 | –0.98 | –0.53 | 4.7 | 9.51 | 4.17 | 8.99 | 5.10 | 2.0059 |
| 2l | 0.93 1.21 | – 0.98 | 5.59 7.14 | –1.26 | –1.04 | 8.20 | 9.47 | 4.08 | 9.22 | 5.00 | 2.0058 |
| 3 | 0.45 2.32 | 0.26 | 14.51 12.16 | –1.32 | –1.16 | 14.20 | 7.72 | 7.72 | 2.0064 | ||
1аН(СН3)
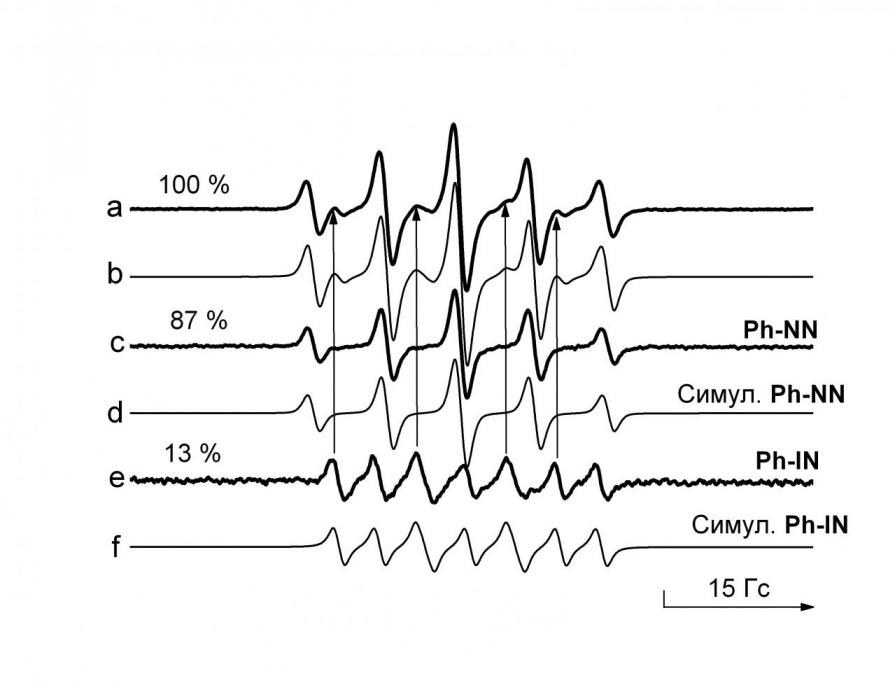
Рис. 7. Экспериментальные (a, c, e) и симулированные (b, d, f) спектры ЭПР 510–4 М раствора 1n с примесным 2n (потенциостатический режим). Спектр a относится к исходному раствору, c – после электролиза при потенциале 1.2 В в течение 1 мин., e – во время электролиза при потенциале 1.0 В

Рис. 8. Кривые ЦВА i(E) и ЦВА ДЭПР s’(E) в ходе ЭХО 510–3 М раствора 1n с примесным 2n (фон – 510–1 М Et4NBF4)
Если же вести электролиз при потенциале 1.0 В, то происходит полное превращение 1n в соответствующий IN (рис. 7f) с магнитно-резонансными параметрами: aN(N-1) = 9.50 Гс, aN(N-3) = 4.31 Гс, g = 2.0058.
5.1.3. 4,4,5,5-Тетраметил-1,2-диоксоимидазолидин-1-иум-3-олат и парамагнитные продукты. На рис. 9 приведены экспериментальные кривые ЦВА i(E) и ЦВА ДЭПР s’(E) 5.10–3 М раствора 4,4,5,5-Тетраметил-1,2-диоксоимидазолидин-1-иум-3-олата (цвиттер-ион - ЦИ) в ходе электрохимического восстановления в CH3CN. При потенциале Е1 = – 0.39 В наблюдается обратимый пик ЦВА, приводящая к парамагнитному продукту – анион-радикалу. Из кривой ЦВА ДЭПР видно, что перенос первого электрона является обратимым процессом. ЭХВ ЦИ в потенциостатическом режиме на потенциале –0.35 В дает анион-радикал ЦИ.-, спектр ЭПР которого представляет собой квинтет с aN = 8.31 Гс и g = 2.0061.
В ходе ЭХО наблюдается частично обратимый пик с потенциалом полупика на – 1.7 В.
В присутствии основания ЦИ подвергается диспропорционированию на парамагнитный анион – 4,4,5,5-тетраметил-2-оксоимидазолидин-3-оксил-1-олат (ЦИ.-) и парамагнитный катион. Последний быстро превращается в детектируемый спектроскопией ЭПР 3-гидрокси-4,4,5,5-тетраметилимида-золидин-2-он-1-оксил (НЦИ.-), который, в свою очередь, диспропорционирует на 1,3-дигидрокси-4,4,5,5-тетраметилимидазолидин-2-он (Н2ЦИ2-) и исходный ЦИ (схема 3). Применение избытка основания позволяет добиться полного превращения ЦИ в Н2ЦИ2- и ЦИ.-.
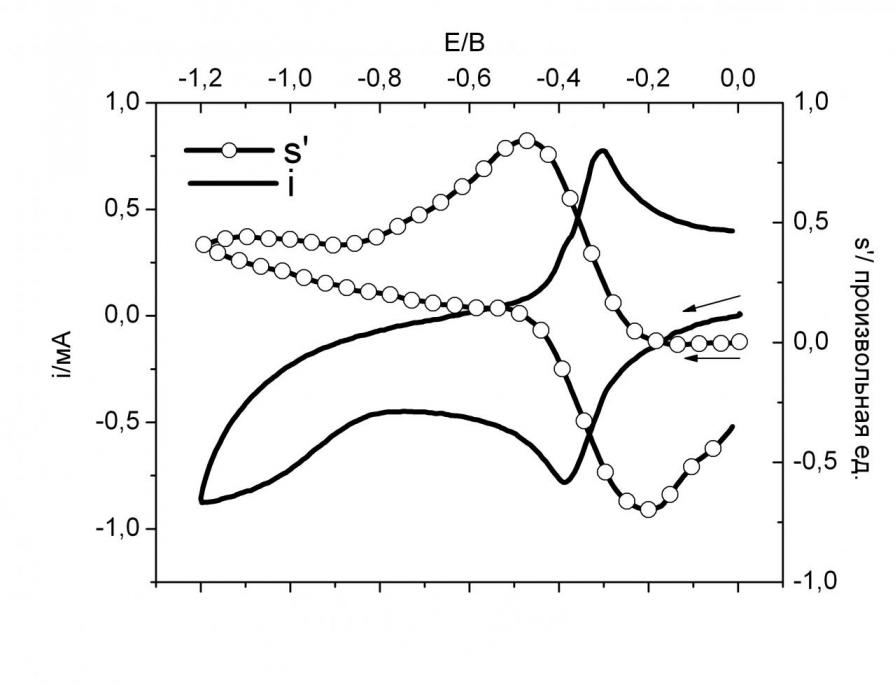
Рис. 9. Кривые ЦВА i(E) и ЦВА ДЭПР s’(E) 5.10–3М раствора ЦИ в ходе ЭХВ в CH3CN на фоне 3.10–1М Et4NBF4 на Au; скорость развертки потенциала 0.1 В/c; температура 293 К
Сложный химический состав реакционной смеси, образующейся при взаимодействии эквимолярных количеств КОН и ЦИ, находит свое отражение на кривых ЦВА ДЭПР. Так, отсутствие на рис. 10 явно выраженных волн, по-видимому, свидетельствует о том, что при ЭХО реакционной смеси одновременно реализуется несколько окислительных процессов. Обращает на себя внимание, что производная интенсивности сигнала ЭПР ЦИ.- резко спадает при потенциале со значением полупика Е = 0.04 В, что, вероятнее всего, связано с ЭХО ЦИ.-.

(Схема 3)
Поскольку потенциал окисления ЦИ.- составляет всего 0.04 В, он легко взаимодействует с кислородом во влажном воздухе с образованием ЦИ, компропорционирующего с присутствующим в реакционной смеси 1,3-1,3- дигидрокси-4,4,5,5-тетраметилимидазолидин-2-оном, что приводит, в конечном итоге, к полному превращению в ЦИ.
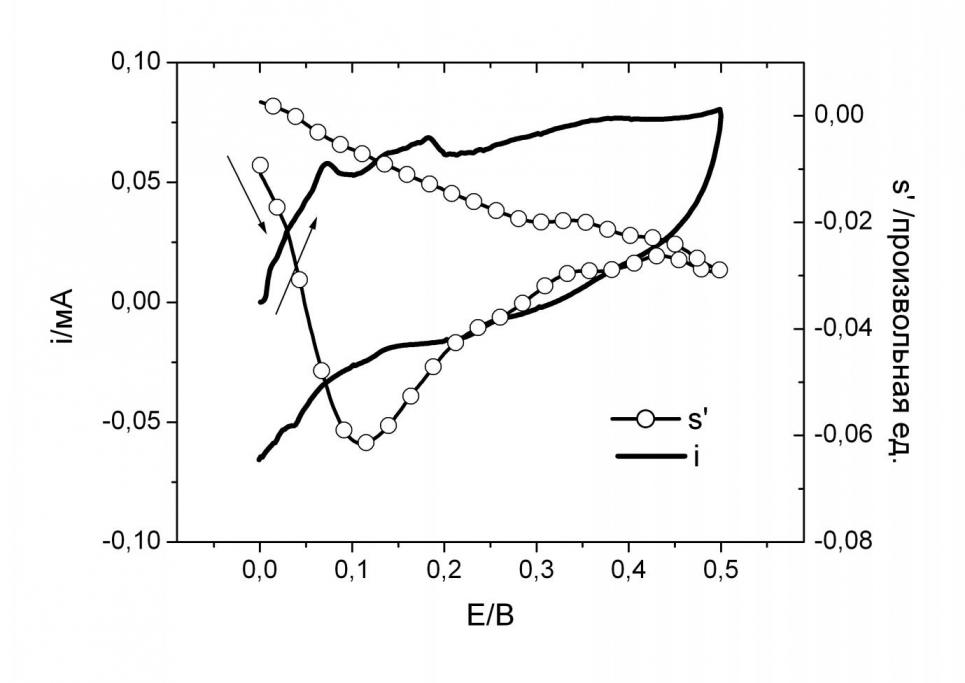
Рис. 10. ЦВА i(E) реакционной смеси, образованной прибавлением эквимольного количества водного раствора КОН к 5.10–3 М раствору ЦИ в CH3CN, и ЦВА ДЭПР s’(E) ЦИ.- в ходе ЭХО на фоне 3.10–1 М Et4NBF4 на Pt; скорость развертки потенциала 0.1 В/c; температура 293 К
Проведенные исследования методами ЦВА ДЭПР позволили предложить пути постановки химического и электрохимического синтеза различных солей анион-радикала 4,4,5,5-тетраметил-1,2-диоксоимидазолидин-1-иум-3-олата (см. «Основ- ные результаты и выводы»), интересных с точки зрения создания молекулярных магнитных материалов.
В разделе 5.2. «Комплексы переходных металлов» обсуждаются результаты исследования комплексов никеля и меди с лигандами, образующими стабильные радикалы. В последнее время большой интерес вызывают комплексные соединения металлов с парамагнитными лигандами. Лиганды нередко оказываются электрохимически активными и при электрохимическом восстановлении или окислении этих комплексов наряду с превращениями центрального иона возможны также и превращения лигандов, что неизменно приводит к изменению парамагнитных свойств таких многоспиновых систем. В их исследовании большую ценность представляет метод ЦВА ДЭПР, который во время электрохимического воздействия позволяет одновременно наблюдать за поведением и парамагнитных лигандов, и парамагнитных ионов переходных металлов по изменению характера и интенсивности их сигналов ЭПР, обычно располагающихся в спектре раздельно.
Комплексы (dppe)Ni(Cat) (где dppe-бис(дифенилфосфино)этан, Cat - дианион пространственно затрудненного пирокатехина) подвергались одно- и двухэлектронному электрохимическому окислению (5.2.1. Катехолатные комплексы Ni(II) с бис(дифенилфосфино)этаном). Перенос первого электрона является обратимым процессом, в результате которого образуются парамагнитные частицы, спектры ЭПР которых регистрируются с помощью программно-аппаратного комплекса. Параметры спектров ЭПР этих частиц свидетельствуют о плоско-квадратной геометрии продуктов одноэлектронного окисления. Метод ЦВА ДЭПР использован для изучения механизма гетерогенного переноса второго электрона. Необратимость переноса второго электрона обуславливается реакцией компропорционирования катион-радикалов с участием исходных комплексов и генерируемых дикатионов.

Ni-dppe-1 Ni-dppe-2
На рис. 11 приведены ЦВА i(E) и ЦВА ДЭПР s’(E) соединения Ni-dppe-1 в интервале рабочих потенциалов, когда происходит гетерогенный перенос и второго
электрона. Судя по кривой ЦВА, можно заключить, что первый пик окисления является обратимым, а вот обратимость второго не проявляется на вольтамперограмме в данных условиях эксперимента. Первому пику окисления i(E) соответствует пик s’(E), фиксирующий образование катион-радикала.
-e
Ni-dppe-1 D Ni-dppe-1+·
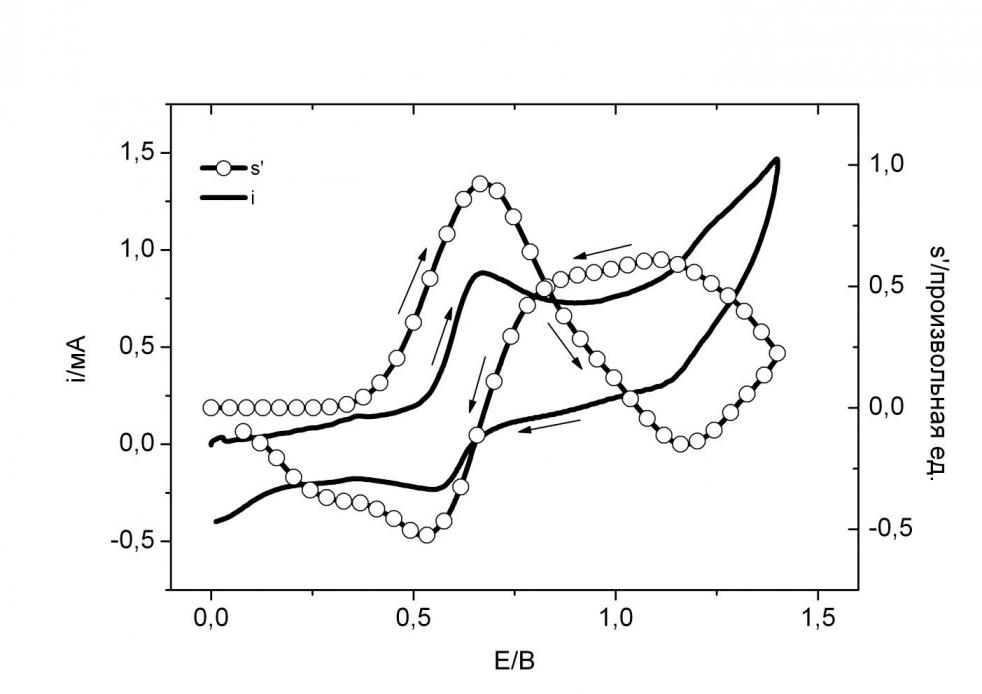
Рис. 11. ЦВА i(E) и ЦВА ДЭПР s’(E) 5.10-3 комплекса Ni-dppe-1 в ацетонитриле на фоне 3.10-1 NaBF4; скорость развертки потенциала E(t) 0,5 В/c; 293 К
Второй пик (1.3 В) соответствует окислению катион-радикала и, соответственно, образованию дикатиона,
-e
Ni-dppe-1+· D Ni-dppe-12+
что четко видно по характеру кривой s’(E), которая идет вниз. Кривая ЦВА ДЭПР s’(E) дает ответ и на вопрос о том, чем обусловлена необратимость второго пика окисления. После достижения второго пика кривая s’(E) начинает идти вверх. Это свидетельствует о наличии процесса, приводящего к образованию катион-радикалов после достижения потенциалов образования дикатиона. Причем скорость образования катион-радикалов в результате этого третьего процесса выше скорости их расходования реакцией окисления катион-радикала. Этим третьим процессом является реакция компропорционирования катион-радикалов с участием исходного соединения Ni-dppe-1 и дикатиона Ni-dppe-12+:
Ni-dppe-1 + Ni-dppe-12+ D 2(Ni-dppe-1+·)
5.2.2. Комплекс Cu(II) с нитронилнитроксильными радикалами. Спектр ЭПР раствора комплекса CuLnn•2 в ДМФА состоит из двух частей разной интенсивности из-за того, что спектры нитронилнитроксильного радикала и Сu(II) разнесены по оси магнитного поля и имеют разные ширины линий, из-за чего имеют несопоставимые интенсивности. Поэтому, чтобы увидеть все детали спектра, его удобнее представить в виде двух частей – спектра обменной триады (рис. 12а) и спектра свободных NN (рис. 12b). Для того чтобы оценить, какая часть комплекса диссоциирована, в исследованный раствор было добавлено эквимолярное количество пиридина, который является сильным электронодонором, вытесняющим нитронилнитроксильные лиганды из комплекса, и образует новый комплекс с характерным квадруплетом, присущим плоскоквадратным комплексам иона двухвалентной меди, с магнитно-резонансными параметрами: aCu = 60.0 Гс gCu = 2.134. Сигнал NN вырос в пять раз (рис. 12b), что свидетельствует о том, что диссоциировано 20 % комплекса CuLnn•2. Соотношение величин g-факторов обменной триады (2.050), меди (II) (2.134) в пиридиновом комплексе и NN (2.007) удовлетворяет соотношению
gNN-Cu-NN = (gCu +2.gNN)/3
и свидетельствует также о сильном обменном взаимодействии между парамагнитными центрами обменной триады.
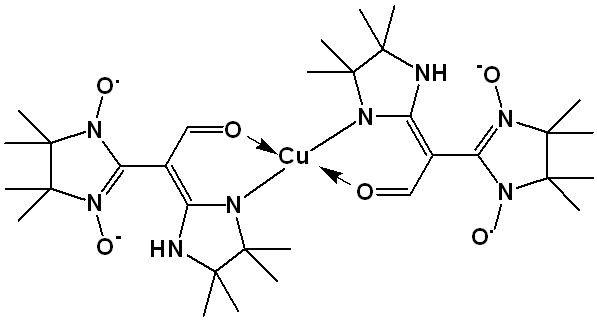
CuLnn•2
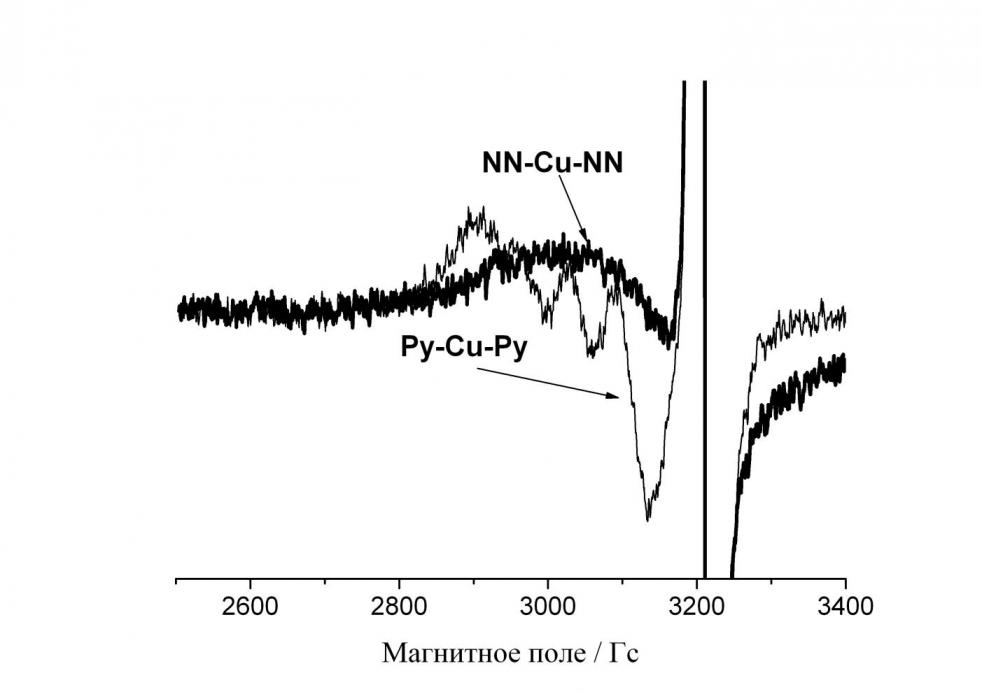
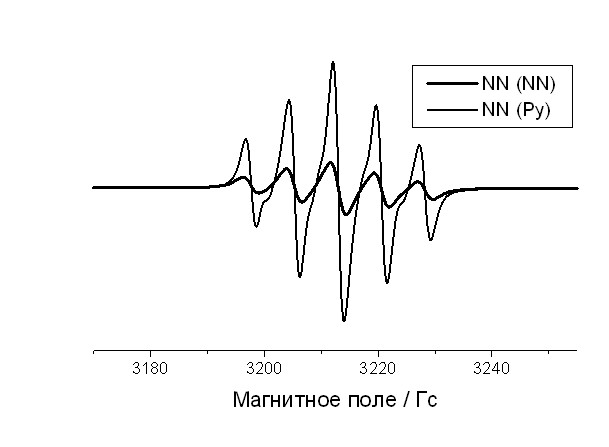
- b)
Рис. 12. Спектры ЭПР а) обменной триады NN-Cu-NN в 5.10-4 М соединении CuLnn•2 в ДМФА и Cu(II) в пиридиновом комплексе, b) свободных лигандов, не координирующих ион металла
На рис. 13 приведены кривые ЦВА i(E) и ЦВА ДЭПР s(E) в ходе ЭХВ 510–4 М раствора CuLnn•. Здесь кривая ЦВА ДЭПР s(E) полнее и четче показывает процессы электрохимического восстановления комплекса, чем ЦВА. Поэтому для рассмотрения этих процессов обратимся к кривой ЦВА ДЭПР лиганда s(E). До пика восстановления лиганда наблюдается некоторый рост кривой s(E), причем этот рост более пологий, чем характер пика переноса электрона. По всей видимости, мы здесь опосредованно видим химическую стадию, связанную с отсоединением одного парамагнитного лиганда после одноэлектронного гетерогенного переноса электрона на двухвалентный ион меди с необратимым пиком на Е = – 0.7 В. Видимо, обменная триада после восстановления парамагнитного Сu(II) распадается на две раздельные радикальные частицы: одна в составе комплекса Сu(I)Lnn•, а вторая - Lnn•, отсоединившаяся от комплекса и потерявшая связь с ним. g – Факторы и константы СТВ этих двух радикалов не должны заметно отличаться. Рост s(E) отражает исчезновение обменных взаимодействий между радикальными частицами и вклад обеих частиц в общий сигнал s(E). Далее мы видим обратимое восстановление радикалов с пиком на Е = – 1.1 В по s(E).
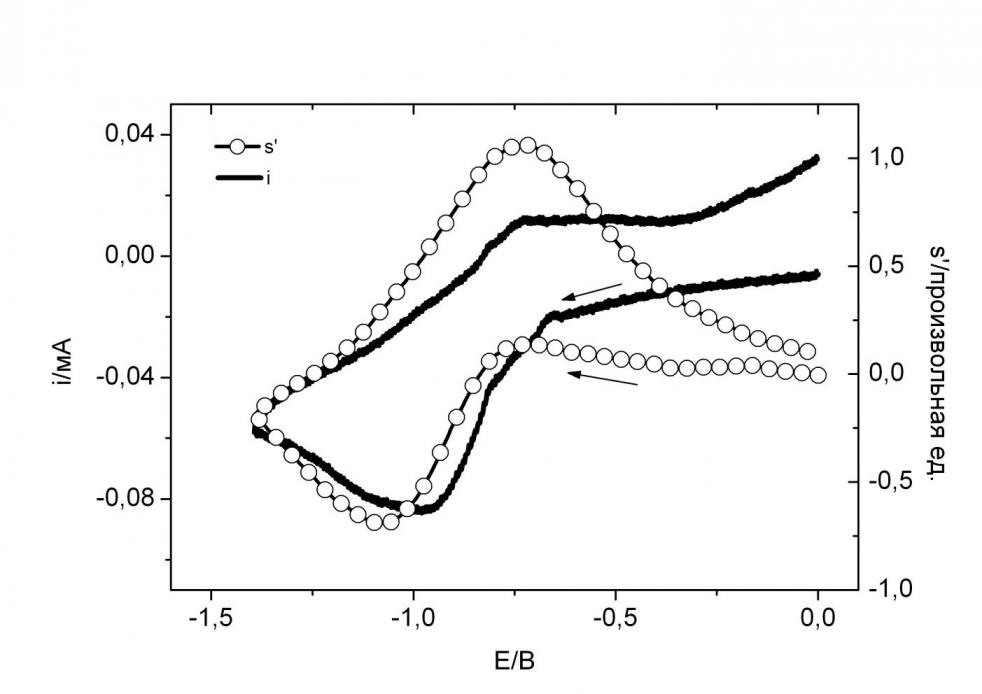
Рис. 13. Кривые ЦВА i(E) и ЦВА ДЭПР s(E) в ходе ЭХВ 510–4 М раствора CuLnn•2 в ДМФА при развертке потенциала со скоростью 0.1 В/с, 293 К
Характер кривой s(E) (рис. 14) в ходе ЭХВ комплекса CuLnn•2 до меньших потенциалов подтверждает выше приведенные предположения. s(E) – Это интенсивность сигнала ЭПР радикалов и связан с их концентрацией в растворе. После необратимого ЭХВ Сu(II) до Сu(I) s(E) продолжает расти и на обратной ветви кривой ЭХВ. Это говорит о большей скорости химических процессов распада первоначального комплекса по сравнению с гетерогенным переносом электрона, контролируемым диффузией.
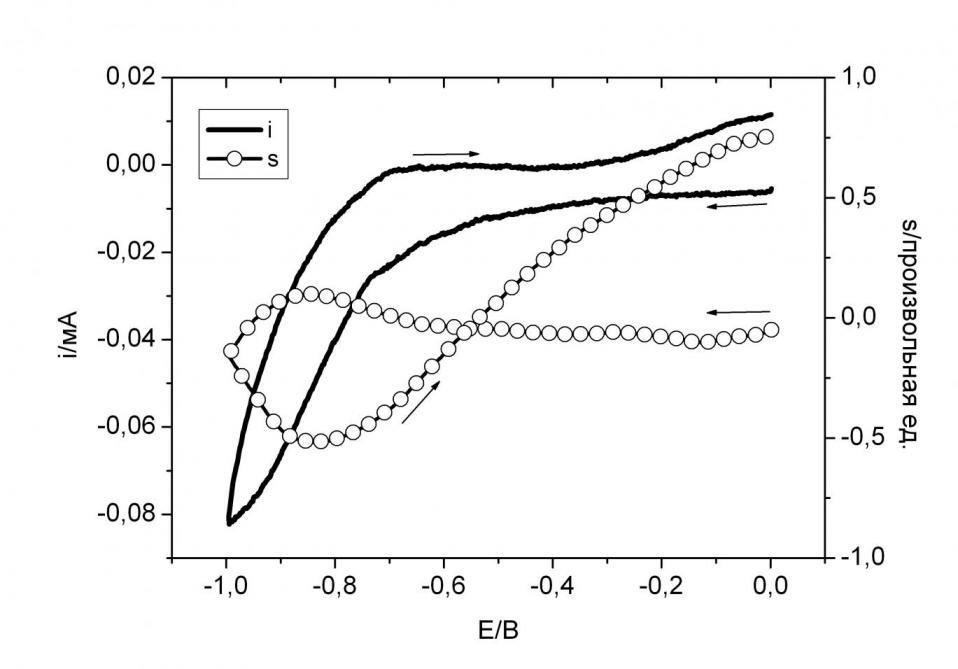
Рис. 14. Кривые ЦВА i(E) и уровня сигнала ЭПР лиганда s(E) в ходе ЭХВ 510–4 М раствора CuLnn•2 в ДМФА при развертке потенциала со скоростью 0.1 В/с до -1 В, 293 К
5.3. Тиокол-эпоксидные системы. Тиоколы (полисульфидные олигомеры – ПСО) способны отверждаться без нагревания с образованием резин, обладающих высокой масло-, бензо-, и атмосферостойкостью, широким температурным диапазоном проявления высокоэластических свойств (от -57 до +120 0 С). Однако они характеризуются невысокими адгезионными показателями к металлам и стеклам, этот недостаток восполняется введением в состав герметика эпоксидных смол (ЭС). В качестве отвердителей использованы фенольные основания Манниха. Соотношение ПСО:ЭС было близко к эквимолярному или 100:25 по массе, в качестве наполнителя использовали технический углерод П-803 в количестве 30 мас. ч. на 100 мас. ч. ПСО.
В параграфе «5.3.1. Технический углерод как ЭПР-метка в саженаполненных герметиках» методом ЭПР изучены свойства свободных радикалов наполнителя – технического углерода и радикалов, образующихся в процессе сополимеризации, их роль в формировании физико-механических свойств образующихся композиций.
Приведенные ниже (рис. 15) зависимости имеют следующую закономерность: интенсивность сигнала ЭПР (I) свободных радикалов технического углерода и величина адгезии к дюралюминию (А) симбатны и они антибатны прочности.
Часть свободных радикалов, генерируемых в системе ПСО–ЭС–ФОМ, рекомбинирует с радикальными центрами технического углерода, что проявляется в уменьшении интенсивности сигнала ЭПР. При этом наполнитель оказывается вовлеченным в химическое взаимодействие с полимером, что приводит к упрочнению материала и к снижению адгезии.

Рис. 15. Кривые адгезии А герметика к дюралю марки Д16, условной прочности и относительной интенсивности I/I0 сигнала ЭПР от содержания ФОМ
С ростом концентрации ФОМ количество катион-радикалов ФОМ·+ возрастает и большее их количество рекомбинрует с алкильными или тиильными радикалами. Это отражается на увеличении сигнала ЭПР радикалов технического углерода, так как они меньше связываются с макромолекулами олигомеров. Этим и объясняется снижение условной прочности () с ростом содержания ФОМ.
Значение адгезии композиций также находится в симбатной зависимости от числа генерируемых радикалов. При этом, чем в большей мере технический углерод связывается с макромолекулами олигомеров, тем ниже молекулярная подвижность, необходимая для формирования контакта адгезив – субстрат. При повышенной концентрации углеродных радикалов в системе возрастает вероятность разрыва –S –S – связей ПСО, а значит, появления более коротких цепей, что способствует увеличению адгезии.
Таким образом, роль технического углерода в процессе получения герметика сводится к катализу радикальных процессов и сшиванию полимерных цепей, а интенсивность сигнала ЭПР технического углерода позволяет контролировать радикальные процессы в саженаполненных композициях.
5.3.2. Комплексообразование на границе тиокол-эпоксидного полимера с латунной подложкой и его связь с адгезией. Изучены тиоколовые герметики состава (в мас. ч.) тиокол- 100, эпоксидная смола (Э-40) –20, инициатор –1,5, содержание свободной серы варьировалось от 0 до 20. В качестве инициатора применены фенольные основания Манниха.
Для выяснения природы адгезии герметика к поверхностям латуни и дюралюминия использован метод ЭПР. Изучались образцы как с предварительным разрушением контакта герметика с подложкой, так и без разрушения. В последнем случае использовали латунные трубки диаметром 3 мм, которые вместе с нанесенным на них герметиком помещали в резонатор спектрометра.
Результатом исследования межфазной поверхности образцов, независимо от того, вводилась в них сера или нет, было обнаружение сигнала ЭПР (g = 2.0857, g = 2.0267, А = 156.7 Гс, А = 37.7 Гс), отнесенного к комплексу двухвалентной меди, лигандами которого являются RS-содержащие фрагменты тиоколовых цепей. Анализ наблюдаемых спектров ЭПР позволяет предположить, что координационный узел иона меди состоит из четырех атомов серы с близким к плоскоквадратному характером расположения.
Зависимость интенсивности сигнала ЭПР комплекса от содержания серы оказалась антибатной величине адгезии (рис. 15). В области максимальных значений от 2 до 5.0 мас. ч. она низка, что свидетельствует о малом содержании комплекса в поверхностном слое, а при концентрациях серы выше 7.5 мас. ч интенсивность сигнала возрастает, а значит, увеличивается и концентрация комплекса.
Медь Си(II) характеризуется наиболее вероятным координационным числом 6 или 4 (тетрагонально искаженный октаэдр), поэтому первоначальный (по отношению к увеличению количества серы) поверхностный комплекс Си(II) можно представить как структуру, в которой экваториальные положения и одно из аксиальных занимают лиганды полимерных цепей, а в качестве лиганда, обеспечивающего координационное число 6, выступает поверхность металла.

Рис. 15. Зависимости адгезии А тиоколового герметика и относительной интенсивности I/I0 сигнала ЭПР сажи от содержания S8
Следствием сохранения связи иона меди в составе поверхностного комплекса с атомами кристаллической решетки является хорошая адгезия с подложкой.
С увеличением процентного содержания свободной серы в каучуковой смеси растет (по данным ЭПР) концентрация плоскоквадратных комплексов, что приводит к общему снижению удельной адгезионной прочности тиоколового каучука к поверхности чистой меди.
6.4. Cпиновые аддукты электрокаталитического окисления этанола в топливном элементе. С применением миниатюрного Н2/O2 ТЭ с Nf/Pt мембранно-электродным блоком, сконструированного для исследования методом ЭПР парамагнитных частиц, образующихся в ходе его работы, при наличии, дополнительно, спиновых ловушек были зарегистрированы (рис. 16) спиновые аддукты электрокаталитического окисления метанола и этанола.
Варьированием условий окисления, в частности, потенциала ТЭ, удалось получить интересные результаты, касающиеся прямого электроокисления этанола, который может с успехом заменить метанол в прямых спиртовых ТЭ. В ходе работы ТЭ при низких потенциалах на анодной стороне ТЭ были обнаружены спин-аддукты ДМПО/СН(ОН)СН3 (aN = 15.7 Гс, aH = 23.0 Гс) и ДМПО/СОСН3 (aN = 14.9 Гс, aH = 18.8 Гс, по литературным данным: aN = 13.3 Гс, aH = 17.5 Гс, свидетельствующие о протекании следующих реакций:
Pt +С2Н5ОН Pt-[СН(ОН)CH3]ads + H+ + e-
С2Н5ОН СН3-СHO + 2H+ + 2e-
Pt + СН3-СHO Pt-(CO-CH3)ads + H+ + e-
а также ДМПО/ОН (aN = 14.6 Гс, aH = 14.5 Гс), что, вероятнее всего, является результатом диссоциативной адсорбции воды:
Pt + H2O Pt-OHads + H+ + e-
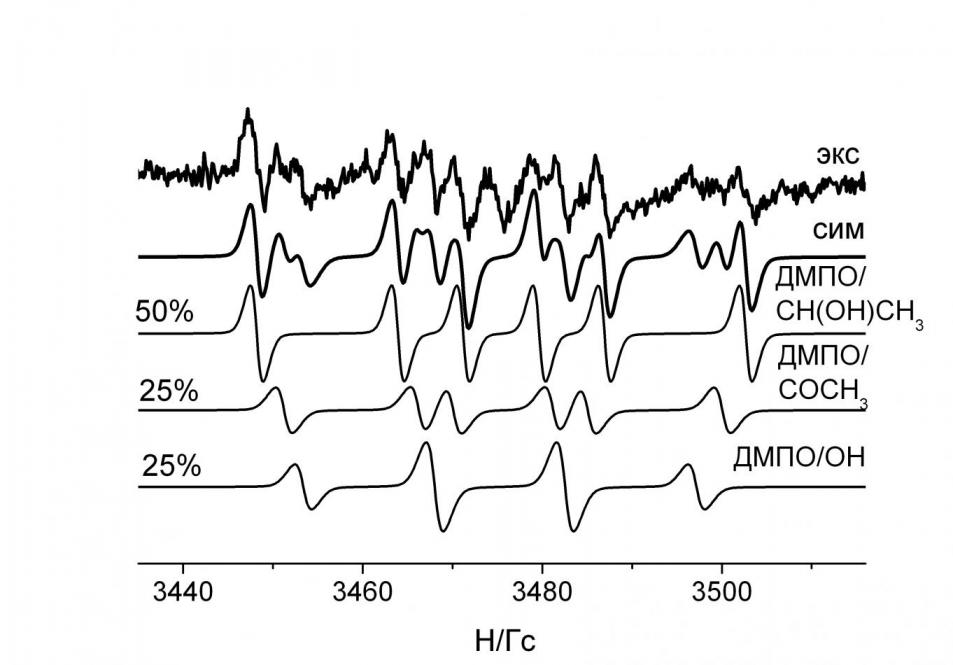
Рис. 16. Экспериментальный спектр (вверху) ЭПР спин-аддуктов, зарегистрированный в водно-этанольном растворе ДМПО на анодной стороне в Н2/O2 ТЭ для ЭПР при низких потенциалах; ниже – симулированный суммарный спектр, еще ниже – спектры составляющих их спин-аддуктов
Работа ТЭ контролировалась путем снятия диагностических кривых потенциал - плотность тока, плотность мощности - плотность тока и эффективность – плотность мощности.
Основные результаты и выводы
1. Усовершенствован и развит физико-химический подход к экспериментальным исследованиям, сочетающий в себе спектроскопию ЭПР и электрохимию, в рамках которого создан программно-аппаратный комплекс электрохимии-ЭПР со спиральной трехэлектродной ячейкой для исследования короткоживущих парамагнитных частиц, позволяющий получать качественную и количественную информацию о гетерогенном переносе электрона и последующих химических превращениях на основе четырех переменных, зависящих от времени, – тока, потенциала, интенсивности сигнала ЭПР и первой производной интенсивности сигнала ЭПР.
2. Создан метод циклической вольтамперометрии, детектируемой электронным парамагнитным резонансом (ЦВА ДЭПР), который является мощным инструментом для исследования сложных молекулярных систем с несколькими парамагнитными центрами и многостадийными переносами электрона.
3. Установлены механизмы электрохимического и химического образования функциональных многоспиновых парамагнитных систем, интересных с точки зрения создания молекулярных магнетиков. На базе исследования окислительно-восстановительных свойств цвиттер-иона - 4,4,5,5-тетраметил-2-оксоимидазолидин-3-оксид-1-олата и анализа спектра ЭПР его анион-радикала в жидких растворах определено, что цвиттер-ион обратимо восстанавливается до анион-радикала, а его дианион компропорционирует с непрореагировавшим цвиттер-ионом, образуя снова анион-радикал. Для химического генерирования солей анион-радикала цвиттер-иона необходимо использовать многократный избыток основания и использовать инертную атмосферу, поскольку в присутствии оснований анион-радикал легко окисляется в цвиттер-ион кислородом воздуха.
4. Определены параметры редокс-процессов и спектров ЭПР широкой группы впервые синтезированных нитронил- и иминонитроксилов, что позволило идентифицировать их в ходе электрохимических и последующих химических превращений. Обнаружено, что фактически все исследованные нитронилнитроксилы даже при хранении при пониженной температуре самопроизвольно теряют кислород и постепенно превращаются в соответствующие иминонитроксилы. Методом ЦВА ДЭПР и ЭПР установлено, что для каждого конкретного нитронилнитроксила можно подобрать величину потенциала, при котором его можно практически нацело перевести в соответствующий иминонитроксил.
5. Установлен механизм гомогенного переноса электрона в донорно-акцепторных системах хлор- или броманил – диметиламин, 2-диметиламинометилфенол – фенил-2,6-ди(трет-бутил)хинонимин. Впервые получены и идентифицированы анион-радикалы 2,6-диметиламинохлоранила и 2,6-диметиламиноброманила и катион-радикал 2-диметиламинометилфенола.
6. Уточнены свободнорадикальные механизмы модификации композиционных материалов, а также механизмы раскрытия эпоксидного кольца и начальной стадии сополимеризации эпоксидного и полисульфидного олигомеров при использовании в качестве модифицированных отвердителей донорно-акцепторной системы 2-диметиламинометилфенол – фенил-2,6-ди(трет-бутил)хинонимин.
7. Показано, что основная часть генерированных электронов в результате фотоионизации фенотиазина в жидких мицеллярных растворах анион-активных ПАВ расходуется на восстановление молекулярного кислорода, растворенного в водной объемной фазе, при этом катион-радикалы фенотиазина не вступают в реакцию с молекулами воды. Установлено, что добавлением электролитов можно регулировать разделение заряда в мицеллярных растворах.
8. Сконструирован топливный элемент, приспособленный для работы в резонаторе спектрометра ЭПР, с возможностью параллельной записи поляризационных кривых и спектров ЭПР спин-аддуктов, позволяющий регистрировать интермедиаты электроокисления топлива и связать механизм распада топлива с эффективностью топливного элемента. В топливном элементе in situ одновременно получены поляризационные кривые и зарегистрированы новые парамагнитные интермедиаты электроокисления этанола, который может заменить метанол в прямых спиртовых топливных элементах.
9. Открыт механизм деградации по боковым цепям перфторированных сульфокатионитовых иономеров, применяемых в качестве полиэлектролитов топливных элементов. Впервые генерированы и идентифицированы алкильные радикалы, свидетельствующие о такой деградации.
Основное содержание диссертации изложено в следующих работах:
- Nefed’ev, E.S. EPR imaging study of paramagnetic center distribution in thiokol-epoxy hermetics / E.S. Nefed’ev, K.M. Musin, T.Yu. Mirakova, M.K. Kadirov, K.L. Aminov, K.M. Salikhov, V.A. Silaev. - Appl. Magn. Reson. – 1996. - Vol.11. - P.115-123.
- Кадиров, М.К. Ячейка для исследования короткоживущих парамагнитных частиц / М.К. Кадиров, Е.С. Нефедьев, А.Г. Сафиуллин, М.И. Аюпов / Патент РФ 2120621. – G 01 N 24/10, G 01 R 33/10. - Приоритет 27.12.1996. – 1998. - БИ №29.
- Петров, О.В. Модификация каучуков эпоксидными соединениями / О.В. Петров, Е.С. Нефедьев, М.К. Кадиров // Каучук и резина. – 1998. - №5. - С.11-19.
- Кадиров, М.К. Исследование методом ЭПР фотоокисления фенотиазинов в водных мицеллярных растворах / М.К. Кадиров Е.С. Нефедьев // Известия АН, Сер. хим. – 2003. - №5. - С.1055-1059.
- Кадиров, М.К. Перенос электрона и парамагнитные продукты при взаимодействии галогенхинонов с простейшими алифатическими аминами / М.К. Кадиров, C.Е. Нефедьев, М.Б. Зуев // Известия АН, Сер. хим. – 2003. - №4. - С.859-862.
- Kadirov, M.K. Membrane-Derived Fluorinated Radicals Detected by Electron Spin Resonance in UV-Irradiated Nafion and Dow Ionomers: The Effect of Counterions and H2O2 / M.K. Kadirov, A. Bosnjakovic, Sh. Schlick // J. Phys. Chem. B. - 2005. – V.109. – P.7664-7670.
- Schlick, Sh. Radicals Detected by Electron Spin Resonance (ESR) Spectroscopy in UV-Irradiated Nafion Membranes: The Effect of Counterions and H2O2 / Sh. Schlick, M.K. Kadirov // Polym. Prepr. (Am. Chem. Soc. Div. Polym. Chem.) -2005. – V.46. -№1. - P.307-308.
- Bosnjakovic, A. Using ESR spectroscopy to study radical intermediates in proton-exchange membranes exposed to oxygen radicals / A. Bosnjakovic, M.K. Kadirov, Sh. Schlick // Res. Chem. Intermed. - 2007. – Vol.33. – No.8-9. – P.677-687.
- M.Danilczuk, M. Direct ESR and spin trapping methods for the detection and identification of radical fragments in Nafion membranes and model compounds exposed to oxygen radicals / M. Danilczuk, A. Bosnjakovic, M.K. Kadirov, Sh. Schlick // J. Pow. Sources. – 2007. – Vol.172. – P.78-82.
- Кадиров, М.К. Ячейка для электрохимии-ЭПР / М.К. Кадиров // Патент РФ № 69252. – G 01 N 24/00. - Приоритет 18.07.2007. – 2007. - БИ № 34.
- Кадиров, М.К. Программно-аппаратный комплекс для электрохимии и электронного парамагнитного резонанса / М.К. Кадиров, В.Л. Одиванов, Ю.Г. Будникова // Приборы и техника эксперимента. - 2007. -№1. – С.151-153.
- Кадиров, М.К. Установка детектируемой электронным парамагнитным резонансом циклической вольтамперометрии / М.К. Кадиров, Ю.Г. Будникова, О.Г. Синяшин // Патент РФ 67266. – G 01 N 27/26. - Приоритет 14.05.2007. – 2007. - БИ № 28.
- Кадиров, М.К. Исследование электрохимического окисления катехолатных комплексов никеля с бис(дифенилфосфино)этаном комбинированным методом циклической вольтамперометрии и ЭПР / М.К. Кадиров, Ю.Г. Будникова,Т.В. Грязнова, О.Г. Синяшин, М.П. Бубнов, А.В. Крашилина, В.К. Черкасов // Изв. АН, Сер. Хим. - 2007. - №1. - С.99-102.
- Кадиров, М.К. Установка для электрохимических исследований / М.К. Кадиров, Ю.Г. Будникова, В.Л. Одиванов, О.Г. Синяшин // Патент РФ 69642. – G 01 N 27/26. - Приоритет 06.08.2007. – 2007. - БИ № 36.
- Кадиров, М.К. Топливный элемент для ЭПР / М.К. Кадиров // Патент РФ 66540. - G 01 N 24/10. - Приоритет 14.05.2007. – 2007. - БИ № 25.
- Кадиров, М.К. Электрохимическая ячейка для ЭПР / М.К. Кадиров // Патент РФ №.74476 – G 01 N 24/00. - Приоритет 31.01.2008. – 2008. - БИ № 18.
- Кадиров, М.К. Бинарные смеси хинониминов с основаниями Манниха: катион-радикальный механизм модификации эпоксидных композиций / М.К. Кадиров, Е.С. Нефедьев // Вестник Казан. технол. ун-та. – 2008. - №4. – С.66-74.
- Кадиров, М.К. Деградация перфторсульфонированных мембран: алкильные макрорадикалы / М.К. Кадиров // Вестник Казан. технол. ун-та. – 2008. - №5. – С.171-178.
- Kadirov, M. Electrochemistry of the sterically hindered imidazolidine zwitterion and its paramagnetic derivatives / M. Kadirov, E. Tretyakov, Y. Budnikova, M.Valitov, K. Holin, T. Gryaznova, V. Ovcharenko, O. Sinyashin // J. Electroanalyt. Chem. – 2008. – V.624.-N1-2.-P.69-72.
- Кадиров, М.К. Cпин-аддукты электрокаталитического окисления легких алифатических спиртов в топливном элементе для ЭПР in situ / М.К. Кадиров // Вестник Казан. технол. ун-та. – 2008. - №5. – С.158-165.
- Будникова, Ю. Г. Электрохимия нитронил- и иминонитроксилов / Ю.Г. Будникова, Т.В. Грязнова, М.К. Кадиров, Е В. Третьяков, К.В. Холин, В.И. Овчаренко, Р.З. Сагдеев, О.Г. Синяшин // Журн. физ. химии. 2009. – Т.83. - №11. – С.2169-2174.
- Кадиров, М.К. Электронный парамагнитный резонанс и детектируемая им циклическая вольтамперометрия нитронил- и иминонитронилов / М.К. Кадиров, Е.В. Третьяков, Ю.Г. Будникова, К.В. Холин, М.И. Валитов, В.Н. Вавилова, В.И. Овчаренко, Р.З. Сагдеев, О.Г. Синяшин // Журн. физ. химии. – 2009. – Т.83. - №12. – С.1-8.
- Кадиров М.К., Холин К.В., Валитов М.И., Низамеев И.Р., Литвинов А.И. Ячейка для электрохимии-ЭПР. Патент РФ 96976, МПК G01N 24/00. Приоритет 6.04.2010. – 2010. - БИ № 23.
- Кадиров, М. К. Влияние плотности покрытия катализатором платиново-нафионных мембранно-электродных блоков на поляризационную кривую топливного элемента / М.К. Кадиров, М.И. Валитов, И.Р. Низамеев, Е.С. Нефедьев, О.Г. Синяшин // Вестник Казан. технол. ун-та. – 2010. - №6. – С.255-262.
- Кадиров, М. К. Прямое электрокаталитическое разложение легких алифатических спиртов в топливном элементе c полимерным электролитом по данным ЭПР спиновых аддуктов / М.К. Кадиров, М.И. Валитов, И.Р. Низамеев, Д.М. Кадиров, Ш.Н. Мирханов // Изв. АН, Сер. Хим. - 2010. - №8. - С.1506-1511.
- Кадиров, М. К. Обменные взаимодействия в многоспиновых системах на основе нитронилнитроксильных радикалов / М. К. Кадиров, Е. В. Третьяков, К. В. Холин, Е. С. Нефедьев, В. И. Овчаренко, О. Г. Синяшин // Вестник Казан. технол. ун-та. – 2011. –Т.14. - №4. – С. 36-40.
- Tretyakov, Evgeny V. Synthesis, structure, and magnetic properties of 2,2-(buta-1,3-diyne-1,4-diyl)bis(4,4,5,5-tetramethyl-4,5-dihydro-1H-imidazole 3-oxide 1-oxyl) / Evgeny V. Tretyakov, Svyatoslav E. Tolstikov, Galina V. Romanenko, Artem S. Bogomyakov, Dmitry V. Stass, Marsil K. Kadirov, Oleg G. Sinyashin, and Victor I. Ovcharenko // Polyhedron.- 2011.-V.30. – P.3232-3237.
СПИСОК СОКРАЩЕНИЙ
ПАВ – поверхностно-активное вещество
ПОМ – протонобменная мембрана
ПСО – полисульфидный олигомер
СТВ – сверхтонкое взаимодействие
ТЭ - топливный элемент
ФОМ – фенольное основание Манниха
ЦВА – циклическая вольтамперометрия
ЦВА ДЭПР – циклическая вольтамперометрия, детектируемая электронным
парамагнитным резонансом
Эл-ЭПР - электрохимия – электронный парамагнитный резонанс
ЭПР – электронный парамагнитный резонанс
ЭС – эпоксидная смола
ЭХВ – электрохимическое восстановление
ЭХО – электрохимическое окисление
IN – иминонитроксильный радикал
NN – нитронилнитроксильный радикал

